А.В. Туев, В.Ю. Мишланов
ХРОНИЧЕСКИЕ БРОНХООБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ
И
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
Пермь, 2008
УДК 616.24-02:616.233-002.2-007.271]-06:616.1
ББК 54.12
Авторы: А.В. Туев, В.Ю. Мишланов
Рецензенты:
Профессор кафедры госпитальной терапии Санкт-Петербургского государственного медицинского университета, заслуженный деятель науки Российской Федерации, профессор Г.Б. Федосеев;
заведующий кафедрой клинической фармакологии и фармакотерапии Московского государственного медико-стоматологического университета, Заслуженный деятель науки РФ, профессор А.Л. Верткин.
Рекомендовано ЦКМС и Ученым советом Государственного образовательного учреждения высшего профессионального образования «Пермская государственная медицинская академия имени академика Е.А. Вагнера Федерального агентства по здравоохранению и социальному развитию»
Хронические бронхообструктивные заболевания и сердечно-сосудистая система / А.В. Туев, В.Ю. Мишланов.- М., 2008.- 227 с.
© А.В. Туев,
© В.Ю. Мишланов, 2008
Монография освещает современные решения некоторых теоретических и практических проблем хронических бронхообструктивных заболеваний. Основная идея – раскрыть причины формирования различных вариантов поражения сердечно-сосудистой системы, алгоритмы их диагностики и лечения. Актуальность темы опирается на распространенность обсуждаемых болезней органов дыхания, которая в совокупности составляет около 10 % населения России. Новые данные о патогенезе и эффективности лечебной тактики позволяют значительно улучшить диагностику и результаты лечения, дают врачу профессиональную уверенность и возможность оказывать качественную эффективную помощь больным.
Излагаемый материал ориентирован на существующие международные и российские клинические рекомендации и стандарты лечения.
Книга предназначена для врачей общей практики, пульмонологов, аллергологов-иммунологов, кардиологов, ординаторов, интернов и студентов, обучающихся в медицинских ВУЗах.
ОГЛАВЛЕНИЕ
Список сокращений 7
Введение. Современные представления об атеросклерозе и роль сердечно-сосулистой патологии при заболеваниях органов дыхания 8
Глава I. Бронхиальная астма 23
- Современное представление о бронхиальной астме (определение, эпидемиологические данные, факторы риска, диагностика и лечение). 23
- Механизмы развития аллергического воспаления бронхов. 24
- Иммунологическая модель бронхиальной астмы 29
- Клинические проявления и современные принципы ведения больных бронхиальной астмой 41
- Атеросклероз и артериальная гипертония у больных бронхиальной астмой (распространенность, ассоциация с факторами риска сердечно-сосудистых заболеваний) 65
Глава II. Хроническая обструктивная болезнь легких 77
- Современные представления о хронической обструктивной болезни легких (определение, эпидемиологические данные, факторы риска) 77
- Механизмы развития воспаления бронхов при хронической обструктивной болезни легких 80
- Иммунологическая модель воспаления бронхов при хронической обструктивной болезни легких 84
- Клинические проявления и современные принципы ведения больных хронической обструктивной болезнью легких 86
- Поражение сердечно-сосудистой системы у больных хронической обструктивной болезнью легких 99
Глава III. Бронхоэктазы и другие хронические нагноительные заболевания легких 125
- Современные представления о бронхоэктатической болезни (определение, эпидемиологические данные, факторы риска) 125
- Механизмы развития воспаления при хронических нагноительных заболеваниях легких 126
- Иммунологическая модель воспаления при хронических нагноительных поражениях органов дыхания 128
- Клинические проявления и современные принципы ведения больных бронхоэктатической болезнью 131
- Поражение сердечно-сосудистой системы у больных хроническими нагноительными заболеваниями органов дыхания 141
Глава IV. Дифференциальная диагностика и сравнительная характеристика механизмов поражения сердечно-сосудистой системы у больных хроническими бронхообструктивными заболеваниями 147
- Основные иммуно-патогенетические и клинические различия бронхиальной астмы и хронической обструктивной болезни легких 147
- Алгоритм дифференциальной диагностики у больного с бронхообструктивным синдромом 150
- Эффективность различных методов лечения 153
- Факторы риска атерогенеза и осложнений сердечно-сосудистых заболеваний у больных хроническими обструктивными заболеваниями легких (возраст, курение, инфекционные факторы, липидный спектр крови, липидвысвобождающая способность лейкоцитов, лекарственная терапия) 157
Глава V. Особенности диагностики и лечения атеросклероза у больных хроническими бронхообструктивными заболеваниями 161
- Особенности лечения атеросклероза у больных бронхиальной астмой 161
- Особенности лечения утеросклероза у больных хронической обструктивной болезнью легких 163
- Особенности лечения атеросклероза при гнойно-обструктивных поражениях органов дыхания 165
- Современные принципы профилактики, лечения и реабилитации заболеваний, ассоциированных с атеросклерозом у больных хроническими бронхообструктивными заболеваниями 167
Заключение 170
Список литературы 173
СПИСОК СОКРАЩЕНИЙ
АГ – артериальная гипертония;
АД – артериальное давление;
БА – бронхиальная астма;
ГБ – гипертоническая болезнь;
ГК – глюкокортикоиды;
ЖЕЛ – жизненная емкость легких;
ИБС – ишемическая болезнь сердца;
ИГК – ингаляционные глюкокортикоидные препараты;
ИЛ – интерлейкин;
ИНФ – интерферон;
ЛВСЛ – липидвысвобождающая способность лейкоцитов;
ЛС – легочное сердце;
ОФВ1 – объем форсированного выдоха за 1 секунду;
ПСВ – пиковая скорость выдоха;
СРБ – С-реактивный белок;
ФАЛ – фагоцитарная активность лейкоцитов;
ФЖЕЛ – форсированная жизненная емкость легких;
Фн – концентрация фибриногена в крови;
ФНО – фактор некроза опухоли;
ХОБЛ – хроническая обструктивная болезнь легких;
ХС – общий холестерин;
ЦИК – циркулирующие иммунные комплексы;
ЧСС – частота сердечных сокращений;
Эхо-КГ – эхокардиографическое исследование;
Ig – иммуноглобулин(ы)
РаСО2 – парциальное давление СО2 в крови;
РаО2 – парциальное давление О2 в крови;
SaО2 – сатурация О2 в ткани.
ВВЕДЕНИЕ
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ ОБ АТЕРОСКЛЕРОЗЕ И РОЛЬ СЕРДЕЧНО-СОСУДИСТОЙ ПАТОЛОГИИ ПРИ ЗАБОЛЕВАНИЯХ ОРГАНОВ ДЫХАНИЯ
В последние десятилетия значительные успехи были достигнуты в изучении хронических обструктивных заболеваний органов дыхания. Понятными стали принципы дифференциальной диагностики, внедрены стандарты ведения больных бронхиальной астмой (БА) и хронической обструктивной болезнью легких (ХОБЛ). Высокой эффективностью отличаются усовершенствованные и широко применяемые программы лечения БА. К сожалению, лечение других бронхо-обструктивных заболеваний остается нерешенной медицинской проблемой. В целом, распространенность БА, ХОБЛ и хронических гнойно-обструктивных заболеваний составляет около 10 % населения России и 5-15 % среди взрослого населения индустриально развитых стран [195]. Временная и стойкая утрата трудоспособности, затраты на лечение, потеря квалифицированных кадров на производстве, ухудшение качества жизни и сокращение ее продолжительности – вот далеко не полный перечень социального бремени обсуждаемой темы. Между тем, не все пациенты страдают только проявлениями дыхательной недостаточности. Воспалительная реакция, имеющая системный характер, и опосредованная участием биологически активных веществ, циркулирующих в крови, присутствующих в других биологических жидкостях и тканях, наряду с гемодинамическими и инфекционными факторами поражает сердечно-сосудистую систему и, во многих случаях, является причиной формирования сердечной недостаточности, артериальной гипертонии (АГ), тромбозов артериального русла и последствий указанных патологических состояний [195]. Проблему хронических пульмонологических заболеваний в большинстве случаев нельзя решить только пульмонологическими методами. Важную роль в лечении этих больных играют врач общей практики (терапевт) и кардиолог. С учетом значительного развития кардиохирургических методов лечения, существуют вопросы особенностей тактики ведения пульмонологических пациентов, подлежащих оперативной реваскуляризации в различных бассейнах артериального русла.
Освещение вопросов взаимного влияния заболеваний органов дыхания и сердечно-сосудистой системы имеет актуальность и с точки зрения распространенности, других социальных проблем, обусловленных АГ [95, 140, 152, 167], ИБС [6, 48, 66, 74], ишемическим поражением нижних конечностей [1, 21, 30, 31, 90, 146, 242, 344], формированием сердечно-сосудистой недостаточности [129], угрозой развития инфарктов миокарда [28, 44, 150] и других неотложных состояний [29, 380].
Основу современных представлений о факторах риска поражения сердечно-сосудистой системы при заболеваниях органов дыхания составляет учение о различных вариантах воспалительного процесса. Участие тех или иных факторов воспаления изменяет реакцию сосудистого эндотелия, тромбоцитов, рецепторов вазоактивных веществ, формирует стереотип сосудистой реактивности и функциональный статус сердечно-сосудистой системы в целом.
В последние годы значительно изменились представления об атеросклерозе, механизмах его развития, методах диагностики и лечения. Термин атеросклероз имеет греческое происхождение от слов "атеро" – кашица и "склероз" – сухой, твердый. Атеросклерозом называют морфологические изменения внутренней оболочки стенки артерий в виде мозаичных структур с чередованием жировых отложений и соединительной ткани, или с преобладанием тех или иных процессов, а также сопровождающиеся гипертрофией гладких мышечных волокон и отложением фибрина со стороны просвета сосуда [65, 69, 363].
Развитие воспалительной теории и иммунологических методов диагностики позволило получить новые данные, которые не только дополнили, но, в определенной мере, изменили традиционные взгляды на атерогенез и механизмы артериальной гипертонии. С 1995 года в научной литературе активно обсуждается роль молекул адгезии при воспалительных заболеваниях, в т.ч. БА, ХОБЛ, других заболеваниях инфекционно-воспалительной, аутоиммунной и аллергической природы [227, 268]. Гипотеза Butcher и Springer выделяет трехэтапную модель воспалительного процесса с участием молекул адгезии [307]. На первом этапе основная роль принадлежит селектинам, которые замедляют ток воспалительных клеток в сосудистом русле и обуславливают их пристеночное движение к сосудистому эндотелию (краевое стояние) в очаге повреждения тканей. Далее хемокины избирательно обеспечивают активацию и целенаправленное движение определенных лейкоцитов к эндотелиоцитам, их миграцию в ткани. Интегрины завершают формирование очага воспаления, отвечая за прочную адгезию лейкоцитов к стенке сосудов, трансмиграцию сквозь эндотелий и движение лейкоцитов в плотных тканях в очаг воспаления. Эти данные составляют основу современных представлений участия эндотелиоцитов в патогенезе воспалительных заболеваний.
Исследования механизмов атерогенеза показали вовлечение молекул адгезии, прежде всего молекул VCAM, ICAM-1, в меньшей степени E-selectin, PECAM-1 и других, обеспечивающих миграцию лейкоцитов в интиму [191, 236, 269, 310]. Эти результаты согласуются с доказательствами нарушения функции эндотелиоцитов [292, 294, 316], гипотезой о превращении моноцитов в содержащие холестерин пенистые клетки в сосудистой интиме [65, 69, 250], и данными о способности моноцитов высвобождать провоспалительные цитокины и ростовые факторы, стимулирующие экспрессию молекул адгезии (VCAM-1) на эндотелиоцитах и гладкомышечных клетках, а также миграцию и пролиферацию этих типов клеток [339, 387].
Увеличение количества пенистых клеток макрофагального происхождения и лимфоцитов в атеросклеротических бляшках ассоциируется с нестабильностью бляшки и клиникой острого коронарного синдрома [249, 340]. Воспалительные механизмы формирования рестенозов артерий после баллонной ангиопластики также опосредованны молекулами адгезии [271]. Участие этих молекул вызывает инфильтрацию сосудистой стенки лейкоцитами в зоне повреждения. Если этот процесс происходит в области ранее сформировавшейся атеросклеротической бляшки, то говорят о появлении «активных» или «активированных» атеросклеротических бляшек.
Установлено, что развитие острого коронарного синдрома сопровождается появлением “активированных” бляшек в самых различных бассейнах артериального русла, что подтверждает мнение о том, что у больных острым коронарным синдромом может иметь место системная воспалительная реакция, вовлекающая коронарные артерии [191, 385].
Признавая роль воспаления при атеросклерозе, и ведущую роль моноцитов в качестве элементов воспаления, существующая теория гласит, что первичным фактором атерогенеза является инфильтрация интимы холестерином, что служит элементом повреждения и первичным стимулом к развитию воспаления [65, 69]. Воспалительную теорию развивают данные о некоторых особо атерогенных фракциях холестерина низкой плотности – перекисно модифицированных (денатурированных) липопротеидах низкой плотности (ЛПНП), малых, плотных частицах ЛПНП, недоокисленных ЛПНП и липопротеиде (а) [16, 65, 69, 104, 209, 240, 277, 337, 366, 397]. Известны данные о повреждающем эффекте ЛПНП на сосудистую стенку и стимулирующем в отношении гиперплазии, опосредованной действием ангиотензина II [259, 297].
Недоокисленные фракции ЛПНП стимулируют экспрессию молекул адгезии на эндотелиальных клетках [69, 348]. Кроме этого, ЛПНП стимулируют образование свободных кислородных радикалов, вызывая продукцию провоспалительных цитокинов эндотелиальными клетками. Имеются данные, что кислородные радикалы снижают количество эндотелиального релаксирующего фактора (NO), стимулируют миграцию гладкомышечных клеток [262, 280, 317], активируют нуклеарный транскриптирующий фактор в гладкомышечных клетках [326]. Влияние продуктов перекисного окисления липидов на развитие воспаления, видимо, также опосредовано участием цитокинов и молекул адгезии, высвобождаемых эндотелием [269, 303, 351]. Показано, что у больных ИБС имеет место повышение содержания ЦИК, содержащих холестерин, играющих патогенетическую роль при атеросклерозе [69, 92].
Тем не менее, все больше фактов свидетельствуют о том, что гиперхолестеринемия может рассматриваться только в качестве дополнительного фактора атерогенеза. Концентрация атерогенных фракций липопротеидов в крови далеко не всегда отражает реальный риск прогрессирующего течения заболевания и определяется общими закономерностями регуляции биосинтеза белков и холестерина [346]. Так, Zanchetti A. и соавт (2001) установили, что степень поражения сонных артерий коррелировала с величинами систолического и пульсового артериального давления крови, но не с диастолическим давлением или с уровнями основных фракций липидного спектра крови у гипертоников, имеющих умеренное повышение артериального давления (АД) [403].
Кроме моноцитов/макрофагов в патогенезе атеросклероза активно обсуждается роль других клеток крови. Воспалительные клетки, в частности тромбоциты, высвобождают ростовые факторы, способные стимулировать пролиферацию гладкомышечных клеток [400].
Ряд исследователей считает, что нейтрофилы принадлежат к элементам воспаления в пораженных участках артерий при атеросклерозе [251, 262, 367, 402]. Еще в 1977 году в монографии И. М. Раскина «Липидсодержащие лейкоциты при ишемической болезни сердца» была дана оценка многочисленным фактам, подтверждающим способность нейтрофилов накапливать капли холестерина. Показано, что больные ИБС имели достоверно повышенную способность к накоплению холестерина нейтрофилами в крови [143]. Жухоров Л.С., Голованов С.А. (1983) показали, что нейтрофилы и лимфоциты периферической крови существенно отличаются друг от друга по содержанию липидов. Содержание общих липидов и других изучавшихся липидных фракций в расчете на 1012 клеток и на 1 мг клеточного белка в нейтрофилах было значительно больше, чем в лимфоцитах крови [56]. В диссертационной работе А.П. Шаврина «Фагоцитарная активность нейтрофилов крови у лиц с факторами риска при некоторых заболеваниях внутренних органов как интегральный показатель иммунобиологической защиты» (1998) изучалась фагоцитарная активность нейтрофилов при некоторых заболеваниях внутренних органов, в т.ч. ИБС. Было установлено, что показатели фагоцитарной активности нейтрофилов у больных ИБС (острый инфаркт миокарда) достоверно выше, чем в группе здоровых лиц. У здоровых пациентов с гиперхолестеринемией индекс активности фагоцитов в стандартном выражении также достоверно превышал средние величины в группе здоровых лиц, не имеющих гиперхолестеринемии. Корреляционной зависимости между показателями липидного спектра и фагоцитарным числом не выявлено, но установлена обратная корреляционная взаимосвязь уровня ЛПНП и индекса активности фагоцитов [185, 187]. В 1999 году в диссертационной работе Е.В. Фоминых изучалось состояние иммунной системы у больных разными формами ИБС. Установлено, что фагоцитарная активность нейтрофилов повышена у больных ИБС по отношению к здоровым лицам, и достоверно выше при нестабильных формах заболевания (прогрессирующая стенокардия, инфаркт миокарда) по отношению к стенокардии напряжения [173]. Аттаева М.Ж. и соавт. (2001) получили данные о том, что у больных атеросклерозом в период госпитализации имеет место значительное повышение уровня гликогена, активности миелопероксидазы, тетразолиевой активности гранулоцитов по сравнению с нормой, при этом содержание катионного белка умеренно повышалось, а повышение активности кислой фосфатазы нейтрофилов носило несущественный характер [15]. Уровень триптазной активности повышается у больных нестабильной стенокардией [376]. C.M. Kahler et al. (1997) и другие авторы [402] продемонстрировали способность некоторых цитокинов (секретоневрин, ФНО-) увеличивать экспрессию молекул адгезии на эндотелиальных клетках и миграцию нейтрофилов, моноцитов через эндотелиальный слой [310, 325]. В свою очередь, мигрирующие сквозь эндотелий полиморфно-нуклеарные лейкоциты высвобождают хемотаксические факторы для мононуклеаров и индуцируют экспрессию на эндотелии молекул адгезии [367]. Получены противоречивые данные, позволяющие считать, с одной стороны, что снижение спНСТ у больных инфарктом миокарда является фактором риска летального исхода [82], а, с другой стороны, что критерием неблагоприятного прогноза следует считать увеличение спНСТ по отношению к стНСТ [81]. Другие авторы указывают на возможность одномоментного увеличения высвобождения и активности катепсина и кислой фосфатазы нейтрофилами при повреждениях миокарда [83].
Опубликованы также материалы, позволяющие выделить особую провоспалительную роль Т-лимфоцитов при атеросклерозе. Во-первых, цитокины, высвобождаемые этими и другими клетками-участниками иммунной реакции стимулируют экспрессию молекул адгезии на эндотелиоцитах. Это относится к ИЛ-1 (высвобождается преимущественно моноцитами) [58], ИЛ-2 [224], ИЛ-6 [58], -ИНФ [246], ФНО- [7, 58, 147, 236, 325, 370, 387]. Указанные данные согласуются с современными представлениями о спектре цитокинов, выделяемых Т-хелперами 1-го типа [70, 88, 197]. Во-вторых, в случаях посттрансплантационного атеросклероза, возникающего у пациентов после пересадки почки, установлена роль цитотоксических Т-лимфоцитов, что отличает данный вид поражения артерий от естественного развития атеросклероза, где обнаруживаемые Т-лимфоциты, не являющиеся цитотоксическими [244]. Другие авторы отмечали увеличение активности цитотоксических Т-лимфоцитов при остром инфаркте миокарда и зависимость выраженности реакции от его гемодинамического варианта [24, 123, 325].
Роль Т-лимфоцитов может быть представлена как инициирующая иммунное воспаление, экспрессию молекул адгезии и миграцию нейтрофилов и моноцитов в интиму сосудов в ответ на воздействие антигенного стимула. Орудием Т-лимфоцитов выступают провоспалительные цитокины. Миграция Т-лимфоцитов в интиму осуществляется при участии молекул CD40 и CD40L, количество которых увеличивается при нестабильной стенокардии [190, 245, 320, 331]. Известно также, что взаимодействие CD40 и CD40L сопровождается стимуляцией экспрессии молекул главного комплекса гистосовместимости I и II класса, а также молекул ICAM-1 и VCAM-1 на поверхности гладкомышечных клеток [283].
В научной литературе описаны факты, указывающие на активацию гуморального звена системы иммунитета при атеросклерозе [10, 224].
Активно обсуждается роль острофазовых тестов в диагностике нестабильных форм ИБС [12, 16, 17, 47, 189, 191, 241]. Не вызывают сомнения факты, что уровень СРБ отражает активность воспалительного процесса в коронарных артериях у большинства больных ИБС [12, 16, 47, 58, 63, 104, 109, 111, 128, 139, 145, 171, 224]. Причем стимуляция синтеза СРБ не зависит от ишемии, что предполагает участие механизмов, связанных с воспалением у больных атеросклерозом [263]. Данный показатель рекомендуется для мониторинга активности атеросклеротического процесса у больных, оценки эффективности проводимой терапии, определения прогноза. Кроме этого клинического показателя активно обсуждаются другие лабораторные тесты (уровни фибриногена, ИЛ-1, ИЛ-6, ИЛ-8, ФНО-, растворимый рецептор к ФНО- и др.), увеличение которых совпадает с проявлениями нестабильности течения заболевания [186, 325, 332, 335]. Предполагается, что ИЛ-1 является стимулятором синтеза СРБ, в то время как ИЛ-6 стимулирует синтез фибриногена (Фн), с чем связано различие в сроках повышения СРБ и Фн при инфаркте миокарда. Показано, что уровень растворимой молекулы VCAM-1 отражает тяжесть заболевания [252, 260, 341, 349, 399]. Есть данные о том, что белковые факторы свертывания крови, высвобождаемые поврежденным эндотелием, являются маркерами нестабильности течения ИБС [332].
Среди причин воспаления обсуждаются гемодинамические факторы. Так, напряжение сдвига ламинарного тока крови стимулирует синтез эндотелина-1 в эндотелиальных клетках и в норме вызывает вазодилацию, стимулируя ET- рецепторы [334]. Однако к развитию митогенного эффекта в отношении гладкой мускулатуры приводит стимуляция ET-, но не ET-- рецепторов.
Гипоксия также может вызывать усиление экспрессии молекул адгезии на поверхности эндотелия [404].
Тем не менее, на сегодняшний день нет полной уверенности в агрессивной, патогенной роли воспаления при атеросклерозе. Ряд авторов считает, что высвобождение ИЛ-1 стимулирует синтез молекулы NO в гладкомышечных клетках, обеспечивая механизмы релаксации [362]. C. Depre и соавт. напротив утверждают, что увеличение экспрессии NO-синтетазы под влиянием провоспалительных цитокинов способствует увеличению продукции супероксида и пероксинитритов, которые могут вызвать внутрикоронарный тромбоз. Возможно, в формировании различий в понимании причинно-следственных связей имеет значение определенная модель исследования, изучение молекулярных механизмов в норме и патологии, а также различная роль тех или иных провоспалительных факторов. Например, исследования, посвященные изучению роли молекул адгезии при атеросклерозе, позволяют считать молекулу VCAM-1 специфичным патогенным маркером, по сравнению с другими молекулами адгезии, однако такая точка зрения также разделяется не всеми авторами [399].
Высказывается мнение о возможном протективном действии ростовых факторов (печеночного ростового фактора, эндотелиального сосудистого ростового фактора), высвобождаемых моноцитами и эндотелиоцитами под влиянием провоспалительных цитокинов – ИЛ-1, ИЛ-6, ФНО- [222, 339]. Ростовые факторы могут способствовать развитию коллатерального кровообращения, неоваскуляризации и реэндотелизации сосудов после повреждения ишемизированного органа у больных атеросклерозом, но могут вызывать образование неоинтимы и неоадвентиции, стимулировать значительное утолщение всех стенок артерии, активировать воспалительную реакцию моноцитов [396] и формирование рестеноза после баллонной ангиопластики, а также способствовать образованию тромбов путем активации тромбоцитов ростовым фактором, высвобождаемым поврежденными эндотелиоцитами [290]. В материалах Национальных Конгрессах кардиологов России обсуждалась положительная роль тканевого активатора плазминогена, обладающего свойствами предотвращать образование неоинтимы и сужение просвета сосуда после баллонного повреждения. Противоположные эффекты выявлены для урокиназного активатора плазминогена (урокиназа), что связывают со структурными особенностями фермента [131, 159].
Спорной проблемой в понимании механизмов атерогенеза является роль апоптоза эндотелиоцитов и гладкомышечных клеток. Некоторые цитокины, например ФНО-, стимулируют апоптоз эндотелиоцитов у больных атеросклерозом [370]. С одной стороны, с апоптозом связывают повреждение эндотелия, «покрышки» атеросклеротической бляшки, развитие тромбогенных ситуаций [205, 212, 291]. С другой стороны, избыточная клеточная пролиферация гладкомышечных, воспалительных и адвентициальных клеток может способствовать гиперплазии интимы и рестенозу после ангиопластики [211, 322, 365]. Эффективность некоторых ингибиторов ГМГ-КоА редуктазы связывают с антипролиферативным эффектом в отношении гладкомышечных клеток, опосредованным повышением экспрессии р53 и регуляцией экспрессии циклин-зависимой киназы-2 (проапоптотическими механизмами), что компенсируется повышением межклеточного уровня ИЛ-8. Инактивация р53, вероятно, связана с развитием рестенозов [355, 368]. Кроме этого, было показано, что доноры NO способны индуцировать апоптоз человеческих коронарных гладкомышечных клеток и, таким образом, осуществлять важную функцию в предупреждении атеросклероза и рестеноза [289]. Предполагается, что индукция апоптоза человеческих эндотелиальных клеток может вызываться как минимум двумя различными механизмами: одним, зависимым от синтеза белка (истощение белка), другим, зависимым от окислительных механизмов [270]. Еще одним патогенетическим фактором является апоптоз кардиомиоцитов, интенсификация которого может быть фактором развития сердечной недостаточности, что существенно усложняет клиническую интерпретацию данных об изменениях процессов апоптоза при ИБС или гипертонической болезни [309, 335].
Факторами повреждения и инициаторами воспаления в сосудистой стенке при атеросклерозе, вероятно, могут выступать не только артериальная гипертония (АГ) или эндогенные провоспалительные стимулы, появление которых связывают с нарушением метаболизма ангиотензина II или других регуляторных молекул и гормонов. Большое количество работ посвящено роли инфекционных факторов в атерогенезе. Роль инфекции в атерогенезе нашла отраженение в многочисленных научных исследованиях [98, 106, 188]. Особого внимания в этой связи заслуживают Koxaki V., Chlamydia pneumoniae, Helicobacter pylori, Cytomegalovirus и некоторые друрие. Результаты обследования жителей Новосибирска показали, что у 66 % больных ИБС в лейкоцитах крови обнаруживаются фрагменты ДНК Chlamydia pneumoniae, в то время как у здоровых лиц не более 12 %. Антигены Chlamydiae pneumoniae обнаруживают в атеросклеротических бляшках. Методом ДНК-ДНК гибридизации показано, что инфицирование Micoplasma hominis является фактором риска развития острого инфаркта миокарда. Кроме этого, у больных острым инфарктом миокарда выявлено значительное увеличение распространенности антител к Chlamydia pneumoniae, Cytomegalovirus, Toxoplasma, Rubella V, Mycoplazma pneumoniae. [9, 10]. Исследование Гаджиевой З.Г. (2001) показало, что выявление антител к Chlamydia pneumoniae (IgA) является фактором риска ИБС и ассоциация ее находится в прямой связи с такими факторами, как гиперхолестеринемия, артериальная гипертензия и сахарный диабет [32]. Коц Е.Е., Маршалкина Н.А. и соавт. (2001) выявили влияние уровня IgM к Chlamydia pneumoniae на величину интервала Q-T у больных стенокардией, страдающих пароксизмами мерцания предсердий, что делает вероятным влияние активного инфекционного процесса на электрическую нестабильность миокарда; показано, что наиболее высокие титры IgM к Chlamydia pneumoniae были выявлены в группе больных нестабильной стенокардией в сочетании с пароксизмальной мерцательной аритмией [79, 93]. В 1997 году опубликованы результаты исследования Gupta S. et al. показавшие возможности снижения частоты неблагоприятных событий у больных ИБС, имевших высокие титры антител к Chlamydia pneumoniae, после лечения азитромицином [275]. Однако не все последующие наблюдения подтвердили столь оптимистичные выводы.
При исследовании уровней антител к Cytomegalovirus у больных нестабильной стенокардией и инфарктом миокарда, IgM были обнаружены только у 1,28 % пациентов, что свидетельствует о недавно перенесенном обострении цитомегаловирусной инфекции, в то время как антитела IgG были обнаружены у 100 % больных [51].
Предполагается связь между наличием и активностью очагов хронической инфекции и течением ИБС. Так, Мякинькова Л.А. (2001) показала, что обострение хронического пиелонефрита у больных ИБС часто сочетается с развитием нестабильного состояния и госпитализацией в кардиологическое отделение, а также с нарушениями ритма, повышением АД, ишемическими изменениями на ЭКГ, увеличением уровней липопротеидов и общего холестерина в сыворотке крови, повышением уровня Фн, активацией свертывающей активности крови (укорочение тромбинового и протромбинового времени) [116]. Показано, что у больных вторичным сифилисом также имеется дисфункция эндотелия и увеличение агрегационной функции тромбоцитов, которые могут быть факторами риска развития склерогенных изменения сосудов [196]. Изменения липидного спектра при желчекаменной болезни у женщин аналогичны таковым при ИБС, что позволяет считать наличие желчекаменной болезни фактором риска развития атеросклероза [37, 38].
Концепция воспалительных механизмов в развитии атеросклероза не противоречит концепции атеросклероза с точки зрения патологии полиеновых жирных кислот, предложенной В.Н. Титовым и опубликованной в двух его монографиях (2002, 2003 гг.). Автор придает значение холестерину как носителю полиеновых жирных кислот от клетки к клетке и основную проблему атеросклероза видит в дефиците эссенциальных полиеновых жирных кислот внутри клеток. Оказывается, клетки организма человека не в состоянии синтезировать полноценные полиеновые жирные кислоты. Происходит замещение эссенциальных (-3 и -6) жирных кислот в составе клеточных мембран на дефектные молекулы – -9 полиеновые жирные кислоты, содержащие не более трех двойных связей и не далее, чем у 9-го атома углерода от метильного конца жирной кислоты. Изменение состава клеточных мембран является причиной нарушения их функции, включая гиперэкспрессию молекул адгезии (в настоящее время не доказано). Изменение рецепторного поля, вызывает мембранопатию с развитием АГ, инсулинорезистентности, микроальбуминурии и других неблагоприятных эффектов. Возможно, именно патологические полиеновые жирные кислоты являются причиной эндогенного воспаления при атеросклерозе, причиной повышенной экспрессии молекул адгезии, синтеза медиаторов воспаления, прежде всего лейкотриенов [157, 158]. Обсуждаемая теория атерогенеза должна учитывать различные причины нарушения поглощения клетками эссенциальных полиеновых жирных кислот. Эти причины могут иметь или генетически обусловленных характер или возникать под влиянием факторов системной воспалительной реакции. В исследовании Рысмердиева А.Ж. и соавт. (2001) была предпринята попытка выявить генетические дефекты апопротеинов, с которыми можно связать нарушение взаимодействия липопротеинов с клеточными мембранами. Но значительных различий между группами больных ИБС и практически здоровыми лицами не установлено [144].
Таким образом, накопленные результаты научных исследований указывают на очевидную роль иммунного воспаления в интиме сосудов в развитии атеросклероза с участием Т-хелперов 1-го типа или цитотоксических Т-лимфоцитов, а также моноцитов и нейтрофилов, способных накапливать капли холестерина, стимулировать миграцию и пролиферацию гладкомышечных клеток. Инициирующим фактором атеросклероза признается повреждение сосудистой стенки с возможным участием хламидий, микоплазмы, хеликобактера, вирусов, ЛПНП, комплексов антиген-антитело, АГ, продуктов перекисного окисления липидов и других факторов. Кроме этого, ряд острофазовых тестов рекомендуется для клинической практики (СРБ, ФНО-, ИЛ-1, ИЛ-6) с целью повышения точности диагностики нестабильных состояний. В последнее время появилось много работ указывающих на противовоспалительные эффекты статинов – блокаторов основного фермента синтеза мевалоновой кислоты (предшественника холестерина) гидрокси-метилглютарил-КоА-редуктазы. Более того, ученые считают, что именно противовоспалительные эффекты являются наиболее важными в развитии клинической эффективности данных препаратов, на что указывают исследования, показавшие уменьшение размеров бляшек в сосудах еще до значимого снижения ЛНП в крови больных ИБС [191, 329].
Механизмы системного воспаления оказывают не менее активное влияние на формирование атеросклеротических повреждений сосудистой стенки, чем воспаление в области атеросклеротической бляшки. Атеросклероз активно развивается у пациентов с различными хроническими воспалительными заболеваниями, что заставляет обратить особое внимание на этот вариант поражения сердечно-сосудистой системы при заболеваниях органов дыхания. Обсуждая влияние патологии органов дыхания и сердечно-сосудистой системы, в большинстве случаев говорят о синдроме взаимного отягощения. С одной стороны, дыхательная недостаточность, изменение биомеханики работы грудной клетки, воспаление бронхо-легочного аппарата оказывают влияние на состояние сердечно-сосудистого комплекса. С другой, левожелудочковая сердечная недостаточность является достаточно частой причиной одышки и даже вторичных изменений в легких. Дифференциальная диагностика причин одышки является важной клинической проблемой, и ее успешное решение представляет немало сложностей.
Безусловным прогрессом является внедрение за последние годы современных фармакологических средств, регулирующих воспалительную реакцию, позволяющих успешно корректировать метаболические дефекты, формируя адекватные реакции организма человека на различные внешние и внутренние стимулы. Искусство применения новых препаратов требует постоянного стремления к пониманию патогенеза, развития концепций тактики и стратегии в лечении больных. Поэтому, последовательное изложение патогенеза и особенно воспалительных механизмов различных хронических бронхообструктивных заболеваний помогает понять формирование нарушений сердечно-сосудистого комплекса, а также сопоставить результаты применения стандартов лечения и собственных клинических наблюдений с теоретическими данными.
ГЛАВА I
БРОНХИАЛЬНАЯ АСТМА
- Современное представление о бронхиальной астме
Учение о БА интенсивно развивается и, в конце 1980-х, начале 1990-х годов наше понимание патогенетических механизмов заболевания, а также принципов его лечения существенно изменилось. Ранее БА называли заболевание, основным клиническим проявлением которого является приступ удушья, возникающий как проявление бронхоспазма. Но после обобщения результатов патоморфологических и ряда экспериментальных исследований, доминирующим механизмом этого заболевания считают особый вариант воспаления дыхательных путей, появился термин «аллергическое воспаление» [42, 160, 238, 266, 268, 353].
Определение
Бронхиальная астма – хроническое воспалительное поражение дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. Хроническое воспаление ассоциировано с гиперреактивностью дыхательных путей и приводит к повторяющимся эпизодам хрипов, одышки, чувства сдавления в груди и кашлю, преимущественно ночью или ранним утром. Эти эпизоды обычно сопровождаются распространенной, но вариабельной обструкцией дыхательных путей внутри легких, которая часто обратима спонтанно или под влиянием лечения.
С клинических позиций для улучшения дифференциальной диагностики важно отметить, что БА по статистике является одним из самых распространенных хронических воспалительных поражений бронхов (бронхитов). Наиболее частым симптомом заболевания является кашель. Это не специфичный симптом, но, с учетом высокого распространения БА – 3-30 % среди всего населения [54, 55, 160, 169, 181, 266] – длительный, рецидивирующий кашель, чаще всего, маркирует наличие БА.
Главными моментами, обозначенными в определении БА, являются: представление о воспалительной природе заболевания, понятие о вариабельности бронхиальной обструкции, отсутствие данных о приступе удушья и понимание, что астма может проявляться различными респираторными симптомами.
- Механизмы развития аллергического воспаления бронхов
Воспалительные механизмы приводят к структурной перестройке слизистой оболочки бронхов [203, 266, 296, 318]. Анализ аутопсийного материала, полученного от больных, умерших от БА, и биопсийного материала различных участков слизистой оболочки бронхов, полученного при бронхоскопии, указывает на следующие черты воспалительной реакции (табл. 1.1).
Таблица 1.1.
Морфологические признаки воспаления при бронхиальной астме
- деструкция реснитчатого эпителия слизистой бронхиального дерева,
- утолщение и редупликация базальной мембраны слизистой и волокон субэпителиального ретикулярного коллагена,
- гипертрофия перибронхиальных гладкомышечных волокон,
- гиперплазия бронхиальных желез с гиперсекрецией слизи,
- отек слизистой оболочки бронхов и подслизистого слоя и некоторые другие [203, 204, 266, 296].
Доказано, что степень активности воспаления влияет на выраженность бронхиальной обструкции и степень гиперреактивности бронхиального дерева у больных БА [203, 206, 217, 219, 221, 232, 255, 272, 278, 336, 364].
Бронхиальная обструкция формируется, прежде всего, за счет спазма гладкой мускулатуры бронхов, что и определяет эффект 2-агонистов у больных БА, расслабляющих мышцы бронхов за счет накопления внутриклеточного цАМФ. Другие механизмы – усиление секреции слизи и изменение ее реологических свойств, отек слизистой оболочки бронхов – чаще имеют меньшее значение, но в ряде клинических ситуаций являются причиной неэффективности лечения. Длительное существование тяжелой неконтролируемой БА (при высокой активности воспаления в бронхах) приводит к развитию изменений стенки бронхов, обуславливающих стойкую бронхиальную обструкцию – отложению коллагеновых волокон в подслизистом слое, неравномерному утолщению базальной мембраны, гипертрофии гладких мышц.
Все перечисленные механизмы бронхиальной обструкции рассматриваются как следствие воспалительной реакции, в ходе которой наблюдается высвобождение биологически активных веществ – медиаторов, действующих на клетки-эффекторы воспалительной реакции и структурные элементы бронхиальной стенки, включая гладкомышечные клетки (табл. 1.2).
Таблица 1.2.
Основные медиаторы воспаления при бронхиальной астме
- гистамин,
- ацетилхолин,
- лейкотриены В4, С4, D4, Е4,
- простагландины D4, F2-альфа,
- фактор, активирующий тромбоциты,
- эотаксины 1 и 2,
- вещество П,
- брадикинин,
- бомбезин,
- тахикинины,
- вазоактивный интестинальный пептид и другие
Источниками высвобождения медиаторов являются тучные клетки, базофилы, нейтрофилы, нервные окончания и клетки слизистой оболочки бронхов [217, 219, 364].
Большое значение имеют биологически активных веществ, высвобождаемых эозинофилами – эозинофильный катионный белок, большой щелочной белок, эозинофильный белок X и эозинофильная пероксидаза, которые содержатся в гранулах эозинофилов [388]. Биологическая роль данных веществ заключается в повреждении реснитчатого эпителия дыхательных путей и базальной мембраны, что обнажает субэпителиальные структуры, рецепторы нервных окончаний, способствует прогрессирующей воспалительной реакции, инфильтрации слизистой оболочки воспалительными клетками, приводит к утолщению слизистой оболочки и пропотеванию тканевой жидкости в просвет бронха [266].
Различают два механизма развития аллергического воспаления. Первый – развитие острого бронхоспазма – классически связывают с механизмами аллергической реакции немедленного типа, возникающей под влиянием контакта с виновным аллергеном в стенке бронхов. Реакция протекает с участием иммуноглобулина Е, фиксированного на тучных клетках и базофилах [258]. При взаимодействии со специфическим аллергеном, стимулируется высвобождение биологически активных веществ, влияющих на гладкую мускулатуру с развитием бронхоспазма. Одновременно имеют место реакция эндотелиальных клеток, способствующая повышению проницаемости сосудистой стенки и формированию отека бронхиальной слизистой, а также раздражение нервных окончаний (рис. 1.1).
Второй вариант событий формирования бронхиальной обструкции связывают с поздней фазой аллергической реакции (рис. 1.2). Она обусловлена патологическим действием воспалительных клеток крови, мигрировавших в бронхиальную стенку под влиянием биологически активных веществ, освобожденных ранее [285, 301, 302]. Большая роль в формировании поздней аллергической реакции отводится эозинофилам [390, 391].

Рис. 1.1. Механизмы аллергической реакции немедленного типа
Их растворимые биологически активные вещества вызывают структурную перестройку бронхиальной стенки, включая деструкцию эпителия, обнажение субэндотелиальных структур и повышение чувствительности нервных окончаний. Это ведет к длительному воспалительному процессу в бронхах, формированию бронхиальной гиперреактивности и бронхиальной обструкции (рис. 1.2).

Рис. 1.2. Механизмы поздней фазы аллергической реакции
Оба указанных механизма бронхиальной обструкции при БА традиционно считают аллергическими или иммунными. Но возможны другие, например, повреждение эпителия бронхов и раздражение нервных окончаний возникают в результате длительного влияния некоторых химических веществ, таких как окислы азота, оксид азота, оксид серы, озон, формальдегиды и другие. Вместе с тем исключить формирование иммунологических механизмов не всегда представляется возможным. Было доказано, что при длительном раздражении слизистой бронхиального дерева метахолином у здоровых волонтеров ведет к формированию бронхиальной гиперреактивности и повышению общего иммуноглобулина Е в сыворотке крови [233].
Обсуждаются и другие неиммунные механизмы развития бронхиальной обструкции при астме [27, 170, 389], но для утверждения о первичности тех или иных нарушений со стороны рецепторного аппарата клеток или метаболических нарушений по отношению к воспалительному процессу нужны дополнительные исследования.
- Иммунологическая модель бронхиальной астмы
Данные, полученные с помощью нескольких методик (исследование аутопсийного материала больных, умерших от БА, биопсийного материала бронхов, а также исследование бронхиальных смывов и жидкости бронхоальвеолярного лаважа) показали, что во всех случаях, даже у больных легкой астмой, выявляются, описанные выше, элементы воспаления бронхиального дерева. При этом было установлено, что степень деструкции мерцательного реснитчатого эпителия, количество дегранулировавших эозинофилов и концентрация биологически активных веществ (гистамина, простагландина F2-альфа, лейкотриенов С4 и D4, эозинофильного катионного белка, большого щелочного белка, эотаксина-2 и некоторых других) соответствуют тяжести клинических проявлений и функциональным изменениям у больных БА [203, 272, 285, 336, 364, 390, 391]. Степень активности участников воспаления сильно варьирует, что определяет клиническую картину каждого конкретного случая заболевания.
Взгляды на механизмы воспалительной реакции и формирования бронхиальной обструкции суммирует схема патогенеза заболевания, представленная на рисунке 1.3.
Участие агрессивных факторов эозинофилов определяет формирование гиперреактивности бронхов в позднюю фазу аллергической реакции [206, 223, 286, 293].

Рис. 1.3. Воспалительные механизмы бронхиальной обструкции при БА [238]
Поэтому приходится признать ведущую роль эозинофилов – клеток разрушителей и главных виновных клеток воспаления при БА [203, 221, 223, 265, 272, 296, 364, 388, 390, 391]. Эти данные несколько противоречат прежним представлениям о защитной функции фeрментов этих клеток (арилсульфатаза и гистаминаза) при аллергических заболеваниях [141]. В тоже время увеличение количества эозинофилов в периферической крови и ранее связывали с тяжестью БА [388].
Было показано, что в случаях тяжелой астмы выявляются активированные эозинофилы с признаками дегрануляции. Результаты проведенных исследований указывают на значение большого щелочного белка, высвобождаемого эозинофилами, как главного виновника деструкции эпителия бронхов. Доказана корреляционная взаимосвязь концентрации этого фактора в бронхоальвеолярной жидкости и величины гиперчувствительности бронхов к неспецифическим стимулам [203]. Подобная зависимость динамики максимального потока выдоха от содержания эозинофильного катионного белка в сыворотке крови (коэффициент корреляции r=-0,433, p<0,05 до лечения и r=-0,504, p<0,02 после лечения) была выявлена E.Griffin и соавт. (1992) [272], а также другими авторами [221, 223, 232, 255, 336]. Современные исследования указывают на достаточно высокую точность соответствия концентрации высвобождаемого эотаксина-2 в культуре клеток индуцированной мокроты больных БА и тяжести течения заболевания [364].
Здесь проявляется отличие бактериального воспаления, направленного на элиминацию возбудителя из организма человека, где активная роль принадлежит нейтрофилам – воинам экссудативной фазы воспалительного процесса. При БА главной клеткой воспалительного процесса чаще всего является эозинофил. Его медиаторы разрушают структуры стенки бронха и вызывают воспалительный ответ в области поврежденных тканей [206, 285, 296].
В настоящее время уже сделаны попытки установить причину столь необычного поведения эозинофилов у больных БА. Почему у определенных людей или в определенных условиях воспалительная реакция протекает не с преобладанием нейтрофилов и макрофагов, а при активации эозинофилов? Где лежат причины активации эозинофилов и тучных клеток, которые играют роль блокаторов дыхательных путей при участии выделяемых ими медиаторов (рис. 1.4)?
Ответы на поставленные вопросы раскрывает теория организации воспалительного ответа – как модели кооперации иммунокомпетентных клеток. Центральной фигурой иммунной реакции является лимфоцит – "дирижер оркестра клеточных реакций в воспалительном ответе". Но, как будет показано ниже, воспаление при астме очень коварно, потому, что некоторые другие клетки, такие как базофилы и тучные клетки пытаются "сыграть свою партию", отчего общая ситуация становиться мало управляемой, хаотичной и непредсказуемой [219].

Рис. 1.4. Формирование различных вариантов воспалительной реакции
под влиянием антигенов (аллергенов) в зависимости от участия дополнительных факторов
Под "иммунологической моделью" БА понимают совокупность знаний о состоянии системы иммунитета, при котором воспаление бронхиального дерева становится причиной этого заболевания. Такое состояние определяется закономерностями межклеточной иммунокооперации.
Традиционная роль Т-лимфоцита-регулировщика (Т-хелпера-индуктора) заключается в восприятии информации о попавшем в организм чужеродном веществе-антигене в комплексе с необходимым стимулирующим медиатором – интерлейкином-1 от макрофага (или другой антигенпрезентирующей клетки). После определения таких сигналов Т-хелпер-индуктор в свою очередь передает инструкции В-лимфоцитам о начале синтеза антител для агрегации чужеродных агентов, опсонизации и поглощения их фагоцитирующими клетками с последующей элиминацией из организма. Сигналами Т-лимфоцита в этом случае выступают другие интерлейкины – 2, 4, 5, 6 типов (ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6) (рис. 1.5).
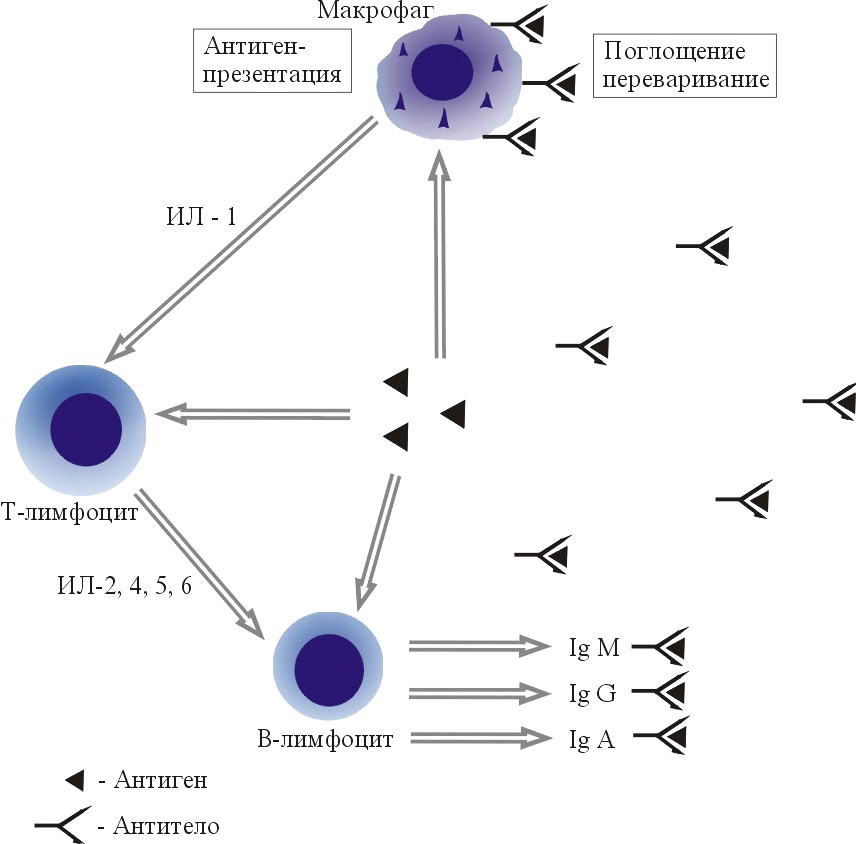
Рис. 1.5. Модель межклеточной кооперации в иммунном ответе
Представленная схема участия иммунокомпетентных клеток в ответной реакции организма на чужеродный агент очень упрощена и не охватывает всего сложного комплекса событий действия клеток и их растворимых факторов. Но она отражает самые главные, центральные механизмы. Как было установлено, именно в этом звене иммунного ответа у больных аллергическими заболеваниями возникают нарушения. В организме человека присутствуют Т-лимфоциты, выполняющие разные функции. Важным фактом развития аллергического воспаления является наличие у человека 2-х субпопуляций Т-хелперов, вырабатывающих различные спектры цитокинов – Т-хелперов 1-го типа (Тх-1) и Т-хелперы 2-го типа (Тх-2). Т-хелперы 2-го типа (Тх-2) способны выделять интерлейкины-3, -4, -5, -6, -9, -10, -13 [197, 213, 285]. Интерлейкины осуществляют управление функциями других иммунокомпетентных клеток. Роль интерлейкина -4 в стимуляции синтеза IgE у больных атопической астмой была доказана в работах многих ученых [305, 313, 386, 392, 395, 401]. У больных БА под влиянием интерлейкинов -4 и -13 наблюдается синтез IgЕ, а действие интерлейкинов -3 и -5 способствует образованию эозинофилов в костном мозге, выходу их в циркуляцию, устойчивости их по отношению к повреждающим факторам и повышению их активности. Следовательно, вместо стимуляции синтеза защитных классов иммуноглобулинов (M, G, A) у больных аллергическими заболеваниями Т-хелперы определяют синтез IgE и стимулируют эозинофилы [162, 217, 392].
Роль активных лимфоцитов при астме имеет определяющее значение. Факты участия Т-лимфоцитов в организации межклеточного взаимодействия подробно изложены в сообщении M.Ricci на Международном Конгрессе Интерасма'93 [353] и монографии Астма (2003), изданной Европейским респираторным обществом [206, 258, 285, 299] (рис. 1.6).
В дыхательных путях больных астмой отмечается повышенное содержание Т-лимфоцитов в активной форме. Они высвобождают цитокины, которые являются важными медиаторами хронического воспаления и оказывают влияние на природу воспалительного ответа [223, 301, 302].
Содержание растворимого клеточного маркера лимфоцитов CD23 в сыворотке крови имеет корреляционную взаимосвязь с уровнем эозинофильного катионного белка. Аналогичные данные были получены при изучении взаимосвязи содержания IgE и эозинофильного катионного белка в сыворотке крови [232, 248, 265, 301, 305, 347, 359, 392].
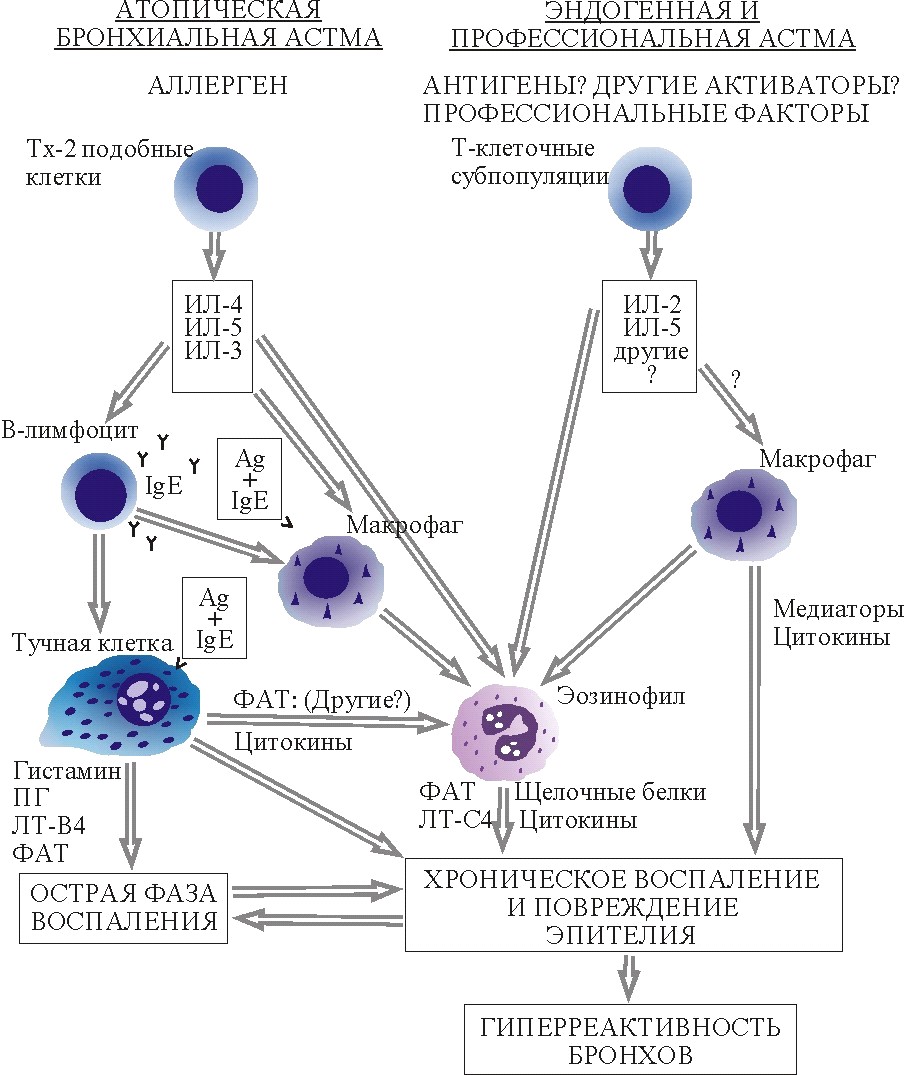
Рис. 1.6. Роль Т-лимфоцитов-регулировщиков в организации воспаления при бронхиальной астме [353]
У больных с внутренней и профессиональной астмой регулирующей функцией обладают цитотоксические Т8+ лимфоциты и Т4+, продуцирующие спектр интерлейкинов -2, -3 и -5 типов. Считается, что интерлейкин -5 может служить цитокином, ответственным за селективную активацию эозинофилов при аллергических заболеваниях. Влияние интерлейкина -5 заключается в усилении функциональной активности зрелых клеток, поддержании их жизнеспособности, индукции образования супероксиданиона и стимуляции хемотаксиса эозинофилов, а также в избирательной стимуляции и дифференцировке костномозговых предшественников эозинофилов. Стимуляция костномозговых предшественников эозинофилов происходит также под действием интерлейкинов -1 и -3 [197].
В процессе воспалительной аллергической реакции Тx2-подобную активность могут приобретать другие клетки – базофилы и тучные клетки с высвобождением интерлейкинов -4, -3, -5 и -13 [219, 239, 299, 314].
На значение Т-лимфоцитов при астме указывает мнение, что они являются одними из главных мишеней действия ингаляционной глюкокортикоидной терапии [238].
Конечно, особенности реагирования Т-лимфоцитов при БА не могут полностью объяснить патогенез заболевания, это только один из предрасполагающих факторов, но нарушения в иммунном ответе у больных БА не вызывают сомнения. Описанная иммунологическая модель БА объясняет, почему воспаление и участие эозинофилов одинаково выражено проявляется как при экзогенной (атопической) природе заболевания, так и при других клинических вариантах.
Макрофаги также являются активными клетками, индуцирующими воспаление при астме. Они способны высвобождать широкий ряд медиаторов, включая простагландины, лейкотриены, кислородные радикалы и цитокины (ИЛ-1, ИЛ-8, компонент комплемента С5а, фактор некроза опухоли и другие), которые могут оказывать существенное влияние на природу воспалительного ответа. Известно, что их действие угнетается ГК и не зависит от 2-агонистов [141].
В патогенезе воспалительной реакции при астме принимают участие нейтрофилы и тромбоциты [23, 170, 203, 234, 235, 287]. Их участие тесным образом связано с активацией перекисного окисления липидов и метаболитов арахидоновой кислоты [23, 170, 257, 327, 384].
У некоторых больных БА нейтрофилы выявляются в значительно повышенном количестве среди инфильтрирующих бронхи клеток. Они также как эозинофилы, активно генерируют кислородные радикалы в зоне воспаления. Разрушительной активностью обладают ферменты, содержащиеся в гранулах нейтрофилов – катепсин G, рибонуклеаза, трипсин, эластаза и другие. Активатором нейтрофилов считают Т-лимфоциты, которые синтезируют и высвобождают гранулоцитарный макрофагальный колонии стимулирующий фактор, ИЛ-8, фактор ингибирующий миграцию лейкоцитов, нейтрофильный хемотаксический фактор. Возможно, что роль нейтрофилов не ограничивается только повреждающей функцией. Они включаются в сложные межклеточные кооперации, тесно взаимосвязаны с эозинофилами и тромбоцитами, привлекая последние в очаг воспаления и активируя их функцию. Особой активностью обладает фактор, активирующий тромбоциты. Он не только стимулирует адгезию и агрегацию тромбоцитов и высвобождение содержимого их гранул, но самостоятельно может усиливать сосудистую проницаемость и вызывать спазмы гладкой мускулатуры бронхов. Возникающие при этом стаз крови в капилярах и венулах, тромбоцитарные пробки, обнажение субэндотелиальных структур определяют активацию системы гемостаза и блокаду местной микроциркуляции [170].
Ативно изучается и роль других мезенхимальных клеток (тучные, гладкомышечные и др.) в патогенезе БА [204, 231, 314], участие которых посредством высвобождаемых ими медиаторов значительно меняет картину заболевания у отдельных групп пациентов, что является патогентическим основанием для выделения клинических вариантов течения заболевания.
Большое значение в генерации бронхоспастических реакций имеют продукты обмена арахидоновой кислоты – простагландины и лейкотриены. Причем, ингаляции лейкотриенов С4 и D4 вызывают нарушение бронхиальной проходимости в гораздо меньших концентрациях, чем гистамин и метахолин. Их концентрация, вызывающая бронхоспазм, зависит от реакции бронхов на метахолин [203]. Простагландины и лейкотриены, участвующие в воспалении при астме образуются как эозинофилами, так и другими: тучными клетками, макрофагами, нейтрофилами и другими [23, 141, 170, 219, 285, 301, 314].
Участие нервной системы в воспалении может быть опосредовано усилением эфферентной иннервации, действием медиаторов нехолинэргической неадренэргической нервной системы, по механизму "аксон рефлекса" или реакцией ЦНС, где происходит синтез интерлейкина -1, фактора, активирующего тромбоциты и фактора некроза опухоли. Установлена способность интерлейкина-1 проникать через гематоэнцефалический барьер и влиять на активность нервных клеток через специализированные рецепторы [170, 199, 299].
В зависимости от причины и действующих факторов клеточной и гуморальной природы в развитии воспаления дыхательных путей описано несколько его вариантов, среди которых можно выделить аллергический, инфекционно-зависимый, метаболический, токсический, связанный с действием биологически активных веществ, высвобождаемых тучными клетками под влиянием неспецифических стимулов, а также "нейрогенное воспаление" и другие. Основные различия между вариантами связаны со значением провоцирующих факторов и соотношением воспалительных клеток и медиаторов [160, 170, 199, 217, 233, 282, 353]. Вместе с тем, проблема зависимости клинической картины заболевания и выбора терапевтической тактики от ведущих факторов патогенеза остается актуальной. Интерес вызывает дальнейшее развитие учения о дифференцированном лечении с учетом клинических и патогенетических особенностей заболевания [76, 160, 169, 181].
Главными клинико-патогенетическими вариантами бронхиальной астмы являются атопический и инфекционно-зависимый. Многие авторы выделяют особо астму физического усилия и "аспириновую" астму. В механизмах развития последней принимают участие нарушения обмена арахидоновой кислоты. Причинами клинических проявлений "аспириновой" астмы могут быть циклооксигеназингибирующие и протеинсвязывающие свойства анальгезирующих средств, а также IgE-опосредованная реакция на салицилаты [36, 141, 181, 184, 243, 327, 378, 398].
Некоторые особенности патогенетических механизмов, клиники и рациональной терапии выявлены у гормонозависимых пациентов, а именно, увеличение кортизолрезистентной фракции лимфоцитов, изменение микробного пейзажа слизистой бронхов, требующие соответствующей терапевтической коррекции и особой тактики лечения в период обострения заболевания [160, 276].
Большой интерес представляют работы, посвященные изучению механизмов формирования бронхиальной гиперчувствительности на неспецифические стимулы при БА. Долгое время гиперчувствительность считали кардинальным признаком БА, формирующимся в результате генетической предрасположенности, атопической реакции на неспецифические аллергены или в результате реакции на инфекционные агенты [169]. В период формирования представлений об астме как о воспалительном заболевании было доказано, что гиперчувствительность бронхов является следствием воспалительного процесса и возникает под влиянием биологически активных веществ, продуцируемых воспалительными клетками [203, 206, 219, 353]. Однако, доказана была и возможность развития воспаления бронхов в результате стимуляции метахолином и другими стимулами [233]. Степень воспаления в бронхах не всегда точно соответствует выраженности повышения их чувствительности к неспецифическим стимулам [204]. Однако нельзя исключить, что реактивность гладкомышечных клеток изменяется вторично под воздействием провоспалительных стимулов [219, 231]. Так или иначе, но взаимосвязь воспаления бронхов и их повышенной чуствительности к раздражителям считается доказанной [266].
Таким образом, в настоящее время полностью доказана роль воспаления в формировании основных клинических проявлений у больных БА. Причина его хронического течения определяется условиями организации и функционирования сложного ансамбля взаимодействующих клеток: лимфоцитов, нейтрофилов, эозинофилов, тучных клеток, базофилов, тромбоцитов, эндотелиоцитов, нервных клеток, и не исключено, что участники начинают выполнять несвойственные им в норме функции все более и более стимулируя друг друга к проявлению активности. Обнаружены корреляционные зависимости факторов воспалительной реакции с уровнем бронхиальной обструкции.
Достаточно подробно изучены механизмы формирования аллергической реакции, включая отсроченный тип реакции с участием эозинофилов, тучных клеток, лимфоцитов и других клеточных элементов, а также высвобождаемых ими растворимых факторов, что представляет отличительную особенность воспаления при астме. Доктор P.J.Barnes дал меткое определение такой ситуации – "mediator soup" (медиаторный бульон), подчеркивая перспективы к поиску новых антимедиаторных средств, нацеленных на "тушение пожара" особого вида воспалительного процесса при астме. Кооперация клеток и их растворимых факторов в воспалительной реакции бронхов при астме отражена на рисунке 1.7. (схема из доклада доктора P.J.Barnes скопирована из Доклада Симпозиума по проблемам БА, состоявшегося в Осло в марте 1992 года [293]).
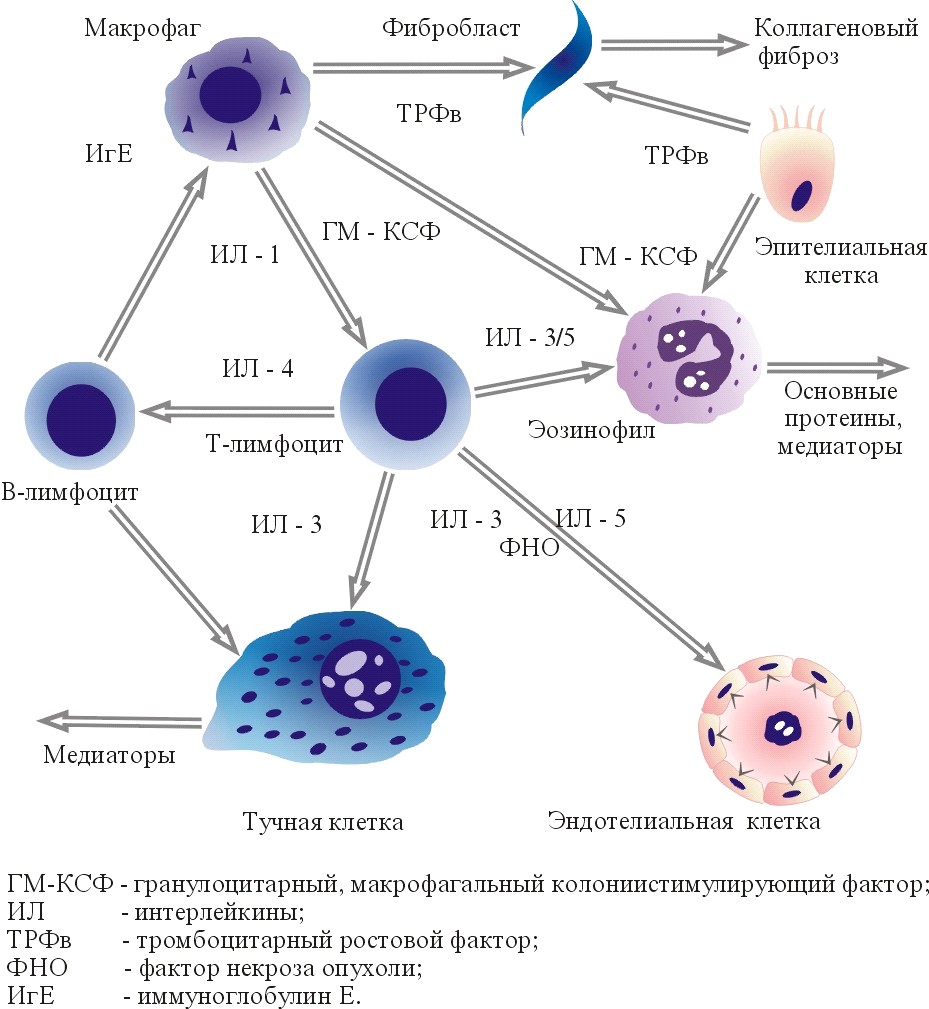
Рис. 1.7. Механизмы кооперации клеточных и растворимых факторов при бронхиальной астме [293]
- Клинические проявления и современные принципы ведения больных бронхиальной астмой
Диагностика бронхиальной астмы
Рассмотрим алгоритм диагностики БА. Необходимо стремиться к тому, чтобы первые его этапы осуществлялись на приеме врача общей практики. Подозрение о наличии БА возникает при обращении пациента с жалобами на длительный или рецидивирующий кашель, различные другие симптомы респираторного заболевания, сопровождающиеся кашлем и/или хрипами в грудной клетке, симптомом «свистящего» дыхания. Эти клинические признаки могут возникнуть вследствие бронхиальной обструкции и указывают на необходимость проведения дифференциальной диагностики между бронхитом, БА, бронхоэктазами, ХОБЛ и другими заболеваниями.
БА проявляется самыми разными респираторными симптомами, чаще всего кашлем. Кашель у больных БА обычно сухой, типично он появляется ночью, но чаще, конечно, в дневные часы. Мокрота плохо откашливается, но появляется после приступа кашля в виде плотного прозрачного комочка. Кашель и другие симптомы утихают после отхождения мокроты. Эпизоды БА часто имеют предвестники в виде зуда в глотке, в носу, чихания и других симптомов. Иными словами типичный эпизод БА имеет, как правило, три периода: период предвестников, выраженных проявлений (включая возможное развитие удушья), и период разрешения.
Диагностировать БА на основании приступов удушья неправильно. Приступы удушья могут иметь место при различных заболеваниях бронхов, легких, сердца, реже в других случаях. Приступы удушья являются не самым частым и, можно сказать, поздним симптомом БА, они маркируют тяжесть течения заболевания.
Симптомами астмы могут быть также чувство заложенности в груди, тяжесть дыхания, сдавление грудной клетки, нехватка воздуха, боль в грудной клетке, ощущение инородного тела, различные хрипы при дыхании и, наконец, дискомфорт дыхания.
Тем не менее, не всякий кашель или перечисленные симптомы являются проявлениями астмы. Как различить симптомы астмы от проявлений других респираторных заболеваний? Ответ простой. БА всегда проявляется бронхиальной обструкцией. Значит, если кашель или другие респираторные симптомы связаны с бронхиальной обструкцией, следует назначить обследование для исключения БА.
Для своевременной диагностики БА нужно хорошо знать симптомы бронхиальной обструкции:
- симптомы сопровождаются хрипами в грудной клетке;
- бочкообразная грудная клетка;
- резистентная грудная клетка;
- ослаблены дыхательные шумы при аускультации легких, ослаблена бронхофония;
- сухие хрипы, преимущественно в фазу выдоха при аускультации легких (при форсированном выдохе);
- в спирограмме – снижение ОФВ1, индекса Тиффно;
- рентгенологические признаки эмфиземы легких
- гиперкапнический тип дыхательной недостаточности.
У каждого больного, который обратился с жалобами на длительно существующий кашель, следует решить вопрос: связаны ли симптомы с бронхиальной обструкцией. Иными словами мы, следуя принципам посиндромной диагностики, формулируем ведущий синдром заболевания. Для БА ведущим синдромом является бронхообструктивный. Но кашель может быть признаком бронхитического синдрома (продуктивный кашель), легочно-плеврального синдрома, поражения интерстиция легких, возникать по причине раздражения диафрагмального нерва, в связи с сердечной недостаточностью, почечной недостаточностью и некоторыми другими синдромами. Формулировка ведущего синдрома – это первый этап диагностики любого заболевания внутренних органов, включая БА.
Второй этап диагностики БА – определение степени вариабельности бронхиальной обструкции. Вариабельность представляет собой возможность увеличения или уменьшения степени бронхиальной обструкции спонтанно или под влиянием лекарственной терапии. Вариабельной называется бронхиальная обструкция, способная к изменению в пределах 15-20 % и более в течение дня или нескольких дней. В последнее время критерием обратимости считают изменение величины ОФВ1 или ПСВ на 12-15 % и более после применения сальбутамола или спонтанно в течение суток или нескольких дней [122]. При БА обструкция обратима.
Чаще всего врач сталкивается с необходимостью проводить дифференциальный диагноз с другими заболеваниями, сопровождаемыми бронхиальной обструкцией – ХОБЛ, бронхоэктазами, первичной эмфиземой легких, муковисцедозом и некоторыми другими. Эти заболевания обычно сопровождаются частично необратимой бронхиальной обструкцией.
Итак, БА – бронхообструктивное заболевание, имеющее преимущественно обратимую бронхиальную обструкцию; ХОБЛ (и некоторые другие заболевания бронхов и паренхимы легких) – бронхообструктивное заболевание, имеющее преимущественно необратимую бронхиальную обструкцию. Какое значение имеет определение характера бронхиальной обструкции? Очевидно, что тактика лечения больного БА не всегда является лучшим выбором для больного ХОБЛ и наоборот. Тест на обратимость бронхиальной обструкции позволяет поставить правильный диагноз и назначить правильное лечение.
Приступ удушья – это достаточно редкое и тяжелое проявление болезни, при правильном лечении мы стремимся к полному устранению этого симптома. Если диагностика астмы ориентирована на наличие приступа удушья, то возникает проблема поздней диагностики заболевания. Больные, не имеющие диагноза БА, но болеющие этим заболеванием, не получают соответствующего лечения и имеют большой риск прогрессирования заболевания, риск внезапной смерти. Их часто беспокоят респираторные симптомы: кашель, насморк, а также общее недомогание. «Простудные симптомы» вызывают временную утрату трудоспособности. При этом сами больные и некоторые врачи называют это ОРЗ, ОРВИ. На самом деле в этих случаях речь идет о периодах обострения БА. В результате люди тратят деньги на неправильное лечение, государство оплачивает большое количество больничных листков, а работодатели терпят убытки вследствие невыхода работника на рабочее место или снижения его отдачи на производстве. Правильная диагностика БА отвечает интересам людей, государства и работодателей.
Следовательно, бояться необходимо не диагноза БА, а отсутствия правильной диагностики при наличии этого заболевания.
Почему люди болеют БА? Развитие астмы ассоциируется с некоторыми внутренними (host) и внешними факторами (environmental).
Предрасполагающие факторы обуславливают склонность индивидуума к болезни. Прежде всего, речь идет об атопии – повышенной способности вырабатывать иммуноглобулин Е в ответ на контакт с аллергенами окружающей среды.
Причинными факторами называют аллергены, вирусы и некоторые химические факторы, вызывающие начало заболевания.
Усугубляющие факторы способствуют развитию обострений заболевания или играют дополнительную роль в развитии БА. К таким факторам относят курение, загрязнение воздуха, вирусную респираторную инфекцию, малый вес при рождении, плохое питание и некоторые другие. Обсуждение роли этих факторов продолжается [55, 113, 160, 169, 181, 220].
Триггерные факторы являются необходимыми для обострения заболевания. Провоцирующими факторами обострения может быть дополнительная экспозиция причинно значимых аллергенов, профессиональных факторов, физическая нагрузка, холод, вдыхание раздражающих газов или воздействие чрезвычайных эмоциональных факторов.
Следует отметить, что в настоящее время не установлены какие-либо генетические факторы, непосредственно влияющие на развитие БА. Предполагается, что ряд генетических особенностей может способствовать развитию БА в сочетании с воздействием неблагоприятных факторов окружающей среды [328].
Можно обозначить алгоритм диагностики заболевания следующими тремя этапами:
- обращать внимание на всех больных с неспецифическим респираторными симптомами, прежде всего, с рецидивирующим хроническим кашлем, подозревая наличие у них БА;
- обследовать их для выявления признаков бронхообструктивного синдрома;
- выполнять тест с сальбутамолом или пикфлоуметрию для установления факта вариабельности бронхиальной обструкции и исключения других заболеваний.
Для определения бронхиальной обструкции важным моментом является проведение исследования функции внешнего дыхания. Наиболее информативными показателями считаются ОФВ1, ПСВ, индекс Тиффно.
ОФВ1 – это максимальный объем воздуха, который пациент может выдохнуть в течение 1-й секунды маневра форсированного выдоха после максимально глубокого вдоха.
ПСВ – это максимальная (пиковая) скорость выдоха.
Индекс Тиффно – это соотношение ОФВ1/ЖЕЛ.
Снижение индекса Тиффно ниже 70 % от должной величины, одновременно со снижением ОФВ1 и ПСВ свидетельствует о бронхиальной обструкции.
Указанные показатели можно получить с помощью компьютерной спирографии. Для определения ПСВ применяют карманные пикфлоуметры. Такие приборы должны иметь все больные, страдающие БА. Аналогично тому, что больные гипертонической болезнью, должны постоянно измерять свое АД, больные БА должны минимум 1-2 раза в день измерять ПСВ. Эти данные заносятся в график, называемый пикфлоуграммой. Пикфлоуграмму необходимо требовать у каждого больного БА при визите к врачу, потому что только анализ пикфлоуграммы позволяет врачу максимально быстро оценить тяжесть течения БА. При отсутствии пикфлоуграммы это трудно сделать даже за 20-30 минут обследования больного.

