Государственное бюджетное образовательное учреждение
дополнительного профессионального образования
«Новокузнецкий государственный институт усовершенствования врачей»
Министерства здравоохранения Российской Федерации
На правах рукописи
КЕРЕМЕЦКАЯ
ЕЛЕНА ВАСИЛЬЕВна
ВЛИЯНИЕ КОМБИНИРОВАННЫХ ОРАЛЬНЫХ КОНТРАЦЕПТИВОВ НА СОДЕРЖАНИЕ в крови иммунорегуляторных белков,
иммунных комплексов и цитокинов
14.01.01 – Акушерство и гинекология
Диссертация
на соискание ученой степени кандидата медицинских наук
Научные руководители:
доктор медицинских наук, профессор
Л.Г. Баженова
доктор биологических наук,
Р.М. Зорина
Новокузнецк – 2014
ОГЛАВЛЕНИЕ
| СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ …………………………. | 4 |
| ВВЕДЕНИЕ …………………………………………………………………. | 5 |
| Глава 1. ЛИТЕРАТУРНЫЙ ОБЗОР …………………………………….. | 10 |
| 1.1. Эволюция препаратов гормональной контрацепции …………….... | 10 |
| 1.2. Влияние современных КОК на метаболические процессы, показатели иммунитета и свертывания крови …………………………………... | 18 |
| 1.3. Онкологические аспекты современной гормональной контрацепции | 32 |
| Глава 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ ……………… | 38 |
| 2.1. Характеристика групп обследованных женщин …………………….. | 38 |
| 2.2. Методы забора биологического материала, иммунологические и биохимические исследования сыворотки крови …………………………. | 40 |
| 2.3. Методы статистической обработки результатов исследования ……. | 43 |
| РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ ………………….. | 45 |
| Глава 3. ВЛИЯНИЕ ПРИЁМА ПРЕПАРАТОВ КОК НА ПОКАЗАТЕЛИ ИММУНОРЕГУЛЯТОРНЫХ БЕЛКОВ, ИХ ИММУННЫХ КОМПЛЕКСОВ И ЦИТОКИНОВ В СЫВОРОТКЕ КРОВИ …………… | 45 |
| 3.1. Изменение сывороточных концентраций макроглобулинов (АБГ, МГ) у женщин, принимающих микро- и низкодозированные КОК …… | 45 |
| 3.2. Содержание специфических иммунных комплексов АБГ-IgG и МГ-IgG в крови женщин, принимающих микро- и низкодозированные КОК …... | 55 |
| 3.3. Уровни цитокинов (ИЛ-1, ИЛ-6, ФНО-, ИФН-) в сыворотке крови женщин, принимающих микро- и низкодозированные КОК ………... | 59 |
| 3.4. Концентрации острофазовых белков (лактоферрина, альфа-1-антитрипсина) в сыворотке крови женщин, принимающих микро- и низкодозированные КОК ………………………………………………….. | 64 |
| Примеры из практики ……………………………………………….......... | 68 |
| Глава 4. Корреляционные взаимосвязи сывороточных концентраций белков СЕМЕЙСТВА МАКРОГЛОБУЛИНОВ, ИХ иммунокомплексов, Острофазовых белков И ЦИТО-КИНОВ в сыворотке крови женщин, принимающих препараты КОК ………………………………………………………… | 70 |
| ОБСУЖДЕНИЕ …………………………………………………………….. | 79 |
| ВЫВОДЫ …………………………………………………………………… | 88 |
| Практические рекомендации …………………………………… | 90 |
| СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ ……………………….. | 91 |
СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ
| АБГ | – ассоциированный с беременностью альфа-2- гликопротеин |
| АБГ-IgG | – иммунокомплексы ассоциированного с беремен- ностью альфа-2-гликопротеина с IgG |
| альфа-1-АТ | – альфа-1-антитрипсин |
| ИЛ-1, ИЛ- 6, ФНО- | – интерлейкины |
| ИФН- | – интерферон гамма |
| КОК | – комбинированные оральные контрацептивы |
| ЛФ | – лактоферрин |
| МГ | – альфа-2-макроглобулин |
| МГ-IgG | – иммунокомплексы альфа-2-макроглобулина с IgG |
| ЛПВП | – липопротеиды высокой плотности |
| ЛПОНП | – липопротеиды очень низкой плотности |
| РМЖ | – рак молочной железы |
| РШМ | – рак шейки матки |
| ЭЭ | – этинилэстрадиол |
ВВЕДЕНИЕ
Актуальность исследования
Одним из приоритетных составляющих программы планирования семьи является оптимальный выбор методов контрацепции. В настоящее время наиболее эффективным методом признана гормональная контрацепция, и не менее 200 млн. женщин предупреждают нежеланные беременности комбинированными оральными контрацептивами (КОК) (Серов В.Н., Соколова Ю.Ю., 2010).
В последнее время активно изучается связь между приемом оральных контрацептивов и злокачественными новообразованиями, в частности, репродуктивной системы. Имеются данные о том, что использование оральных контрацептивов достоверно снижает риск возникновения злокачественных опухолей яичников и рака эндометрия (Pike M.C. et al., 2000). Л.Г. Баженовой и соавт. (2005) установлена зависимость длительности безрецидивного течения рака яичников от использования препаратов половых стероидов с контрацептивной и лечебной целью в анамнезе. Наряду с этим, А. Berrington et al. (2002) убедительно продемонстрировали прямую коррелятивную зависимость увеличения риска развития рака шейки матки с длительностью приема КОК. Согласно другим данным, у женщин с дебютом приема КОК в возрасте до 20 лет повышается риск развития рака молочной железы (на 20%) в сравнении с женщинами, начинающими их прием в более зрелом возрасте. При этом значительных различий в «степени онкологического риска» между группами женщин, принимающих КОК с разным составом препаратов и дозировкой входящих компонентов, не было выявлено (Bjelic-Radisic V. et al., 2010).
Общеизвестно, что развитие злокачественных процессов напрямую связано с врожденными дефектами, либо функциональными нарушенииями иммунной системы, поэтому значительная часть современных исследований патогенеза злокачественных новообразований, в том числе репродуктивных органов, посвящена изучению молекулярных механизмов регуляции этой системы. Среди них особую роль занимают цитокины и их полифункциональные белки-транспортеры, обладающие иммуномодуляторными свойствами. В их числе - альфа-2-макроглобулин (МГ), ассоциированный с беременностью альфа-2-гликопротеин (АБГ) и лактоферрин (Zorin N.A., et al., 2006). МГ транспортирует и модулирует синтез цитокинов, гормонов и липидов; участвует в процессинге и презентации антигенов; регулирует синтез антител, в том числе, при распознавании опухоли; контролирует деление и апоптоз клеток (Birkenmeier G., 2001). АБГ - эстрогензависимый белок «зоны беременности» или PZP, обладает выраженными иммуносупрессивными свойствами и является резервным аналогом МГ (Helgasson S., et al., 1982; Зорин Н.А., Зорина В.Н., 2012). Лактоферрин также модулирует синтез цитокинов, транспортирует железо и обладает выраженными противоопухолевыми и противовирусными сойствами (Legrand D., et al., 2005).
Современные подходы к синтезу препаратов комбинированной оральной контрацепции направлены на минимизацию содержания в них эстрогенного компонента и качественное улучшение гестагенного компонента при сохранении высокой контрацептивной надежности, а также использование неконтрацептивных эффектов с лечебной и профилактической целью при различных экстрагенитальных и гинекологических заболеваниях (Прилепская В.Н. и соавт, 2011). Однако до настоящего времени не проанализировано влияние современных микро- и низкодозированных КОК на вышеперичесленные показатели, играющие существенную роль в патогенезе онкопролиферативных процессов.
Цель исследования: разработать индивидуальный подход к назначению комбинированных оральных контрацептивов путем оценки влияния их приема на сывороточные уровни макроглобулинов (ассоциированного с беременностью альфа-2-гликопротеина, альфа-2-макроглобулина), их иммунных комплексов, некоторых острофазовых белков (альфа-1-антитрипсина, лактоферрина) и цитокинов (ИЛ-6, ФНО-, ИЛ-1, ИФН).
Задачи исследования:
- Изучить влияние длительности приема, а также состава низко- и микродозированных препаратов КОК на сывороточные уровни ассоциированного с беременностью альфа-2-гликопротеина (АБГ) и альфа-2-макроглобулина (МГ), их специфических иммунокомплексов (МГ- IgG, АБГ- IgG), у женщин, использующих гормональную контрацепцию.
- Исследовать сывороточные концентрации цитокинов (ИЛ-6, ФНО-, ИЛ-1, ИФН), а также альфа-1-антитрипсина и лактоферрина в зависимости от длительности приема и состава микро- и низкодозированных препаратов КОК.
- Установить характер изменений сывороточных уровней изученных макроглобулинов, их иммунокоплексов, цитокинов и острофазовых белков в динамике первого года приема микродозированных препаратов КОК.
- Исследовать коррелятивные взаимосвязи уровней изученных макроглобулинов, специфических иммунокомплексов, острофазовых белков и некоторых цитокинов в соответствии с длительностью приема КОК.
Научная новизна
Впервые установлена зависимость сывороточных концентраций АБГ от дозы эстрогенного и вида гестагенного компонента в составе микро- и низкодозированных препаратов КОК.
Выявлено, что прием КОК свыше 2-х лет, независимо от дозы эстрогенного и вида гестагенного компонента КОК, повышает концентрацию иммунокомплексов МГ- IgG, что может свидетельствовать о влиянии КОК на молекулу МГ, изменяя ее антигенную структуру и усиливая синтез специфических аутоантител (IgG) против данного белка.
Впервые обнаружен повышенный уровень альфа-1-АТ в крови женщин, использующих гормональную контрацепцию, независимо от вида препарата и длительности его приема.
Показано, что использование современных препаратов КОК существенно не влияет на сывороточные концентрации про- и противоспалительных цитокинов (ФНО-, ИЛ-1; ИЛ-6, ИФН).
При динамичном наблюдении в течение первого года приема КОК выявлено значимое снижение содержания цитокинов (ИЛ-6, ФНО-) и специфических иммунокомплексов (МГ-IgG и АБГ-IgG) у женщин, принимающих микродозированные КОК, содержащих в качестве гестагенного компонента дезогестрел, что может свидетельствовать о функциональной системной иммунодепрессии.
Практическая значимость работы
Полученные результаты позволили обосновать необходимость внедрения в практику определения сывороточного содержания ассоциированного с беременностью альфа-2-гликопротеина (АБГ) и альфа-2-макроглобулина (МГ) в динамике приема низко- и микродозированных препаратов КОК в качестве оценки риска возможного онкопролиферативного потенциала эстрогензависимых органов в долгосрочном прогнозе.
Оценка сывороточных концентраций ФНО- и ИЛ-6 может помочь акушерам-гинекологам персонифицировать рекомендации по подбору препаратов КОК.
Положения диссертации, выносимые на защиту:
- Сывороточная концентрация эстрогензависимого ассоциированного с беременностью альфа-2-гликопротеина (АБГ) значимо повышается в крови женщин, принимающих гормональные препараты с целью контрацепции, и зависит от дозы этинилэстрадиола и типа гестагенного компонента. Содержание альфа-2-макроглобулина (МГ), напротив, снижается при приеме низкодозированных КОК и остается неизменным при использовании микродозированных препаратов.
- Длительный прием КОК (свыше двух лет) сопровождается повышением сывороточных концентраций АБГ (от 5до 100 раз выше физиологической нормы), что может увеличивать потенциальный риск развития онкопролиферативных процессов эстрогензависимых органов за счет длительного периода иммуносупрессии.
- В динамике первого года приема микродозированного КОК, содержащего в качестве гестагенного компонента 150 мкг дезогестрела, статистически значимо снижаются сывороточные уровни специфических иммунокомплексов (МГ-IgG и АБГ-IgG) и концентрации провоспалительных цитокинов (ИЛ-6 и ФНО-), что свидетельствует об иммуносупрессивном эффекте данного препарата.
Глава 1.
ЛИТЕРАТУРНЫЙ ОБЗОР
1.1. Эволюция препаратов гормональной контрацепции
«Охрана репродуктивного здоровья населения и каждого человека в отдельности – особая сфера человеческой жизни, которая в современных условиях демографического неблагополучия в стране должна входить в число основных направлений деятельности Российской Федерации как социального государства. Репродуктивное здоровье в настоящее время является важнейшим фактором, который формирует благоприятную демографическую перспективу страны. Концепция демографической политики Российской Федерации на период до 2025 года, утвержденная Указом Президента №1351 от 09.10.2007, ставит одной из основных задач – укрепление репродуктивного здоровья населения» (Сухих Г.Т. и соавт., 2010). Анализ демографической ситуации в Российской Федерации показал продолжающееся сокращение численности населения, начавшееся в 1992 г., однако его темпы в последние годы существенно снизились (Сухих Г.Т. и соавт., 2010; Филлипов О.С. и соавт., 2010; Широкова В.И. и соавт., 2011). По данным на 1 января 2008 г. доля женского населения в общей численности населения Российской Федерации (142,0 млн.) составила 53,7% (76,29 млн.) в сравнении с 2007 г. (76,37 млн.). Число женщин фертильного возраста уменьшилось с 39,11 млн. в 2007 г. до 38,66 в 2008 г. Обращает на себя внимание рост числа случаев онкологических заболеваний репродуктивной системы у женщин, в том числе: рака яичников – на 7,5% от уровня 2007г., рака тела матки – на 3,7%, рака молочной железы – на 3,1%, рака шейки матки – на 0,6% (Филлипов О.С. и соавт., 2010).
Важной характеристикой репродуктивного здоровья женщин является частота абортов, нередко приводящих к развитию гинекологических заболеваний, бесплодию, эндокринным нарушениям и невынашиванию беременности. Официальные статистические данные Минздравсоцразвития РФ свидетельствуют о тенденции к снижению числа абортов: за последние 5 лет общее число абортов снизилось на 23,2% (с 1610,5 тыс. в 2004 г. до 1236,4 тыс. в 2008 г.); число абортов на 1000 женщин фертильного возраста уменьшилось с 40,5 в 2004 г. до 32,0 в 2008 г., а число абортов на 100 родившихся живыми и мертвыми – с 106,6 до 73,1 соответственно. Несмотря на снижение абсолютного числа абортов на 6,9% в возрастной группе моложе 17 лет включительно (с 35 402 в 2007 г. до 32 976 в 2008 г.), число абортов у девочек моложе 14 лет и девушек 15-17 лет сохраняется достаточно высоким (соответственно 0,07% и 2,6% от общего числа абортов во всех возрастных группах в 2008 г.) (Сухих Г.Т. и соавт., 2010; Филлипов О.С. и соавт., 2010).
Таким образом, несмотря на положительные тенденции, частота абортов в Российской Федерации всё ещё превышает показатели в экономически развитых странах, что во многом обусловлено малой долей женщин, применяющих эффективные методы контрацепции. В 2009 г. в РФ число женщин, применявших современные контрацептивы, составило 9,02 млн. (24,0% женщин фертильного возраста), в том числе гормональные средства – 4,2 млн. женщин, что значительно ниже аналогичного показателя в ряде европейских стран (Филиппов О.С. и соавт., 2010). К примеру, во Франции и Германии наиболее распространенным методом контрацепции является приём гормональных препаратов (57,8% и 59,1% соответственно) (Авдеев А.А., Троицкая И.А., 2011).
По мнению Филиппова О.С. и соавт. (2010) в настоящее время существует проблема учета применения гормональных средств контрацепции в Российской Федерации, так как большинство женщин обращаются для подбора метода контрацепции в медицинские организации иной формы собственности, что не находит отражения в существующей статистической отчётности. Кроме того, отпуск комбинированных оральных контрацептивов в аптечной сети без рецепта врача является нарушением приказа Минздравсоцразвития России от 13 сентября 2005 г. №578 «Об утверждении перечня лекарственных средств, отпускаемых без рецепта врача», в соответствии с которым гормональные контрацептивные препараты не включены в перечень безрецептурных препаратов.
В настоящее время врачами акушерами-гинекологами общепризнанны достоинства метода гормональной контрацепции для планирования семьи и положительного влияния на здоровье женщины. Продолжаются исследования механизмов действия гормональных контрацептивов, разработка новых форм препаратов путем синтеза новых компонентов КОК: высокоселективных прогестагенов, эстрогенов, идентичных по структуре натуральным, создания новых комбинаций и дозировок уже известных гестагенов и эстрогенов (Кузнецова И.В. и соавт. 2009; Тарасова М.А., 2009; Шатунова Е.П. и соавт. 2011; Прилепская В.Н., 2012). В настоящее время в России зарегистрированы новые препараты: Зоэли, в состав которого входит 17 -эстрадиол и высокоселективный прогестаген – номегэстрола ацетат и Клайра, эстрогенный компонент которого представлен эстрадиола валератом, а гестагенный – диеногестом (Прилепская В.Н., 2012).
Все существующие КОК классифицируются по составу: по типу прогестагенного компонента, по дозе входящего в каждую таблетку этинилэстрадиола. По количеству эстрогенного компонента КОК подразделяются на: высокодозированные – содержащие 50 мкг ЭЭ/сут. (Овидон); низкодозированные – содержащие не более 30-35 мкг ЭЭ/сут. (Диане-35, Белара, Регивидон, Микрогинон, Жанин, Фемоден, Ярина, Мидиана, Силест, Марвелон, Регулон, Линдинет 30, Триквилар, Трирегол, Три-мерси и т.д.); микродозированные – в состав которых входит 15-20 мкг ЭЭ/сут. (Логест, Миррель, Новинет, Мерсилон, Линдинет 20, Минизистон 20 фем, Джес и т.д.).
Синтезированные в настоящее время КОК, в зависимости от комбинации эстрогена и гестагена в каждой таблетке, подразделяются на два основных типа:
1. монофазные: с постоянной на протяжении приёма ежедневной дозой эстрогена и гестагена (Диане 35, Жанин, Фемоден, Ярина, Силест, Логест, Новинет, Мерсилон, Линдинет 20, Минизистон 20);
2. многофазные: трехфазные, имитирующие колебания естественных яичниковых гормонов в течение нормального менструального цикла (3 вида таблеток с разным соотношением эстроген/прогестаген Трирегол, Три-мерси) (Прилепская В.Н., 2006).
С учетом прогестагенного компонента КОК подразделяются по поколениям, с момента их первого синтеза. В 1912 году Инсбрук Людвиг Хабербландт впервые доказал в своем эксперименте, что экстракт из яичников беременных животных блокирует овуляцию и рекомендовал его как средство для искусственного бесплодия (Роговская С.И., 2011). В 1934 году Гутенахтом был синтезирован и доказан его блокирующий эффект на разрыв фолликула. Разработка первых гормональных контрацептивов началась в 1944 году, когда Бикенбах и Павлович индуцировали в эксперименте ановуляторные циклы у женщин путем парентерального введения прогестерона (Прилепская В.Н. и соавт., 2011). В 1945 году Фуллером Албрайтом было установлено, что эстрогены способны подавлять овуляцию, и тем самым возможно достижение контрацептивного эффекта. Опыты продолжались, и Джоном Роком было доказано, что для подавления овуляции нужен естественный прогестерон в дозе 300-400 мг. В дальнейшем исследования были направлены на синтез гестагенов, которые бы обладали способностью более медленно, по сравнению с естественными стероидами, подвергаться метаболическим превращениям и превосходить последних по биологическому действию, что дало бы возможность назначать их перорально в небольших дозах и с хорошим контрацептивным эффектом (Прилепская В.Н. и соавт., 2011). В 1954 году Джон Рок и Грегори Пинкус провели первые успешные клинические испытания средства под торговым названием Эновид. Они подтвердили антиовуляторное действие препарата. Основные клинические испытания данного контрацептива были выполнены в Пуэрто-Рико (Rock J. et al., 1956; Pincus G. et al., 1958).
История развития комбинированных контрацептивных средств может быть разделена на несколько этапов. На первом этапе были созданы препараты первого поколения с высоким содержанием гормонов (препараты Эновид и Инфекундин), которые характеризовались низким индексом Перля, а также нередко возникающими опасными для жизни осложнениями (Прилепская В.Н. и соавт., 2011). Уже с 1961 года начали появляться сообщения об отрицательных последствиях приема пероральных контрацептивов (Бурцев Е.М., 1984). Отмечалось, что у женщин, принимавших пероральные контрацептивы длительное время, чаще возникают тромбоэмболические осложнения, заболевания сердца, нарушения мозгового кровообращения и некоторые психопатологические расстройства. Исследования W.H. Inman и M.P. Vessey, проведенные в 1968 году под эгидой английского комитета по безопасности медикаментов, показали, что пероральные контрацептивы ускоряют возникновение тромбозов и эмболий, повышают частоту тромбоэмболических осложнений и смертность от них. При применении пероральных контрацептивов происходило повышение содержания в крови ряда прокоагулянтов – факторов V, VII, VIII, X, а также ферментов, участвующих в образовании протромбина; угнетение фибринолитической активности и усиление наклонности к агрегации тромбоцитов; снижение скорости кровотока вследствие уменьшения тонуса сосудистой стенки и поражения сосудов (отёк эндотелия) (Хаджиев Д. и соавт., 1981; Луцик Л.А., 1981). Р. Ламбрехт и соавт. (1986) проанализировали все случаи острых тромбозов с 1975 до 1981 года и сделали выводы, что у женщин до 30 лет возникали тромбоэмболические заболевания после приема гормональных противозачаточных средств без каких-либо тромбогенных причин. З.Х. Зарипова и соавт. (1977) отмечали нарушение толерантности к глюкозе у 78% женщин, получавших пероральные контрацептивы, а также развитие сахарного диабета в 13% случаев. При продолжительном приеме отмечалось значительное (до 95%) увеличение содержания в крови свободных жиров, кислот, триглицеридов и в меньшей степени – холестерина и липопротеинов (Бурцев Е.М., 1984). Многие исследователи полагали, что у женщин, принимавших КОК, возникали психопатологические расстройства разной выраженности – от немотивированных колебаний настроения, в виде раздражительности и капризности, преимущественно по утрам, до стойких депрессивных реакций и тяжелых психозов (в 6,6% случаев), обусловливающих госпитализацию в психиатрический стационар (Бурцев Е.М., 1984). Т.Д. Датуашвили и А.Г. Хомасуридзе (1979 г.) изучили в динамике функциональное состояние почек и верхних мочевых путей в процессе применения прогестинов с целью контрацепции и определили изменения, выражающиеся вначале в дискинезии, гипертонии и гиперкинезии чашечно-лоханочных систем мочеточников, а затем – в гипотонии, гипокинезии и дилатации верхних мочевых путей. Прогестагены первого поколения (норэтинодрел, этинодиола диацетат и норэтиндрона ацетат) синтезированы из С-19-нортестостерона растительного происхождения, обладающего хорошими контрацептивными свойствами. В организме человека прогестагены первого поколения трансформируются в норэтистерон. На данный момент высокодозированные КОК применяются в основном в лечебных целях. К 1970 году синтезировали новые С-19-нортестостероиды – прогестагены второго поколения (норгестрел и левоноргестрел).
Следующий этап развития гормональной контрацепции привел к снижению дозы гормонов (эстрогенного и гестагенного компонента) при сохранении высокой контрацептивной надежности. В 80-х годах ХХ века синтезированы прогестагены третьего поколения (дезогестрел, гестоден, норгестимат, диеногест, дроспиренон), близкие по действию к прогестерону, но с низкой андрогенной активностью и высокой афинностью к прогестероновым рецепторам. Повысилась не только безопасность этих препаратов, но и появилась возможность использования клинико-фармакологических эффектов в лечебных целях: при дисфункциональных маточных кровотечениях, предменструальном синдроме, дисменорее, эндометриозе, миоме тела матки, гиперандрогении и т.д. (Корхов В.В. и соавт. 2004; Пасман Н.М., 2004; Тарасова М.А., 2010; Прилепская В.Н. и соавт., 2011; Corson S.L., 1990).
На данный момент не существует единой общепринятой классификации гестагенов. Согласно классификации, приведенной в монографии В.Н. Прилепской (2011), прогестагены делятся на группы по химическому производному (рис. 1).
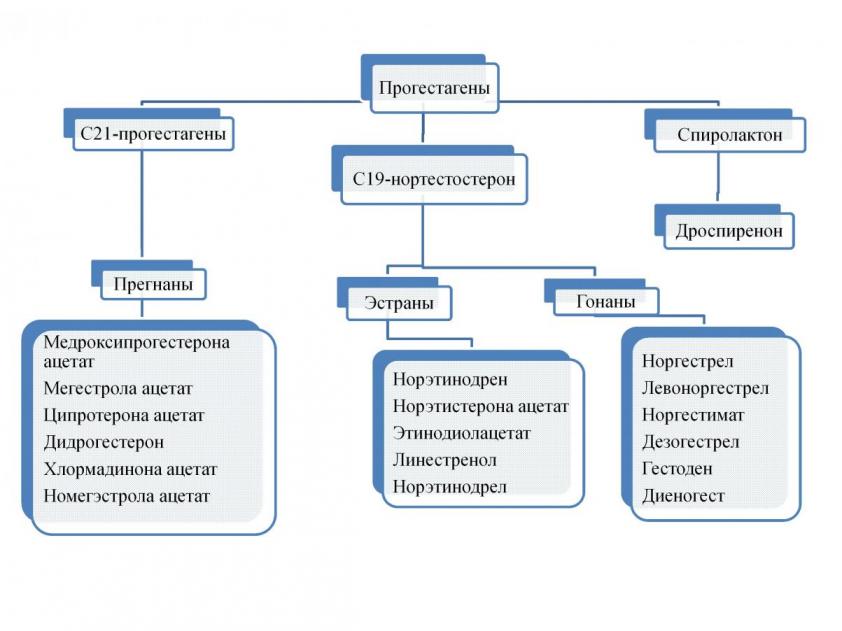
Рисунок 1 – Классификация синтетических прогестагенов (Прилепская В.Н. и соавт., 2011).
По химическому строению половые стероиды представляют собой полициклические структуры, производные циклопентанпергидрофенантрена. Наличие радикалов, связанных со стероидной структурой (гидроксильных, метильных, кето-групп и др.), приближает строение синтетических стероидных компонентов к структуре естественных половых гормонов: эстрадиолу, прогестерону, тестостерону, что обусловливает особенности их биологической активности. Синтетические гестагены всасываются в тонкой кишке. Биодоступность различных гестагенов составляет от 40 до 100%. Дезогестрел и норгестимат являются неактивными пролекарствами, для них требуется активация в печени. Активным метаболитом дезогестрела является 3-кето-дезогестрел (Межевитинова Е.А., 2000, 2001; Никитин С.В., 2003). Дезогестрел значительно активнее прогестерона и имеет большую антиэстрогенную активность, чем норэтистерон и не обладает эстрогенподобным действием (Кузнецова И.В., 2004). Левоноргестрел, гестоден, диеногест, ципротерона ацетат, дроспиренон не трансформируются при первичном прохождении через печень (Яглов В.В., 2001; Пестрикова Т.Ю. и соавт., 2001; Острейкова Л.И., Прилепская В.Н., 2002). Вышеперечисленные гестагены, обладающие 100% биодоступностью и не требующие активации в печени, создают более стабильные концентрации в крови, что обеспечивает высокие контрацептивные свойства и хороший контроль менструального цикла.
Биологические эффекты гестагенов определяются их взаимодействием со стероидными рецепторами. Существует 5 видов стероидных рецепторов: для глюкокортикоидов, минералокортикоидов, эстрагенов, гестагенов и андрогенов. Выраженность гестагенного эффекта прогестагенов обусловлена различным их сродством к рецепторам прогестерона. И именно с этим связано как контрацептивное действие прогестагенов, так и их возможное системное влияние на организм женщины. Все прогестагены индуцируют характерные изменение эндометрия, их активность широко варьирует и часто зависит от дозы, необходимой для трансформации эндометрия (Прилепская В.Н. и соавт., 2011).
В настоящее время по рекомендациям ВОЗ доза эстрогенного компонента в КОК, использующихся с целью плановой контрацепции, не должна превышать 35 мкг этинилэстрадиола (низкодозированные контрацептивы).
1.2. Влияние современных КОК на метаболические процессы, показатели иммунитета и свертывания крови
В течение всего периода использования КОК как с контрацептивной, так и лечебной целью изучается их влияние на отдельные звенья углеводного, жирового и белкового обмена. Метаболические изменения, возникающие при приеме КОК, определяются действием как эстрогенного, так и гестагенного компонента. Известно, что входящие в состав КОК синтетические эстрогены и гестагены связываются с теми же рецепторами в цитоплазме, что и естественные половые гормоны, образуя гормон-белковый комплекс. Данные метаболические изменения у женщин при приеме КОК аналогичны изменениям, происходящим во время беременности, но имеют свои индивидуальные особенности, обусловленные действием входящих в препарат компонентов (Серов В.Н., Соколова Ю.Ю., 2010).
Было выявлено, что у женщин, принимавших низкодозированные КОК, исходно имевших нарушения углеводного обмена или наследственную предрасположенность к метаболическому синдрому, иногда отмечалось снижение толерантности к глюкозе и влияние на уровень инсулина в крови (Manning James M. et al., 1997).
Эстрогенный компонент КОК может индуцировать тромбоэмболические осложнения, нарушения функции печени, в том числе обмена липидов. Возникновение этих осложнений зависит как от дозы этинилэстрадиола, так и от наличия факторов риска и заболеваний, увеличивающих вероятность эстрогензависимых неблагоприятных эффектов: курение, ожирение, генетические формы тромбофилии, сахарный диабет, артериальная гипертензия и др. (Abdollahi M.C., 2003; De Stefano V. et al., 2003). Наличие тромбогенных мутаций (мутация фактора V Лейдена, недостаточность протеина S и др.) увеличивает относительный риск тромбоэмболических осложнений: у женщин с мутацией фактора V Лейдена – в 8-30 раз, у гомозигот – в 100 и более раз (Тарасова М.А. и соавт., 1998; Папаян Л.Н. и соавт., 1999; Саидова Р.А., Макацария А.Д., 2005; Vandenbroucke J.P. et al., 1994; Tarasova M.A., Ailamazyan E.K., 2002).
Под влиянием КОК увеличивается содержание фибриногена и К-зави-симых факторов свертывания крови: протромбина, VII, IX, X, XII. Этот эффект зависит от дозы эстрогена в КОК: низкодозированные препараты (30 мкг ЭЭ и 150мкг левоноргестрела) повышают уровень VII и X факторов в меньшей степени, чем высокодозированные препараты КОК. Изолированное увеличение уровня факторов означает, что имеется потенциальная гиперкоагуляция, не имеющая признаков активации внутрисосудистого свертывания крови и тромбоза (Джангидзе М.А., 2001). Крупное постмаркетинговое исследование (EURAS study) показало, что риск венозного тромбоза обычно недооценивается. Он составляет 44 на 100 000 женщин/лет у тех, кто не пользуется КОК, 291 на 100 000 женщин/лет при беременности и 90 на 100 000 женщин/лет в случае применения КОК вне зависимости от гестагенного компонента, входящего в состав препарата (Dinger J.C. et al., 2007). Повышенный риск развития тромбоэмболических осложнений при использовании препаратов третьего поколения исследователи связывают с тем, что большинство врачей (86-90%), назначали препараты КОК пациенткам с факторами риска, недооценивая противопоказания к их применению (Прилепская В.Н. и соавт., 2011).
Влияние приема КОК на липидный обмен активно изучается на протяжении последних трех десятилетий. Многочисленные исследования показали, что увеличение общего содержания липидов и нарушение соотношения между отдельными их фракциями играют важную роль в патогенезе ишемической болезни сердца и развитии системного атеросклероза (Маколкин В.И., 2012; Bobryshev Y.V. et al., 2011; Vincze Z., Brugos B., 2012). Гестагенный компонент КОК оказывает важное влияние на липидный обмен. Это подтверждено выявленной корреляцией между влиянием комбинированных оральных контрацептивов на липидный спектр и андрогенной активностью прогестагенного компонента: чем меньше андрогенная активность прогестагена, тем менее выражено влияние данного КОК на метаболизм липидов. А также предполагается, что подавляющее влияние гестагенов на секрецию липопротеидов очень низкой плотности (ЛПОНП) обусловлено тем, что гестагены – производные 19-нортестостерона подавляют синтез триглицеридов в клетках печени и тонкого кишечника (Прилепская В.Н. и соавт., 2011). Механизм влияния половых стероидов на липопротеиды высокой плотности (ЛПВП) достаточно сложен. Считают, что стероиды влияют на продукцию и катаболизм ЛПВП путем изменения активности печеночной липопротеидлипазы. Под влиянием эстрогенов активность этого фермента подавляется, что в свою очередь сопровождается снижением скорости метаболических превращений ЛПВП и содержание их в плазме крови повышается. Гестагены и андрогены оказывают противоположное влияние на метаболизм ЛПВП: повышая активность липопротеидлипазы, гестагены ускоряют расщепление ЛПВП, тем самым снижая их содержание в крови (Прилепская В.Н. и соавт., 2011).
Другими исследованиями был показан и иной механизм влияния половых стероидов на изменение ЛПВП – посредством изменения синтеза апопротеинов в клетках печени. Было выявлено, что эстрогены увеличивают, а гестагены, наоборот, подавляют продукцию апопротеинов, формирующих комплекс ЛПВП (Вильям М. Кеттайл, Рональд А. Арки, 2001).
В 2009 году V. Soska et al. было проведено исследование с целью изучения изменений в крови липидов и липопротеинов при применении КОК, чтобы оценить атерогенный характер дислипидемии. В результате применение контрацептивных препаратов в течение 3-х месяцев привело к статистически значимо увеличению концентрации триглицеридов, общего холестерина, ЛПВП, ЛПНП, аполипопротеина А1и аполипопротеина В. В тоже время соотношение общего холестерина/ЛПВП и аполипопротеина В/аполипопротеина А1 существенно не изменилось. Таким образом, по мнению авторов, дислипидемии, вызванные приемом гормональных контрацептивов, не следует рассматривать как проатерогенные.
В тоже время по данным Е.А. Межевитиновой (2001) препараты третьего поколения повышают концентрацию триглицеридов и уровень липопротеинов высокой плотности.
Снижение риска сердечно-сосудистых заболеваний и смертности от сердечно-сосудистых заболеваний на фоне применения препаратов КОК связывают с типами гестагенов, обладающих слабой андрогенной активностью (дезогестрел, гестоден, норгестимат, диеногест) (Прилепская В.Н. и соавт., 2011). В.А. Бражник (2009) провела сравнительную оценку влияния ОК на основе хлормадинона и дезогестрела на показатели липидного и углеводного обмена. Результаты исследования показали, что изменения параметров липидного и липопротеинового обмена были незначительными и не приводили к повышению клинического или биохимического риска развития атеросклероза и ИБС. Влияние обоих ОК на углеводный обмен было минимальным, обратимым и расценивалось как незначимое с точки зрения развития нарушения толерантности к глюкозе.
Однако в работе Sanjary Pour M. et al. (2012) установлено статистически значимое повышение ЛПОНП и холестерина в крови женщин принимающих КОК.
Таким образом, использование гормональных препаратов с целью контрацепции сопровождается изменениями содержания всех классов липопротеидов, и это в свою очередь может явиться неблагоприятным преморбидным фоном, предрасполагающим к развитию сердечно-сосудистых осложнений.
Роль воспаления в патогенезе сердечно-сосудистых заболеваний хорошо известна. СРБ является самым сильным независимым предиктором инфаркта миокарда и инсульта у женщин (gren U.M. et al., 2011). Результаты проведенного в 2011 году исследования в Финляндии показали, что приём монофазного низкодозированного КОК в течение 6 месяцев, содержащего 30 мкг этинилэстрадиола (ЭЭ) и 150 мкг левоноргестрела, увеличивал концентрацию С-реактивного белка – СРБ (gren U.M. et al., 2011). Данные Е.Ю. Мазной (2004), полученные при исследовании приёма КОК, свидетельствуют о том, что происходит увеличение уровня фибриногена в крови, который рассматривается исследователями как реактант острой фазы воспаления.
По мнению M. van Rooijen et al. (2006) при применении КОК третьего поколения повышается концентрация СРБ в связи с прямым воздействием на гепатоциты без участия опосредованных факторов воспаления (цитокинов). C. Kluft et al. (2002) показали, что у женщин, принимавших низкодозированные КОК (30 мкг ЭЭ) с различным гестагенным компонентом (75 мкг гестодена и 150 мкг дезогестрела) и значительно повышенным уровнем СРБ, одновременно повышались и другие острофазовые белки – фибриноген, церулоплазмин, Фактор фон Виллебранда, синтезируемые в печени и играющие важную роль в свертывании крови. Авторы предполагают, что монофазные КОК третьего поколения оказывают прямое провоспалительное действие на гепатоциты и эндотелий сосудов, стимулируя синтез острофазовых белков и увеличивая риск тромбоэмболии (Kluft C. et al., 2002).
Литературные данные об изменении сывороточных концентраций острофазовых белков – альфа-1-антитрипсина (АТ) и лактоферрина у женщин, принимающих КОК, единичны. Альфа-1-антитрипсин – это относительно «медленный», позитивный реактант воспаления, основной ингибитор сериновых протеиназ плазмы, на долю которого приходится около 90% общей антипротеазной активности крови. АТ синтезируется гепатоцитами, лейкоцитами, моноцитами и макрофагами (Коржов В.И. и соавт., 1990; Дубровин С.М., 2000). Основная функция белка направлена на нейтрализацию эластазы нейтрофилов (Веремеенко К.Н. и соавт., 1988). В последнее время альфа-1-антитрипсин относят к белкам, обладающим не только противовоспалительными, но иммуномодулирующими свойствами (Wanner A. et al., 2012). Концентрация альфа-1-АТ в сыворотке здоровых людей колеблется в пределах 1,5-2,5 г/л (Веремеенко К.Н. и соавт., 1988; Зорин Н.А. и соавт., 1992). Показано, что у длительно болеющих ослабленных людей содержание белка в сыворотке крови снижается до уровня менее 1,0 г/л., что связано с истощением резервных возможностей организма (Коржов В.И. и соавт., 1990). Наиболее подробно изучено ферментативное окисление, катализируемое системой миелопероксидазы, инактивирующей альфа-1-антитрипсин при различных воспалительных процессах. C.H. Nielsen и соавт. (1993) изучили концентрации альфа-1-антитрипсина, АБГ, антитромбина III у женщин, принимавших низкодозированные оральные контрацептивы, содержащие этинилэстрадиол в сочетании с левоноргестрелом (трёхфазный КОК), и левоноргестрел и дезогестрел (монофазные КОК). На основании полученных результатов исследователи пришли к выводам, что увеличение концентрации альфа-1-антитрипсина сопровождалось уменьшением уровня антитромбина III; интенсификация фибринолиза сочеталась со сниженным уровнем АБГ, а левоноргестрел оказывал больший антиэстрогенный и андрогенный эффект, чем дезогестрел. Отсутствие влияния приема КОК на уровень альфа-1-антитрипсина в крови женщин продемонстрировано в работах P. Fassati et al. (1990).
Одним из высокочувствительных острофазовых белков является лактоферрин (ЛФ) – низкомолекулярный, железосвязывающий гликопротеин, обладающий иммуномодулирующими, антибактериальными, противовирусными, противовоспалительными свойствами (Vogel H.J. et al., 2002; Legrand D. et al., 2004). Данный белок синтезируется в основном нейтрофилами и повышается на самых ранних стадиях воспаления (Дюгеев А.Н., Шипулин А.Н., 1991). Кроме того, белок, экспрессируясь на поверхности зрелых нейтрофилов, может участвовать в связывании микроорганизмов (Deriy L.V. et al., 2000). Некоторые авторы отмечают наличие коррелятивных взаимосвязей между уровнями ЛФ, провоспалительными цитокинами и клиническим течением заболеваний, позволяющих определять активность воспалительного процесса (Тихонова О.В., 2001; Трунов А.Н. и соавт., 2002; Шрамко С.В., 2008). Это мономерный гликопротеин с молекулярной массой около 80 кДа, присутствующий практически во всех секретах и биологических жидкостях человеческого организма. Наибольшая концентрация ЛФ обнаруживается в молозиве и молоке (2000-4000 мкг/мл), а минимальная – в спинномозговой жидкости: 0,005 мкг/мл (Зорина Р.М., 2002). В сыворотке крови здоровых женщин уровень ЛФ составляет 0,5-1,0 мкг/мл (Зорина В.Н., 2001).
Литературные сведения о влиянии современных препаратов КОК на отдельные показатели иммунитета крайне малочисленны. Проведенное Е.А Межевитиновой (1994) сравнительное исследование двух методов контрацепции (ОК и ВМС) у подростков показало, что приём орального контрацептива, содержащего этинилэстрадиол 35 мкг и этинодиол диацетат 1мг, отразился на показателях периферической крови и цервикальной слизи: произошло снижение IgA, IgM, IgG. Напротив, Е.Ю. Мазной (2004) не выявлено достоверного увеличения уровня иммуноглобулинов, компонента комплемента С3, был отмечен достоверный рост количества лизоцима на фоне приема КОК. О.А. Окраинская (2008) при исследовании показателей местного иммунитета на фоне приёма микродозированных КОК, установила повышение уровня лактоферрина, С5 комплемента, IgM, IgG цервикального секрета, что, по мнению автора, говорит о некотором увеличении активности факторов местной иммунной защиты. Проведенное исследование в США показало, что эндогенная противомикробная активность может быть биомаркером мукозного иммунитета, снижение которого наблюдается при приеме КОК (Shust G.F. et al., 2010). В 2000 году в Германии G. Klinger et al. провели сравнительное изучение двух контрацептивных препаратов, содержащих, в одном случае, 2 мг диеногеста и 0,03 мг этинилэстрадиола, в другом, – 0,15 мг дезогестрела и 0,02 мг этинилэстрадиола. Было установлено, что прием препарата, содержащего 0,15 мг дезогестрела, сопровождался значительным увеличением числа лимфоцитов, моноцитов и гранулоцитов в сыворотке крови и уменьшением уровней иммуноглобулинов (IgA, IgG, IgM). При применении в течение 10 дней 2 мг диеногеста и 0,03мг этинилэстрадиола уменьшалось число CD4 лимфоцитов, а также сывороточного уровня вышеперечисленных иммуноглобулинов. После 21 дня использования препарата, содержащего 0,15 мг дезогестрела и 0,02мг этинилэстрадиола, увеличивалась концентрация CD19 и CD23 лимфоцитов. По мнению авторов, прием вышеперечисленных препаратов КОК не сопровождался устойчивой иммуносупрессией (Klinger G. et al., 2000).
Важную роль в определении направленности иммунного ответа играют цитокины – многочисленные и разнообразные по свойствам и функциям иммунорегуляторные молекулы. Сывороточные уровни большинства из данных пептидов в крови определяются в пределах от 0 до 100 пкг/мл как в норме, так и при патологии. Различные цитокины могут синтезироваться совершенно разными независимыми клетками и тканями. Изменение концентрации какого-либо из цитокинов может повлечь за собой целый каскад реакций, сопровождающихся значительными изменениями уровней других цитокинов. Баланс этих белков оказывает решающее влияние как на функционирование всего живого организма, так и отдельных его систем (Ярилин А.А. и соавт., 2010). Проведённое в США исследование показало, что у женщин, принимавших КОК, были выявлены изменения концентрации ИЛ-6 в плазме крови, которые коррелировали с дозой прогестагена (Salkeld B.D. et al., 2001).
ИЛ-6 представляет группу цитокинов, синтезируемых Th-2 типом клеток. Этот полифункциональный цитокин синтезируется иммунными клетками, фибробластами, эндотелиальными клетками, адипоцитами и миоцитами. Установлено, что сывороточный уровень ИЛ-6 значительно повышается у больных РМЖ в сравнении с контрольной группой здоровых женщин и незначительно – при доброкачественных образованиях молочной железы (Naria D. et al., 2011). ИЛ-1 – классический, провоспалительный цитокин, синтезируемый Th-1-типа моноцитами, макрофагами и эпителиальными клетками. ФНО- – еще один цитокин, продуцируемый Th-1-типа мононуклеарными фагоцитами, натуральными киллерами и антиген-стимулированными Т-клет-ками. Человеческий яичник содержит иммунореактивный IFN- и, предполагается, что этот цитокин играет паракринную роль в функционировании яичника (Grasso G. et al., 1994).
Ассоциированный с беременностью альфа-2-гликопротеин (АБГ) и альфа-2-макроглобулин (МГ) являются представителями семейства макроглобулинов и обладают достаточно широким спектром иммуннорегуляторных функций. Большинство авторов считают, что АБГ способен угнетать спонтанную или митогениндуцированную пролиферацию лейкоцитов (Stimson W.H., 1976; Horne C.H.W., 1982; Petersen S.M., 1993, Мальцева Н.В., 1998). В то же время установлено, что АБГ способен стимулировать синтез иммуноглобулинов в клеточных культурах in vitro мононуклеарных клеток мужчин, небеременных и беременных женщин (Зорин Н.А. и соавт., 1993). Также известно, что данный белок относится к числу неспецифических маркеров клеточной пролиферации и рака эстрогензависимых органов (Зорин Н.А. и соавт., 1993; Баженова Л.Г. и соавт., 2005; Промзелева Н.В., 2012). Однако, S.M. Petersen с соавторами (1990) не обнаружили повышения уровня данного белка при онкозаболеваниях.
Источники биосинтеза АБГ в организме человека до сегодняшнего дня до конца не выяснены. Известно, что белок может синтезироваться лейкоцитами (Stimson W.H., Blackstook J.C., 1975) и плазматическими клетками, несущими на своей поверхности IgA и мононуклеарными клетками (Horne C.H.W., et al., 1983; Gorin V.S. et al, 1990). В работе S.M. Petersen (1993) продемонстрирована приоритетность продукции АБГ в мононуклеарах над синтезом его в гепатоцитах. У мужчин и небеременных женщин содержание АБГ в плазме (сыворотке) крови редко превышает 0,01-0,02 г/л (Татаринов Ю.С. и соавт., 1970; Berg O., Hemmingsen L., 1979; Folkersen J. et al., 1981; Horne C.H.W. et al., 1982; Gerrie L.H. et al., 1986; Vestergard-Povlsen J.,1987). У женщин концентрация АБГ в крови в 2-5 раз выше по сравнению с мужчинами и возрастает пропорционально возрасту (Зорин Н.А. и соавт., 1986). Содержание данного белка значительно (в сотни раз) увеличивается при беременности (Зорин Н.А. и соавт., 1990). Половые различия объясняются стимулирующим действием эстрогенов. Именно поэтому уровень белка в сыворотке крови женщин, применяющих половые стероиды с контрацептивной или заместительной целью, возрастает (Schoultz B. et al., 1974; Зорина В.Н. и соавт. 2007). Исследованиями Bernard H. Berne (1974) было установлено, что индивидуальные уровни АБГ не коррелировали напрямую с уровнями эстрона, эстрадиола или эстриола у беременных, небеременных женщин и принимающих оральные контрацептивы. Эстрогены способствовали повышению сывороточного уровня данного белка, но напрямую не определяли его концентрацию. Эти данные подтверждены в более поздних работах, в которых оценивалось влияние прогестерона, эстрадиола и тестостерона на биосинтез АБГ мононуклеарными клетками мужчин, небеременных и беременных женщин (Зорин Н.А. и соавт., 1991). В то же время было установлено, что концентрация ассоциированного с беременностью альфа-2-гликопротеина (АБГ) значительно повышается в крови женщин, принимающих высокодозированные эстрогенсодержащие противозачаточные препараты, достигая значений характерных для третьего триместра беременности (Луцик Л.А., 1981). Проведенное исследование Н.А. Митрофановым и Н.А. Краюшкиной (1983) показало, что концентрация АБГ в сыворотке крови женщин, имеющих производственный контакт с синтетическими эстрогенами, резко возрастала и оставалась существенно повышенной в течение нескольких месяцев после прекращения производственного контакта. Ранее было показано, что, в отличие от эстрогенов, прогестины, андрогены и преднизолон угнетают биосинтез данного белка (Laurell C.B., Rannevik G.,1979; Nielsen C.H. et al., 1993). Концентрации АБГ в крови возрастают не только при беременности, но и при некоторых онкопролиферативных заболеваниях, в частности при раке легкого, молочной железы, эндометрия, яичников, гортани, желудка, прямой кишки и лейкемии (Мингалев Н.В., 1998; Zorina V.N. et al, 2001; Промзелева Н.В., 2012). Проведенное исследование Л.Г. Баженовой (2005) показало, что сывороточный уровень АБГ при злокачественных новообразованиях яичников в 1,5 раза превышал норму и отражал наличие, степень распространения и динамику течения злокачественного опухолевого процесса в яичниках. В строме, окружающей пограничную по степени злокачественности опухоль яичника, в 1,8 раза возрастала экспрессия рецепторов к АБГ. Н.В. Промзелевой и соавт. (2012) установлено, что АБГ повышался в крови больных раком молочной железы пропорционально степени злокачественности, а максимальные концентрации белка ассоциировались с неблагоприятным прогнозом. Повышение уровня белка у онкологических больных связывают с его синтезом самой опухолью (Lundgren E. et al., 1979, Sarcione E.J. et al., 1983). В экспериментальных работах E. Lundgren et al. (1979) показано, что линии злокачественных клеток продуцируют АБГ в больших количествах, нежели клетки иных тканей. E.J. Sarcione et al. (1983) обнаружили, что белок может синтезироваться в тканях опухоли молочной железы и в определенных линиях клеток рака молочной железы in vitro. Все это дает основание ряду авторов предлагать использование уровня АБГ в качестве неспецифического диагностического и прогностического маркера рака гортани, молочных желез и рака яичников (Мингалев Н.В., 1998; Промзелева Н.В., 1998; Махов В.А., 2004; Баженова Л.Г., 2005).
Альфа-2-макроглобулин (МГ) играет значительную роль в гуморальном и клеточном иммунном ответе: транспортирует цитокины, гормоны и липиды к клеткам, участвует в процессинге и презентации антигенов, влияет на антителогенез и апоптоз клеток (Зорин Н.А., Зорина В.Н., 2012; Birkenmeier G., 2001). Иммуномодулирующие свойства белка описаны в работах отечественных авторов (Мальцева Н.В. и соавт., 1991; Зорин Н.А. и соавт., 1993). Установлено, что МГ в культурах мононуклеарных клеток способен стимулировать биосинтез иммуноглобулинов (IgG и IgA) и в то же время блокировать спонтанную и митогениндуцированную бласттрансформацию лимфоцитов. Кроме того, белок способен напрямую связываться с некоторыми бактериями (Зорин Н.А., Жабин С.Г., 1990). Синтез МГ происходит в основном в печени, а также в мононуклеарах и фибробластах. (Веремеенко К.Н. и др. 1988; Justus C.W., et al., 1990; Бумблите И., 1992; Krummen L.A. et al., 1993; Зорин Н.А. и соавт., 2005). Альфа-2-макроглобулин связывает практически все известные гидролазы без блокирования их активного центра, что отличает его от серпинов, которые полностью инактивируют ферменты, необратимо блокируя их активные центры (Hibbets K., et al., 1999). Ковалентное связывание фермента происходит внутри так называемой «ловушки» МГ. После связывания с ферментом молекула МГ модифицируется, на ней открываются новые сайты, после чего МГ может присоединять к себе новые молекулы различных соединений, к числу которых относятся гормоны пептидной природы, природные и рекомбинантные цитокины, включая факторы роста, интерлейкины, интерфероны и факторы некроза опухолей, а также иммуноглобулины, биогенные амины и металлы (Зорин Н.А., Зорина В.Н., 2012; Petersen S.M., 1993; Birkenmeier G., 2001). В экспериментах на животных показано, что только у женских особей крыс стероидный гормон эстрадиол регулирует синтез 2-макроглобулина в ответ на тканевые повреждения (Bell S.C., 1980).
Период полувыведения комплексов МГ-протеиназа из циркуляторного русла не превышает 1,5 минуты, что существенно меньше, нежели у комплексов серпин-протеиназа, измеряемый в часах (Armstrong P.B., Quigley J.P., 1999; Hibbets K., 1999). Предполагается, что такая быстрая элиминация комплексов МГ с протеиназами связана с наличием рецепторов модифицированного МГ на многих клетках. Основным рецептором является макроглобулин/липо-протеиновый рецептор (LRP) или CD91, выполняющий функцию эндоцитоза в клетке, в том числе злокачественно трансформированной (Li Y., et al., 1997; Yamamoto N. et al., 1998; Foca C. et al., 2000; Birkenmeier G., 2001).
Образование комплексов МГ-гидролазы предполагает их утилизацию через LRP. Количественный состав рецепторов в новообразованиях неоднороден. В культурах малой плотности, зонах инвазии и метастазирования их количество значительно выше, нежели в интактных клетках и в плотных опухолевых конгломератах (Arkona C., Wiederanders B., 1996; Li Y. et al., 1997; Asplin I.R. et al., 2000). Большое количество рецепторов позволяет злокачественно трансформированным клеткам получать большее количество энергоресурсов в виде липопротеинов, хиломикронов и регуляторных субстанций, транспортируемых МГ. В силу того, что МГ не имеет избирательности для транспортируемых соединений, биологически активные продукты, доставляемые к опухоли МГ, позволяют не только стимулировать ее рост, но и блокировать. МГ способен доставлять к опухоли и факторы, способствующие гибели ее клеток, в частности фактор некроза опухолей и ингибины. Исследования, посвященные сравнительному изучению комплексов МГ с цитокинами, обладающими стимулирующими и ингибирующими характеристиками по отношению к клеткам опухоли, пока не проводились. Можно только предполагать, что темпы инвазии во многом связаны с балансом между комплексами МГ и цитокинами, обладающими свойствами факторов роста и онкотоксинов по отношению к раковым клеткам.
Сведения о влиянии КОК на содержание МГ в крови крайне малочисленны и противоречивы. Изучение прямого воздействия половых гормонов (прогестерон, эстрадиол и тестостерон) на биосинтез белка в культурах мононуклеарных клеток мужчин, небеременных и беременных женщин не выявило какой-либо зависимости (Зорин Н.А и соавт., 1991). Позднее G. Klinger et al. (2000) установили увеличение концентрации белка в крови женщин, принимающих препарат, содержащий 2 мг диеногеста и 0,03 мг этинилэстрадиола. Однако, по данным Е.М. Предеиной и соавт. (2005), прием препаратов заместительной гормональной терапии (содержание этинилэстрадиола около 1-2 мг) не оказывал влияние на уровень МГ в крови женщин.
По-прежнему мало изученными остаются реакции связывания макроглобулинов с иммуноглобулинами. В 1985 году впервые был обнаружен феномен связывания циркулирующего в крови АБГ с иммуноглобулинами основных классов: G, A, M (Зорина Р.М. и соавт., 1985). В последующем было показано, что иммуноглобулин G способен связываться при пропускании сыворотки через колонки с иммобилизованным МГ (Лыкова О.Ф., 1994). Недавними исследованиями было установлено, что в норме и при раке молочной железы плазма крови содержит иммунные комплексы, состоящие из макроглобулинов и иммуноглобулинов, среди которых преобладает IgG (Zorina V.N. et al., 2001). Авторы установили, что при адекватном лечении рака концентрация комплексов МГ-IgG существенно превосходит норму, тогда как при продолженном росте она снижена. Аналогичная динамика концентраций характерна для комплексов АБГ-IgG, но при благоприятных исходах она не отличается от нормы (Zorina V.N. et al., 2001). Выявленная зависимость уровня ассоциированного с беременностью альфа-2-гликопротеина с наличием злокачественных эпителиальных опухолей, степенью распространенности опухолевого процесса, исходом заболевания и возникновением рецидива опухоли позволило предположить их участие в механизмах канцерогенеза (Баженова Л.Г. 2005). Следует отметить, что в образовании комплексов принимают участие преимущественно модифицированные формы МГ и АБГ, способные доставлять регуляторные субстанции к злокачественно трансформированным клеткам. Резкое увеличение в крови иммунокоплексов МГ-IG при ревматоидном артрите позволило авторам утверждать об их участии в механизмах патогенеза аутоиммунных заболеваний (Зорин. Н.А., 2005).
1.3. Онкологические аспекты современной гормональной контрацепции
Одним из актуальных вопросов является связь приема оральных контрацептивов и злокачественных новообразований репродуктивной системы. Несмотря на многочисленные исследования, мнения исследователей относительно влияния контрацептивных препаратов на частоту онкологического риска диаметрально расходятся. Имеются многочисленные данные о том, что использование комбинированных оральных контрацептивов достоверно снижает риск возникновения рака яичников и рака эндометрия (Pike M.C., Spicer D.V., 2000; Veljkovic M., Veljkovic S., 2010). В работе А.С. Вишневского и соавт. (1996) показано, что прием эстроген-гестагенных противозачаточных препаратов за 2,5-3 года до установления диагноза рака эндометрия повлиял на морфологические характеристики опухоли. Авторы предположили, что выявленный эффект связан с накоплением специфической информации в структуре ДНК стволовых клеток, что проявляется наличием благоприятных для больной признаков заболевания (высокая степень морфологической дифференцировки, минимальная инвазия). В систематическом обзоре А.О. Mueck et al. (2010) представлены данные 15 исследований случай-контроль и четырех крупных исследований когорты, продемонстрировавшие снижение риска развития рака эндометрия (до 50%) при длительном применении КОК, причем этот положительный эффект не зависел от вида препарата и сохранялся на протяжении 10-15-20 лет после отмены оральных контрацептивов. В основе онкопротективного действия КОК в отношении рака яичников может лежать несколько механизмов. Согласно первой, овуляционной гипотезе, развитие рака яичников происходит в результате повторных микротравм поверхностного эпителия при овуляции (Veljkovic M., Veljkovic S., 2010). Ее подавление под действием гормональных препаратов, беременности или кормления грудью объясняет снижение частоты рака яичников у женщин принимавших КОК, кормивших грудью и имевших 2 и более беременностей, закончившихся родами. Гонадотропиновая теория предполагает, что злокачественная трансформация происходит под действием повышенного уровня гонадотропинов. В систематическом обзоре Е.А. Ульрих и соавт. (2009) представлены данные четырех когортных, 21-го случай-контроль и мета-анализ 45-ти эпидемиологических исследований, продемонстрировавших снижение риска развития рака яичников в два раза у женщин, использовавших КОК, и этот эффект сохранялся через 30 лет после прекращения применения данных препаратов. Проведенный мета-анализ трех исследований случай-контроль показал значительное снижение риска развития рака яичников у носительниц мутаций BRCA1/2, принимавших КОК (0,57, ДИ 0,47-0,70, р<0,001) (Cibula D. et al., 2011). По мнению D. Cibula et al. (2011), применение КОК возможно в качестве альтернативной стратегии в химиопрофилактике риска развития рака яичников у носительниц BRCA1 в возрасте старше 30 лет и отказавшихся от профилактического удаления придатков матки. Однако при анализе когортных исследований был выявлен значительно повышенный риск развития рака молочной железы у носительниц мутаций BRCA1, принимавших КОК (ОР 1,48, 95% ДИ 1,14-1,92) (Cibula D. et al., 2011).
На протяжении многих лет изучается влияние приема оральных контрацептивов на развитие рака шейки матки. Некоторые авторы рекомендовали приём ОК в качестве метода лечения эктопии шейки матки у молодых женщин, так как полагали, что происходит исчезновение диспластических изменений (Прилепская В.Н., Сотникова Е.И., 1994; Назарова Н.М., Кондриков Н.И., 2000; Vessey M.P., 1995). Однако, в своем исследовании P.L. Bright et al. (2011) показали связь увеличения площади эктопии шейки матки и приема КОК в течение года. Другие исследователи считают, что применение ОК сопровождается повышением риска возникновения РШМ. С учетом ведущей роли вируса папилломы человека (ВПЧ) в генезе рака шейки матки представляют интерес и данные о влиянии ОК на риск инфицирования вирусом и вирусную прогрессию, приводящую к раку. (Efird J.T. et al., 2011). В систематическом обзоре В.Г. Волков (2001) связывает высокий риск инфицирования ВПЧ при приеме контрацептивных препаратов с тем, что использование ОК увеличивает размеры эктопии у молодых женщин, способствуя этим инфицированию эндоцервикальных клеток. Так же, по мнению В.Г. Волкова (2001), имеются трудности в оценке влияния ОК на развитие РШМ, которые связаны с тем, что женщины, принимающие ОК, находятся под медицинским наблюдением и постоянно проходят цитологическое обследование, поэтому обнаружение рака у них может быть более частым по сравнению с общей популяцией. Более ранние работы, посвященные риску развития РШМ при использовании КОК и основанные на пяти когортных и шестнадцати случай-контроль исследованиях (IARC Monographs on the Evalution of Carcinogenic Risks to Humans, 1999), продемонстрировали незначительное увеличение риска развития РШМ преимущественно за счет длительного использования препаратов. Однако в большинстве этих исследований не был проведен анализ между сексуальным поведением, программами скрининга, ВПЧ-инфекциями, играющими значительную роль в развитии РШМ (Ульрих Е.А. и соавт., 2009). Результаты многоцентрового случай-контроль исследования (IARC, 2002) показали, что длительность применения КОК возможно была кофактором, увеличивающим риск возникновения РШМ до 4-х раз у женщин с позитивным ДНК HPV. Коэффициент несогласия в этом исследовании составлял 2,82 (95% ДИ 1,46-5,42) для тех женщин, которые применяли КОК от 5-9 лет, и 4,03 (2,09-8,02) при приеме 10 лет и более длительно. Данный риск развития РШМ не зависел от времени первого и последнего приема. Напротив, исследование Shields et al. (2004) продемонстрировало снижение риска для HPV-рандомизированной группы с течением времени, поскольку в контрольной группе увеличивалась доля женщин-носительниц антител к HPV.
Начиная с 80-х годов, показано, что гормоны играют важную роль в развитии РШМ. Это связано с тем, что эпителий шейки матки относится к гормонзависимым и оральные контрацептивы могут привести к увеличению биологической уязвимости шейки матки (Veljkovic M., Veljkovic S., 2010). Однако результаты иммуногистохимического исследования рецепторов экзоцервикса к эстрогенам и прогестеронам свидетельствуют об отсутствии эстрогеновых рецепторов при тяжелой дисплазии (в 80% случаев) и микроинвазивной карциноме (во всех случаях) (Fonseca-Montinho J. et al., 2002). В.Г. Волков (2001) в систематическом обзоре представил механизмы, посредством которых гормоны, входящие в состав КОК, могут вызывать изменения в шейке матки, способствующие канцерогенезу. Во-первых, применение КОК повышает риск инфицирования ВПЧ. Женщины, принимающие КОК, больше подвержены риску заражения ВПЧ в силу особенностей полового поведения. Во-вторых, гормональные контрацептивы могут способствовать онкогенной трансформации инфицированных клеток. Результаты исследования R. Samir et al. (2012) показали избыточную экспрессию циклооксигеназы-2 при приеме КОК, которая сопровождалась выраженным повышением ИЛ-10. Также была выявлена низкая экспрессия цитокератина 10 и ИЛ-10 при применении оральных контрацептивов, содержащих только прогестагенный компонент. Установлено, что увеличение заболеваемости раком молочной железы (РМЖ) произошло одновременно с повышением количества женщин, использующих контрацептивные препараты (Veljkovic M., Veljkovic S., 2010). Поэтому женщины, начавшие прием КОК, были под более пристальным вниманием со стороны специалистов и, как следствие, это приводило к более частому выявлению РМЖ на более ранних стадиях. Были проведены многочисленные исследования по выявлению факторов риска развития рака молочной железы у женщин, принимавших комбинированные оральные контрацептивы. Использование высокодозированных оральных контрацептивов до 1975 года у женщин с семейным анамнезом РМЖ значимо повышало риск развития рака молочной железы (ОР 3,3, 95% ДИ 1,5-7,2) (Grabrick D.M. et al., 2000). G. Ursin et al. (1997) установлены следующие факторы риска развития РМЖ: наличие у женщин генетических маркеров мутаций BRCA1/2, применение оральных контрацептивов более 4-х лет до первой доношенной беременности. В систематическом обзоре и мета-анализе H.D. Nelson et al. (2012) шестидесяти шести исследований были получены данные о том, что у женщин повышался риск развития рака молочной железы в 1,0-1,5 раза при приеме КОК, при отсутствии родов в анамнезе, возрасте 30-ти лет и старше, при рождении первого ребенка. Результаты исследований Merethe Kamle (2002) показали, что наиболее высокий риск развития РМЖ наблюдался у женщин старше 45 лет, продолжавших употребление ОК (144%, по сравнению с контролем). В этом исследовании выявлено, что у женщин, использовавших ОК в возрасте до 20 лет или до беременности, завершившейся родами, риск повышения частоты РМЖ отсутствует. Однако исследования, выполненные V. Bjelic-Radisic, E. Petru (2010), показали, что у женщин, начавших принимать КОК в возрасте до 20 лет, риск развития рака молочной железы на 20% выше, в сравнении с женщинами, принимавшими КОК в более зрелом возрасте. При этом значительных различий в «степени риска» между группами женщин, принимавших КОК с разным составом препаратов и дозировкой компонентов, не выявлено (Bjelic-Radisic V., Petru E., 2010). В систематическом обзоре Е.А. Ульрих и соавт. (2009) представлены результаты проведенного норвежского когортного исследования, которое собрало данные о 96 000 женщин, среди которых развился 851 случай инвазивного РМЖ. Данные авторы ввели специальный расчетный коэффициент относительного онкологического риска для женщин, использовавших КОК. Оказалось, что относительный риск для пользователей КОК составил 1,25 и увеличивался через 10 лет приема препаратов до 1,40. Длительность приема преимущественно усугубляла риск развития РМЖ, нежели период прекращения приема КОК. При сравнении типов КОК был выявлен увеличивающийся риск для РМЖ среди препаратов 1-го и 2-го поколения (через три года приема – 1,21 и 1,45 соответственно). Тогда как риск для препаратов 3-го поколения через три года приема был ниже и составил 1,11. Особый интерес представляет новый эстрогенный компонент КОК эстрадиол. Проведенное сравнительное исследование в Швейцарии G.S. Merki-Feld et al (2012) показало, что в комбинации с различными гестагенами как эстрадиол, так и этинилэстрадиол, не увеличивает риск возникновения рака молочной железы вне зависимости от режима приема данных препаратов женщинами. Наряду с этим, результаты мета-анализа 13 проспективных когортных исследований за период с 1960 по 2012 год в Китае показали, что относительный риск развития рака молочной железы увеличивался у женщин, принимавших КОК, на 1,08 (95% ДИ 0,99-1,17), а при более длительном использовании этот риск значительно возрастал – на 14% (95% ДИ 1,05-1,23) (Zhu H. et al., 2012).
Таким образом, литературные данные противоречивы, многие исследования свидетельствуют об увеличении риска возникновения рака молочной железы, рака шейки матки при приеме КОК. По рекомендациям ВОЗ полученные данные не являются ограничением использования гормональной контрацепции. Очевидно, что необходимо дальнейшее изучение данной проблемы.
Глава 2.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Характеристика групп обследованных женщин
Для решения поставленных задач обследованы 193 женщины, сопоставимые по возрасту, менструальной функции, контрацептивному, репродуктивному и соматическому анамнезу (дизайн исследования представлен на рис. 2). В работе основная группа обследованных была представлена двумя подгруппами. В первую подгруппу вошли 91 женщина, средний возраст которых составил 23,06±0,017лет, принимавшие микродозированные КОК. Вторая подгруппа была представлена 59 женщинами в возрасте 25±0,9 лет, принимавших низкодозированные КОК.

Рисунок 2 – Дизайн исследования.
Дополнительно, для уточнения влияния гестагенного компонента КОК на изучаемые показатели, из общего числа обследованных выделены 71 женщина, принимавшие микродозированные препараты, гестагенный компонент которых был представлен 150 мкг дезогестрела (29 женщин), 100 мкг левоноргестрела (24 пациентки) и 75 мкг гестодена (18 женщин).
Отбор пациенток, участвующих в данном исследовании, проводился во время консультативного приёма «Планирование семьи» и осуществлялся по критериям включения и исключения.
Критериями включения женщин в исследование были:
- соматическое здоровье,
- отсутствие какой-либо патологии при гинекологическом осмотре и обследовании молочных желез,
- отсутствие указаний на прием КОК в течение 1 года до момента исследования,
- наличие нормативных показателей биохимического исследования крови и цитологического исследования мазков с шейки матки,
- информированное согласие на участие.
Критерии исключения женщин из исследования:
- перенесенные аутоиммунные заболевания,
- доброкачественные и злокачественные опухоли в анамнезе,
- уровень АБГ в крови пациенток до приема КОК свыше нормативного значения (0,02±0,003г/л).
Менструальная функция: Своевременное наступление менархе (от 11 до 14 лет) отмечено у 144 женщин (96%), в 4% случаев наступление менархе было в 15 лет. Нарушений ритма менструаций среди всех обследованных не было установлено. На момент обследования 141 (94%) женщина находились в раннем репродуктивном возрасте (от 18 до 29 лет) и 9 (6%) – в позднем (от 29 до 36 лет).
Репродуктивный анамнез: Все обследованные были сопоставимы по паритету. Из числа принимавших микродозированные КОК 76 женщин (83,52%) в анамнезе имели беременности, среднее число которых на одну женщину составило 2,18±0,13. При этом среднее число родов на одну женщину составило 0,55±0,07, а абортов – 1,58±0,08. В группе женщин, принимавших низкодозированные КОК, беременности в анамнезе имели 50 женщин (84,75%). При этом среднее число беременностей на одну женщину составило 2,34±0,17, родов – 0,68±0,05 и абортов – 1,65±0,09. Достоверных различий между исследуемыми группами в особенностях репродуктивного анамнеза не выявлено.
В настоящем исследовании оценивалось влияние приема препаратов КОК, содержащих 20-35 мкг этинилэстрадиола. В качестве гестагенного компонента входили: 150 мкг дезогестрела, 100 мкг левоноргестрела, 75 мкг гестодена, 300 мкг дроспиренона, 200 мкг диеногеста, 200 мкг ципротерона ацетата.
2.2. Методы забора биологического материала, иммунологические и биохимические исследования сыворотки крови
Для проведения иммунохимического исследования забор крови проводился в пластмассовые пробирки, не содержащие антикоагулянт. Сыворотку крови отделяли центрифугированием в течение 15 минут при 1500 оборотах в минуту. Полученные образцы в пробирках «Эпендорф» хранили при температуре -20С в замороженном состоянии. Исследование сывороточных уровней белков семейства макроглобулинов (МГ, АБГ), ЛФ, АТ, иммунокомплексов (МГ-IgG и АБГ-IgG), цитокинов (ФНО-а, ИФН-, ИЛ-6, ИЛ-1) проводилось как в динамике (до приёма микродозированных КОК, через 3 мес. приёма КОК, 6 мес., 9-12 мес.), так и при однократном исследовании спустя 1 год, 2 года и более 2-х лет приема КОК.
Сывороточные уровни АБГ и МГ оценивали методом низковольтного ракетного иммуноэлектрофореза с использованием моноспецифических поликлональных кроличьих антисывороток против данных белков (Зорин Н.А., 1992; Зорина В.Н. и соавт., 2003) (рис. 3). Данный метод выполняли с помощью блоков питания и камеры для горизонтального электрофореза (Ирбис, Белоруссия). В качестве поддерживающей среды использовали легкоплавкую агарозу с mr ~0,1-0,15, температурой гелеобразования 30-40°С и достаточной механической прочностью при формировании геля из 1% золя (Sigma, США; Serva, Германия). Гели формировали на стеклянных подложках. В качестве буферных сред применяли трис-трициновый буфер с рН 8,6. Для соединения с буферными отсеками использовали бумажные «мостики». Для построения калибровки использовали ступенчатое разведение пула беременных женщин с установленной концентрацией АБГ (0,35 г/л). Использована 5 точечная калибровка. Кроме того, использовался образец сыворотки с установленной концентрацией АБГ для контроля над воспроизводимостью результатов. Исследуемые образцы вносили в круглые или щелевидные канавки различной емкости, вырезанные в блоке геля. Электрофорез проводили без охлаждения гелей. Преципитаты окрашивали кумаси бриллиантовым синим R-250 (Bio-Rad, США).
Концентрации интерлейкинов: ИЛ-1, ИЛ-6, ФНО-, ИФН-, а также лактоферрина определяли методом твердофазного иммуноферментного анализа с использованием тест-систем фирмы «Вектор-Бест» (Новосибирск).

Рисунок 3 – Методы исследования.
Уровень специфических иммунокомплексов МГ- IgG и АБГ-IgG определяли методом твердофазного иммуноферментного анализа (ИФА) в собственной модификации (Зорина В.Н., и соавт., 2003). Мы использовали сконструированные de novo тест-системы на базе НИЛ иммунологии ГБОУ ДПО НГИУВ МЗ и СР РФ под руководством проф. Н.А. Зорина. Для этого использовались плоскодонные планшеты COSTAR (США), первичные афинно-очищенные поликлональные кроличьи антитела к МГ либо АБГ, метод «забивки» свободного полистирола 5% бычьим сывороточным альбумином (БСА). Для промывания планшетов и разведения образцов использовали 0,1 М фосфатный буфер, рН 7,4, со 150 мМ хлоридом натрия, содержащий 0,05% Твина-20 (0,001-0,05 М) рН 7-8 (ЗФР-Т). Образцы разводили в ЗФР-Т в соотношении 5 мкл буфера на 195 мкл образца. Для построения калибровки использовали первичные антитела к IgG и высокоочищенный иммуноглобулин класса G в ступенчатом разведении. Для выявления комплексов использовали кроличьи поликлональные антитела к Fc фрагментам IgG человека, «меченные» пероксидазой хрена. В качестве источника хромогенов был использован ортофенилендиамин. Реакция развивалась в течение 10-15 мин. и характеризовалась появлением желтой окраски различной интенсивности в лунках содержащих калибровку и образцы. Реакцию останавливали серной кислотой. Замер оптической плотности, построение калибровочного графика и конечный расчет концентрации комплексов производили при помощи спектрофотометра Microplate Rider, Model-450 (Bio-Rad, США), при 2 длинах волн: 490 нм и 650 нм, с использованием прилагающейся сертифицированной программы Microplate Manager/PC Data Analysis Software, Ver.2.02, по стандартной технологии для иммуноферментного анализа.
Измерение и обработка всех результатов, полученных методом твердофазного иммуноферментного анализа, проводились при помощи оборудования Bio Rad – USA (Microplate Reader, model 3550) с использованием сертифицированной программы PC Microplate Manager/ PC Data Analysis Software (Bio-Rad, USA).
Исследование проведено на базе кафедры акушерства и гинекологии ГБОУ ДПО НГИУВ Минздравсоцразвития России (заведующая кафедрой – доктор медицинских наук, профессор Л.Г. Баженова) и Научно-исследова-тельской лаборатории ГБОУ ДПО НГИУВ Минздравсоцразвития России (заведующий лабораторией – член-корр. РАЕН, доктор биологических наук, профессор Н.А. Зорин). Все клинико-лабораторные исследования выполнялись после получения информированного согласия обследуемых женщин.
2.3. Методы статистической обработки результатов исследования
Статистическая обработка результатов проводилась при помощи программы для биостатистики InStat-II (Sigma, США). Данная программа представляет собой пакет основных методов параметрической и непараметричес-кой статистики, позволяющий обрабатывать сравниваемые группы последовательно при помощи нескольких критериев и посттестов. Параметры, приводимые в работе и таблицах, имеют следующее обозначение: M – среднестатистическое значение, m – ошибка средней, n – объем анализируемой выборки, r – коэффициент корреляции, p – достоверность различий (значимо 0,05). Применялось парное межгрупповое сравнение показателей по критерию Стьюдента, корреляционный анализ проводился по критерию Пирсона. Проверка нормальности распределения признаков проводилась с использованием критерия Колмогорова-Смирнова.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Глава 3.
ВЛИЯНИЕ ПРИЁМА ПРЕПАРАТОВ КОК НА ПОКАЗАТЕЛИ ИММУНОРЕГУЛЯТОРНЫХ БЕЛКОВ, ИХ ИММУННЫХ КОМПЛЕКСОВ И ЦИТОКИНОВ В СЫВОРОТКЕ КРОВИ
3.1. Изменение сывороточных концентраций макроглобулинов (АБГ, МГ) у женщин, принимающих микро- и низкодозированные КОК
Мы исследовали сывороточное содержание двух полифункциональных белков семейства макроглобулинов: ассоциированного с беременностью альфа-2-гликопротеина (АБГ) и иммунорегуляторного альфа-2-макроглобулина (МГ). Альфа-2-макроглобулин – основной представитель семейства, ингибитор протеиназ, а также белок, выполняющий значительную роль в гуморальном иммунном ответе. АБГ – «белок беременности», обладает выраженными иммуносупрессивными свойствами и относится, по мнению некоторых авторов, к числу неспецифических маркеров клеточной пролиферации и рака эстрогензависимых органов (рака молочной железы, яичников и пр.). Это определило наш научный интерес к изучению данных белков у женщин принимающих микро- и низкодозированные КОК. Нами проведен наиболее детальный анализ полученных результатов в зависимости от типа препарата КОК и длительности их применения.

