Министерство образования и науки Российской Федерации
Федеральное государственное автономное
образовательное учреждение
высшего профессионального образования
«Сибирский федеральный университет»
УДК 577.151.03, 577.151.45
№ госконтракта 02.740.11.0766
№ госрегистрации И100921055352
Инв.№ 11
УТВЕРЖДАЮ
Ректор СФУ
академик РАН
Е.А. Ваганов
______________________
(подпись)
“____” сентября 2010 г.
М.П.
ОТЧЕТ
О НАУЧНО-ИССЛЕДОВАТЕЛЬСКОЙ РАБОТЕ
В рамках федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы
по теме:
БИОЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ МОЛЕКУЛЯРНЫХ ПРОЦЕССОВ В КЛЕТКАХ И ИХ ФИЗИКО-ХИМИЧЕСКИХ МОДЕЛЯХ; СОЗДАНИЕ НА ИХ ОСНОВЕ НОВОГО ПОКОЛЕНИЯ БИОЛЮМИНЕСЦЕНТНЫХ СЕНСОРОВ ДЛЯ БИОЛОГИИ И МЕДИЦИНЫ
(промежуточный, этап № 1)
Наименование этапа: «Изучение условий для создания прототипов физико-химических моделей функционирования ферментов в клетке на примере светящихся бактерий»
| Руководитель НИР, академик, д-р медиц. наук, проф. | _________________ подпись, дата | И.И.Гительзон |
Красноярск 2010
СПИСОК ИСПОЛНИТЕЛЕЙ
| Руководитель темы, д-р медиц. наук, профессор-консультант ИФБиБТ СФУ, научный руководитель НОЦ «Енисей», академик РАН | _________________ подпись, дата | И.И. Гительзон (реферат, введение, разделы 1-4, заключение) |
| Д.б.н., профессор, зав. кафедрой биофизики ИФБиБТ СФУ | _________________ подпись, дата | В.А.Кратасюк (реферат, введение, разделы 1-4, заключение) |
| Д. ф.-м.н., профессор кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | П.И. Белобров (разделы 4) |
| Д.б.н., профессор ИЦМиМ СФУ | _________________ подпись, дата | Н.С. Кудряшева (разделы 4) |
| Д.ф.-м.н., профессор кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | С.И.Барцев (разделы 3.5, 4) |
| К.б.н., доцент кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | Е.Н. Есимбекова (реферат, введение, разделы 2, 3.2, 3.3, 3.4, 3.5, заключение) |
| К.б.н., с.н.с кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | И.В. Свидерская (раздел 1,4) |
| К.б.н., доцент кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | В.В. Межевикин (разделы 3.5, 4) |
| К.б.н., доцент кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | И.Е. Суковатая (разделы 2.2, 3.1, 3.6, 4) |
| К.ф.-м.н., директор ИФБиБТ СФУ, директор НОЦ «Енисей» | _________________ подпись, дата | В.А. Сапожников (раздел 1, 4) |
| К.ф.-м..н., доцент кафедры биофизики ИФБиБТ СФУ | _________________ подпись, дата | Е.В. Немцева (разделы 1, 2, 4) |
| Инженер СФУ | _________________ подпись, дата | М.В. Даценко (раздел 4) |
| Инженер СФУ | _________________ подпись, дата | С.М. Гусев (раздел 2) |
| К.т.н., в.н.с. НИЧ СФУ | _________________ подпись, дата | А.Г. Суковатый (раздел 4) |
| Инженер СФУ | _________________ подпись, дата | О.С. Максимова (раздел 1, 4) |
| Электроник сектора административных территориальных сегментов МКИВС СФУ | _________________ подпись, дата | А.В. Суханов (раздел 2, 4) |
| Аспирант СФУ | _________________ подпись, дата | В.О. Шеходанов (раздел 4) |
| Инженер СФУ | _________________ подпись, дата | Н.В. Шманько (раздел 4) |
| Старший преподаватель ИМ СФУ | _________________ подпись, дата | Р.Г. Углев (раздел 2, 4) |
| Аспирант СФУ | _________________ подпись, дата | В.В. Зыков (раздел 2, 4) |
| Начальник отдела интеллектуальной собственности СФУ | _________________ подпись, дата | Л.И. Черепанова (раздел 3,4) |
| Аспирант СФУ | _________________ подпись, дата | А.С. Тарасова (раздел 2,4) |
| Начальник отдела ОРГиП ЦГП НИЧ СФУ | _________________ подпись, дата | С.А. Кузнецов (раздел 1, 4) |
| Аспирант СФУ | _________________ подпись, дата | М.А. Александрова (раздел 4) |
| Аспирант СФУ | _________________ подпись, дата | О.А. Вшивкова (раздел 4) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | А.М. Кондик (раздел 2.3, 3.2, 4) |
| Магистр ИФБиБТ СФУ | _________________ подпись, дата | А.В. Орлова (раздел 3,4) |
| Магистр ИФБиБТ СФУ | _________________ подпись, дата | А.В. Архипова (раздел 4) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | Д.В. Гульнов (раздел 4) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | И.А. Денисов (раздел 2,4) |
| Студентка ИФБиБТ СФУ | _________________ подпись, дата | А.Е. Безруких (раздел 4) |
| Студентка ИФБиБТ СФУ | _________________ подпись, дата | Г.А. Кудряшева (раздел 4) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | К.А. Лукьяненко (раздел 4) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | А.Г. Туманян (раздел 2,4) |
| Магистр ИФБиБТ СФУ | _________________ подпись, дата | Н.С. Бука (раздел 3.1, 4) |
| Студентка ИФБиБТ СФУ | _________________ подпись, дата | Н.А. Зайцева (раздел 4) |
| Магистр ИФБиБТ СФУ | _________________ подпись, дата | Е.В. Васюнькина (раздел 4) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | О.С. Сутормин (раздел 4) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | А.С. Якимов (раздел 4) |
| Студентка ИФБиБТ СФУ | _________________ подпись, дата | Т.И. Авсиевич (раздел 4) |
| Студент ИФБиБТ СФУ | _________________ подпись, дата | В.А. Черняев (раздел 4) |
| Координатор НОЦ «Енисей» | _________________ подпись, дата | А.Ю. Денисова (раздел 4) |
| Референт ИБФ СО РАН | _________________ подпись, дата | Г.Е. Касаева (раздел 1) |
| Д.б.н., в.н.с., зав. лабораторией ИБФ СО РАН | _________________ подпись, дата | В.С. Бондарь (раздел 1) |
| К.б.н., н.с. ИБФ СО РАН | _________________ подпись, дата | К.В. Пуртов (раздел 1, 4) |
| К.б.н., н.с. ИБФ СО РАН | _________________ подпись, дата | Г.А. Выдрякова (раздел 1) |
| К.б.н., с.н.с. ИБФ СО РАН | _________________ подпись, дата | С.Е. Медведева (раздел 1,2) |
| К.б.н., в.н.с. ИБФ СО РАН | _________________ подпись, дата | Э.К. Родичева (раздел 1) |
| Лаборант ИБФ СО РАН | _________________ подпись, дата | Д.А. Котов (раздел 4) |
| Инженер-технолог ИБФ СО РАН | _________________ подпись, дата | А.И. Петров (раздел 1, 2) |
| К.б.н., с.н.с. ИБФ СО РАН | _________________ подпись, дата | Н.С. Мануковский (раздел 1) |
| К.б.н., с.н.с. ИБФ СО РАН | _________________ подпись, дата | В.С. Ковалев (раздел 1) |
| Лаборант ИБФ СО РАН | _________________ подпись, дата | Н.Н. Озимок (раздел 2) |
| С.н.с. ИБФ СО РАН | _________________ подпись, дата | А.П. Пузырь (раздел 2) |
| К.б.н., с.н.с. ИБФ СО РАН | _________________ подпись, дата | О.А. Могильная (раздел 2) |
| К.б.н., зав. лабораторией ИБФ СО РАН | _________________ подпись, дата | Г.С. Калачева (раздел 2) |
| К.б.н., с.н.с. ИБФ СО РАН | _________________ подпись, дата | Н.А. Тюлькова (разделы 2.2, 3.1, 3.6, 4) |
| Доцент ИКиИТ СФУ | _________________ подпись, дата | В.А. Комаров (раздел 4) |
| Аспирант центра технологий электронного обучения СФУ | _________________ подпись, дата | А.А.Трухин (раздел 4) |
| Электроник центра обслуживания систем обработки данных СФУ | _________________ подпись, дата | Д.Ю.Худоногов (раздел 4) |
| Нормоконтролер | _________________ подпись, дата | О.С. Максимова (реферат, введение, разделы 1-4, заключение) |
УДК 001.891[047]:006.354 МКС 01.140.20 Т62 ОКСТУ 0007
Ключевые слова: научно-технический документ, отчет, научно-исследовательская работа, промежуточный отчет
Реферат
Отчет _145_ с., _4_ ч., _52_ рис., _16_ табл., _47_ источник
КЛЮЧЕВЫЕ СЛОВА: БИОЛЮМИНЕСЦЕНЦИЯ, ЛЮЦИФЕРАЗА, СВЕТЯЩИЕСЯ БАКТЕРИИ, СВЕТЯЩИЕСЯ ГРИБЫ, МИКРООКРУЖЕНИЕ, ИММОБИЛИЗАЦИЯ, ВЯЗКОСТЬ СРЕДЫ, СТАБИЛИЗАЦИЯ ФЕРМЕНТОВ, МОДЕЛИРОВАНИЕ, ВКЛЮЧЕНИЕ В ГЕЛЬ, ИННОВАЦИОННОЕ ОБРАЗОВАНИЕ
Проект направлен на понимание процессов поведения ферментативной люминесцентной системы светящихся бактерий в условиях близких к in vivo. Представлены исследования по моделированию процессов функционирования сопряженных ферментативных систем в клетке на примере ферментов светящихся бактерий».
Цель проекта: разработка и исследование физико-химических экспериментальных моделей для изучения функционирования цепей сопряжения ферментов и механизмов стабилизации ферментов внутри клетки и в растворе на примере люминесцентной системы светящихся бактерий и грибов.
Цель первого этапа проекта: изучение условий для создания прототипов физико-химических моделей функционирования ферментов в клетке на примере светящихся бактерий.
План НИР первого этапа работы (2010 г.) над проектом включал следующие основные задачи:
- Выбор микроокружения с использованием растворов различной вязкости, близкого к условиям работы ферментов in vivo, сохранении активности и субстратной специфичности ферментов.
- Выбор условий иммобилизации биолюминесцентной системы бактерий в гели, обеспечивающих высокую активность ферментов.
- Сравнительный анализ физико-химических характеристик растворимой и иммобилизованной биолюминесцентной биферментной системы.
- Исследование влияния вязкости, роли диффузии и других физико-химических параметров реакционной среды на кинетические параметры биолюминесцентной биферментной реакции.
- Создание теоретической концептуальной модели для описания работы биолюминесцентных систем в разном микроокружении.
- Проведение патентных исследований.
- Разработка и экспериментальная проверка кинетических моделей взаимодействия бактериальной люциферазы с ингибиторами и активаторами.
За отчетный период получены следующие основные результаты:
- С использованием растворов различной вязкости, подобрано микроокружение, близкое к условиям работы ферментов in vivo, в котором сохраняется активность и субстратная специфичность бактериальных биолюминесцентных систем, функционирующих в стационарном и нестационарном режиме. Показано, что интенсивность свечения биферментной биолюминесцентной системы уменьшается с увеличением вязкости реакционной среды и не зависит от природы растворителя. Квантовый же выход и константа спада биолюминесценции подвержены влиянию не только вязкости реакционной среды, моделируемой введением глицерина и сахарозы, но и природы растворителя.
- Показано, что оптимальным микроокружением для биферментной системы является 3 % крахмальный гель, при использовании которого не происходит инактивации ферментов, функциональная активность ферментов сохраняется. Биферментная система, иммобилизованная в крахмальный гель, сохраняет свою активность в течение длительного времени и не требует специальных условий хранения.
- Подобран температурный и временной режимы высушивания иммобилизованных препаратов. Оптимальным режимом высушивания дисков является 40С - в этом случае диски обладают высокой активностью и целостностью, что упрощает использование их в биолюминесцентном анализе. Оптимальным временем высушивания иммобилизованных препаратов является 15-20 часов. При меньшем времени высушивания диски недостаточно высыхают и при помещении их в реакционную смесь быстро разрушаются.
- В качестве подложки для высушивания иммобилизованной биферментной системы необходимо использовать лавсановую пленку. Дозирование и последующее высушивание иммобилизованных ферментов непосредственно в лунках планшета, приводит к существенному снижению выхода активности, который составляет не более 3,5 %. При проведении измерений в планшетном биолюминометре с использованием дисков, предварительно высушенных на лавсане, выход активности в 2 раза выше.
- Максимальный выход активности иммобилизованных ферментов - 60 % - достигался при проведении измерений с использованием кюветного биолюминометра и содержании люциферазы в диске 0,33 мкг. Минимальное содержание люциферазы, при котором наблюдалось значительное по сравнению с фоновым свечение биферментной системы, составило 0,2 мкг при использовании как кюветного, так и планшетного биолюминометров.
- Сравнительный анализ физико-химических характеристик (рН- и температурный оптимум активности, энергия активации, константы скорости термоинактивации и Михаэлиса) растворимых и иммобилизованных ферментов продемонстрировал преимущества иммобилизованных ферментов.
- Показано, что иммобилизация в крахмальный и желатиновый гели приводит к значительной стабилизации биферментной системы по отношению к денатурирующим воздействиям: рН-оптимум расширяется, как в кислую, так и щелочную области, сохраняется высокая активность ферментов при увеличении концентрации солей, повышается термостабильность. Наибольшей термостабильностью отличается иммобилизованная в крахмальный гель биферментная система.
- Описано влияние процесса иммобилизации и вязкости среды на субстратную специфичность ферментов. Показано, что при использовании геля желатина выход активности существенно ниже, а значения Km каж для ФМН и НАДН, а также величина энергии активации более высоки, чем в случае крахмального геля. Полученные закономерности объясняются различиями в физико-химических характеристиках и природе гелеобразующих полимеров.
- Проведен сравнительный анализ эффективности применения препаратов растворимых и иммобилизованных ферментов с целью создания биодатчика для экологического биотестирования. Показано, что для большинства исследуемых поллютантов чувствительность растворимой биферментной системы и иммобилизованных реагентов не различалась. Кроме того, чувствительность биферментной системы, в том числе и иммобилизованной на исследуемых носителях выше, либо сравнима с ПДК некоторых хинонов для питьевой воды. Однако для фенолов чувствительность как иммобилизованной так и растворимой биферментной системы меньше указанных ПДК. Для разработки биотеста на основе иммобилизованной биферментной системы необходимо оптимизация методики проведения тестирования.
- Исследовано влияние процессов диффузии на кинетические параметры биолюминесцентной биферментной реакции. Показано, что процесс диффузии непосредственно не влияет на динамику и интенсивность светоизлучения в реакции, происходящей при совместной иммобилизации субстратов и ферментов. Полученный иммобилизованный препарат может быть использован в качестве реагента для ферментативного биотестирования, так как при этом регистрируется величина максимума интенсивности свечения, в реакции биолюминесценции, происходящей с участием только молекул, расположенных на поверхности диска. Чувствительность к анализируемым токсикантам при этом не уменьшается по сравнению с растворимым реагентом в силу отсутствия препятствий их взаимодействия с компонентами биолюминесцентных реакций.
- Разработана теоретическая модель описания работы биолюминесцентных систем в разном микроокружении, позволяющая оценить вклад различных механизмов и стадий реакции в кинетику свечения.
- Разработана и экспериментально проверена кинетическая модель взаимодействия бактериальной люциферазы с ингибиторами и активаторами. Показано, что тип взаимодействия люцифераз с каким-либо эффектором (ингибитором или активатором) определяется в большей мере тем, какой из альдегидов используется в качестве субстрата, а различная структура и физико-химические свойства растворителей оказывают влияние на скорости образования или распада каталитически активных комплексов ферментов. Экспериментально определена природа взаимодействия (гидрофобная или электростатическая) с эффекторами различной природы, подтверждающая предсказательную силу предлагаемой модели.
Работа имеет высокую практическую значимость: разработанный многокомпонентный реагент может послужить основой для создания биолюминесцентного сенсора и проведения биолюминесцентного анализа. Технология производства и использования реагента оформлены в виде заявок на патенты РФ: № 2009110636 «Биолюминесцентный биомодуль и способ его приготовления» и № 2009113656 «Экспресс-способ биотестирования природных, сточных вод и водных растворов». «Методика определения интегральной токсичности проб поверхностных, пресных, грунтовых, питьевых, сточных и очищенных сточных вод по интенсивности биолюминесценции иммобилизованных ферментов светящихся бактерий» направлена для аттестации в Федеральное государственное унитарное предприятие «Уральский научно-исследовательский институт метрологии».
Проведены поисковые исследования функционирования ферментативных систем в клетке и их сопряжения на новых экспериментальных примерах, которые были подготовлены для изучения ферментов светящихся бактерий. Результаты показали перспективность применения пористых наноалмазных композитов для управляемой сорбции и десорбции субстратов с помощью электрических и магнитных полей. Сформулированные концепции и подходы к сопряжению биологического, технического и электронного модулей будут развиваться на следующих этапах данного проекта.
Для создания научно-образовательного пространства, включающего преподавателей, научных работников, молодых ученых и студентов и аспирантов разных специальностей развивался инновационный образовательный процесс на основе новых полученных результатов, Были разработаны новые принципы ведения научных исследований со студентами 3-5 курсов при выполнении студентами курсовых и дипломных работ по темам проекта, внедрены в учебный процесс Учебно-методические комплексы по дисциплинам «Фотобиофизика» и «История и методология биологии и биофизики», разработан проект вовлечения молодежи в инновационную деятельность в рамках Молодежной Международной Открытой Лаборатории Перспективных Исследований и Технологий (МОЛПИТ), организован Научно-образовательный семинар по биохимической физике. Методические разработки, и практические рекомендации, полученные при выполнении исследования по теме проекта используются для создания новых магистерских прогорамм и их продвижению на российские и международные рынки образовательных услуг
Содержание
РЕФЕРАТ…………………………………………………………………………………… …….…7
СОДЕРЖАНИЕ…………………………………………………………………………………….12
ВВЕДЕНИЕ …………………………………………………………………………………………16
Основная часть ……………………………………………………………………………………..20
Раздел 1 Описание проблемы и пути решения ………………………………………………...21
1.1 Актуальность проблематики …………………………………………………………………21
1.2 Предлагаемые подходы ………………………………………………………………………..22
1.3 Практическая значимость ……………………………………………………………………23
1.4 Актуальность тематики для развития инновационного образования …………………25
Раздел 2. Методы исследования …………………………………………………………………28
2.1 Материалы и приборы ……………………………………………………………………….28
2.2 Методы изучения кинетических параметров работы ферментов в вязких растворах сахарозы и глицерина …………………………………………………………………………….29
2.3 Способы получения иммобилизованных ферментов …………………………………….30
Раздел 3. Изучение условий для создания прототипов физико-химических моделей функционирования ферментов в клетке на примере светящихся бактерий ………………31
3.1 Выбор микроокружения с использованием растворов различной вязкости, близкого к условиям работы ферментов in vivo, сохранении активности и субстратной специфичности ферментов ………………………………………………………………………31
3.1.1 Особенности функционирования моноферментной биолюминесцентной
системы……………………………………………………………………………………………..32
3.1.2 Кинетические особенности функционирования биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза……………………………………………………35
3.1.3 Экспериментальное изучение кинетических параметров биферментной биолюминесцентной системы в вязких растворах сахарозы и глицерина…………………36
3.1.4 Сравнительный анализ влияния вязкости реакционной среды на кинетические параметры моноферментной и биферментной биолюминесцентных систем……………..43
3.2 Выбор условий иммобилизации биолюминесцентной системы бактерий в гели, обеспечивающих высокую активность ферментов. …………………………………………49
3.2.1. Зависимость параметров биолюминесценции иммобилизованной биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза от природы геля...49
3.2.2.Зависимость параметров биолюминесценции иммобилизованной биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза от концентрации и источника крахмала………………………………………………………………………………..52
3.2.3.Зависимость параметров биолюминесценции иммобилизованной биферментной
системы НАДН:ФМН-оксидоредуктаза-люцифераза от содержания люциферазы в диске………………………………………………………….……………………………..............55
3.2.4. Зависимость параметров биолюминесценции иммобилизованной биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза от концентрации стабилизаторов...56
3.3 Сравнительный анализ физико-химических характеристик растворимой и иммобилизованной биолюминесцентной биферментной системы ………………………….60
3.3.1. Исследование чувствительности иммобилизованных реагентов
к действию рядов поллютантов…………………………………………………………………66
3.4 Исследование влияния вязкости, диффузии и других физико-химических параметров реакционной среды на кинетические параметры биолюминесцентной биферментной реакции. ……………………………………………………………………………………………..69
- Создание теоретической концептуальной модели для описания работы биолюминесцентных систем в разном микроокружении. ……………………………………76
3.5.1. Люциферазная реакция………………………………………………………………….79
3.5.2.НАДН:ФМН оксидоредуктазная реакция………………………………………….80
3.5.3. Анализ механизмов формирования кинетических кривых свечения…………81
3.6. Разработка и экспериментальная проверка кинетических моделей взаимодействия бактериальной люциферазы с ингибиторами и активаторами……………………………..93
3.6.1 Кинетических моделей взаимодействия бактериальной люциферазы с ингибиторами и активаторами……………………………………………………………….93
3.6.2 Экспериментальная проверка кинетических моделей взаимодействия бактериальной люциферазы с ингибиторами и активаторами…………………………..97
3.6.2.1.Кинетический анализ взаимодействия люцифераз с субстратами в водно-органических средах………………………………………………………………………………..97
3.6.2.2.Определение типов взаимодействия органических растворителей с люциферазами по отношению к ФМНН2 и альдегидам с разной длиной цепи…………….97
3.6.2.3.Константа Михаэлиса и природа взаимодействия субстратов и люцифераз в водно-органических средах……………………………………………………………………….110
3.6.3 Анализ кинетики реакции бактериальной люциферазы, как ферментативной системы с нестабильным субстратом……………………………………………………….114
Раздел 4. Разработка новых принципов обучения и форм организации научно-образовательного процесса …………………………………………………………………….121
4.1. Выполнение студентами –участниками проекта курсовых и дипломных работ по темам проекта…………………………………………………………………………………...122
4.2. Научно-образовательные семинары как способ формирования современного научно-образовательного пространства по биохимической физике………………………..124
4.3. Чтение оригинальных курсов лекций с включением результатов исследований по проекту……..………………………………….............................................................................125
4.4. Разработка специальных практикумов по темам проекта ……………………..127
4.5. Внедрение в учебный процесс учебно-методических комплексов
дисциплин ……………………………………………………….………………….............127
4.6. Организация студенческих конференций………………………………………….128
4.7. Участие студентов и молодых ученых с докладами на научных, образовательных конференциях и других форумах и стажировках………………...129
4.8. Молодежная Международная Открытая Лаборатория Перспективных Исследований и Технологий (МОЛПИТ)……………………………………………………….132
4.9. Развитие совместных научных и научно-образовательных программ и проектов с зарубежными партнерами………………………………………………………………………133
Раздел 5. Отчет о патентных исследованиях……………………………………………….......135
ЗАКЛЮЧЕНИЕ……………………………………………………………………………………138
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ……………………………………………142
ОПРЕДЕЛЕНИЯ, ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
| Биолюминесценция | - свечение живых организмов |
| Хемилюминесценция | - излучение света в результате дезактивации молекул, образованных в ходе химической реакции |
| Люцифераза | - фермент, катализирующий биолюминесцентную реакцию |
| Эмиттер | - молекула в электронно-возбужденном состоянии, ответственная за излучение регистрируемой люминесценции |
| I | - интенсивность люминесценции |
| С14 | - тетрадеканаль |
| ФМН | - флавинмононуклуотид |
| ФМНН2 | - восстановленный флавинмононуклеотид |
| Кm каж | - Константа Михаэлиса кажущаяся |
| С50 | –пороговая концентрация растворителя, при которой происходит потеря половины ферментативной активности |
| kcn | - константа спада биолюминесценции |
| Q | - квантовый выход реакции |
| T | - температура |
| ES-комплекс | - фермент-субстратный комплекс |
| Биферментная система | - смесь оксидоредуктазы и люциферазы |
| Вязкость | -свойство текучих тел, жидкостей, оказывать сопротивление перемещению одной их части относительно другой |
| Гидрофобность | -характеристика интенсивности молекулярного взаимодействия поверхности тел с водой. между молекулами воды и любого тела всегда будут действовать меньшей степени межмолекулярные силы притяжения |
| Бактериальная люцифераза | - флавин-зависимая монооксигеназа |
| Еа | - энергия активации |
| НАДН:ФМН-оксидоредуктаза-люцифераза, Л+Р | - сопряженная бактериальная биолюминесцентная система на основе бактериальных люцифераз и резуктаз |
| БСЖО | - биологическая система жизнеобеспечения |
ВВЕДЕНИЕ
Одной из важных задач современной образовательной реформы в России является подготовка научных и научно-педагогических кадров для изменяющейся инновационной России, развитие научных и научно-образовательных программ и проектов, позволяющих широко вовлекать в научные исследования молодежь (аспирантов, магистрантов, студентов и даже школьников), обеспечивать подготовку специалистов мирового уровня для науки и системы коммерциализации научных идей, а также для развития высокотехнологических производств.
Научно-методическое обеспечение подготовки научных кадров в высшей школе и развитие научно-исследовательской работы студентов и аспирантов в настоящем проекте осуществляется в рамках направления создания нового поколения биолюминесцентных биосенсоров для биологии и медицины на основе биолюминесцентного анализа молекулярных процессов в клетках и их физико-химических моделях.
Задачей настоящего проекта является изучение механизмов стабилизации ферментных комплексов в клетках путем создания физико-химических моделей и их практическое использование с целью принципиального усовершенствования биолюминесцентных сенсоров для медицины, биотехнологии и экологии.
Вследствие надмолекулярной организации ферментных комплексов метаболические цепи функционируют в клетках эффективнее, чем ферменты в растворах. В супрамолекулярных комплексах многократно возрастает устойчивость ферментов и удлиняется время их жизни. Однако прямые исследования ферментных комплексов в клетках затруднены и их результаты трудно поддаются однозначному истолкованию без модельных экспериментов. Их кинетика, как правило, не описывается уравнением Михаэлиса-Ментен, справедливого для реакций в разбавленных растворах с участием высокоочищенных ферментов [1,2]. Весьма эффективным инструментом для понимания внутриклеточных процессов является создание физико-химических моделей ферментативных комплексов в микроокружении, моделирующем внутриклеточную среду.
Познание механизмов стабилизации ферментов в клетке посредством создания адекватных физико-химических моделей, помимо фундаментального общебиологического значения, открывает перспективы для применения в промышленных биотехнологиях, использующих ферменты, таких ферментных комплексов с целью их защиты от инактивации, продления срока жизни и повышения эффективности работы в составе ферментных целей.
Для изучения фундаментальной проблемы супрамолекулярной организации ферментных комплексов в клетке и влияния на них клеточной среды излучающие ферменты – люциферазы являются исключительным, уникальным инструментом. Их излучение является естественным продуктом жизнедеятельности клетки и активности ферментов. это позволяет изучать внутриклеточные процессы, измеряя параметры биолюминесцентной реакции дистантно по исходящему излучению и не создавать артефактов вмешательством экспериментатора.
Предельная чувствительность (вплоть до счета квантов) и точность фотометрических измерений обеспечивают высокую достоверность и статистическую обеспеченность результата, что является специфическим достоинством биолюминесцентных измерений, выгодно отличающих этот вид анализа от многих других измерений биологических процессов.
Предлагаемое исследование актуально с практической точки зрения, так как разработанные модели, представляющие собой ферментативные системы в иммобилизованном состоянии в средах разной вязкости, создают инструмент для стабилизации ферментов в реакциях in vitro. стабилизация ферментов, являющихся реагентами ферментационных технологий, весьма актуальны для биотехнологии. Исследование микроокружения ферментов внутри клетки и создание подобного микроокружения для ферментов в реагенте может послужить основой для новой концепции диагностических наборов (китов) для разных типов анализов в экологии, медицине и биотехнологии. Собственно предполагаемую физико-химическую модель саму можно рассматривать как многокомпонентный реагент, так как она представляет собой в первом приближении «искусственную клетку», содержащую все необходимые для анализа компоненты и стабилизирующую их микросреду. Эти же реагенты, особенно иммобилизованные, являются основой для создания биологического модуля биосенсоров.
Создание физико-химических моделей функционирования ферментов в клетке предполагается проводить на примере ферментов светящихся бактерий, исследование которых проводится в Научно-образовательном центре «Енисей» (проект «Фундаментальные основы экологизации технологий и образования») с 1999 по настоящее время, так как одним из основных направлений научно-образовательной деятельности НОЦ является изучение механизмов ингибирования биолюминесцентных реакций, являющихся фундаментальной основой для разработки биолюминесцентных биотестов для экологического мониторинга, а также создания нового поколения биолюминесцентных сенсоров. Прикладная ценность таких исследований обусловлена тем, что в последнее время, большинство регионов Российской Федерации, в том числе и Красноярский край, столкнулись с острыми проблемами интенсивного водопользования, сброса сточных вод от промышленных, фармацевтических и коммунальных источников, загрязнения воздушной среды промышленными газами, особенно при техногенных авариях, представляющих опасность для здоровья и жизни населения. В сложившейся ситуации необходимость в новых методах и мобильных системах экологического контроля диктуется потребностью не допустить развития тяжелых последствий для людей при возникновении чрезвычайных ситуаций и обеспечить контроль над водными ресурсами и охрану воздушной среды.
Современный подход, широко используемый в экологическом контроле, опирается на методы, требующие специализированных лабораторий с высоко квалифицированным персоналом и дорогостоящим оборудованием. Используемые в настоящее время методы можно разделить на две основные группы. С одной стороны, это химический анализ, в котором определяется концентрация разнообразных компонентов среды. При всех его достоинствах химический анализ не может показать степень опасности этих веществ или среды для человека. С другой стороны, это биотесты, в которых токсичность среды определяется по реакции живых организмов. Однако биотесты на живых организмах из-за длительности анализов и сложности методов трудно использовать для экспресс-контроля в чрезвычайных ситуациях.
Биолюминесцентный ферментативный анализ позволяет в течение секунд или минут ответить на поставленный вопрос. Принцип биолюминесцентных биотестов заключается в обнаружении токсических свойств тестируемых веществ и смесей по их влиянию на светящиеся бактерии и их ферментативные системы. Новое направление биотестирования токсичности – люциферазные биотесты, разрабатываемые в НОЦ «Енисей», отличается тем, что в качестве тест-объектов вместо светящихся бактерий используется смесь из ферментов светящихся бактерий и их субстратов. При замене живых организмов на ферменты возникает целый ряд преимуществ: увеличивается точность и чувствительность, сокращается время анализа. Однако использование ферментов, выделенных из светящихся организмов, существенно осложняет проведение рутинных анализов, поскольку ферменты, вырванные из естественного вязкого микроокружения, которое они имеют внутри клетки, нестабильны, быстро теряют активность и требуют специальных условий хранения (низкой температуры, узкого диапазона рН и концентрации ионов). Увеличения стабильности ферментов можно достичь при их иммобилизации и подборе микроокружения. Важным преимуществом такого подхода является возможность управления устойчивостью ферментов к действию физических и химических факторов среды путем выбора соответствующего микроокружения. При оптимальном микроокружении иммобилизованные ферменты сохраняют высокую активность в широком температурном диапазоне, наблюдается расширение рН-оптимума и оптимума ионной силы. В настоящее время разработано более 40 различных способов иммобилизации ферментов светящихся организмов. Однако, при иммобилизации люцифераз редко удается сочетать стабильность с сохранением высокой активности ферментативного препарата. Ни один из известных методов иммобилизации не позволяет получить многокомпонентный дозированный препарат для биолюминесцентного анализа, за исключением разработанного нами метода иммобилизации в крахмальный гель [3, 4]. Проектом предусматривается изучение факторов, стабилизирующих ферменты при иммобилизации в полимерные гели, а также при изменении вязкости микроокружения с использованием сахарозы и глицерина.
Новизна нашего подхода заключается в совмещении компонентов биосенсорной смеси в один картридж, содержащий все необходимые составляющие в требуемых пропорциях и концентрациях. Необходимым условием создания биологического модуля биосенсора является стабилизация белковых молекул для сохранения высокой каталитической активности ферментов в течение длительного времени без высоких требований к условиям хранения. Знание условий стабилизации биферментной биолюминесцентной системы позволит разработать реагент для широкого использования в биолюминесцентном анализе и интегрирования в качестве биологической части в картридж – сенсор для портативной системы. Использование иммобилизованных реагентов позволит существенно упростить процедуру измерения и улучшить другие его характеристики: экспрессность, чувствительность, точность анализа, проведение анализа в одну стадию и сохранение ферментов в активном состоянии не менее 1 года. Такой картридж будет создан на основе исследования физико-химической экспериментальной модели функционирования ферментов в клетке.
Вторым объектом исследования по настоящему проекту будет изучение организации биолюминесцентной системы в эукариотической клетке. Для этой цели выбраны светящиеся грибы.
В практическом отношении биолюминесценция грибов привлекательна своей длительностью – мицелий грибов, растущих на древесных субстратах, может излучать в течение недель и месяцев. Это создает основу для создания нового класса биолюминесцентных сенсоров, работающих в режиме ожидания и выдающих тревожный сигнал при появлении в воздушной или водной среде токсикантов.
Стартовой кадровой основой для организации работ по проекту является коллектив сотрудников СФУ и Института биофизики СО РАН, который сформировался в 1999 году после получения гранта русско-американской программы CRDF и Минобразования РФ «Фундаментальные исследования и высшее образование» и создания научно-образовательного центра (НОЦ) «Енисей». Образовательные идеи и научные достижения НОЦ «Енисей» послужили основой инновационной образовательной программы в рамках проекта «Разработка современной системы подготовки отечественных профессионалов для проведения коммерчески ориентированных научных исследований в области физико-химической, молекулярной и клеточной технологий», реализуемой в Институте фундаментальной биологии и биотехнологии (ИФБиБТ) СФУ. Предлагаемые в проекте исследования являются естественным продолжением исследований, проводимых в НОЦ «Енисей» в предыдущие годы.
На основе этих научных исследований разрабатывается современная система подготовки отечественных профессионалов для проведения коммерчески ориентированных научных исследований в области физико-химической, молекулярной и клеточной технологий.
План НИР первого этапа работы (2010 г.) над проектом включал следующие основные задачи:
- Выбор микроокружения с использованием растворов различной вязкости, близкого к условиям работы ферментов in vivo, сохранении активности и субстратной специфичности ферментов.
- Выбор условий иммобилизации биолюминесцентной системы бактерий в гели, обеспечивающих высокую активность ферментов.
- Сравнительный анализ физико-химических характеристик растворимой и иммобилизованной биолюминесцентной биферментной системы.
- Исследование влияния вязкости, роли диффузии и других физико-химических параметров реакционной среды на кинетические параметры биолюминесцентной биферментной реакции.
- Создание теоретической концептуальной модели для описания работы биолюминесцентных систем в разном микроокружении.
- Проведение патентных исследований.
- Разработка и экспериментальная проверка кинетических моделей взаимодействия бактериальной люциферазы с ингибиторами и активаторами.
Другой целью настоящего проекта являлось вовлечение молодежи в научную деятельность и построение образовательного процесса на основе новых научных результатов. Реализация этой цели осуществлялась на примере кафедры биофизики Института фундаментальной биологии и биотехнологии СФУ (ИФБиБТ СФУ), возглавляемой участником настоящего проекта - проф., д.б.н. Кратасюк В.А.
Основная часть
Раздел 1. Описание проблемы и пути решения.
1.1. Актуальность проблематики.
Для решения фундаментальной задачи понимания механизмов сопряжения и функционирования ферментативных метаболических цепей в клетке используются разные подходы, одним из которых является исследование работы ферментов в условиях различного микроокружения, в том числе при иммобилизации. Для того чтобы лучше понять поведение и регуляцию ферментов in vivo, было предпринято много попыток изучить влияние на них условий иммобилизации и определенной гетерогенной среды, а затем соотнести полученные сведения с ситуацией in vivo [5]. Уникальные возможности для подобного рода исследований представляет собой бактериальная люцифераза – фермент, участвующий в преобразовании энергии химической связи в излучение видимого оптического диапазона. Действительно, люцифераза обладает существенным преимуществом благодаря удобному параметру регистрации ее активности посредством измерения интенсивности свечения.
Проведение прямых экспериментов на живых светящихся организмах затруднено, так как работает сложная цепь метаболических процессов, а клеточная оболочка препятствует прямому воздействию на клетку. С другой стороны, использование выделенных фермент-субстратных систем для интерпретации процессов, происходящих внутри клетки, часто приводит к артефактам, так как в системах in vitro нарушаются все связи, имеющиеся у люциферазы в клетке, и исследователь имеет дело с люциферазой, извлеченной из привычного и оптимального для нее окружения - вязкость среды и микроокружение люциферазы в клетке значительно отличаются от таковых в пробирке. Таким образом, ответа на вопрос о структурно-функциональной организации люминесцентной системы светящихся бактерий до сих пор нет.
По аналогии с известным, но не всегда доказанным предположением о том, что ферменты многих метаболических путей связаны с теми или иными мембранными структурами клетки [5], имеются все основания считать, что, не смотря на высокую растворимость люциферазы [6], она может быть связана внутри клетки с клеточными структурами [7]. Проверка этого предположения проводится в основном косвенными методами. Тем не менее, есть возможность на примере бактериальной люциферазы создать экспериментальную модель, исследование которой приведет к пониманию процессов функционирования цепей ферментов внутри клетки. При этом предполагается, что иммобилизованная люцифераза и другие ферменты будут встраиваться в матричную структуру геля, приобретать определенное строго фиксированное место в гелевом микроокружении. При таком подходе возможно также конструирование связей между несколькими ферментами, составляющими метаболическую цепочку. Поведение иммобилизованного фермента, или цепей из 2-3 и более ферментов будет приближаться к естественному их поведению in vivo.
1.2. Предлагаемые подходы.
Предлагается принципиально новый подход к изучению механизмов стабилизации сопряжения и функционирования цепей сопряжения ферментов в клетке - создание и исследование иммобилизованных ферментативных комплексов, которые можно рассматривать как экспериментальные модели, в которой реконструирована цепь сопряжения люциферазы с другими ферментами светящихся бактерий в матричной структуре геля. Благодаря совместной иммобилизации всех необходимых для свечения компонентов (ферментов и субстратов) модель проявляет биолюминесцентную активность. В модели имитируется вязкое микроокружение ферментов в матриксе, а также связь с мембранными структурами. Оптимизация микроокружения достигается за счет подбора соответствующей гелеобразующей системы в качестве носителей для иммобилизации. Используя полимерные носители с различными физическими свойствами можно варьировать создаваемое ими микроокружение для иммобилизованных ферментов. Для понимания процессов поведения и регуляции ферментативной люминесцентной системы светящихся бактерий in vivo изучено влияние иммобилизации и определенной гетерогенной среды на сопряженную биферментную систему НАДН:ФМН-оксидоредуктаза-люцифераза. Наиболее перспективными для создания оптимального микроокружения ферментов следует признать полимерные гели, позволяющие добиться высокой каталитической активности иммобилизованных ферментов. Метод иммобилизации в гели состоит в том, что молекулы фермента включаются в трехмерную сетку из тесно переплетенных полимерных цепей, образующих гель. Среднее расстояние между соседними цепями в геле меньше размера молекулы включенного фермента, поэтому он не может покинуть полимерную матрицу и выйти в окружающий раствор. Поскольку многие ферменты в клетке функционируют в тесном контакте с другими ее компонентами, в частности с углеводами и белками, изучение поведения ферментов иммобилизованных на белковых и полисахаридных матрицах позволяет понять закономерности их функционирования in vivo. В качестве носителей для иммобилизации выбраны желатиновый и крахмальный гели, относящиеся к белкам и полисахаридам, соответственно.
Изучение поведения и кинетики ферментов, иммобилизованных на белковых и полисахаридных матрицах, позволяет понять закономерности их функционирования in vivo и взаимодействия с другими химическими компонентами матрикса клетки, определить ферменты, с которыми люцифераза связана в метаболической цепи, истинные субстраты люциферазы, влияние микроокружения внутриклеточного матрикса на взаимодействие субстратов и ферментов. Сравнение поведения фрагментов метаболических цепей с люциферазой в экспериментальной модели и в растворе позволяет составить представление о функционировании все метаболической цепи и роли в ней люциферазы. Предлагаемые методы и подходы является оригинальными, никем ранее не использованными, соответствуют мировому уровню исследования в области биофизики биологических объектов. Исследования, проведенные на ферментах светящихся бактерий, могут быть перенесены далее на другие метаболические пути клеток живых организмов.
1.3. Практическая значимость.
Реализация целей проекта полезна как для решения фундаментальной проблемы стабилизации функционирования ферментов в клетке, так и для прикладных задач биолюминесцентного анализа, в котором широко используются ферменты светящихся организмов.
Основной принцип биолюминесцентного анализа заключается в том, что концентрация анализируемого вещества (фермента или метаболита) коррелирует с интенсивностью испускаемого света [8-17]. В настоящее время наиболее активно в биолюминесцентном анализе используются ферментативные системы, выделенные из светящихся бактерий и светляков [18-19]. На мировом рынке активно предлагаются комплекты биолюминесцентных реактивов для проведения специфического анализа различных веществ и ферментов в биохимии, в практике клинических лабораторий, в технической микробиологии, при контроле окружающей среды и многих других областях [20-21]. Однако использование ферментов, выделенных из светящихся организмов, существенно осложняет проведение рутинных анализов, поскольку ферменты, вырванные из естественного вязкого микроокружения, какое они имеют внутри клетки, быстро инактивируются и требуют специальных условий хранения (обеспечение низкой температуры, узкого диапазона рН и концентрации солей).
Таким образом, есть все предпосылки считать, что стабилизация ферментов может быть достигнута при восстановлении их вязкого микроокружения, и создании на этой основе новых реагентов для биолюминесцентного анализа. Для этого необходимо провести изучение факторов, стабилизирующих ферменты при иммобилизации в полимерные гели, а также при изменении вязкости микроокружения с использованием сахарозы и глицерина. Производство иммобилизованных реагентов для аналитических целей – одно из наиболее перспективных направлений в прикладной энзимологии. Важным преимуществом иммобилизованных ферментов является возможность управления устойчивостью ферментов к действию физических и химических факторов среды путем выбора соответствующего микроокружения. При оптимальном микроокружении иммобилизованные ферменты сохраняют высокую активность в широком температурном диапазоне, наблюдается расширение рН-оптимума и оптимума ионной силы.
В настоящее время разработано более 40 различных способов иммобилизации светящихся организмов и выделенных из них ферментов [22-23]. Чрезвычайно широка и область их использования – от аналитической химии (анализ НАДН, ФМН, АТФ и других веществ), медицины (анализ D- и L-лактата, желчных кислот в сыворотке крови, аминокислот аланина и фенилаланина, НАДН-зависимых ферментов и т.д.), пищевой промышленности (анализ общей бактериальной обсемененности) до экологического мониторинга [24-26]. Несмотря на значительное разнообразие предлагаемых методов иммобилизации ферментов, редко удается сочетать стабильность иммобилизованных ферментов с высоким выходом активности ферментов по сравнению с ферментами в растворе. Действительно, связывание люциферазы с носителями часто происходит с участием активных групп фермента, важных для катализа. Это приводит к существенной инактивации фермента и мешает правильной количественной интерпретации результатов. Кроме того, постоянно дополняется список требований, предъявляемый к иммобилизованным ферментным препаратам. В соответствии с современными представлениями иммобилизованные реагенты для биолюминесцентного анализа должны удовлетворять следующим требованиям:
- реагент должен оставаться стабильным как при хранении, так и при использовании;
- в иммобилизацию не должны вовлекаться активные центры фермента, важные для катализа, т.е. активность конечного продукта (иммобилизованного биолюминесцентного реагента) должна быть близка к 100% по сравнению с активностью в растворе;
- после иммобилизации люцифераза и другие ферменты должны сохранять специфичность по отношению к субстратам;
- ферментный препарат должен быть дозированным;
- каждый реагент, предназначенный для проведения одного измерения, должен содержать весь набор необходимых реакционных компонентов и способ иммобилизации должен обеспечивать возможность связывания люциферазы с другими ферментами и их субстратами.
Каждое из этих требований может быть реализовано только при выполнении первого, а именно обеспечения стабильности реагента. Поэтому создание реально работающего активного реагента для биолюминесцентного анализа возможно только в результате понимания механизмов влияния разнообразного микроокружения на ферменты, выбора условий, в которых микроокружение ферментов в реагенте приближено к микроокружению ферментов внутри клетки. При этом возможно достижение уникального сочетания характеристик иммобилизованных препаратов ферментов, например, стабильности с высокой каталитической активностью, возможностей многократного использования с перспективой разработки автоматизированной аналитической системы, высокой чувствительности метода с экспрессностью выполнения анализа и минимизацией объема анализируемой пробы.
Кроме того, выбор крахмала и желатина в качестве носителей для иммобилизации, является экономически обоснованным. Действительно, эти реактивы отличаются дешевизной, а процедура проведения иммобилизации ферментов в крахмальный и желатиновый гели весьма проста, что является немаловажным с точки зрения тиражирования и конкурентоспособности полученных реагентов.
1.4. Актуальность тематики для развития инновационного образования.
Другой целью настоящего проекта являлось вовлечение молодежи в научную деятельность и построение образовательного процесса на основе новых научных результатов. Реализация этой цели осуществлялась на примере кафедры биофизики Института фундаментальной биологии и биотехнологии СФУ (ИФБиБТ СФУ).
Основанием для такого подхода являлось то, что одной из важнейших задач Программы развития СФУ является освоение международного научно-образовательного пространства. При этом в настоящее время научно-образовательная система России, в отличие от Европы и США, характеризуется разделением на элитную часть, связанную с вузами и исследовательскими институтами Москвы, Петербурга и немногочисленными сильными академическими центрами и региональную часть, можно сказать провинциальную, разбросанную по городам, оторванным от первых. Однако это разделение обусловлено не только пространственной оторванностью и историческими традициями, но крайней неравномерностью распределения финансов и других экономических и учебных ресурсов. Для провинциальных вузов это создает принципиальную проблему подготовки специалистов современного уровня в соответствии с международными стандартами. Последняя по времени попытка смягчить это разделение – создание федеральных университетов, на основе объединения нескольких вузов пусть в больших, но все-таки провинциальных городах: в Красноярске, Ростове, Владивостоке и др. Вновь созданные федеральные университеты призваны стать флагманами в реорганизации научно-образовательной системы в России, а вернее в ее организации в провинциях в соответствии с международными стандартами.
Образование в немногочисленных элитных вузах имеет качественное отличие. В элитных вузах научно-исследовательская работа является важным компонентом образовательного процесса, и преподаватели активно работают в науке. Практически, эти элитные вузы представляют собой научно-образовательные агломерации из вузов как таковых и научно-исследовательских институтов разного подчинения.
Заметный вклад в процесс интеграции российского высшего образования в мировое образовательное пространство вносят негосударственные вузы, осуществляющие подготовку специалистов в соответствии с Болонским соглашением. Расположены эти вузы также в основном в Москве и Петербурге. Некоторые из этих вузов имеют не одну, а несколько аккредитаций. Например, Московский Институт Туро имеет аккредитацию Российской федеральной службы по надзору в сфере образования и науки, а кроме того, программа бакалавра по бизнесу является частью аккредитации Колледжа Туро в Ассоциации высших учебных заведений Центральных штатов США. Все эти скромные достижения по интеграции в мировое образовательное пространство связаны только с экономическими или гуманитарными направлениями: финансы, управлением бизнесом и т.д. Что касается естественнонаучного направления подготовки специалистов, то здесь ситуация заметно хуже. Заметно уменьшились объемы подготовки специалистов по этому направлению и такое обучение ведут только государственные вузы. Программы, интегрированные в международное образовательное пространство, отсутствуют даже в таких ведущих вузах как МГУ, МФТИ или НГУ. Во вновь созданном Сибирском федеральном университете естественно-научное направление является одним из приоритетных.
Второй по значимости особенностью современной системы высшего образования в России является сочетание старого советского одноуровневого образования (специалитет, обучение в течение пяти лет) с новым, еще не окрепшим двухуровневым образованием (четырехлетний бакалавриат и двухгодичная магистратура). Однако переход российских вузов к двухуровневой системе высшего образования встречается с объективными трудностями и вызывает противоречивые оценки и усиливающуюся дискуссию. В наибольшей степени это касается подготовки специалистов по фундаментальным наукам (математика, физика, химия, биофизики, биология), и не только в виду их сложности и большого объема усваиваемых знаний, но и тем, что двухуровневая система подготовки по фундаментальным наукам предназначена, прежде всего, для формирования интеллектуальной элиты общества: научных работников и преподавателей вузов, однако именно это направление в настоящее время наименее престижно. Необходим анализ путей и средств оптимальной интеграции российского высшего фундаментального образования по точным и естественным наукам в международное научно-образовательное пространство.
Третья особенность российского высшего образования, препятствующая его интеграции в мировую научно-образовательную систему: очень низкий уровень как внутрироссийской, так и международной академической мобильности студентов и преподавателей и межкультурной коммуникации. Это связано с низким уровнем доходом большей части населения, низким финансированием вузов государством, плохим знанием иностранных языков, очень низким числом зарубежных студентов в российских вузах.
Раздел 2. Методы исследования.
2.1. Материалы и приборы.
В работе использовали лиофилизованные препараты высокоочищенных ферментов, произведенные в лаборатории нанобиотехнологии и биолюминесценции Института биофизики СО РАН (Красноярск). Один флакон лиофилизованного препарата содержал 0,4 мг/мл люциферазы (L) EC 1.14.14.3 из рекомбинантного штамма E.coli и 0,18 ед.активности НАДH:ФМН-оксидоредуктазы (R) EC 1.5.1.29 (Vibrio fischeri). Перед измерениями лиофилизованные ферменты растворяли в 0,05 М калий фосфатном буфере (рН 6,8).
Были использованы следующие реактивы: картофельный крахмал, НАДH и ФМН фирмы «Serva» (Германия), тетрадеканаль фирмы «Merck» (Германия), желатин (ГОСТ 11293-89, Россия), сахароза, глицерин. Для приготовления растворов использовали 0,05 М калий фосфатный буфер (рН 6,8).
Исследовали изменение следующих параметров биолюминесценции в зависимости от микроокружения биферментной системы: максимальной интенсивности свечения Im, константы спада kсп, квантового выхода Q.
Для регистрации кинетических параметров биферментной биолюминесцентной системы в вязкой среде, созданной различными концентрациями сахарозы и глицерина, использовали следующие компоненты реакционной смеси: 10 мкл раствора ферментов; 50 мкл 0,9 мM раствора тетрадеканаля; 200 мкл 0,02 М фосфатного буфера; 5 мкл 0,7 мМ раствора ФМН; 50 мкл 0,1 мМ раствора НАДН.
Активность растворимой и иммобилизованной биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза определяли по величине максимальной интенсивности свечения Imax, выраженной в милливольтах, в реакционной смеси следующего состава: 5 мкл раствора ферментов; 50 мкл 0,002 % раствора тетрадеканаля; 50 мкл 0,5 мМ раствора ФМН; 200 мкл 0,05 М калий фосфатного буфера, рН 6,8; 200 мкл 0,4 мМ раствора НАДН. В кювету биолюминометра вносили последовательно все компоненты реакционной смеси, быстро перемешивали, помещали кювету в биолюминометр и регистрировали величину максимальной интенсивности свечения Imax. При измерении активности иммобилизованных ферментов вместо раствора ферментов вносили иммобилизованные ферменты, приготовленные в форме диска на лавсановой подложке.
Измерения проводили на оборудовании, закупленном в СФУ по программе развития Сибирского федерального университета, а именно мультимодальном планшетном ридере LB 941 TriStar I (Berthold Technologies, Германия), портативном люминометре Junior LB 9509 (Berthold Technologies, Германия), а также биолюминометрах фирмы «Terner BioSystens» (USA) и BLM 8801, изготовленном в СКТБ «Наука» КНЦ СО РАН (Красноярск) и соединенным с регистратором 2210 фирмы «LKB» (Швеция), закупленных по программе НОЦ «Енисей».
2.2. Методы изучения кинетических параметров работы ферментов в вязких растворах сахарозы и глицерина.
Для понимания процессов поведения ферментативной люминесцентной системы светящихся бактерий в условиях близких к in vivo изучено влияние определенной гетерогенной среды на биферментную систему НАДН:ФМН-оксидоредуктаза-люцифераза.
В ходе биферментной биолюминесцентной реакции регистрировали следующие кинетические параметры: интенсивность свечения, константу спада и квантовый выход. Максимум интенсивности свечения (Imax) характеризует начальную скорость и концентрацию фермент-субстратных комплексов, образуемых в ходе биферментной реакции. Спад биолюминесценции определяет скорость распада фермент-субстратного комплекса и во времени подчиняется экспоненциальному закону. Константа спада биолюминесценции (kcn) вычисляется по спаду свечения от 80% до 20 % от максимальной интенсивности: kcn=(lnI80-lnI20)/t. Общее число квантов Q= Imax/kсn пропорционально общему числу молекул фермент-субстратного комплекса, распавшихся с излучением.
Активность растворимой биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза определяли по величине максимальной интенсивности свечения Imax, выраженной в милливольтах, в реакционной смеси следующего состава: 5 мкл раствора ферментов; 50 мкл 0,002 % раствора тетрадеканаля; 50 мкл 0,5 мМ раствора ФМН; 200 мкл 0,05 М калий фосфатного буфера, рН 6,8; 200 мкл 0,4 мМ раствора НАДН. В кювету биолюминометра вносили последовательно все компоненты реакционной смеси, быстро перемешивали, помещали кювету в биолюминометр и регистрировали величину максимальной интенсивности свечения Imax.
Для реализации поставленной задачи был проведен ряд экспериментов, в ходе которых были получены наборы кинетических характеристик бактериальных биолюминесцентных систем НАДН:ФМН-оксидоредуктаза-люцифераза.
Оптимизация микроокружения была достигнута за счет подбора соответствующих реакционных сред: различных концентраций вязких растворителей. В качестве органических растворителей для варьирования вязкости реакционной среды использовали сахарозу и глицерин. С целью исследования взаимосвязи вязкости среды с эффектом используемых растворителей и кинетическими параметрами биолюминесцентной реакции фосфатный буфер заменяли на водно-органическую смесь, содержащую необходимую концентрацию органического компонента, которую получали из исходных концентрированных растворов исследуемых веществ путем разведения. Конечные концентрации органических растворителей выражали в молях.
Как правило, каждый эксперимент проводили не менее чем в трех повторностях. Статистическая обработка полученных экспериментальных результатов проводилась методом наименьших квадратов с использованием пакета программ Excel for Windows-XP. Разброс полученных значений не превышал 5-15%.
Предлагаемые методы и подходы является оригинальными, никем ранее не использованными, соответствуют мировому уровню исследования в области биофизики.
2.3. Способы получения иммобилизованных ферментов.
Иммобилизацию НАДН:ФМН-оксидоредуктазы и люциферазы в крахмальный гель проводили следующим образом: 5 мл крахмального геля различной процентной концентрации кипятили до прозрачности, остужали до 300С, в гель вводили 0,25 мл раствора ферментов. Полученную смесь дозировали микропипеткой по 50 мкл на лавсановую подложку и высушивали в течение 12 часов при температуре 40С.
Иммобилизацию НАДН:ФМН-оксидоредуктазы и люциферазы в желатиновый гель проводили аналогичным образом: 5 мл 5 % желатинового геля нагревали до полного растворения желатина, фильтровали раствор желатина через 2 слоя фильтровальной бумаги, остужали до 300С, в гель вводили 0,25 мл раствора ферментов. Полученную смесь дозировали микропипеткой по 50 мкл на лавсановую подложку и высушивали в течение 12 часов при комнатной температуре.
Выход активности иммобилизованных ферментов рассчитывали как отношение максимальной интенсивности свечения иммобилизованного препарата и максимальной интенсивности свечения ферментов в растворе. При многокомпонентной иммобилизации вместе с ферментами в гель вводили растворы субстратов.
Иммобилизованный реагент представлял собой диск диаметром 7-8 мм, толщиной 50-60 микрон, сухой вес 9 мг.
Раздел 3. Изучение условий для создания прототипов физико-химических моделей функционирования ферментов в клетке на примере светящихся бактерий.
3.1. Выбор микроокружения с использованием растворов различной вязкости, близкого к условиям работы ферментов in vivo, сохранении активности и субстратной специфичности ферментов.
Люциферазы из разных видов светящихся бактерий катализируют биолюминесцентную реакцию, одним из продуктов которой является свет [27]. Способность люцифераз трансформировать энергию химических связей в световую и определяет пристальный интерес исследователей к этому ферменту. Ферментативная диагностика на основе бактериальных люцифераз используется для мониторинга окружающей среды, контроля чистоты воздуха, качество природных и сточных вод, в медицине и гигиене, в сельском хозяйстве и пищевой промышленности [7, 19, 28]. Этим и определяется практический интерес к результатам фундаментальных исследований в области структурно-функциональной организации люцифераз.
Структурно-динамическая организация белков является одной из фундаментальных проблем современной биофизики и биохимии. Для направленного изменения свойств и структуры белка одним из перспективных подходов является ‘дизайн среды’, который предполагает многообразие методов и подходов для изменения физико-химических характеристик реакционной среды для катализа в средах с различным содержанием воды. Изучение “эффектов среды” на ферментативные реакции в настоящее время широко применяется к изучению механизмов ферментативного катализа. Моделирование физико-химических характеристик реакционной среды (вязкость, гидрофобность, диэлектрическая проницаемость, рН, ионную силу и т.д. ) для ферментативного катализа, путем введения органических растворителей, в последнее время получило широкое распространение, поскольку позволяет моделировать многие биохимические процессы, например, функционирование белка в условиях, близких к естественным (in vivo), а также получить информацию о ферментах зачастую не доступных в рамках традиционной энзимологии [29-35]. Одной из наиболее важных физико-химических характеристик реакционной среды для ферментативного катализа является вязкость.
На данном этапе работы было проведено сравнительное изучение влияния вязкости реакционной среды на биферментную биолюминесцентную бактериальную систему НАДН:ФМН-оксидоредуктаза-люцифераза и биолюминесцентную реакцию, катализируемую одним ферментом – бактериальной люциферазой, выделенной из разных видов светящихся бактерий.
Было изучено влияние вязкости реакционной среды на величину кинетических параметров биферментной биолюминесцентной реакции: интенсивность свечения, константу спада, квантовый выход.
3.1.1. Особенности функционирования моноферментной биолюминесцентной системы.
Биолюминесценция – это хемилюминесцентная реакция, в которой химическая энергия превращается в световую. Это уникальный параметр жизнедеятельности, который может быть успешно использован для получения интегральных характеристик сложных сред, экосистем, целого организма. В основе преобразования энергии в биолюминесцентных системах лежит каталитическое окисление восстановленных субстратов – люциферинов специфическими ферментами – люциферазами. Наиболее доступной является бактериальная биолюминесценция. Люциферазы из разных видов светящихся бактерий отличаются по своим физическим и каталитическим свойствам, но все они катализируют одну и ту же реакцию:
ФМН Н2 + RCHO + O2 ![]() ФМН + RCOOH + Н2О + h, (3.1)
ФМН + RCOOH + Н2О + h, (3.1)
где ФМН и ФМНН2 – окисленная и восстановленная форма флавинмононуклетида, RCOH и RCOOH – длинноцепочечный алифатический альдегид и соответствующая жирная кислота, h – квант света. Светоизлучение наблюдается в сине-зеленой части видимого спектра с максимумом 478-505 нм. Представленная реакция является моноферментной. Структура субстратов и продуктов реакции, катализируемой бактериальной люциферазой представлены на рисунке 3.1.1.
Способы измерения активности моноферментной биолюминесцентной системы имеют отличительную особенность: время, требуемое для одного каталитического цикла системы намного больше, чем время жизни одного из субстратов реакции - ФМНН2, который автокаталитически окисляется кислородом менее чем за 1 сек:
ФМНН2 + O2 ФМН + H2O2, (3.2)
Поэтому в условиях запуска реакции одной порцией предварительно восстановленного ФМН фермент успевает совершить всего один оборот. Наблюдается люминесцентная вспышка, затухающая по экспоненте (рисунок 3.1.2).

Рисунок 3.1.1 - Структура субстратов и продуктов реакции, катализируемой бактериальной люциферазой: 1- ФМНН2, 2- ФМН, 3- тетрадеканаль, 4- миристиновая кислота
Второй субстрат – RCHO подвержен медленному неферментативному окислению, и скорость окисления зависит от температуры и начальной концентрации. При комнатной температуре раствор альдегида, используемый для измерения биолюминесценции, стабилен в течение 8 часов. Неферментативное окисление альдегида в отличие от ФМНН2 не оказывает влияния на ход люминесцентной реакции, поскольку его скорость значительно меньше скорости ферментативного окисления. Все бактериальные люциферазы проявляют биолюминесцентную активность с альдегидами, длина цепи которых от восьми до шестнадцати углеродов. Существует предположение, что сродство альдегида к люциферазе обусловлено гидрофобными взаимодействиями между каждым участком алифатической цепи альдегида и гидрофобными группами фермента. Благодаря этому с увеличением длины углеродной цепи альдегид прочнее связывается с люциферазой. Это обеспечивает бльшую эффективность превращения химической энергии в световую. Однако эту гипотезу нельзя считать всеобъемлющей, поскольку не для всех люцифераз соблюдается монотонная связь параметров биолюминесцентной реакции с длиной цепи альдегида. Специфичность люцифераз к альдегидам проявляется в том, что другие алифатические длинноцепочечные соединения (кетоны, кислоты, спирты) не обнаруживают с люциферазой биолюминесцентной активности, хотя не исключено, что они реагируют с ней без излучения.
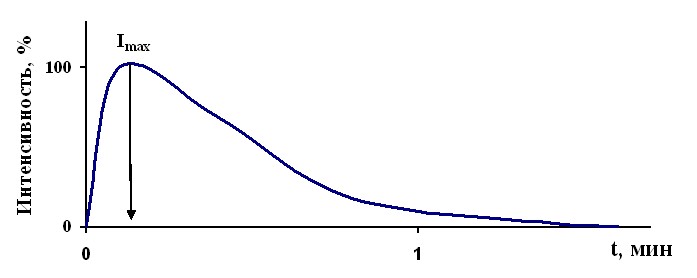
Рисунок 3.1.2 - Кинетика моноферментной биолюминесцентной реакции люцифераз
Следует отметить, что альдегиды крайне мало растворяются в воде, поэтому исследователи работают не с истинными растворами, а с эмульсией, действующая концентрация которой определяется способом приготовления (диспергирование ультразвуком, дополнительное встряхивание, предварительное растворение альдегида в спиртах). Видимо, этими причинами объясняется столь широкий диапазон значений константы Михаэлиса, полученные разными авторами для разных люцифераз: Кm люциферазы Р.leiognathi по отношению к деканалю в 10 раз превышает эту константу люциферазы V.harveyi. Существует предположение, что сродство альдегида к люциферазе обусловлено гидрофобными связями между каждым участком алифатической цепи альдегида и гидрофобными группами фермента. Благодаря этому с увеличением длины углеродной цепи альдегид прочнее связывается с люциферазой. Эту гипотезу Ватанабе нельзя признать всеобъемлющей, поскольку не для всех люцифераз соблюдается монотонная связь параметров биолюминесценции с длиной цепи альдегида. Специфичность люцифераз к альдегидам проявляется в том, что другие алифатические длинноцепочечные соединения (кетоны, кислоты, спирты) не обнаруживают с люциферазой биолюминесцентной активности, хотя не исключено, что они реагируют с ней без излучения.
3.1.2. Кинетические особенности функционирования биферментной системы НАДН:ФМН-оксидоредуктаза-люцифераза.
Любые ферменты, катализирующие синтез субстратов люциферазы, могут образовывать с ней сопряженную ферментную систему. Одной из первых была исследована и описана сопряженная ферментная система НАД(Ф)Н:ФМН-оксидоредуктаза-люцифераза, осуществляющая следующую цепь ферментативных реакций:
ФМН + НАД(Ф)H + ФМН H2 + НАД(Ф), (3.3)

