Министерство сельского хозяйства Российской Федерации
Федеральное государственное образовательное учреждение
высшего профессионального образования
«Московская государственная академия ветеринарной медицины и биотехнологии имени К. И. Скрябина» (ФГОУ ВПО МГАВМиБ)
| УДК 544.7 № госрегистрации 01200961265 Инв. № 59-11-15 | «УТВЕРЖДАЮ» Ректор ФГОУ ВПО МГАВМиБ, академик РАСХН, профессор ______________Ф.И. Василевич «___» июня 2011 г. |
ОТЧЕТ о научно-исследовательской работе
Проведение научных исследований коллективами научно-образовательных центров в области коллоидной химии и поверхностных явлений.
по теме:
РАЗРАБОТКА МЕТОДИК И СОЗДАНИЕ БИОХИМИЧЕСКИХ КОЛЛОИДНЫХ СИСТЕМ ДЛЯ ВЕТЕРИНАРНО-БИОЛОГИЧЕСКИХ И ЗООТЕХНИЧЕСКИХ
НАПРАВЛЕНИЙ
(итоговый этап №6)
«Обобщение и оценка результатов теоретических и экспериментальных
исследований по теме НИР»
Государственный контракт от «07» июля 2009 г. № 02.740.11.0270 в рамках ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы
Мероприятие 1.1 Проведение научных исследований коллективами научно-образовательных центров.
Руководитель проекта,
академик РАСХН, д.с/х.н., проф. ___________ Н.А. Балакирев
«__» июня 2011 г.
Москва 2011
Список основных исполнителей
| Проректор по НР, академик РАСХН, д.с./х.н., проф. | ____________ подпись, дата | Н.А. Балакирев Раздел 6.1 |
| Зав. кафедрой, д.х.н., д.б.н., проф. | ____________ подпись, дата | С. Ю. Зайцев Раздел 6.1-6.6 |
| Проф., д.х.н | ____________ подпись, дата | М. С. Царькова Раздел 6.1, 6.6 |
| Доцент, к.х.н. | ____________ подпись, дата | Л.А. Фролова Раздел 6.5 |
| Доцент, к.х.н. | ____________ подпись, дата | О.С. Белоновская Раздел 6.2.3, 6.3.3 |
| Доцент, к.б.н. | ____________ подпись, дата | А.А. Лисицына Раздел 6.5 |
| Старший научный сотрудник, к.б.н | ____________ подпись, дата | Л.А. Закирова Раздел 6.4.,6.6 |
| Аспирант | ____________ подпись, дата | Е. Н. Зарудная Раздел 6.2, 6.3, 6.5 |
| Аспирант | ____________ подпись, дата | М.Н. Шапошников Раздел 6.1 |
| Зав. уч. лабораторией к.б.н. | ____________ подпись, дата | И.В. Милаева Раздел 6.2.4, 6.3.4 |
| Аспирант | ____________ подпись, дата | Н.А. Довженко Раздел 6.2.3, 6.3.3 |
| Аспирант | ____________ подпись, дата | Н.А.Ткачев Раздел 6.1 |
| Студентка | ____________ подпись, дата | Д.О. Соловьева Раздел 6.1 |
| Инженер | ____________ подпись, дата | Е.В. Баннова Раздел 6.4.1 |
| Нормоконтролер | ____________ подпись, дата | Е.Ю. Любинская Раздел 6.4.2 |
| Старший лаборант | ____________ подпись, дата | Н.С. Епихина Раздел 6.2.3 |
СОДЕРЖАНИЕ
| Реферат ……………………………………………………………………………………….…….. | 5 |
| 6.1.Разработка методов и получение МКС для определения ряда аминокислот спектральными методами. Сравнительный анализ спектров поглощения и флуоресценции хемосенсорных материалов на основе таких МКС……………………………..………………. | 10 |
| 6.1.1. Спектральные характеристики ОМС №5, иммобилизованного в полимерные матрицы, при взаимодействии с аминокислотами…………………………..……………………………… | 10 |
| 6.1.2. Исследование монослоев ОМС № 5 со стеариновой кислотой в присутствии лизина…. | 25 |
| 6.2. Сравнительный анализ показателей ДПН биологических жидкостей животных разных видов.…………………………..…………………………..…………………………..……………. | 27 |
| 6.2.1. Сравнительный анализ показателей ДПН сыворотки крови крупного рогатого скота в разные сроки постнатального онтогенеза…………………………..……………………………. | 28 |
| 6.2.2. Сравнительный анализ показателей ДПН сыворотки крови свиней в ранние сроки постнатального онтогенеза…………………………..…………………………..………………… | 31 |
| 6.2.3. Сравнительный анализ показателей ДПН сыворотки крови собак с полом и возрастом | 33 |
| 6.2.4. Сравнительный анализ показателей ДПН сыворотки крови лошадей в разные сроки постнатального онтогенеза…………………………..…………………………..………………… | 34 |
| 6.2.5. Сравнительновидовой анализ ДПН биологических жидкостей животных..……………. | 38 |
| 6.3. Анализ влияния отдельных компонентов сыворотки крови животных на ДПН и применение БКС в ветеринарно-биологическом направлении…………………………..…… | 38 |
| 6.3.1. Сравнительный анализ биохимических показателей сыворотки крови крупного рогатого скота в разные сроки постнатального онтогенеза и корреляционный анализ между параметрами ДПН и биохимическими показателями сыворотки крови крупного рогатого скота…………………………..…………………………..…………………………..……………. | 39 |
| 6.3.2. Сравнительный анализ показателей биохимических показателей сыворотки крови свиней в разные сроки постнатального онтогенеза и корреляционный анализ между параметрами ДПН и биохимическими показателями сыворотки крови свиней……………… | 48 |
| 6.3.3. Сравнительный анализ показателей ДПН сыворотки крови собак с полом и возрастом и корреляционный анализ между параметрами ДПН и биохимическими показателями сыворотки крови собак…………………………..…………………………..…………………….. | 53 |
| 6.3.4. Сравнительный анализ биохимических показателей сыворотки крови лошадей в разные сроки постнатального онтогенеза и корреляционный анализ между параметрами ДПН и биохимическими показателями сыворотки крови лошадей……………………………. | 57 |
| 6.3.5. Применение БКС в ветеринарно-биологическом направлении………………………….. | 67 |
| 6.3.6. Изменение ряда биохимических и зоотехнических показателей у кур под действием естественного метаболита – коламин на при двукратном использовании препарата………… | 86 |
| 6.4. Обобщение результатов предыдущих этапов работ. Оценка полноты решения задач и эффективности полученных результатов в сравнении научно-техническим уровнем………. | 91 |
| 6.4.1 Итоги НИР по результатам исследований, проведенных за период 2009-2011 г………. | 92 |
| 6.4.2 Оценка полноты решения поставленных задач по результатам НИР……………………. | 96 |
| 6.4.3 Оценка эффективности полученных результатов в сравнении с современным научно-техническим уровнем…………………………..…………………………..……………………… | 97 |
| 6.5. Анализ апробации результатов по разработке модельных систем и сравнительной оценке данных ДНП для модельных систем и биологических жидкостей в учебном процессе…………………………..…………………………..…………………………..………… | 98 |
| 6.5.1. Внедрение результатов НИР в календарно-тематические планы дисциплин, преподаваемых на кафедре органической и биологической химии МГАВМиБ………………. | 98 |
| 6.5.2. Программа внедрения результатов VI этапа НИР в предстоящий с сентября 2011 г. образовательный процесс по направлению 020400 Биология (бакалавриат и магистратура) по Федеральным государственным образовательным стандартам высшего профессионального образования 3-го поколения. …………………………..………………….. | 101 |
| 6.6 Оценка возможности создания конкурентоспособной продукции и разработка рекомендаций по использованию результатов проведенных НИР…………………………….. | 105 |
| 6.6.1 Оценка возможности создания конкурентоспособной продукции……………………… | 105 |
| 6.6.2 Разработка рекомендаций по использованию результатов опытов по влиянию препарата коламин на эмбриональное и постэмбриональное развитие цыплят-бройлеров. …………………………………………..…………………………..………… | 108 |
| 6.6.3 Разработка рекомендаций по использованию результатов проведенных НИР………… | 109 |
| Список использованных источников………………………………………………………..…... | 110 |
| Приложения…………………………………………………………………………………….…. | 112 |
| Приложение 1. Статьи в научных журналах……………………………….………………….…. | 113 |
| Приложение 2. Монографии и учебно-методические пособия……………………………….… | 117 |
| Приложение 3. Материалы конференций………………………………………………………… | 118 |
| Приложение 4. Патенты и ноу-хау………………………………………………………………... | 122 |
Реферат
Отчет 122 с., 6 ч., 26 рис., 46 табл., 4 приложения.
Ключевые слова: биохимические коллоидные системы, мембранные коллоидные системы, полимеры, полимерные матрицы, иммобилизованные ОМС, супрамолекулярные ферментные комплексы, коллоидно-химические свойства, белки, хемосенсорные материалы, спектры поглощений, спектр флуоресценции, динамическое поверхностное натяжение, сыворотка крови, спектральные методы.
Объекты исследования и разработки. МКС для определения ряда аминокислот спектральными методами. Хемосенсорные материалы на основе таких МКС. Спектры поглощения и флуоресценции хемосенсорных материалов на основе МКС. Состав и свойства биологических жидкостей разных видов животных, связанные с физиологическим состоянием животных, активацией и изменением интенсивности обмена веществ в период роста, полового и физиологического созревания. Показатели ДПН биологических жидкостей животных разных видов. Влияние отдельных компонентов биологических жидкостей животных на значения ДПН. Применение БКС в ветеринарно-биологическом направлении. Разработка модельных систем, имитирующих состав биологических жидкостей животных и сравнительная оценка данных ДПН для модельных систем и биологических жидкостей. Использование результатов НИР в учебном процессе.
Цели работы
- Разработка методов и получение МКС для определения ряда аминокислот спектральными методами, в том числе проведение сравнительного анализа спектров поглощения и флуоресценции хемосенсорных материалов на основе таких МКС;
- Сравнительный анализ показателей ДПН биологических жидкостей животных разных видов, находящихся на разных фазах постнатального онтогенеза в зависимости от пола, возраста и периода репродуктивного цикла;
- Сравнительновидовой анализ ДПН биологических жидкостей животных;
- Сравнительный анализ биохимических показателей сыворотки крови разных видов животных в зависимости от возраста, пола и функционального состояния организма,
- Анализ влияния отдельных компонентов сыворотки крови животных разных видов на показатели ДПН, в том числе, корреляционный анализ между параметрами ДПН и биохимическими показателями сыворотки крови животных;
- Применение БКС в ветеринарно-биологическом направлении;
- Изучение изменения ряда биохимических и зоотехнических показателей у кур под действием естественного метаболита – коламин при двукратном использовании препарата;
- Обобщение результатов предыдущих этапов работ. Оценка полноты решения задач и эффективность полученных результатов в сравнении с научно-техническим уровнем;
- Анализ апробации результатов по разработке модельных систем и сравнительной оценке данных ДНП для модельных систем и биологических жидкостей в учебном процессе;
- Оценка возможности создания конкурентоспособной продукции и разработка рекомендаций по использованию результатов проведенных НИР.
Метод и методология проведения работы включали:
разработку методов получения МКС для определения ряда аминокислот спектральными методами; сравнительный анализ спектров поглощения и флуоресценции хемосенсорных материалов на основе таких МКС; сравнительный анализ показателей ДПН биологических жидкостей животных разных видов; анализ влияния отдельных компонентов сыворотки крови животных на ДПН и применение БКС в ветеринарно-биологическом направлении; обобщение результатов предыдущих этапов работ; оценку полноты решения задач и эффективности полученных результатов в сравнении с научно-техническим уровнем; анализ апробации результатов по разработке модельных систем и сравнительной оценке данных ДНП для модельных систем и биологических жидкостей в учебном процессе; оценку возможности создания конкурентоспособной продукции и разработку рекомендаций по использованию результатов проведенных НИР.
В работе использованы следующие физико-химические методы исследования: измерение ДПН методом максимального давления в пузырьке; биохимический анализ; корреляционный анализ; измерение спектров поглощения; измерение спектров флуоресценции, измерение биохимических показателей крови.
Результаты работы
По итогам НИР были получены следующие результаты:
- Разработаны методы получения МКС типа тонких пленок и монослоев (ОМС №5:С18=1:2) для возможной детекции аминокислот. Показана возможность использования полученных материалов для определения аминокислот, при этом предпочтительным методом для исследований МКС стал метод флуоресцентной спектроскопии.
- Сравнительный анализ показателей ДПН сыворотки крови физиологически здоровых животных 4 видов (крупный рогатый скот, свиньи, собаки и лошади) выявил характерные изменения ДПН в зависимости от возраста, пола и функционального состояния животных. Для коров наиболее низкие значения ДПН при больших временах «существования» поверхности отмечаются у стельных животных в период лактации (56,80-58,97 мН/м), для этих же животных характерные наиболее высокие коэффициенты наклона тензиограммы (0 - 5,47-7,30 мНм-1с-1/2; 1 - 7,98-9,14 мНм-1с1/2). Для свиней наиболее характерные особенности в динамике ДПН отмечаются для поросят в возрасте 20 суток, а наиболее специфичным параметром, зависящим от возраста, является ДПН при больших временах «существования» поверхности. У собак и лошадей половые особенности наиболее характерно прослеживаются при сравнении коэффициентов наклона тензиограммы, что обусловлено разным соотношением ПАВ и других соединений сыворотки крови кобелей и сук с возрастом.
- Сравнительновидовой анализ данных выявил общие закономерности в формировании ДПН, для которых характерно плавное снижение значений ДПН с увеличением времени «существования» поверхности. При этом каждому виду животных присущи особенности в динамике ДПН, связанные с генетически-заложенными особенностями физиолого-биохимического статуса организма, активацией и изменением интенсивности обмена веществ в период роста, полового и физиологического созревания, а также с наступлением и течением беременности;
- Сравнительный анализ биохимических показателей сыворотки крови животных на разных сроках постнатального онтогенеза выявил физиологические особенности для животных разного вида, пола и возраста, а также с течением беременности и лактации, что может объясняться, как внутренними физиологическими (функциональное состояние нервной, гормональной и др. систем организма), так и внешними (уровень физической нагрузки, стресс и другие) факторами. Полученные данные закономерно отражают возраст и функциональное состояние животных и наблюдаемые изменения в значениях ДПН сыворотки крови.
- Корреляционный анализ между ДПН и биохимическими показателями сыворотки крови животных выявил сильные взаимосвязи между отдельными компонентами сыворотки крови и параметрами ее ДПН. Было доказано, что для крупного рогатого скота на параметр ДПН при средних временах «существования» поверхности (2) наибольшее влияние оказывают общий белок, альбумины, общий холестерол, триацилглицеролы и глюкоза, а также кальций и мочевина, а параметр ДПН при больших временах «существования» поверхности (3) - общий белок, альбумины и холестерол. У свиней на 2 наибольшее влияние оказывает общий белок и триацилглицеролы, а на 3 – общий белок, альбумины, триацилглицеролы и мочевина. У собак на параметры 2 и 3 наибольшее влияние оказывают общий белок, альбумины и неорганический фосфор, которые их понижают. Для лошадей на ДПН при средних временах наиболее существенно влияют триацилглицеролы, а при больших временах: у кобыл - глюкоза, калий, триацилглицеролы, которые значения ДПН понижают, а также хлорид-ионы и холестерол, которые их повышают, у жеребцов - белки (общий белок и альбумины), увеличение концентрации которых вызывает понижение ДПН, а также калий, который их повышает.
- В двухкомпонентных смесях добавление хлорида натрия или БСА к смеси везикул приводит к снижению параметров ДПН 2 и 3; в трехкомпонентных смесях добавление БСА к раствору везикул вызывает снижение значений 2 и 3, а добавление хлорида натрия это снижение уменьшает. Полученные данные являются наглядной моделью, демонстрирующей процессы взаимодействия основных компонентов (белков, липидов, солей) в биологических жидкостях животных;
- Проведенные исследования позволяют говорить о взаимосвязи изменений параметров ДПН с биохимическими показателями сыворотки крови животных, что свидетельствует о возможности использования метода межфазной тензиометрии в комплексе с обычными клиническими исследованиями для оценки физиолого-биохимического статуса организма животных при ведении племенной работы, в период проведения массовых вакцинаций и осеменения животных, для ранней диагностики отклонений физиолого-биохимического статуса от нормы при заболеваниях различной этиологии и контроля за их лечением.
Рекомендации по внедрению результатов НИР
Разработка методик и создание биохимических коллоидных систем с использованием современных методических и инструментальных достижений позволяет решить ряд актуальных фундаментальных проблем в области коллоидной химии и поверхностных явлений, а также прикладных задач биомедицины и экологии, нано- и биотехнологии, ветеринарии и зоотехнии. БКС на основе мембран и тонких пленок позволят создать нанокомпозитные материалы для хемосенсорных устройств биологического контроля катионов биогенных металлов и малых органических молекул в воде и биологических жидкостях.
Все вышеизложенное является неотъемлемой частью научно-технического прогресса в развитии животноводства на современном этапе и будет реализовано в данной НИР на базе достижений коллоидной химии.
Выполнение НИР обеспечит достижение научных результатов мирового уровня в решении многих актуальных фундаментальных и прикладных проблем химии и биологии, медицины и экологии, нано- и биотехнологии, ветеринарии и зоотехнии; позволит завершить создание комплексной системы подготовки высококвалифицированных специалистов (от бакалавров и магистров до кандидатов и докторов наук), обладающих особыми компетенциями по профилю данной НИР, что приведет к формированию эффективного и жизнеспособного научного коллектива.
Область применения полученных результатов.
Результаты проекта включены в образовательную программу ФГОУ ВПО МГАВМиБ и использоваться в образовательном процессе на базе научного кадрового потенциала, лабораторного и испытательного оборудования научно-образовательного центра ФГОУ ВПО МГАВМиБ, в том числе в процессе проведения настоящих научно-технических работ.
Новые БКС, разработанные на основе полимеров разного типа, находят применение в медицине человека и животных, нано- и биотехнологии, экологии. Полученные результаты являются ключевыми для успешного выполнения всего проекта.
Прогнозные предположения о развитии объекта исследования.
В процессе проведения НИР были разработаны технологические параметры БКС и методические рекомендации по их использованию для различных областей применения, в том числе: экспериментальные образцы; методики испытаний экспериментальных образцов; технологии получения биохимических коллоидных систем.
В ходе выполнения НИР были получены результаты интеллектуальной деятельности: патенты, ноу-хау; статьи; монографии; учебно-методические комплексы, включающие учебно-методические пособия, указания и рекомендации; примерные и рабочие учебные программы, практикумы по дисциплинам «Биохимия мембран», «Физическая и коллоидная химия», «Кинетика и термодинамика ферментативных реакций», «Энзимология», «Биоэнергетика», «Бионанотехнология» и другие.
6.1. Разработка методов и получение МКС для определения аминокислот спектральными методами. Сравнительный анализ спектров поглощения и флуоресценции хемосенсорных материалов на основе таких МКС
6.1.1. Спектральные характеристики МКС на примере оптического молекулярного сенсора №5, иммобилизованного в полимерные матрицы, при взаимодействии с аминокислотами
На предыдущих этапах НИР были разработаны методы и получены МКС для определения катионов металлов и диаминов. На 6 этапе была исследована возможность определения ряда аминокислот в водных растворах с помощью оптического молекулярного сенсора №5, иммобилизованного в матрицы на основе различных полимеров: поливинилбутираля (ПВБ), целлюлозы ацетатфталата (ЦАФ), целлюлозы ацетатгидрофталата (ЦАГФ), целлюлозы ацетатбутирата (ЦАБ). В качестве аминокислот применяли глицин, фенилаланин, аланин, серин, аргинин и изолейцин.
Для приготовления растворов полимеров и ОМС в качестве растворителя использовались: ацетонитрил, дихлорэтан, ацетон. Спектры поглощения и флуоресценции снимали на спектрофотометре HITACHI 330 и спектрофлуориметре SHIMADZU RF 5000, с применением кварцевых стекол (для пленок).
Исследовались спектры поглощения и флуоресценции ОМС №5 до и после (в течение 30 мин.) воздействия водного раствора соответствующей аминокислоты с концентрацией 1 мМ в области 300-700 нм. Как следует из литературных данных, об образовании супрамолекулярных комплексов краун-эфира и катиона металла (комплексы типа «гость-хозяин») судят по сдвигу максимума длины волны поглощения и/или флуоресценции, а иногда - по изменению интенсивности.
На рисунках 1-7 приведены спектры поглощения и флуоресценции хемосенсорных материалов из разных полимеров, после воздействия водного раствора серина.
 |
| Рисунок 1 - Спектр поглощения ОМС №5 в пленке ПВБ до (1) и после (2) контакта с раствором серина с концентрацией 1 мМ. |
Длина волны максимума поглощения ОМС №5 в матрице на основе ПВБ составляет 390 нм, а интенсивность – 0,465. После выдерживания в растворе серина длина волны максимума поглощения составила 390 нм, интенсивность -0,341. Сдвиг максимума поглощения не наблюдается. Обнаружено уменьшение интенсивности поглощения спектра ХМ на основе ПВБ с ОМС №5, как в области максимума (385 – 395 нм), так и в области минимума (330 – 340 нм).
 |
| Рисунок 2 - Спектр поглощения ОМС №5 в пленке ЦАФ до (1) и после (2) контакта с раствором серина с концентрацией 1 мМ. |
Длина волны максимума поглощения ОМС №5 в пленке ЦАФ составила 393 нм, интенсивность – 0,485. После выдерживания в растворе серина длина волны максимума поглощения ОМС №5 составила 400 нм, интенсивность – 0,496. Наблюдается сдвиг максимума поглощения ОМС №5 в пленке ЦАФ на 7 нм в длинноволновую область. Интенсивность поглощения ХМ на основе ЦАФ с ОМС №5 практически не изменилась, как в области максимума (390 – 400 нм), так и в области минимума (320 – 330 нм).
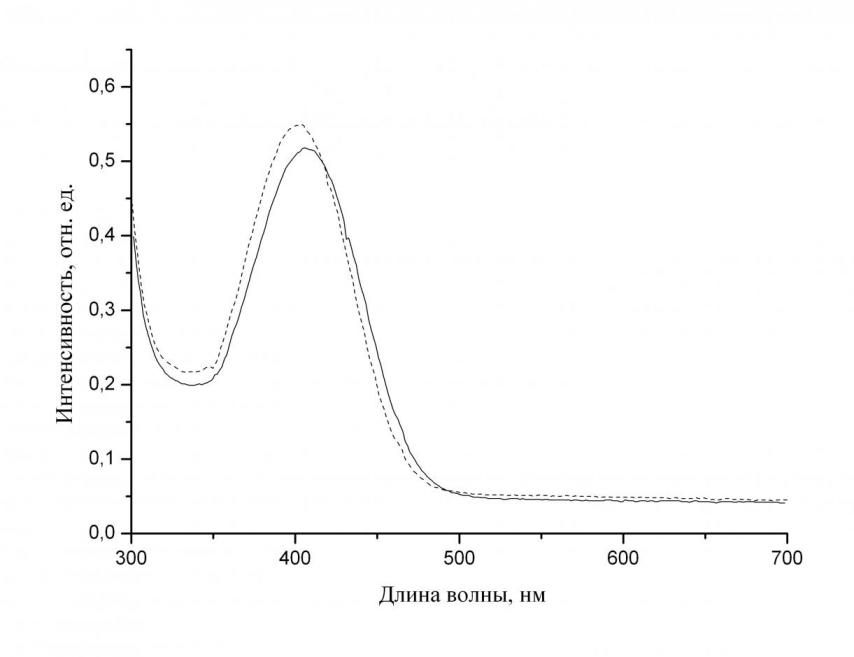 |
| Рисунок 3 - Спектр поглощения ОМС №5 в пленке ЦАГФ до (1) и после (2) контакта с раствором серина с концентрацией 1 мМ. |
Длина волны максимума поглощения ОМС №5 в пленке ЦАГФ составила 402 нм, интенсивность – 0,550. После выдерживания в растворе серина длина волны максимума поглощения ОМС №5 составила 407 нм, интенсивность – 0,517. Длина волны максимума поглощения ОМС №5 в пленке ЦАГФ изменилась на 5 нм в длинноволновую область, Обнаружено уменьшение интенсивности поглощения как в области максимума (400 – 410 нм), так и в области минимума (340 – 350 нм) спектра ХМ на основе ЦАГФ с ОМС №5.
 |
| Рисунок 4 - Спектр флуоресценции ОМС №5 в пленке ЦАФ до (1) и после (2) контакта с раствором серина (конц. 1 мМ). |
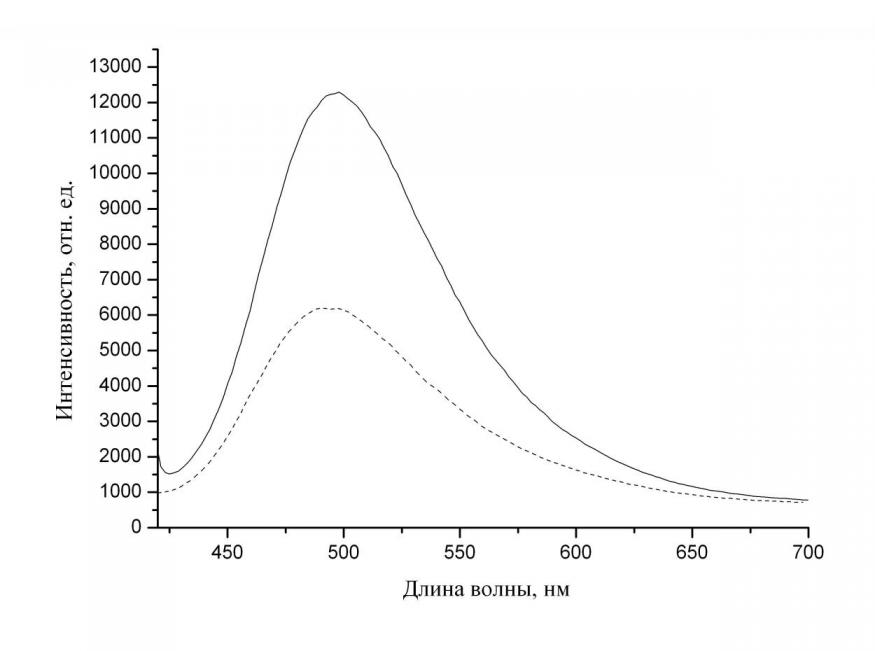 |
| Рисунок 5 - Спектр флуоресценции ОМС №5 в пленке ПВБ до (1) и после (2) контакта с раствором серина с концентрацией 1 мМ. |
Длина волны максимума флуоресценции ОМС №5 в пленке ПВБ составила 494 нм, интенсивность – 6224. После выдерживания в растворе серина длина волны максимума поглощения ОМС №5 составила 496 нм, интенсивность – 12300. Максимум поглощения ОМС №5 в пленке ПВБ сместился на 2 нм в длинноволновую область. Обнаружено увеличение интенсивности спектра флуоресценции ХМ на основе ПВБ с ОМС №5.
 |
| Рисунок 6 - Спектр флуоресценции ОМС №5 в пленке ЦАФ до (1) и после (2) контакта с раствором серина с концентрацией 1 мМ. |
Длина волны максимума поглощения ОМС №5 в пленке ЦАФ составила 514 нм, интенсивность – 10800. После выдерживания в растворе серина длина волны максимума поглощения ОМС №5 составила 523 нм, интенсивность – 6172. Наблюдается сдвиг максимума поглощения ОМС №5 в пленке ЦАФ на 9 нм в длинноволновую область. Интенсивность флуоресценции спектра ХМ на основе ЦАФ с ОМС №5 уменьшилась в области максимума флуоресценции (510 – 530 нм).
 |
| Рисунок 7 - Спектр флуоресценции ОМС №5 в пленке ЦАГФ до (1) и после (2) контакта с раствором серина с концентрацией 1 мМ. |
Длина волны максимума флуоресценции ОМС №5 в пленке ЦАГФ составила 505 нм, интенсивность – 10524. После выдерживания в растворе серина длина волны максимума поглощения ОМС №5 составила 519 нм, интенсивность – 10140. Максимум поглощения ОМС №5 в пленке ЦАГФ смещается на 14 нм в длинноволновую область. Обнаружено незначительное уменьшение интенсивности флуоресценции в области максимума (500 - 520 нм) спектра ХМ на основе ЦАГФ с ОМС №5.
На рисунках 8-12 приведены спектры поглощения и флуоресценции хемосенсорных материалов из разных полимеров, после воздействия водного раствора глицина.
 |
| Рисунок 8 – Спектр поглощения ОМС №5 в пленке ПВБ до (1) и после (2) контакта с раствором глицина с концентрацией 1 мМ. |
Длина волны максимума поглощения ОМС №5 в матрице на основе ПВБ составляет 394 нм, а интенсивность - 0,269. После выдерживания в растворе глицина длина волны максимума поглощения составила 397 нм, а интенсивность – 0,209. Наблюдается сдвиг максимума поглощения ОМС №5 на 3 нм в длинноволновую область. Обнаружено уменьшение интенсивности поглощения как в области максимума (390 – 400 нм), так и в области минимума (340 - 350 нм).
 |
| Рисунок 9 - Спектр поглощения ОМС №5 в пленке ЦАФ до (1) и после (2) контакта с раствором глицина с концентрацией 1 мМ. |
Длина волны максимума поглощения ОМС №5 в пленке ЦАФ составляет 393 нм, интенсивность – 0,508. После выдерживания в растворе глицина длина волны максимума поглощения ОМС №5 составила 399 нм, интенсивность – 0,477. Таким образом, максимум поглощения ОМС №5 сместился на 6 нм в длинноволновую область. Обнаружено уменьшение интенсивности как в области максимума (390 – 400 нм), так и в области минимума (320 – 330 нм) спектра ХМ на основе ЦАФ с ОМС №5.
 |
| Рисунок 10 - Спектр поглощения ОМС №5 в пленке ЦАГФ до (1) и после (2) контакта с раствором глицина с концентрацией 1 мМ. |
Длина волны максимума поглощения ОМС №5 в пленке ЦАГФ составила 401 нм, интенсивность – 0,359. После выдерживания в растворе глицина длина волны максимума поглощения ОМС №5 составила 408 нм, интенсивность – 0,359. Максимум поглощения ОМС №5 в пленке ЦАГФ сместился на 7 нм в длинноволновую область. Интенсивность поглощения спектра ХМ на основе ЦАГФ с ОМС №5 не изменилась, как в области максимума (400 – 410 нм), так и в области минимума (340 – 350 нм).
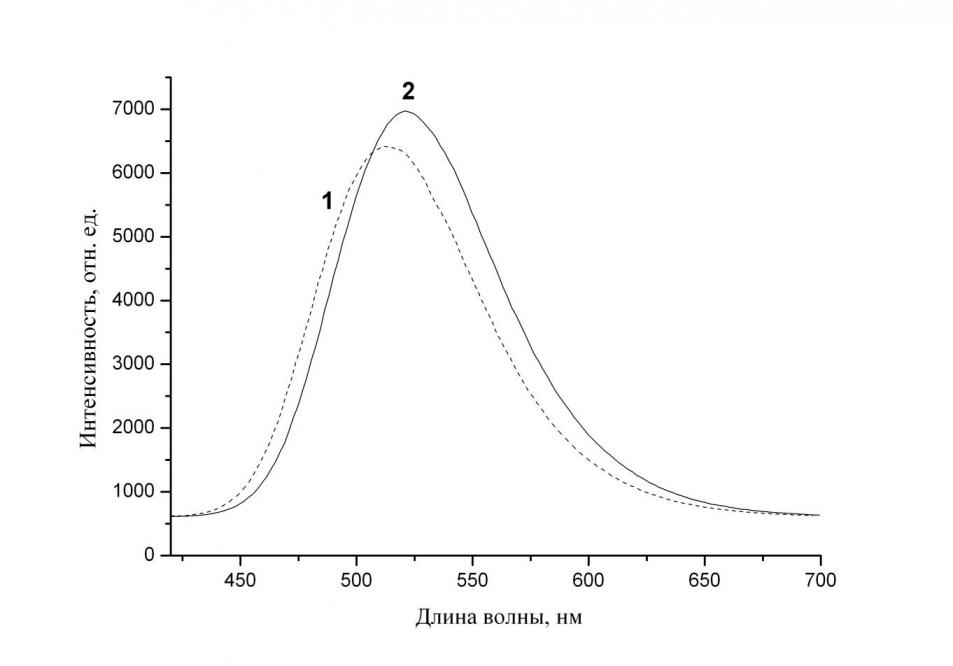 |
| Рисунок 11 - Спектр флуоресценции ОМС №5 в пленке ЦАФ до (1) и после (2) выдерживания в растворе глицина с концентрацией 1 мМ. |
Длина волны максимума флуоресценции ОМС №5 в пленке ЦАФ составила 514нм, интенсивность – 6410. После выдерживания в растворе глицина длина волны максимума поглощения ОМС №5 составила 521нм, интенсивность – 6980. Наблюдается сдвиг максимума поглощения ОМС №5 в пленке ЦАФ на 7 нм в длинноволновую область. Обнаружено увеличение интенсивности в области максимума флуоресценции (510 – 530 нм) спектра ХМ на основе ЦАФ с ОМС №5.
 |
| Рисунок 12 - Спектр флуоресценции ОМС №5 в пленке ЦАГФ до (1) и после (2) выдерживания в растворе глицина с концентрацией 1 мМ. |
Длина волны максимума флуоресценции ОМС №5 в пленке ЦАГФ составила 505 нм, интенсивность – 10832. После выдерживания в растворе глицина длина волны максимума поглощения ОМС №5 составила 520 нм, интенсивность – 10824. Наблюдается сдвиг максимума поглощения ОМС №5 в пленке ЦАГФ на 15 нм в длинноволновую область, интенсивность флуоресценции не изменилась.
На рисунках 13 – 17 приведены спектры поглощения и флуоресценции некоторых ХМ в присутствии аланина и фенилаланина.

Рисунок 13 - Спектр поглощения ОМС № 5 в пленке ЦАФ до (1) и после (2) контакта с раствором аланина с концентрацией 1 мМ.
Длина волны максимума поглощения ОМС № 5 в пленке ЦАФ составила 399 нм, интенсивность – 0,462. После выдерживания в растворе аланина длина волны максимума поглощения ОМС № 5 составила 405 нм, интенсивность – 0,431. Наблюдается сдвиг максимума поглощения ОМС № 5 в пленке ЦАФ на 6 нм в длинноволновую область, интенсивность поглощения изменилась незначительно.

Рисунок 14 - Спектр флуоресценции ОМС№ 5 в пленке ЦАФ до (1) и после (2) контакта с раствором аланина с концентрацией 1 мМ.
Длина волны максимума флуоресценции ОМС № 5 в пленке ЦАГФ составила 512 нм, интенсивность – 705. После выдерживания в растворе аланина длина волны максимума флуоресценции ОМС № 5 составила 524 нм, интенсивность – 558. Наблюдается сдвиг максимума флуоресценции ОМС № 5 в пленке ЦАГФ на 12 нм в длинноволновую область, интенсивность флуоресценции уменьшилась в 1,26 раз.

Рисунок 15 - Спектр поглощения ОМС № 5 в пленке ЦАФ до (1) и после (2) контакта с раствором фенилаланина с концентрацией 1 мМ.
Длина волны максимума поглощения ОМС № 5 в пленке ЦАФ составила 402 нм, интенсивность – 0,426. После выдерживания в растворе фенилаланина длина волны максимума поглощения ОМС № 5 составила 406 нм, интенсивность – 0,411. Наблюдается сдвиг максимума поглощения ОМС №5 в пленке ЦАФ на 4 нм в длинноволновую область, интенсивность поглощения практически не изменилась.

Рисунок 16 - Спектр флуоресценции ОМС №5 в пленке ЦАФ до (1) и после (2) контакта с раствором фенилаланина с концентрацией 1 мМ.

Рисунок 17 - Спектр флуоресценции ОМС № 5 в пленке ЦАФ до (1) и после (2) контакта с раствором фенилаланина с концентрацией 1 мМ.
Длина волны максимума флуоресценции ОМС № 5 в пленке ЦАФ составила 516 нм, интенсивность – 16604. После выдерживания в растворе фенилаланина длина волны максимума флуоресценции ОМС № 5 составила 521 нм, интенсивность – 9089. Наблюдается сдвиг максимума флуоресценции ОМС № 5 в пленке ЦАФ на 5 нм в длинноволновую область, интенсивность флуоресценции уменьшилась в 1,82 раза
На рисунках 18 – 22 приведены спектры поглощения и флуоресценции некоторых ХМ в присутствии аргинина и изолейцина.

Рисунок 18 - Спектр поглощения ОМС №5 в пленке ЦАФ до (1) и после (2) контакта с раствором аргинина с концентрацией 1 мМ.
Длина волны максимума поглощения ОМС 5 в пленке ЦАФ составила 402 нм, интенсивность – 0,430 (рис. 18). После выдерживания в растворе аргинина длина волны максимума поглощения ОМС 5 составила 406 нм, интенсивность – 0,400. Наблюдается сдвиг максимума поглощения ОМС 5 в пленке ЦАФ на 4 нм в длинноволновую область, интенсивность поглощения уменьшается на 0,030 отн. ед. (т.е. на 7%).

Рисунок 19 - Спектр флуоресценции ОМС №5 в пленке ЦАФ до (1) и после (2) контакта с раствором аргинина с концентрацией 1 мМ.
Длина волны максимума флуоресценции ОМС №5 в пленке ЦАФ составила 515 нм, интенсивность – 10651 (рис. 19). После выдерживания в растворе аргинина длина волны максимума флуоресценции ОМС 5 составила 524 нм, интенсивность – 7900. Наблюдается сдвиг максимума флуоресценции ОМС №5 в пленке ЦАФ на 9 нм в длинноволновую область, интенсивность флуоресценции уменьшилась в 1,34 раза.

Рисунок 20 - Спектр поглощения ОМС №5 в пленке ЦАГФ до (1) и после (2) контакта с раствором изолейцина с концентрацией 1 мМ.
Длина волны максимума поглощения ОМС №5 в пленке ЦАГФ составила 401 нм, интенсивность – 0,490 (рис. 20). После выдерживания в растворе изолейцина длина волны максимума поглощения ОМС №5 составила 405 нм, интенсивность – 0,516. Наблюдается сдвиг максимума поглощения ОМС №5 в пленке ЦАГФ на 4 нм в длинноволновую область, интенсивность поглощения увеличилась на 0,026 отн. ед. (рис. 20), что отличается от аргинина, где интенсивность уменьшается (рис. 18).

Рисунок 21 Спектр флуоресценции ОМС №5 в пленке ЦАФ до (1) и после (2) контакта с раствором изолейцина с концентрацией 1 мМ.
Длина волны максимума флуоресценции ОМС 5 в пленке ЦАФ составила 512 нм, интенсивность – 12480 (рис. 21). После выдерживания в растворе аргинина длина волны максимума флуоресценции ОМС №5 составила 520 нм, интенсивность – 13991. Наблюдается сдвиг максимума флуоресценции ОМС 5 в пленке ЦАФ на 8 нм в длинноволновую область, интенсивность флуоресценции возросла в 1,12 раза.

Рисунок 22 - Спектр флуоресценции ОМС №5 в пленке ЦАГФ до (1) и после (2) контакта с раствором изолейцина с концентрацией 1 мМ.
Проведенные исследования показали следующее. Вследствие малых сдвигов в системе ПВБ с ОМС №5 дальнейшие исследования этого ХМ нецелесообразны. Оптимальные результаты по связыванию ХМ с аминокислотами установлены для ОМС №5 в матрицах на основе эфиров целлюлозы – ЦАГФ и ЦАФ. Более выражены сдвиги максимума длины волны в спектрах флуоресценции (по сравнению со спектрами поглощения). Для примера в табл. 1 приведены сравнительные данные спектров поглощения и флуоресценции для аланина и фенилаланина (матрица ЦАГФ).
Таблица 1 - Характеристики спектров поглощения и флуоресценции для ХМ на основе ЦАГФ, содержащих ОМС №5, до и после выдерживания в растворах аланина и фенилаланина (концентрация аминокислот равна 1 мМ).
| аминокислота | аланин | фенилаланин | аланин | фенилаланин |
| вид спектра | поглощение | флуоресценция | ||
| , нм | +5 | +6 | +12 | +13 |
| I0/I | 1,05 | 1,06 | 0,87 | 1,08 |
Очевидно, что взаимодействие ОМС №5 с аминокислотами лучше характеризуется с помощью спектров флуоресценции.
Ниже в табл. 2 приведены данные спектров флуоресценции ХМ на основе ЦАФ и ОМС №5 до и после их контакта с исследованными аминокислотами.
Таблица 2 - Флуоресценция полимерных пленок на основе ЦАФ, содержащих ОМС № 5, до и после выдерживания в водных растворах аминокислот с концентрацией 1 мМ.
| Аминокислота | , нм, (до пропитки) | , нм, (после пропитки) | сдвиг, нм |
| глицин | 512±1 | 520±1 | +8 |
| фенилаланин | 512±1 | 524±1 | +12 |
| аланин | 512±1 | 517±1 | +5 |
| серин | 512±1 | 520±1 | +8 |
| аргинин | 512±1 | 521±1 | +9 |
| изолейцин | 512±1 | 520±1 | +8 |
Видно, что после воздействия на полимерную матрицу ЦАФ с ОМС №5 водными растворами аминокислот в спектрах наблюдаются следующие сдвиги длины волны максимума флуоресценции: для раствора фенилаланина он составляет 12 нм, аргинина - 9 нм, для глицина, серина и изолейцина - 8 нм и аланина - 5 нм. На основе полученных результатов наибольший сдвиг наблюдается для раствора фенилаланина по сравнению с остальными растворами, что может быть интерпретировано как селективная хемосенсорная активность полученной ХМ для определенной аминокислоты.
Эти данные свидетельствуют о возможном использовании ХМ на основе ЦАФ и ОМС №5 для возможной детекции аминокислот. Флуоресцентная спектроскопия является предпочтительным методом для исследований ХМ с ОМС № 5.
6.1.2. Исследование монослоев ОМС № 5 со стеариновой кислотой в присутствии лизина
Для получения наноразмерных пленок была использована альтернативная технология (Лэнгмюра). Этой технологией были получены монослои ОМС №5 со стеариновой кислотой (мольное соотношение 1:2) в присутствии и в отсутствие водного раствора лизина (концентрации лизина 1 мМ). Были построены изотермы поверхностного давления и поверхностного потенциала полученных монослоев (рис. 23), а также проведены спектральные исследования данных монослоев до и после контакта с раствором лизина при концентрации 1 мМ (табл. 3.).
 |
| Рисунок 23. Изотермы поверхностного давления (1;3) и поверхностного потенциала (2;4) для смеси ОМС №5(1мМ):C18(1мМ)=1:2 на субфазе 1мМ водного раствора лизина. |
Таблица 3. Спектр флуоресценции монослоя смеси ОМС №5 и стеариновой кислоты (С18) в соотношении ОМС №5:С18=1:2 без контакта и с контактом водного раствора лизина с концентрацией 1 мМ.
| Монослой | , нм, (нет контакта) | , нм, (есть контакт) | , сдвиг, нм |
| Смеси ОМС №5:С18=1:2 | 534±1 | 536±1 | +2 |
Спектр флуоресценции монослоя смеси ОМС №5:С18=1:2 показал батохромный сдвиг +2 нм, что не является достоверным доказательством процесса комплексообразования ОМС №5 с лизином при исследованной концентрации последнего.
Таким образом, получены МКС и исследовано их взаимодействие с рядом аминокислот спектральными методами. Сравнительный анализ спектров поглощения и флуоресценции МКС на базе ОМС №5 показал их возможность для использования как хемосенсорных материалов для детекции ряда аминокислот.
6.2. Сравнительный анализ показателей ДПН биологических жидкостей животных разных видов
Каждому виду сельскохозяйственных животных присущи особенности в обмене веществ. Уровень обмена веществ организма животных определяется генетически-заложенным потенциалом, обуславливающим интенсивность и скорость протекающих в нем всех физиолого-биохимических процессов, и зависит от кормления, условий содержания, возраста, продуктивности животных и физиологического состояния систем, органов и организма в целом. В разные фазы постнатального онтогенеза в период роста, развития, адаптации и старения происходит приспособление целого организма, его органов и клеток к меняющимся условиям окружающей среды, изменяется и характер обмена веществ [1-9]. Именно кровь, являясь внутренней средой организма и зоной свободного перемещения веществ, концентрация которых находится под контролем различных физиолого-биохимических механизмов, обеспечивает стабильность функционирования органов и регуляцию их функциональной активности. Кровь наиболее полно отражает физиолого-биохимические процессы, протекающие в организме, и в процессе онтогенеза претерпевает изменения [2-3, 6-7, 9]. Следствием этого являются характерные изменения биохимического состава плазмы (сыворотки) крови и ее физико-химических свойств, но все эти изменения происходят в определённых пределах, что является нормой для конкретного вида животного. Изменения свойств и состава крови, выходящие за эти пределы, считаются патологическими и указывают на отклонение физиолого-биохимического статуса организма животного от нормы [7-9].
Одним из современных методов, позволяющих в целом судить о состоянии обмена веществ организме в онтогенезе, диагностировать отклонения физиолого-биохимического статуса животных от нормы при заболеваниях различной этиологии, следить за динамикой развития заболевания и осуществлять контроль над его лечением является метод межфазной тензиометрии, т.е. измерение динамического поверхностного натяжения (ДПН) сыворотки крови [10-13].
Исследования проведены на 132 физиологически здоровых животных 4 видов: крупный рогатый скот (48 голов), свиньи (49 голов), собаки (24 головы) и лошади (59 голов). Кровь для исследований брали: у крупного рогатого скота и лошадей - из яремной вены, у свиней - из краниальной полой вены, у собак - из подкожной вены предплечья в утренние часы, натощак. Сыворотку крови получали по общепринятой методике [8-9]. Для всех проб сыворотки крови определяли ДПН и ряд биохимических показателей, оказывающих наиболее существенное влияние на ДПН.
Измерение ДПН проводили на приборе ВРА-1Р (Maximum Bubble Pressure Tensiometer; Sinterface Technologies, Германия), позволяющем получать большой массив значений поверхностного натяжения во временном интервале «жизни» поверхности от 0,01 до 10 секунд.
 а а |  б б |
| Рисунок 24 - Внешний вид прибора (а); принципиальна схема работы тензиометра ВPA-1P (б). | |
Полученные результаты измерений ДПН отображаются на экране компьютера в виде тензиограмм (кривых зависимости поверхностного натяжения от времени «жизни» поверхности) и графиков других зависимостей, а также в форме таблицы данных. На полученных графиках, используя компьютерную программу ADSA, находили значения поверхностного натяжения () при определенных временах (t) «существования» поверхности: 0 (при t, стремящемся к нулю), 1 (t=0,02 с), 2 (t=1 с) и 3 (при стремящемся к бесконечности, а также коэффициенты наклона тензиограммы в области малых (0) и больших (1) времен «жизни» поверхности. Полученные значения ДПН характеризуют количественное содержание поверхностно-активных (ПАВ) и других химических веществ, оказывающих непосредственное влияние на адсорбцию ПАВ, а определяемые коэффициенты позволяют судить об изменении концентрации ПАВ в данных образцах исследуемой жидкости [10, 12-13].
6.2.1. Сравнительный анализ показателей ДПН сыворотки крови крупного рогатого скота в разные сроки постнатального онтогенеза
Исследования ДПН были проведены на физиологически здоровых коровах черно-пестрой породы в возрасте от 6 мес. до 2,5 лет, которые были разделены на 6 групп по принципу аналогов с учетом возраста и периода репродуктивного цикла: 1 - телочки в возрасте 6 месяцев; 2 - телочки в возрасте 12 месяцев; 3 - телочки в возрасте 17-18 месяцев; 4 - нетели в возрасте 22-23 месяцев, находящиеся на 5 месяце стельности; 5 и 6 группы - стельные коровы: 5 - в возрасте 3 лет, находящиеся на 1-2 месяце стельности и 3-4 месяце лактации; 6 - в возрасте 3,5 лет, находящиеся на 5-6 месяце стельности и 6-7 месяце лактации. В 5 и 6 группу были включены коровы массой от 530 до 580 кг с удоем за предыдущую лактацию 5300-5400 кг с жирностью молока 3,7-3,8%.
 | ||
| Рисунок 25 - Тензиограммы сыворотки крови коров: 1-телочки 6 месяцев; 2 - телочки 12 месяцев; 3 - нетели; 4 - лактирующей коровы (3-4 месяц лактации; 1-2 месяц стельности). | ||
Тензиограммы сыворотки крови коров всех исследуемых групп характеризуются относительно небольшим понижением ПН при малых временах «существования» поверхности и последующим быстрым снижением ПН при t > 0,6 c (рис. 25). Наиболее высокие значения ПН при средних и больших временах «существования» поверхности наблюдаются для телок 12-месячного возраста, а наибольшие отличия в форме самих тензиограмм - для сыворотки крови 6-месячных телочек и лактирующих коров, находящихся на 1-2 месяце стельности. Для более подробной характеристики ДПН были определены параметры ДПН, средние значения которых представлены в табл. 4.
Исследования показали, что у 6-месячных телочек параметры ДПН сыворотки крови имеют особенности, которые с возрастом претерпевают существенные изменения. Наступление половой зрелости и достижение телочками живой массы 260-280 кг приводит к адаптивным изменениям показателей ФБС их организма, выраженных в параметрах ДПН сыворотки крови, так, 0, 1, 2 и 3 к 12 месяцам достоверно увеличиваются (на 2,6%, 2,3%, 5,0% и 5,2%, соответственно), а значения 0, напротив, снижаются на 47,0%. Это свидетельствует о более низком содержании ПАВ в сыворотке крови этой группы животных по сравнению с телочками 6-месячного возраста. К моменту наступления физиологической зрелости (17-18 месяцам) телки достигают живой массы 370-390 кг, завершается формирование их организма, что приводит к значительным изменениям значений ДПН их сыворотки крови. Так, относительно 12-месячных телок 3 достоверно снижается (на 3,3%), а 0 и 1 достоверно повышаются (на 45,3% и 28,8%, соответственно).
Известно, что наступление беременности сопровождается многочисленными сложными изменениями в организме самок, что создает оптимальные условия для внутриутробного развития плода. При беременности ряд веществ, содержащихся в крови, количественно изменяется, изменяется и активность ферментов, что приводит к изменениям значений ДПН сыворотки крови стельных животных. Так, к 5 месяцу стельности у нетелей и лактирующих коров значения ДПН достоверно снижаются: 2 - на 5,4% и 6,2%, 3 - на 2,8% и 5,8%, соответственно, а значения 0 достоверно увеличиваются на 32,2% и 59,0%, соответственно, по сравнению с телками 17-18-месячного возраста.
Таблица 4 - Средние значения параметров динамического поверхностного натяжения сыворотки крови коров (M±m; n=8), где n- число особей.
| группа пара-метры | тёлочки, 6 мес | тёлки, 12 мес | тёлки, 17-18 мес | нетели | коровы | |
| месяц стельности (лактации) | ||||||
| 5 | 1-2 (3-4) | 5-6 (6-7) | ||||
| 0, мН/м | 72,07± 0,17 | 73,94± 0,49 | 73,34± 0,35 | 73,22± 0,31 | 74,39± 0,42 | 73,18± 0,32 |
| 1, мН/м | 71,91± 0,43 | 73,52± 0,14 | 73,08± 0,48 | 72,86± 0,23 | 73,09± 0,51 | 72,45± 0,39 |
| 2, мН/м | 66,80± 0,30 | 70,11± 0,42 | 69,86± 0,76 | 66,10± 0,48 | 64,24± 0,43 | 65,62± 0,37 |
| 3, мН/м | 61,19± 0,66 | 64,35± 0,64 | 62,22± 0,55 | 60,45± 0,59 | 56,80± 0,59 | 58,97± 0,69 |
| 0, мНм-1с-1/2 | 5,96± 0,15 | 3,16± 0,39 | 4,59± 0,39 | 6,07± 0,28 | 5,47± 0,36 | 7,30± 0,36 |
| 1, мНм-1с1/2 | 6,12± 0,23 | 5,70± 0,49 | 7,34± 0,38 | 6,79± 0,29 | 9,14± 0,35 | 7,98± 0,60 |
Для всех значений Р0,95 (p0,05)
У коров, находящихся на 1-2 и 5-6 месяце стельности, значения параметров 2 на 8,4% и 6,4%, соответственно, и 3 на 11,7% и 8,4% достоверно ниже, а значения 0 в среднем в 1,7 раза и 1 на 60,4% и 40,0% достоверно выше по сравнению с телками в возрасте 12-месяцев. Нетели и коровы на 5-6 месяце стельности имеют достоверно более высокие значения параметров 2, 3 и 0 (2 - в среднем на 2,5%, 3 - на 6,4% и 3,8%, 0 - на 11,0% и 33,5%, соответственно) и достоверно более низкие значения параметров 0 и 1 (0 - в среднем на 1,6%, 1 - на 25,7% и 12,5%, соответственно) по сравнению с коровами, находящимися на 1-2 месяце стельности. Очевидно, это связано с более низким содержанием ПАВ в сыворотке крови животных во второй трети стельности, а у лактирующих коров с высокими удоями на 3-4 месяце лактации.
В целом, наиболее высокие значения параметров 1 (73,52±0,14 мН/м), 2 (70,11±0,42 мН/м) и 3 (64,35±0,64 мН/м) отмечаются для телочек 12-месячного возраста, а 0 (74,39±0,42 мН/м) и 1 (9,14±0,35 мНм-1с1/2) для коров, находящихся на 1-2 месяце стельности. Для этих же групп животных отмечаются и наиболее низкие значения параметров 0 (3,16±0,39 мНм-1с-1/2) и 1 (5,70±0,49 мНм-1с1/2) - у телочек и 2 (64,24±0,43 мН/м) и 3 (56,80±0,59 мН/м) - у лактирующих коров.
Следовательно, рост и функциональное состояние организма коров в онтогенезе сопровождаются закономерными изменениями физиолого-биохимического статуса их организма, зависящие от возраста и периода репродуктивного цикла, что находит отражение в динамике параметров ДПН их сыворотки крови.
6.2.2. Сравнительный анализ показателей ДПН сыворотки крови свиней в ранние сроки постнатального онтогенеза
Измерено ДПН сыворотки крови поросят от 5 до 210 суток. Исследования проведены на физиологически здоровых поросятах, которые были разделены на 7 возрастных групп по принципу аналогов: 1 - поросята в возрасте 5 суток, 2 – в возрасте 10 суток, 3 - 20 суток, поросята, 4 - 60 суток на доращивании, 5 – поросята в возрасте 90 суток на доращивании, 6 - ремонтные свинки в возрасте 120 суток
Для всех возрастных групп поросят наблюдается плавное снижение поверхностного натяжения при увеличении времени «существования» поверхности (рис. 26, табл. 5). Максимальное снижение (на 20,0%) наблюдается для поросят в возрасте 5 и 20 суток, для других групп это снижение составляет 12,0-14,0 %.
Наиболее низкие значения ДПН и наиболее высокие коэффициенты наклона тензиограммы отмечаются у поросят молочного питания: 0 и 1 у них ниже в среднем на 2,7%, 2 – на 3,7%, 3 – на 9,6%, а 0 и 1 - выше на 13,4% и 37,2%, соответственно, по сравнению с поросятами старших групп.
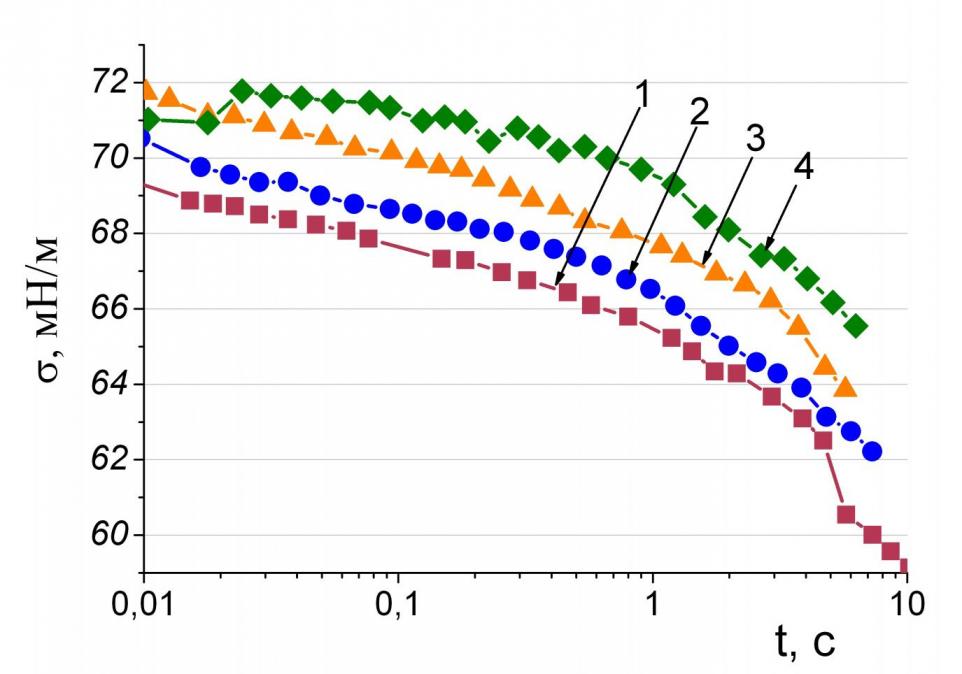 | ||
| Рисунок 26 - Тензиограммы сыворотки крови поросят: 1 - пятисуточного поросенка; 2 - поросенка 10-суточного возраста; 3 - поросенка в возрасте 60 суток; 4 - ремонтного поросенка в возрасте 220 суток. | ||
Среди поросят молочного питания низкие значения ДПН отмечаются для поросят в возрасте 5 суток (0 - 68,60±0,30 мН/м, 1 - 68,66±0,20 мН/м, 2 - 63,90±0,50 мН/м, 3 - 54,60±0,80 мН/м), у этой же группы поросят выше коэффициенты наклона тензиограммы (0 - 5,70±0,20 мНм-1с-1/2, 1 – 10,30±1,10 мНм-1с1/2). Минимальные значения ДПН при средних (2) временах «существования» поверхности наблюдаются в возрасте 20 суток (63,3±0,2 мН/м), а при больших временах (3) - в возрасте 5 и 20 суток (54,6±0,8 мН/м и 54,6±1,4 мН/м, соответственно). Снижение 2 и 3 для поросят в возрасте 20 суток может быть связано с изменениями в рационе питания поросят при снижении молочности матки, стимулируемом перед предстоящим отъемом.
При смене рациона поросят после периода молочного питания значения ДПН плавно повышаются и при достижении возраста 60 суток 2 оказываются на 5,2 %, а 3 – на 11,7 % выше по сравнению с 20-суточными поросятами. В возрасте от 60 до 210 суток значения ДПН сыворотки крови при средних и больших временах «жизни» поверхности колеблются в пределах 66,6±0,4 мН/м и 61,7±0,3 мН/м, соответственно, но наиболее высокие значения отмечаются для поросят 210-суточного возраста. В этом же возрасте отмечаются наиболее низкие значения 0 (3,40±0,20 мНм-1с-1/2).
Таблица 5 - Средние значения параметров динамического поверхностного натяжения сыворотки крови поросят разного возраста (M±m; n=7), где n- число особей.
| параметры ДПН группа | 0, мН/м | 1, мН/м | 2, мН/м | 3, мН/м | 0, мНм-1с-1/2 | 1, мНм-1с1/2 |
| поросята, 5 суток | 68,6± 0,3 | 68,66± 0,2 | 63,9± 0,5 | 54,6± 0,8 | 5,7± 0,8 | 10,3± 1,1 |
| поросята, 10 суток | 69,9± 0,2 | 69,73± 0,2 | 65,4± 0,2 | 59,8± 0,3 | 4,8± 0,10 | 5,9± 0,18 |
| поросята, 20 суток | 69,3± 1,2 | 69,0± 1,1 | 63,3± 0,2 | 54,6± 1,4 | 5,8± 0,6 | 9,0± 1,3 |
| поросята 60 суток | 71,3± 0,5 | 71,0± 0,6 | 66,4± 0,4 | 61,0± 0,6 | 4,8± 0,10 | 5,5± 0,3 |
| поросята 90 суток | 71,9± 0,4 | 71,9± 0,5 | 66,8± 0,5 | 61,4± 0,5 | 4,9± 0,3 | 5,5± 0,2 |
| ремонт.свинки, 120 суток | 70,4 ± 0,4 | 70,4± 0,5 | 65,8± 1,2 | 62,2± 0,7 | 5,6 ± 2,1 | 4,0± 1,3 |
| ремонт.свинки, 210 суток | 70,7± 0,8 | 70,6± 0,8 | 67,3± 0,7 | 62,2± 0,5 | 3,4± 0,2 | 5,6± 0,3 |
Для всех значений Р0,95 (p0,05)
Таким образом, ДПН сыворотки крови поросят имеет возрастные особенности: наибольшие изменения отмечаются для поросят в возрасте 20 суток, а наиболее специфичным параметром, зависящим от возраста, является 3 (ДПН при больших временах «существования» поверхности).
6.2.3. Сравнительный анализ показателей ДПН сыворотки крови собак с полом и возрастом
Возникновение и течение многих патологических состояний может существенно отличаться у особей мужского и женского пола. В связи с этим, необходимо отличать тактику диагностики (в том числе, и лабораторной) у самцов и самок животных. Исследования ДПН сыворотки крови были проведены на физиологически здоровых собаках породы немецкая овчарка, которые были разделены на 4 группы по принципу аналогов в зависимости от пола и возраста.
Исследования показали, что с возрастом у кобелей и сук наиболее существенные отличия отмечаются в динамике ДПН при больших временах «жизни» поверхности и коэффициентах наклона кривых (табл. 6). У сук коэффициент 0 на 49% и значения 3 на 3,2% с возрастом повышаются, а коэффициент 1, отражающий изменение концентрации ПАВ в зависимости от величины их адсорбции на 13% снижается. У кобелей значения 3 с возрастом повышаются на 2%, а 0 и 1 снижаются на 6% и на 20%, соответственно. В возрасте 4 лет значения 0 на 22% и 1 на 13% у сук ниже, чем у кобелей, а в 7 лет только 1 на 6% у сук остается ниже, 0 на 23% становится выше по сравнению с кобелями, в этом же возрасте у сук выше значения 3 на 2,6%.
Таблица 6 - Средние значения параметров динамического поверхностного натяжения сыворотки крови немецких овчарок (M±m), n- число особей.
| группа параметры | Кобели | Суки | Кобели | Суки |
| 4 года | 7 лет | |||
| n | 9 | 5 | 6 | 4 |
| 0, мН/м | 73,78± 0,07 | 73,50± 0,06 | 74,04± 0,21 | 73,48± 0,08 |
| 1, мН/м | 73,40± 0,09 | 73,20± 0,16 | 73,54± 0,15 | 72,92± 0,12 |
| 2, мН/м | 67,12± 1,43 | 67,12± 0,26 | 67,11± 0,13 | 67,09± 0,14 |
| 3, мН/м | 59,04± 0,89 | 59,96± 0,90 | 60,32± 0,22 | 61,89± 0,16 |
| 0, мНм-1с-1/2 | 8,37± 0,21 | 6,50± 0,97 | 7,90± 0,45 | 9,70± 0,21 |
| 1, мНм-1с1/2 | 8,40± 1,73 | 7,30± 0,91 | 6,70± 0,32 | 6,30± 0,87 |
Для всех значений Р0,95 (p0,05)
Таким образом, ДПН сыворотки крови собак имеет особенности, зависящие от пола животного, которые наиболее четко прослеживаются при сравнении коэффициентов наклона тензиограммы, что обусловлено разным соотношением ПАВ и других соединений сыворотки крови кобелей и сук с возрастом.
6.2.4. Сравнительный анализ показателей ДПН сыворотки крови лошадей в разные сроки постнатального онтогенеза
Исследования ДПН были проведены на физиологически здоровых лошадях русской рысистой породы в возрасте от 1 мес. до 10 лет, которые были разделены на 13 групп по принципу аналогов с учетом пола и возраста.
У месячных жеребят (кобылок) значения ДПН существенно изменяются с возрастом.
Так, у кобылок в возрасте 1 месяц значения 1….3 незначительно (на 2-15%) ниже, а значение 0 (на 70-103%) выше по сравнению со взрослыми кобылами (табл. 7).
После периода интенсивного роста и адаптации к новым условиям в течение 2-х лет, значения ДПН крови у кобыл 2 лет отличаются от кобылок следующими показателями: 1….3 и 1 значительно - на 6, 5, 3 и 13% соответственно, выше, а значение 0 ниже на 103%. У 3 летних кобыл по сравнению с кобылками снижается значение 0 на 2%, все остальные значения 1… 3 выше на 5,5, 7 % соответственно. Отмечается значительное, на 62 % снижение значения 0, а 1 практически не отличается от такового, полученного для жеребят.
Таблица 7 - Средние значения динамического поверхностного натяжения крови кобылок и кобыл (M±m), n- число особей.
| группа параметры | 1 мес. | 2 года | 3 года | 4 года | 5 лет | 6 лет | >10 лет |
| n | 3 | 3 | 3 | 3 | 3 | 3 | 7 |
| 0, мН/м | 77,5± 0,9 | 77,4± 0,9 | 76,3± 1,5 | 74,6± 0,2 | 79,5± 1,1 | 78,8± 0,7 | 78,0± 0,8 |
| 1, мН/м | 71,1± 0,6 | 75,5± 1,2 | 74,5± 1,6 | 73,5± 0,5 | 77,9± 1,1 | 76,5± 1,1 | 75,5± 0,5 |
| 2, мН/м | 68,7± 0,3 | 72,5± 1,3 | 72,3± 1,5 | 73,3± 1,1 | 73,9± 0,9 | 73,8± 1,2 | 73,0± 1,0 |
| 3, мН/м | 61,1± 0,7 | 62,8± 0,9 | 65,6± 1,3 | 61,8± 0,7 | 62,7± 1,3 | 63,2± 0,7 | 62,5± 1,2 |
| 0, мНм-1с-1/2 | 9,5± 0,2 | 4,7± 0,2 | 3,6± 0,6 | 1,9± 0,4 | 5,4± 0,7 | 4,7± 0,3 | 4,9± 1,1 |
| 1, мНм-1с1/2 | 7,8± 0,2 | 9,0± 0,4 | 7,4± 0,3 | 11,9± 0,8 | 12,9± 0,4 | 12,2± 0,5 | 11,7± 1,6 |

