« ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ «НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ КЛИНИЧЕСКОЙ ИММУНОЛОГИИ СИБИРСКОГО ОТДЕЛЕНИЯ РОССИЙСКОЙ АКАДЕМИИ МЕДИЦИНСКИХ НАУК» ...»
Иммунокомпетентные клетки являются основными компонентами иммунной системы, которые принимают активное участие в воспалении и формировании иммунного ответа. Участие Т-лимфоцитов в иммунных реакциях обусловлено возможностью распознавания антигенов. CD3+ лимфоциты регулируют и формируют эффекторный иммунный ответ. Многочисленные исследования свидетельствуют о влиянии характера УХП на количество в кровотоке CD3+, CD4+, CD8+, CD16+, CD20+, CD25+, CD38+, CD95+ клеток. Хирургическая травма сопровождается реакцией стресса и приводит к увеличению содержания в крови абсолютных количеств лейкоцитов, гранулоцитов, моноцитов, CD3+, CD4+, CD8+, CD16+, CD19+ лимфоцитов [186, 461].
Болевой синдром стимулирует адренергические механизмы нейромедиации. [179] Преобладание тонуса симпатического отдела вегетативной нервной системы приводит к снижению содержания в кровотоке ИЛ-1-РА и увеличению продукции ИЛ-6 [179]. При этом общая анестезия вызывает провоспалительный иммунный ответ, увеличение популяций CD4+, CD20+ клеток и снижение количества NK-клеток [273]. Стресс приводит в действие молекулярные механизмы, приводящие к уменьшению уровня экспрессии CD3 молекул [462], снижению распознавания антигенов CD4+ и CD8+ клетками, угнетению их пролиферации [357]. Стресс и выброс глюкокортикоидов подавляют активность дендритных клеток, межклеточные взаимодействия, активацию и пролиферацию CD8+ лимфоцитов [174], индуцируют апоптоз в клетках иммунной системы [212, 346].
К четвёртым суткам послеоперационного периода снижаются количества CD4+, CD8+ лимфоцитов, отмечается угнетение экспрессии HLA-DR молекул моноцитами, увеличение продукции ИЛ-6 и ФНО- [217]. Иммуносупрессия при сепсисе может быть вызвана лимфопенией вследствие апоптоза клеток лимфоидного и миелоидного ряда, в том числе CD4+ и CD8+ клеток, вызванного массивным поступлением в кровоток антигенов [215, 474]. Блокирование механизмов апоптоза может иметь предохранительное значение при сепсисе [215]. Лимфопения, вызванная апоптозом на фоне стресса и воспаления, сопровождается увеличением функциональной активности сохранившихся CD8+ лимфоцитов [378]. Это может стать причиной рефрактерности CD4+ лимфоцитов к антигенной стимуляции [265]. Тяжёлое течение сепсиса приводит к повреждению предшественников CD8+ лимфоцитов, что в дальнейшем, спустя месяцы после клинического выздоровления, проявляется снижением эффективности иммунитета против вирусных и бактериальных инфекций [484, 492]. Культуры CD4+ и CD8+ лимфоцитов in vitro восстанавливали свои пролиферативные возможности только спустя 21 день после выделения из крови мышей, больных сепсисом [265].
CD4+ лимфоциты распознают антигены в комплексе с молекулами MHC II класса и включают субпопуляции хелперных и регуляторных клеток, пропорции которых изменяются в результате травм или оперативных вмешательств [58, 219, 283]. Операционная травма приводит к снижению общего количества CD4+ клеток и соотношения CD4+/CD8+. В некоторых случаях общее количество CD4+ клеток остается сниженным до пятидесяти дней после операции [442]. Развитие послеоперационных инфекционных осложнений связывают со сдвигом соотношения субпопуляций CD4+ в сторону преобладания Th2 клеток [256, 260, 270]. Есть противоположные данные, согласно которым популяции NK-клеток и NKТ-клеток участвуют в смещении иммунных реакций в сторону Th1 иммунного ответа и усугублению бактериального перитонита [416]. В результате тяжёлых травм существенно снижается продукция макрофагами цитокинов. Кроме снижения продукции ИЛ-12, увеличивается продукция ИЛ-4, в результате чего смещается баланс субпопуляций CD4+ клеток в сторону Th2 [256]. Степень нарушений продукции цитокинов моноцитами и Т-клеточного звена иммунной системы на уже на вторые сутки после хирургической травмы коррелирует с продолжительностью воспаления и развитием неблагоприятных клинических исходов [256].
Увеличение объёма травмированных во время операции тканей приводит к углублению CD4+ и CD8+ лимфопении у пациентов в послеоперационном периоде [203].
При сходных клинических проявлениях у пациентов с сепсисом уровни экспрессии CD4 + и CD8 + лимфоцитов выше, чем у пациентов без развития сепсиса [220, 377]. У пациентов с септическими состояниями наряду с увеличением продукции цитокинов отмечено снижение экспрессии к ним рецепторов [254]. Продукция хематтрактантов и привлечение нейтрофилов при раневой инфекции и, как результат – размножение бактерий, контролируются CD4+ лимфоцитами [213]. После операционной травмы в брюшную полость перемещаются CD4+ Th1 лимфоциты [214], где они контролируют выпадение фибрина и спаечный процесс при участии ИФН-, ИЛ-6 [214, 307].
Популяция CD4+ лимфоцитов контролирует активность CD8+ лимфоцитов [58]. В первые сутки послеоперационного периода увеличиваются доля CD8+ лимфоцитов, уровни продукции ИЛ-6 и ИЛ-10, смещается баланс Th1/Th2 клеток [441]. В послеоперационном периоде снижается экспрессия мембранных Т-клеточных рецепторов и антигенов MHC на мембранах моноцитов и макрофагов, NK-клеток, лимфоцитов, изменяется продукция цитокинов и ИЛ-2 [416], снижается уровень CD4+ клеток, продукция ИФН-, продукция ИЛ-6 возрастает [219]. В послеоперационном периоде снижаются продукция цитокинов CD4+ клетками и экспрессия на их поверхности MHC II класса [416]. Увеличение количества CD8+клеток коррелирует со снижением эффективности антигенного распознавания что может быть обусловлено нарушениями в клетках обменных процессов [509]. Субстанция P и белки теплового шока активируют CD8+ клетки и способствуют увеличению интенсивности и продолжительности воспаления [183, 458]. Метаболические поломки и оксидативный стресс влияют на численность популяции CD8+ клеток [449].
Эффективность иммунного ответа связана с реализацией механизмов иммунологической памяти [58, 296, 493] Существует предположение, что избыточно высокий уровень иммунного ответа, который наблюдается при септическом шоке, способен преждевременно активировать регуляторные механизмы и вызывает торможение иммунных реакций по механизму обратной связи [58].
NK-клетки относят к системе конституционального иммунитета, однако накоплены данные, что они способны к обучению и участию в адаптивных механизмах иммунного ответа [490, 528]. Защита от бактериальных инфекций может быть реализована посредством активации нескольких систем врожденного иммунитета, в том числе TLR и дефензинов. Связывание в составе циркулирующих иммунных комплексов С5а компонента комплемента увеличивает экспрессию CD16 (Fc--RIII) молекул по отношению к Fc--RII [302, 330]. Рецепторы CD16 (FcRIII) и CD11b (CR3) принимают участие в фагоцитозе бактерий и экспрессируются более чем на 85% зрелых нейтрофилов. В послеоперационном периоде нарушения фагоцитоза в сочетании с увеличением антигенной нагрузки сопровождаются снижением уровня экспрессии CD16 на поверхности нейтрофилов [338, 350, 448]. Однако, действие стресса сопровождается увеличением экспрессии CD16 молекул [266]. При увеличении тяжести состояния пациентов по шкале APACHE II уровень экспрессии молекул CD16 и CD11b снижается [204, 535]. Вероятной причиной этого может быть связывание антигенов Escherichia coli с CD16 молекулами (FcRIII) нейтрофилов, которое приводит к угнетению фагоцитоза и активации синтеза ФНО- посредством стимуляции TLR4 и развитию медиаторной бури и сепсиса [206, 267]. В ответ на бактериальную инфекцию и хирургическую агрессию одновременно с увеличением продукции ИЛ-6 и ИЛ-8 изменяются пропорции экспрессии семейства Fc- рецепторов на поверхности нейтрофилов: увеличивается экспрессия CD64 (Fc--RI) молекул и снижается уровень экспрессии CD16 (Fc--RIII) молекул [231, 397, 409, 512].
Резкое увеличение антигенной нагрузки и поступление в кровоток токсинов приводит к изменению фенотипа моноцитов и экспрессии на мембранах молекул CD16 и гиперпродукции ФНО-, что является одной из вероятных причин развития полиорганной недостаточности [425]. Действие антигенов на рецепторы нейтрофилов при бактериальной инфекции и сепсисе приводит к усилению экспрессии CD64 (Fc--RI) молекул и снижению экспрессии CD16 (Fc--RIII) молекул [297]. Такие фенотипические изменения могут служить для предупреждения апоптоза нейтрофилов [297]. Подобные изменения наблюдаются при стрессе [284].
При развитии септического шока на фоне сепсиса существенно снижается экспрессия HLA-DR молекул на моноцитах и CD16 молекул на гранулоцитах, повышается продукция ИЛ-6 и ИЛ-10 [397]. Длительность снижения количества в периферической крови CD16+ клеток на протяжении послеоперационного периода достигает 8 дней [331].
NK-клетки высокочувствительны к действию окислительного стресса [496]. Свободные радикалы кислорода угнетают функциональную активность NK-клеток, стимулируют их апоптоз [496] и угнетают экспрессию молекул CD16 на нейтрофилах [457]. Однако, у пациентов в критических состояниях с развитием SIRS в нейтрофилах наблюдаются фенотипические и функциональные изменения, заключающиеся в большей ригидности к внешним стимулам и устойчивости к апоптозу [306, 350]. В первые сутки после операции апоптоз нейтрофилов подавляется действием ИЛ-6 и гранулоцитарного макрофагального колоние-стимулирующего фактора, после чего увеличивается продукция ФНО- и ИЛ-10, которые усиливают апоптоз [248, 253, 335]. При остром воспалении и SIRS в кровоток выходят незрелые CD16+ нейтрофилы, которые способны выполнять защитные функции, но при этом более устойчивы к апоптозу и действию ФНО- и ИЛ-10 [343, 350, 512]. Одним из важных механизмов развития септического шока при перитоните является миграция NK-клеток в брюшную полость и активация ими макрофагов с последующей гиперпродукцией цитокинов и системной медиаторной бури [412].
Процессы клеточной пролиферации и дифференцировки T-клеток регулируются цитокином ИЛ-2. Его действие опосредовано активацией рецепторов: ИЛ-2R (CD25), ИЛ-2R (CD122), ИЛ-2R (CD132) [232, 482]. Экспрессия CD25 молекул необходима для развития Th2 иммунного ответа [349, 482]. У пациентов после холецистэктомии из лапаротомного доступа выше экспрессия CD25 молекул и продукция ИЛ-6, ИЛ-8 and ИЛ-1-РА по сравнению с лапароскопическими операциями [221]. В эксперименте доказано угнетение продукции эндогенного ИЛ-2 при травмах вследствие нарушений реализации генетических механизмов его синтеза [252, 460]. Введение ИЛ-2 и ИФН- в эксперименте предотвращает развитие абсцессов брюшной полости [329]. Эффективность применения ИЛ-2 для предотвращения развития абсцессов брюшной полости в эксперименте зависит от дозы и количества в крови CD4+ клеток [329].
Уровень экспрессии CD38 молекул является маркером пролиферативной активности клеток иммунной системы [205]. Молекулы CD38 регулируют работу ионных каналов, регулирующих процессы соотношения активации клеток и апоптоза [489, 497, 514]. Молекула CD38 экспрессируется на различных клетках иммунной системы, преимущественно на В-лимфоцитах [294, 489]. Она участвует в апоптозе, клеточной активации, дифференциации и пролиферации. CD38 является эктоферментом и рецептором, контролирующим ионные каналы [264, 294, 489, 497, 525]. Регулирование пролиферации и дифференцировки В-клеток в плазматические клетки включает в себя интеграцию различных внутриклеточных сигналов от рецепторов конституциональной и адаптивной иммунной системы. Связывание молекулы CD38 вызывает мобилизацию кальция, фосфорилирование белков и транслокацию сигнального комплекса в ядро. Конечным результатом этого являются пролиферация и переключение изотипа антител к IgG1 [208, 211].
CD38+ клетки активно продуцируют ИЛ-2 и ИФН- [470]. Уровень экспрессии молекул CD38 отражает способность к хематтракции [428, 489], дефицит CD38+ клеток ассоциирован с восприимчивостью к бактериальным инфекциям [428]. Количество CD38+ клеток отражает уровень иммуносупрессии [207, 486].
CD38+ клетки высокочувствительны к окислительному стрессу. Поэтому угнетение пролиферации и отсутствие на поверхности лимфоцитов CD38 молекул может быть не только следствием повреждения, но и защитной стратегией клеток при окислительном стрессе [400]. Депрессии и стрессы угнетают экспрессию CD38 молекул, увеличивают количество CD8+ клеток. Снижение количества CD38+ клеток коррелирует с угнетением пролиферации Т-клеток и снижением NK-клеток [257, 311]. В клеточных культурах индукция синтеза CD38 может быть вызвана активацией TLR в сочетании с действием ИФН- [182, 210, 508] или ИФН- [272]. Также уровень экспрессии CD38 молекул увеличивается под действием ИЛ-8 [178].
Есть предположение, что уровень экспрессии CD38 молекул может значительно меняться в зависимости от внешних условий и связаны с изменениями клеточного цикла [209, 464].
Молекула CD95 является составной частью рецепторного комплекса ФНО-, индуцирующего апоптоз (Fas, Apol) [96, 498]. Экспрессия генов, регулирующих синтез CD95 молекул, индуцируется различными формами метаболического стресса. Однако, чрезмерные нарушения метаболизма приводят к ингибированию синтеза CD95 молекул [327]. Бактериальные антигены активируют апоптоз посредством активации CD95-сигнального пути [172, 299].
Гипоксия и стресс индуцируют экспрессию CD95 молекул, посредством которых усиливаются процессы апоптоза [326]. Стресс характеризуется изменениями как вегетативной регуляции, так и дисбалансом синтеза про- и противовоспалительных цитокинов [174, 179, 212]. Повышение продукции ИЛ-1, ИЛ-6, ИЛ-8 и снижение продукции ИЛ-10 при стрессе увеличивают риск развития послеоперационных осложнений. [186, 219]. Вероятно, нарушения микроциркуляции также способствуют экспрессии CD95 молекул с последующей активацией процессов апоптоза [429]. У пациентов с развитием полиорганной недостаточности на фоне SIRS уровень экспрессии CD95 молекул коррелирует с глубиной лимфопении, выраженностью апоптоза, тяжестью состояния и летальностью [295].
Результаты научных исследований и практический опыт дают основания полагать, что воздействие на иммунную систему основных патогенетических факторов: воспаления, стресса, травмы, анестезиологического пособия, бактериальной инфекции и сепсиса у пациентов с УХП взаимно усиливают негативные эффекты друг друга. Однако, действие этих факторов неоднозначно влияет на показатели лабораторных исследований и опосредовано различными механизмами регуляции. Поэтому для мониторинга состояния иммунной системы необходимы новые подходы, позволяющие объединить столь многочисленные и противоречивые факты относительно преобладания того или иного механизма регуляции иммунных реакций у пациентов с УХП.
1.4. Иммунокоррекция как составляющая комплексного лечения пациентов с ургентной хирургической патологией
В предыдущие годы исследователи уделяли значительное внимание разработке методов асептики и стерилизации, совершенствованию технологий респираторной поддержки, профилактическому применению антибиотиков и пробиотиков [362]. Появление резистентных возбудителей привело к снижению эффективности лечения вторичных инфекций [163, 319]. Учитывая важнейшее участие иммунной системы в патогенезе УХП, на современном этапе важнейшей задачей комплексного лечения является разработка методов лечения, ориентированных на управление состоянием иммунной системы [78, 332, 362, 440, 441].
Предотвращение ранних воспалительных реакций и восстановление функций клеточного звена иммунной системы являются главными задачами иммунокорригирующей терапии в послеоперационном периоде [332, 388, 389, 392]. Становится очевидной необходимость разработки технологий применения иммуномодуляторов у более тяжёлых категорий пациентов, в частности, для лечения хирургического сепсиса и полиорганной недостаточности [332, 336, 440, 529].
Клинические и экспериментальные исследования показали, что при активации клеток иммунной системы в них существенно изменяется течение обменных процессов, критическими проявлениями которого может стать развитие метаболического иммунодефицита [250, 396]. Назначение в диету аминокислот и метаболитов, способствующих нормализации функций иммунной системы, пациентам хирургических и ожоговых отделений снижает уровень инфекционных осложнений и продолжительность пребывания в стационаре [288, 388, 389, 444]. Добавление в диету глютамина [312, 499] аргинина, жирных кислот и нуклеотидов снижает степень выраженности послеоперационного иммунодефицита [277] и снижает частоту развития пневмоний и внутрибрюшных абсцессов в послеоперационном периоде.
Даларгин (тирозил-d-аланил-глицил-фенилаланил-лейцил-аргинина диацетат) является синтетическим аналогом лейцин-энкефалина – регуляторного нейропептида [10]. Вещества, подобные даларгину, способны в условиях воспаления увеличивать продукцию хемокинов макрофагами [317], экспрессию рецепторов к хемокинам на поверхности нейтрофилов [427]; стимулируют продукцию нейтрофилами активных форм кислорода и экспрессию CD16 молекул [278]. Предполагается, что эндогенные опиоидные пептиды участвуют в механизмах иммунологической памяти и способствуют формированию гуморального иммунного ответа при инфекциях [488]. Даларгин разнонаправлено влияет на обменные функции нейтрофильных гранулоцитов, способствуя снижению избыточной активности ферментов и стимулируя угнетенную метаболическую активность in vivo и in vitro [10].
У пациентов с УХП опиоидные пептиды оказывают системное действие как компонент анестезии, также увеличение концентрации эндогенных опиоидных пептидов наблюдается в области воспаления [273, 278], поэтому даларгин способен снижать выраженность воспалительного компонента боли [426, 427]. Даларгин снимает иммуносупрессивное действие стресса [225] и используется в клинике для профилактики стрессовых язв желудка и тонкого кишечника [32, 165].
Пентоксифиллин (3,7-дигидро-3,7-диметил-1-(5-оксогексил)-1Н-пурин-2,6-дион) – производное пурина. Основным иммунотропным эффектом пентоксифиллина является торможение синтеза и высвобождения ФНО- активированными клетками [146, 147, 433]. За счет этого пентоксифиллин тормозит синтез хемокинов и миграцию нейтрофилов и моноцитов в очаг воспаления [276, 430]. В раннем послеоперационном периоде баланс между про- и противовоспалительными влияниями может быть восстановлен введением пентоксифиллина и препаратов ИФН- [392]. Пентоксифиллин обладает цитопротективным действием [146, 147, 282]. Пентоксифиллин значительно снижает гистологические повреждения в легочной ткани, вызванные активацией и дегрануляцией нейтрофилов при экспериментальном остром панкреатите [432] и геморрагическом шоке [325, 431]. Однако его комбинация с синергичным препаратом не дает ощутимого усиления эффекта [282].
Пирацетам (2-оксо-1-пирролидинацетамид, -аминомасляная кислота, ГАМК) – синтетический аналог нейромедиатора центральной нервной системы. Есть данные, что клетки иммунной системы экспрессируют рецепторы к ГАМК [259, 420], за счет активации которых пирацетам может использоваться в качестве ИТЛС у пациентов в послеоперационном периоде, снижая выраженность Th1-эффектов [420]. При этом ГАМК проявляет синергичные эффекты с ИЛ-1 [344, 345]. Пирацетам повышает активность перитонеальных макрофагов, стимулирует гуморальный и клеточный иммунный ответ, стимулирует пролиферативную активность спленоцитов [334]. Иммуномодулирующие эффекты пирацетама также могут быть опосредованы влиянием на иммунорегуляторные функции гипоталамуса [218, 242, 309] Пирацетам улучшает иммунореактивность при введении в эксперименте лизатов синегнойной палочки [454].
Милдронат (триметилгидразиния пропионат, мельдоний) – аналог гамма-бутиробетаина, подавляет гамма-бутиробетаингидроксиназу, снижает синтез карнитина и транспорт длинноцепочечных жирных кислот через оболочки клеток, препятствует накоплению в клетках активированных форм неокисленных жирных кислот [342]. Изменения метаболизма на уровне митохондрий приводят к нарушению функций клеток иммунной системы [396]. Милдронат нормализует работу митохондрий [281, 395, 408]: восстанавливает равновесие между доставкой кислорода и его потреблением в клетках при ишемии, предупреждает нарушение транспорта АТФ; одновременно с этим активирует гликолиз, не требующий потребления кислорода [286] и снижает выраженность окислительного стресса [72]. Милдронат нормализует показатели Т-клеточного и фагоцитарного звеньев иммунной системы, количество B-лимфоцитов, показатели системы комплемента, продукцию ИЛ-1, ИЛ-6, ИФН- [22, 27]. Милдронат нормализует метаболизм и функциональную активность нейтрофилов, стимулирует гуморальный иммунный ответ [74]. Милдронат оказывает стресс-протекторное действие на слизистую желудка и двенадцатиперстной кишки и применяется в хирургической практике [101, 153]. Включение милдроната в комплексное лечение гинекологического перитонита сокращает длительность стационарного лечения пациенток [72]. Милдронат применяют как иммунокорректор для профилактики пневмоний у пациентов с ишемическим инсультом [143]. При этом дозозависимые эффекты милдроната являются нелинейными [414].
Глутоксим (глутамил-цистеинил-глицин динатрия) – синтетический аналог глутатиона, оказывает нормализующее влияние на процессы тиолового обмена – необходимой составляющей экспрессии генов и детоксикации [159]. Глутатион (GSH) является важнейшим биорегулятором, его содержание в клетках снижается при воспалении, травмах, после оперативных вмешательств и стрессов [288]. Для коррекции иммунодефицитов при сепсисе предлагают использовать метаболический предшественник глутатиона [469]. В нормальных клетках глутоксим стимулирует процессы пролиферации и дифференцировки, в атипичных – активирует апоптоз. Глутоксим усиливает продукцию ИЛ-1, ИЛ-6, ИФН, стимулирует экспрессию рецепторов ИЛ-2 [159]. Глутоксим увеличивает эффективность антибактериальных препаратов, обладает цитопротективным и гепатопротективным действием [25]. Назначение глутоксима в послеоперационном периоде способствует быстрому купированию воспаления в области операционной травмы и снижению числа инфекционных оcложнений [124]. Применение глутоксима в составе комплексного лечения острого панкреатита позволяет сократить сроки нормализации показателей интоксикации, снизить выраженность иммуносупрессии, улучшить показатели внутриклеточного обмена лимфоцитов [33, 71].
Реамберин – раствор N-(1дезокси-D-глюцитол-1ил)-N-метиламония, натрия сукцинат 1,5% для внутривенной инфузии. Реамберин широко применяется в хирургической практике в качестве детоксицирующего, антиоксидантного и иммунокорригирующего препарата [67, 68, 167].
Под влиянием реамберина улучшается кислородотранспортная функция эритроцитов и утилизация кислорода тканями [135, 148], сокращаются сроки заживления язвенных дефектов желудка и кишечника [135]. Применение реамберина нормализует функции нейтрофилов и ускоряет сроки очищения и заживления гнойных ран [98]. Использование реамберина у больных абдоминальным сепсисом способствует активации перитонеальных макрофагов и нейтрофилов, увеличению продукции ИЛ-10 и снижению продукции ИЛ-6 [16]. При септических пневмониях применение реамберина восстанавливает антиокисдантную активность крови [135, 156] и сокращает продолжительность клинических проявлений SIRS [156]. Реамберин способствует сохранению функциональной активности митохондрий при распространенном гнойном перитоните [66, 67, 68] и при полиорганной недостаточности [119].
Тимоген – синтетический пептид, воспроизводящий один из нативных пептидов тимуса, натриевая соль дипептида глутаминовой кислоты и триптофана (L-Glu--L-Trp). Тимоген связывается с рецепторами белков семейства тимозинов на мембранах клеток [59, 169]. Тимоген запускает генетические механизмы пролиферации клеток [146], защиты от окислительного стресса и апоптоза [366, 515], тормозит эффекты ФНО- и экспрессию генов ИЛ-8 [483, 517, 516]. Применение тимогена при пневмониях способствует нормализации уровня ИЛ-1, ИЛ-8 и ФНО-, увеличению синтеза IgG, IgM, IgA, снижению уровня белков острой фазы воспаления [59]. Тимоген и пептиды тимуса применяют при панкреатитах, травмах, гнойной хирургической инфекции, перитонитах [146, 149, 169], для снижения послеоперационных осложнений в абдоминальной хирургии [2] и травматологии [59].
Имунофан – тимусный препарат третьего поколения, синтетический пептид (Arg--Asp-Lys-Val-Tyr-Arg), производное тимопоэтина (thymopoietin) [169]. Имунофан стимулирует пролиферацию CD3+, CD4+, CD8+, CD22+, CD16+ лимфоцитов, стимулирует фагоцитарную, бактерицидную активность нейтрофилов, синтез IgG и IgА, повышает продукцию ИФН- и ИФН- [6, 49, 146, 169].
Имунофан эффективен при стрессовых расстройствах [84] и лечении язвенной болезни [42]. Применение тимопоэтина в послеоперационном периоде восстанавливает уровень синтеза ИЛ-2 [146, 147, 333] и способствует профилактике гнойных осложнений [26]. У пациентов с панкреонекрозом имунофан нормализует количество CD3+ и CD4+ клеток, продукцию ФНО-, ИЛ-l, ИЛ-8, ИЛ-4 [116]. Имунофан ослабляет лекарственную устойчивость бактерий за счет воздействия на транспортные белки [169], стимулирует кислородзависимый метаболизм и фагоцитарную активность перитонеальных макрофагов [73]. Применение имунофана у пациентов с разлитым гнойным перитонитом способствует увеличению количества CD2+, CD3+, CD4+ лимфоцитов, снижению продукции ИЛ-1, ФНО- [73] и снижению летальности [142]. У пациентов с послеоперационными гнойно-воспалительными осложнениями включение в комплексную терапию имунофана способствует нормализации иммунного статуса и сокращению сроков лечения [5, 50].
Полиоксидоний (азоксимера бромид, сополимер N-окси-1,4-этиленпиперазина и (N-карбокси)-1,4-этиленпиперазиния бромида) – линейный полимер с молекулярной массой около 100 кДа, по своей структуре близок к естественным полимерам-участникам азотистого обмена [146, 159]. Прямое действие полиоксидония повышает устойчивость мембран клеток к цитопатическим воздействиям [159]. Полиоксидоний способен проникать в клетки: причём более интенсивно проникает в моноциты, чем в лимфоциты [34]. Полиоксидоний увеличивает продукцию эндогенной перекиси водорода и повышает бактерицидность лейкоцитов на 44–75% в отношении фагоцитированных бактерий Staphylococcus aureus [34]. Способностью проникать внутриклеточно может быть обусловлено свойство увеличивать эффективность действия антибиотиков. Полиоксидоний стимулирует продукцию ИЛ-1 и ИЛ-6 и нормализует синтез ФНО- [34]. Использование полиоксидония позволяет повысить эффективность и снизить продолжительность лечения при бактериальных пневмониях [75, 146].
Ронколейкин – лекарственная форма рекомбинантного ИЛ-2 [139], стимулирует иммунные реакции в отношении вирусных и бактериальных инфекций [328]. ИЛ-2 является индуктором пролиферации T-лимфоцитов и их предшественников, синтеза ИФН- [61]. Введение в предоперационном периоде препаратов ИЛ-2 предотвращает развитие в послеоперационном периоде лимфопении, толерантности к антигенам и гипоергии [61], снижения количества CD4+ клеток и соотношения CD4+ / CD8+, развивающихся в результате хирургической травмы [280, 442, 478]. Назначение ИЛ-2 снижает уровень продукции ИЛ-6 в послеоперационном периоде и частоту развития осложнений [177]. Ронколейкин показал хорошие результаты у пациентов с онкопатологией для коррекции нарушений клеточных популяций лимфоцитов и фагоцитарного звена иммунной системы в послеоперационном периоде [97] у пациентов с колоректальным раком [177, 280] и при раке желудка [53, 442]. Ронколейкин рекомендован для применения у пациентов с септическими состояниями и панкреонекрозами [47, 108, 109]. ИЛ-2 является не только фактором иммунорегуляции, но и оказывает анальгезирующее действие, связываясь с опиоидными рецепторами, что роднит его с даларгином [347]. Препараты ИЛ-2 усиливают действие антибактериальной терапии при инфицировании резистентными возбудителями [337], поэтому наиболее эффективные схемы применения ронколейкина отмечены при его сочетании с антибиотиками [139]. Однако длительное применение ИЛ-2 снижает реактивность иммунной системы к повторным инфекциям [328].
Реаферон-ЕС-липинт – липосомированный препарат рекомбинантного интерферона -2b. Препараты ИФН- способны ингибировать синтез интерферонов ИФН- нивелировать его негативное влияние на синтез антител [7, 19]. Применение интерферонов эффективно для лечения пациентов с гнойными инфекциями в хирургии, гинекологии и акушерстве, при сепсисе [7, 55, 115]. Подтверждено эффективное использование интерферонов для коррекции иммунологической недостаточности при лечении пациентов с травмами [175] и для коррекции послеоперационной иммуносупрессии [392]. Препараты интерферонов нормализуют количество нейтрофильнох гранулоцитов, экспрессирующих CD16 и CD95 в послеоперационном периоде у пациентов после дуоденопластики [48]. Рекомендовано применение интерферонов после санации очага гнойной инфекции в послеоперационном периоде [65] и для профилактики и терапии пневмоний [123, 143].
Иммуноглобулины для внутривенного применения являются важным компонентом интенсивной терапии пациентов с иммунологической недостаточностью. Применение иммуноглобулинов позволяет в кратчайшие сроки создавать в крови высокие концентрации антител [121]. Заместительная терапия внутривенными иммуноглобулинами является эффективным методом профилактики гнойно-септических осложнений послеоперационного периода [21, 62, 392], способствует очищению гнойных ран [151]. Применение иммуноглобулинов увеличивает эффективность лечения сочетанных травм [175], послеродового эндометрита [55]. Препараты иммуноглобулинов способны модулировать активность лейкоцитов и фагоцитарных клеток, а также проявляют антиоксидантные свойства, нейтрализуя свободные радикалы [100], инактивируют некоторые токсины [75]. В составе препаратов иммуноглобулинов есть антитела к бета-лактамазам, поэтому применение иммуноглобулинов усиливает действие антибактериальных препаратов [121]. Препараты иммуноглобулинов рекомендованы для лечения сепсиса [21, 450, 456]. Однако, влияние препаратов внутривенных иммуноглобулинов на организацию иммунных реакций носит модулирующий нелинейный характер, связанный с дозировкой на единицу массы тела [100]. Также остаются спорными вопросы о про- и противоапоптотических эффектах внутривенного введения иммуноглобулинов [198].
Несмотря на положительный опыт применения иммунотропных препаратов, иммунокоррекция не применяется как неотъемлемый компонент комплексного лечения, поскольку применение иммунотропных лекарственных препаратов с использованием традиционных подходов к назначению недостаточно эффективно [44, 176]. Непредсказуемось эффективности иммуномодуляторов является следствием особенностей функционирования иммунной системы: действие препаратов приводит к перераспределению эффектов на все элементы иммунной системы в зависимости от их функционального состояния [95, 159]. При оценке иммуномодулирующих препаратов при классических характеристиках фармакодинамических процессов выявляется неоднородность эффектов, которые связывают с неизвестными особенностями рецепторных взаимодействий [268]. Многие препараты, как новейшие, так и традиционно используемые, не проходят испытаний с позиций доказательной медицины [513]. Даже препараты с высокой специфичностью (ронколейкин) не обладают однозначно предсказуемым эффектом, поскольку не выявлено цитокинов со строго определенным действием [159].
Внедрение в клиническую практику многих дорогостоящих вмешательств требует подтверждений их эффективности, основанных на принципах доказательной медицины. При обзоре проведенных исследований эффективности иммунотропной терапии среди 502 работ только 18 были признаны соответствующими уровню доказательств 1b и 2b [175]. Важным моментом на пути повышения эффективности иммунокоррекции является системный подход при назначении ИТЛС. Среди принципов назначения иммунотропных препаратов, разработанных A. M. Земсковым и В. М. Земсковым [39, 41, 46], необходимо отметить следующие: 1) иммунокорректоры назначают как дополнение этиотропной терапии; 2) обязательна оценка характера иммунных нарушений; 3) необходимо учитывать другие особенности пациента; 4) необходимо учитывать иммунологические эффекты традиционных лекарственных средств; 5) необходимо учитывать сочетанные и побочные действия иммунотропных препаратов; 6) необходимо учитывать плейотропность действия иммунотропных лекарственных средств на различные звенья иммунной системы; 7) необходимо учитывать возможное изменение эффектов иммунотропных лекарственных средств в зависимости от особенностей иммунной системы пациента; 8) выраженность эффекта коррекции выше в остром периоде заболевания, чем в стадии ремиссии; 9) необходима предварительная оценка возможного эффекта применения иммунотропных лекарственных средств.
По мнению P. M. Хаитова и Б. В. Пинегина [157, 158], качественные изменения применения иммунотропных лекарственных средств заключаются в переходе от эмпирического назначения препаратов к поиску научно обоснованных подходов к выбору ИТЛС. Интегрируя многолетний опыт применения иммуномодуляторов, отечественные ученые считают необходимым учитывать этиологию заболевания, характер и стадию патологического процесса, а также основные фармакологические свойства иммуномодуляторов [95].
Однако, как было показано выше, имеется следующая совокупность особенностей проведения иммунотропной терапии:
- Разнообразие, сложность и разнонаправленность действия этиологических и патогенетических факторов приводят к трудностям оценки их совместного влияния на состояние иммунной системы и тяжесть состояния у пациентов с УХП.
- Иммунная система отличается сложностью внутренних и межсистемных механизмов регуляции, что проявляется трудностью прогнозирования адаптационных реакций на внешние воздействия.
- Иммунотропные препараты отличаются уникальными фармакологическими свойствами, которые нивелируются плейотропным эффектом при их практическом применении: смещение эффектов иммунотропных препаратов зависит от тонких настроек регуляции состояния иммунной системы.
- Количество клинических и лабораторных показателей, достаточное для оценки состояния иммунной системы пациентов, не определено вследствие отсутствия четких границ иммунной системы и по причине отсутствия показателей для мониторинга, обладающих универсальной информативностью.
- Интерпретация любых изменений лабораторных показателей является неоднозначной вследствие сложного поведения иммунной системы.
Таким образом, назначение иммунотропных лекарственных средств не может быть основано только на синтезе эмпирического и патогенетического подходов. Учитывая сложность реакций иммунной системы, личный опыт и интуиция врача являются важными [78], но недостаточными для выбора эффективной иммунокоррекции. Каждая из перечисленных особенностей приводит к неопределенности, устранение которой является сложной комплексной задачей. Очевидно, что совокупность этих задач невозможно решить эмпирическими методами. Выбор эффективной иммунотропной терапии у пациентов с УХП можно сформулировать как проблему, требующую принципиально новых подходов к её решению.
1.5. Предпосылки и методологические основы выделения стадий функциональной организации иммунной системы
В клинической практике оценка иммунного статуса пациента важна для диагностики, мониторинга состояния пациента и выбора оптимальной лекарственной терапии. Однако информативность показателей иммунного статуса не всегда соответствует ожиданиям. Показатели строго индивидуальны для каждого пациента. Это проявляется в том, что тяжесть состояния не всегда соответствует значениям показателей. Пациент в тяжёлом состоянии может иметь более выигрышные значения показателей. Напротив, пациент с более благоприятным течением заболевания может отличаться неблагоприятными значениями лабораторных показателей. Применение иммунотропных препаратов при улучшении клинической картины может сопровождаться изменением значений показателей в неблагоприятную сторону. При этом наши общие классические представления о положительных или отрицательных изменениях в иммунной системе остаются верными. Врач имеет дело с индивидуальным лечением пациента, руководствуясь стандартными статистическими данными. Однако в частных случаях клинической практики они не всегда оправдываются. При длительных клинических наблюдениях складывается впечатление о наличии сложных закономерностей организации иммунной системы. Размышления о вариантах исследования таких закономерностей наталкиваются на необходимость найти теоретическое обоснование нечастым, но противоречивым фактам.
Принципы интегральной оценки состояния иммунной системы усложнялись одновременно с пониманием механизмов иммунорегуляции и в сочетании с повышением доступности вычислительной техники и развитием пользовательских методик математической обработки данных.
На вычислении величины отклонений показателей от средних нормальных значений основаны системы оценки иммунологических нарушений и выбора препаратов для иммунокоррекции, предложенные A. M. Земсковым с соавт. и другими исследователями [13, 40, 88, 89]. Однако очевидно, что нормальные величины показателей приемлемы только для здоровых людей; благоприятное течение патологических состояний предполагает собственные значения показателей, оптимальных для положительной динамики и благоприятного исхода заболевания [77, 527]. Вероятно, что по мере улучшения состояния пациента границы адекватных состоянию показателей должны смещаться.
Известные закономерности функционирования иммунной системы используются для построения моделей – искусственных объектов со сходными свойствами [78]. Предполагается, что применение математических моделей иммунной системы может снизить количество необходимых лабораторных исследований на практике [102, 103]. Одним из методов оценки состояния иммунной системы и выбора наиболее эффективных препаратов является регрессионный анализ. Регрессионные модели нашли применение в различных областях медицины, например, для прогнозирования течения онкозаболеваний [216, 289], для оценки эффективности вакцинации [410], выбора методов иммунокоррекции [78], для оценки эффективности антибиотикопрофилактики [465] и вероятности инфекционных осложнений в хирургии [421].
Другим направлением изучения иммунитета является имитационное моделирование характеристик иммунной системы. Заслуживает внимания базовая математическая модель инфекционного заболевания, предложенная в 1975 году Г. И. Марчуком [90, 91, 92, 387]. Модель представляет собой систему дифференциальных уравнений с постоянными запаздываниями в фазовых переменных для решения задачи Коши [54]. Модель учитывает следующие процессы: 1) количество инфекционного агента с учётом исходной инфицирующей дозы, динамики размножения и элиминации; 2) распознавание антигенов клетками иммунной системы и бласт-трансформацию В-лимфоцитов в плазматические клетки; 3) динамику синтеза антител, их связывания с антигенами и элиминации; 4) состояние органов и систем, пораженных инфекцией [90, 91, 92, 387]. В ходе вычислительного эксперимента модель позволяет описывать следующие формы инфекционного процесса: 1) абортивную форму при элиминации патогена; 2) острый инфекционный процесс, заканчивающийся выздоровлением; 3) летальную форму инфекции; 4) хроническую инфекцию. Применение математического анализа позволило формализовать работу иммунной системы как единого целого [54, 92].
Для описания состояния иммунной системы при онкологической патологии предложены несколько математических моделей, в которых используются системы уравнений, включающие от 5 до 7 дифференциальных уравнений [52]. Модель гуморальных реакций иммунной системы включает систему из 5 дифференциальных уравнений [79]. Для описания воспалительных процессов в лёгких предложена модель из 10 дифференциальных уравнений [131]. Другой автор для исследования противоопухолевого иммунитета предложил математическую модель, описывающую соотношения макрофагов, Т-лимфоцитов и учитывающую продукцию ИЛ-2, состоящую из 11 обыкновенных дифференциальных уравнений и 5 алгебраических уравнений [380]. Авторы похожих математических моделей инфекционных заболеваний предлагают уменьшить степень свободы системы уравнений за счет учёта только наиболее эффективных механизмов реагирования [54, 130, 131] и выходят к пониманию принципа оптимальности [485, 527]. При этом для коррекции неточностей модели предлагается учитывать эволюцию во времени её характеристик [54]. Необходимо отметить, что в ряде имитационных моделей динамика клеточных популяций представляет собой неравномерные волновые процессы в сочетании с существованием стационарных состояний [52, 423, 424].
Степень сходства иммунной системы и модели зависит от объёма теоретических знаний о закономерностях работы иммунной системы человека при заданных клинических условиях, а также от индивидуального объёма обследования пациента. При этом для качества модели огромное значение имеет точность исходных характеристик [29, 86, 87]. По мере выполнения расчетов, удаленных от начальной точки вычислений, стремительно растет погрешность принимаемых решений [29, 86, 87]. Практическое применение подобных моделей также затруднено. Причинами этого являются: необходимость учёта большого количества данных, невозможность получения полных данных, необходимость подстраивания модели под наблюдаемые явления [54, 387]. Например, актуальной задачей для повышения качества таких моделей является поиск алгоритмов запаздывания [30, 31]. Такие вспомогательные задачи выходят на первый план и приобретают самостоятельное значение.
Предложенные модели созданы для идеальных условий и описывают инфекционный процесс в замкнутой системе, рассматривая организм пациента как единое целое. Это повышает требования для точности, времени обследования пациента и при этом резко увеличивает объём необходимых лабораторных исследований. Для того чтобы подобные математические модели могли учитывать воздействия вновь выявленных патогенетических факторов, их необходимо дополнять новыми системами уравнений [155]. Уточнение модели имеет свои ограничения: поскольку в реальной иммунной системе все элементы связаны между собой, количество уравнений должно лавинообразно нарастать пропорционально факториалу (n!) количества учитываемых показателей иммунной системы [17, 122]. Нахождение оптимальных параметров модели – результат компромисса между неточностью в результате ограничения количества переменных и неточностью в результате затруднения получения исчерпывающей информации о теоретических механизмах организации иммунной системы в совокупности с трудностью обследования пациента в достаточном объёме [131]. Очевидно, что эти противоположные тенденции находятся в стороне от практической реализации.
Сложные самоорганизующиеся системы с неочевидными закономерностями называют антиинтуитивными [113, 126]. Поэтому другие исследователи считают перспективным для практического использования не имитационное моделирование, а изучение сложных самоорганизующихся систем посредством анализа их характеристик в динамике [81, 82]. В данном случае уместна аналогия с квантовыми вычислениями, при реализации которых в качестве ячейки памяти используют объект природного происхождения с квантовыми свойствами, поскольку такие свойства невозможно воссоздать искусственно в цифровой системе вычислений, т.е. математически моделировать [14, 287].
Новым направлением исследований является изучение факторов, под воздействием которых иммунная система формирует и перестраивает принципы управления и функциональные связи между её элементами, адекватные по отношению к внешним влияниям [105, 106, 110, 111, 310]. Количественно оценить действие факторов можно с помощью значений главных компонент, вычисляемых в процессе анализа данных [105, 106, 310]. Информативность главных компонент существенно превышает информативность реальных клинико-лабораторных показателей [201, 262], поэтому подобный подход является перспективным для решения клинических задач.
Оценка состояния иммунной системы, информативная для использования в клинической практике, должна отвечать следующим условиям:
- Основываться на универсальных принципах, применимых для оценки состояния иммунной системы при любых патологических состояниях.
- Адекватно оценивать состояние иммунной системы в условиях ограниченного объёма исследований, либо не требовать неорганиченного увеличения объёма исследований.
- Адекватно оценивать состояния иммунной системы без исследования высокоспецифических показателей.
- Учитывать не только специфические процессы внутри иммунной системы, но и косвенно отражать процессы, протекающие за пределами «горизонта исследований», т.е. вне пределов, доступных для изучения.
- Учитывать неоднородные характеристики иммунной системы: волновой или стадийный характер организации иммунных реакций.
- Учитывать адаптивный, приспособительный характер организации иммунной системы и принципы оптимальности, лежащие в его основе.
Важным свойством иммунной системы является резервирование функций, которое проявляется, например, многократным дублированием действия цитокина другими цитокинами. При экспериментальном моделировании отсутствия ИЛ-2 его функцию замещают цитокины: ИЛ-4, ИЛ-7, ИЛ-15, а также совместное действие комбинации цитокинов: ИЛ-1, ИЛ-6, ИЛ-12, ФНО- [168]. Сходные принципы замещения эффектов описаны и для других цитокинов. Кроме того, для системы цитокинов характерна плейотропность действия, которая заключается в множественности эффектов цитокинов за счёт функционального разнообразия популяций клеток-мишеней [168].
Другим важным свойством является фазность иммунных реакций. Цитокины начальных периодов воспаления стимулируют продукцию цитокинов последующих фаз воспаления, являющихся ингибиторами продукции цитокинов-индукторов собственного синтеза. Например, ИЛ-6, обладающий провоспалительными эффектами в отношении популяции B-лимфоцитов, ингибирует синтез ИЛ-1, ФНО- [15, 137, 150, 168, 487], стимулирует синтез ИЛ-1-РА, апоптоз нейтрофилов и, в целом, индуцирует активность клеток, характерную для стихания острой фазы местного воспалительного процесса [15, 137, 487].
Сложность принципов регуляции иммунных функций и взаимодействия с участием цитокиновой сети связаны с взаимными влияниями не только между всеми элементами иммунной системы, но и с элементами других регуляторных систем [168]. В целом, система цитокинов представляет скорее язык межклеточной кооперации, в котором важнейшее смысловое значение отводится последовательности синтеза сигнальных молекул [85, 229, 361, 521]. Несмотря на значительные объёмы накопленного научного материала по организации межклеточных взаимодействий с помощью сигнальных молекул в иммунной системе и на межсистемном уровне, анализ результатов этих исследований не выходит из контекста отдельных клинических ситуаций или исследовательских задач.
Решение подобных задач возможно лишь при переходе с эмпирического этапа исследований на аналитический, с привлечением методов анализа, способных сформулировать принципы организации сложных самоорганизующихся биологических систем.
При этом улучшение диагностических возможностей и внедрение в клиническую практику новых лабораторных индикаторов не является методологически безупречным. Любой из показателей, сопряженный с иммунной системой, может изменяться антиинтуитивно. Поэтому наиболее правильным вариантом решения проблемы интерпретации результатов исследования иммунного статуса является попытка найти обоснования сложных реакций иммунной системы с позиций формирования адаптационных реакций и системного анализа. Наиболее точно стоящие перед нами задачи описывает высказывание основателя синергетики Германа Хакена (Hermann Haken): «Информацию, перегруженную огромным количеством деталей, затемняющих существо дела, необходимо сжать, превратив в небольшое число законов, концепций или идей» [126].
Подобное рассмотрение иммунной системы позволит шире смотреть на принципы организации иммунной системы, избавит исследователей и врачей от противоречий, позволит увидеть закономерности в частных случаях и исключениях из правил. Клиническими результатами могут стать улучшение диагностики и оптимизация лечебных воздействий.
Для понимания процессов функциональной организации иммунной системы, прежде всего, необходимо попытаться оценить клинические данные непредвзято, не обращаясь к частным закономерностям. Фактически, нужно попытаться найти закономерности de novo. Результатом должна стать модель организации иммунной системы, полностью согласующаяся с классическими представлениями и также объясняющая исключения из правил.
Решая научные и практические задачи, врачу постоянно приходится сталкиваться как с упорядоченными (детерминированными), так и со случайными (неупорядоченными) процессами [473]. Комбинация управляемости и пластичности, является характерным свойством биологических систем [291]. Другим основным свойством биологических систем является их антиинтуитивность [64]. Она проявляется непредсказуемой реакцией на внешние, привычные воздействия. Применение лекарственных средств без учёта особенностей организации патологического процесса у конкретного пациента может привести как к отсутствию какого-либо эффекта, так и вызвать нежелательные изменения здоровья. Предполагается, что причиной антиинтуитивного поведения биологических систем является гетерогенность их функциональной организации [291].
В семидесятые годы XX века на основе принципов системности сформировалась новая наука – синергетика, допускающая возможность самоорганизации систем из отдельных элементов [8, 113, 152]. Синергетика объединила в себе все новейшие представления о принципах организации материи. Ключевой момент синергетики – концепция сложных адаптивных систем [81, 82, 308]. Установлено, что не только живые структуры, но и любые системы с заданными свойствами способны к построению взаимосвязей между элементами и самоорганизации [291, 365]. Существование внутри биологической системы множества относительно автономных подсистем, для которых сигналы управления не имеют характера жестких команд, повышает устойчивость системы в целом [82, 473] и определяет её способность к самоорганизации, то есть спонтанному образованию и развитию сложных упорядоченных структур [82, 365, 534]. Образование новых и утрата старых функциональных связей – естественное для биологических объектов свойство – является материальным проявлением колебания состояния системы между упорядоченностью и хаотичностью [353, 443].
Под действием внешних факторов биологические системы способны к функциональным перестройкам. Нередко именно возникновение или изменение функциональных связей служит первым признаком внешнего воздействия. Эти изменения лежат в основе процессов адаптации [291, 443]. Успешная адаптация предполагает такую организацию взаимодействий между элементами биологической системы, чтобы в новых условиях последняя находилась в наиболее выгодном, устойчивом состоянии [415].
Применение методик изучения самоорганизующихся систем в медицине позволяет оценивать с новых позиций состояние организма [118, 199, 200, 382]. Принципы теории самоорганизации систем применяются для описания процессов работы мозга [226, 271], миокарда [82, 364, 371], дифференцировки стволовых клеток [303], возникновения онкологической патологии [322], биологии старения [365, 367], фармакодинамики лекарственных препаратов [251]. В живых организмах колебания состояния зависят от соотношения внешних факторов [20, 81, 384] и параметров нервной, иммунной, эндокринной систем [113]. Высокая степень вариабельности взаимодействий между компонентами иммунной системы служит основой для выбора наиболее эффективного способа иммунного ответа [199, 305, 373]. Межклеточная кооперация с участием иммунной системы также описывается как совокупность процессов с непостоянной упорядоченностью [510], а иммунодефицитные состояния можно рассматривать как дезорганизацию межклеточных взаимодействий и утрату функциональных связей между элементами иммунной системы [196].
Таким образом, любую сложную биологическую систему можно представить как совокупность функционирующих элементов, в зависимости от условий обладающих как свойствами строгой упорядоченности и иерархичностью организации, так и дезорганизацией внутренних связей, нестабильностью и хаотичностью [251, 283, 291, 415].
С позиций современных научных знаний иммунной системе присущи основные классические свойства самоорганизующихся систем [20, 251]:
- Существование собственных механизмов управления [384].
- Иерархичность, проявляющаяся наличием в системе элементов разного уровня соподчиненности [384, 506].
- Структурная организация, обеспечивающаяся за счет взаимодействий между элементами системы [305].
- Проявление локальных взаимодействий в системе на макроуровне [360, 415, 434, 526].
- Множественность устойчивых состояний [82, 305, 353].
- Резервирование механизмов функционирования, обеспечивающее устойчивость системы к повреждениям [308, 316, 367].
- Адаптивность – способность переходить из одного устойчивого состояния в другое, которое сопровождается качественными, скачкообразными изменениями поведения системы [494].
- Нелинейная динамика свойств за счет перехода из одного устойчивого состояния в другое при исчерпании резерва устойчивости [371, 385, 415, 505].
- Сложность строения и поведения, при которых свойства системы как целого превосходят сумму свойств ее отдельных элементов [291, 407, 413, 494, 510, 524].
Самоорганизация возникает за счет возникновения и динамического изменения характера взаимодействий между элементами системы [20, 251]. Для выявления структурно-функциональных особенностей организации иммунной системы нужно особенно отметить несколько свойств.
Стадийность функциональной организации биологических систем подтверждается накопленным опытом в различных областях медицины. Важнейшим условием для возникновения стадийной структуры внутри самоорганизующихся систем является резервирование составляющих элементов и/или механизмов, обеспечивающих её функционирование [459, 473, 534]. Резервирование позволяет не изменять структурные и функциональные связи между элементами системы, сохранять принципы управления и устойчивость работы системы при возрастании нагрузки [459, 473, 534]. В этом случае система компенсирует возрастание нагрузки включением незадействованных элементов (для иммунной системы – клеток и механизмов регуляции) и постепенным увеличением нагрузки на отдельные элементы без внешних проявлений структурных и функциональных перестроек [459, 473, 534]. При истощении резервных возможностей системы вследствие критического увеличения нагрузок система вынужденно перестраивается, оптимизируя свою организацию для работы в новых условиях, по возможности оставляя резервные элементы для компенсации возможного дальнейшего увеличения функциональных нагрузок [291, 459, 473, 534].
Очевидно, что в момент перехода из одного состояния в другое изменится характер и сила взаимодействия между элементами системы; изменятся или исчезнут старые связи – и появятся новые. Стадийный характер организации функциональной системы предполагает нелинейность свойств и, как следствие, непредсказуемый характер реакций на внешние воздействия, антиинтуитивность поведения системы как единого целого.
Стремление элементов системы к оптимальным характеристикам неизбежно приводит к математической неоднородности массивов данных. Под влиянием внешних воздействий, внутри массива составляющих систему элементов появляются области, в которых связи приобретают высокую степень упорядоченности [81, 82, 415, 534]. Эти области принято называть «центрами кристаллизации» (рис. 1).
Для поддержания наиболее выгодного функционального состояния каждый регистрируемый показатель стремится к оптимальному значению (рис. 1). Поэтому плотность показателей в областях значений, близких к «центрам кристаллизации», максимальна. Наоборот, на периферии «центров кристаллизации» плотность значений показателей минимальна, поскольку их значения стремятся к изменению в сторону наиболее близкого «центра кристаллизации» (рис. 1).

Рис. 1. Упрощенная схема образования кластеров
Число «центров кристаллизации» зависит от ширины диапазона значений исследуемых показателей. Чем больше состояний системы входит в массив анализируемых данных, тем больше упорядоченных областей данных можно выделить внутри него. Это свойство было описано при изучении характеристик самоорганизации иммунной, нервной систем, экспрессии генов [494]. С учётом изменения внешних влияний, каждый центр кристаллизации можно охарактеризовать как стадию функциональной организации системы [534].
В практической деятельности невозможно учесть и измерить количественно все факторы, действующие на изучаемое явление. Поэтому современная прикладная наука рассматривает любую систему элементов как открытую, то есть обменивающуюся энергией и информацией с внешней средой [81, 82]. При рассмотрении открытой системы возникает опасение, что исследование затронет лишь часть системы и важнейшие связи будут упущены из виду. Однако исследователи утверждают [8, 82], что достоверное описание принципов функционирования сложной саморегулирующейся системы возможно при исследовании любой её структурной части.
1.6. Выводы: пути решения проблемы эффективности иммунотропной терапии
На современном этапе развития медицинской науки сохраняет свою актуальность проблема лечения пациентов с УХП органов брюшной полости. Прежде всего, это обусловлено стабильно высокими показателями уровня заболеваний и травм органов брюшной полости, требующих экстренного оперативного лечения. Ургентный характер патологии определяет высокую частоту развития инфекционных осложнений и перитонита, SIRS, полиорганной недостаточности и, как следствие – неблагоприятных исходов заболеваний. Важнейшими факторами усугубления тяжести состояния пациентов являются неизбежная хирургическая агрессия и воспалительный процесс.
Иммунологические механизмы являются неотъемлемой составляющей патогенеза послеоперационного периода. Активация провоспалительных механизмов по принципу отрицательной обратной связи приводит к запуску комплекса противовоспалительных влияний (CARS). При их избыточности развивается послеоперационная иммуносупрессия, увеличивающая риск развития послеоперационных осложнений. При недостаточности противовоспалительных влияний происходит генерализация действия провоспалительных цитокинов, развитие медиаторной бури с последующим истощением про- и противовоспалительных механизмов и развитием иммунологического паралича. Течение этих процессов проявляется развитием клиники SIRS, присоединение сепсиса, септического шока и полиорганной недостаточности.
Существенной проблемой оценки состояния иммунной системы является сложность ее функциональной организации. Исследования свидетельствуют о нелинейной динамике зависимости между показателями иммунной системы и состоянием пациента. Надежность иммунологического надзора обеспечивается многократным резервированием элементов иммунной системы и механизмов внутрисистемных и межсистемных взаимодействий. Существование особенностей реагирования или дефектов может быть компенсировано за счет привлечения ассоциированных механизмов регулирования иммунных функций. Практическими следствиями этого являются трудности интерпретации показателей иммунного статуса и затруднения объективной оценки состояния иммунной системы.
Управление состоянием иммунной системы для снижения рисков развития послеоперационных осложнений и неблагоприятных исходов представляется актуальным направлением клинической иммунологии. Существуют множество препаратов и продолжают разрабатываться новые для воздействия на отдельные элементы иммунной системы и механизмы регулирования. Однако, многочисленные связи между элементами иммунной системы приводят к плейотропному эффекту большинства препаратов, применяемых для иммунокоррекции. Поэтому результаты иммунотропной терапии трудно прогнозировать, а эффективность действия препаратов сложно обосновать с позиций доказательной медицины.
Актуальной остается проблема поиска ключевых показателей для мониторинга состояния иммунной системы. Увеличение объёма знаний об организации иммунитета расширяет границы межсистемных взаимодействий и требует оценки состояния показателей, относящихся к смежным системам. Также углубленно изучаются молекулярные механизмы регулирования внутри иммунной системы. В этих условиях исследователь вынужден в качестве одного из важнейших приоритетов рассматривать поиск информативных показателей.
Опираясь на вышеизложенные факты, целесообразно рассматривать иммунную систему как открытую, свободно обменивающуюся информацией и энергией с внешней средой и оптимизирующую механизмы саморегуляции в соответствии с влияниями внешних факторов. Можно предположить стадийный характер организации иммунного ответа как проявление свойства самоорганизации биологических систем. При анализе больших объёмов данных, в зависимости от силы и характера внешних патогенетических влияний, среди общего массива показателей иммунного статуса должны образовываться области уплотнения данных с сильными, упорядоченными взаимодействиями между элементами. В областях разреженных данных внутренние связи остаются менее упорядоченными. Стадия функциональной организации и удаление показателей пациента от «центра кристаллизации» могут служить предикторами для оценки состояния пациента, прогнозирования течение заболевания и эффективности лекарственных воздействий.
Необходимость эффективной коррекции состояния иммунной системы, демонстрирующей антиинтуитивное реагирование на внешние факторы, позволяет представить иммунокоррекцию у пациентов с УХП как актуальную проблему клинической иммунологии. Использование принципов стадийной организации иммунной системы открывает новые возможности для оптимизации иммунотропной терапии при иммунодефицитных состояниях.
Глава 2
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В проведении работы участвовали следующие научные организации, учебные заведения и лечебные учреждения:
- ФГБУ «НИИ клинической иммунологии СО РАМН», г. Новосибирск;
- ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В. Ф. Войно-Ясенецкого» Министерства здравоохранения Российской Федерации, г. Красноярск.
2.1. Материалы исследования
Работа включала следующие этапы собственных исследований:
- Исследование информативности иммунологических показателей для оценки клинических характеристик пациентов (глава 3).
- Исследование функциональной организации иммунной системы у пациентов с УХП. Оценка информативности показателей иммунного статуса. Выделение кластеров иммунного статуса. Исследование особенностей показателей состояния пациентов, принадлежащих к различным кластерам иммунной системы (глава 4).
- Разработка способа прогноза исхода заболевания у пациентов с УХП, оценка его чувствительности и специфичности (глава 5).
- Исследование особенностей действия иммунотропных лекарственных средств у пациентов с УХП. Разработка способа подбора оптимальной иммунотропной терапии (глава 6).
- Оценка эффективности индивидуального подбора иммунотропных лекарственных средств у пациентов с УХП (глава 7).
2.1.1. Дизайн исследования
Критериями включения пациентов в исследование являлись:
- Наличие УХП органов брюшной полости, требовавшей экстренного оперативного вмешательства
Критериями исключения являлись:
- Возраст моложе 18 и старше 70 лет.
- Хроническая соматическая патология.
- Лекарственная аллергия.
- Наличие сопутствующей патологии ЦНС (в том числе травм головного мозга).
Критериями формирования групп были следующие:
- Нозологическая характеристика патологии органов брюшной полости.
- Кластерная принадлежность показателей иммунного статуса пациентов.
- Применение иммунотропных препаратов в ходе лечения.
Были сформированы следующие группы пациентов:
- Группа 1 – пациенты, получавшие стандартную комплексную терапию без применения ИТТ (173 человека).
- Группа 2 – пациенты, получавшие комплексную терапию с применением ИТТ на основании традиционных показаний к их применению с учётом показателей иммунного статуса (275 человек).
- Группа 3 – пациенты, получавшие комплексную терапию с применением ИТТ на основании разработанного метода выбора оптимальной иммунотропной терапии (250 человек).
- Группа контрольная – пациенты с распространенным перитонитом средней степени тяжести для оценки качества модели оценки тяжести состояния (80 человек).
Для выделения стадий функциональной организации иммунной системы у пациентов с УХП органов брюшной полости использованы результаты обследования пациентов 1-ой и 2-ой групп в динамике лечения.
Для сравнительной оценки информативности шкал тяжести состояния и разработки «Способа оценки степени тяжести состояния и прогноза исхода заболевания пациентов с УХП органов брюшной полости» использованы результаты обследования пациентов 1-ой и 2-ой групп в динамике лечения. Для оценки качества модели дополнительно были обследованы пациенты с распространенным перитонитом средней степени тяжести (группа контрольная).
Для оценки эффективности применения ИТТ и разработки «Способа подбора оптимального лекарственного препаратов для иммунокоррекции у пациентов, оперированных на органах брюшной полости» использованы результаты обследования пациентов 2-ой группы в динамике лечения.
Для оценки «Способа подбора оптимального лекарственного препаратов для иммунокоррекции у пациентов, оперированных на органах брюшной полости» использованы результаты его применения у пациентов 3-ей группы. Схематично дизайн исследования представлен на рисунке 2.
2.1.2. Нозологические характеристики пациентов
Обследованы 698 пациентов с патологией органов брюшной полости, требовавшей экстренного оперативного лечения. Группы пациентов были исходно сопоставимы по характеру патологии, тяжести состояния, возрасту и половому составу (табл. 1). Оперативное лечение включало лапаротомию, ревизию органов брюшной полости, устранение последствий травмы или ранения, ликвидацию (по возможности) очага инфекции. При невозможности одномоментного устранения гнойного или некротического процесса в брюшной полости проводили программированные релапаротомии. В случае сохранения симптомов интоксикации и гнойного отделяемого по дренажам на фоне интенсивной терапии проводили релапаротомии по требованию. Все пациенты получали инфузионную, детоксикационную и антибактериальную терапию в объёме, адекватном тяжести состояния.
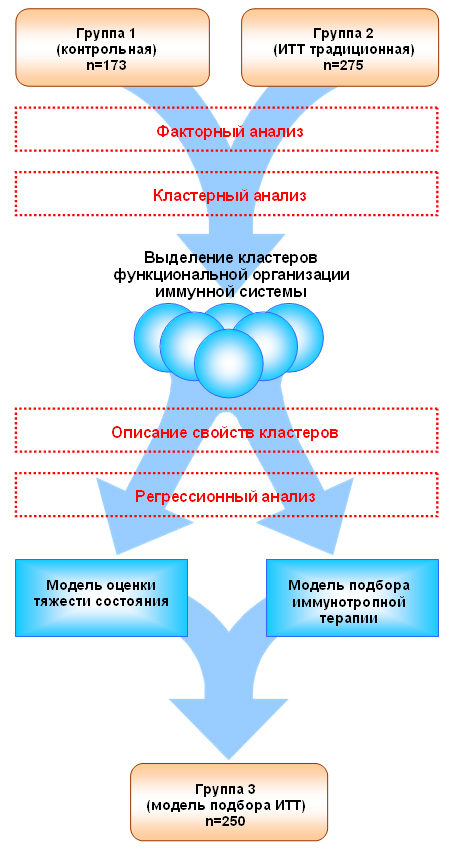
Рис. 2. Дизайн исследования
Таблица 1
Клинико-нозологические характеристики групп пациентов
| Показатель | Группа 1 | Группа 2 | Группа 3 | 21-2; p1-2 | 21-3; p1-3 | 22-3; p2-3 |
| Число пациентов | 173 | 275 | 250 | – | – | – |
| Возраст, лет (M±m) | 41,51 ±1,20 | 41,07 ±0,96 | 43,36 ±1,10 | 0,70 | 0,41 | 0,19 |
| Половой состав (мужчин / женщин) | 104 / 69 | 151 / 124 | 154 / 96 | 1,17; 0,28 | 0,09; 0,76 | 2,41; 0,12 |
| ЯБ, осложненная перфорацией | 53 (30,64%) | 72 (26,18%) | 76 (30,40%) | 1,05; 0,31 | 0,00; 1,00 | 1,15; 0,28 |
| ЯБ, осложненная кровотечением | 8 (4,62%) | 9 (3,27%) | 10 (4,00%) | 0,53; 0,47 | 0,10; 0,75 | 0,20; 0,66 |
| Травмы и ранения органов брюшной полости | 35 (20,23%) | 41 (14,91%) | 35 (14,00%) | 2,14; 0,14 | 2,87; 0,09 | 0,09; 0,77 |
| Травмы селезенки, спленэктомия | 1 (0,58%) | 7 (2,55%) | 5 (2,00%) | 2,34; 0,13 | 1,48; 0,22 | 0,17; 0,68 |
| Панкреонекрозы инфицированные | 18 (10,40%) | 29 (10,55%) | 20 (8,00%) | 0,00; 1,00 | 0,72; 0,40 | 1,00; 0,32 |
| Острая кишечная непроходимость | 7 (4,05%) | 21 (7,64%) | 17 (6,80%) | 2,34; 0,13 | 1,45; 0,23 | 0,14; 0,71 |
| Острый деструк-тивный аппендицит | 9 (5,20%) | 23 (8,36%) | 25 (10,00%) | 1,60; 0,21 | 3,18; 0,07 | 0,42; 0,52 |
| ГВЗПМ | 19 (10,98%) | 24 (8,73%) | 22 (8,80%) | 0,62; 0,43 | 0,56; 0,45 | 0,00; 1,00 |
| НТКС | 76 (43,93%) | 108 (39,27%) | 134 (53,60%) | 0,95; 0,33 | 3,82; 0,05 | 10,82; 0,00 |
| Крона болезнь | 4 (2,31%) | 8 (2,91%) | 5 (2,00%) | 0,15; 0,70 | 0,05; 0,82 | 0,45; 0,50 |
| Абсцессы брюшной полости | 20 (11,56%) | 33 (12,00%) | 29 (11,60%) | 0,02; 0,89 | 0,00; 1,00 | 0,02; 0,89 |
| Пневмония септическая | 4 (2,31%) | 10 (3,64%) | 8 (3,20%) | 0,62; 0,43 | 0,29; 0,59 | 0,08; 0,78 |
| Перитонит диффузный | 111 (64,16%) | 175 (63,64%) | 175 (70,00%) | 0,01; 0,91 | 1,59; 0,21 | 2,39; 0,12 |
| Абдоминальный сепсис | 118 (68,21%) | 184 (66,91%) | 186 (74,40%) | 0,08; 0,78 | 1,94; 0,16 | 3,53; 0,06 |
| Тяжёлый сепсис | 58 (33,53%) | 123 (44,73%) | 132 (52,80%) | 5,53; 0,02 | 15,35; 8,92*10-5 | 3,42; 0,06 |

