« ХАРЬКОВСКИЙ НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ На правах рукописи Коляда Олег Николаевич ...»
Примечание: 3 - р0,05 по сравнению с животными, не подвергавшихся коррекции.
У необлученных животных, которым вводили дипептид глутамил-триптофан (X группа), генерализация инфекционного процесса через неделю наблюдалась в 66,7% случаев. Также существенно снижалась степень обсемененности, которая не превышала 50 КОЕ, по сравнению с животными аналогичной группы, которым вводили метилглюкамина акридонацетат. Через две недели генерализация инфекционного процесса наблюдалась лишь у 16,7% животных, при слабой обсемененности, которая не превышала 20 КОЕ.
Эффект от воздействия дипептида глутамил - триптофана наблюдался и у облученных животных (XI группа), у которых в конце 1-й недели инфекционного процесса в 50% случаев снизилась степень обсемененности, а в конце 2-й недели генерализация наблюдалась лишь у 50% животных, со слабой обсемененностью. Однако, по сравнению с необлученными животными, процент крыс с генерализованной формой инфекционного процесса и степень обсемененности внутренних органов были выше.
Резюме. Недостаточный уровень стимуляции фагоцитарной активности в ответ на введение метилглюкамина акридонацетата у облученных и инфицированных животных снижает скорость элиминации циркулирующих иммунных комплексов и скорости расхода комплемента на активацию комплексов антиген-антитело (ЦИК) по классическому пути.
Положительное влияние дипептид глутамил-триптофана на течение инфекции связано со стимуляцией моноцитарно-макрофагального звена иммунитета и его противовоспалительным действием, которое обеспечивало восстановление баланса IFN-/IL-10. Также, дипептид глутамил-триптофан способствовал формированию более эффективного специфического гуморального ответа на антигены Candida albicans, чем метилглюкамина акридонацетат. У крыс, которым вводили дипептид глутамил-триптофан снижались степень обсемененности внутренних органов и процент животных с генерализованной формой инфекционного процесса. О положительном влиянии используемых иммуностимуляторов на течение инфекции свидетельствует отсутствие летальности у облученных животных.
РАЗДЕЛ 4. АНАЛИЗ И ОБОБЩЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
Широко известно, что в зависимости от дозы и типа ионизирующего излучения его влияние на функциональную активность клеток может иметь различный характер. Многими авторами было показано, что влияние радиации на клетки организма может быть прямым, за счет непосредственного действия излучения на молекулы-мишени, либо опосредованным – путем образования свободных радикалов вследствие изменения биохимических процессов, в том числе распространяться через биологические медиаторы, в частности цитокины [18, 94, 103, 171-173].
Адекватная работа иммунной системы возможна только при условии поддержания определенного баланса про- и противовоспалительных цитокинов. Нарушения гомеостаза цитокинового профиля с большой долей вероятности могут указывать на воздействие различных неблагоприятных факторов на иммунологическую реактивность, и, как следствие, изменение ответа на внешнее воздействие [174-179].
Роль исходных уровней цитокинов в ответе на радиационное воздействие на сегодняшний день не совсем ясна, однако, по результатам некоторых исследований, применение нейтрализующих антител против цитокинов у облученных животных показало, что IL-1 и TNF, содержащиеся в крови и тканях мышей, играют определенную роль в системе радиорезистентности. Кроме того, эти же авторы указывают, что гиперпродукция TNF, IL-1 и IL-6 при травме и сепсисе может оказать повреждающее воздействие на метаболические функции и стабильность гемодинамики. Антитела, нейтрализующие IL-6 и TNF-, смягчают негативные последствия сепсиса, вызванного бактериальными эндотоксинами [13, 18, 19, 180].
Данный факт позволяет по-новому взглянуть на влияние радиации на клетки и организм в целом. По современным представлениям, индукция цитокинов в качестве адаптационного механизма является прямым ответом на экзогенное воздействие. Понимание роли цитокинов в патогенезе различных заболеваний, в том числе и радиационно- индуцированных, создаст предпосылки для разработки улучшенных подходов в терапии патологических процессов, развивающихся на фоне облучения, поэтому одной из целей нашего исследования было изучение воздействия предварительного фракционированного рентгеновского облучения на динамику показателей цитокинового профиля, которые характеризуют состояние поляризации иммунного ответа (Th1/Th2) [4, 18, 33,181].
В результате эксперимента мы получили выраженное и стабильное повышение сывороточного уровня TGF-, которое наблюдалось с 1-х по 17-е сутки. Уровень цитокина превышал значение у интактных животных от 4 до более чем 6 раз и возвращался к исходным значениям на 28-е сутки (рис. 4.1).
TGF- представляет собой плейотропный цитокин, влияющий практически на все типы клеток и в составе иммунной системы выполняющий, прежде всего, регуляторную ингибирующую функцию [71]. Эти же авторы показывают, что у мышей с отключенным геном TGF- или же экспрессирующих доминантный отрицательный рецептор TGF- (TGF- RIIDN), наблюдается спонтанная дифференцировка Th-клеток и спонтанные мультиорганные аутоиммунные воспалительные процессы. В работе [13] показано, что рост уровня TGF- повышает вероятность летального исхода у животных, подвергшихся высоким дозам радиационного облучения [182-184].

Рис. 4.1. Влияние фракционированного тотального рентгеновского облучения на уровень TGF- и IL-10 в сыворотке крови крыс (пг/мл).
При попытке систематизировать данные, касающиеся изменений ряда параметров имунной системы под влиянием ионизирующего излучения в зависимости от дозы, было выявлено [94], что низкие дозы стимулируют продукцию IL-12, CD80 и CD28 на фоне снижения уровня IL-10, что приводит к повышению активности Т-клеток. В то же время высокие дозы на фоне стимуляции продукции CD80 и IL-12 также приводят к повышению экспрессии CTLA-4 и IL-10, что в свою очередь ведет к подавлению активности Т-клеток. Эти изменения, в свою очередь, связаны с влиянием низкодозовой радиации на каскады передачи сигнала между компонентами иммунной системы. При этом выделен ряд важных каскадов, таких как каскад PKC/Ca2+, приводящий к активации транскрипционных факторов и транслокации в ядре NF-B через изменение соотношения цАМФ/цГМФ в тимоцитах, а также молекулы нисходящего каскада PКА. Эти изменения в свою очередь связаны с экспрессией CD3/CD28 и активацией фосфодиэстеразы-. Изменения в передаче сигналов в совокупности будут влиять на транскрипционные факторы, которые в свою очередь будут воздействовать на экспрессию цитокинов, например, будут стимулировать синтез IL-12, IL-1 и TNF- [94, 185].
В свете этих данных, определение уровня IL-10 может свидетельствовать об изменениях эффекторного звена иммунологической реактивности. Концентрация IL-10 на протяжении первых 3-х суток после облучения существенно не изменялась (рис. 4.1). Выраженное и стойкое увеличение продукции данного цитокина было выявлено только на 10-е сутки после облучения, и его уровень продолжал оставаться высоким на протяжении еще недели. В конце четвертой недели наблюдения содержание обоих цитокинов – TGF- и IL-10 – в сыворотке крови по сравнению с показателями контрольной группы (интактных животных) существенно не отличалось.
Функция IL-10 заключается в подавлении уже не нужного воспалительного процесса в организме и, тем самым, ограничении дальнейшего повреждения тканей. Тем не менее, иммуносупрессивные свойства IL-10 могут приводить к снижению защитных воспалительных и антигенспецифичных реакций, которые, как правило, необходимы для элиминации инфекционного агента. IL-10 также подавляет синтез промежуточных активных форм кислорода и азота в стимулированных макрофагах [55-57].
Исходя из вышеизложенного, активация продукции IL-10, как и TGF-, в ответ на фракционированное тотальное рентгеновское облучение может носить негативный характер, поскольку повышение их уровней, вероятно, указывает на состояние радиационно-индуцированной иммунодепрессии. Известно, что действие IL-10 приводит к ингибированию синтеза каскада провоспалительных цитокинов, включая IFN–, TNF, IL-1, IL-2 и GM-CSF, а также ряд хемокинов [58-72, 186, 187].
Что касается одного из маркерных цитокинов Th1-лимфоцитов – IFN-, то наши исследования показали снижение его уровня после воздействия фракционированного тотального рентгеновского облучения. Однако дефицит продукции данного цитокина определялся не сразу, а по прошествии 3-х суток после облучения, с последующей постепенной нормализацией к концу 4-й недели, когда существенных различий по сравнению с показателями у интактных животных не было выявлено (рис. 4.2).
Продукция IL-4 Th2-клетками постепенно снижалась с минимальными значениями на 10-е сутки после облучения. Восстановление также происходило к концу периода наблюдений – на 28-й день.
Несмотря на то, что в более ранних работах было показано, что Th1-клетки являются более радиочувствительными по сравнению с Th2, изменения уровня IL-4 были не менее выражены, чем IFN- (рис 4.2). Данные факты свидетельствуют об опосредованном влиянии радиации – через индукцию их антагонистов – IL-10 и TGF- [80, 100, 106].

Рис. 4.2. Содержание IFN- и IL-4 в сыворотке крови крыс (пг/мл) при воздействии низкодозового фракционированного рентгеновского облучения.
Приведенные выше данные свидетельствуют о наличии условий для угнетения индукции основных эффекторных механизмов (Th1, Th2). Иммуносупрессивный эффект радиационного облучения также хорошо известен, но его механизм не изучен. Возможно участие обоих механизмов, как прямых, так и опосредованных: ионизирующее облучение не только вызывает повреждение ДНК, но и запускает ряд разнообразных физиологических реакций в клетках млекопитающих, включая иммуносупрессию и воспаление. Эти данные согласуются и с предположением, что индуцируемая радиационным облучением иммуносупрессия может быть связана с подавлением цитокинов Th1 [11, 13, 18, 19, 93-96], что совпадает с вышеописанным снижением уровня IFN-.
В этих условиях существенный интерес представляет изучение клеточных и гуморальных факторов иммунологической реактивности.
К клеточным факторам иммунологической реактивности относятся фагоциты, как макро -, так и микрофаги. Фагоцитоз представляет собой сложный процесс, в котором можно выделить такие стадии, как образование фагосомы и последующее созревание последней, а результатом завершенного фагоцитоза является уничтожение патогена и презентация антигена [45-47]. Учитывая высокую устойчивость фагоцитов к радиации, наиболее вероятный механизм воздействия радиации на процесс фагоцитоза – через сложный каскад цитокинов [18, 20, 188-190].
При исследовании параметров неспецифической иммунологической реактивности, динамика которых представлена на рисунке 4.3, установлено, что фракционированное тотальное рентгеновское облучение оказывает депрессивное воздействие на фагоцитарную активность перитонеальных макрофагов крыс. При этом фагоцитарное число макрофагов достигло заметных изменений уже на 3-и сутки, а минимальный его уровень наблюдался на 10-е сутки, с последующим восстановлением до нормальных значений. Фагоцитарный индекс перитонеальных макрофагов на 1-й неделе наблюдения имел лишь тенденцию к снижению и только на 10-е сутки достиг достоверной разницы по сравнению с контрольной группой.

Рис. 4.3. Изменения поглотительной функции фагоцитов, возникающие при воздействии фракционированного рентгеновского облучения.
Динамика же показателей фагоцитарной активности перитонеальных нейтрофилов была более выраженной (рис. 4.3). Мы получили заметное снижение количества фагоцитирующих нейтрофилов у облученных крыс уже на 3-и сутки, а минимум был отмечен на 10-е сутки после воздействия радиации. Что же касается показателя поглотительной способности перитонеальных нейтрофилов, то для него характерна была та же динамика.
К концу периода наблюдений значения вышеуказанных показателей также восстанавливались до контрольных
Макрофаги, активированные IFN-, выполняют функции эффекторных клеток в защитных и повреждающих реакциях воспалительного процесса. При этом макрофаги синтезируют и секретируют широкий спектр цитокинов, обладающих эффекторной и регуляторной активностью, разрушительных ферментов и активных форм кислорода и азота [46-48, 188].
Авторами [20] было показано, что активация макрофагов в ответ на радиацию вызвана взаимодействием с лимфоцитами. Она также просходит за счет паракринной индукции образования определенных цитокинов, которая инициируется наличием ИЛ-1, высвобождаемым макрофагами, подвергшимися радиационному воздействию. К тому же, по современным представлениям, индукция цитокинов является прямым ответом на экзогенное воздействие [3].
Регулирующим цитокином для макрофагов является IL-10 – антагонист IFN-. Его продуцентами могут быть моноциты/макрофаги и T-клетки. Ингибирующим действием на фагоциты обладает TGF-, эффекты которого зависят, как от дозы, так и от присутствия других цитокинов [62].
Напротив, влияние IL-4 на фагоцитоз противоречиво, так как у макрофагов, индуцированных IL-4, наблюдается как усиленная, так и сниженная фагоцитарная активность [84]. Данное противоречие может объясняться наличием множества форм фагоцитоза, для которых характерна активация определенных рецепторов, что приводит к различным межмолекулярным взаимодействиям [45-48].
Благодаря способности IL-4 индуцировать альтернативную активацию макрофагов, запускается формирование реакции, существенно отличающейся от классической активации за счет IFN-. В частности, характерно усиление синтеза цитокинов и хемокинов макрофагами, активированными IL-4, под воздействием ЛПС и высокий уровнь эндоцитоза [82]. В свою очередь, Th2-клетки синтезируют такой оппозитный цитокин, как IL-4, который может индуцировать реакции, управляемые IgE и эозинофилами за счет синтеза ряда цитокинов, тем самым обеспечивая гуморальный иммунитет [46]. Поэтому снижение содержания IL-4 на 3-и и 10 сутки совпадает с периодами снижения поглотительной активности фагоцитов.
Недостаточный уровень функционирования фагоцитов отразился и на механизмах элиминации патогена, что проявилось в повышении уровня ЦИК с максимумом на 17-е сутки (рис. 4.4).
Колебания комплементарной активности сыворотки крови на протяжении всего периода наблюдений имели лишь характер тенденций по сравнению с уровнем этого показателя у контрольных животных, за исключением 3-х суток после облучения, когда она была достоверно снижена (рис. 4.4).
ЦИК и комплементарная активность сыворотки крови, с одной стороны, относятся к эффекторному звену воспалительного процесса, являясь участниками всех его феноменов: альтерации, экссудации, эмиграции и, в меньшей степени, пролиферации. С другой стороны, они являются маркерами эффективности элиминационных процессов, так как накопление ЦИК является неблагоприятным признаком [45-48].

Рис. 4.4. Действие низкодозового фракционированного рентгеновского облучения на содержание ЦИК (МЕ) и активность комплемента (гем. ед.) в сыворотке крови крыс.
Таким образом, нами было установлено, что воздействие фракционированного рентгеновского облучения на крыс привело к системному росту уровня TGF-, что, в комплексе с усилением синтеза IL-10, создает условия для угнетения эффекторных механизмов Th1,/Th2 специфического иммунного ответа, проявляющегося в снижении уровней сывороточных цитокинов IFN- и IL-4. Наряду с этим, наблюдался нестойкий, носящий преимущественно характер тенденций, дефицит системы неспецифической иммунной защиты, что свидетельствует об угнетении инициальных этапов воспаления [44], которые, как правило, необходимы для элиминации инфекционного агента.
Представленные выше данные о влиянии фракционированного тотального рентгеновского облучения свидетельствуют о признаках функциональной декомпенсации иммунологической реактивности у облученных животных, которая, при дополнительной функциональной нагрузке, в качестве которой нами выбрана модель экспериментального диссеминированного кандидозного сепсиса, проявляется возрастанием функционального дефекта антиинфекционной защиты различной степени выраженности.
Актуальность выбранной модели связана с тем, что проблема кандидемии и острого диссеминированного кандидоза приобретает весомое значение вследствие увеличения случаев этой патологии у больных с нарушениями противоинфекционной защиты, а также тяжести клинических проявлений и высокой летальности [140-152, 191].
На сегодняшний день хорошо изучено течение острой инфекции на фоне высоких доз ионизирующего облучения, по сути, острой лучевой болезни. При этом иммунотропные эффекты низкодозового облучения, достаточно распространенного, на течение и прогноз инфекционного процесса, изучены в гораздо меньшей степени [12, 127].
Достоверно установлено, что инфекция является основной причиной смерти после общего радиационного поражения, а также то, что цитокины играют ведущую роль в контроле реакций хозяина на радиацию и инфекцию. Первая линия противоинфекционной защиты включает в себя инициацию воспалительной реакции и высвобождение медиаторов, таких как свободные кислородные радикалы и провоспалительные цитокины активированными макрофагами и гранулоцитами [2, 3].
Таким образом, возникла необходимость в проведении исследований комбинированного влияния небольших доз радиации и инфекции на организм.
Нами была разработана и запатентована экспериментальная модель инфицирования крыс линии Wistar путем внутривенного введения микробной суспензии широко используется для изучения вирулентности изолятов и штаммов Candida albicans, а также представляет собой наглядную модель диссеминированной инфекции у человека [192, 193].
Несмотря на то, что Candida albicans связана с рядом тяжелых заболеваний, этот патоген, в первую очередь, является комменсалом. Данное явление является результатом постоянного двустороннего взаимодействия с иммунной системой хозяина. При развитии благоприятных условий, в частности, радиационно-индуцированной генерации противовоспалительного/толерогенного состояния, данный патоген имеет тенденцию к персистенции за счет модуляции и активации локальных регуляторных Т-клеток, способных подавлять системы врожденного и приобретенного иммунитета. Сама же C. albicans также может способствовать поддержанию толерогенного состояния [194].
Поэтому дуалистическая природа данного микроорганизма – одновременно комменсала и патогена – указывает на его способность управлять иммунной реакцией в двух направлениях [136]. Полный спектр взаимоотношений хозяина и C. albicans определяется наличием рецепторов распознавания на дендритных клетках и мононуклеарных фагоцитах, посредством которых, через определенные внутриклеточные сигнальные пути, происходит генерация различных противогрибковых иммунных реакций [151, 195].
При изучении продукции цитокинов в условиях кандидозного сепсиса показано прогрессивное возрастание уровня IFN-. Он увеличивается уже на 1-е сутки, с достижением максимальных значений на 3-и сутки и последующим снижением на 10-е сутки. К 17-м суткам уровень IFN- восстанавливался до нормы, а на 28-е сутки был ниже нормы (рис. 4.5).
Облучение оказывало депрессивный эффект, поэтому в группе облученных и инфицированных крыс повышение уровня данного цитокина было менее выражено и достижение максимальных значений сдвигалось на 10-е сутки. При этом, однако, возврата к значениям уровня IFN- у интактной группы животных к концу периода наблюдений не происходило (рис. 4.5).
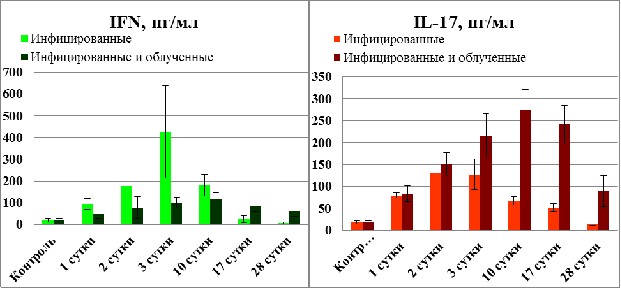

Рис. 4.5. Влияние фракционированного тотального рентгеновского облучения на содержание IFN- и IL-17 в сыворотке крови при остром генерализованном кандидозе у крыс.
Повышение уровня IL-17 (рис. 5.5) наблюдалось у необлученных крыс уже на 1-е сутки после инфицирования, максимальный рост зафиксирован на 3-и сутки. В последующем он снижался: на 10-е и 17-е сутки, вплоть до нормы на 28-е сутки. В группе облученных крыс продукция IL-17 оставалась на более высоком уровне на протяжении, по крайней мере, 14-ти суток после инфицирования, продолжая оставаться высокой даже на 28-е сутки исследования.
Учитывая литературные данные [196- 197], в которых IL-17 определялся как маркер тяжести заболевания, снижение уровня данного цитокина может указывать на неспособность организма элиминировать C. albicans при диссеминированных и хронических формах кандидоза. Следует отметить, что благоприятный, или же, наоборот, отрицательный эффект экспрессии IL-17 в ходе инфекционного процесса также может быть связан с видом возбудителя [199]. В целом, основываясь на данных этих источников можно сделать вывод о том, что поскольку продукция IL-17 может иметь как благоприятное, так и негативное влияние на ход различных патологических состояний, то использование его как маркера тяжести инфекционного процесса возможно только в случае учета всех составляющих наблюдаемого состояния. Кроме того, повышение уровня IL-17 явно указывает на интенсификацию нейтрофильного, цитотоксического воспаления, которое потенциально может нанести вред хозяину, и, таким образом, чрезмерная экспрессия данного цитокина является, скорее, свидетельством неблагоприятного течения заболевания [200, 201].
Роль IL-17 и Th17-клеток в противогрибковой защите организма также была подробно описана в ряде экспериментальных исследований с моделированием кандидозной инфекции. В частности, в этих работах указывалось, что инфицирование мышей путем внутривенного введения суспензии C. albicans индуцирует быструю экспрессию IL-17 [21]. В то же время для мышей, неспособных реагировать на IL-17 вследствие дефектов в рецепторах, воспринимающих данный цитокин, была характерна повышенная обсеменненность тканей и летальность. Это, в свою очередь, было связано с нарушением миграции периферических нейтрофилов к очагам инфекции [202].
Что касается такого регуляторного цитокина, как IL-10, то наши исследования показали, что у необлученных инфицированных животных рост уровня IL-10 в сыворотке крови наблюдался лишь на 10-е сутки после инфицирования. На 28-е сутки содержание IL-10 восстанавливалось до нормы (рис. 4.6). Как показано на том же рисунке, у животных, предварительно подвергавшихся облучению, уровень IL-10 заметно возрастал также на 2-е и 3-и сутки после инфицирования.
По данным многих исследований, продукция IL-10 положительно коррелирует со степенью тяжести течения системного кандидоза [188, 189].

Рис. 4.6. Влияние фракционированного тотального рентгеновского облучения на содержание IL-10 и IL-4 в сыворотке крови при остром диссеминированном кадидозе у крыс.
Уровень маркера Th2 – IL-4 – в нашем эксперименте у необлученных животных на фоне кандидозного сепсиса также прогрессивно возрастал на протяжении 1-й недели, достигая максимальных значений на 3-и сутки, и оставался высоким вплоть до 10-х суток. В группе облученных крыс рост уровня IL-4 имел похожую, однако, менее выраженную динамику.
Для адекватного ответа на инфекцию C. albicans требуется экспрессия ряда провоспалительных цитокинов. Четко показана связь реакции Th2 в почках мышей с летальным исходом, поскольку мыши с отключенным геном IL-10 являются более устойчивыми к инфекции [192].
Эффект Th2-клеток, в данном контексте, заключается в подавлении активности Th1-лимфоцитов, стимулировании антителообразования, в т. ч. IgA и IgE, угнетении фагоцитоза, а также фунгицидного действия макрофагов и нейтрофилов [13, 151, 196, 201].
Значение баланса двух подтипов Т-хелперов, вероятно, заключается в том, что макроорганизм «предпочитает» относительно безопасный Th2 (антительный) ответ, а не сильный фунгицидный Th1 (клеточный) иммунный ответ, с обширным разрушением тканей в тех случаях, когда он не справляется с большим количеством микробных тел.
Переключение на Th2-ответ может происходить и на промежуточных этапах, в целях контроля за избыточной деструктивной деятельностью фагоцитов.
Участие CD8+-лимфоцитов («киллеров»/«супрессоров») в противогрибковом иммунном ответе также имеет разнонаправленный характер. CD8+ лимфоциты способны уничтожать макрофаги с незавершенным процессом фагоцитоза и расположенными в цитоплазме клетками кандиды [184].
Главная роль Th1-клеток заключается в опосредованной интерфероном стимуляции процесса фагоцитоза, презентации антигена фагоцитами, кислородных и NO-зависимых фунгицидных механизмов, а также секреции опсонинов. За счет продукции интерферона и IL-2 CD8+-лимфоциты стимулируют Th1 и NK-клетки, увеличивают эффективность фагоцитоза и угнетают Th2-ответ. Кроме того, CD8+-лимфоциты могут оказывать непосредственный фунгицидный эффект, взаимодействуя с клетками C. albicans [152].
Вышеуказанные закономерности подтвердились и в наших исследованиях: динамика Th1-цитокина – IFN- – совпадала с активацией поглотительной способности фагоцитов, а рост маркеров Th2 – IL-10 и IL-4 – совпадал с его угнетением. Так, у необлученных крыс при генерализованном кандидозном сепсисе наблюдалась выраженная активация фагоцитарной функции перитонеальных макрофагов на протяжении 17-ти суток эксперимента, достигая максимума для ФИмф на 3-и сутки, а для ФЧмф – на 17-е (рис. 4.7). На том же рисунке показано, что у облученных и инфицированных животных наблюдалось уменьшение процента активных макрофагов с первых же суток наблюдения по сравнению с необлученными инфицированными крысами. Еще более заметными были изменения со стороны поглотительной способности макрофагов, показатели которой были ниже таковых не только группы сравнения, но и интактных животных.

Рис. 4.7. Влияние фракционированного тотального рентгеновского облучения на показатели поглотительной способности фагоцитов при остром диссеминированном кандидозе у крыс.
Такую же динамику мы наблюдали и в отношении функциональной активности нейтрофилов: закономерное нарастание как поглотительной активности фагоцитов, так и числа фагоцитирующих клеток у необлученных крыс на фоне диссеминированной кандидозной инфекции в течение первых 10-ти дней, с максимумом на 3-и сутки. Относительная недостаточность активации фагоцитоза нейтрофилов, которая наблюдалась у облученных и инфицированных животных по сравнению с аналогичными показателями в группе необлученных инфицированных крыс, достигала статистически достоверных значений на 10-е сутки (рис. 4.7).
Макрофаги и нейтрофилы выполняют основную работу по элиминации грибов рода Candida как непосредственно – путем фагоцитоза, так и посредством регуляции иммунного ответа – за счет продукции цитокинов.
Роль оксида азота в функции макрофагов в настоящее время рассматривается как одна из ключевых в противогрибковой защите. Специализированные макрофаги обладают высокоактивной «индуцибельной» синтазой оксида азота (iNOS). Индукция этого фермента происходит в присутствии IFN и TNF, а угнетение – под действием IL-4, IL-10, TGF-. В конечном итоге, это ведет к цитостатическим и гибельным для клеток эффектам [18, 199, 203].
Активация иммунного ответа макрофагами осуществляется за счет ряда цитокинов, являющихся ростовыми факторами и активаторами для многих популяций клеток, в т. ч. самих макрофагов, стимулирующих продукцию их цитокинов, а также острофазовых белков. Особенно важную роль играет IFN-, усиливающий фунгицидную активность фагоцитов. Лимфоциты различных популяций способны к связыванию с клетками кандиды, угнетению их роста и уничтожению инфицированных клеток за счет экспрессии IFN, TNF и IL-2, которые, в свою очередь, влияют на развитие Th1-реакций, могут усиливать фагоцитоз [195, 203, 204].
Несмотря на то, что клеточный иммунитет играет основополагающую роль в защите против кандидозной инфекции, тем не менее, признается значение специфического гуморального иммунитета, который принимает участие в различных этапах борьбы с кандидозом. В эксперименте доказана защитная роль антител класса IgM к маннановой фракции клеточной стенки C. albicans, выполняющей функцию адгезии, а также роль опсонинов. Установлена защитная роль опсонинов – IgG подкласса 2а, продукция которых стимулируется Тh1-клетками. Антитела класса IgG к маннанам C. albicans активируют комплемент по классическому пути [151].
При исследовании нами уровня специфических антител к Candida albicans было установлено, что на 7-е сутки инфекции титры специфических антител у предварительно облученных крыс были вчетверо ниже, чем у необлученных животных. На 14-е сутки различия в титрах антикандидозных антител также наблюдались, однако были менее выраженными (рис. 4.8).
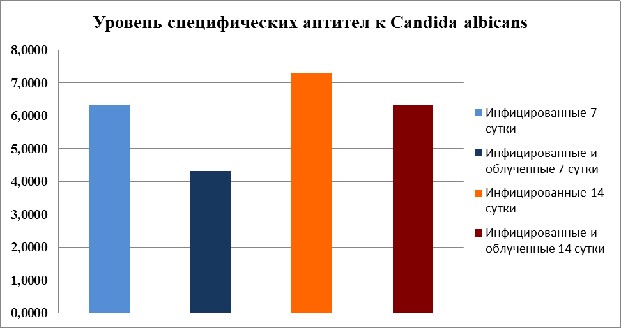

Рис. 4.8. Сравнительный анализ динамики нарастания титров специфических антител к Candida albicans у облученных и необлученных крыс.
Как показано на рисунке 4.9, при диссеминированном кандидозном сепсисе у необлученных животных происходило повышение уровня ЦИК со 2-х суток и на протяжении всего периода наблюдения с максимумом на 17-е сутки. У облученных и инфицированных крыс содержание ЦИК было достоверно выше во все сроки исследования, что, вероятно, связано с нарушением функции элиминации со стороны фагоцитарных клеток и системы комплемента.

Рис. 4.9. Динамика содержания ЦИК (МЕ) и активности комплемента (гем. ед.) в сыворотке крови у инфицированных облученных и необлученных крыс.
Роль комплемента в защите макроорганизма при генерализованном кандидозе представляется несомненной. Однако конкретные механизмы действия компонентов системы комплемента и их взаимодействие между собой и другими факторами иммунитета остаются не уточненными. В принципе, роль комплемента заключается в связывании (прямом по альтернативному пути и опосредованном антителами по классическому пути) с микробами, с их опсонизацией или непосредственным уничтожением, а также в образовании факторов, обеспечивающих хемотаксис фагоцитов [151].
Иммуноглобулины класса G к маннановым антигенам способны запускать активацию фактора С3 по классическому пути. Несколькими исследованиями была доказана способность различных видов Candida к активации альтернативного пути активации комплемента. Хемотаксические факторы C3а и С5а сохраняют свое значение при кандидозе, играя ту же роль, что и при других инфекциях [151].
В наших исследованиях определяли общую комплементарную активность сыворотки крови по 50%-ному гемолизу, которая снижалась в обеих группах инфицированных животных (облученных и необлученных), скорее всего, за счет усиленного потребления компонентов системы комплемента. Данное явление, вероятно, связано с накоплением ЦИК, а также элиминацией патогена по альтернативному пути. Минимальные значения активности комплемента наблюдались на 10-е сутки эксперимента. При этом активность комплемента у облученных животных во все сроки исследования была ниже, чем у необлученных крыс, что указывает на более сильное его потребление в первом случае (рис. 4.9).
Полученные нами результаты согласуются с литературными данными [152], которые свидетельствуют о том, что кандидоз относится к ряду оппортунистических инфекций и развивается только в иммунологически скомпрометированном макроорганизме [152, 153].
Как показано на рисунке 4.10, в группе облученных крыс наблюдалась 100%-ная генерализация инфекционного процесса как на 7-е, так и на 14-е сутки. Уровень элиминации возбудителя, о котором судили по отсутствию положительной динамики степени обсеменения внутренних органов, свидетельствует об усугублении клинического течения инфекции, индуцированном фракционированным облучением, и, даже, наблюдалась летальность в данной группе животных.

Рис. 4.10. Результаты бактериологического исследования течения кандидозного сепсиса у облученных и необлученных крыс.
При сравнительном анализе исследуемых групп животных было установлено, что у необлученных крыс на 7-е сутки тоже наблюдалась 100%-ная генерализация инфекционного процесса, но на 14-е сутки – только в 66,7 % случаев, а также имелась тенденция к снижению степени обсеменения внутренних органов. Для необлученных животных инфекционная модель была сублетальной (рис. 4.10).
Таким образом, при инфекционном процессе функциональная декомпенсация неспецифической реактивности у облученных крыс нарастала: усугубление имеющегося дисбаланса в цитокиновом соотношении IFN-/IL-4 привело негативным последствиям – диссеминации процесса и утяжелению клинической картины.
Раскрытие роли иммунологической реактивности в физиологических и патофизиологических процессах создало предпосылки для разработки методов коррекции, основанных на направленной регуляции иммунных реакций. Одной из возможных сфер применения иммуностимулирующих препаратов является использование их при инфекционных заболеваниях, в особенности, в случае неадекватного функционирования иммунной системы, например, в условиях воздействия ионизирующей радиации.
Наиболее современным подходом в иммунокоррекции данных нарушений является использование эндогенных полипептидов иммунной системы – цитокинов и связанных с ними факторов, наиболее распространенным из которых является интерферон [154-157]. При этом, однако, следует учитывать и побочные эффекты, которые наблюдаются при проведении цитокиновой или же, напротив, антицитокиновой терапии. Несмотря на плейотропизм и многообразие, в случае, если гомеостаз организма не имеет нарушений, цитокины эффективно взаимодействуют друг с другом, однако, искусственное введение дополнительного количества определенного цитокина может нарушить данное равновесие. Об этом свидетельствует тот факт, что при использовании цитокиновой терапии возникают вопросы с их дозировкой и временем введения [153].
Исходя из вышеизложенного, нами был выбран не сам интерферон, а его индуктор – метилглюкамина акридонацетат. При этом мы учитывали, что воздействие различных стимуляторов экзогенного происхождения происходит через систему цитокинов, и, таким образом, качественных различий между эффектами от введения интерферона или его индуктора не должно быть.
Значительным преимуществом метилглюкамина акридонацетата по сравнению с другими иммуностимуляторами является то, что он имеет синтетическое происхождение, небольшую молекулярную массу и обладает легко выявляемыми фармакокинетическими характеристиками. Однако, при этом, следует учитывать, что проявление эффекта от использования иммуностимулятора напрямую зависит от количественного и качественного состава индуцированного им синтеза интерферонов [205-207].
IFN- играет большую роль в процессе активации макрофагов, развитии и дифференцировке CD4+-T-клеток в Th1-клетки, при этом угнетая развитие Th2-клеток за счет ингибирования синтеза IL-4. Кроме того, важной функцией IFN-/ также является усиление цитотоксичности NK-клеток и стимуляция их пролиферации [155].
При изучении действия метилглюкамина акридонацетата на иммунологическую реактивность крыс с кандидозным сепсисом мы выяснили, что у облученных животных происходило усугубление имеющегося дисбаланса в цитокиновом профиле за счет значительного повышения уровня IFN- и умеренного увеличения уровня IL-10 по сравнению с животными, не подвергнутыми коррекции. У неинфицированных животных (V группа) этот эффект был менее заметным: соотношение IFN-/IL-10 возросло за счет повышения уровня IFN- по сравнению с крысами без иммунокоррекции (рис. 4.11).
Кроме того, из рисунка 4.11 видно, что уровень IL-4 возрастал у инфицированных крыс, получавших метиглюкамина акридонацетат, при том, что у животных без коррекции он существенно меньше. Это, очевидно, только содействовало углублению дисбаланса в цитокиновом профиле. При этом ожидаемого уровня стимуляции функций фагоцитов у инфицированных облученных животных не наблюдалось (рис. 4.12).

Рис. 4.11. Влияние метилглюкамина акридонацетата на уровень сывороточных цитокинов при лечении инфекции Candida albicans у облученных и необлученных крыс.

Рис. 4.12. Влияние метилглюкамина акридонацетата на показатели фагоцитоза при лечении инфекции Candida albicans у облученных и необлученных крыс.
Как показано на рисунке 4.12, у облученных животных, которым вводили метилглюкамина акридонацетат, на 7-е сутки после инфицирования наблюдалось статистически достоверное повышение уровня активации макрофагов по сравнению с животныим без иммунокоррекции, а фагоцитарное число макрофагов у животных исследуемой группы также было существенно выше, чем в интактном контроле.
Заметное повышение фагоцитарной активности нейтрофилов под влиянием метилглюкамина акридонацетата также было выявлено лишь у облученных крыс, не подвергавшихся инфицированию. В обеих группах инфицированных животных под влиянием метилглюкамина акридонацетата фагоцитарная активность нейтрофилов практически не увеличивалась.
Недостаточность достигнутого уровня стимуляции фагоцитарных функций нейтрофилов подтверждается и стабильностью в концентрации ЦИК в обеих группах инфицированных животных. Так, концентрация ЦИК у всех крыс, участвовавших в эксперименте, была достоверно выше по сравнению с интактными животными. У животных с кандидозным сепсисом без предварительного облучения, на фоне введения метилглюкамина акридонацетата наблюдалась лишь тенденция к снижению ЦИК. У аналогичных, но предварительно облученных животных, уровень ЦИК был практически такой же (рис. 4.13).

Рис. 4.13. Влияние метилглюкамина акридонацетата на показатели циркулирующих иммунных комплексов и комплемента при лечении инфекции Candida albicans у облученных и необлученных крыс.
Из рисунка 4.13 также видно, что метилглюкамина акридонацетат оказывал негативное влияние и на активность комплемента в сыворотке крови в условиях сепсиса, как у животных, подвергавшися предварительному облучению, так и не подвергавшихся.
В отличие от данных, полученных нами, отчеты о клинических испытаниях, опубликованные в литературных источниках, указывают на то, что метилглюкамина акридонацетат обладает интерфероноподобным действием, активируя макрофаги и индуцируя выработку IL-1 и IFN-. Также было показано, что IFN- значительно снижает тяжесть течения, в основном, бактериальных инфекций у пациентов с хроническим грануломатозным заболеванием – на 70% [155-157].
Поскольку система интерферонов – это единая система регуляции функций клеток и межклеточных взаимодействий полипептидными молекулами, то в процессе иммунного ответа последние выполняют роль короткодистантных медиаторов межклеточного взаимодействия. Интерфероны связываются со специфическими рецепторами на клетках-мишенях, при этом они не обладают ферментативной либо химической активностью, а их действие проявляется опосредованно через клетки-мишени при помощи вторичных мессенджеров [203, 204].
Действие интерферона реализуется по сетевому принципу, т.е. передаваемая информация содержится в наборе регуляторных цитокинов, которые получили название цитокинового каскада. Включение каскада обусловливает синергические или антагонистические действия медиаторов, индукцию выработки ими друг друга, а также трансмодуляцию поверхностных рецепторов к другим медиаторам [154-157].
Данные взаимодействия имеют очень сложный характер, и, на сегодняшний день, они малоизучены. Можно предположить, что полученные нами данные указывают на то, что компрометация иммунной системы низкодозовым ионизирующим облучением нарушает синтез ряда цитокинов, что, в свою очередь, приводит к сбоям в выработке компонентов цитокинового каскада, в частности, индукция IFN-, иммунокомпетентными клетками и усугубляет течение инфекционного процесса. Поскольку метилглюкамина акридонацетат, как указывалось выше, является индуктором синтеза эндогенного интерферона и непосредственно не влияет на выработку других цитокинов, то данный препарат не в состоянии скорректировать вызванные радиацией нарушения.
Представленные данные свидетельствуют том, что дипептид глутамил-триптована не только тимомиметический иммуномодулятор, но, и, в не меньшей степени, полифункциональный биорегулятор, выполняющий, как и другие короткие пептиды, функцию стартового сигнала в пептидном регуляторном каскаде [33]. Эти представления позволяют понять способность дипептид глутамил-триптована одновременно индуцировать различные эффекты, направленность которых определяется видом клеток-мишеней и характером имеющихся повреждений. Накопленная информация позволяет утверждать, что фактором, определяющим свойства того или иного пептида, является его структура, а не происхождение [33].
Большинство эффекторных и вспомогательных функций клеток иммунной системы осуществляются при участии особых эндогенных структур – внутрисистемных гормонов и медиаторов. Наибольшие успехи в этом направлении стали возможны после открытия регуляторных пептидов центральных органов иммунитета, в частности, тимуса. Дальнейшее развитие идеи пептидных тимомиметиков привело к пониманию того факта, что для индукции регуляторного сигнала системе может быть достаточно минимального пептида, состоящего всего из 2-х аминокислотных остатков. Дипептид глутамил-триптофан является классическим тимомиметиком, обладающим всей совокупностью иммуномодулирующих реакций, иммунорегулирующими свойствами, которые могут быть использованы в терапевтической практике [33].
Триптофан представляет собой незаменимую аминокислоту, которая участвует в белковом синтезе и других метаболических процесах. В последнее время была установлена связь между катаболизмом триптофана и воспалительным процессом при многих заболеваниях [208].

Рис. 4.14. Влияние дипептида глутамил-триптофана на уровень сывороточных цитокинов при лечении инфекции Candida albicans у облученных и необлученных крыс.
Как показано на рисунке 4.14, к наиболее существенным положительным изменениям в иммунном статусе облученных животных на фоне введения исследуемого препарата нужно отнести наличие тенденции к уменьшению дисбаланса в цитокиновом профиле, более выраженное у облученных животных с генерализованным сепсисом. Соотношение IFN-/IL-10 у инфицированных животных уменьшилось за счет увеличения уровня IL-10 и умеренного повышения уровня IFN-. Аналогичный эффект наблюдался и у необлученных животных: соотношение IFN-/IL-10 также уменьшилось за счет значительного повышения уровня IL-10 и умеренного повышения уровня IFN- по сравнению с контрольными крысами (рис. 4.14).
Кроме того, у облученных и инфицированных животных лечение глутамил-триптофаном привело к уменьшению уровня ИЛ-4 по сравнению с контролем. У инфицированных животных без предварительного облучения разница была также заметной, что, очевидно, свидетельствует о противовоспалительном эффекте препарата.
Что касается продукции IL-17, то наблюдалось заметное уменьшение его уровня у животных ХІ группы.
Фагоцитарная активность макрофагов значительно повышалась при введении дипептида глутамил-триптофана именно у облученных животных, которые имели наиболее низкий исходный уровень этого показателя. Аналогичный, но менее выраженный эффект стимуляции был у инфицированных необлученных животных (рис 4.15).
На том же рисунке наглядно отображено, что дипептид глутамил-триптофан оказывал значительное стимулирующее влияние на фагоцитарную активность нейтрофилов во всех исследованных группах, кроме инфицированных необлученных крыс, которые имели наиболее высокий исходный уровень этого показателя.

Рис. 4.15. Влияние дипептида глутамил-триптофана на показатели фагоцитоза при лечении инфекции Candida albicans у облученных и необлученных крыс.
На сегодняшний день значение расщепления триптофана, индуцированное IFN-, изучено недостаточно, однако, многие исследователи полагают, что данный феномен является частью биологического механизма, направленного на снижение доступа триптофана к патогенным микроорганизмам и раковым клеткам [208]. Наши исследования показали снижение уровня IFN- у инфицированных и облученных крыс по сравнению с животными без предварительного облучения. Данный факт может указывать на то, что в организме облученных крыс происходит замедление расщепления триптофана. Также известно, что у людей наблюдается повышение интенсивности расщепления триптофана при вирусных инфекциях, злокачественных новообразованиях, а также аутоиммунных заболеваниях [207]. Кроме того, было установлено, что триптофан является ключевым компонентом формирования иммунной толерантности при беременности [208].
Расщепление триптофана контролируется, кроме IFN-, также рядом других цитокинов, таких как IL-4 и IL-10. Последние, согласно данной теории, способны подавлять расщепление триптофана мононуклеарами периферической крови, вероятно, за счет прямого ингибирования продукции цитокинов Th1, а также влияния IFN- на моноциты/макрофаги [32, 163]. Результаты нашего эксперимента согласуются данными о том, что при добавлении в культуру макрофагов IL-4 и IL-10 в тех же концентрациях наблюдается аддитивный эффект по отношению к эффекторным функциям макрофагов [163].
Дипептид глутамил-триптофан является синтетическим полипептидом, который обеспечивает активацию макрофагов через активацию Toll-подобных рецепторов, в том числе и рецептора TLR9. Стимуляция данного рецептора может приводить к усилению формирования регуляторных Т-клеток фенотипа CD4+ и CD25+ под контролем дендритных клеток. Т-клетки данного фенотипа являются ключевыми компонентами защитных реакций против грибковой инфекции [26-28, 163].
В обеих группах инфицированных животных на фоне введения дипептида глутамил-триптофана заметно снижалось количество ЦИК. В этих же группах наблюдалось повышение комплементарной активности сыворотки крови (рис. 4.16).

Рис. 4.16. Влияние дипептида глутамил-триптофана на показатели циркулирующих иммунных комплексов и комплемента при лечении инфекции Candida albicans у облученных и необлученных крыс.
Эффекторное звено системной противокандидозной защиты обеспечивается не только за счет активации фагоцитов, но и за счет стимуляции синтеза защитных антител.
Уровень специфических антител против Candida albicans нарастал после введения как метилглюкамина акридонацетата, так и дипептида глутамил-триптофана практически у крыс всех групп, однако, как показано на рисунке 4.17, глутамил-триптофан оказал большее влияние именно у животных, подвергшихся предварительному облучению, в то время как метилглюкамин акридонацетат оказался более эффективным у необлученных крыс.

Рис. 4.17. Сравнительный анализ динамики нарастания титров специфических антител к Candida albicans в группах животных, которые получали метилглюкамина акридонацетат и дипептид глутамил-триптофан.
На 7-е сутки инфекционного процесса титры специфических антител были вчетверо ниже у облученных крыс III группы, на 14-е сутки различия в титрах антикандидозных антител были вдвое. При этом у облученных животных введение метилглюкамина акридонацетата стимулировало рост титра антител как на 7-е, так и на 14-е сутки, а при действии дипептида глутамил-триптофана стимуляция выработки антител была намного более выраженной.
У необлученных крыс при введении дипептида глутамил-триптофана на 7-е и 14-е сутки стимуляция происходила в 2 раза. Метилглюкамина акридонацетат в группе инфицированных крыс влияния на титры специфических антител не оказывал.
Кроме того, вышеуказанные препараты оказывали влияние и на степень обсемененности внутренних органов. Так, на фоне введения метилглюкамина акридонацетата у необлученных животных на протяжении 1-й недели инфекционного процесса наблюдалась тенденция к снижению степени обсеменения. В течение следующей недели отмечалось существенное снижение показателей генерализации процесса у половины животных, а плотность культуры Candida albicans во внутренних органах ни в одной из исследуемых групп к концу 2-й недели не превышала 50 КОЕ/г.
У облученных животных наблюдалась генерализации инфекционного процесса на 7-е сутки и высокая степень обсемененности. При введении метилглюкамина акридонацетата его эффект проявился лишь через две недели. При этом он составлял больше 100 КОЕ у 50% животных, меньше 100 КОЕ – у 33,3% и меньше 50 КОЕ – у 16,7%. О положительном влиянии на течение инфекционного процесса используемых иммуностимуляторов свидетельствует отсутствие летальности у облученных животных.
У необлученных животных, которым вводили дипептид глутамил-триптофан, генерализация инфекционного процесса через неделю снизились и наблюдалась чуть больше, чем в половине случаев. Также существенно снижалась степень обсемененности, по сравнению с животными аналогичной группы, которым вводили метилглюкамина акридонацетат. Через 2 недели генерализация инфекционного процесса наблюдалась лишь у небольшого числа животных при слабой обсемененности.
Эффект от воздействия дипептида глутамил-триптофана наблюдался и у облученных животных, у половины из которых в конце первой недели инфекционного процесса снизилась степень обсемененности, а в конце второй недели генерализация наблюдалась лишь у 50% животных со слабой обсемененностью. Однако, по сравнению с необлученными животными, процент крыс с генерализованной формой инфекционного процесса и степень обсемененности внутренних органов были выше.
Таким образом, проведенные иммунологические, бактериологические и клинические исследования позволяют утверждать, что в пределах разработанной модели дефекта иммунологической реактивности дипептид глутамил-триптофан можно считать адекватным средством иммунокоррекции, который стимулирует активность фагоцитарных систем, содействует восстановлению баланса в цитокиновом профиле и повышению эффективности процессов формирования специфического иммунного ответа с соответствующими клиническими результатами.
Полученные результаты позволяют сделать вывод о том, что недостаточный уровень активации макрофагов и нейтрофилов, и значительное углубление дисбаланса про- и противовоспалительных цитокинов при остром диссеминированном кандидозе можно считать одними из характерных и, возможно, ключевыми показателями дестабилизации деятельности системы иммунологической резистентности. Это вытекает из прямых исследований фагоцитоза и цитокинового профиля при инфекционном процессе в облученном организме, позволяющих предполагать патогенетичность этих механизмов, а также из результатов попыток коррекции обнаруженных изменений, подтверждающих патогенетичность данных механизмов. Дипептид глутамил-триптофан сильнее стимулирует фагоцитоз, чем метилглюкамина акридонацетат. Он также нормализует баланс цитокинов, в то время как метилглюкамина акридонацетат, напротив, усугубляет дисбаланс цитокинов.
Это, в свою очередь, показывает, что более высокая эффективность дипептида глутамил-триптофана, чем метилглюкамина акридонацетата, связана с разницей в механизмах действия этих иммуностимуляторов. Как указывалось, метилглюкамина акридонацетат является индуктором интерферона, влияющим на эффективность фагоцитоза. Однако на нашей модели выраженной активации фагоцитоза под влиянием этого препарата мы не получили. В то же время обнаружено усугубление дисбаланса про- и противовоспалительных цитокинов. Дипептид глутамил-триптофан эффективно стимулирует фагоцитоз и нормализует баланс цитокинов. Бльшая эффективность этого препарата, по-видимому, объясняется тем, что он, по данным литературы, обладает более широким спектром иммуномодулирующей активности, стимулирует специфический иммунитет. В наших исследованиях это подтверждается тем, что дипептид глутамил-триптофан способствует формированию специфического гуморального ответа на антигены Candida albicans, причем более выраженного, чем метилглюкамина акридонацетат. Кроме того, дипептид глутамил-триптофан обладает радиопротекторными и противовоспалительными свойствами, важными при терапии инфекционного процесса в облученном организме.
Полученные результаты показывают, что одним из патогенетических принципов коррекции нарушений иммунологической реактивности при инфекционном процессе на фоне облучения может быть использование иммуномодуляторов, нормализующих цитокиновый баланс.
ВЫВОДЫ
В диссертационной работе представлено теоретическое обобщение и решение актуальной научной медицинской задачи, состоящей в выявлении механизмов формирования радиационно-индуцированных изменений иммунологической реактивности при инфекционном процессе и патогенетическом обосновании коррекции этих нарушений с использованием иммунотропных препаратов (метилглюкамина акридонацетата, дипептида глутамил-триптофана).
- Тотальное низкодозовое фракционированное рентгеновское облучение крыс (по 0,5 Gy в сутки в течение 3-х дней) приводит к дисбалансу сывороточных про- и противовоспалительных цитокинов (повышению уровня TGF- и IL-10 и снижению содержания IFN- и IL-4), угнетению фагоцитарной активности перитонеальных макрофагов и нейтрофилов, увеличению концентрации циркулирующих иммунных комплексов и снижению активности комплемента в сыворотке крови.
- При кандидозном сепсисе у необлученных животных концентрации IFN- и IL-4 прогрессивно нарастают на протяжении первой недели. У облученных крыс их повышение менее выражено, что, вероятно, обусловлено депрессивным воздействием облучения на противоинфекционную защиту. У облученных и инфицированных крыс наблюдаются гораздо более высокие уровни циркулирующих иммунных комплексов по сравнению с необлученными животными, что связано с нарушением функции элиминации со стороны фагоцитов и системы комплемента. Показатели генерализации инфекционного процесса и степени обсемененности внутренних органов у облученных крыс также выше, чем у необлученных.
- При кандидозной инфекции, как у облученных, так и у необлученных животных, дипептид глутамил-триптофан нормализует баланс цитокинов, в то время как метилглюкамина акридонацетат, напротив, усугубляет дисбаланс цитокинов. Дипептид глутамил-триптофан также сильнее стимулирует фагоцитоз, чем метилглюкамина акридонацетат.
- Дипептид глутамил-триптофан способствует формированию более выраженного специфического гуморального ответа на антигены Candida albicans и более эффективно снижает показатели генерализации инфекционного процесса и степени обсемененности внутренних органов, чем метилглюкамина акридонацетат.
- Значительное углубление дисбаланса про- и противовоспалительных цитокинов и недостаточный уровень активации макрофагов и нейтрофилов при остром диссеминированном кандидозе можно считать одними из характерных и, возможно, ключевыми показателями дестабилизации деятельности системы иммунологической резистентности. Одним из патогенетических принципов коррекции нарушений иммунологической реактивности при инфекционном процессе на фоне облучения может быть использование иммуномодуляторов, нормализующих цитокиновый баланс.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
- Williams J. P. Animal Models for Medical Countermeasures to Radiation Exposure / J. P. Williams, S. L. Brown, G. E. Georges, M. Hauer-Jensen, R.P. Hill, A. K. Huser, D.G. Kirsch, T. J. MacVittie, K. A. Mason, M. M. Medhora, J. E. Moulder, P. Okunieff, M. F. Otterson, M. E. Robbins, J. B. Smathers, W. H. McBride, // Radiat. Res. -2010, - Vol. 173. - P. 557 – 578.
- Васильев, Н. В. Медико-социальные последствия ядерных катастроф / Н. В. Васильев, В. И. Мальцев, В. Н. Коваленко, В. М. Шубик, В. Ф. Москаленко, Ю. Л. Волянский, Т. И. Коляда, В. М. Пономаренко, З. М. Парамонов // «Здоров'я». – 1999. – 197 С.
- Шойхет, Я. Н. Иммунная система населения, подвергшегося воздействия на следе ядерного взрыва / Я. Н. Шойхет, В. А. Козлов, В. И. Коненков, В. И. Киселев, С. В. Сенников, И. Б. Колядо, А. И. Алгазин, В. Б. Колядо, Е. В. Зайцев // Барнаул. - 2000. – 179 с.
- DiCarlo, A. L. Development and Licensure of Medical Countermeasures for Platelet Regeneration after Radiation Exposure / A. L. DiCarlo, M. Poncz, D. R. Cassatt, J. R. Shah, C. W. Czarniecki, B. W. Maidment // Rad. Res. – 2011. – V. 176. P. 134–137.
- Augustine D. Animal models for radiation injury, protection and therapy // D. Augustine, T. Gondre-Lewis, W. McBride, L. Miller, T. C. Pellmar, S. Rockwell // Radiat. Res. – 2005. – Vol. 164, - P. 100–109.
- Самбур М.Б. Динамика состояния системы иммунитета крыс в процессе адаптации к однократному и фракционированному воздействию малых доз внешнего -облучения / М. Б. Самбур, О. Ф. Мельников, С. В. Тимченко, М. Д. Тимченко // Радиационная биология. Радиоэкология. - 1994. - №1. - Т.34. - С. 55 - 63.
- Самбур М.Б. Морфологическая характеристика центральных и периферических органов системы иммунитета крыс в динамике адаптации к внешнему -облучению в малых дозах // М. Б. Самбур, Л. П. Калиновская, О. Ф. Мельников, Л. Г. Розенфельд // Радиационная биология. Радиоэкология. - 1998. - № 2. - Т.38. - С. 191-199.
- Шмакова, Н.Л. Цитогенетические эффекты малых доз облучения в клетках млекопитающих: анализ ферментов гиперчувствительности и индуцированной резистентности // Н. Л. Шмакова, Т. А. Фадеєва, Е. А. Насонова // Радиационная биология. - Радиоэкология. - 2002. - № 3. - Т.42. - С.245 - 250.
- Гриневич Ю.А. Иммунные и цитогенетические эффекты плотно- и редкоионизирующих излучений: Монография // Ю. А. Гриневич, Э. А. Демина, под ред. А. А. Ярилина - К.: Здоров'я, 2006. - 200 с.
- Zhang, H. The Development of Classically and Alternatively Activated Macrophages Has Different Effects on The Varied Stagesof Radiation-induced Pulmonary Injury in Mice / H. Zhang, G. Han, H. Liu, J. Chen, X. Ji, F. Zhou, Y. Zhou, C. Xie // J. Radiat. Res. – 2011. – V. 52. – P. 717 – 726.
- Rizvi A. Low-dose gamma-rays and simulated solar particle event protons modify splenocyte gene and cytokine expression patterns [Text] / A. Rizvi, M. J. Pecaut, D. S. Gridley // J. Radiat. Res., - 2011. – V. 52. – P. 701–711
- Brook I. Susceptibility of the irradiated mice to Bacillus anthracis Sterne by intratracheal route of infection // I. Brook, T. B. Elliot, R. A. Harding // J. Med.Microbiology, - 2011. – V. 50. - P. 702 - 711
- Chang, C. M. Ionizing radiation and bacterial challenge alter splenic cytokine gene expression [Text] / C. M. Chang, T. B. Elliott, M. E. Dobson, et al. // J. Radiat. Res. – 2000, - V. 41. – P. 259–277
- Ryu T. Transplantation of newborn thymus plus hematopoietic stem cells can rescue supralethally irradiated mice // T. Ryu, N. Hosaka, T. Miyake, W. Cui, T. Nishida, T. Takaki, M. Li, K. Kawamoto, S. Ikehara // Bone Marrow Transplant – 2008, - Vol. 41. – P. 659–666
- Yoshino H. Differential induction from X-irradiated human peripheral blood monocytes to dendritic cells // H. Yoshino, K. Takahashi, S. Monzen, I. J. Kashiwakura // J. Radiat. Res. – 2008, - Vol. 49. – P. 293–303
- Anno G. H. Dose response relationships for acute ionizing-radiation lethality // G. H. Anno, R. W. Young, R. M. Bloom, J. R. Mercier // Health Phys. – 2003, - Vol. 84. – P. 565–575.
- Gridley D. S. Radiation and primary response to lipopolysaccharide: bone marrow-derived cells and susceptible organs in vivo // D. S. Gridley, G. M. Miller, M. J. Pecaut –2007, – V. 21. - P. 453-462
- Ibuki Y. Contribution of inflammatory cytokine release to activation of resident peritoneal macrophages after in vivo low-dose -irradiation [Text] / Yuko Ibuki, Rensuke Goto // Journal of Radiation Research. – 1999. – V. 40. - № 3. – P. 253 - 262
- Gremy O. Caffeic acid phenethyl ester modifies the Th1/Th2 balance in ileal mucosa after y-irradiation in the rat by modulating the cytokine pattern [Text] / O. Gremy, M. Benderiter, C. Linard // World. J. Gastroenterol. - 2006. – V. 12. - № 31. – P. 4996-5004
- Coates P.J. Indirect macrophage responses to ionizing radiation: implications for genotype-dependent bystander signaling [Text] / P.J. Coates, J.K. Rundle, S.A. Lorimore, E.G. Wright // Cancer Res. – 2008. – V.68. - №2. – P. –
- Flierl M. A. Adverse functions of IL-17A in experimental sepsis [Text] / M. A. Flierl, Rittirsch D., Gao H., Hoesel L. M. et al. // FASEB J. – 2008. – V. 22. – P. 2198–2205
- van der Veerdonk F. L. Th17 responses and host defense against microorganisms: an overview [Text] / F. L. van der Veerdonk, M. S. Gresnigt, B. J. Kullberk, J. W. M. van der Meer et al. // BMB reports. - 2009. – V. 42. - № 12. – P. 776 - 787
- Passos S. T. IL-6 Promotes NK cell production of IL-17 during toxoplasmosis [Text] / S. T. Passos, J. S. Silver, A. C. O’Hara, D. Sehy et al. // The journal of immunology. – 2010. –V. 184. – P. 1776–1783
- Wang Y. Activated CD4+ T cells enhance radiation effect through the cooperation of interferon- and TNF- [Text] / Y. Wang, S. Radfar, H. T. Khong // BMC Cancer. – 2010. –V. 10. – P. 60 – 73
- Keestra, A. M. Early MyD88-dependent induction of interleukin-17A expression during Salmonella colitis [Text] / A. M. Keestra, I. Godinez, M. N. Xavier, M. G. Winter et al. // Infection and immunity. – 2011. – V. 79. - № 8. –P. 3131-3140.
- Zhang P. Activation of IKK by thymosin a1 requires the TRAF6 signalling pathway [Text] / P. Zhang, J. Chan, A.-M. Dragoi, X. Gong et al. // EMBO reports. – 2005. – V. 6. - № 6. – P. 531-538
- Zhang Y. Thymosin alpha1- and ulinastatin-based immunomodulatory strategy for sepsis arising from intra-abdominal infection due to carbapenem-resistant bacteria [Text] / Y. Zhang, H. Cheng, Y. M. Li, S. S. Zheng et al. // J Infect Dis. – 2008. – Vol. 198. - №5. – P. 723-30
- Yang X. Effect of thymosin alpha-1 on subpopulations of Th1, Th2, Th17, and regulatory T cells (Tregs) in vitro [електронний ресурс] / X. Yang, F. Qian, H.-Y. He, K.-J. Liu et al. // Brazilian Journal of Medical and Biological Research Online Provisional Version. – 2011.: www.bjournal.com.br
- Klebanoff C. A. Sinks, suppressors and antigen presenters: how lymphodepletion enhances T cell-mediated tumor immunotherapy // C. A. Klebanoff, H. T. Khong, P. A. Antony, D. C. Palmer, N. P. Restifo // Trends Immunol. – 2005, - Vol. 26. - P. 111–117
- MacVittie T. J. Defining the full therapeutic potential of recombinant growth factors in the post radiation-accident environment: the effect of supportive care plus administration of G-CSF // T. J. MacVittie, A. M. Farese, W. Jackson 3rd. // Health Phys. – 2005, - Vol. 89. – P. 546–555
- Olascoaga D. Wound healing in radiated skin: pathophysiology and treatment options // D. Olascoaga, A. Vilar-Compte, A. Poitevin-Chacon, J. Contreras-Ruiz // Int. Wound J. – 2008, - Vol. 5. – P. 246–257
- Chen X. M. Immunomodulatory function of orally administered thymosin 1 [Text] / X. – M. Chen, H.-L. Jiang, L.-F. Zhou, X.-P. Pan et al. // Zhejiang Univ. Sci. – 2005, –Vol. 6B. - № 9. – P. 873-876.
- Клиническая фармакология тимогена / под ред. В.С. Смирнова. // СПб:, 2003. С.156.
- Yao Q. Thymosin-alpha1 modulates dendritic cell differentiation and functional maturation from human peripheral blood CD14+ monocytes [Text] / Q. Yao, L. X. Doan, R. Zhang, U. Bharadwaj et al. // Immunol. Lett. – 2007. – Vol. 110. - № 2. – P. 110 - 120
- De Chadarevian S. Mice and the reactor: the “genetics experiment” in 1950s / S. De Chadarevian - Britain. J. Hist. Biol. – 2006. - Vol. 39. P. 707–735
- FDA New drugs and biological drug products: evidence needed to demonstrate effectiveness of new drugs when human efficacy studies are not ethical or feasible, In Federal Register, Std. 37988–37998. – 2002. - Washington,
- Давыдовский, И. В. Общая патология человека / И. В. Давыдовский. – 2-е изд., перераб. и доп. – М. : Медицина, 1969. – 611 с.
- Sereti, A. Biomarkers in Immune Reconstitution Inflammatory Syndrome: Signals from Pathogenesis [Text] / I. Sereti, A. J. Rodger, M. A. French // Curr. Opin. HIV AIDS. – 2010. – V. 5. - № 6. – P. 504–510.
- Кузник Б.И. Иммуногенез и неспецифическая резистентность организма / Б. И. Кузник, Н. В. Васильев, Н. Н. Цыбиков — М. : Медицина, 1989.320 с.
- Коляда Т. И. Адаптационный синдром и иммунитет / Т. И. Коляда, Ю. Л. Волянский, Н. В. Васильев, В. И. Мальцев — Харьков, 1995.-368 с.
- Игнатьева Г. А. Современные представления об иммунитете (контуры общей теории) / Г. А. Игнатьева // Патол. физиология и эксперим. терапия. – 2003. – № 2. – С. 2 – 7.
- Горицький В. М. Запалення – типовий патологічний процес / В. М. Горицький М. С. Регеда / Проблеми патології в експерименті та клініці : зб. наук. праць. – Львів - 1996. – Т. 17. – С. 155 – 180.
- Медведецкий Е. Б. Маркеры воспаления и их клиническое значение / Е. Б. Медведецкий, В. А. Деев, В. П. Шкарбан / Клініч. хірургія. – 2005. – № 11/12. – C. 42.
- Никоненко А. Г. Современные представления о механизмах регуляции воспалительного процесса / А. Г. Никоненко - Биол. терапия. – 2006. – № 1. – С. 11 – 16.
- Ройт А. Иммунология: пер. с. англ. / А. Ройт, Дж. Бростофф, Д. Мейл — М.: Мир, 2000. — 592 с, ил.
- Дранник Г.М. Клінічна імунологія та алергологія [Текст] / Г. М. Дранник, О.С. Прилуцький, Ю.И. Бажора - Підручник під ред. Г. М. Драник - К.: Здоров’я, 2006. - 888 с.
- Чоп'як В.В. Клінічна імунологія для практичних лікарів (цикл лекцій частина перша) [Текст] / В. В, Чоп'як, Г. О. Потьомкіна, А. М. Гаврилюк – Л, 2010. - 226 с.
- Якобісяк М. Імунологія / М. Якобісяк під ред. В. В. Чоп'як, - Вінниця: Нова книга. - 2003. - 705 с.
- Lopez A. F. Molecular basis of cytokine receptor activation / A. F. Lopez, T. Hercus, R. P. Ekert et al. - IUBMB Life. – 2010. – Vol. 62, № 7. – P. 509–518.
- Bordon Y. Cytokines: Cytokines reach out / Y. Bordon - Nat. Rev. Immunol. – 2010. – Vol. 10, № 6. – Р. 382.
- Ishii H. Inflammatory cytokines / H. Ishii, M. Yoshida - Nippon Rinsho. – 2010. – Vol. 68, № 5. – P. 819–822.
- Schett G. Effects of inflammatory and anti-inflammatory cytokines on the bone / G. Schett - Eur. J. Clin. Invest. – 2011. May 25. doi: 10.1111/j.1365-2362.2011.02545.x. [Epub ahead of print].
- Goriely S. Interleukin-12 family members and type I interferons in Th17-mediated inflammatory disorders / S. Goriely, R. Cavoy, M. Goldman - Allergy. – 2009. – Vol. 64, № 5. – P. 702–709.
- Hamza T. Interleukin 12 a key immunoregulatory cytokine in infection applications / T. Hamza, J. B. Barnett, B. Li - Int. J. Mol. Sci. – 2010. – Vol. 11, № 3. – P. 789–806.
- Cyktor J. C. Interleukin-10 and immunity against prokaryotic and eukaryotic intracellular pathogens [Text] / J. C. Cyktor, J. Turner - Infection and immunity. - 2011. – V. 79. - № 8. –P. 2964–2973.
- Moore K. W. Interleukin-10 and the interleukin-10 receptor // K. W. Moore, R. de Waal Malefyt, R. L. Coffman, A. O'Garra - Annu. Rev. Immunol. 2001. – Vol. 19. – P. 683–765.
- Saraiva M. The regulation of IL-10 production by immune cells / M. Saraiva, A. O'Garra - Nat. Rev. Immunol. - 2010. – Vol. 10. – P. 170–181.
- Stumhofer J. S. Interleukins 27 and 6 induce STAT3-mediated T cell production of interleukin 10 / J. S. Stumhofer et al. - Nat. Immunol. - 2007. – Vol. 8. – P. 1363–1371.
- McGeachy M. J. TGF-beta and IL-6 drive the production of IL-17 and IL-10 by T cells and restrain T(H)-17 cell-mediated patholog / M. J. McGeachy et al. - Nat. Immunol. – 2007. – Vol. 8. - P. 1390–1397.
- Fitzgerald D. C. Suppression of autoimmune inflammation of the central nervous system by interleukin 10 secreted by interleukin 27-stimulated T cells / D. C. Fitzgerald et al. - Nat. Immunol. – 2007. – Vol. 8. P. 1372–1379.
- Murugaiyan G. IL-27 is a key regulator of IL-10 and IL-17 production by human CD4+ T cells / G. Murugaiyan, A. Mittal, R. Lopez-Diego, L. M. Maier, D. E. Anderson, H. L. Weiner - J. Immunol. – 2009. – Vol. 183. – P. 2435–2443.
- Nemeth Z. H. Adenosine augments IL-10 production by macrophages through an A2B receptor-mediated posttranscriptional mechanism / Z. H. Nemeth et al. - J. Immunol. – 2005. – Vol. 175. – P. 8260–8270.
- Guichelaar T. Autoantigen-specific IL-10-transduced T cells suppress chronic arthritis by promoting the endogenous regulatory IL-10 response / T. Guichelaar et al. - J. Immunol. – 2008. – Vol. 180. - P. 1373–1381.
- Horwitz D. A. Natural and TGF--induced Foxp3+CD4+ CD25+ regulatory T cells are not mirror images of each other / D. A. Horwitz, S. G. Zheng, J. D. Gray - Trends Immunol. – 2008. – Vol. 29. – P. 429–435
- Mantel P. Y. Transforming growth factor-: recent advances on its role in immune tolerance / P. Y. Mantel, C. B. Schmidt-Weber - Methods Mol. Biol. – 2011. – Vol. 677. – P. 303–338
- Shevach E. M. Mechanisms of foxp3+ T regulatory cell-mediated suppression / E. M. Shevach - Immunity - 2009. – Vol. 30. – P. 636–645
- Wahl S. M. Transforming growth factor-: innately bipolar / S. M. Wahl - Curr. Opin. Immunol. – 2007. – Vol. 19. – P. 55–62
- Yoshimura A. TGF- function in immune suppression / A. Yoshimura, G. Muto - Curr. Top Microbiol. Immunol. – 2011. – Vol. 350 – P. 127–147
- Kulkarni A. Inflammatory myositis in association with inflammatory bowel disease / A. Kulkarni, T. J. Ravi, G. J. Brodmerkel Jr., R. M. Agrawal - Dig. Dis. Sci. – 1997. – Vol. 42. – P. 1142–1145.
- Mi S. Blocking IL-17A promotes the resolution of pulmonary inflammation and fibrosis via TGF-1-dependent and -independent mechanisms / S. Mi, Z. Li, H. Z. Yang, H. Liu, J. P. Wang, Y. G. Ma, X. X. Wang, H. Z. Liu, W. Sun, Z. W. Hu - J. Immunol. – 2011. – Vol. 187. – P. 3003–3014
- Dwivedi V.P. Transforming Growth Factor- Protein Inversely Regulates in Vivo Differentiation of Interleukin-17 (IL-17)-producing CD4+ and CD8+ T Cells / V. P. Dwivedi, S. Tousif, D. Bhattacharya, D. V. R. Prasad, L. V. Kaer, J. Das, G. Das - The Journal Of Biological Chemistry – 2012. - Vol. 287. - No. 5, pp. 2943–2947
- Harrington L.E. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages / L. E. Harrington, R. D. Hatton, P. R. Mangan, H. Turner, T. L. Murphy, K. M. Murphy, C. T. Weaver - Nat Immunol. – 2005, Nov. - Vol. 6 (11). P. 1123-32. Epub 2005 Oct 2.
- Ivanov I. I. Transcriptional regulation of Th17 cell differentiation / I. I. Ivanov, L. Zhou, D. R. Littman // Semin Immunol. – 2007. - Dec;19 (6): 409-17. Epub 2007 Nov 28.
- Mathur A.N. T-bet is a critical determinant in the instability of the IL-17-secreting T-helper phenotype / A. N. Mathur, H. C. Chang, D. G. Zisoulis, R. Kapur, M. L. Belladonna, G. S. Kansas, M. H. Kaplan // Blood. – 2006. - Sep 1;108(5):1595-601.
- Schett G. Review: Immune cells and mediators of inflammatory arthritis / G. Schett // Autoimmunity – 2008. - Apr;41(3):224-9. Review.
- Schett G. Denosumab - a novel strategy to prevent structural joint damage in patients with RA? / G. Schett, J. P. David // Nat. Clin. Pract. Rheumatol. – 2008. - Dec;4(12):634-5. Epub 2008 Oct 7.
- Pollard K.M. Using single-gene deletionsto identify checkpoints in the progression of systemic autoimmunity / K. M. Pollard, P. Hultman, D. H. Kono // Ann. NY Acad. Sci. – 2003. - 987:236–239. doi:10.1111/j.1749-6632.2003.
- Sebba A. Tocilizumab: the first interleukin-6-receptor inhibitor / A. Sebba // Am. J. Health Syst. Pharm. – 2008. – Vol. 65. – P. 1413–1418.
- Yang X.O. T helper 17 lineage differentiation is programmed by orphan nuclear receptors ROR alpha and ROR gamma / X. O. Yang, B. P. Pappu, R. Nurieva, A. Akimzhanov, H. S. Kang, Y. Chung, L. Ma, B. Shah, A. D. Panopoulos, K. S. Schluns, S. S. Watowich, Q. Tian, A. M. Jetten, C. Dong // Immunity – 2008. - Jan;28 (1): P. 29-39. Epub 2007 Dec 27.
- de Keijzer S. Interleukin-4 alters early phagosome phenotype by modulating>
- Шевелев С. В. Иммунологические способности последствия индукции антител к IFN-гамма и IL-4 у мышей / С. В. Шевелев, А. Н. Митин // Цитокины и воспаление. – 2008. – № 3. – С. 3–8.
- Gordon S. Alternative activation of macrophages: mechanism and functions / S. Gordon, F. O. Martinez // Immunity – 2010. – Vol. 32. – P. 593–604.
- Wainszelbaum M. J. IL4/PGE2 induction of an enlarged early endosomal compartment in mouse macrophages is Rab5-dependent / M. J. Wainszelbaum, B. M. Proctor, S. E. Pontow, P. D. Stahl, M. A. Barbieri // Exp. Cell. Res. – 2006. – Vol. 312. – P. 2238–2251
- Varin A. Alternative activation of macrophages by IL-4 impairs phagocytosis of pathogens but potentiates microbial-induced signalling and cytokine secretion / A. Varin, S. Mukhopadhyay, G. Herbein, S. Gordon // Blood. – 2010. – Vol. 115. – P. 353–362
- Loke P. Alternative activation is an innate response to injury that requires CD4+ T cells to be sustained during chronic infection / P. Loke, I. Gallagher, M. G. Nair, X. Zang, F. Brombacher, et al. // J. Immunol. – 2007. – Vol. 179. P. 3926–3936
- Серебренникова С. Н. Роль цитокинов в воспалительном процессе (Сообщение 2) / С. Н. Серебренникова, И. Ж. Семинский // Сиб. мед. журнал. – 2008. – № 8. – С. 5–8.
- Weiss U. Inflammation / Nature. – 2008. – Vol. 454, № 7203. – P. 427.
- Черноморец П. М. Основные современные данные о механизмах воспаления. Основные механизмы развития острого воспаления: взгляд современной физиологии / П. М. Черноморец, А. В. Жолос // Антигомотоксическая терапия острых воспалительных заболеваний: тез. Междунар. науч.-практ. симпозиума. – К., 2006. – С. 6–21.
- Novotny A. R. Biomarkers in SIRS and sepsis: Quo vadis? / A. R. Novotny // J. Emerg. Trauma Shock. – 2010. – Vol. 3, № 1. – P. 36–38.
- Bone R.C., Sir Isaac Newton, sepsis, SIRS, and CARS / R. C. Bone // Crit Care Med. – 1996. - Jul;24(7) – P. 1125-1128.
- Козлов В.А. Клиническая иммунология в клинике внутренних болезней / В. А. Козлов – Новосибирск: Типография СО РАМН, 1997. – 21 с.
- Mossman R.T. The expanding universe of T-cell subsets: Th1, Th2 and more / R. T. Mossman, S. Sad // Immunology Today. – 1996. - V. 17, N3. P. 138 – 146.
- Cao, M. Gamma irradiation alters the phenotype and function of CD4+CD25+ regulatory T cells [Text] / M. Cao, R. Cabrera, Y. Xu, C. Liu, D. Nelson // Cell. Biol. Int. – 2009. – V. 33. - № 5. – P. 565–571
- Liu, S. – Z. Nonlinear dose response relationship in the immune system following exposure to ionizing irradiation: mechanisms and implications [Text] / S. – Z. Liu // Nonlinearity in Biology, Toxicology and Medicine. – 2003. – V. 1. - № 1. – P. 71-92
- Stone H. B. Models for evaluating agents intended for the prophylaxis, mitigation and treatment of radiation injuries / H. B. Stone, J. E. Moulder, C. N. Coleman, K. K. Ang, M. S. Anscher, M. H. Barcellos-Hoff, W. S. Dynan, J. R. Fike, D. J. Grdina, D. Zaharevitz // Report of an NCI Workshop, December 3–4, 2003. Radiat. Res. – 2004. Vol. 162. - P. 711–728 (2004).
- McBride W. H. A sense of danger from radiation / W. H. McBride, C. S. Chiang, J. L. Olson, C. C. Wang, J. H. Hong, F. Pajonk, G. J. Dougherty, K. S. Iwamoto, M. Pervan, Y. P. Liao, // Radiat. Res. – 2004. Vol. 162. – P. 1–19
- Yoshino H. Differential induction from X-irradiated human peripheral blood monocytes to dendritic cells / H. Yoshino, K. Takahashi, S. Monzen, I. J. Kashiwakura // Radiat. Res. – 2008. – Vol. 49. – P. 293–303
- Thompson, A. L. Cytokines: the future of intranasal vaccine adjuvants [Text] / A. L. Thompson, H. F. Staats // Clinical and Developmental Immunology. – 2011. - V. 2011. - Article ID 289597. – 17 p
- Плехова Е.И. Характеристика иммуногормональных связей на этапе позднего полового созревания у здоровых подростков и потомков ликвидаторов последствий чернобыльской катастрофы / Е. И. Плехова, Н. В. Шляхова // Проблеми ендокринної патології - №2, 2011. – С. 12 – 16.
- Ярилин А.А. Действие ионизирующей радиации на лимфоциты (повреждающий и активирующий эффекты) / А. А. Ярилин // Иммунология. - 1988. - № 5. - С. 5-11.
- Бычковская И. Б. Особые долговременные изменения клеток при воздействии радиации в малых дозах / И. Б. Бычковская, Р. П. Степанов, Р. Ф. Федорцева // Радиационная биология. Радиоэкология. -2002. - №1. - Т.42. - С. 20-35.
- Губский В.И. Пострадиационные изменения структуры плазматических мембран тимоцитов и лимфоцитов при фракционированном облучении крыс / В. И. Губский, В. И. Древаль, Н. А. Митряева // Радиационная биология. Радиоэкология. - 1994. - № 6. - Т.34.
- Клименко М.О. Вплив низькоінтенсивного -випромінювання на клітинний склад вогнища хронічного запалення / М. О. Клименко, М. І. Онищенко // Фізіол. журн. - 2004. - №6. - Т.50. - С. 88-94.
- Пинчук Л.Б. Состояние костномозгового кроветворения у крыс / Л. Б. Пинчук, Я. И. Серкиз, Н. К. Родионова // Радиационная биология. Радиоэкология. - 1991. - №5. - Т.31. - С. 635 -641.
- Мельников О.Ф. Состояние клеточного иммунитета у разных поколений крыс / О. Ф. Мельников, М. Б. Самбур, В. М. Индык // Радиационная биология. Радиоэкология. - 1991. - №5. - Т.31. - С. 673 -677.
- Ручко М.В. Влияние различных доз ионизирующего излучения на функциональную активность и механизмы активации лимфоидных клеток селезенки и тимуса крыс при воздействии стимулирующего сигнала / М. В. Ручко, Л. И. Остапченко, О. Е. Налевина, Н. Е. Кучеренко // Радиационная биология. Радиоэкология. - 1994. - №2. - Т.34. - С. 247 - 250.
- Савцова З.Д. Кооперативные иммунные реакции у различных поколений мышей / З. Д. Савцова, С. А. Ковбасюк, О. Ю. Юдина // Радиационная биология. Радиоэкология. - 1991. - №5. - Т.31. - С. 679 -686.
- Серкиз Я.И. Модель эксперимента. Радиационные нагрузки у животных, постоянно находившихся в условиях внешнего и внутреннего радиационного воздействия в зоне ЧАЭС / Я. И. Серкиз, А. И. Липская, Л. Б. Пинчук // Радиационная биология. Радиоэкология. - 1991. - №5. - Т.31. - С. 629 - 634.
- Амвросьев А.П. Состояние кровеносных капилляров яичника плодов белой крысы после облучения в различные периоды их эмбриогенеза / А. П. Амвросьев, О. Н. Аблековская // Радиационная биология. Радиоэкология. - 2001. - №4. - Т.41. - С. 373-377.
- Амвросьев А.П. Влияние однократного внешнего -облучения в дозе 0,5 Гр на развитие зародышей крысы / А. П. Амвросьев, Ю. И. Рогов, Р. И. Дорохина, В. С. Павленко // Радиационная биология. Радиоэкология. - 1993. - №2 (5). - Т.33.
- Бурлакова Е.Б. Особенности биологического действия малых доз облучения / Е. Б. Бурлакова, А. Н. Голощапов, Н. В. Горбунова // Радиационная биология. Радиоэкология. - 1996. - № 4. - Т.36. - С. 611-631.
- Клименко М.О. Вплив низько інтенсивного -випромінювання на кістковий мозок при хронічному запаленні / М. О. Клименко, В. В. Золотухін // Укр. радіол. журн. - 2006. - Т.41, вип. 1. - С. 42-46.
- Клименко М.О. Лейкоцитарная реакция периферической крови при действии низкоинтенсивного -излучения на фоне хронического воспаления / М. О. Клименко, В. В. Золотухін // Експерим. і клін. медицина. - 2006. - №2. - С. 22-25.
- Клименко М.О. Лейкоцитарная реакция очага хронического воспаления при действии низкоинтенсивного -излучения / М. О. Клименко, В. В. Золотухін // Експерим. і клін. медицина. - 2006. - №3. - С.5-9.
- Klimenko N.A. Cellular response on low dose-rate gamma-irradiation at chronik inflammation in rats / N. A. Klimenko, V. I. Onyshchenko, O. S. Varvarycheva, V. V. Zolotukhin // Chin. J. Pathophysiol. - 2006. - Vol. 22, №13. - Р. 353.
- Клименко М.О. Вплив низькоінтенсивного -випромінювання на хемілюмінесценцію тканин тимуса при хронічному запаленні / М. О. Клименко, О. С. Варваричева // Експерим. і клін. медицина. - 2006. - №2. - С.17-21.
- Клименко М.О. Експресія білка р53 у лімфоцитах тимуса й селезінки щурів при дії низькоінтенсивного гамма-випромінювання на тлі хронічного запалення / М. О. Клименко, О. С. Варваричева // Укр. радіол. журн. - 2007. - Т.15, № 1. - С. 71-75.
- Клименко Н.А. Морфологические изменения тимуса под влиянием низкоинтенсивного -облучения при хроническом воспалении / Н. А. Клименко, И. В. Сорокина, О. С. Варваричева // Медицина сьогодні і завтра. - 2006. - № 3-4. - С.42-49.
- Кузьменко А.В. Индивидуальные особенности восстановления показателей иммунитета крыс после общего однократного рентгеновского облучения / А. В. Кузьменко, М. О. Иваненко, Н. А. Никифорова / / Украинский радиологический журнал. — 2008. — Т. XVII, вып.2. — С. 206 — 210.
- Liu, C. Gamma-ray irradiation impairs dendritic cell migration to CCL19 by down-regulation of CCR7 and induction of cell apoptosis [Text] / C. Liu, J. Lin, L. Zhao, Y. Yang et al. // Int. J. Biol. Sci. - 2011. – V. 7. – № 2. – P. 168-179
- Gridley, D. S. Low dose, low dose photon radiation modifies leukocyte distribution and gene expression in CD4+ Cells [Text] / D. S. Gridley, A. Rizvi, X. Luo-Owen, A. Y. Makinde, M. Pecaut // J. Radiat, Res. – 2009. – V. 50. – P. 139-150
- Narang H. Mitogen-activated protein kinases: specificity of response to dose of ionizing radiation in liver / H. Narang, M. Krishna // J Radiat Res. - 2004 Jun;45(2):213-20.
- Gallet., P. Long-term alterations of cytokines and growth factors expression in irradiated tissues and relation with histological severity scoring [Електронний ресурс] / P. Gallet., B. Phulpin., J. Merlin, A. Leroux, P. Bravetti, H. Mecellem, N. Tran, G. Dolivet // PlosONE. – 2011. – V. 6. – Issue 12. –P. 293-299.
- Shigematsu, S. Effects of Low-dose Irradiation on Enhancement of Immunity by Dendritic Cells / S. Shigematsu, Y. Adachi, N. Koike-Kiriyama, Y. Suzuki, M. Iwasaki, Y. Koike, K. Nakano, H. Mukaide, M. Imamura, S. Ikehara // J. Radiat. Res. – 2007. – Vol. 48. – P. 51-55
- Soule, B. P. Effects of gamma radiation on FcRI and TLR-mediated mast cell activation [Text] / B. P. Soule, J. M. Brown, N. M. Kushnir-Sukhov, N. L. Simone et al. // The Journal of Immunology. - 2007. –V. 179. –P. 3276–3286.
- Scaldaferri F. Inflammatory bowel disease: progress and current concept of etiopathogenesis / F. Scaldaferri, C. Fiocchi // J. Dig. Dis. – 2007. – Vol. 8. – P. 171–178.
- Garga, S. Influence of sublethal total-body irradiation on immune cell populations in the intestinal mucosa [Text] / S. Garg, M. Boerma, J. Wang, Q. Fu et al. // Radiat Res. – 2010. – V. 173. - № 4. - P. 469–478
- Linard, C. Acute induction of inflammatory cytokine expression after gamma-irradiation in the rat: effect of an NF-B inhibitor / C. Linard, C. Marquette, J. Mathieu, A. Pennequin, D. Clarencon, D. Mathe // Int. J. Radiat. Oncol. Biol. Phys. – 2004. – Vol. 58. – P. 427–434.
- Gremy, O. Acute and persisting Th2-like immune response after fractionated colorectal gamma-irradiation / O. Gremy, M. Benderitter, C. Linard // World J. Gastroenterol. – 2008.- Vol. 14. P. - 7075–7085.
- MacDonald, T. T. The mucosal immune system / T. T. MacDonald // Parasite Immunol. – 2003. – Vol. 25. – P. 235–246.
- Han, S. K. Effect of gamma radiation on cytokine expression and cytokinereceptor mediated STAT activation / S. K. Han, J. Y. Song, Y. S. Yun, S. Y. Yi, // Int. J. Radiat. Biol. – 2006. – Vol. 82. - P. 686–697.
- Park, H. R. Factors effecting the Th2-like immune response after gamma-irradiation: low production of IL-12 heterodimer in antigen-presenting cells and small expression of the IL-12 receptor in T cells / H. R. Park, S. K. Jo, S. G. Paik // Int. J. Radiat. Biol. – 2005. – Vol. 81. P. 221–231.
- Reissfelder, C. A randomized controlled trial to investigate the influence of low dose radiotherapy on immune stimulatory effects in liver metastases of colorectal cancer [Електронний ресурс] / C. Reissfelder, C. Timke, H. Schmitz-Winnenthal, N. N. Rahbari, M. Koch, F. Klug, F. Roeder, L. Edler, J. Debus, M. W. Bchler, P. Beckhove, P. E. Huber, J. Weitz // BMC Cancer. – 2011. – P. 11:419.
- Saito-Fujita, T. Attenuated lung fibrosis in interleukin 6 knock-out miceafter c-ion irradiation to lung / T. Saito-Fujita, M. Iwakawa, E. Nakamura, M. Nakawatari, H. Fujita, T. Moritake, T. Imai // J. Radiat. Res. – 2011. – V. 52. - P. 270–277.
- Kiyohara, H Radiation-induced ICAM-1 Expression via TGF-1 Pathway onHuman Umbilical Vein Endothelial Cells; Comparisonbetween X-ray and Carbon-ion Beam Irradiation / H. Kiyohara, Y. Ishizaki, Y. Suzuki, H. Katoh, N. Hamada, T. Ohno, T. Takahashi, Y. Kobayashi, T. Nakano // J. Radiat. Res. – 2011. – V. 52. – P. 287–292.
- Conti, H. R. Host responses to Candida albicans: Th17 cells and mucosal candidiasis [Text] / H. R. Conti, S. L. Gaffen // Microbes Infect. – 2010. –V. 12. - № 7. – P. 518–527.
- Fitzgerald D. C. Suppression of autoimmune inflammation of the central nervous system by interleukin 10 secreted by interleukin 27-stimulated T cells / D. C. Fitzgerald et al. // Nat. Immunol. – 2007. – Vol. 8. – P. 1372–1379.
- Abba, M. C. GATA3 protein as a MUC1 transcriptional regulator in breast cancer cells / M. C. Abba, M. I. Nunez, A. G. Colussi, M. V. Croce, A. Segal-Eiras, C. M. Aldaz // Breast Cancer Res. – 2009.- Vol. 8. – P. 64.
- Cash, H. L. Symbiotic bacteria direct expression of an intestinal bactericidal lectin / H. L. Cash, C. V. Whitham, C. L. Behrendt, L. V. Hooper – Science – 2006. – Vol. 313. - P. 1126–1130.
- Aubert, D. Characterization of specific anti-Candida IgM, IgA and IgE: diagnostic value in deep-seated infections / D. Aubert, D. Puygauthier-Toubas, P. Leon, B. Pignon, F. Foudrinier, F. Marnef, J. Boulant, J. M. Pinon // Mycoses. - 1996 May-Jun Vol. 39. – P. 5-6, 169-176.
- Balish, E. Importance of beta2-microglobulin in murine resistance to mucosal and systemic candidiasis / E. Balish, F. A. Vazquez-Torres, J. Jones-Carson, R. D. Wagner, T. Warner // Infect. Immun. – 1996. - Dec 64:12 5092-7.
- Vazquez-Torres, F. A. Macrophages in resistance to candidiasis / F. A. Vazquez-Torres, E. Balish // Microbiol. Mol. Biol. - Rev. 1997. – Vol. 61, 2. P. 170-192.
- Samaranayake, Y. H. The antifungal effect of lactoferrin and lysozyme on Candida krusei and Candida albicans / Y. H. Samaranayake, L. P. Samaranayake, P. Wu, M. So // APMIS. – 1997. - Nov. Vol. 105. –P. 875-883.
- Wang, Y. Cytokine Involvement in Immunomodulatory Activity Affected by Candida albicans / Y. Wang, S. Li, A. Moser, K. Bost, J. Domer // Mannan. Infect. Immun. – 1998. – Vol. 66. P. 1384-1391.
- Romani, L. Th1 and Th2 cytokine secretion patterns in murine candidiasis: association of Th1 responses with acquired resistance / L. Romani, S. Mocci, C. Bietta, L. Lanfaloni, P. Puccetti, F. Bistoni // Infect. Immun. – 1991. – Dec. Vol. 59. – P. 4647-4654.
- Cenci, E. T helper cell type 1 (Th1)- and Th2-like responses are present in mice with gastric candidiasis but protective immunity is associated with Th1 development / E. Cenci, A. Mencacci, R. Spaccapelo, L. Tonnetti, P. Mosci, K. H. Enssle, P. Puccetti, L. Romani, F. Bistoni // J. Infect. Dis. – 1995. - Vol. 171. – P. 1279-1288.
- Ashman, R. B. Production and function of cytokines in natural and acquired immunity to Candida albicans infection / R. B. Ashman, J. M. Papadimitriou // Microbiol. Rev. – 1995. - Dec Vol. 59. - P. 646-672.
- Romani, L. Natural killer cells do not play a dominant role in CD4+ subset differentiation in Candida albicans-infected mice. / L. Romani, A. Mencacci, E. Cenci, R.Spaccapelo, E. Schiaffella, L. Tonnetti, P. Puccetti, F. Bistoni // Infect. Immun. – 1993. – Vol. 61. - P. 3769-3774.
- De Bernardis, F. Protective role of antimannan and anti-aspartyl proteinase antibodies in an experimental model of Candida albicans vaginitis in rats / F. De Bernardis, M. Boccanera, D. Adriani, E. Spreghini, G. Santoni, A. Cassone // Infect. Immun. – 1997. – Aug. Vol. 8. – P. 3399- 33405.
- Wojdani, A. In vivo augmentation of natural killer cell activity by Candida albicans / A. Wojdani, M. Ghoneum // Int. J. Immunopharmacol. – 1987. – Vol.9. – P. 827-832.
- Лебедева Т. Н. Иммунитет при кандидозе (обзор) / Т.Н. Лебедева //. Проблемы медицинской микологии. - 2004. - Т.6, №4 - С.8-16.
- Сергеев А. Ю. Кандидоз, природа инфекции, механизмы агрессии и защиты, лабораторная диагностика, клиника и лечение / А. Ю. Сергеев, Ю.В. Сергеев // М., 2001, 472 с..
- Werner, G. H., Immunostimulating agents: what’s next? A review of their potential medical applications [Text] / G. H. Werner, P. Jolles // Eur. J. Biochem. – 1996. - V. 242. – P. 1-19.
- Dawson, R. Immunomodulation with recombinant interferon-1 in pulmonary tuberculosis [Електронний ресурс] / Dawson, R. Condos, D. Tse, M. L. Huie // PLoS One. – 2009. – V. 4. – Issue 9. – P. e6984.
- Goodbourn, S. Interferons: cell signalling, immune modulation, antiviral responses and virus countermeasures [Text] / S. Goodbourn, L. Didcock, R. E. Randall // Journal of General Virology. – 2000. – V. 81. – P. 2341–2364.
- Randall, R. E. Interferons and viruses: an interplay between induction, signalling, antiviral responses and virus countermeasures / R. E. Randall, S. J. Goodbourn // J. Gen. Virol. – 2008. – Vol. 89. – P. 1-47.
- Tilahun, A. Y. Interferon gamma-dependent intestinal pathology contributes to the lethality in bacterial superantigen- induced toxic shock syndrome [Електронний ресурс] / A. Y. Tilahun, M. Holz, T.-T. Wu, C. S. David, G. Rajagopalan // PlosOne. – 2011. – V. 6. – Issue 2. – P. e16764.
- Yang, C. Immunosuppressive exosomes: a new approach for treating arthritis / C. Yang, P. D. Robbins // Int. J. Rheumatol. - 2012;2012:573528. Epub 2012 Mar 6.
- Hiejima, E. Gastric ulcer and gastroenteritis caused by Epstein-Barr virus during immunosuppressive therapy for a child with systemic juvenile idiopathic arthritis / E. Hiejima, T. Yasumi, H. Kubota, K. Ohmori, K. Ohshima, R. Nishikomori, H. Nakase, T. Chiba, T. Heike // Rheumatology (Oxford). – 2012. - May 15.
- Nurmohamed, M. T. Malignancy risk during TNF-blocking therapy increased or not? / M. T. Nurmohamed // Ned. Tijdschr. Geneeskd. – 2012. – Vol. 156(21):A4812.
- Segal, B. H. Immunotherapy for fungal infections [Text] / B. H. Segal, J. Kwon-Chung, T. J. Walsh, B. S. Klein et al. // Clinical Infectious Diseases. - 2006. – V. 42. – P. 507–15.
- Bethunaickan, R. Anti-TNF treatment of IFN induced lupus nephritis reduces the renal macrophage response but does not alter glomerular immune complex formation / R. Bethunaickan, R. Sahu, Z. Liu, Y. T. Tang, W. Huang, Q. Edegbe, H. Tao, M. Ramanujam, M. P. Madaio, A. Davidson // Arthritis Rheum. – 2012. - Jun 5. doi: 10.1002/art.34553.
- Romani, L. Thymosin alpha1:an endogenous regulator of inflammation, immunity, and tolerance [Text] / L. Romani, F. Bistoni, C. Montagnoli, R. Gaziano et al. // Ann. N. Y. Acad. Sci. – 2007. – V. 1112. – P. 326-38.
- Naik, S. R. Study of immunological aspects of aspergillosis in mice and effect of polyene macrolide antibiotic (SJA-95) and IFN-: a possible role of IFN- as an adjunct in antifungal therapy [Text] / S. R. Naik, V. N. Thakare, S. K. Desai, P. R. Rahalkar // Immunol. Lett. – 2011. – V. 141. - № 1. – P. 68-73
- Periti, P. Antimicrobial chemoimmunoprophylaxis in colorectal surgery with cefotetan and thymostimulin: prospective, controlled multicenter study / P. Periti, F. Tonelli, T. Mazzei, F. Ficari // Italian Study Group on Antimicrobial Prophylaxis in Abdominal Surgery. J Chemother. – 1993. - Feb;5(1). – P. 37-42.
- Netea, M. G. Aspergillus fumigatus evades immune recognition during germination through loss of tolllike receptor 4—mediated signal transduction / M. G. Netea, A. Warris, J. W. Van der Meer et al. // J. Infect. Dis. – 2003. – Vol. 188. – P. 320–326.
- Romani, L. Thymosin alpha1: an endogenous regulator of inflammation, immunity, and tolerance [Text] / L. Romani, F. Bistoni, C. Montagnoli, R. Gaziano et al. // Ann. N. Y. Acad. Sci. – 2007. – V. 1112. – P. 326-38.
- Hao, C. Treatment of patients with severe sepsis using Ulinastatin and Thymosin 1: a prospective, randomized, controlled pilot study [Text] / C. Hao, M. He, Y. Li // Chinese Medical Journal. – 2009. – V. 122. - № 8. –P. 883-888.
- Пат. № ua 76250 Державна служба інтелектуальної власності Україна, ДП «Український інститут промислової власності» МПК «Спосіб отримання моделі генералізованого кандидозу» [Текст] / Коляда О.М., Коляда Т.І., Скляр Н.І..Клименко О. М. », заявл.26.06. 2012; опубл. 25.12.2012, Бюл.№ 24/
- Караулов, А. В. Клиническая иммунология // А. В. Караулов // Медицинское информационное агенство. – Москва. - 1999. – 650 с.
- Lorimore, S. A. Inflammatory-type responses after exposure to ionizing radiation in vivo: a mechanism for radiation-induced bystander effects?[Text] / S. A. Lorimore, P. J. Coates, G. E. Scobie, G. Milne, E. G. Wright // Oncogene. – 2001. –V. 20. – P. 7085 – 7095
- Zheng, L. TLR9 engagement on CD4 T lymphocytes represses -radiation–induced apoptosis through activation of checkpoint kinase response elements [Text] / L. Zheng, N. Asprodites, A. H. Keene, P. Rodriguez et al. // Blood. -2008. – V. 111. - № 5. –P. 2704 - 2713
- Tsukimoto, M. Low-dose gamma-ray irradiation induces translocation of Nrf2 into nuclear in mouse macrophage RAW264.7 cells [Text] / M. Tsukimoto, N. Tamaishi, T. Homma, S. Kojima // J. Radiat. Res. -2010. –V. 51. – P. 349–353
- Гусев, Е. Ю. Системное воспаление с позиции теории типового патологического процесса [Текст] / Е. Ю. Гусев, В.А. Черешнев, Л.Н. Юрченко // Цитокины и воспаление. – 2007. – Т. 6. - № 4. – С. 9-21
- Tedder, T. F. Innate and adaptive receptors interact to balance humoral immunity [Text] / T. F. Tedder // J. Immunol. – 2010. – V. 184. – P. 2231-2232
- Sirisingha, S. Insight into the mechanisms regulating immune homeostasis in health and disease [Text] / S. Sirisingha // Asian Pac. J. Allergy Immunol. – 2011. – V. 29. – P. 1-14
- Новиков В.С. Иммунофизиология экстремальных состояний / В. С. Новиков, В. С. Смирнов // СПб: Наука, - 1995. - 172 с.
- Schklovskaya, E. Severely impaired clonal deletion of CD4+ T cells in low-dose irradiated mice: role of T cell antigen receptor and IL-7 receptor signals [Text] / E. Schklovskaya, B. F. de St. Groth // The Journal of Immunology. – 2006. – V. 177. – P. 8320–8330
- Hernandez, J. B. Life and death in the thymus – cell death signaling during T cell development [Text] / J. B. Hernandez, R. H. Newton, C. M. Walsh // Curr Opin Cell Biol. – 2010. – V. 22. - № 6. – P. 865–871
- Смирнов В.С. Вторичные иммунодефицитные состояния и их коррекция при промышленных катастрофах и стихийных бедствиях: Автореф. дисс. докт. мед. наук. СПб, 1992. 38 с.
- Kiyohara, H. Radiation-induced ICAM-1 Expression via TGF-1 Pathway onHuman Umbilical Vein Endothelial Cells; Comparisonbetween X-ray and Carbon-ion Beam Irradiation / H. Kiyohara,Y. Ishizaki, Y. Suzuki, H. Katoh, N. Hamada, T. Ohno, T. Takahashi, Y. Kobayashi, T. Nakano // J. Radiat. Res. – 2011. – Vol. 52. - 287–292
- Yoshimura A. GF- function in immune suppression / A. Yoshimura, G. Muto // T. Curr. Top Microbiol. Immunol. – 2011. – Vol. 350. – P. 127–147. [PubMed: 20680806]
- Kaser A. Inflammatory bowel disease / A. Kaser A, S. Zeissig, R. S. Blumberg // Annu. Rev. Immunol. – 2010. – Vol. 28. – P. 573–621. [PubMed: 20192811]
- Mi S. Blocking IL-17A promotes the resolution of pulmonary inflammation and fibrosis via TGF-1-dependent and -independent mechanisms / S. Mi, Z. Li, H. Z. Yang, H. Liu, J. P. Wang, Y. G. Ma, X. X. Wang, H. Z. Liu, W. Sun, Z. W. Hu // J. Immunol. – 2011. – Vol. 187. – P. 3003–3014. [PubMed: 21841134]
- Hamsa, T. Interleukin 12 a key immunoregulatory cytokine in infection applications [Text] / T. Hamsa, J. B. Barnett, Bingyun Li // Int. J. Mol. Sci. – 2010 – V. 11. – P. 789-806;
- Croxford, A. L. Cytokine reporter mice in immunological research: perspectives and lessons learned [Text] / A. L. Croxford, T. Buch // Immunology. – 2010. – V. 132. – P. 1–8
- Hu, X. Cross-regulation of Signaling and Immune Responses by IFN- and STAT1 [Text] / X. Hu, L. B. Ivashkiv // Immunity. – 2009. – V. 31. - № 4. – P. 539–550
- Acosta-Iborra, B. Macrophage Oxygen Sensing Modulates Antigen Presentation and Phagocytic Functions Involving IFN- Production through the HIF-1 Transcription Factor [Text] / B. Acosta-Iborra, A. Elorza, I. M. Olazabal et al. // The Journal of Immunology. – 2009. – P. 182. – P. 3155–3164.
- Flohe, S. B. Diversity of Interferon and Granulocyte-Macrophage Colony-Stimulating Factor in Restoring Immune Dysfunction of Dendritic Cells and Macrophages During Polymicrobial Sepsis [Text] / S. B. Floh, H. Agrawal, S. Floh // Mol Med. – 2008. – V. 14. - № 5 – 6. –P. 247 - 256
- Shenoy, A. R. Emerging themes in IFN--induced macrophage immunity by the p47 and p65 GTPase Families [Text] / A. R. Shenoy, B.-H. Kim, H.-P. Choi et al. // Immunobiology. – 2007. – V. 212. – № 9-10. – P. 771–784
- Климко Н. Н. Диагностика и лечение кандидемии и острого диссеминированного кандидоза [Електронний ресурс] / Н. Н. Климко // Инфекции и антимикробная терапія. – 2002. – Том 4, № 1. – режим доступу http://www.consilium-medicum.com/article/8012.
- McCallum, D. M. Massive induction of innate immuneresponse to Candida albicans in the kidney in a murine intravenous challenge model [Text] / D. M. McCallum // FEMS Yeast Res. – 2009. - V. 9. – P. 1111–1122
- MacCallum, D.M. Hosting Infection: ExperimentalModels to Assay Candida Virulence [Електронний ресурс] / D. M. MacCallum // International Journal of Microbiology. – 2012. – V. 2012. - Article ID 363764. – P.12.
- Bonifazi, P. Balancing inflammation and tolerance in vivo through dendritic cells by the commensal Candida albicans [Text] // P. Bonifazi, T. Zelante, C. D’Angelo, A. De Luca et al. // Mucosal immunology. – 2009. – V. 2 - № 4. – P. 362- 374
- Heinsbroek, S. E. M. Stage-specific sampling by pattern recognition receptors during Candida albicans phagocytosis [Електронний ресурс] / S. E. M. Heinsbroek, P. R. Taylor, F. O. Martinez, L. Martinez-Pomares et al. // PLoS Pathogens. – 2008. - V. 4. – Issue 11. – P.e1000218. Режим доступу до журналу: www.plospathogens.org
- Camargo, M. R. Modulation of macrophage cytokine profiles during solid tumor progression: susceptibility to Candida albicans infection [Text] / M. R. Camargo, J. Venturini, F. R. Vilani-Moreno, M. S. P. Arruda // BMC Infectious Diseases. – 2009. - V 9. – P. 98 - 106
- Cheng, S. – S. Candida albicans dampens host defense by downregulating IL-17 production [Text] / S.-S. Cheng. – F. van de Veerdonk, S. Smeekens, L. A. B. Joosten et al. // The Journal of Immunology. – 2010. – V. 185. – P. 2450–2457
- Curtis, M. M. Interleukin-17 in host defence against bacterial, mycobacterial and fungal pathogens [Text] / M. M. Curtis, S. S. Way // Immunology. – 2009. – V. 126. – P. 177-185
- De Luca, A. Functional yet Balanced Reactivity to Candida albicans Requires TRIF, MyD88, and IDO-Dependent Inhibition of Rorc / A. De Luca, C. Montagnoli, T. Zelante, P. Bonifazi, S. Bozza, S. Moretti, C. D’Angelo, C. Vacca, L. Boon, F. Bistoni, P. Puccetti, F. Fallarino, L. Romani // The Journal of Immunology, 2007, 179: 5999 – 6008
- Eyerich K. Patients with chronic mucocutaneous candidiasis exhibit reduced production of Th17-associated cytokines IL-17 and IL-22 [Text] / K. Eyerich, S. Foerster, S. Rombold, H.-P. Seidl et al. // Journal of Investigative Dermatology –2008. – V. 128. – P. 2640–2645
- Fei M. – J. TNF- from inflammatory dendritic cells (DCs) regulates lung IL-17A/IL-5 levels and neutrophilia versus eosinophilia during persistent fungal infection [Text] / M. – J. Fei, S. Bhatiaa, T. B. Orissa, M. Yarlagaddaa et al. // PNAS. – 2011. – V. 108. - № 13. – P. 5360-5365
- Freitas, A. IL-17 receptor signaling is required to control polymicrobial sepsis [Text] / A. Freitas, J. C. Alves-Filho, T. Victoni, T. Secher et al. // The Journal of Immunology. – 2009. – V. 182. – P. 7846–7854.
- Hu, X. Regulation of IFN and TLR signaling during macrophage activation by opposing feedforward and feedback inhibition mechanisms [Text] / X. Hu, S. D. Chakravarty, L. B. Ivashkiv // Immunol. Rev. – 2008. – V. 226. – P. 41–56.
- Han, S. K. Gamma irradiation-reduced IFN- expression, STAT1 signals, cell-mediated immunity [Text] / S. –K. Han, J.-Y. Song, Y.-S. Yun, S.-Y. Yi // Journal of Biochemistry and Molecular Biology. – 2002. - V. 35. - № 6. – P. 583-589
- Лавлинский А.Д. Циклоферон в клинической онкологии (реферативный сборник) / А. Д. Лавлинский // СПб., - 2009. — 52 с.
- Ершов Ф.И. Циклоферон. Клиническая фармакология и терапия: Руководство для врачей / Ф. И. Ершов, А. Л. Коваленко, М. Г. Романцов, С. Ю. Голубев // М.; СПб., 1998. - 109 с. - ISBN 5-88874043.
- Moffet, J. R. Tryptophan and the immune response [Text] / J. R. Moffet, M. A. Namboodri // Immunology and Cell Biology. – 2003. – V. 81. – P. 247–265
- Mellor, A. L. Tryptophan catabolism and regulation of adaptive immunity [Text] / A. L. Mellor, D. H. Munn // The Journal of immunology. – 2003. – V. 170. – P. 5809-58113.

