Корневые и прикорневые гнили плодовых и ягодных культур, диагностика и меры борьбы
На правах рукописи
Головин Сергей Евгеньевич
Корневые и прикорневые гнили плодовых и ягодных культур, диагностика и меры борьбы
Специальность: 06.01.07 – защита растений
Автореферат
диссертации на соискание ученой степени
доктора сельскохозяйственных наук
МОСКВА – 2010
Работа выполнена в Государственном научном учреждении
Всероссийский селекционно-технологический институт
садоводства и питомниководства Россельхозакадемии
Официальные оппоненты: доктор сельскохозяйственных наук, профессор
Белошапкина Ольга Олеговна
доктор сельскохозяйственных наук
Каширская Наталья Яковлевна
доктор сельскохозяйственных наук, профессор
Атрощенко Геннадий Парфёнович
Ведущая организация - Государственное научное учреждение Всероссийский научно-исследовательский институт генетики и селекции плодовых растений им. И.В. Мичурина Россельхозакадемии
Защита диссертации состоится «23» декабря 2010 г. в 13 часов на заседании диссертационного совета Д 006.035.01 при ГНУ Всероссийский селекционно-технологический институт садоводства и питомниководства Россельхозакадемии, по адресу: 115598, г. Москва, ул. Загорьевская, 4, e-mail: [email protected]
С диссертацией можно ознакомиться в библиотеке ГНУ ВСТИСП Россельхозакадемии
Автореферат разослан и выставлен на сайте ВАК РФ « » 2010 г.
Ученый секретарь
диссертационного совета, кандидат
сельскохозяйственных наук Марченко Людмила Александровна
ВВЕДЕНИЕ
Актуальность темы. Корневые и прикорневые гнили плодовых и ягодных культур до настоящего времени в России являлись наименее исследованными болезнями, поражающими садовые культуры. Это было связано со сложностью их идентификации, отсутствием простых и надежных методов диагностики. Эти болезни наносят существенный ущерб при выращивании посадочного материала, а также могут вызывать выпады на промышленных плантациях, особенно это характерно для земляники и малины. Так выпады зеленых черенков плодовых и ягодных культур от этих патогенов, при их укоренении в теплице, могут достигать 70-80% [Метлицкий, Головин, 1989; Головин, 1994]. Выпады сеянцев плодовых культур в условиях Нечерноземной полосы в отдельные годы достигали 40-50% в условиях открытого грунта, а при выращивании в условиях теплицы – 60-80% [Головин, 1992]. Последние наиболее полные исследования в этом направлении проводились, в основном, на ягодных культурах еще в Советском Союзе [Барбатунова, 1986; Головин, 1990]. Значение этих болезней для плодовых культур в Российской Федерации серьезно не изучалось с 1970-х годов.
Широкая и не контролируемая интродукция декоративных и садовых растений из-за рубежа, имевшая место в 90-х годах XX века, создала возможность завоза новых патогенных видов и расс почвенных микромицетов, ранее не встречавшихся на территории России [Метлицкий и др., 2001]. В связи с этим, возникла необходимость всестороннего мониторинга фитосанитарной ситуации, сложившейся в отечественном садоводстве к началу XXI века. Особенно это касается таких трудно диагностируемых патогенов, как почвенные микромицеты.
Слабая изученность распространенности возбудителей корневых и прикорневых гнилей и их значения для плодовых и ягодных культур в современных условиях России, также не позволяли разработать эффективные системы защиты в борьбе с этими болезнями.
К началу наших исследований были крайне не полно разработаны методы профилактики и защиты в питомниководстве и в промышленных насаждениях плодовых и ягодных культур. Также не было определено значение отдельных возбудителей корневых и прикорневых гнилей для ряда культур, особенно для плодовых.
Цель и задачи исследований. Целью исследований стало изучение видового состава почвенных микромицетов, связанных с корневыми гнилями плодовых и ягодных культур, и научное обоснование и разработка мер борьбы с корневыми и прикорневыми гнилями основных плодовых и ягодных культур в средней полосе России.
В задачи исследований входило:
1. Уточнить видовой состав, распространенность и элементы биоэкологии микромицетов – возбудителей корневых и прикорневых гнилей основных плодовых и ягодных культур.
2. Обобщить и уточнить фитосанитарную значимость и вредоносность микромицетов – основных возбудителей корневых и прикорневых гнилей плодовых и ягодных культур.
3. Отработать применительно к местным условиям методы обнаружения микромицетов – возбудителей корневых и прикорневых гнилей основных плодовых и ягодных культур.
4. Обосновать и разработать концепцию изменения патогенеза почвенных микромицетов на плодовых и ягодных растениях в условиях агроценозов.
5. Обосновать и разработать основные элементы системы защиты плодовых и ягодных культур от корневых и прикорневых гнилей.
Новизна исследований
Впервые в России изучен комплекс почвенных микромицетов – возбудителей корневых и прикорневых гнилей плодовых и ягодных растений. Определены основные патогенные виды, поражающие эти культуры на разных стадиях их выращивания и размножения. Наиболее полно изучен видовой состав почвенных микромицетов на землянике садовой, на которой идентифицировано 52 вида, 10 из них ранее не были зарегистрированы на этой культуре, на территории РФ.
Выявлен ранее не встречавшийся в России возбудитель корневой гнили малины красной оомицет Phytophthora fragariae Hickman var. rubi Wilcox & Duncan, разработаны оригинальные методы его диагностики в растениях и почве, превосходящие по оперативности зарубежные аналоги, рассчитаны уравнения регрессионного прогноза развития фитофторозной корневой гнили. Определены факторы, препятствующие распространению этой болезни в условиях средней полосы России.
Впервые для условий России в насаждениях малины красной выявлен комплекс фитофторовых оомицетов (Phytophthora nicotianae, Ph. citricola, Ph. cactorum, Phytophthora sp.), встречающийся в том или ином видовом соотношении в насаждениях малины средней полосы России и Кабардино-Балкарии.
Установлено снижение вредоносности фитофтороза рожков земляники, связанное в основном со сменой сортимента этой культуры.
Выявлено возрастание вредоносности ризоктониозной корневой и прикорневой гнилей на землянике, а также и на плодовых культурах в первых полях питомника.
Выявлена взаимосвязь между развитием корневых гнилей в питомнике и заражением почвенно-патогенными микромицетами корнесобственных подвоев и сортов косточковых культур в теплице.
Разработаны схемы диагностики основных возбудителей корневых и прикорневых гнилей плодовых и ягодных растений. Разработан метод «модельных черенков» для диагностики зараженности почвы микромицетами – возбудителями гнилей зеленых черенков плодовых и ягодных культур при укоренении их в теплице. На основе этого метода рассчитаны регрессионные уравнения прогноза потерь зеленых черенков крыжовника и косточковых культур от микозных гнилей при укоренении их в условиях теплицы.
Разработана и обоснована концепция изменения патогенеза почвенных микромицетов на плодовых и ягодных культурах в условиях агроценозов, которая основывается на утверждении, что на патогенез почвенных микромицетов оказывают влияние три основных фактора: почвенно-климатический, биологический и антропогенный. Влияние этих факторов может выражаться, как стимулирующем, так и лимитирующем воздействие на патогенез возбудителей корневых и прикорневых гнилей плодовых и ягодных культур.
Разработан эффективный способ защиты от микозных гнилей зеленых черенков косточковых культур при их укоренении в пленочной теплице, с использованием в качестве налипателя для фунгицидов водоэмульсионной краски. Производственное испытание данного метода, примененного совместно с разработанной нами схемой защиты, показало его эффективность, проявившуюся в снижении развития гнилей и повышении укореняемости черенков вишни и сливы в 2-2,5 раза, при увеличении доли выхода стандартных саженцев в 1,5 – 3 раза.
Научно обоснованы и разработаны схемы защитных мероприятий при получении посадочного материала плодовых культур различными методами, направленные против корневых и прикорневых гнилей.
Научно обоснованы и разработаны схемы защитных мероприятий против корневых и прикорневых гнилей, при размножении и выращивании земляники и малины.
Основные положения выносимые на защиту:
- Видовой состав почвенных микромицетов – возбудителей корневых и прикорневых гнилей плодовых и ягодных культур, их распространенность и вредоносность.
- Биологическая и экономическая значимость на плодовых и ягодных культурах наиболее распространенных и вредоносных почвенных микромицетов.
- Научно-обоснованная система мониторинга основных почвенных микромицетов, включающая в себя упрощенные и доступные методы диагностики и элементы прогноза.
- Концепция изменения патогенеза почвенных микромицетов на плодовых и ягодных растениях в условиях агроценозов.
- Научно-обоснованная система защитных мероприятий, направленная против возбудителей корневых и прикорневых гнилей в насаждениях плодовых и ягодных культур.
Практическая ценность работы. Выявлен видовой состав, распространенность и вредоносность основных почвенных микромицетов, связанных с корневыми и прикорневыми гнилями плодовых и ягодных культур. Предложена усовершенствованная система мониторинга основных почвенных микромицетов – возбудителей корневых и прикорневых гнилей.
Разработаны простые и доступные методы диагностики почвы на зараженность основными почвенными микромицетами, ассоциирующимися с корневыми и прикорневыми гнилями плодовых и ягодных культур. В том числе, разработан метод диагностики корней и прикорневой почвы малины красной на зараженность карантинным объектом оомицетом Phytophthora fragariae var. rubi, который отличается простотой и экономичностью, а также оперативностью по сравнению с аналогичной зарубежной методикой. Предложенная методика для диагностики данного патогена требует в 3 раза меньше затрат на проведение теста, а также в 4-5 раз оперативней, чем зарубежная аналогичная методика.
Предложена методика прогноза потерь от микозных гнилей зеленых черенков плодовых и ягодных культур от микозных гнилей при укоренении их в грунтовых теплицах в условиях исскуственного тумана, рассчитаны уравнения регрессионного прогноза как общие для нескольких культур, так и индивидуальные для вишни и сливы.
Предложена методика регрессионного прогноза развития фитофторозной корневой гнили малины красной с учетом суммы осадков за апрель май и июнь, точность прогноза составляет 80-88%, в зависимости от используемого уравнения.
Разработан эффективный способ защиты от микозных гнилей зеленых черенков косточковых культур при их укоренении в пленочной теплице, который снижает развитие гнилей и повышает укореняемость черенков вишни и сливы в 2-2,5 раза, при увеличении доли выхода стандартных саженцев в 1,5 – 3 раза.
Разработаны схемы защитных мероприятий в борьбе с корневыми и прикорневыми гнилями плодовых и ягодных культур на разных этапах их выращивания.
Результаты проведенных исследований использованы при составлении 4-х методических указаний (25, 26, 28, 31) по диагностике, прогнозу и борьбе с корневыми и прикорневыми гнилями плодовых и ягодных культур.
Личный вклад автора. Постановка проблемы, цель и задачи исследований и её методологии, экспериментальные работы, анализ и обобщение полученных результатов выполненных автором лично. Отдельные разделы диссертации выполнены в сотрудничестве (доля участия автора не менее 75%) с с.н.с. Т.И. Романченко (ГНУ ВСТИСП) (исследования корневых и прикорневых гнилей плодовых культур в питомниках открытого грунта в 2003-2007 гг.) и с с.н.с. А.Ю. Павловой, н.с. Н.Ю. Джурой (ГНУ ВСТИСП) (испытание средств борьбы с микозными гнилями зеленых черенков плодовых и ягодных культур при их укоренении в теплице в 1992-2008).
Апробация работы. Основные положения диссертации доложены на научно практических и международных конференциях: Регуляторы роста и развития растений (Москва, 1991); Актуальные проблемы развития питомниководства и научное обеспечение отрасли (Москва, 1991); Контроль фитосанитарного состояния сельскохозяйственных культур (Москва, 1994); Паразитарное загрязнение мегаполиса Москвы (Москва, 1994); Регуляторы роста и развития растений (Москва, 1995); Молодые ученые садоводству России (Москва, 1995); Всероссийский съезд по защите растений. Защита растений в условиях реформирования АПК (Санкт Петербург, 1995); Актуальные вопросы теории и практики защиты плодовых и ягодных культур от вредных организмов в условиях многоукладного сельского хозяйства (Москва, 1996); Теория и практика борьбы с паразитарными болезнями (Москва, 1999); Промышленное производство оздоровленного материала плодовых, ягодных и цветочно-декоративных культур (Москва, 2001); 2-й Всероссийский Съезд по защите растений “Фитосанитарное оздоровление агроэкосистем” (Санкт-Петербург, 2005); Мониторинг и методика исследований в садоводстве в нестабильных экологических условиях (Москва, 2005); Методические аспекты создания прецизионных технологий возделывания плодовых культур и винограда (Краснодар, 2006); Инновационные направления в питомниководстве плодовых культур (Москва, 2007); Инновационные подходы к обеспечению стабильной продуктивности косточковых культур (Москва, 2008); Методы изучения продукционного процесса растений и фитоценозов (Нальчик, 2009); Инновационные направления в селекции и возделывании ягодных культур (Брянск – Кокино, 2009); Инновационные направления и проблемы в защите садовых культур от вредных организмов на современном этапе (Москва, 2010).
Публикации. По теме диссертации опубликовано 47 печатных работы, из них 17 в рецензируемых научных журналах, одна монография и четыре методических указания (три в соавторстве).
Объём и структура диссертации. Диссертационная работа состоит из введения, 8 глав (64 разделов), выводов и рекомендаций производству, списка использованных источников и 9 приложений.
Материалы диссертации изложены на 412 страницах машинописного текста, содержит 104 таблицы, 29 рисунков, список использованных источников включает 649 наименований, из которых 489 – зарубежная литература.
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
В данной главе рассмотрены краткая история, состояние изученности почвенно-патогенных микромицетов – возбудителей корневых и прикорневых гнилей плодовых и ягодных культур в России и других странах. Уточнены особенности развития и вредоносности наиболее опасных видов почвенных микромицетов в агробиоценозах земляники, малины, смородины и крыжовника, а также семечковых и косточковых культур.
На основе мировой и отечественной литературы проанализированы сведения по методам диагностики почвы и растений на зараженность почвенно-патогенными микромицетами, дана оценка преимуществ и недостатков тех или иных методов.
На основе мировой и отечественной литературы приведены сведения о современных путях и принципах защитных мероприятий по борьбе с корневыми и прикорневыми гнилями плодовых и ягодных культур.
Сформулированные во введении цель и задачи настоящей работы были выбраны в свете необходимости научно-практического решения рассмотренных выше проблем защиты плодовых и ягодных культур от корневых и прикорневых гнилей.
ГЛАВА 2. МАТЕРИАЛЫ УСЛОВИЯ И МЕТОДЫ ИССЛЕДОВАНИЙ
Объекты, материалы и условия исследований. Настоящие исследования проведены в 1990 – 2008 годы в ГНУ ВСТИСП Россельхозакадемии. Для сравнительного анализа видового состава почвенных микромицетов на землянике садовой по годам, использовали также данные, полученные автором ранее в 1984-1989 гг. Некоторые эксперименты были выполнены в АОЗТ «Совхоз им. Ленина» Московской области. Обследования проведены в 21 хозяйстве Московской, Рязанской, Тульской, Нижегородской, Пермской, Кировской областей, а также Чувашской и Мордовской республик. Кроме того, проводились микологические анализы растительных и почвенных образцов из Вологодского и Кокинского опорных пунктов ГНУ ВСТИСП (соответственно Вологодской и Брянской областей), экспериментальных хозяйств Орловской, Самарской, Воронежской и Ленинградской областей, а также анализировали растительные и почвенные образцы из Калужской, Липецкой, Белгородской областей, Башкирской, Кабардино-Балкарской, Адыгейской республик, а также из Беларуси, Украины, Литвы, Польши и Германии.
Основными объектами исследований были почвенные микромицеты: грибы из родов Fusarium, Cylindrocarpon, Rhizoctonia, Alternaria, Cladosporium, Phoma, Coniothyrium, Verticillium, Pestalotia, Pyrenochaeta, Phomopsis и некоторые другие, а также псевдогрибы в основном из родов Pythium и Phytophthora. Кроме того, наблюдения проведены на 50 сортах земляники садовой (Fragaria ananassa Duch.), 30 сортах малины красной (Rubus idaeus L.), 5 сортах крыжовника (Glossularia reclinata [L] Nill.), 10 сортах и подвоях вишни (Cerasus vulgaris Mill.), 6 сортов и подвоев сливы (Prunus domestica L.), 2 подвоя черешни (Cerasus avium), 25 сортов и подвоев яблони (Malus domestica L.), 6 сортов и подвоев груши (Pirus communis L.).
В борьбе с корневыми и прикорневыми гнилями испытано 14 синтетических фунгицидов и 7 биопрепаратов (4 - на основе антагонистической бактерии Pseudomonas fluorescens (штаммы и Агат 25К); препарат Симбионт 1 – на основе ризосферной микофлоры женьшеня из актиномицета Actinomyces lavendulae [Гельцер, 1990]; препарат Кетомиум, содержащий хламидоспоры гриба Chaethomium sp. (Таиланд); препарат Микофунгицид на основе гриба Trichoderma viride (фирма БиО – БИС, Россия).
Методы проведения наблюдений и экспериментов. Видовой состав почвенных микромицетов, распространенность, вредоносность изучали в соответствии с методами, имеющимися в литературе (Кирай и др., 1974; Метлицкий и др., 1975; Пристансков, 1982; Поляков, Эберт, 1983). Для выделения фитопатогенных микромицетов из растений и почвы использовали методики следующих авторов (Наумов, 1937; Nadakavukaren, Horner, 1959; Flowers, Hendrix, 1969; Herr, 1973; Mc Intosh, 1975; Maas, 1976; Tsao, Guy, 1977; Билай, 1977; Степанова, Сидорова, 1981; George, Milholland, 1986). Для выделения некоторых микромицетов из почвы использовали ряд методик, разработанных автором (3, 13, 16, 25).
Опыты по подбору биоприманок для выделения видов из рода Phytophthora закладывали в лабораторных условиях при температуре 16-18°С. В качестве биоприманок испытывали черешки листьев и листья сортов и сеянцев малины красной (Rubus idaei L.), малинно-ежевичных гибридов Тайберри и Логанберри, ежевики сортов Агавам и Смутсен, малины черной (Rubus occidentalis), малины душистой (Rubus odoratus), лесной земляники (Fragariae vesca L.) клон Альпина, земляники садовой (Fragaria ananassa Duch.), а также зеленые черенки золотистой смородины, крыжовника и чубушника. Каждый вариант включал три повторности, повторность - чашка Петри по шесть листьев или 10 черешков (черенков) на чашку, или 500 мл банку.
Патогенность выделенных чистых культур некоторых микромицетов проверяли на двухнедельных сеянцах земляники сорта Фестивальная от свободного опыления. Повторность в опытах 4-5-кратная, контейнер с пятью сеянцами - повторность. Для тестирования на патогенность видов Phytophthora на малине использовали трехнедельные сеянцы малины, выращенные в стерильном субстрате в условиях зимней теплицы.
Лабораторные, полевые (мелкоделяночные) и производственные испытания различных способов защиты плодовых и ягодных культур от корневых и прикорневых гнилей проводили в соответствие с методикой опытного дела (Пирс, 1969; Литтл, Хиллз, 1981; Доспехов, 1985).
Опыты по испытанию эффективности фунгицидов и биопрепаратах на зеленых черенках крыжовника и косточковых культур были трех- и четырехфакторными. Опыты по испытанию эффективности фунгицидов и биопрепаратах на малине и в питомнике плодовых культур были трехфакторными.
Опыты по борьбе с микозными гнилями укореняемых зеленых черенков крыжовника проводили в период с 1990-1994 годов. В опытах использовали сорта крыжовника Русский, Колобок, Садко. В качестве защитных средств в опытах были использованы фунгициды Фундазол 50 % СП, Спортак 45 % ЭК, Ронилан 60 % СП, Топаз К 62,5 % СП, Атеми С 88 % ВГ, Панч 25 % КЭ, а также биологические препараты штаммы антагонистической бактерии Pseudomonas fluorescens и препарат Симбионт 1.
Для обработки зеленых черенков крыжовника фунгицидами применяли три способа внесения препаратов:
1) предпосадочное замачивание нижней части черенков в растворах фунгицидов с экспозицией 15, 30 и 45 минут;
2) пропитка почвы с нормой расхода 5 л/м;
3) опрыскивание маточных кустов фунгицидами за 14 дней до срезки черенков.
Все опыты закладывались в 4-х кратной повторности, по 15-20 черенков в каждой повторности.
За период с 2001 по 2007 г. было проведено шесть мелкоделяночных опытов по разработке мер борьбы с микозными гнилями зеленых черенков косточковых культур при их укоренении в пленочной теплицы в условиях исскуственного тумана. В опытах использовались зеленые черенки подвоя вишни Измайловский (ПН), черешневых подвоев ЛЦ-52 и Колт, сорта сливы Евразия - 21 и Скороспелка красная. В производственном опыте использовали зеленые черенки вишни сортов Ардатовская, Владимировская, Светлая, вишневого подвоя Измайловский (ПН), и сорт сливы Скороспелка красная.
Эксперименты по защите подвоев яблони при высадке их в первое поле питомника были заложены в производственных условиях в 2004 и 2006 годах. Для защиты подвоев яблони от корневых гнилей в первом поле питомника применяли два фунгицида Фундазол 50 % СП и Ридомил голд МЦ СП, добавляемые в глиняную болтушку в концентрации 0,2%. Ридомил голд МЦ применялся только совместно с Фундазолом. Повторность опытов 5-и кратная (делянка – повторность, по 30 растений в каждой).
В опытах по борьбе с корневыми гнилями малины красной испытывались фунгициды: Акробат МЦ 69 % СП, Гальбен 80 % СП, Ридомил 25 % СП и Сандофан М 67 % СП в концентрации 0,1 и 0,2 % по препарату. Фунгициды вносили вручную, методом пропитки прикорневой почвы под растениями малины, с нормой расхода 250 мл рабочего раствора на растение. Опыты заложены в 4-х кратной повторности, по 15 - 25 растений в каждой повторности. Учеты поражения растений малины фитофторозной корневой гнилью проводили через два месяца после внесения фунгицидов по шести бальной шкале В. Вашингтона [Washington, 1988]. Дополнительным фактором в некоторых опытах являлся микрорельеф участка, опытные делянки размещались, как в понижениях, так и на повышениях рельефа.
Для борьбы с фитофторозной корневой гнилью малины в 2000 г. был испытан препарат АгроХит в полевых условиях на лабораторном участке ГНУ ВСТИСП. Для закладки опыта использовали саженцы малины восприимчивых сортов Лазаревская (85 %) и Алый парус (15 %). Перед посадкой саженцы погружали на 30 минут в растворы 1% АгроХита или 0,2% Акробата МЦ. Повторность опыта 4-х кратная, по 8 растений в каждой повторности.
Лабораторная и статистическая обработки опытных данных, расчеты эффективности защитных мероприятий. Определение изолятов грибов и псевдогрибов до рода и далее проводилось по определителям: Литвинов, 1967; Waterhouse, 1968, 1970; Gilman, 1975; Билай,1977; Пидопличко, 1977; Ribeiro, 1978; Филиппов и др., 1980; Krober, 1985.
Степень развития болезней рассчитывали по общепринятой формуле [Степанов, Чумаков, 1972], биологическую эффективность обработок рассчитывали по формуле Эбота (Unterstehnhofer, 1964), хозяйственную и с использованием данных бухгалтерского учета хозяйств и при консультации с сотрудниками отдела экономики ГНУ ВСТИСП Россельхозакадемии.
Статистическую обработку полученных данных проводили с использованием угловой трансформации и множественного t – критерия Дункана, а также с помощью корреляционного анализа (Доспехов, 1978; Литтл, Хиллз, 1981). Расчет формул регрессионного прогноза проводили по методике В.А. Захаренко и др. (2001). Статистическую обработку большинства полученных данных проводили с помощью компьютерных программ в среде Excel.
Глава 3. Анализ видового состава, распространенности и вредоносности микромицетов, связанных с поражением корневыми и прикорневыми гнилями плодовых и ягодных культур
3.1. Видовой состав микромицетов, связанных с корневыми и прикорневыми гнилями земляники садовой, их распространенность и вредоносность
Земляника садовая является наиболее чувствительной культурой к поражению почвенными микромицетами – возбудителями корневых и прикорневых гнилей, как в России, так и по всему миру, где возделывается эта культура. В связи с этим, в течение более чем 20 лет нами проводились исследования по выявлению причин возникновения этих заболеваний, определению возбудителей, их вредоносности и распространенности.
Из растений земляники, пораженных корневыми и прикорневыми гнилями наиболее часто выделялись такие микромицеты: возбудитель гнили рожков земляники - оомицет Phytophthora cactorum (Lebert et Cohn) Schroet., грибы Rhizoctonia solani Khn и Cylindrocarpon destructans (Zins.) Sholten, виды из родов Pythium, Fusarium. Следует отметить, что грибы рода Verticillium, в частности, гриб V. albo-atrum Reinke et Berth., считавшиеся основными возбудителями увядания земляники в СССР в 70-х годах прошлого века [Пристансков, 1971; Константинова, 1974; Метлина, Попова, 1975], выделяли из больных растений очень редко и нерегулярно, средняя частота выделения 0,7 %, против 33,2 % для Phytophthora cactorum и 37,6 % для Rhizoctonia solani.
В таблице 1 представлены выделенные виды и роды микромицетов, которые упоминались другими исследователями, как возбудители корневых и прикорневых гнилей земляники или как ассоциирующиеся с этими болезнями. Так, род Pythium представлен 10 видами, выделявшихся из больных растений земляники и прикорневой почвы. Наиболее часто из некротизированных участков корней выделялись P. ultimum (1,6 %), и P. irregulare (1,3 %), реже виды P. proliferum (0,32 %) и P. intermedium (0,53 %). Вид P. mamillatum (0,32 %) чаще выделялся из черешков листьев. Некоторые виды, такие как P. dissotocum, P. vanterpoolii, P. monospermum, отмечены только в прикорневой почве земляники, тогда как из растений выделены не были.
Грибы из рода Fusarium были представлены, в основном, семью видами. Наиболее часто из больных растений выделялись виды F. sambucinum (1,6 %) и F. oxysporum (0,79 %), реже F. solani (0,51 %) и F. gibbossum (0,35 %), другие виды отмечались значительно реже.
Таблица 1. Частота встречаемости видов микромицетов, ассоциирующихся с корневыми и прикорневыми гнилями земляники садовой в Московской области (1984-2007 гг.)
| Виды микромицетов | Частота встречаемости, % | |
| растения | почва | |
| Phytophthora cactorum(Lebert et Cohn) Schroet. | 33,2 | 46,7 |
| Phytophthora spp.de Bary | 2,4 | 3,5 |
| Ph. nicotianae van Breda de Haan | 0,3 | 1,1 |
| Ph. citricola Sawada | 0,9 | 1,5 |
| Ph. syringae (Kleb.)Klebahn | - | 0,2 |
| Rhizoctonia solani Khn | 37,6 | 33,9 |
| Rhizoctonia spp. D.C. | 0,2 | 0,7 |
| Cylindrocarpon destructans (Zins.) Sholten | 33,9 | 9,6 |
| Cylindrocarpon spp. Wr. | 4,8 | 4,9 |
| Pythium spp. Prigsheim | 17,9 | 28,5 |
| P.ultimum Trow | 1,6 | 6,5 |
| P. middletonii Sparrow, syn. :P. proliferum de Bary | 0,3 | 5,0 |
| P. salpingophorum Drechsler | 0,1 | 0,7 |
| P. intermedium de Bary | 0,5 | 1,4 |
| P. acanticum Drechsler | 0,1 | 0,1 |
| P. monospermum Prinsh. | - | 0,9 |
| P. irregulare Buisman | 1,3 | 1,4 |
| P. mamillatum Meurs | 0,3 | 0,3 |
| P. dissotocum Drechsler | - | 0,5 |
| P.vanterpoolii V. Kouy. et H. Kouy | - | 0,6 |
| Fusarium spp. Link. | 12,5 | 7,8 |
| F. oxysporum Schlecht. et Hans | 0,8 | - |
| F. gibbossum App. et Wr. | 0,4 | - |
| F. moniliforme Sheld. | 0,2 | 0,1 |
| F. lateritium Nees. et Hans | 0,2 | - |
| F. sambucinum Fuskel | 1,6 | 3,3 |
| F.solani (Mart.) App. et Wr. | 0,5 | 0,5 |
| F.avenaceum (Fr.) Sacc. | 0,1 | - |
| Verticillium spp. Nees | 0,7 | - |
| Pestalotia spp. de Not. | 1,7 | - |
| Botrytis cinerea Pers. | 1,8 | - |
| Hainesia lythri Ell. et Sacc. | 2,4 | - |
| Alternaria spp. Nees. | 3,2 | - |
| Colletotrichum spp. Sacc. | 0,8 | - |
| Zythia fragariae Laibach | 2,5 | - |
| Phoma spp. Fr. | 3,0 | - |
Также выделялись грибы Botrytis cinerea, Hainesia lythri, Zythia fragariae, Pestalotia spp., Colletotrichum spp., Alternaria spp., которые были чаще связаны с гнилью надземной части растений, вызывали некрозы и пятна на черешках листьев, цветоносах и усоплетях.
Изучая видовой состав микромицетов, ассоциирующихся с корневыми и прикорневыми гнилями земляники, мы проанализировали образцы из 15 областей и 4 республик в России, а также из Беларуси, Литвы, Украины и посадочный материал из Германии и Польши.
Оомицет Phytophthora cactorum отмечен на больных растениях земляники в девяти областях России и одной республике, в прикорневой почве в 11 областях, трех республиках РФ и в Литве. Таким образом, из 23 регионов выращивания земляники (областей, республик, стран) этот патоген был отмечен в образцах из 17 регионов.
Другим наиболее часто встречаемым грибом на землянике и в прикорневой почве был гриб Rhizoctonia solani, который был отмечен в 10 областях России, в трех республиках РФ, а также в образцах из четырех стран.
3.1.1. Симптомы проявления корневых и прикорневых гнилей
земляники и микромицеты, ассоциирующиеся с ними
Поражение земляники микромицетами – возбудителями корневых и прикорневых гнилей может проявляться несколькими типами симптомов. Это внезапное или постепенное увядание растений, так называемый «вилт» или скоротечная форма. Другой формой проявления симптомов поражения растений корневой гнилью может быть слабый рост или остановка в росте - «карликовость», так называемая хроническая форма. Такие симптомы могут вызывать различные возбудители корневых и прикорневых гнилей.
Фитофторозное увядание (гниль рожков). В большинстве случаев увядание растений земляники было вызвано заражением оомицетом Phytophthora cactorum, известным возбудителем гнили рожков земляники. Фитофтороз земляники во второй половине 80-х годов прошлого века наносил значительный ущерб этой культуре в Московской и других областях центральной России, как на плодоносящих плантациях, так и в маточниках [Барбатунова, 1986; Головин, 1990 а].
С середины 1990-х годов произошло снижение вредоносности фитофтороза земляники (возб. - Ph. cactorum) на территории России. Есть много гипотез о причине этого явления. Одной из основных причин снижения вредоносности фитофторозной гнили рожков явилась замена восприимчивых сортов на толерантные или устойчивые. Так, среди увядающих из-за поражения фитофторозной гнилью рожков растений земляники, встречаемость в анализируемых образцах сильно поражаемого сорта Фестивальная отмечали достаточно часто (до 1992 г. - 9 раз), а с 1997 по 2007 г. этот сорт упоминается всего один раз. К этому же времени из производственных насаждений исчезают такие поражаемые сорта, как Надежда, Заря, Дубровский Родник, Луч, Ранняя Махерауха и другие.
Поражение Ph. cactorum часто приводит к «скоротечному» увяданию растений земляники. В зависимости от сорта возможно различное проявление симптомов, либо более молодые листья в жаркие часы дня теряют тургор, восстанавливая его ночью (за несколько дней до полного увядания), либо наоборот, подвядают старые наружные листья растений. Через несколько дней увядает и сморщивается все растение.
Ризоктониозная гниль земляники. В процессе наших исследований мы наблюдали увядание растений земляники не связанное с поражением Ph. cactorum. У таких растений отсутствовали симптомы некроза рожка, но интенсивно развивалась гниль коры рожка и основания черешков листьев, причем в первую очередь некротизировались основания черешков внешних листьев, которые затем увядали, вследствие чего куст разваливался. Корни таких растений были либо слабо некротизированы в начальной стадии заболевания, либо были некротизированы в значительной степени и бурели при сильном поражении, которое приводило к гибели растений. Следует отметить, что в таких случаях некротизация корней часто начиналась от рожка.
Таблица 2. Распространенность увядания в маточнике земляники посадки 2006 года в результате поражения ризоктониозом (пос. Спасское, Ленинский р-н, Московской обл., август, 2007).
| Сорт | Увядание в среднем по сорту, % | Увядание в очагах, % | Выпады в очагах, % |
| Найдена добрая | 25-30 | 35-45 | 25-30 |
| Редгонтлет | 3-5 | 7-10 | 3-5 |
| Трибъют | 5-7 | 10-20 | 5-7 |
| Холидей | 2-3 | 7-10 | 3-5 |
| Красавица Загорья | 10-12 | 15-20 | 7-10 |
| Дукат | - | - | 3-5* |
| Зенга Зенгана | - | - | 3-5* |
| Кама | 5-7 | 10-15 | 5-7 |
| Царскосельская | 1-2 | - | 7-10* |
| Русич | 0,5-1 | - | 1-1,5* |
Примечание: * - выпады 2006 г.
Массовое проявление таких симптомов было отмечено в 2007 г. в июле на сортах: Найдена добрая, Трибъют, Красавица Загорья, Редгонтлет и др. В наибольшей степени увядание было отмечено на сорте Найдена добрая, в средней степени были поражены сорта Трибъют, Красавица Загорья, Кама, а сорта Редгонтлет и Холидей были поражены в слабой степени (табл. 2).
Микологический анализ увядающих растений земляники (табл. 3) показал, что из некротизированных оснований черешков листьев с высокой частотой (77,8-100%) выделялся гриб Rhizoctonia solani, этот гриб выделялся также из рожков и корней.
Таблица 3. Частота выделения (%) почвенных микромицетов из увядающих растений земляники в маточнике 2006 года закладки, пос. Спасское, Ленинского р-на, Московской обл., от 16.08.07
| Виды микромицетов | Найдена добрая | Трибъют | Красавица Загорья | ||||||
| Кор.* | Рож. | Череш. | Кор. | Рож. | Череш. | Кор. | Рож. | Череш. | |
| Rhizoctonia solani | 100 | 50,0 | 100 | 50,0 | 55,5 | 100 | 88,7 | 83,3 | 100 |
| Pythium spp. | 16,7 | 11,1 | 16,7 | 0 | 0 | 0 | 0 | 0 | 0 |
| P.ultimum | 0 | 0 | 0 | 50,0 | - | - | 77,8 | - | - |
| Cylindrocarpon spp. | - | 11,1 | - | - | 11,1 | 11,1 | 11,1 | - | - |
| C.destructans | 100 | 44,4 | 11,1 | 83,3 | 55,5 | - | 33,3 | 11,1 | 11,1 |
| C.album | - | 33,3 | - | 16,7 | - | - | 0 | 0 | 0 |
| Fusarium spp. (F.sambucinum F.avenaceum F.gibbossum v. | 33,3 | 77,8 | - | 16,7 | 22,2 | 50,0 | - | 16,7 | - |
| Alternaria tenuissima | - | - | 33,3 | 0 | 0 | 0 | - | - | 16,7 |
| Alternaria spp. | - | 11,1 | - | 0 | 0 | 0 | 0 | 0 | 0 |
| A.consortiale | 0 | 0 | 0 | 0 | 0 | 0 | 11,1 | - | - |
| Colletotrichum sp. | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Chalara sp. | 16,7 | 33,3 | 44,4 | 83,3 | 44,4 | 16,7 | - | 50,0 | - |
| Acremonium sp. | 0 | 0 | 0 | 0 | 0 | 0 | - | 16,7 | 16,7 |
| Phoma sp. | 0 | 0 | 0 | - | - | 16,7 | 0 | 0 | 0 |
| Hainesia lythri | 0 | 0 | 0 | - | - | 16,7 | - | 83,3 | - |
| Pestalotia truncata | 0 | 0 | 0 | - | - | 33,3 | 0 | 0 | 0 |
Примечание: *- Кор. – корни; Рож. – рожки; Череш. – черешки листьев
Следует отметить, что гибель растений земляники от ризоктониоза отмечали и в предыдущие годы. Так, во второй половине июня 2006 г. наблюдалась массовая гибель новосадки земляники близ пос. Жабкино, Ленинского р-на, Московской области.
Плантация земляники, высаженная в начале мая 2006 г., прижилась к концу мая, а в июне при повышении дневных температур до + 27-30°С наблюдали симптомы увядания и выпады. Выпады восприимчивого сорта Юния Смайдс по отдельным рядам достигали 80%, а на сорте Красавица Загорья – 50%.
Микологические анализы показали, что с высокой частотой (до 100%) из рожков, черешков листьев и корней выделялся гриб Rhizoctonia solani, тогда как присутствия другого возможного патогена, оомицета Ph. cactorum, не было обнаружено ни в растениях, ни в почве.
По нашим наблюдениям наибольшую вредоносность на землянике проявляет гриб R. solani в теплицах, так как в них поддерживается постоянная высокая влажность, а температура даже весной достигает 25°С. Так, в 2004 г. в теплице НПО «Фитогенетика» Тульской области наблюдали массовую гибель рассады земляники польского происхождения сортов Хонуэй Эльсанта, Дукат, Кама с симптомами интенсивной гнили надземной части и рожков.
В 2007 г. в зимней теплице ГНУ ВСТИСП наблюдалась массовая гниль надземной части и корней укореняемой рассады сортов Царскосельская, Трибъют и Марышка. Результаты микологического анализа также показали высокую частоту выделения гриба Rhizoctonia solani из корней, рожков и черешков листьев пораженных растений.
3.1.2. Корневые гнили земляники. Корневые гнили земляники часто ассоциировались с симптомами карликовости или остановки роста, особенно при выращивании земляники в тепличной горшечной культуре. Такие растения переставали расти, загнивали, а при выкопке на них отмечали симптомы интенсивной корневой гнили. Часто из корней и рожков таких растений выделяли виды Fusarium, Cylindrocarpon, Pythium, Botrytis, Rhizoctonia.
Питиозы земляники. Оомицеты из рода Pythium отмечались многими исследователями в качестве возбудителей корневых гнилей земляники [Hendrix, Campbell, 1974; Nemec, Sanders, 1970, Watanabe et al., 1977].
Впервые исследования особенностей проявления питиоза в теплице на адаптируемых растениях земляники сортов Редгонтлет и Дубровский Родник нами были проведены еще в 1985 году. Из пораженных растений был выделен оомицет P. ultimum, который заражал не только корни, но и рожки растений земляники. В 1988 году мы наблюдали питиоз корней земляники как в теплице на сортах Гренада и Талисман, так и в условиях открытого грунта на сорте Золушка. Кроме того, в совхозе «Крекшино» (Нарофоминский р-н, Московской обл.) на молодой плантации земляники, расположенной на пойменной террасе, на фоне весеннего переувлажнения отмечали развитие интенсивной корневой гнили, вызванной оомицетами из рода Pythium - P. salpingophorum , P. acanticum. В 2004 году в АОЗТ «Совхоз им. Ленина» Ленинского р-на Московской обл. в маточнике, расположенном на пойменной террасе, наблюдали, развитие питиозной корневой гнили земляники на сортах Баунти и Хонэй, одним из возбудителей которой являлся оомицет Pythium intermedium.
Патогенность видов Pythium на сеянцах земляники. Как показали наши исследования из 5 видов Pythium (табл. 4), наиболее патогенными на сеянцах земляники в лабораторных условиях были виды P. ultimum и P. irregulare.
Таблица 4. Результаты опыта по исскуственному заражению сеянцев земляники пятью видами Pythium
| Виды Pythium | происхождение | Гибель в % через дней | Гниль корней, % | ||
| 7 | 19 | 38 | |||
| P. ultimum | Земляничный изолят, из корней погибшего растения (ЗГ)* | 50,0 | 65,0 | 75,0 | 83,0 |
| P. irregulare | Земляничный изолят из растений с черной корневой гнилью (ОГ) | 35,0 | 60,0 | 70,0 | 76,7 |
| P. intermedium | Земляничный изолят из корней угнетенного растения (ОГ)** | 30,0 | 40,0 | 55,0 | 65,0 |
| P. salpingophorum | Земляничный изолят, из корней погибшего растения (ОГ) | 20,0 | 30,0 | 50,0 | 56,0 |
| P. proliferum | Изолят из прикорневой почвы земляники (ЗГ) | 0 | 5,0 | 5,0 | 16,7 |
| Контроль (без заражения) | Без заражения | 0 | 0 | 0 | 8,2 |
Примечание:*- ЗГ – защищенный грунт, ** - ОГ – открытый грунт
Эти виды вызывали интенсивную корневую гниль и гибель зараженных сеянцев, в пределах 70-75 % от общего числа.
Виды P. intermedium и P. salpingophorum были умеренно патогенными, вызывали гибель 50-55 % сеянцев земляники, а вид P. proliferum был слабо патогенен, вызывая слабую корневую гниль зараженных сеянцев (некротизация корней 16,7 %, против 83 % у P. ultimum). Контрольные сеянцы земляники выжили все, хотя некоторые из них имели несколько некротизированных корней (некротизация корней 8,2 %).
Черная корневая гниль. Симптомы черной корневой гнили земляники были отмечены в разных странах по всему миру [Maas. 1984; Wing et al., 1994] и установлено, что эту болезнь могут вызывать, как патогенные организмы, так и абиотические факторы окружающей среды.
В процессе проведения исследований мы неоднократно отмечали подобного рода симптомы на землянике. Часто они были связаны с отсутствием или угнетением роста растений, а иногда и с их скоротечной гибелью.
Следует отметить, что большинство случаев угнетения роста, карликовости растений земляники были напрямую связаны с симптомами черной корневой гнили. У таких растений отмечено практически полное отмирание корневой системы, то есть корни становились темно бурыми, а при переувлажнение в теплицах – черными.
Микологические анализы растений земляники, пораженных черной корневой гнилью показали, что наиболее часто на пораженных корнях в комплексе микромицетов присутствовали виды Pythium spp. (84.8%), Rhizoctonia solani (65,2%), Fusarium spp. (65,2%), C. destructans (52,1%)
Симптомы черной корневой гнили земляники могут также проявляться и при так называемой хронической форме заражения растений такими патогенами, как Verticillium albo-atrum и Phytophthora cactorum. В частности, о наличии «хронической» формы вертициллезного вилта в Подмосковье сообщал Ю.П. Пристансков [1976], который выделял из корней угнетенных растений виды Pythium, Fusarium, Alternaria, считая их вторичными патогенами. В своих исследованиях в 1980-х годах мы также отмечали хроническую форму фитофтороза рожков земляники. Так, например, в Рязанской области на сорте Редгонтлит мы наблюдали угнетение роста растений земляники ранее пораженных оомицетом Ph. cactorum, а из корней таких растений выделялись виды Pythium и Fusarium.
Поражение растений земляники ризоктониозом (возб. Rhizoctonia solani) в дальнейшем также может приводить к возникновению симптомов черной корневой гнили, поскольку ослабленные ризоктониозом растения поражаются комплексом почвенных микромицетов, вызывающих интенсивную гниль корней земляники.
3.2. Видовой состав микромицетов, ассоциирующихся с корневыми гнилями малины красной, их распространенность и вредоносность.
Во время исследования причин корневых гнилей малины нами был выделен целый ряд почвенных грибов, которые периодически встречались на гниющих корнях и в основании стеблей больных растений малины. Так из гниющих корневых отпрысков в теплице часто выделялись виды Cylindrocarpon (46,7%), Rhizoctonia solani (36,7%), Thielaviopsis basicola (20%), другие виды, такие как Fusarium, Pestalotia, Verticillium albo-atrum и прочие встречались намного реже. Хотя следует отметить, что в 1992 г. гриб Verticillium albo-atrum вызывал увядание малины сорта Бальзам на одном из маточников в Подмосковье и был выделен нами как из корней, так из стеблей увядающих растений.
3.2.1. Фитофторозная гниль корней малины красной. В 1991 г. на селекционном участке ГНУ ВСТИСП отмечали внезапное усыхание и гибель гибридных растений малины красной семей № 445 и № 444 (Сенатор Иркутская).
Болезнь проявлялась в виде усыхания отросших побегов в течение сезона. Часть растений отрастали весной и внезапно увядали, другие растения цвели и увядали в период завязывания ягод. У всех увядших побегов и стеблей растрескивалась кора на уровне почвы и отмечалась интенсивная корневая гниль. При микроскопическом анализе коры корней и оснований стеблей отмечено наличие крупных ооспор оомицета из рода Phytophthora от 27,0 до 45,9 мкм в диаметре.
Наши исследования морфологических и других характерных особенностей этого патогена, в частности, отмеченное оптимальное развитие при температурах от +15 до 20°С позволили отнести данный патоген к виду Phytophthora fragariae Hickman. Для этого вида также характерно образование спорангиев вначале сферических, позже обратно грушевидных, овальной или эллипсовидной формы, без папил (сосочков) и ножки, размером 34,8-84,525,8-43,5 мкм.
Попытка заражения этим патогенным видом корней и черешков листьев земляники была безуспешной, хотя корни, черешки листьев и листья малины заражались регулярно. Все перечисленные особенности выявленного вида позволили отнести его к малинному биотипу - Phytophthora fragariae v. rubi, что согласуется с описанием данного биотипа, в том числе с результатами зарубежных исследователей [Kennedy, Duncan, 1993; Wilcox et al., 1993].
Наблюдения, проводившиеся в ГНУ ВСТИСП с 1991 по 2008 гг., выявили периодичность интенсивности развития данного патогена по годам. Наиболее высокая интенсивность развития наблюдалась во влажные годы (рис. 1). Снижение интенсивности развития патогена наблюдалось в годы с жарким летом, это было отмечено в 1992, 1999 и 2002, 2006, 2007 гг., а также в годы с умеренными летними температурами, но с меньшим количеством осадков и с весенней засухой.
Во влажные годы начала ХХІ века (2001, 2003, 2004, 2005) опять выявили вспышку развития этого патогена в посадках малины, где он был отмечен в предыдущие годы. Так, в 2001 году выявили сильную вспышку фитофтороза корней малины (возбудитель Phytophthora fragariae var. rubi) на лабораторном участке в п. Измайлово (Ленинский р-н, Московская обл.). Начали сильно усыхать сорта Киржач (гибель до 40 % растений), Патриция (гибель очагах от 32 до 80 %), Таруса (гибель от 3,7 до 59 %), Арбат (гибель до 32 %), Форма ИК-21 (до 20 %), Калашник (в зависимости от расположения насаждений, микрорельефа участка и близости очага инфекции - гибель от 0 до 80 %).
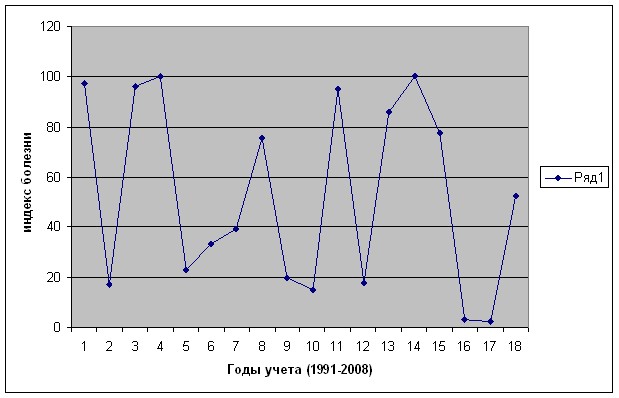 Рисунок 1. Изменение интенсивности развития фитофтороза корней малины по годам (1991-2008).
Рисунок 1. Изменение интенсивности развития фитофтороза корней малины по годам (1991-2008).
В условиях средней полосы России при междурядной обработке плантаций малины из-за выноса верхнего слоя почвы происходит поднятие рядов при культивировании. Например, если в 2004 г. на плантации 2003 года посадки высота гряд в ряду колебалась от -4 до +6 см, то уже на плантации 2000 года закладки – от +4 до +15 см, а на плантации 1989 г. – от +17 до +35 см. Образование гряд служит естественным барьером для распространения патогена с дождевой и талой водой. С другой стороны, по данным зарубежных исследователей, метод посадки растений на гряды считается одним из эффективных способов ограничения инфекции [Montgomery, Kennedy,1982; Maloney et al., 1993; He1berg, 1995].
При исследовании промышленной плантации малины с очагами фитофторозной корневой гнили, мы также получили данные о продолжительности сохранения гриба Ph. fragariae v. rubi в почве при отсутствии растения - хозяина. Так, предыдущая плантация малины на этом участке после обнаружения очагов фитофторозной корневой гнили была запахана осенью 1994 г. В течение шести лет участок находился под черным паром, а в 2000 г. в нижней части участка заложили новую плантацию малины, где в 2001 г. в очагах начали проявляться симптомы увядания. Имея схемы посадки плантации до 1994 г. с отмеченными очагами корневой гнили, мы сравнили их с очагами на новой плантации и выяснили, что часть очагов в 2001 г. совпадает с таковыми, отмеченными ранее.
3.2.2. Фитофторозные гнили корней малины. Данные более чем за 15 лет исследований (1991-2008 гг.) показывают, что, не считая случаев с корневыми гнилями в теплицах, в открытом грунте, помимо основного патогена выделялось еще не менее трёх видов Phytophthora (табл. 5).
Таблица 5. Виды рода Phytophthora, ассоциирующиеся с корневыми гнилями малины красной в условиях открытого (ОГ) и защищенного грунтов (ЗГ)
| Годы | Виды Phytophthora | Источник выделения |
| 1988 | Ph. cactorum* Ph. citricola | Корневые отпрыски малины + почва (ЗГ) |
| 1992 | Ph. citricola* Ph. cryptogea | Растения малины после термокамеры (ЗГ) |
| 1993 | Ph. fragariae v. rubi* Ph. nicotianae Ph. cactorum Phytophthora sp. | Корни растений + почва (ОГ) |
| 1994 | Ph. fragariae v. rubi* Ph. nicotianae Ph. cactorum Ph. citricola | Корни растений + почва (ОГ) |
| 1995 | Ph. fragariae v. rubi* Ph. nicotianae Ph. cactorum Phytophthora sp. | Корни растений + почва (ОГ) |
| 1996 | Ph. fragariae v. rubi* Ph. nicotianae Phytophthora sp. | Корни и корневые отпрыски растений + почва (ОГ) |
| 1997 | Ph. fragariae v. rubi* Ph. nicotianae Ph. cactorum Phytophthora sp. | Корни растений + почва (ОГ) |
| 1998 | Ph. nicotianae Ph. cactorum Ph. citricola | Корни растений + почва (ОГ) |
| 1999 | Ph. fragariae v. rubi* Ph. nicotianae Ph. cactorum Ph. citricola | Корни растений + почва (ОГ) |
| 2001 | Ph. fragariae v. rubi* Ph. nicotianae Phytophthora sp. | Корни растений + почва (ОГ) |
| 2005 | Ph. fragariae v. rubi* Ph. nicotianae Ph. cactorum Phytophthora sp. | Корни растений + почва (ОГ) |
Примечание: * - основной патоген
В частности, очень часто сопутствующими видами были Ph. nicotianae и Ph. cactorum, реже вид Ph. citricola. Следует отметить, что Ph. nicotianae относительно часто выделяли из корней больных растений, а два других вида наоборот выделяли очень редко, особенно в условиях открытого грунта.
Исследования, проведенные в 1996 и 2004 годах, показали, что виды Ph. citricola и Ph. nicotianae заражали корневые отпрыски малины в условиях открытого грунта. Оба вида вызывали некрозы на этиолированных частях корневых отпрысков, а при сильном развитии гнили – усыхание.
Нами также выявлено, что подтопление насаждений малины усиливает фитофторозные корневые гнили, которые вызываются слабо патогенными видами из рода Phytophthora. Так уровень подтопления от – 5 см и выше до – 1 см резко увеличивал количество погибших и больных растений, а затопление участков на +1 см над поверхностью почвы вызывало 100%-ную гибель растений.
Статистический анализ данных показал, что существует прямая корреляционная зависимость между уровнем затопления и пораженностью малины фитофторозными корневыми гнилями с коэффициентами корреляции от 0,935 до 0,999.
3.2.3. Тесты на патогенность видов Phytophthora на сеянцах малины. Для выяснения роли видов Phytophthora, ассоциирующихся с корневыми гнилями малины, нами проведен лабораторный тест по испытанию патогенности 5 видов этого рода на сеянцах малины красной (табл. 6).
Таблица 6. Результаты опыта по оценке патогенности 5 видов Phytophthora на сеянцах малины красной (1994)
Виды Phytophthora | Происхождение изолятов | Гибель сеянцев через дней, % | Гниль корней, % | ||
| 7 | 19 | 38 | |||
| Ph. fragariae var. rubi 1* | Малина, корни, открытый грунт (ОГ) | 35,0 | 65,0 | 80,0 | 85,6 d |
| Ph. fragariae var. rubi 2** | Малина, корни (ОГ) | 45,0 | 75,0 | 90,0 | 91,5 d |
| Ph. nicotianae | Малина, прикорневая почва (ОГ) | 5,0 | 25,0 | 35,0 | 43,2 b |
| Ph. cryptogea | Малина, прикорневая почва, (ЗГ) | 10,0 | 40,0 | 50,0 | 57,0 bc |
| Ph. citricola | Земляника, прикорневая почва, теплица (ЗГ) | 20,0 | 50,0 | 60,0 | 65,0 c |
| Ph. cactorum | Земляника, прикорневая почва, (ЗГ) | 5,0 | 30,0 | 40,0 | 43,7 b |
| Контроль (без заражения) | - | 0 | 0 | 0 | 5,7 a |
Примечание: 1*– инокуляция почвы; 2**– инокуляция растений
Для заражения использовали чистые культуры видов Phytophthora, таких как Ph. fragariae var. rubi, Ph. nicotianae и Ph. cryptogea (малинные изоляты), а также Ph. citricola и Ph. cactorum (земляничные изоляты).
Из приведенных данных (табл. 6) видно, что наиболее патогенным для сеянцев малины был вид Ph. fragariae var. rubi, который вызывал гибель 35-45 % сеянцев через 7 дней после инокуляции и 80-90 % растений через 38 дней. Поражение сеянцев малины этим патогеном характеризовалось интенсивной корневой гнилью, которая проявлялась почти полной некротизаций корней (85,6-91,5%) в конце опыта.
Другие виды Phytophthora проявляли умеренную патогенность для сеянцев малины, причем такие виды, как Ph. citricola и Ph. cactorum часто поражали не только корни, но и корневую шейку сеянцев, вызывая светло-коричневые некрозы.
3.3. Видовой состав почвенных микромицетов, ассоциирующийся с корневыми и прикорневыми гнилями плодовых культур, распространенность и вредоносность
3.3.1. Корневые и прикорневые гнили сеянцев плодовых культур. Потери семечковых и косточковых культур в школках сеянцев иногда достигают 50-80 % от общего числа высеянных семян. Причинами выпадов, в основном, считают либо потерю всхожести семян из-за не правильной их подготовки (например, нарушение режимов стратификации), либо поражение почвенно-патогенными микромицетами.
Наши исследования показали, что с выпадами сеянцев было связано более 23 видов почвенных микромицетов, причем в разные годы и в различных условиях выращивания менялись виды основных возбудителей гнилей.
В разные годы и в различных условиях «черную ножку» сеянцев могли вызывать такие микромицеты, как Fusarium lateritium, Rhizoctonia solani, Pythium spp., Ph. cactorum и некоторые другие (табл. 7). Виды Fusarium часто ассоциировались с «черной ножкой» сеянцев яблони в условиях теплицы. Выпады от этих патогенов часто были связаны с первоначальной зараженностью ими семян яблони.
В полевых условиях гниль корневой шейки была обусловлена заражением сеянцев видами рода Pythium и Ph. cactorum, частота выделений которых составила 62,5 и 50 % соответственно (табл. 7).
Гибель сеянцев плодовых пород также может вызывать гриб R. solani, особенно если они выращиваются в теплице (табл. 7). Так, в апреле 1992 г. мы наблюдали гибель сеянцев сливы в теплице в результате поражения ризоктониозом. В этом же году в июне было отмечено поражение ризоктониозом сеянцев груши в условиях открытого грунта.
В то же время, в условиях открытого грунта наличие в почве школки до посадки оомицета P. ultimum обусловило, в дальнейшем, сильное развитие корневой гнили сеянцев яблони.
Таблица 7. Частота выделения почвенных микромицетов (%) из сеянцев плодовых культур пораженных корневыми гнилями в условиях открытого (ОГ) и защищенного грунтов (ЗГ)
Виды микромицетов | 1991 | 1992 | 1993 | 2007 | |||
| Яблоня (ЗГ) | Яблоня (ОГ) | Слива (ЗГ) | Яблоня (ОГ) | Яблоня (ЗГ) | Груша (ОГ) | Алыча (ОГ) | |
| Ph. cactorum | 0 | 50,0 | 0 | 0 | 0 | 0 | 0 |
| Pythium sp. | 0 | - | - | - | 0 | 10,0 | 20,0 |
| P. ultimum | 0 | 33,3 | 0 | 50,0 | 0 | 0 | 0 |
| P. intermedium | 0 | 16,7 | 0 | 0 | 0 | 0 | 0 |
| P. mamillatum | 0 | 0 | 20,0 | 0 | 0 | 0 | 0 |
| P.proliferum | 0 | 16,7 | 0 | 0 | 0 | 0 | 0 |
| Rhizoctonia solani | 16,7 | 0 | 80,0 | 0 | 0 | 0 | 80,0 |
| Fusarium spp. | - | 33,3 | - | 16,7 | 16,7 | 0 | 0 |
| F. lateritium | 83,3 | 0 | 0 | 0 | 100 | 0 | 0 |
| F.sambucinum | 0 | 0 | 60,0 | 0 | 80,0 | 0 | |
| F.avenaceum | 0 | 16,7 | 0 | 16,7 | 0 | 0 | 0 |
| F. solani | 0 | 0 | 0 | 16,7 | 0 | 0 | 40,0 |
| F.sporotrochiella | 33,3 | 0 | 0 | 0 | 0 | 0 | 0 |
| C. destructans | 0 | 0 | 40,0 | 40,0 | 16,7 | 90,0 | 80,0 |
| Alternaria spp. | 33,3 | 0 | 0 | 16,7 | 0 | 0 | 0 |
| Phoma sp. | 0 | 0 | 60,0 | 0 | 0 | 0 | 0 |
| Thielaviopsis basicola | 0 | 0 | 20,0 | 0 | 0 | 0 | 0 |
| Verticillium sp. | 0 | 0 | 0 | 33,3 | 0 | 0 | 0 |
| Geotrichum candidum | 0 | 0 | 0 | 0 | 83,3 | 0 | 0 |
Сеянцы плодовых культур могут поражаться почвенными микромицетами после пересадки их в первое поле питомников. Этому способствуют механические повреждения корневой системы, наносимые при выкопке сеянцев. При неблагоприятных условиях выращивания (засуха, переувлажнение) раны на корневой системе сеянцев заселяются почвенными грибами, относящимися к раневым патогенам, которые вызывают гниль корней. Так, в 2007 г., во время жаркого засушливого лета, наблюдались интенсивные выпады сеянцев в первом поле питомника. Эти выпады сопровождались интенсивной корневой гнилью, с которой ассоциировались такие грибы, как Cylindrocarpon destructans, Fusarium sambucinum, F. solani и Rhizoctonia solani.
3.3.2. Корневые гнили подвоев и саженцев плодовых культур в питомнике. В плодовых питомниках ежегодно наблюдаются выпады саженцев, часть из которых нельзя объяснить поражением, например, грибами – возбудителями инфекционного усыхания.
Микологические анализы показали, что симптомы корневой гнили у клоновых подвоев и окулянтов яблони и сливы были связаны с заселением корней и базальной части саженцев почвенно-патогенным грибом Rhizoctonia solani, часто совместно с другими почвенными микромицетами, такими как Fusarium spp., Cylindrocarpon spp., Pythium spp., иногда Phytophthora spp. (табл. 8).
Таблица 8. Частота выделения почвенных микромицетов (%) из укорененных черенков сливы в теплице и после высадки в поле на доращивание
| Виды микромицетов | Пленочные теплицы | Измайлово (подвои и сорта сливы в поле) | |||
| Загорье | Измайлово | ||||
| ОД-2-3 | Новинка | Скороплодная | ОД-2-3 | Новинка | |
| Rhizoctonia solani | 33,3 | 100 | 83,3 | 41,7 | 75,0 |
| Fusarium spp. | 25,0 | 66,7 | 22,2 | 8,3 | 33,3 |
| F. sambucinum | 50,0 | 100 | 11,1 | 0 | 33,3 |
| F. sublunatum | 0 | 0 | 5.0 | 26,0 | 16,6 |
| F. aqueductum | 0 | 0 | 0 | 0 | 8,3 |
| F. gibbossum | 0 | 0 | 0 | 0 | 8,3 |
| Pythium spp. | 8,3 | 0 | 0 | 8.3 | 0 |
| P. mamillatum | 41,7 | 0 | 0 | 0 | 0 |
| Cylindrocarpon destructans | 25,0 | 88,9 | 0 | 0 | 88,3 |
| Alternaria tenuissima | 25,0 | 22,2 | 16,6 | 25,0 | 83,3 |
| Gliocladium spp. | 33,3 | 66,7 | 5,0 | 8,3 | 8,3 |
| Geotrichum candidum | 0 | 0 | 11,1 | 16,6 | 8,3 |
| Diplocladiella scalaroides | 0 | 0 | 33,3 | 8,3 | 33,3 |
| Subulispora sp. | 41,7 | 55,5 | 16,6 | 8,3 | 16,6 |
| Phomopsis mali | 0 | 0 | 11,1 | 33,3 | 0 |
| Pestalotia hartigii | 0 | 0 | 11,1 | 16,6 | 0 |
Причиной корневых гнилей в первом поле плодового питомника часто бывает заражение почвенными микромицетами клоновых подвоев ещё на стадии укоренения их в теплице. Из приведенных данных (табл. 8) видно, что уже на стадии укоренения зеленых черенков сливы в условиях теплицы происходит их заражение почвенно-патогенным грибом R. solani, что в дальнейшем сказывается на приживаемости саженцев после высадки в открытый грунт.
Так в 2007 году выпады в 1-ом поле плодового питомника составили 10,5-58,9 %. Причем наибольший процент выпадов (до 58,9 %) приходился на клоновые подвои вишни, которые были получены при укоренении зеленых черенков в теплице.
3.3.3. Гнили зеленых черенков плодовых культур при их укоренении в теплице. Микологические исследования зеленых черенков плодовых и ягодных культур, пораженных микозными гнилями, показали, что наиболее часто встречающимся патогеном был гриб Rhizoctonia solani, который выделялся из некротизированных частей базальных частей с частотой встречаемости 80-100 %. Другой наиболее часто и постоянно встречающейся группой грибов были виды из рода Fusarium, с преобладанием вида F. sambucinum. Встречаемость видов рода Pythium варьировала по годам от 5,5 до 57,1 %. Среди видов рода Pythium были идентифицированы три вида: P. mamillatum, P. ultimum и P. irregulare, которые также ассоциировались с корневыми и прикорневыми гнилями саженцев и сеянцев плодовых культур.
В целом, наибольший ущерб при укоренении зеленых черенков в теплицах наносит гриб Rhizoctonia solani, вызывая гниль базальной части зеленых черенков и отмирание зоны корнеобразования.
ГЛАВА 4. Диагностика почвы и растений на зараженность микромицетами - возбудителями корневых и прикорневых гнилей плодовых и ягодных культур, прогноз их развития
4.1. Метод плавающих биоприманок для диагностики почвы и корней растений на зараженность видов Phytophthora. В связи с тем, что в 1991 году нами была выявлена новая для России болезнь малины – фитофторозная корневая гниль, возбудитель Phytophthora fragariae var. rubi, возникла необходимость разработать доступные методы диагностики этого патогена в почве и в растениях.
В 1994 году был проведен ряд опытов по подбору приманок для диагностики Ph. fragariae var. rubi в почве и корнях растений. Наиболее подходящими для тестирования этого патогена в почве были листья и черешки листьев малины от микроразмноженных растений, адаптированных в теплице.
Для выделения этого патогена из корней малины было предложено в качестве приманок использовать черешки листьев малины, выращиваемой в условиях открытого грунта. Результаты опыта показали, что черешки листьев различных сортов отличались восприимчивостью к Ph. fragariae var. rubi. Максимальную некротизацию черешков листьев наблюдали у сортов Маросейка и Калашник, частота выделения патогена в этом случае достигала 70,0 и 55,5 %, соответственно. Наименее чувствительными к заражению этим патогеном были черешки листьев сортов Маллинг эксплайн и Норфолк Джайнт, которые проявляли некротизацию 0,12 и 0,15 %, соответственно, при низкой частоте выделения этого патогена. Следует отметить, что эти сорта по сообщениям зарубежных исследователей являются устойчивыми к фитофторозной гнили корней [Barritt et al., 1981; Duncan et al., 1993].
Результаты опытов 1997 г. по подбору наиболее селективной приманки для выделения Phytophthora fragariae var. rubi суммированы в таблице 9. Из представленных данных видно, что лишь листья альпийской лесной земляники оказались совершенно непригодными для выделения Phytophthora fragariae var. rubi из почвы.
Следует отметить, что средний коэффициент селективности у листьев малины красной соответствовал 48,9 %, а у молодых листьев ежевики сорта Смутсен – 79,2 % (наивысший коэффициент селективности из 8 испытанных биоприманок).
Таблица 9. Значения коэффициентов селективности (Кс) к Ph. fragariae var. rubi восьми типов биологических приманок
| Вид биоприманок | Коэффициент селективности | |||
| 18.02.97 | 12.02.97 | 9.04.97 | Среднее по опытам | |
| Малина красная | 53,8* | 50,0 | 42,8 | 48,9 |
| Малина черная | - | 54,8 | 0 | 27,4 |
| Малина душистая | - | 13,3 | - | 13,3 |
| Ежевика Агавам | 47,6 | - | - | 47,6 |
| Ежевика Смутсен | - | 87,5 | 71,0 | 79,2 |
| Тайберри** | 38,5 | - | - | 38,5 |
| Логанберри** | 58,3 | - | 40,0 | 49,1 |
| Земляника лесная (альпийская) | - | 0 | 0 | 0 |
Примечание: * - формула расчета коэффициента селективности: Кс= По- Прр 100%,
По
где По – общее число видов Phytophthora, Прр – число видов не относящиеся к Ph. fragariae var. rubi,
Нашими опытами также установлена возможность диагностирования Ph. fragariae var. rubi в почвенных образцах при лабораторных температурах от + 15 до +20°С и оптимуме + 17-18°С. Однако отобранные летом образцы даже при оптимальных условиях тестирования в лаборатории не позволяют выявлять этого патогена. Его удавалось обнаружить в этих образцах лишь весной следующего года (марте, апреле) после продолжительного хранения в холодильнике при +5°С.
Из аналогичных методик по тестированию данного патогена в почве с помощью биоприманок известна методика Дж. М. Дункана [Duncan, Kennedy, 1993], но она требует больших материальных затрат и времени на диагностику. Так, если на диагностику Ph. fragariae var. rubi предложенными способами при благоприятных условиях уходит 4-6 дней, то по методике Дункана – 4-5 недель.
4.2. Метод зеленых черенков для диагностики почвенных микромицетов, возбудителей корневых гнилей плодовых и ягодных культур.
Изучая микозные гнили зеленых черенков плодовых и ягодных культур, мы попытались использовать зеленые черенки, как модельные для диагностики почвенных микромицетов – возбудителей гнилей черенков, а также для определения риска возникновения гнилей.
Таблица 10. Гибель зеленых черенков косточковых культур от гнилей в теплице и процент некротизации «модельных черенков» в тепличном субстрате перед посадкой (через 7-8 дней инкубации при 24-26°С)
| год | Культура, сорт, подвой | Гибель черенков в теплице, % | Некротизация модельных черенков, % | Наличие Rhizoctonia solani |
| 1997 | Вишня / подвой П-7 | 47,5 | 63,7 | +++* |
| 1997 | Вишня/Владимирская | 71,4 | 74,5 | +++ |
| 1997 | Вишня/Гриот Московский | 77,8 | 68,5 | +++ |
| 2001 | Вишня / подвой Измайловский (ПН) | 52,5 | 73,7 | +++ |
| 2002 | Вишня / подвой ПН* | 60,0 | 69,1 | +++ |
| 2002 | Вишня / подвой ПН | 0 | 7,7 | - |
| 2003 | Вишня / подвой ПН | 30,0 | 37,6 | ++ |
| 2003 | Вишня / подвой ПН* | 15,0 | 17,5 | + |
| 2003 | Вишня / подвой ПН | 10,0 | 12,7 | - |
| 2003 | Вишня / подвой ПН | 85,0 | 75,5 | +++ |
| 2003 | Слива /подвой ЛЦ-52* | 50,0 | 37,6 | ++ |
| 2003 | Слива /подвой ЛЦ-52 | 95,0 | 78,5 | +++ |
| 2003 | Слива /подвой ЛЦ-52 | 65,0 | 38,1 | ++ |
| 2003 | Слива /подвой ЛЦ-52 | 90,0 | 59,7 | +++ |
| 2005 | Слива / Скороспелка красная | 50,0 | 72,0 | +++ |
| 2005 | Слива/Евразия 21 | 75,0 | 91,5 | +++ |
| 2007 | Слива/Евразия 21* | 50,0 | 38,1 | ++ |
| 2007 | Слива/Евразия 21 | 63,2 | 51,1 | +++ |
| 2007 | Слива/Евразия 21 | 38,0 | 28,5 | ++ |
| Коэффициент корреляции (r) | 0,823 | |||
Примечание *– укоренение проходило в разных теплицах
Из результатов опытов 1991-1992 гг. (табл. 10) видно, что выпады зеленых черенков напрямую были связаны некротизации «модельных» черенков. В частности, статистический анализ данных показал прямую корреляционную зависимость между выпадами и скоростью некротизации «модельных» черенков, при высоком коэффициенте корреляции (r = 0,823). Также была отмечена прямая корреляционная зависимость между выпадами укореняемых черенков и частотой выделения гриба Rhizoctonia solani из модельных черенков (r = 0,979).
4.3. Прогноз развития корневых и прикорневых гнилей плодовых и ягодных культур
4.3.1. Регрессионный прогноз развития гнилей зеленых черенков при их укоренении в теплице. Для прогноза выпадов зеленых черенков при их укоренении в пленочных теплицах мы рассчитали уравнение регрессии, имеющее вид: У=5,30х-34,13 (1), где У – процент гибели зеленых черенков, х – коэффициент некротизации почвы, рассчитываемый по некротизации «модельных» черенков золотистой смородины в тестируемой почве. В таблице 11 приведены данные прогноза с помощью этого уравнения выпадов зеленых черенков крыжовника, сливы, вишни и красной смородины и сравнение предсказанных значений с фактическими показателями. В частности, из этих данных видно, что ошибка прогноза не выходила за пределы 25 % от фактических значений выпадов.
Таблица 11. Регрессионный прогноз потерь зеленых черенков крыжовника при укоренении в теплице в зависимости от коэффициента (Кп) некротизации «модельных» черенков на почве (У=5,30х-34,13)
| Культура | Кп, % | Выпады, % фактические | Выпады, % теоретические | Ошибка прогноза |
| Крыжовник * | 19,8 | 90,0 | 70,8 | -19,2 |
| Смородина красная* | 18,7 | 80,0 | 65,0 | -15,0 |
| Крыжовник** | 23,2 | 87,0 | 88,9 | 1,9 |
| Крыжовник** | 23,0 | 78,0 | 87,8 | 9,2 |
| Крыжовник** | 10,0 | 7,5 | 18,9 | 11,4 |
| Крыжовник** | 14,8 | 27,5 | 44,3 | 16,8 |
| Крыжовник** | 3,8 | 2,5 | -13,9 | -12,4 |
| Слива** | 9,6 | 15,0 | 16,8 | 1,8 |
| Слива** | 18,4 | 72,5 | 63,4 | -9,1 |
| Крыжовник** | 12,7 | 28,0 | 33,2 | 5,2 |
| Вишня | 13,2 | 45,0 | 35,8 | -9,2 |
| Крыжовник** | 13,4 | 15,0 | 36,9 | 21,9 |
| Суммарная ошибка | 3,3 | |||
| Средняя ошибка | 0,3 | |||
Примечание: * - укоренялись одревесневшие черенки весной (март) в зимней теплице;
** – укоренение проходила одинаковых культур в разные годы.
Для упрощения процедуры диагностики и прогноза развития гнили зеленых черенков в теплице вместо коэффициента некротизации почвы (Кп) мы применили прямую оценку некротизации «модельных» черенков для расчета уравнения регрессионного прогноза. Нами было рассчитано уравнение регрессионного прогноза для косточковых культур имеющее вид: У=0,89х+7,48 (2), где х – общая некротизация модельных черенков чубушника, У – прогнозируемая гибель черенков.
Для увеличения точности прогноза мы рассчитали отдельно формулу для предсказаний для зеленых черенков:
– вишни У=1,02х-3,94 (В)
– сливы У=0,42х+41,99 (С).
Расчеты по индивидуальным формулам показали, что в среднем ошибка по прогнозу для вишни была снижена почти в два раза, а для сливы поменяла знак с минуса на плюс, при уменьшении отклонений от фактических в 2 раза.
4.3.2. Регрессионный прогноз фитофторозной гнили корней малины. В ходе наших исследований установлено, что в условиях Московской области оомицет Phytophthora fragariae v. rubi проявляет периодичность в своей вредоносности в зависимости от погодных условий, преобладающих в вегетационный период. Результаты анализа показали, что отмечается высокая корреляционная зависимость (r=0,888) между индексом болезни и суммой осадков за апрель, май, июнь. Прогноз фитофторозной гнили осуществляли по введенному нами значению – индекс болезни (ИБ), который соответствует общепринятому термину – распространенность болезни, но в ИБ вводятся поправки на развитие болезни в текущий год учета.
Используя данные наблюдений за 17 лет, мы рассчитали два уравнения регрессионного прогноза, где в первом (У=0,56 х – 35,55) использовали в качестве независимой переменной х сумму осадков за 3 месяца (апрель, май, июнь), а во втором (У=9,94 х – 37,31) – х это коэффициент отношения суммы осадков за 3 месяца к максимальной среднемесячной температуре (Ко/т). Анализ этих двух уравнений регрессионного прогноза показал, что по уравнению регрессии, где в качестве независимой переменной использовали сумму температур за 3 месяца, давал суммарную ошибку – 4,1 %, а среднюю -0,2 %, что было на порядок ниже лучших регрессионных прогнозов по гнилям зеленых черенков.
Результатом исследований по диагностике и мониторингу явилось создание системы учетов и диагностики, корневых и прикорневых гнилей плодовых культур с использованием оптимальных сроков для учета болезней и проведения анализов. Данная система базируется в основном на разработанных нами методах диагностики с помощью биоприманок и предусматривает применение элементов прогноза для определения риска развития болезней вызываемых некоторыми почвенными патогенами.
ГЛАВА 5. Концепция изменения патогенеза почвенных микромицетов на плодовых и ягодных растениях в условиях агроценозов.
Концепция изменения патогенеза почвенных микромицетов на плодовых и ягодных растениях в условиях агроценозов сформулирована следующим образом.
На патогенез почвенных микромицетов оказывают влияние три основных фактора: почвенно-климатические условия, биологический и антропогенный.
Влияние этих факторов может выражаться, как стимулирующем, так и лимитирующем воздействие на патогенез возбудителей корневых и прикорневых гнилей плодовых и ягодных культур.
Почвенно-климатический фактор является определяющим по своему влиянию на патогенез почвенных грибов и псевдогрибов, так как оказывает сильное влияние, как на структуры их популяции, так и на способность их изменчивости для преодоления устойчивости растения-хозяина.
Лимитирующая роль климатических условий может выражаться в виде «дробности» патогенеза или его периодичности, что ограничивает вредоносность большинства почвенно-патогенных микромицетов на плодовых и ягодных растениях в регионах с континентальным или с резко континентальным климатом.
Основными биологическими факторами являются – количественный и качественный состав популяции почвенно-патогенных микромицетов (плотность инокулюма и наличие вирулентных расс), состояние растения-хозяина (устойчивость или восприимчивость), антагонистическая активность почвы.
Антропогенные факторы, особенно при выращивании растений в искусственных условиях, могут быть определяющими для патогенеза некоторых почвенных микромицетов. Применение новых интенсивных технологий в садоводстве и ягодоводстве может усиливать патогенез почвенных грибов и псевдогрибов, которые ранее не имели значения для этих культур.
В условиях агроценозов, как правило, наблюдается взаимодействие факторов влияющих на патогенез почвенных микромицетов, которое может усиливать или снижать их способность к патогенезу. Изменение одного из взаимодействующих факторов может значительно изменять патогенез почвенных микромицетов, в ту или иную сторону.
Глава 6. Разработка приемов защиты плодовых и ягодных культур от корневых и прикорневых гнилей
6.1. Борьба с гнилями зеленых черенков крыжовника при укоренении в пленочных теплицах.
Результаты опытов по защите зеленых черенков крыжовника от гнилей базальной части показали, что при использовании в качестве предпосадочной обработки замачивание черенков с экспозицией 15 минут в 0,2 % водных суспензиях фунгицидов наиболее эффективным на зараженном субстрате был Фундазол 50 % с.п. Этот фунгицид снижал развитие базальной гнили на черенках в 2,4 раза, по сравнению с контролем.
В борьбе с гнилями черенков крыжовника был испытан такой прием, как профилактическое опрыскивание маточных черенков крыжовника системными фунгицидами Фундазол 50% с.п. и Спортак 45% к.э. (прохлораз) за две недели до заготовки черенков. Наиболее эффективно подавляло заселение черенков видами Fusarium опрыскивание 0,2% Фундазолом, что способствовало увеличению числа укоренившихся черенков крыжовника в 2 раза (табл. 12). Опрыскивание 0,2 % Спортаком напротив увеличивало частоту выделения видов Fusarium до 100 %, против 44,4 % в контроле, что привело к ухудшению укореняемости черенков.
Таблица 12. Влияние фунгицидных обработок маточных кустов крыжовника сорта Русский и замачивания зеленых черенков в фунгицидах перед высадкой теплицу на приживаемость и корнеобразование
| Тип обработки | Приживаемость, % | Средняя длина корней, см | |
| Опрыскивание маточника | Замачивание перед посадкой | ||
| Вода | Вода | 35,71 a | 4,84 |
| Вода | Фундазол 0,2% | 33,33 a | 5,82 |
| Вода | Спортак 0,2% | 60,0 b | 8,86 |
| Фундазол 0,2% | Вода | 71,43 bc | 7,52 |
| Спортак 0,2% | Вода | 40,0 a | 4,40 |
| Фундазол 0,2% | Фундазол 0,2% | 80,0 c | 6,90 |
| Спортак 0,2% | Спортак 0,2% | 72,73 bc | 4,64 |
Для защиты зеленых черенков крыжовника сорта Колобок испытаны три штамма бактерии Pseudomonas fluorescens (№35, №163, №183). Данные штаммы испытывались по отдельности и в смеси. Результаты этого опыта показали, что все штаммы, при обработке черенков путем погружения их нижние части в бактериальный раствор с экспозицией 30 минут, были мало эффективны в борьбе с гнилью черенков. Повышение экспозиции до 60 минут повышало эффективность штаммов №35 и №163, приближая их по эффективности к Фундазолу.
Результаты опыта по применению препарата Симбионта 1 путем замачивания в нем зеленых черенков крыжовника на 30 минут совместно с 0,02 % CuSO4 или с 0,2 % Фундазолом несколько увеличивали укореняемость черенков (до 65,7 и 80,0 %, соответственно) и были на уровне эталонной обработки Фундазолом. Применение Симбионта 1 в тех же сочетаниях способом пропитки тепличного субстрата увеличивало эффективность препарата, который обеспечивал укоренение до 88,3 и 93,3 % черенков, против 61,6 % в контроле.
6.2. Борьба с гнилями зеленых черенков косточковых культур при их укоренении в пленочных теплицах.
В 2001 был проведен опыт по использованию биопрепаратов для защиты зелёных черенков вишни от почвенно-патогенных микромицетов. Наиболее эффективным было заблаговременное внесение гранул Кетомиума в пленочные пакеты с торфо-песчаным субстратом, которое в 2 раза снижало поражение зеленых черенков гнилями.
Влияние биологического препарата Агат 25 К на приживаемость и укореняемость зеленых черенков клонового подвоя вишни было не равнозначным и противоречивым, причём прослеживалась четкая тенденция снижения числа укоренных растений при повышении концентрации препарата с 0,01% до 0,05%. Пропитка почвенного субстрата 0,15 % водной суспензией фунгицида Топсин М 70 % СП была более эффективной, чем замачивание черенков в этом препарате, и обеспечивала приживаемость 85 % черенков против 57,5 %, соответственно.
Второй опыт (2002 г.) заключался в обработке тепличных субстратов биопрепаратами (внесение перед высадкой черенков). В опыте использовались Агат 25 К – 1,0 %, Кетомиум – 1,0 %, Микофунгицид (на основе хламидоспор и мицелия Trichoderma viride) – 1,0 % и фунгицид Топсин М – 0,15 % (препарат-эталон). Применение биологических препаратов с черенками клонового подвоя Измайловский (ПН) в контейнерах было мало эффективным или заметно снижало выход подвоев со стандартной корневой системой, как в варианте с микофунгицидом – снижение до 30 %, так и в варианте с пониженной концентрацией агата (0,5 %). В варианте с черешневым подвоем Колт, который хуже укоренялся и образовывал крупные каллусы на базальном срезе (от 1 до 5 см3), применение биопрепаратов заметно увеличивало выход подвоев с хорошо сформированной корневой системой. В частности, 1 % Агат увеличивал выход в 2 раза, также как и Кетомиум, а Микофунгицид в 2,8 раза.
В 2005 году был заложен опыт по испытанию двух налипателей, препятствующих смыву фунгицидов с базальной части, это 5% агар-агара и 50% водоэмульсионной краски при укоренении зеленых черенков сливы сорта Евразия 21. Для защиты черенков также использовали Применяли фунгициды Топсин М, Фундазол и Эупарен мульти. Укореняемость в опыте 2005 г. черенков в контрольном варианте составила 40 %, применение стимулятора ризогенеза – корневина (аналога ауксина) не способствовала увеличению укореняемости в среднем по всему опыту. Минимальная укореняемость наблюдалась при использовании в качестве налипателя агар-агара от 0 до 10,4 %. Применение водоэмульсионной краски обеспечивало укоренение у 65 % черенков сливы, это в 1,2-1,6 раза выше, чем в контрольных вариантах. Использование Фундазола и Эупарена мульти совместно с водоэмульсионной краской значительно снижало поражение коры черенков гнилями (в 1,8-2 раза) в зоне корнеобразования. Для контактного фунгицида Эупарен-мульти сохранение этого препарата с помощью водоэмульсионной краски (ВЭК) на черенках увеличило его эффективность в 2 – 6 раз, по сравнению с замачиванием черенков в водной суспензии фунгицида.
В 2007 году были продолжены исследования по применению налипателей для сохранения фунгицидов на базальной части зеленых черенков при их укоренении в теплице. В качестве налипателей испытывались водоэмульсионные краски: акриловая и латексная. Латексная краска заметно снижала эффективность Фундазола и Топсина М, по сравнению и акриловой краской. Особенно сильно такое снижение было заметно для Топсина М, так при использовании его с латексной краской приживаемость черенков составляла 28,6 % (19,0 % - с хорошо развитой корневой системой), а при использовании водной суспензии фунгицида 44 % (40 %, соответственно). В каждом варианте этого опыта с налипателями были свои наиболее эффективные фунгициды, В частности, при использовании латексной краски с Максимом укореняемость была 63,1 % (57,9 %) против 39,1 % (30,4 %) в контроле без обработок. Фундазол показал наибольшую эффективность в варианте с акриловой краской, укореняемость 91,7 % (87,5 %) против 39,1% (30,4 %) в контроле, а Ридомил голд оказался более эффективен в воде, без налипателей – 90,5 % (66,7 %) против 39,1 % (30,4 %).
По результаты своих исследований, мы пришли к выводу, что для полной защиты зеленых черенков от гнилей одной обработки бывает не достаточно, даже при использовании налипателей. Необходимо проводить 2 - 4 обработки фунгицидами во время укоренения и роста корней. Профилактические обработки также необходимы для борьбы с гнилями листьев, особенно серой гнилью, которая как показали наблюдения, представляет серьезную опасность, особенно в годы с влажным летом.
В 2008 году при проверке данного способа в производственных условиях, в тепличном комплексе ГУ ОС «Центральная» ВСТИСП, были включены дополнительные опрыскивания фунгицидами укореняемых черенков, в период корнеобразования. Обработки проводились по следующей схеме: ВЭК + 0,2 % Фундазол (кратковременное погружение перед посадкой), 0,2 % фундазол (пропитка почвы через две недели); 2 - 0,15 % хорусом (опрыскивания против серой гнили с интервалом 14 дней) и пропитка почвы 0,2 % фундазолом через 20 дней (табл. 13).
Таблица 13. Влияние предлагаемого способа защиты на укореняемость зеленых черенков вишни и сливы при их укоренении в производственных условиях, в 2008 г.
| Культура | Сорт, подвой | Укореняемость, % | |
| средняя за 2 года до проведения испытания | 2008 г. | ||
| Вишня | Светлая | 30,0 | 85,0 |
| Владимирская | 28,5 | 75,0 | |
| Подвой ПН | 45,7 | 92,0 | |
| Ардатовская | 25,7 | 75,0 | |
| Слива | Скороспелка красная | 37,8 | 87,5 |
Применение разработанной системы защиты зеленых черенков вишни и сливы увеличило их укореняемость в 2 - 2,5 раза, по сравнению с предыдущими годами, когда система защиты в полном объеме не проводилась. Рекомендованный способ защиты зеленых черенков от микозных гнилей способствовал повышению качества укорененных черенков в сравнении с данными, предшествующими началу испытания. В частности, у сортов вишни Владимирская и Светлая выход саженцев первого сорта увеличился в 2,5 и 2,7 раза, а у клонового подвоя вишни Измайловский (ПН) – в 3 раза, а у сливы сорта Скороспелка красная – в 2,8 раз, соответственно.
6.3. Борьба с корневыми и прикорневыми гнилями плодовых культур в первом поле питомника
Первый рекогносцировочный опыт по защите саженцев был заложен в производственных условиях в 2004 году. Была проведена предпосадочная обработка корней в глиняной болтушке, содержащей 0,2 % фундазола. Учеты, проведенные в 2005 году, показали, что в вариантах с обработкой таким способом значительно снизились выпады подвоев. Так, на клоновом подвое 54-118 выпады по сравнению с контролем сократились почти в 6 раз, а на подвоях 62-396 и ММ 106 в 3,6 и 5,3 раза, соответственно. На всех обработанных клоновых подвоях наблюдалось снижение в 2-2,5 раза числа растений с угнетением роста.
В 2006 году было расширен сортимент применяемых фунгицидов таким образом, чтобы они своим фунгицидным действием перекрывали большее количество видов почвенно-патогенных микромицетов.
Обработка подвоев смесью фунгицидов (Фундазол + Ридомил Голд МЦ) обеспечивала приживаемость растений на 100 %, а биологическую эффективность борьбы с болезнями до 97,5 % (через месяц после обработки). Обработка одним фундазолом также была эффективна и обеспечивала приживаемость на уровне 99,2 %, а биологическую эффективность борьбы с болезнями до 92,6 % (табл. 14).
Обработка подвоев перед посадкой в первое поле питомника смесью фунгицидов обеспечивала приживаемость растений на 88,5 % (через полтора года после посадки), а приживаемость окулировок здесь, соответственно, составила 91,6 %, в то время как сохранность подвоев в контроле была – 63,1 %, а приживаемость окулировок – 75,3 %. В сентябре 2007 года выход стандартных саженцев в варианте (Ридомил + Фундазол) составил 81,4 %, против варианта без обработки – 47,2 %.
Таблица 14. Эффективность применения предпосадочной обработки подвоев яблони и её влияние на приживаемость растений и их состояние (2006 г.)
| Вариант | Приживаемость % | Пораженность в баллах | Биологическая эффективность |
| Фундазол 0,2%+ глиняная болтушка | 99,2 | 0,09 | 92,6 |
| Фундазол 0,2%+ Ридомил Голд 0,2%+ глиняная болтушка | 100,0 | 0,03 | 97,5 |
| Контроль без обработки | 89,7 | 1,21 | - |
6.4. Борьба с фитофторозными гнилями корней малины
Первый опыт по борьбе с этой болезнью был заложен в 1994 году в селекционных молодых посадках малины с естественным инфекционным фоном. Результаты опыта показали, что все фунгициды в той или иной мере снижали пораженность растений малины фитофторозной корневой гнилью (табл. 15).
Таблица 15. Эффективность пропитки почвы в рядах водными суспензиями фунгицидов в борьбе с корневой гнилью малины (1994)
| Фунгицид | Концентрация, % | Средний балл поражения* | Биологическая эффективность (%) |
| Гальбен 80% СП | 0,1 | 1,22 | 55,63 |
| 0,2 | 1,42 | 48,36 | |
| Акробат МЦ 69% СП | 0,1 | 1,02 | 62,91 |
| 0,2 | 0,97 | 64,73 | |
| Ридомил 25% СП | 0,1 | 0,85 | 69,10 |
| 0,2 | 0,85 | 69,10 | |
| Сандофан М 67% СП | 0,1 | 1,25 | 54,54 |
| 0,2 | 1,55 | 43,63 | |
| Контроль | - | 2,75 | - |
Примечание: *- оценка по 5-ти бальной шкале (0 – растение внешне здорово, менее 20% корней некротизированы; 4 балл – растение погибло, 100 % корней загнило).
Наиболее эффективно снижал развитие болезни Ридомил 25 % СП (Б.Э. = 69,1%), причем увеличение концентрации рабочего раствора фунгицида с 0,1 % до 0,2 % не влияло на эффективность препарата. Вторым по эффективности был Акробат МЦ 69 % СП, который снижал развитие корневых гнилей в 2,7-2,8 раза, по сравнению с контролем. Фунгициды Сандофан М и Гальбен были менее эффективны (Б.Э.= 43,6 – 55,6 %), причем их эффективность несколько снижалась с увеличением концентрации.
В 1997 году опыт по оценке влияния микрорельефа участка на эффективность фунгицидов в борьбе с фитофторозными гнилями корней малины показал, что необработанные контрольные растения, росшие на делянках с повышенным микрорельефом, были в 2 раза менее поражены корневой гнилью, чем такие же растения в понижениях. На делянках обработанных Ридомилом и расположенных на повышении, средний бал поражения был всего 0,34, а на понижении – в два раза больше. Если на повышенных участках биологическая эффективность Сандофана М была сравнима с таковой у Ридомила (64,2 % против 68,8 %), то на пониженных делянках эффективность Сандофана М снижалась до 39,4 % против практически не изменившего своей эффективности Ридомила (БЭ = 66,5 %).
В 2000 году в полевых условиях испытали препарат на основе лактата хитозана – Агрохит. Предпосадочное 30-минутные погружения в 1 % (п.п.) Агрохит увеличивали рост растений малины примерно на 25 % в сравнении с контролем на возвышенном участке. На пониженном участке в варианте с Акробатом и в контроле произошло заметное ослабление роста растений малины (соответственно на 17 и 25 %). Это было связано с поражением корней растений фитофторовыми оомицетами, более активными во влажных условиях.
Таблица 16. Эффективность защитных мероприятий при посадке малины в борьбе с фитофторозной корневой гнилью (2004)
| Виды грибов | Частота выделения оомицетов из почвы, % | |||
| не обработанные | обработанные | |||
| Киржач (старый) | Патриция | Калашник | Таганка | |
| Phytophthora fragariae var.rubi | 66,7 | 83,3 | 0 | 0 |
| Ph. nicotianae var. | 50,0 | 16,7 | 16,7 | 0 |
| Phytophthora sp. | 33,3 | 0 | 0 | 0 |
| Ph. cactorum | 16,7 | 11,1 | 0 | 16,7 |
| Pythium spp. | 33,3 | 66,7 | 16,7 | 83,3 |
| Средний балл поражения | 2,36 | 3,52 | 0,26 | 0,17 |
| Биологическая эффективность, % | - | - | 92,6 | 95,2 |
В 2004 году было проведено производственное испытание защитных мероприятий против фитофторозной гнили корней малины в производственных условиях. Результаты испытания показали, что обработка корней малины перед посадкой фунгицидом Ридомил Голд МЦ и летняя пропитка почвы в рядах Сандофаном М, практически предотвратила развитие болезни в условиях ее эпифитотии в этом году на необработанных участках. Развитие болезни было в 13,5-20,7 раза ниже, чем на сорте Патриция, который был оздоровлен, но высажен без обработки фунгицидами (табл. 16).
Глава 7. Методологические подходы к планированию и разработке защитных мероприятий в борьбе с корневыми и прикорневыми гнилями плодовых и ягодных культур.
На основе результатов исследований были разработаны схемы защиты плодовых и ягодных культур от корневых и прикорневых гнилей, которые основываются на учете уязвимых для почвенно-патогенных микромицетов фаз развития этих культур или этапов выращивания. Наибольшее внимание, при разработке данных схем защиты, уделялось профилактическим обработкам.
Основное внимание в этих схемах защиты уделяется профилактическим мероприятиям при производстве посадочного материала плодовых и ягодных культур. Борьба с корневыми и прикорневыми гнилями на этапах размножения и выращивания посадочного материала снижает риск возникновения этих болезней на промышленных плантациях.
Для повышения эффективности предложенных схем защиты можно использовать разработанные нами относительно простые методы диагностики и регрессионного прогноза.
ГЛАВА 8. РАСЧЕТ ЭКОНОМИЧЕСКОЙ ЭФФЕКТИВНОСТИ
8.1. Расчет экономической эффективности оригинального метода диагностики корней малины и прикорневой почвы на зараженность Phytophthora fragariae var. Rubi
Для расчета экономической эффективности предложенного нами метода диагностики возбудителя фитофторозной гнили корней малины сравнивали его с методом Дункана [Duncan, 1990], широко используемого до недавнего времени в Европе для тестирования патогена Phytophthora fragariae var. Rubi
Таблица 17. Материальные затраты на тестирование одного почвенного образца на зараженность Phytophthora fragariae var. Rubi, руб.
| Статья расхода | Оригинальный метод | Метод Дункана |
| Электроэнергия | 4,2 | 31,1 |
| Отопление | 5,3 | 39,2 |
| Водоснабжение | 3,5 | 25,9 |
| Амортизация оборудования | 8,3 | 16,6 |
| Амортизация помещения | 1,2 | 27,3 |
| Зарплата с начислениями | 102,3 | 433,1 |
| Расходные материалы | 31,9 | 90,1 |
| Сумма прямых затрат | 155,7 | 663,3 |
| Общепроизводственные затраты | 141,9 | 475,2 |
| Себестоимость теста | 297,6 | 1138,5 |
Из данных расчета (табл. 17) видно, что материальные затраты на проведение диагностики одного почвенного образца оригинальным методом, по сравнению с методом Дункана, в 3,8 раза меньше. Так, себестоимость диагностики одного образца почвы или растения нашим методом составят 297,6 руб., а аналогичным методом диагностики по Дункану увеличивается до 1138,5 руб. Тем не менее, при одновременном тестировании предлагаемым методом десяти и более образцов себестоимость теста одного образца снижается еще в 1,5-2 раза.
8.2. Экономическая эффективность предлагаемого способа защиты укореняемых зеленых черенков от микозных гнилей, при получении подвоев косточковых культур в сравнении со стандартным
Таблица 18. Экономическая эффективность предлагаемого способа защиты укореняемых зеленых черенков от микозных гнилей, при получении подвоев косточковых культур в сравнении со стандартным
| Показатели | Единица измерения | Предлагаемый метод защиты | Практикуемый метод защиты |
| Выход стандартных подвоев (на 50 м) | шт. | 14585 | 6035 |
| Стоимость 1 подвоя | руб. | 25 | 25 |
| Стоимость полученных подвоев | руб. | 364625 | 150875 |
| НДС 18% | руб. | 65632,5 | 27157,5 |
| Сумма полученная от реализации саженцев с учетом НДС | руб. | 298993,5 | 123718,5 |
| Расходы на производство подвоев | |||
| Электроэнергия | руб. | 6751,5 | 6751,5 |
| Водоснабжение | руб. | 4580 | 4580 |
| Амортизация оборудования, текущий ремонт | руб. | 3519,5 | 3519,5 |
| Ядохимикаты (кг, руб.) | руб. | 6249,5 | 10170,3 |
| Зарплата с начислениями | руб. | 33120,3 | 30109,7 |
| Расходные материалы | руб. | 1130,5 | 790,5 |
| Сумма прямых затрат | руб. | 55353,3 | 50922,5 |
| Общепроизводственные затраты | руб. | 47050,3 | 43284,1 |
| Всего затрат | руб. | 102403,6 | 99206,6 |
| Себестоимость 1 подвоя | руб. | 7,0 | 16,4 |
| Прибыль | руб. | 178589,9 | 29511,9 |
| Рентабельность | % | 174,4 | 29,7 |
Применение разработанного нами метода защиты зеленых черенков плодовых и ягодных культур при их укоренении в теплице от микозных гнилей также дает значительный экономический эффект. Это достигается тем, что при использовании данного метода происходит увеличение укореняемости зеленых черенков в 2 раза, также происходит увеличение выхода стандартных подвоев в 1,5 – 3 раза, в зависимости от типа и формы подвоя (табл. 18).
В отличие от стандартного способа защиты, где использовалась предпосадочная пропитка почвы фунгицидами широкого спектра действия, предлагаемый способ предусматривает применение в качестве налипателя для фунгицида водоэмульсионной акриловой краски, что продлевает период защитного действия в два раза. Предлагаемый способ также снижает расход фунгицида в 2 раза, что дает снижение материальных затрат на фунгициды, а также снижает пестицидную нагрузку на окружающую среду.
Сравнивая разработанный метод защиты укореняемых зеленых черенков косточковых культур в теплице, с ранее используемым, установлено, что предлагаемый метод обеспечивает рентабельность 174,4 %, против 29,7% при традиционном (табл. 18).
ОБЩИЕ ВЫВОДЫ
1. Установлено, что в настоящее время на Европейской части России из всех изученных почвенных патогенов для земляники наибольшую опасность представляют такие виды, как Phytophthora cactorum и Rhizoctonia solani, а также комплекс почвенных микромицетов (Cylindrocarpon destructans, Pythium spp., Fusarium spp. и др.), вызывающий черную корневую гниль земляники садовой.
2. Отмечено снижение вредоносности фитофторозной гнили рожков земляники (возб. Ph. cactorum), связанное со сменой сортамента земляники, в ходе которой восприимчивые сорта постепенно заменялись устойчивыми.
3. Установлено, что в последние годы, в условиях открытого грунта, повысилась вредоносность ризоктониозной корневой и прикорневой гнили (возб. Rhizoctonia solani) на землянике и на плодовых культурах в питомнике.
4. Была выявлена новая для России и вредоносная болезнь малины – фитофторозная корневая гниль (возб. Phytophthora fragariae var. Rubi,), установлено влияние на её распространение и вредоносность погодных условий и некоторых агротехнических приемов, характерных для средней полосы России. Разработаны методы диагностики корней малины и прикорневой почвы на зараженность возбудителем фитофторозной корневой гнили Ph. fragariae var. rubi, с помощью плавающих приманок – листьев и черешков листьев малины красной, отличающиеся своей простотой и доступностью, наличие патогена устанавливается в 8-9 раз быстрее, по сравнению с аналогичным зарубежным методом. Рассчитаны две регрессионные модели прогноза развития фитофторозной гнили корней малины в зависимости от суммы осадков за три месяца (апрель, май, июнь) и коэффициента отношения суммы осадков к максимальной средней температуре, которые позволяют с точностью 82,4 % и 88,2 %, прогнозировать развитие болезни в текущем году.
5. Впервые для условий России выявлен комплекс оомицетов (Phytophthora nicotianae, Ph. citricola, Ph. cactorum, Ph. sp.), встречающийся в том или ином видовом соотношении в насаждениях малины красной в средней полосе России и Кабардино-Балкарии. Было выявлено, что непродолжительное затопление участка может усиливать патогенность «сопутствующих» видов Phytophthora, которые в этих случаях могут вызывать развитие сильной корневой гнили.
6. Полегание сеянцев плодовых культур в разных условиях выращивания вызывали такие виды, как Pythium spp., Ph. cactorum, R. solani, Fusarium spp. Виды R. solani и Fusarium spp. (F. avenaceum, F. lateritium) вызывали сильные корневые гнили сеянцев в условиях теплицы, а оомицеты Pythium spp., Ph. cactorum в условиях открытого грунта.
7. Установлено, что гриб Ryizoctonia solani является основным и наиболее агрессивным патогеном для зеленых черенков плодовых и ягодных культур, укореняемых в теплице. Заражение зеленых черенков в период укоренения этим патогеном и другими микромицетами – возбудителями прикорневых гнилей сказывается на качестве посадочного материала, отрицательно влияет на их приживаемость при доращивание в открытом и защищенном грунте.
8. Разработан метод «модельных» зеленых черенков для диагностики почвы на зараженность комплексом микромицетов – возбудителей корневых и прикорневых гнилей плодовых и ягодных культур. С его помощью разработана методика оценки риска возникновения корневых и прикорневых гнилей, а также рассчитаны регрессионные уравнения прогноза развития гнилей зеленых черенков плодовых и ягодных культур в период их укоренении в теплице.
9. Результатом исследований явилось создание системы учетов и диагностики корневых и прикорневых гнилей плодовых культур с использованием оптимальных сроков для учета болезней и проведения анализов. Данная система базируется в основном на разработанных нами методах диагностики с помощью биоприманок и предусматривает применение элементов прогноза для определения риска возникновения и развития болезней, вызываемых некоторыми почвенными патогенами.
10. Разработана концепция изменения патогенеза почвенных микромицетов на плодовых и ягодных растениях в условиях агроценозов, в которой оценивается влияние трех основных факторов (почвенно-климатического, биологического и антропогенного) и их взаимодействие, на изменение патогенеза возбудителей корневых гнилей. В данной концепции также рассматривается регулирование факторов, влияющих на патогенез почвенных микромицетов, которое является основным элементом при разработке защитных мероприятий с возбудителями корневых и прикорневых гнилей плодовых и ягодных культур.
11. Использование системных фунгицидов широкого спектра действия, Фундазол 50 % СП и Топсин М 70% СП для предпосадочной обработки зелёных черенков и пропитки тепличного субстрата, снижает поражение черенков гнилями в 1,5-2 раза и увеличивает их укореняемость в 1,5-1,7 раза. Использование водоэмульсионной акриловой краски (ВЭК), как налипателя, для обработки черенков совместно с фунгицидом увеличивает эффективность системных фунгицидов в 1,5 – 3 раза, а контактных в 2-6 раз, по сравнению со стандартной предпосадочной обработкой черенков водной суспензией этих фунгицидов.
12. Установлено, что применение предпосадочной обработки корней клоновых подвоев яблони глиняной болтушкой с фунгицидами (0,2 % Ридомил Голд МЦ + 0,2 % Фундазол) в обычные годы в 1,5 раза снижало количество выпадов в 1 поле питомника и в 1,5-2 раза увеличивала выход стандартных саженцев.
13. Фунгициды Ридомил 25 % СП, Акробат 67 % СП, Ридомил Голд МЦ снижали развитие фитофторозных корневых гнилей малины красной в 2-3 раза. Для защиты оздоровленного посадочного материала малины от фитофторозной корневой гнили в год эпифитотии было достаточно двух обработок фунгицидами (предпосадочной и пропитка в рядах в июне).
14. Разработанные схемы защиты плодовых и ягодных культур от корневых и прикорневых гнилей основываются на учете уязвимых для почвенно-патогенных грибов фаз развития этих культур или этапах выращивания. Наибольшее внимание при разработке данных схем защиты уделялось профилактическим обработкам. Основное внимание в схемах защиты уделяется профилактическим мероприятиям при производстве посадочного материала плодовых и ягодных культур. Борьба с корневыми и прикорневыми гнилями на всех этапах производства посадочного материала снижает риск распространения этих болезней на промышленных плантациях.
Предложения производству
- На основе полученных результатов разработаны и внедрены в производство четыре методических указания:
- Методические указания «Усовершенствованная система фитосанитарии в питомниководстве» (Москва, 2001)
- Методические указания «Методические указания по диагностике и учету болезней корней и стеблей земляники и малины, передающихся через почву» (Москва, 2001)
- Методические указания «Комплексная система защитных мероприятий в насаждениях яблони в Нечерноземной зоне РФ» (Москва, 2006).
- Методические указания по долгосрочному прогнозу снижения численности вредных организмов в садах (Москва, 2006)
- Диагностировать наличие в прикорневой почве и корнях малины карантинного объекта оомицета Phytophthora fragariae var. rubi, а также других видов Phytophthora на малине с помощью разработанных нами методов биоприманок, с использованием молодых листьев и черешков листьев малины красной.
- Использовать для прогноза интенсивности развития фитофторозных корневых гнилей малины в условиях средней полосы России формулу регрессионного прогноза (У=9,94 х – 37,31), где х – отношение суммы осадков за апрель, май и июнь к максимальной средней температуре в июне.
- Для диагностики пригодности тепличных субстратов для укоренения в них зеленых черенков плодовых и ягодных культур использовать метод «Модельных черенков». Для прогноза риска возникновения гнилей черенков крыжовника, вишни и сливы на основе предлагаемого метода использовать формулы регрессионного прогноза: У=5,30х-34,13, рассчитываемую по коэффициенту некротизации модельных черенков, или формулу: У=0,89х+7,48 – упрощенную, рассчитываемую по общей некротизации.
- Для защиты зеленых черенков плодовых и ягодных культур в период укоренения в теплице, от микозных гнилей проводить следующие защитные мероприятия:
а) профилактическую обработку 0,1% Фундазолом 50 % СП за 2 недели до заготовки черенков;
б) перед посадкой обрабатывать нижнюю часть черенков 50% водным раствором акриловой водоэмульсионной краски, содержащей фунгицид: 0,2 % Фундазол или 0,15 % Топсин М, или 0,3 % Эупарен мульти 50 % ВДГ;
в) в условиях жаркого лета и нагреве тепличного субстрата выше 25°С на старых грунтах проводить пролив черенков и субстрата 0,2% фундазолом или 0,15 % Топсином М через 2-3 недели после посадки черенков на укоренение;
г) при пасмурной и прохладной погоде во время укоренения для борьбы с серой гнилью проводить опрыскивание 0,2 % Эупареном мульти или 0,3 % Хорусом 75 % ВДГ, в случае установления таких погодных условий более двух декад, обработку повторить через 7-10 дней.
6. Для снижения риска развития корневых гнилей в первом поле плодового питомника необходимо обрабатывать корни высаживаемых подвоев глиняной болтушкой, содержащей смесь фунгицидов: 0,2 % Ридомил Голд МЦ + 0,2 % Фундазол. В годы с экстремальными погодными условиями (очень влажное или засушливое лето) проводить дополнительные обработки путем полива фунгицидами прикорневой почвы в рядах с нормой расхода рабочего раствора 2000-2500 л/га. В год с сухим летом для дополнительной обработки использовать 0,2 % Фундазол или 0,15 % Топсин М, а в сезон с избыточным увлажнением - 0,2 % Ридомил Голд МЦ.
7. При разработке защитных мероприятий для борьбы с корневыми и прикорневыми гнилями в питомниках и маточниках, а также молодых промышленных насаждениях (не вступивших в пору плодоношения) плодовых и ягодных культур взять за основу разработанные схемы защиты, с учетом особенностей данного региона.
Список публикаций по теме диссертации
- Головин С.Е. Пути распространения фитофторозной гнили рожков и борьбы с ней на маточниках земляники // сб. науч. тр. ВНИИС им. И.В. Мичурина, Мичуринск, 1990.-С. 195-196.
- Головин С.Е. Предупреждение загнивания черенков черной смородины // Садоводство и виноградарство, 1991. № 4.-С. 20-21.
- Головин С.Е. Основные виды почвенных грибов, связанные с гнилью зеленых черенков плодовых и ягодных культур, и методы их диагностики // Плодоводство и ягодоводство России. - М., 1994. –Т. 1., С. 118-123.
- Головин С.Е., Павлова Н.Ю. Использование системных фунгицидов для борьбы с гнилями зеленых черенков крыжовника при окоренении в пленочных теплицах //Сб. конф. Актуальные проблемы развития питомниководства и науч. обеспечение отрасли. Тез. докл., М., 1993.-С. 42-44.
- Головин С.Е., Метлицкий О.З. Влияние фитопатогенных грибов на развитие гнилей черенков смородины и крыжовника // Вест. Российской академии с./х. наук. 1993. №5. С. 31-34.
- Головин С.Е., Павлова Н.Ю. Влияние фунгицидов на укореняемость зеленых черенков крыжовника // Рабочее совещание: «Регуляторы роста и развития растений». - Тез. докл. ТСХА, М., 1992.-С. 118.
- Головин С.Е. Корневые гнили малины в питомниках, причины возникновения и борьба с ними // Ягодоводство в Нечерноземье - тр. ВСТИСП, М., 1993. – С. 30-38.
- Головин С.Е., Павлова Н.Ю. Защита зеленых черенков крыжовника от гнилей при их укоренении в пленочных теплицах с использованием искусственного тумана // ж. Садоводство и виноградарство. - №5(6), 1994. – С. 12-13.
- Метлицкий О.З., Белозёрова Г.С., Головин С.Е. Пути использования биоиндикаторов при диагностике здоровья почв // Тез. докл. координационного совещания: «Контроль фитосанитарного состояния с/х культур». - М., 1994.-С.41-42
- Головин С.Е. Фитофтороз малины – новая опасная болезнь для маточников и промышленных плантаций России // Паразитарное загрязнение мегаполиса Москвы - Тез. док. научно-практическое совещание, М., 1994. – С. 14
- Павлова Н.Ю., Белозёрова Г.С., Павлова А.Ю., Головин С.Е. Применение препарата Симбионт-1 в плодовом питомнике// Тез. докл. III межд. конф. Регуляторы роста и развития растений, М., 1995.-С. 172-173.
- Головин С.Е. Фитофтороз малины – новая опасная болезнь в маточниках и промышленных плантациях России // Тез. докл. Всеросс. совещание: «Молодые ученые садоводству России». - М., ВСТИСП, 1995. – С. 222 – 225.
- Головин С.Е. Фитофторозная гниль корней малины, причины возникновения, диагностика и меры борьбы // Сб. научн. тр. ВСТИСП. «Плодоводство и ягодоводство России". – М. – 1995, Т.2. – С. 203-209
- Метлицкий О.З., Головин С.Е. Фитофтороз красной малины в России // Тез. докл. Все-росс. съезда по защите растений «Защита растений в условиях реформирования агропромышленного комплекса».- СПб.- 1995.- С. 65
- Головин С.Е. Основные виды почвенных грибов, вызывающих гибель сеянцев семечковых и косточковых культур в условиях открытого и защищенного грунта // Сб. научн. тр. ВСТИСП. Плодоводство и ягодоводство России. – М. – 1996, Т.3. – С. 188-192
- Головин С.Е. Комплекс фитофторовых грибов на малине, особенности диагностики // Сб. научн. тр. ВСТИСП - Плодоводство и ягодоводство России. – М. – 1997, Т.4. – С. 172-179
- Головин С.Е. Корневые гнили ягодных культур // Ж. Защита и карантин растений, М., 1998, №7. - С.34-35
- Метлицкий О.З., Головин С.Е. Фитофтороз на малине // Ж. Защита и карантин растений, 1996, №11 – С. 46-47
- Головин С.Е. Фитофторозная гниль корней малины в России и ее диагностика // Актуальные вопросы теории и практики защиты плодовых и ягодных культур от вредных организмов в условиях многоукладного с.-х-ва // Тез. докл. Всеросс. совещание – М., ВСТИСП. – 1998. – С. 346 – 349.
- Головин С.Е., Павлова А.Ю. Млечный блеск в питомниках и маточниках косточковых культур, его распространение с посадочным материалом и влияние на укореняемость зеленых черенков вишни // Плодоводство и ягодоводство России, 1998; Т.5, - С. 158-164
- Головин С.Е. Интродукция новых патогенных расс фитофторовых грибов с посадочным материалом // тез. конф. - Теория и практика борьбы с паразитарными болезнями, М., 1999. С. 19-18.
- Головин С.Е. Проблемы распознавания фитофторовых грибов на ягодных, декоративных и цветочных культурах и разработка способов их диагностики // Сб. научн. тр. ВСТИСП. Плодоводство и ягодоводство России. – М. – 1999. – Т.6. – С. 197 – 204.
- Головин С.Е. Почвенная микофлора как ограничивающий фактор размножения и выращивания плодовых и ягодных культур // Сб. научн. тр. ВСТИСП. Плодоводство и ягодоводство России. – М. – 2000. – Т.7. – С. 205-215
- Кашин В.И., Дроздовский Э.М., Головин С.Е., Романченко Т.И., Белозёрова Г.С., Наумова Л.В., Артюхов В.Ф., Корнацкая Г.А., Аристов А.Н., Булыгина Л.В //Справочник-определитель вредителей и болезней плодовых культур. - ВСТИСП. - М. – 2000. – 316 с.
- Головин С.Е. Методические указания по диагностике и учёту болезней корней и стеблей земляники и малины, передающихся через почву // ВСТИСП. М.- 2001. – 43 с.
- Метлицкий О.З., Аристов А.Н., Головин С.Е.,. Метлицкая К.В, Романченко Т.И., Зейналов А.С., Наумова Л.В. Усовершенствованная система фитосанитарии в питомниководстве // М.- ВСТИСП.- 2001.- 154 с.
- Головин С.Е. Причины вспышки фитофтороза корней малины в Подмосковье в 2001 году // Сб. научн. тр. ВСТИСП - Плодоводство и ягодоводство России. – М. – 2002. – Т.9. – С. 334-342
- Головин С.Е., Дроздовский Э.М., Белозерова Г.С., Романченко Т.И., Корнацкая Г.А., Наумова Л.В. Методические указания по долгосрочному прогнозу снижения численности вредных организмов в садах // ВСТИСП. - М. – 2006. – 104 с.
- Головин С.Е., Романченко Т.И. Корневые гнили плодовых культур в питомнике, вредоносность и распространенность // Сб. науч. тр. ВСТИСП.- Плодоводство и ягодоводство России. – 2004. – Т.11. - С. 376-389.
- Дроздовский Э.М., Белозерова Г.С., Романченко Т.И., Головин С.Е., Наумова Л.В. Повышение эффективности защиты садов и ягодников от вредителей и болезней в Нечерноземье (Семечковые сады) // Ж. Садоводство и виноградарство. – 2005. № 5. - С.15-18
- Дроздовский Э.М., Белозерова Г.С., Романченко Т.И., Головин С.Е. Комплексная система защитных мероприятий в насаждениях яблони в Нечерноземной зоне РФ (Методические указания) //ВСТИСП. - М. – 2006. – 115 с.
- Головин С.Е. Фитосанитарные проблемы питомниководства России спустя столетие после первых питомников И.В. Мичурина // Тр. ВСТИСП «Плодоводство и ягодоводство России» Т. ХIII, 2005. - С. 110-114
- Головин С.Е., Павлова А.Ю., Джура Н.Ю. Защита зелёных черенков сливы при укоренении в теплице с использованием фунгицидов и налипателей // Материалы 2-ого Всероссийского Съезда по защите растений “Фитосанитарное оздоровление агроэкосистем” 5-10декабря 2005 г. Санкт-Петербург. С-Пб.–2005. – Т.2.–С.271-273
- Головин С.Е. Методические подходы к фитосанитарной диагностики почвы на наличие фитопатогенных грибов и риска возникновения заболеваний растений // Тр. ВСТИСП, «Плодоводство и ягодоводство России» Т. 14, 2005. - С. 101-104
35. Белозерова Г.С., Романченко Т.И., Головин С.Е. Микозное усыхание в питомниках – причины возникновения и пути снижения вредоносности, возможности реализации биологического потенциала сада // Тез конф. Сб. «Методические аспекты создания прецизионных технологий возделывания плодовых культур и винограда» – Краснодар. – 2006.-С. 315-318.
36. Головин С.Е., Романченко Т.И. Фитосанитарные проблемы в питомниках плодовых культур // Тез. Конф. В сб. тр. ГНУ ВСТИСП, «Плодоводство и ягодоводство России» Т.18, М., 2008.-С. 73-79
37. Метлицкий О.З., Головин С.Е., Холод Н.А., Ундрицова И.А. Антракноз садовой земляники // Ж. «Агро ХХI век» 2007. №4-6.-С. 40-41
38. Метлицкий О.З., Головин С.Е., Зейналов А.С., Метлицкая К.В., Ундрицова И.А. Биологическое загрязнение экосистем насаждений ягодных культур // М.-РАСХН, ВСТИСП. 2007.-68 с.
39. Метлицкий О.З., Головин С.Е., Зейналов А.С., Метлицкая К.В., Ундрицова И.А. Защита ягодников // Ж. «Садоводство и виноградарство».-2005.- № 5.-С. 20-22.
40. Александров И.Н., Головин С.Е. Фитофторозная корневая гниль малины // Защита и карантин растений, №7, 2007.
41. Головин С.Е., Романченко Т.И. Проблемы защиты косточковых культур при производстве корнесобственного посадочного материала // Сб. тр. ГНУ ВСТИСП, «Плодоводство и ягодоводство России» Т. 20, М. 2008. - С.47-54
42. Головин С.Е. Возрастание вредоносности ризоктониоза земляники в средней полосе России // Сб. тр. ВСТИСП, «Плодоводство и ягодоводство России» Т.22, Ч.1, М. 2009. - С. 250-260.
43. Головин С.Е. Регрессионный прогноз фитофторозной гнили корней малины // Сб. тр. ВСТИСП, «Плодоводство и ягодоводство России» Т. 22, Ч. 1., М. 2009. - С.261-269.
44. Головин С.Е., Алхасов Э.Б. Метод микологической оценки субстратов для выращивания черенков плодовых культур //Тез. конф. «Методы изучения продукционного процесса растений и фитоценозов», Нальчик, 2009.-С. 57-59
45. Куликов И.М., Борисова А.А., Метлицкий О.З., Грачёва Т.А., Упадышев М.Т., Головин С.Е., Мельникова Н.Н., Романченко Т.И., Зейналов А.С. Производство и сертификация посадочного материала ягодных культур и винограда в России. Контроль качества. (Методические указания). Часть 1. Ягодные культуры (издание второе, дополненное) // ФГУ «Российский сельскохозяйственный центр). - Москва – 2009.-164 с.
46. Головин С.Е. Корневые и прикорневые гнили ягодных и плодовых культур, их диагностика (монография) // ГНУ ВСТИСП. - М.: ООО НИЦ «Инженер», 2010. - 306 с.
47. Головин С.Е., Алхасов Э.Б. Регрессионный прогноз развития гнилей зеленых черенков при их укоренении в теплице // Сб. тр. ВСТИСП, «Плодоводство и ягодоводство России». – М., 2010. - Т 24., Ч. 2. - С. 302-310.

