Синтез, свойства, биологическая активность n -гетериламидов - оксокислот и продуктов их химических превращений
На правах рукописи
МОКИН Павел Александрович
Синтез, свойства, биологическая активность N-гетериламидов -оксокислот и продуктов их химических превращений
15.00.02 – фармацевтическая химия, фармакогнозия
Автореферат
диссертации на соискание ученой степени
кандидата фармацевтических наук
Пермь – 2007
Работа выполнена на кафедре фармацевтической технологии ГОУ ВПО «Пермская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель: кандидат химических наук, доцент
Пулина Наталья Алексеевна
Официальные оппоненты: доктор фармацевтических наук,
профессор Коркодинова Любовь Михайловна
ГОУ ВПО ПГФА Росздрава
кандидат химических наук,
доцент Пименова Елена Валентиновна
ГОУ ВПО «Пермский государственный университет»
Ведущая организация:
ГОУ ВПО «Пятигорская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию»
Защита состоится «15» января 2008 г. _____ на заседании диссертационного совета Д 208.068.01 при Пермской государственной фармацевтической академии по адресу: 614990, г. Пермь, ГСП-277, ул. Ленина, 48.
С диссертацией можно ознакомиться в библиотеке Пермской государственной фармацевтической академии.
Автореферат разослан «_____» декабря 2007 г.

Ученый секретарь Е.В. Метелева
диссертационного совета,
кандидат фармацевтических наук, доцент
Общая характеристика работы
Актуальность темы. Общеизвестно, что одной из важных задач фармацевтической науки является синтез и поиск новых высокоэффективных химических соединений, обладающих низкой токсичностью, превосходящих по силе действия применяемые медицинские препараты. Научные исследования, традиционно проводимые в Пермской государственной фармацевтической академии, показывают, что соединения, полученные на основе превращений ацилпировиноградных кислот, обладают выраженным фармакологическим действием, зачастую, с сочетанием нескольких видов активности. Ранее был разработан простой препаративный метод синтеза амидов 4-арил-2-гидрокси-4-оксо-2-бутеновых (ароилпировиноградных) кислот (АрПК) на основе взаимодействия 5-арил-2,3-дигидрофуран-2,3-дионов (5-АФД) и соответствующих аминов ациклического и гетероциклического строения. В этом ряду наименее изучены N-гетериламиды АрПК, которые представляют практический интерес, благодаря наличию в своей структуре нескольких реакционных центров 1,3-дикетонного и гетероциклического фрагментов. Введение в молекулу исходных соединений потенциально биологически активных гетероциклических синтонов позволяет в определенной степени прогнозировать фармакологическое действие новых химических веществ. Интересным объектом для сравнительного изучения химического поведения гетероциклических аминов с 2,3-диоксогетероциклами является 2,3-дигидробензо[b]фуран-2,3-дион (кумарандион - КД). Образованные на его основе N-гетериламиды 2-(2-гидроксифенил)-2-оксоэтановой (о-гидроксифенилглиоксалевой) кислоты (о-ГФГК) могут обладать значительными синтетическими возможностями для получения биологически активных соединений различного строения, в том числе, растворимых в воде.
Среди важных в препаративном отношении реакций N-гетериламидов АрПК, имеющих теоретическое и практическое значение, особое место занимают их нуклеофильные превращения, при этом взаимодействие с гидразонами кетонов и замещенными гидразинами ранее не изучено. В настоящее время значительно повысился интерес к химической модификации биологически активных веществ путем комплексообразования с эсенциальными металлами. Это позволяет усиливать терапевтическое действие лигандов, выходить на новые виды биологической активности и, в ряде случаев, снижать их токсичность. Реакции N-гетериламидов АрПК и о-ГФГК с солями одно- и двухвалентных металлов ранее также не исследованы. В связи с этим, изучение синтеза, химических свойств N-гетериламидов -оксокислот, а также поиск биологически активных соединений среди продуктов химических превращений является актуальным.
Цель работы. Целью данного исследования является синтез новых биологически активных соединений в ряду N-гетериламидов -оксокислот и на основе их взаимодействия с нуклеофильными реагентами и солями одно-, двухвалентных металлов.
Задачи исследования. Для достижения поставленной цели необходимо решить следующие задачи:
- Осуществить синтез N-гетериламидов -оксокислот, содержащих в своем составе гетроциклический фрагмент с одним, двумя или тремя гетероатомами.
- Провести сравнительное изучение химического поведения N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот и 2-(2-гидроксифенил)-2-оксоэтановой кислоты в реакциях комплексообразования с дихлоридами меди, цинка, кадмия, ртути.
- Получить водорастворимые соединения на основе реакции -оксокислот с N-гетероциклическими аминами, а также взаимодействия N-гетериламидов 2-(2-гидроксифенил)-2-оксоэтановой кислоты с натрия карбонатом.
- Изучить взаимодействие N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот с гидразонами бензофенона и 9-флуоренона, этиловым эфиром гидразинэтановой кислоты.
- Изучить физико-химические свойства и особенности строения неописанных ранее продуктов синтеза.
- На основании полученных результатов фармакологического скрининга синтезированных соединений выявить вещества, обладающие высокой противомикробной, противовоспалительной и анальгетической активностью, а также изучить взаимосвязь их строения с биологическим действием.
Научная новизна. Установлено, что 2-амино-5-R-1,3,4-тиадиазолы и 2-аминобензимидазол раскрывают цикл 5-АФД с образованием N-гетериламидов АрПК, находящихся в растворе в виде таутомерных кетоенольной и -дикетонной форм. Показано, что направление реакции не меняется при взаимодействии N-гетероциклических аминов с КД, в результате чего выделены N-гетериламиды 2-(2-гидроксифенил)-2-оксоэтановой кислоты. Установлено, что при взаимодействии 2-(2-гидроксифенил)-2-оксоэтановой с гетериламинами образуются 2-(2-гидроксифенил)-2-оксоэтаноаты гетериламмония. Впервые осуществлен синтез комплексных соединений на основе N-гетериламидов АрПК с дихлоридами меди, цинка, кадмия, ртути и установлено, что исходные реагенты координируются металлами как бидентатные О-О лиганды. Установлено аналогичное химическое поведение N-гетериламидов о-ГФГК в реакциях с дихлоридами цинка и кадмия, а также получены водорастворимые 2-[2-(N-гетериламино)-2-оксоацетил]феноляты натрия. Изучены реакции N-гетериламидов АрПК с гидразонами бензофенона и 9-флуоренона и обнаружено наличие трех таутомерных форм в растворах полученных соединений. Установлено, что при взаимодействии N-гетериламидов АрПК с этиловым эфиром гидразинэтановой кислоты образуются соответствующие производные 3-арил-2-этоксикарбонилметил-2,3-дигидропиразол-5-карбоновых кислот, которые, в случае N-[2-(5-R-1,3,4-тиадиазолил)]амидов, существуют в растворах в виде двух таутомерных форм. По результатам биологических исследований комплексных соединений поданы две заявки на выдачу патента РФ на изобретения (регистрационный № 2006144010 от 11.12.2006 и № 2007128301 от 23.07.2007).
Практическая значимость. Усовершенствованы или предложены новые методы синтеза N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот, N-гетериламидов 2-(2-гидроксифенил)-2-оксоэтановой кислоты, 4-арил-2-гидрокси-4-оксо-2-бутеноатов гетериламмония, 2-(2-гидроксифениламино)-2-оксоэтаноатов гетериламмония, бис[3-арил-1-(N-гетерил)карбоксамидо-1,3-пропандионато] меди, цинка, кадмия, ртути, 2-[2-(N-гетериламино)-2-оксоацетил]фенолятов натрия, бис{2-[2-(N-гетериламино)-2-оксоацетил]фенолятов} цинка и кадмия, N-гетериламидов 4-арил-2-дифенилметиленгидразино-4-оксо-2-бутеновых кислот, N-гетериламидов 4-арил-4-оксо-2-флуоренилиденгидразино-2-бутеновых кислот, N-гетериламидов 3-арил-2-этоксикарбонилметил-2,3-дигидропиразол-5-карбоновых кислот, которые просты по выполнению и могут быть использованы как препаративные при синтезе новых биологически активных соединений.
В процессе работы синтезировано 119 неописанных в литературе соединений. Установлены некоторые закономерности биологической активности от химического строения, которые могут быть использованы в дальнейшем поиске БАВ в ряду производных N-гетериламидов -оксокислот.
Публикации. Материалы диссертационной работы отражены в 17 работах: 2 статьях в центральной печати, 5 статьях в сборниках и материалах научных конференций различного уровня и 10 тезисов докладов научных конференций.
Апробация работы. Результаты работы доложены на 70-й юбилейной итоговой Республиканской научной конференции студентов и молодых ученых «Вопросы теоретической и практической медицины» (Уфа, 2005), на VI, VII Международных научно-практических конференциях «Здоровье и образование в XXI веке» (Москва, 2005, 2006), на Международной научно-практической конференции «Фармация и здоровье» (Пермь, 2005), на Международной конференции «Приоритеты фармацевтической науки и практики» (Москва, 2006), на 61,62 Региональных конференциях по фармации и фармакологии (Пятигорск, 2006, 2007), на научной Юбилейной конференции «Актуальные вопросы современной фармации и фармацевтического образования» (Уфа, 2006), на VII конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2006), на научно-практической конференции «Новая технологическая платформа биомедицинских исследований (биология, здравоохранение, медицина)» (Ростов-на-Дону, 2006), на Российско-Китайской интернациональной научной конференции по фармакологии «Фундаментальная фармакология и фармация - клинической практике» (Пермь, 2006), на XIV Российском национальном конгрессе «Человек и лекарство» (Москва, 2007), на 3-й Всероссийской научно-методической конференции «Пути и формы совершенствования фармацевтического образования. Создание новых физиологически активных веществ» (Воронеж, 2007).
Связь задач исследования с проблемным планом фармацевтических наук. Диссертационная работа выполнена в соответствии с планом научно-исследовательских работ ГОУ ВПО «Пермская государственная фармацевтическая академия Росздрава» (№ государственной регистрации 01.9.50 007419)
Объем и структура диссертации. Диссертационная работа общим объемом 146 страниц машинописного текста состоит из введения, литературного обзора по синтезу, строению, свойствам и биологической активности N-гетериламидов ацилпировиноградных кислот (глава 1), обсуждения собственных исследований (глава 2), экспериментальной химической части (глава 3), изучения результатов биологической активности N-гетериламидов -оксокислот и продуктов их превращений (глава 4), выводов, литературы, приложения. Список литературы включает 160 работ отечественных и зарубежных авторов. Диссертация содержит 28 таблиц.
На защиту выносятся:
- Результаты синтеза новых N-гетериламидов -оксокислот и их производных на основе взаимодействия с солями с одно-, двухвалентных металлов, гидразонами бензофенона и 9-флуоренона, этиловым эфиром гидразинэтановой кислоты.
- Установление структуры полученных соединений на основании данных спектров ЯМР1Н-, ИК-, и масс-спектроскопии.
- Изучение взаимосвязи строения и фармакологической активности синтезированных соединений, а также выявление перспективных веществ для дальнейших биологических испытаний.
Основное содержание работы
1. Синтез и строение N-гетериламидов -оксокислот
1.1 Синтез и строение N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот
Для получения исходных соединений нами была использована известная реакция 5-АФД 1а-г с гетероциклическими аминами в среде инертного растворителя при эквимолярном соотношении реагентов, при комнатной температуре. В качестве гетериламинов при получении новых соединений были взяты: 2-амино-1,3,4-тиадиазол, 2-амино-5-метил-1,3,4-тиадиазол, 2-амино-5-этил-1,3,4-тиадиазол, 2-аминобензимидазол. В результате реакции выделены N-гетериламиды 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот (метод А) (2а-ч):
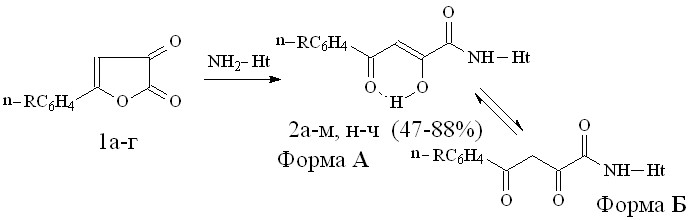
1: R=Н (а), СН3 (б), Cl (в), Br (г);
2: Ht=2-С5Н4N, R=Н (а), Cl (б), Br (в); Ht=3-С5Н4N, R=Н (г), Cl (д); Ht=2-С5Н3BrN, R=Н (е), Cl (ж); Ht=С3Н2NS, R=Н (з), Cl (и), Br (к); Ht=С11Н11N2О, R=Н (л), Cl (м); Ht=С2Н1N2S, R=Н (н), Cl (о), CН3 (п); Ht=С3Н3N2S, R=Н (р), Cl (с), CН3 (т); Ht=С4Н5N2S, R=Н (у), Cl (ф), CН3 (х); Ht=С7Н5N2, R=Н (ц), Cl (ч).
Где: Ht=2-С5Н4N (2-пиридил), С5Н3BrN [2-(5-бромпиридил)], 3-С5Н4N (3-пиридил), С3Н2NS (2-тиазолил), С2Н1N2S [2-(1,3,4-тиадиазолил)], С3Н3N2S [2-(5-метил-1,3,4-тиадиазолил)], С4Н5N2S [2-(5-этил-1,3,4-тиадиазолил)], С7Н5N2 (2-бензимидазолил), С11Н11N2О [4-(2,3-диметил-5-оксо-1-фенил-3-пиразолин)].
Соединения 2н-ч были синтезированы нами впервые. По данным спектров ЯМР1Н гетериламиды 2ф-ч в растворе ДМСО-d6 енолизованы нацело и содержат 100% кетоенольной формы А, в то время как гетериламиды 2н-у содержат еще 8-11% -дикетонной формы Б.
N-[2-(5-R-1,3,4-Тиадиазолил)]амиды 2р,у получены нами также в результате реакции метилового эфира АрПК 3 с соответствующими гетероциклическими аминами (метод Б):

R=Me (р), Et (у).
Вещества, синтезированные двумя методами, были идентичны по физико-химическим и спектральным характеристикам, значению Rf при ТСХ. Однако выход соединений 2р,у значительно ниже, чем в методе А, что связано, по видимому, с конкурентной реакцией образования продуктов по группе С2=О эфира 3. Таким образом, данный способ уступает классическому способу раскрытия 5-АФД аминами и в дальнейшем для синтеза целевых N-гетериламидов АрПК нами не использовался.
1.2 Синтез и строение N-гетериламидов 2-(2-гидроксифенил)-2-оксоэтановой кислоты
Известно, что циклическим аналогом 2-(2-гидроксифенил)-2-оксоэтановой (о-гидроксифенилглиоксалевой) кислоты (о-ГФГК) 4 является кумарандион 5. В продолжение изучения химического поведения 2,3-диоксогетероциклов в реакции с гетериламинами, нами исследовано взаимодействие КД 5 с гетероциклическими аминами различного строения в условиях, аналогичных образованию соединений 2, в результате чего выделены соответствующие N-гетериламиды 2-(2-гидроксифенил)-2-оксоэтановой кислоты (6а-з):
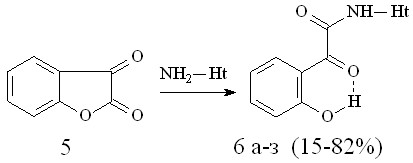
6: Ht=С5Н3BrN (а), 3-С5Н4N (б), 4-С5Н4N (в), С3Н2NS (г), С2Н1N2S (д), С3Н3N2S (е), С4Н5N2S (ж), С7Н5N2 (з).
Спектральные характеристики соединений 6а-з свидетельствует об их существовании в форме с ВВС Н-хелатного типа. По-видимому, образование соединений 6а-з происходит в результате нуклеофильной атаки аминогруппы исходного гетериламина на наиболее электроотрицательный атом углерода С2 кумарандиона с последующим раскрытием лактонного кольца до производного о-ГФГК.
2. Взаимодействие -оксокислот с гетероциклическими аминами
2.1 Синтез и строение 4-арил-2-гидрокси-4-оксо-2-бутеноатов гетериламмония
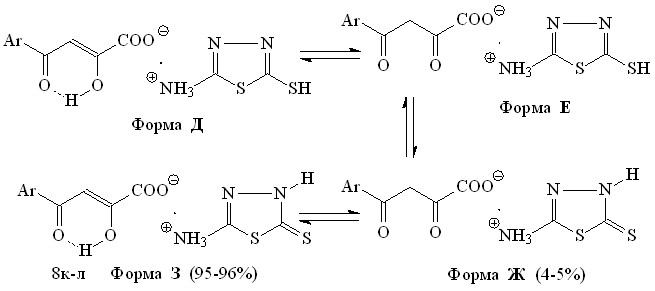
Ранее было показано, что при синтезе гетериламидов АрПК на основе 5-АФД, в зависимости от строения гетероцикла и присутствия воды в реакционной смеси, в качестве сопутствующих соединений образуются соли АрПК. С целью получения биологически активных водорастворимых соединений нами изучено прямое взаимодействие АрПК 7а-в с 2-амино-5-R-1,3,4-тиадиазолами и 2-аминобензимидазолом, в результате чего выделены 4-арил-2-гидрокси-4-оксо-2-бутеноаты гетериламмония (8а-о) (метод А):

8: Ht=C2H1N2S, R=Н (а), Cl (б), CH3 (в); Ht=C3H3N2S, R=H (г), Cl (д), CH3 (е); Ht=C4H5N2S, R=H (ж), Cl (з), CH3 (и); Ht=С2Н1N2S2, R=H (к), Cl (л); Ht=C7H5N2, R=H (м), Cl (н),CH3 (о).
В процессе синтеза бутеноатов 8а-о установлено, что выход соединений зависит от последовательности добавления реагентов. Так, прибавление суспензии амина к суспензии АрПК в хлороформе при интенсивном перемешивании приводит к значительному повышению выхода продукта и не требует нагревания реакционной среды, как предлагалось ранее.
Как и у гетериламидов 2н-у, во всех спектрах ЯМР1Н солей 8а-и,м-о присутствует синглет протонов метиленовой группы слабой интенсивности, что свидетельствует о их существовании в растворе ДМСО-d6 в виде таутомерных форм В и Г с преобладанием кетоенольной формы В (92-96%). В тоже время, в спектрах ЯМР1Н соединений 8к,л, помимо сигналов протонов в ожидаемых областях, наблюдается уширенный синглет протона NH группы в слабом поле и отсутствует сигнал протона SH-группы, что свидетельствует об их существовании в формах Ж и З, имеющей ВВС Н-хелатного типа, и противоречит возможным формам Д, Е:
При сплавлении сухой смеси кислоты 7а и гетериламинов в соотношении 1:1, наряду с продуктами неустановленной структуры, с выходами 16-24% были выделены соли 8а,г,ж (метод Б). Следует отметить, что по данным ТСХ в реакционной смеси также присутствуют соответствующие N-гетериламиды АрПК 2.
2.2 Синтез и строение 2-(2-гидроксифенил)-2-оксоэтаноатов гетериламмония
В продолжение изучения химического поведения гетероциклических аминов в реакциях с -оксокислотами и с целью синтеза БАВ нами исследовано взаимодействие о-ГФГК 4 с 2-, 4-аминопиридинами, 2-аминотиазолом и 2-амино-5-R-1,3,4-тиадиазолом, в результате чего выделены соответствующие 2-(2-гидроксифенил)-2-оксоэтаноаты гетериламмония (9а-д):
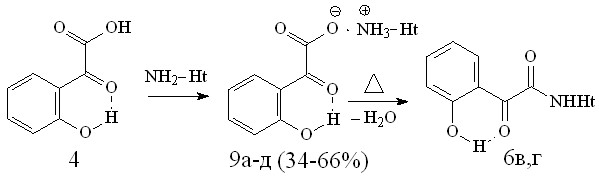
9: Ht=2-С5Н4N (а),4-С5Н4N (б),С3Н2NS (в),С2Н1N2S (г),С3Н3N2S (д).
В виду значительного осмоления реакционной смеси нам не удалось выделить соответствующие соли на основе 2-амино-5-бромпиридина и 2-амино-5-этил-1,3,4-тиадиазола. При плавлении солей 9б,в, и выдерживании их при температуре плавления не более 10 минут, по данным ТСХ образуются соответствующие N-гетериламиды 6в,г.
3 Получение металлорганических комплексных соединений на основе N-гетериламидов -оксокислот
Комплексные соединения широко представлены в биологических системах и также применяются в качестве лекарственных препаратов. Однако реакции N-гетериламидов АрПК и о-ГФГК с солями металлов ранее не изучены.
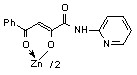
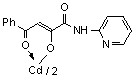
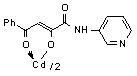
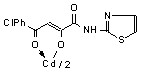
3.1 Синтез и строение бис[3-арил-1-(N-гетерил)карбоксамидо-1,3-пропандионато] меди, цинка, кадмия и ртути
Нами установлено, что N-гетериламиды 2а-д,ж-л,р,у-х взаимодействуют с дихлоридами меди, цинка, кадмия, ртути в соотношении лиганд-металл 2:1 в мягких условиях, в среде спирта этилового с образованием бис[3-арил-1-(N-гетерил)карбоксамидо-1,3-пропандионато] меди (10а-м), цинка (11а-з), кадмия (12а-л) и ртути (13а-г):
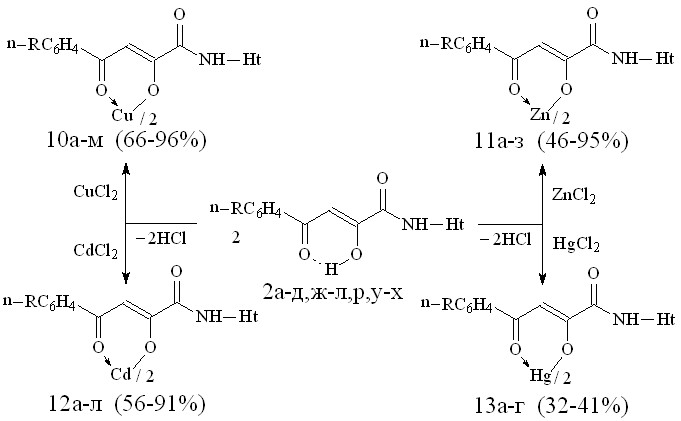
10: Me=Сu, Ht=2-С5Н4N, R=H, (а), Br (б); Ht=С5Н3BrN, R=H (в); Ht=3-С5Н4N, R=Н (г), Ht=С3Н2NS, R=Н (д), Br (е); Ht=С3Н3N2S, R=Н (ж), Сl (з); Ht=С4Н5N2S, R=Н (и), Сl (к), СН3 (л); Ht=С11Н11N2О, R=Н (м).
11: Ме=Zn, Ht=2-С5Н4N, R=H, (а), Сl (б); Ht=С5Н3BrN, R=Cl (в); Ht=3-С5Н4N, R=Н (г), Cl (д); Ht=С3Н2NS, R=Н (е), Cl (ж); Ht=С3Н3N2S, R=Н (з).
12: Ме=Сd, Ht=2-С5Н4N, R=H, (а), Сl (б); Ht=3-С5Н4N, R=Н (в), Cl (г); Ht=С3Н2NS, R=Н (д), Сl (е); Ht=С3Н3N2S, R=Н (ж); Ht=С4Н5N2S, R=Н (з), Сl (и), СН3 (к); Ht=С7Н5N2, R=Н (л).
13: Ме=Нg, Ht=2-С5Н4N, Сl (а); Ht=3-С5Н4N, R=Н (б), Cl (в); Ht=С3Н2NS, R=Н (г).
На наш взгляд, для соединений 10-13 наиболее вероятными структурами продуктов реакции являются И, К, Л.
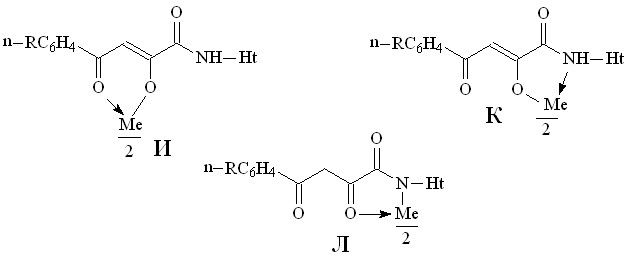
В пользу структуры И свидетельствует наличие полос поглощения NH-групп в ИК спектрах соединений 10-13, а также наличие сигнала протонов NH-групп в спектрах ЯМР1Н. В случае структуры Л данные сигналы должны отсутствовать. Кроме того, установлено, что в ИК спектрах комплексных соединений 10-13 полоса поглощения карбонильных групп С4=О смещена в область низших частот на 10-15 см-1, по сравнению с исходными N-гетериламидами 2, что свидетельствует об участии этих групп в образовании более прочной координационной связи. Для структуры К и Л следовало ожидать наличие в ИК спектре хелатов высокочастотной полосы поглощения данного кетонного карбонила. Таким образом, согласно спектральным данным, N-гетериламиды 2 в реакции комплексообразования координируются металлами как бидентатные О-О лиганды и образуют с ними продукты со структурой И.
3.2 Синтез и строение 2-[2-(N-гетериламино)-2-оксоацетил]фенолятов натрия, бис {2-[2-(N-гетериламино)-2-оксоацетил]фенолятов} цинка и кадмия
С целью получения водорастворимых биологически активных соединений нами изучена реакция N-гетериламидов о-ГФГК 6а,б,д,ж с натрия карбонатом, в результате чего выделены 2-[2-(N-гетериламино)-2-оксоацетил]феноляты натрия (14а-г):
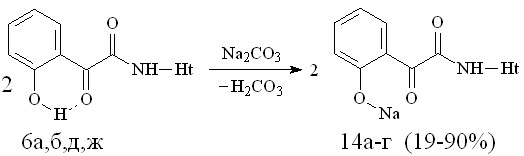
14: Ht=С5Н3BrN (а), 3-С5Н4N (б), С2Н1N2S (в), С4Н5N2S (г).
Установлено, что при взаимодействии N-гетериламидов 6г,е-з с дихлоридами цинка и кадмия при соотношении лиганд – металл 2:1 образуются бис{2-[2-(N-гетериламино)-2-оксоацетил]феноляты} цинк (15) и кадмий (16а-г):
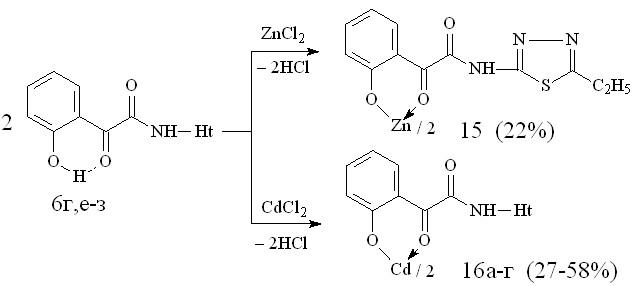
16: Ht=С3Н2NS (а), С3Н3N2S (б), С4Н5N2S (в), С7Н5N2 (г).
Спектральные характеристики подтверждают строение полученных соединений и свидетельствуют о депротонизации лиганда в ходе реакции комплексообразования. В процессе эксперимента нам не удалось получить медные и цинковые хелаты при взаимодействии соответствующих солей с N-гетериламидами 6г,д,е, так как в ходе реакции происходило сильное осмоление смеси. Также не удалось выделить ртутные хелаты и натриевый фенолят в реакции N-(2-тиазолил)амида 6г с Nа2CO3.
4. Взаимодействие N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот с гидразонами кетонов
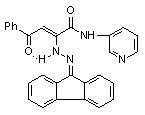
Нами установлено, что N-гетериламиды АрПК 2б,г,д,з,и,л-о,р,с,у-ц взаимодействуют с гидразонами бензофенона и 9-флуоренона с образованием соответственно N-гетериламидов 4-арил-2-дифенилметиленгидразино-4-оксо-2-бутеновых кислот (17а-п) и N-гетериламидов 4-арил-4-оксо-2-флуоренилиденгидразино-2-бутеновых кислот (18а-о):
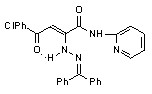
17: Ht=2-С5Н4N, R=Сl (а); Ht=3-С5Н4N, R=Н (б), Сl (в); Ht=С3Н2NS, R=Н (г), Сl (д); Ht=С2Н1N2S, R=Н (е), Сl (ж); Ht=С3Н3N2S, R=Н (з), Сl (и); Ht=С4Н5N2S, R=Н (к), Сl (л), СН3 (м); Ht=С11Н11N2O, R=Н (н), Сl (о); Ht=С7Н5N2, R=Н (п).
18: Ht=2-С5Н4N, R=Сl (а); Ht=3-С5Н4N, R=Н (б), Сl (в); Ht=С3Н2NS, R=Н (г), Сl (д); Ht=С2Н1N2S, R=Н (е), Сl (ж); Ht=С3Н3N2S, R=Н (з), Сl (и); Ht=С4Н5N2S, R=Н (к), Сl (л), СН3 (м); Ht=С11Н11N2O, R=Н (н), Сl (о).
При изучении спектров ЯМР1Н соединений 17,18, снятых в ДМСО-d6 и CDCl3, установлено наличие Z-кетоенгидразинной (Z-KEГ), Е-кетоенгидразинной (Е-КЕГ) и -кетогидразонной (-КГ) форм в растворе этих соединений:
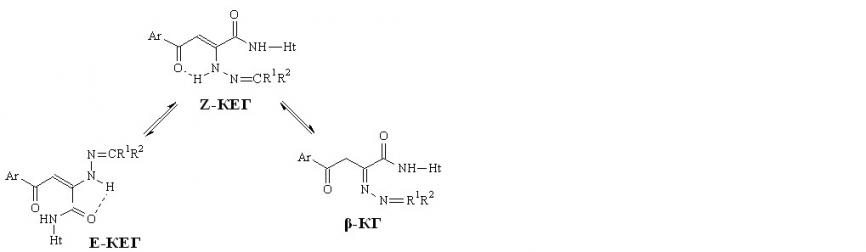
R1=R2=С6H5, СR1R2=С13H8.
Нами установлено, что состав таутомерных форм в растворе определяется, в первую очередь, природой растворителя, а также строением гетероциклического и гидразинного фрагментов. В меньшей степени на содержание форм оказывает влияние заместитель в ароильном радикале. Так, в растворе ДМСО-d6 соединений 17,18 форма Z-КЕГ наблюдается у всех изученных соединений, за исключением производного 18з, и составляет 32-100% для соединений 17 и 15-80% для соединений 18. Минорная форма Е-КЕГ обнаруживается в растворе ДМСО-d6 у соединений 17к (48%) и 18и,к,н,о (15-28%). Содержание формы -КГ в растворе ДМСО-d6 у соединений 17 составляет 15-50%, в то время как у соединений 18 – 50-100%. Следует отметить, что форма Е-КЕГ присутствует в таутомерном равновесии трех форм только в растворе ДМСО-d6, а в растворе CDCl3 – только в равновесии с Z-КЕГ со значительным преобладанием последней. Введение электроноакцепторного заместителя в ароильный фрагмент производных 17,18 приводит к сдвигу таутомерного равновесия в сторону большего содержания формы Z-КЕГ только в растворах ДМСО-d6.
5. Взаимодействие N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот с этиловым эфиром гидразинэтановой кислоты
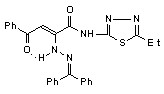
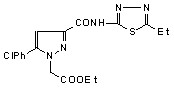
Установлено, что при взаимодействии N-гетериламидов 2д,н,р,с,у-х с этиловым эфиром гидразинэтановой кислоты образуются соответствующие N-гетериламиды 3-арил-2-этоксикарбонилметил-2,3-дигидропиразол-5-карбоновых кислот (19а-з):
19: Ht=3-С5Н4N, Ar=4-C6H4Cl (а); Ht=С2Н1N2S, Ar=C6H5 (б), 4-ClC6H4 (в); Ht=С3Н3N2S, Ar=C6Н5 (г), Сl (д); Ht=С4Н5N2S, Ar=C6H5 (е), 4-СlC6H4 (ж), 4-СН3C6H4 (з).
Обнаружено, что соединения 19б-з обладают ярко-голубой флуоресценцией при облучении УФ-светом, что использовалось нами в процессе детектирования пятен на пластинках «Silufol UV 254» при контроле реакции методом ТСХ.
При изучении спектров ЯМР1Н производных N-[2-(5-R-1,3,4-тиадиазолил)]амидов 19б-з, снятых в ДМСО-d6 и СDCl3, нами установлено наличие таутомерных форм М и Н в растворе этих соединений:
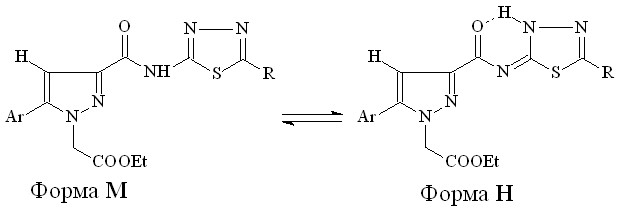
R=H, Me, Et
Таутомерное равновесие этих форм зависит от природы растворителя, а также от характера заместителя в арильном и гетерильном фрагментах молекулы. Так, при снятии спектров ЯМР1Н соединений 19г,д в разных растворителях установлено, что при введении заместителя в арильный фрагмент наблюдаются обе формы с преобладанием формы Н в ДМСО-d6 и формы М в СDCl3, в то время как отсутствие заместителя способствует их 100% содержанию в соответствующем растворителе. При анализе спектров соединений 19в-з, снятых в ДМСО-d6, выявлено, что соединения 19г,е существуют в форме Н (100%), в то время как их замещенные аналоги 19в,д,ж,з существуют в виде равновесных форм Н:М (43-62% : 38-57%).
Механизм образования соединений 19а-з, по видимому, включает первоначальную атаку первичной аминогруппы замещенного гидразина на карбонильную группу С2=О субстрата. Образующийся при этом карбиноламин (I1) элиминирует воду и превращается в енгидразин (I2), который циклизуется в пиразол за счет внутримолекулярной атаки вторичной аминогруппы гидразина на карбонильную группу С4=О субстрата c отщеплением воды.
6. Изучение биологической активности N-гетериламидов -оксокислот и продуктов их превращений
N-гетериламиды -оксокислот и продукты их превращений были подвергнуты биологическим испытаниям с целью поиска БАВ с противовоспалительной, анальгетической, противомикробной активностью, а также влияющих на свертывающую систему крови. Испытания проводились в ГОУ ВПО «Пермская государственная фармацевтическая академия Росздрава» на кафедрах фармакологии с курсом иммунологии, микробиологии, физиологии с основами анатомии.
6.1 Острая токсичность.
Установлено, что большинство производных -оксокислот являются малотоксичными веществами. Так, LD50 соединений 2п, 6г,ж, 8ж, 10м, 11а, 12а,в,д, 13б,в, 16а составляет 500-3000 мг/кг при внутрибрюшинном способе введения. Таким образом, изученные соединения имеют определенные преимущества в плане их безопасности перед препаратами сравнения.
6.2 Противовоспалительная активность (ПВА).
ПВА полученных соединений в дозе 50 мг/кг изучали на модели острого воспалительного отека, вызванного субплантарным введением 0,1 мл 1% водного раствора каррагенина белым крысам обоего пола массой 170-200 г. Соединения вводили перорально в дозе 50 мг/кг в виде взвеси в 2% крахмальном растворе за 1 час до введения флогогенного агента. Препаратом сравнения служил диклофенак (10 мг/кг). Результаты испытаний наиболее активных соединений представлены в таблице 1.
Выявлено, что в ряду N-[2-(5-R-1,3,4-тиадиазолил)]амидов 2 при увеличении алкильной цепи в 5 положении гетероцикла наблюдается значительное уменьшение ПВА, вплоть до ее потери и наибольшую активность показывают производные 2п,т. В меньшей степени активны производные с бензимидазольным гетероциклом (2ц,ч). Также установлено, что не зависимо от строения гетероцикла, электронодонорные заместители в ароильном кольце увеличивают ПВА, а электроноакцепторные, как правило, незначительно влияют на данный вид активности.
Установлено, что N-гетериламиды о-ГФГК 6, по сравнению с N-гетериламидами АрПК 2, проявляют более выраженную ПВА. Кроме того, в данном ряду производных отмечается прямая зависимость влияния заместителя в 5 положении 1,3,4-тиадиазолила на ПВА, которая увеличивается при увеличении алкильной цепи, и наиболее высокую активность проявляет гетериламид 6ж. На пике воспаления он практически не уступает диклофенаку и его эффективная доза от LD50 составляет 0.03. Таким образом, соединение 6ж превосходит по широте терапевтического действия препарат сравнения в 5 раз. Обнаружено значительное повышение ПВА у амида 6з, содержащего в качестве гетероцикла 2-бензимидазол, по сравнению со структурными аналогами – производными АрПК 2ц,ч.
В ряду бутеноатов 8 наибольшую активность проявили соединения 8ж,и,м,о содержащие 5-этил-1,3,4-тиадиазолильный и бензимидазольный заместители, однако их ПВА не превышает препарат сравнения.
При переходе от N-гетериламидов АрПК 2 к их комплексным соединениям 10-13 на ПВА, в большей степени, влияет характер металла и строение гетероцикла.
Нами установлено, что за исключением соединения 11в на основе N-[2-(5-бромпиридил)]амида 2ж, происходит значительное увеличение активности хелатов, по сравнению с исходными амидами 2. Наибольшую активность проявили соединения 12в и 13б, содержащие 3-пиридильный заместитель. При этом кадмиевый хелат 12в на пике воспаления незначительно уступает диклофенаку, но его его эффективная доза от LD50 составляет 0.03, что свидетельствует об определенных его преимуществах перед препаратом сравнения.
При оценке влияния природы металла на проявление ПВА в ряду соединений 10-13 выявлена следующая закономерность и наиболее активные соединения обнаружены среди кадмиевых производных:
[L]2Cd > [L]2Hg > [L]2Zn > [L]2Cu
Переход от N-2-тиазолиламида о-ГФГК 6г к соответствующему кадмиевому хелату 16а также приводит к значительному увеличению ПВА до уровня диклофенака.
Таблица 1
Данные по ПВА наиболее активных соединений
| Соединение (LD50 мг/кг) | Торможение каррагенинового отека в % | |||
| 1 час | 3 часа | 5 часов | ||
 | 29,1±1,5*1 **2 | 46,7±2,1**1 *2 | 40,6±5,6**1 *2 | |
 2т 2т | 49,5±17***1 ***2 | 35,9±0,9**1 ***2 | 35,9±0,9**1 ***2 | |
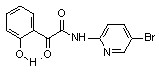 6а 6а | 34,9±8,9 | 42,9±2,3***1 | 27.5±3.8**1 | |
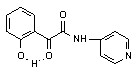 6в 6в | 48,0±5,3***1 ***2 | 45,0±4,2***2 | 33,0±4,1***2 | |
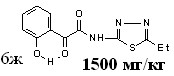 | 69,0±0,3***1 ***2 | 52,4±3,8***1 *2 | 54,5±2,5***1 | |
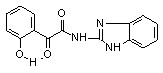 6з 6з | 57,6±2,6***1 ***2 | 35,9±0.9*1 **2 | 27.2±2.0*1 **2 | |
| 33,9±7,4 | 35,1±6,3**1 | 41,4±8,0**1 | ||
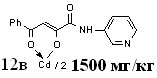 | 63,5±5,3***1 | 42,1±1,5**1 **2 | 38,2±4,9**1 **2 | |
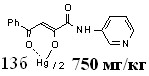 | 58,0±11,3**1 | 28,0±6,0**1 | 33,0±1,5**1 | |
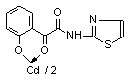 16а 16а | 65,7±5,9***1 *2 | 62,3±3,5***1 | 47,8±5,7**1 ***2 | |
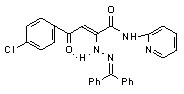 17а 17а | 58,5±1,6***1 ***2 | 36,6±2,6**1 *2 | 29,7±2,6***1 ***2 | |
 17к 17к | 47,0±3,6**1 | 36,5±6,1***1 | 42,7±5,9***1 | |
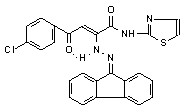 18д 18д | 33,8±5,8*1 | 23,7±5,8*1 ***2 | 31,8±6,7**1 **2 | |
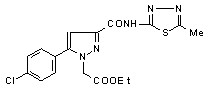 19д 19д | 12,7±1,5 | 39,5±4,3**1 ***2 | 48,9±1,4***1 *2 | |
| Диклофенак | 40.2±4.8 | 65.6±4.3***1 | 60.1±4.7***1 | |
* = p < 0,05, ** = p< 0,01, *** = p < 0,001
1 по сравнению с контролем; 2 – по сравнению с диклофенаком.
Введение во второе положение исходных N-гетериламидов 2-дифенилметиленгидразинового фрагмента также приводит к увеличению ПВА. Наибольшую активность в этом ряду проявили соединения 17а,к, содержащие в качестве гетероциклических заместителей 2-пиридил и 2-(5-этил-1,3,4-тиадиазолил) соответственно. В случае 2-производных N-[2-(5-R-1,3,4-тиадиазолил)]амидов увеличение ПВА наблюдается с возрастанием алкильной цепи в положении 5 гетероцикла и уменьшается при введении в арильный фрагмент электроакцепторного заместителя. Меньшее влияние на этот вид активности оказывает введение флуоренилиденгидразинового заместителя в молекулу исходных N-гетериламидов. Целенаправленное введение потенциально биологически активного фрагмента 4-аминоантипирила в молекулу гидразонопроизводных 17,18 не принесло ожидаемого результата. Так, соединения 17н,о и 18н,о не дали высокой активности, а у соединения 18о даже проявился провоспалительный эффект.
Установлено, что введение этоксикарбонилметильного заместителя во 2 положение пиразола у соединений 19, по сравнению с известными производными 3-пиразол-5-карбоновых кислот, не имеющих этого заместителя, приводит к значительному увеличению ПВА. Выявлено, что с увеличением алкильной цепи в положении 5 гетероцикла и при введении электроакцепторного заместителя в арильный фрагмент у соединений 19б-з активность, как правило, возрастает.
6.3 Анальгетическая активность (АА).
АА определяли на мышах обоего пола массой 16-22 г по методике «горячая пластинка». Исследуемые вещества вводили перорально в дозе 50 мг/кг в виде взвеси в 2 % крахмальном растворе. Препаратом сравнения служил метамизол натрия (50 мг/кг) и диклофенак (10 мг/кг). Результаты испытаний наиболее активных соединений представлены в таблице 2.
Установлено, что также как и при изучении ПВА, у N-2-[5-(R-1,3,4-тиадиазолил)]амидов АрПК 2 анальгетическое действие уменьшается с увеличением алкильной цепи в 5 положении гетероцикла. Однако высокоактивных соединений в этом ряду не обнаружено. Среди производных N-гетериламидов о-ГФГК 6 наибольшей активностью обладает соединение 6ж, чуть уступающее по силе действия диклофенаку, но имеющее меньшую токсичность.
При переходе от исходных N-гетериламидов АрПК 2 к их хелатным комплексам и бутеноатам существенного увеличения АА не выявлено. Только бутеноат 8к и кадмиевые хелаты 12в,л проявили активность на уровне метамизола натрия, но уступающем по действию диклофенаку.
Введение во второе положение исходных N-гетериламидов 2 дифенилметиленгидразинового фрагмента приводит к увеличению АА. Так наибольшей активностью, превышающей действие диклофенака, обладает соединение 17к. Меньшее влияние оказывает флуоренилиденгидразиновый заместитель, за исключением соединения 18б. Введение заместителя в ароильный радикал соединений 17,18 приводит к снижению АА, а увеличение алкильной цепи у производных N-2-[5-(R-1,3,4-тиадиазолил)]амидов, как правило, приводит к увеличению данного вида активности. Производные 17,18, содержащие антипирильный заместитель, проявили активность, не превышающую препараты сравнения. Производные N-гетериламидов пиразол-5-карбоновых кислот 19 обладают слабой АА, за исключением соединения 19ж.
Таблица 2
Данные по АА наиболее активных соединений
| Соединение | Время оборони-тельного рефлекса, в сек. | Соединение | Время оборони-тельного рефлекса, в сек. |
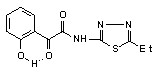 6ж 6ж | 23.0±1.7***1 | 17.3±1.3***1 | |
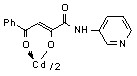 12в 12в | 17.5±1.4***1 | 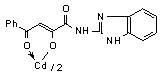 12л 12л | 18.0±0.7***1 ***2 |
 17а 17а | 16.7±1.05***1 | 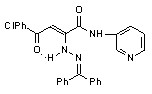 17в 17в | 18.3±1.05***1 ***2 |
 17к 17к | 27.0±1.2***1 | 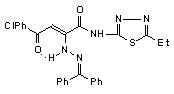 17л 17л | 17.6±0.9***1 ***2 |
 18б 18б | 21.0±0.4***1 ***2 | 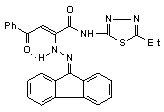 18к 18к | 16.0±0.6***1 ***2 |
 19ж 19ж | 16.3±0.8***1 ***2 | Контроль Метамизол натрия Диклофенак | 10.0±0.5 16.4±3.0*1 26.2±0.6***1 |
* = p < 0,05, ** = p< 0,01, *** = p < 0,001
1 по сравнению с контролем; 2 – по сравнению с диклофенаком.
6.4 Влияние соединений на свертывающую систему крови.
Исследования проводили с помощью коагулометра «Минилаб 701» с использованием цитратной (3.8 %) крови собаки (9:1). Соединения вводили в концентрации 1 мг/мл. В качестве эталона сравнения гемостатической активности использовали этамзилат в концентрации 1мг/мл, а в качестве эталона антикоагулянтной активности – раствор гепарина в концентрации 1 ЕД/мл крови
Показано, что только бутеноат 8а, не имеющий заместителей в ароильном радикале и в 5 положении 1,3,4-тиадиазолильного фрагмента, обладает слабой гемостатической активностью. Соединения 8г,ж оказывают слабое, а бутеноат 8з - выраженное антикоагулянтное действие. Соли 9б-д и феноляты натрия 14а-г показывают различное по характеру действие, но не превышающее препараты сравнения.
6.5 Противомикробная активность (ПМА).
ПМА по отношению к штаммам St. aureus АТСС 6538-Р и E. coli АТСС 25922 определяли методом двукратных серийных разведений в жидкой питательной среде. Для всех исследуемых соединений определяли минимальные ингибирующие концентрации (МИК) в мкг/мл. Препаратами сравнения служили этакридин и гидроксиметилхиноксилиндиоксид (диоксидин). Результаты испытаний наиболее активных соединений представлены в таблице 3.
При изучении ПМА N-гетериламидов АрПК 2 и о-ГФГК 6 установлено, что они оказывают слабое действие. МИК для соединений 2 составляет: 62-500 / 125-1000 мкг/мл, а для соединений 6: 500-1000 / 125-1000 мкг/мл.
При изучении биологической активности бутеноатов 8а-о нами установлено, что они обладают ПМА на уровне, чуть превышающем этакридин, но уступающем диоксидину по отношению к эталонным штаммам микроорганизмов. Таким образом, при переходе «гетериламид-ароилпируват» существенного увеличения антимикробной активности не происходит.
Химическая модификация N-гетериламидов АрПК 2 и о-ГФГК 6 до комплексных соединений 10-13 и 15,16 приводит к значительному увеличению ПМА. Установлено, что антимикробный эффект зависит, в первую очередь, от природы металла и характера гетероцикла. Так, среди медных хелатов 10 не выявлено веществ с высокой антимикробной активностью. Обнаружено, что соединения 11а, 12а,д,е, 13б,в, превышают по противомикробной активности этакридин по отношению к золотистому стафилококку в 16-2000 раз и к кишечной палочке – в 512-1000 раз. Отношение МИК (мкг/мл) к токсичности ЛД50 (мг/кг) у соединений 11а, 12а,д,е, 13б,в, составляет для стафилококка 0,0003-0,01 и для кишечной палочки 0,0025-0,008, в то время как у этакридина эти показатели значительно уступают.
При изучении металлорганических комплексов 15,16 установлено, что в данном ряду наибольшую активность проявили кадмивые хелаты 16б-г. При этом кадмиевые производные показывают активность, не зависящую от строения гетероцикла и значительно превышающие диоксидин.
Введение во второе положение исходных N-гетериламидов 2 дифенилметиленгидразинового и флуоренилметиленгидразинового фрагментов не привело к значительному увеличению ПМА. Так, при сравнении влияния гидразонового заместителя на данный вид активности наибольший эффект проявили флуоренилиденгидразинопроизводные 18, по сравнению с соединениями 17. Выявлено, что их активность находится на уровне этакридина.
Установлено, что при переходе от N-гетериламидов АрПК 2 к производным пиразол-5-карбоновых кислот 19 не происходит существенного увеличения ПМА и их активность соответствует действию этакридина, но не превышает эффект диоксидина.
Таблица 3
Данные по ПМА наиболее активных соединений
| Соединение | МИК, мкг/мл | Соединение | МИК, мкг/мл |
| St. aureus / Е.coli | St. aureus / Е.coli | ||
 11а 3000 мг/кг 11а 3000 мг/кг | 31.0/3.9 | 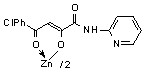 11б 11б | 31.0/62.0 |
 12а 1500 мг/кг 12а 1500 мг/кг | 2.0/2.0 | 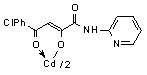 12б 12б | 250/31.0 |
 12в 12в | 15.6/62.0 | 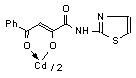 12д 500 мг/кг 12д 500 мг/кг | 2.0/3.9 |
 12е 12е | 1.0/1.0 | 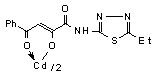 12з 12з | 250/62.0 |
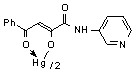 13б 800 мг/кг 13б 800 мг/кг | 3.9/7.8 | 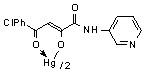 13в 800 мг/кг 13в 800 мг/кг | 0.25/2.0 |
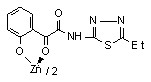 15 15 | 125/62.0 | 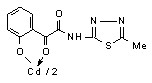 16б 16б | 2.0/3.9 |
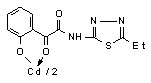 16в 16в | 2.0/3.9 | 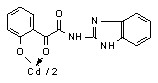 16г 16г | 2.0/3.9 |
| Этакридин | 500/2000 | Диоксидин | 62,5-1000/ 3,9-62,5 |
ВЫВОДЫ
- Реакцией дециклизации 5-арил-2,3-дигидрофуран-2,3-дионов и 2,3-дигидробензо[b]фуран-2,3-диона под действием N-гетериламинов получены N-гетериламиды -оксокислот, имеющие в структуре потенциально биологически активные циклы 2-,3-,4-пиридина, 5-бром-2-пиридина, 2-тиазола, 5-R-1,3,4-тиадиазола и 2-бензимидазола.
- Впервые разработан способ синтеза комплексных соединений Cu2+, Zn2+, Cd2+, Hg2+ на основе N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых и 2-(2-гидроксифенил)-2-оксоэтановой кислот и установлено, что исходные реагенты координируются металлами как бидентатные О-О лиганды.
- Получены водорастворимые соединения на основе реакции -оксокислот с гетероциклическими аминами, а также взаимодействием N-гетериламидов 2-(2-гидроксифенил)-2-оксоэтановой кислоты с натрия карбонатом.
- Изучено взаимодействие N-гетериламидов АрПК с гидразоном бензофенона и 9-флуоренона и установлено наличие таутомерного равновесия Z-КЕГ, Е-КЕГ и -КГ форм в растворах полученных соединений, количественное содержание которых определяется природой растворителя, строением гетероциклического и гидразинного фрагментов.
- Установлено, что взаимодействие N-гетериламидов АрПК с этиловым эфиром гидразинэтановой кислоты приводит к образованию соответствующих производных 3-арил-2-этоксикарбонилметил-2,3-дигидропиразол-5-карбоновой кислоты. При этом выявлено, что в случае N-[2-(5-R-1,3,4-тиадиазолил)]амидов, целевые продукты существуют в растворах в виде двух таутомерных форм за счет миграции протона амидного фрагмента к атому азота гетероцикла.
- На основе разработанных или усовершенствованных методов синтеза получено 119 новых соединений, структура которых подтверждена данными спектров ЯМР1Н, ИК- и масс-спектроскопии, индивидуальность – данными ТСХ.
- Установлены некоторые закономерности биологической активности от химического строения соединений, которые могут быть использованы в дальнейшем поиске биологически активных веществ в ряду производных N-гетериламидов -оксокислот.
- Выявлены наиболее перспективные соединения для дальнейших исследований:
- N-[2-(5-этил-1,3,4-тиадиазолил)]амид 2-(2-гидроксифенил)-2-оксоэтановой кислоты (6ж), обладающий противовоспалительной и анальгетической активностью
- бис{3-фенил-1-[N-(3-пиридил)карбоксамидо]-1,3-пропандионато} кадмий, ртуть (12в, 13б), обладающие противовоспалительной и противомикробной активностью.
Основное содержание диссертации представлено в работах
- Синтез металлорганических соединений на основе производных ароилпировиноградных кислот и изучение их антимикробной активности / П.А. Мокин, Л.Н. Шелепенькина, Е.С. Еловикова [и др.] // Вопросы теоретической и практической медицины: Тез. докл. 70-й юбилейн. итог. Республ. науч. конф. молодых ученых.- Уфа, 2005.- С. 52-53.
- Синтез биологически активных соединений на основе взаимодействия о-гидроксифенилглиоксалевой кислоты с гетериламинами / Н.А. Пулина, П.А. Мокин, А.Е. Рубцов [и др.] // Фармация и здоровье: Мат. Междунар. науч.- практ. конф.- Пермь, 2005.- С.81-82.
- Синтез биологически активных производных пиразол-5-карбоновой кислоты на основе эфиров и амидов ароилпировиноградных кислот / Н.А. Пулина, В.В. Залесов, П.А. Мокин [и др.] // Здоровье и образование в XXI веке: Материалы VI междунар. науч.-практ. конф.- М: РУДН, 2005.- С. 415.
- Мокин, П.А. Изучение противоспалительной активности среди производных гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот / П.А. Мокин, К.В. Яценко // Науки о человеке: Тез. докл. VII конгр. мол. ученых и специалистов.- Томск, 2006.- С. 14-143.
- Биологическая активность гетериламидов ароилпировиноградных кислот и их солей / В.В. Юшков, Н.А. Пулина, П.А. Мокин [и др.] // Новая технологическая платформа биомедицинских исследований (биология, здравоохранение, фармация): Материалы науч.- практ. конф.- Ростов-н/Д, 2006.- С.60-61.
- Пулина, Н.А. Биологически активные соединения на основе взаимодействия о-гидроксифенилглиоксалевой кислоты с гетериламинами / Н.А. Пулина, П.А. Мокин // Новая технологическая платформа биомедицинских исследований (биология, здравоохранение, фармация): Материалы научн.- практ. конф.- Ростов-н/Д, 2006.- С.39-40.
- Pulina, N.A. Synthesis, antiinflammatory and antibacterial activity of a series of novel metal-organic complexes / N.A. Pulina, Р.А. Мокin, К.V. Yасеnkо // 2-nd Russian-Chinese international scientific conferenсe оn pharmacologi: «Fundomental pharmacologi and pharmacy - сlinical practice».- Perm, 2006.- Р.134.
- Изучение синтеза и фармакологической активности, производных гетериламидов о-гидроксифенилглиоксалевой кислоты / Н.А. Пулина, П.А. Мокин, В.В. Залесов [и др.] // Здоровье образование в XXI веке: материалы VII междунар. науч.-практ. конф.- М: РУДН.- 2006.- С.408-409.
- Синтез биологически активных металлоорганических соединений на основе производных ароилпировиноградных кислот / Н.А. Пулина, В.В. Залесов, П.А. Мокин [и др.] // Разработка, исследование и маркетинг новой фармацевтической продукции: сб. науч. тр. / ПятГФА.– Пятигорск, 2006.– Вып. 61.– С.282-284.
- Синтез биологически активных соединений на основе взаимодействия гетериламидов ароилпировиноградных кислот с гидразонами бензофенона и 9-флуоренона / Н.А. Пулина, П.А. Мокин, В.В. Залесов [и др.] // Приоритеты фармацевтической науки и практики: материалы заоч. Междунар. конф.- М.: РУДН, 2006.- С.268-270.
- Синтез и поиск биологически активных водорастворимых веществ в ряду производных гетериламидов -оксокислот / Н.А. Пулина, П.А. Мокин, Ф.В. Собин [и др.] // Медицинский вестник Башкортостана.- 2006.- Т.4, №1.- С.200-202.
- Гетериламиды 4-арил-2,4-диоксобутановых кислот в синтезе новых биологически активных веществ / Н.А. Пулина, П.А. Мокин, В.В. Залесов [и др.] // Пути и формы совершенствования фармацевтического образования. Создание новых физиологически активных соединений: материалы 3-й Всерос. науч.- метод. конф.- Воронеж, 2007.- С.294-296.
- Гетериламиды -оксокислот в синтезе биологически активных соединений / Н.А. Пулина, В.В. Залесов, В.В. Юшков, П.А. Мокин… // Вестник Перм. гос. фарм. акад.- Пермь, 2007.- №2.- С.89-92.
- Изучение антимикробной активности комплексных соединений на основе гетериламидов 4-арил-2,4-диоксобутановых кислот / Н.А. Пулина, В.В. Залесов, П.А. Мокин [и др.] // Человек и лекарство: Сб. материалов. XIV Росс. национ. конгр.: М., 2007.- С.868.
- Поиск биологически активных солей гетероциклических аминов и гетериламидов на основе 4-арил-2,4-диоксобутановых кислот / Н.А. Пулина, П.А. Мокин, В.В. Залесов [и др.] // Разработка, исследование и маркетинг новой фарм. продукции: сб. научн. тр.- Пятигорск: ПятГФА, 2007.- Вып. 62.- С.533-534.
- Поиск биологически активных соединений среди производных о-гидроксифенилглиоксалевой кислоты / Н.А. Пулина, В.В. Юшков, В.В. Залесов, П.А. Мокин… // Фармация.- 2007.- №5.- С.35-38.
- Пулина, Н.А. Взаимодействие гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот с хлоридами двухвалентных металлов / Н.А. Пулина, В.В. Залесов, П.А. Мокин // Баш. хим. журн.- 2007.- Т.14, №3.- С. 52-56.
Автор выражает благодарность зав. кафедрой физики и математики, доц. М.И. Вахрину за запись спектров ЯМР1Н, научному сотруднику РИЦ «Фарматест» Е.Б. Бабушкиной за запись ИК-спектров, старшему преподавателю кафедры токсикологической химии Л.Н. Карповой за запись масс-спектров, зав. кафедрой фармакологии с курсом иммунологии, проф. В.В. Юшкову и аспиранту данной кафедры К.В. Яценко, зав. кафедрой физиологии с основами анатомии, проф. Б.Я. Сыропятову, зав. кафедрой микробиологии, проф. Т.Ф. Одеговой и ассистенту данной кафедры М.В. Томилову за проведение биологических испытаний синтезированных соединений.
Подписано в печать 04.12.2007
Формат 60*90/16. Набор компьютерный. Бумага ВХИ.
Тираж 100 экз. Усл. печ. л. 1,75. Заказ № 119/2007
Отпечатано на ризографе в типографии ГОУ ВПО ПГФА
614070, г. Пермь, ул. Крупской, 46
тел./факс. 8-901-266-59-37

