Состав и технология таблеток амиронина и галавита
На правах рукописи
Барышникова Мария Анатольевна
Состав и технология
таблеток амиронина и галавита
15.00.01 – технология лекарств и организация фармацевтического дела
Автореферат
диссертации на соискание ученой степени
кандидата фармацевтических наук
Москва, 2008 г.
Работа выполнена в Государственном учреждении
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Научный руководитель:
Доктор фармацевтических наук,
профессор Оборотова Наталия Александровна
Официальные оппоненты:
Доктор фармацевтических наук,
профессор Щавлинский Александр Николаевич
Доктор фармацевтических наук,
профессор Лопатин Петр Вячеславович
Ведущая организация: Всероссийский научно-исследовательский институт лекарственных и ароматических растений (ВИЛАР)
Защита диссертации состоится «___»_______2008 г. в 14 часов на заседании диссертационного совета Д.208.040.09. при Московской медицинской академии им. И.М. Сеченова по адресу: г. Москва, Никитский бульвар, 13.
С диссертацией можно ознакомиться в библиотеке ММА им. И.М. Сеченова по адресу: 117998, Москва, Нахимовский проспект, 49.
Автореферат разослан «____»________2008 г.
Ученый секретарь диссертационного совета Д. 208.040.09.
Доктор фармацевтических наук,
профессор Садчикова Наталья Петровна
Введение
Актуальность темы
Таблетки являются одной их самых распространенных и перспективных лекарственных форм. В настоящее время таблетки составляют около 90 % общего объема готовых лекарственных средств, так как они обладают рядом преимуществ перед другими лекарственными формами.
В ГУ Российский онкологический научный центр им. Н.Н. Блохина РАМН проведены исследования оригинальных отечественных препаратов – труднорастворимого цитостатика производного хлорэтиламинов амиронина и иммуномодулятора галавита.
Амиронин представляет собой D,L – - амино -{n-[n-бис ( – хлорэтил) аминофенокси] фенил}пропионовой кислоты гидрохлорид. Тирониновая структура носителя алкилирующей группы придает препарату направленность транспорта на щитовидную железу и опухоли, исходящие из нее. В связи с плохой растворимостью амиронина, наиболее рациональный путь введения его – лекарственная форма в виде таблеток.
Галавит – оригинальный отечественный препарат, относящийся к группе иммунотропных лекарственных средств синтетического происхождения. Активное действующее вещество – 5-амино-1,4-диоксо-1,2,3,4-тетрагидрофталазин-2-ид натрия дигидрат. В 1997 г. галавит зарегистрирован в государственном реестре лекарств России в виде сухой рассыпки для приготовления раствора для инъекций и рекомендован к применению у взрослых в составе комплексной терапии для коррекции иммунодефицитных состояний. Для удобства применения галавита в амбулаторных условиях была предложена лекарственная форма в виде сублингвальных таблеток.
Цель работы – создание таблетированной лекарственной формы труднорастворимого противоопухолевого хлорэтиламина амиронина и сублингвальной таблетированной лекарственной формы иммуномодулятора галавита.
Для достижения поставленной цели необходимо было решать следующие задачи:
- В результате комплексных технологических, химико-фармацевтических и биофармацевтических исследований обосновать выбор составов рациональных лекарственных форм противоопухолевого соединения амиронина и иммуномодулятора галавита.
- Изучить структурно-механическую и химическую совместимость субстанций со вспомогательными веществами в лекарственных формах.
- Обосновать технологию созданных лекарственных форм.
- Разработать методики качественного и количественного анализа полученных лекарственных форм.
- Определить влияние технологического процесса на противоопухолевую активность амиронина в таблетках и исследовать иммуномодулирующую активность сублингвальных таблеток галавита.
- На основании результатов исследований разработать проекты фармакопейных статей предприятия «Амиронин таблетки 250 мг» и «Галавит таблетки сублингвальные 25 мг».
Научная новизна исследования. Разработаны оригинальные составы и технология производства новых лекарственных форм – таблеток амиронина и сублингвальных таблеток галавита. Выбраны показатели и установлены критерии качества таблеток амиронина и галавита, учитывающие физико-химические свойства действующих и вспомогательных веществ, и разработаны методы их химико-фармацевтического контроля. На биологических моделях показана эффективность новых лекарственных форм. Терапевтическая противоопухолевая активность таблеток амиронина превосходит активность субстанции на 20 %. Таблетки галавита оказывают иммуномодулирующее действие на уровне инъекционной формы.
Практическая значимость работы. На основании проведенных исследований разработаны:
- Оптимальные составы таблеток амиронина и галавита;
- Технологические схемы получения таблеток амиронина и галавита;
- Методики определения качества разработанных таблеток по показателям: подлинность, посторонние примеси и количественное определение;
- Проекты фармакопейных статей на «Амиронин таблетки 250 мг» и «Галавит таблетки сублингвальные 25 мг»;
Таблетки амиронина переданы на углубленное доклиническое исследование. Таблетки галавита переданы для внедрения в производство в ЗАО «ЦСМ Медикор».
Апробация работы. Основные положения диссертационной работы доложены и обсуждены на Российской научно-практической конференции с международным участием «Современные методы лечения злокачественных новообразований. Достижения и неудачи», 4-6 июля 2006г. (г. Барнаул); на IV Всероссийской научно-практической конференции «Отечественные противоопухолевые препараты», 24-26 марта 2007 г (г. Москва). Апробация работы проведена на межлабораторной конференции НИИ экспериментальной диагностики и терапии опухолей ГУ РОНЦ им. Н.Н. Блохина РАМН (Москва, 2008).
Публикации. По теме диссертации опубликовано 4 статьи и 2 тезиса.
Связь темы диссертационной работы с планом научных работ учреждения. Диссертационная работа выполнена в соответствии с планом НИР НИИ ЭДиТО ГУ РОНЦ им. Н.Н. Блохина РАМН по теме: «Разработка и создание новых лекарственных форма для медицинской промышленности» (№ гос. регистрации 01.200.316267).
Положения, выдвигаемые на защиту:
- Результаты исследований по разработке и теоретическому обоснованию состава и технологии таблеток амиронина и сублингвальных таблеток галавита;
- Методы анализа и результаты определения качественных и количественных показателей таблеток амиронина и галавита;
- Результаты противоопухолевого действия таблеток амиронина, полученных по разработанной технологии;
- Результаты иммуномодулирующего действия сублингвальных таблеток галавита, полученных по разработанной технологии.
Структура и объем диссертации
Диссертация состоит из введения, обзора литературы, 3-х глав экспериментальной части, общих выводов, списка литературы и приложения. Работа изложена на 109 печатных страницах, содержит 6 рисунков, 14 таблиц. Библиография включает 150 наименований, в том числе 70 иностранных.
Во введении раскрыта актуальность темы, определены цель и задачи исследования, сформулированы научная новизна и практическая значимость работы.
В главе 1 приведен обзор литературы по технологии производства таблеток и контролю их качества. Описаны фармацевтические вспомогательные вещества и требования, предъявляемые к ним, приводится классификация вспомогательных веществ в зависимости от их назначения в технологии производства таблеток. Обсуждены физико-химические и биологические свойства объектов исследования: амиронина и галавита, обосновано их дальнейшее изучение.
Глава 2 содержит характеристики используемых материалов и описание методик проведения исследований.
Глава 3 посвящена разработке лекарственной формы амиронина для приема внутрь. Определены технологические характеристики субстанции амиронина и выбраны вспомогательные вещества для создания таблеток амиронина. Предложены методики контроля качества таблеток амиронина. Проведено исследование противоопухолевой активности полученных таблеток.
Глава 4 посвящена разработке сублингвальных таблеток галавита. Исследованы технологические характеристики субстанции галавита и выбраны вспомогательные вещества для таблетирования. Разработаны методики контроля качества таблеток галавита. Исследована иммуномодулирующая активность таблеток галавита.
В приложении приведены проекты фармакопейных статей предприятия, в которые вошли разработанные методики оценки качества разработанных лекарственных форм.
Содержание работы
1. Материалы и методы исследования
1.1 Характеристика объектов исследования
Амиронин – белый порошок с желтым оттенком, без запаха. Умеренно растворим в спирте метиловом, растворим в спирте этиловом 95%, умеренно растворим в воде. Субстанция амиронина синтезирована в лаборатории химического синтеза НИИ ЭДиТО ГУ РОНЦ им. Н.Н. Блохина РАМН.
Галавит – кристаллический порошок белого или слегка желтоватого цвета. Растворим в воде. Субстанция галавита предоставлена изготовителем (ЗАО «ЦСМ «Медикор», Москва).
При проведении исследований использованы вспомогательные вещества, соответствующие требованиям нормативной документации: ГФ XI издания, отдельных Фармакопейных и Временных фармакопейных статей, ГОСТов и МРТУ (табл. 1).
Таблица 1
Вспомогательные вещества
| Наименование ингредиента | НД | Назначение ингредиента |
| Спирт этиловый | ФС 42-3072-94 | Растворитель |
| Натрия хлорид | ГОСТ 4233-77 | Корректор насыпной массы, стабилизатор гидролиза хлорэтиламинов |
| Крахмал | ГОСТ 7699-78 | Наполнитель |
| Стеарат кальция | ТУ-6-09-4233-76 | Скользящее вещество |
| Тальк | ГОСТ 19284-3 | Скользящее вещество |
| Магния карбонат основной | ГФ СССР Х изд., ст. 388 | Разрыхлитель |
| Аэросил | ГОСТ 14922-77 | Разрыхлитель |
| Сорбит | ТУ 64-5-17-86 | Наполнитель, корригент вкуса |
| Ментол | ОСТ 18-137-73 | Корригент вкуса |
| Этилцеллюлоза | USP ХХVIII | Гранулирующий агент |
| Лактоза | ОСТ 49-63-97 или ТУ 9229-128-04610209-2003 | Наполнитель |
| Фруктоза | ТУ 9110-008-35937677-97 | Наполнитель, корригент вкуса |
| Глюкоза | ГОСТ 975-88 | Наполнитель, корригент вкуса |
1.2. Приборы и методы
Структурно-механические и технологические характеристики субстанций и гранулята амиронина и галавита, а так же качество полученных таблеток исследованы на приборах фирмы Erweka (Германия) с помощью общепринятых в фармацевтической практике методик. Для получения таблеток применялся лабораторный пресс фирмы Erweka (Германия).
В ходе исследования проведены измерения фракционного состава (ситовым методом), формы и размера частиц (с помощью микроскопа МБР-1), насыпной массы, сыпучести, угла естественного откоса (с помощью угломера), прессуемости.
Оценку качества препаратов проводили по следующим основным показателям: описание (внешний вид), подлинность, средняя масса таблеток и отклонение в массе, истираемость (механическая прочность), распадаемость, растворение, посторонние примеси, количественное определение, однородность дозирования. Особенностью нормативных документов для контроля качества сублингвальных таблеток является отсутствие теста «Растворение».
Для оценки качества субстанции и таблеток амиронина использовали УФ-спектрофотометрию. Испытание на специфические примеси проводили с помощью тонкослойной хромотографии (ТСХ) на хроматографических пластинах «Силуфол» в системе растворителей н-бутанол – кислота уксусная ледяная – вода 3:1:1. Для количественного определения амиронина в таблетках применяли УФ-спектрофотометрию.
Подлинность субстанции и таблеток галавита определяли методами ТСХ и УФ-спектрофотометрии. Оценку посторонних примесей проводили методом ТСХ на готовых пластинках “Kieselgel 60 F254” (фирмы “Merck”, Германия). Система растворителей н-бутанол – спирт этиловый 95% – концентрированный раствор аммиака 3:1:1 подобрана экспериментально. Количественное определение проводили методом УФ-спектрофотометрии.
Статистическую обработку полученных в ходе исследования данных проводили с использованием t-критерия Стьюдента в соответствии с требованиями ГФ XI.
При исследовании иммуномодулирующей активности галавита применяли цитотоксический тест. Пролиферативную активность мононуклеарных клеток крови при действии галавита оценивали в колориметрическом тесте с использованием витального красителя AlamarBlue (Biosours, США) в стерильных условиях. Световую микроскопию и фотографирование клеток, генерированных из мононуклекарных клеток периферической крови, во взвеси и в окрашенных мазках проводили с помощью системы AxioVision 4 (фирмы Carl Zeiss, Германия). Уровень цитокинов определяли в сыворотках методом твердофазного иммуноферментного анализа с использованием тест-систем фирмы Biosource (Бельгия). Экспрессию поверхностных маркеров мононуклеаров и дендритных клеток определяли при помощи моноклональных антител (Caltag Laboratories, USA) против соответствующих антигенов. Статистическую обработку материала проводили при помощи программного пакета WINMDI 2.8.
1.3. Животные и опухолевые модели
Все использованные в работе животные были получены из питомника ГУ РОНЦ им. Н.Н. Блохина РАМН, содержались в одинаковых условиях вивария с обычным режимом кормления. Определение противоопухолевой активности амиронина выполняли на мышах-самках гибридах первого поколения BDF1 массой 18-22 г. Штаммы перевиваемых опухолей получены из банка опухолевых штаммов ГУ РОНЦ им. Н.Н. Блохина РАМН. Мышам перевивали альвеолярную аденокарциному молочной железы Ca-755 со слабовыраженным клеточным полиморфизмом в подмышечную область по 0,5 мл 10% взвеси опухолевых клеток в питательной среде 199. Лечение начинали через 48 ч после перевивки опухоли. Субстанцию амиронина готовили ex tempore в виде водной суспензии в 1% крахмальном клейстере и вводили per os 5-кратно с интервалом 24 ч. Таблетки амиронина вводили также per os 5-кратно с интервалом 24 ч.
Эффективность лечения оценивали по следующим критериям: торможение роста опухоли (ТРО) и средняя продолжительности жизни (СПЖ).
ТРО рассчитывали по формуле:
(Объем опухоли в контроле – Объем опухоли в опыте) 100
ТРО =
Объем опухоли в контроле
Определение иммуномодулирующей активности галавита поводили in vivo на половозрелых мышах-самках линии СВА массой 18-22 г. Фрагмент таблетки галавит (40 мкг) помещали с использованием катетера в защечный мешок мыши до полного рассасывания, затем процедура повторялась 5 раз с интервалом 1 ч (суммарная доза составила 200 мкг). Мышам группы сравнения вводили галавит по 200 мкг внутрибрюшинно. Контрольной группе животных сублингвально давали крахмал. Каждая группа состояла из 10 животных.
2. Результаты собственных исследований
2.1 Разработка и изучение лекарственной формы амиронина
Исследование технологических характеристик субстанции амиронина гидрохлорида
Показано, что амиронин является полидисперсным порошком. Фракции с размером частиц 0,1 – 0,2 мм составляют около 60 %, фракции с размером частиц 0,2 – 0,6 мм — около 40 %. Следовательно, неоднородный фракционный состав субстанции амиронина требует дополнительной гомогенизации субстанции по размеру частиц.
Установлено, частицы амиронина различной формы, размеров и шероховатости. Известно, что характер поверхности порошка определяет прочность таблеток. Так как частицы амиронина имеют слабо шероховатую поверхность, и глубина выступов и впадин на поверхности частиц находится в пределах 1/2 – 1/3 их размера, порошок амиронина способен спрессовываться.
Субстанция амиронина плохо и нестабильно высыпается из вибрирующей воронки, поэтому можно говорить лишь о приблизительном значении коэффициента текучести.
Показано, что технологические характеристики субстанции амиронина не позволяют использовать прямое прессование, поэтому в дальнейших исследованиях провели поиск вспомогательных веществ, оптимизирующих технологические характеристики порошка.
Выбор вспомогательных веществ для создания таблеток амиронина
Для улучшения сыпучести и коррекции насыпной массы в состав смеси для таблетирования добавили крахмал и натрия хлорид, а также использовали влажную грануляцию. Кроме того, натрия хлорид является стабилизатором, замедляющим гидролиз хлорэтиламинов в присутствии влаги. Так как амиронин частично растворим в воде, в качестве гранулирующей жидкой фазы выбран 95% этиловый спирт, а в качестве гранулирующего агента предложена растворимая в нем этилцеллюлоза. Для исключения залипаемости на прессующий инструмент в состав таблеток введена «опудривающая смесь», состоящая из талька, соли стеариновой кислоты и крахмала в соотношении 3:1:6.
Учитывая химическую термолабильность амиронина, гранулят сушили на воздухе при температуре 20 ± 2 °С, влажности 60 % в течение суток, затем растирали и добавляли опудривающую смесь. Далее гранулят таблетировали на лабораторном прессе ударного типа. Полученные таким образом модели таблеток не соответствовали требованиям ГФ XI по критерию «распадаемость», все исследуемые модели набухали, но не распадались.
Добавление в пропись таблеток амиронина магния карбоната в качестве разрыхлителя, позволило получить таблетки, соответствующие требованиям ГФ XI по распадаемости (5 – 7 мин). Однако в экспериментах установлено, что при растворении таблеток амиронина магния карбонат взаимодействует с гидрохлоридом амиронина, способствуя превращению его в основание амирон, являющееся менее активным.
Магния карбонат заменили на разрыхлитель аэросил, что позволило получить таблетки, соответствующие требованиям ГФ XI (распадаемость 7 – 8 мин).
Некоторые модельные смеси для таблетирования приведены в табл. 2.
Таблица 2
Модельные смеси для таблетирования амиронина
| Модельные смеси для таблетирования | Результат |
| Амиронина – 0,25 г Крахмала – 0,10 г Натрия хлорида – 0,05 г Магния карбоната – 0,05 г | Таблетируемая смесь прессуется. Поверхность таблеток глянцевая, без сколов. Распадаемость 5 – 7 минут. Но есть вероятность взаимодействия амиронина гидрохлорида с карбонатом магния, в результате чего образуется менее активное основание амиронина (амирон). |
| Амиронина – 0,25 г Крахмала – 0,15 г Натрия хлорида – 0,05 г | Таблетируемая смесь прессуется. По внешнему виду таблетки хорошего качества, без сколов, поверхность глянцевая. Таблетки не соответствуют требованиям ГФ XI по критерию «распадаемость». |
| Амиронина – 0,25 г Крахмала – 0,1 г Натрия хлорида – 0,05 г Аэросила – 0,05 | Таблетируемая смесь прессуется. Таблетки хорошего качества, с глянцевой поверхностью, без сколов. Распадаемость 7 – 8 минут. |
После влажной грануляции 1%-ным раствором этилцеллюлозы фракционный состав гранул для таблетирования стал равномерным (размер частиц около 0,6 мм), насыпная масса составила 0,2 г/см2, сыпучесть составила 3,0 г/с, смесь не электризовалась (табл. 3).
Таблица 3
Технологические характеристики субстанции амиронина и гранул для таблетирования
| Наименование технологической характеристики | Субстанция | Гранулы для таблетирования |
| Фракционный состав, мм | 0,1 – 0,6 | 0,6 |
| Насыпная масса, г/см3 | 0,08 – 0,09 | 0,2 |
| Текучесть (сыпучесть), г/с | около 0,1 | 3,0 |
Технологическая схема получения таблеток амиронина представлена на рис. 1.
В результате проведенных исследований разработан следующий состав таблеток (в граммах):
Амиронина – 0,25
Крахмала – 0,10
Натрия хлорида – 0,05
Аэросила – 0,05
Опудривающая смесь – 0,05
Масса таблетки – 0,5 г
В лабораторных условиях наработано для первичной стандартизации и изучения условий и сроков хранения 5 серий таблеток амиронина.
Химико-фармацевтический анализ таблеток амиронина
Цель данного исследования — обеспечить объективный контроль за химико-фармацевтическими характеристиками новой лекарственной формы амиронина. Основные критерии качества лекарственной формы амиронина выбраны на основе требований ГФ ХI, предъявляемых к таблеткам.
Описание (Внешний вид). Все полученные образцы представляли собой круглые таблетки белого цвета с сероватым или желтоватым оттенком, без запаха. Диаметр таблеток 12±2 мм.
Подлинность таблеток амиронина определяли спектрофотометрически и цветной реакцией с нингидрином. УФ-спектр 0,001% раствора препарата в спирте метиловом в области от 210 до 290 нм имеет максимум поглощения при 260 ± 2 нм, УФ-спектр 0,01% раствора препарата в спирте метиловом в области от 270 до 320 нм имеет максимум поглощения при 301 ± 2 нм. С раствором нингидрина появляется сине-фиолетовое окрашивание.
Испытание на специфические примеси проводили с помощью тонкослойной хроматографии на хроматографических пластинках «Силуфол» УФ-254 в системе растворителей н-бутанол – кислота уксусная ледяная – вода в соотношении 3:1:1. В качестве специфических примесей рассматриваются этиловый эфир амиронина и основание амиронина, которые являются промежуточными продуктами синтеза амиронина и могут присутствовать в исходной субстанции. Хроматограммы просматривали в УФ-свете и проявляли раствором нингидрина с последующим нагреванием при 110 °С в течение 15 мин. Пятна примесей в пробах таблеток соответствовали по положению пятнам стандартного образца вещества свидетеля
не превышали их по интенсивности окрашивания, что означает присутствие в исследуемых сериях не более 0,5 % каждой примеси.
Среднюю массу таблеток, распадаемость, растворение, содержание талька определяли согласно требованиям ГФ XI. Таблетки всех полученных серий соответствовали требованиям ГФ XI по данным показателям.
Количественное определение. Для определения амиронина в таблетках применена стандартная спектрофотометрическая методика.
Электронный спектр поглощения 0,001% раствора амиронина в метиловом спирте имеет выраженный максимум поглощения — при 260 ± 2 нм. Установлено, что раствор амиронина в метиловом спирте подчиняется закону Бугера-Ламберта-Бера в диапазоне концентраций от 2 до 20 мкг/мл. Исследование влияния вспомогательных веществ на спектральные характеристики амиронина показало, что присутствие крахмала, талька, соли стеариновой кислоты и натрия хлорида не изменяет положения характеристического максимума, так как ни одно из вышеперечисленных веществ в спирте метиловом нерастворимо. Поэтому для количественного определения амиронина в таблетках в качестве раствора сравнения был использован спирт метиловый.
Методика. Около 0,5 г (точная навеска) растертых таблеток амиронина помещают в химический стакан вместимостью 50 мл, добавляют 30 мл 30% уксусной кислоты и перемешивают в течение 15 мин. Полученную суспензию количественно переносят в мерную колбу вместимостью 100 мл, доводят объем 30% уксусной кислотой до метки. Тщательно перемешивают и фильтруют через бумажный фильтр, отбрасывая первые 10 мл фильтрата. 0,2 мл полученного раствора переносят в мерную колбу вместимостью 50 мл, доводят объем метанолом до метки и перемешивают. Измеряют оптическую плотность полученного раствора при длине волны 260 ± 2 нм в кювете с толщиной оптического слоя 10 мл относительно раствора сравнения. Параллельно определяют оптическую плотность стандартного раствора амиронина.
Приготовление стандартного раствора. Около 0,25 г субстанции амиронина (точная навеска) и 0,25 г (точная навеска) смеси вспомогательных ингредиентов, входящих в таблетку, помещают в мерную колбу вместимостью 100 мл, прибавляют уксусной кислоты 30% около 70 мл, 0,2 мл 3% спиртового раствора этилцеллюлозы и тщательно взбалтывают в течение 15 мин. Доводят уксусной кислотой 30% до метки, взбалтывают и фильтруют через бумажный фильтр, отбрасывая первые 10 мл фильтрата. 0,2 мл фильтрата помещают в мерную колбу вместимостью 50 мл и доводят метанолом до метки.
Приготовление раствора сравнения. Точную навеску «смеси вспомогательных ингредиентов», входящих в таблетку, и 0,2 мл 3% спиртового раствора этилцеллюлозы помещают в мерную колбу вместимость 100 мл и тщательно взбалтывают с 70 мл уксусной кислоты 30% в течение 15 мин, доводят уксусной кислотой 30% до метки, снова взбалтывают, фильтруют через бумажный фильтр, отбрасывая первые 10 мг фильтрата. 0,2 мл фильтрата помещают в мерную колбу вместимостью 50 мл и доводят метанолом до метки.
Содержание амиронина в таблетке рассчитывают по формуле:
А1 Сст.К mср.
X = ——————,
Аст b
где:
Х — содержание амиронина в таблетке, г;
А1 — оптическая плотность исследуемого раствора;
Аст — оптическая плотность стандартного раствора;
Сст — концентрация амиронина в стандартном растворе, г/ мл;
К — коэффициент разбавления, равный 25000;
mср. — навеска таблеток, г;
b — средняя масса таблетки, г.
Содержание амиронина в таблетке должно составлять 0,237 – 0,263 г.
В табл. 4 приведены результаты количественного определения амиронина в различных сериях лекарственной формы.
Предложенная методика количественного определения амиронина может быть использована при контроле качества препарата в процессе производства и хранения таблеток. Относительная ошибка методики не превышает 1,5 %.
Таблица 4
Результаты количественного определения амиронина в таблетках различных серий
| Серия лекарственной формы | Оптическая плотность | Найдено амиронина, г | Метрологические характеристики |
| 011205 | 0,454 0,458 0,454 0,464 0,462 0,467 | 0,239 0,241 0,239 0,244 0,243 0,246 | X = 0,242 Sх = 2,828 10–3 Sх = 1,155 10–3 X = 2,968 10–3 = 1,226 % |
| 031205 | 0,477 0,488 0,486 0,481 0,483 0,490 | 0,251 0,257 0,256 0,253 0,254 0,258 | X = 0,255 Sх = 2,756 10–3 Sх = 1,125 10–3 X = 2,893 10–3 = 1,134 % |
| 081106 | 0,488 0,492 0,483 0,477 0,494 0,486 | 0,257 0,259 0,254 0,251 0,260 0,256 | X = 0,256 Sх = 3,316 10–3 Sх = 1,354 10–3 X = 3,481 10–3 = 1,359 % |
Исследование противоопухолевой активности таблеток амиронина
Исследование противоопухолевой активности препарата амиронин в таблетках проведено на модели перевиваемой аденокарциномы молочной железы мышей Ca 755 по принятой в РОНЦ методике.
Полученные результаты показали, что в выбранном режиме терапевтическая активность препарата в лекарственной форме в виде таблеток не отличается от активности субстанции (табл. 5).
Таблица 5
Противоопухолевое действие субстанции амиронина и его лекарственной формы в виде таблетки на модели Са 755
| Доза амиронина: мг/кг число введений / интервал (час) | Торможение роста опухоли, % | СПЖ, дни | |||
| Дни после перевивки опухоли | |||||
| 7 | 10 | 14 | 18 | ||
| Субстанция 1005/24 | 91,1* | 74,6* | 65,1* | 59,2 | 15,6 |
| Таблетки 1005/24 | 90,6* | 74,8* | 83,9* | 64,7* | 19,1 |
*Достоверность по сравнению с контролем р0,05
Полученные лабораторные серии таблеток стандартизированы с помощью разработанных методик и заложены на хранение при температуре 20±2 °С. Проведенные анализы подтвердили стандартность серий таблеток амиронина и показали стабильность лекарственной формы в течение 2 лет при заданных условиях хранения.
2.2. Создание сублингвальных таблеток галавита
Определение технологических характеристик субстанции галавита
Исследование фракционного состава показало, что галавит является полидисперсным порошком. Фракция с размером частиц менее 0,25 мм составляет 55 %, и фракция с размером частиц 0,25 – 0,5 мм – 45 %. Таким образом, фракционный состав субстанции галавита позволяет вводить в смеси для прессования более крупные частицы.
При исследовании линейных размеров и формы частиц галавита оказалось, что они имеют слабо шероховатую поверхность, глубина выступов и впадин лежит в пределах 1/2 – 1/3 размера соответствующих частиц, и следовательно, галавит способен спрессовываться.
При исследовании сыпучести выявили, что по ряду причин, в том числе сильной электризуемости, субстанция галавита плохо и нестабильно высыпается из вибрирующей воронки. Поэтому можно говорить лишь о приблизительном значении коэффициента сыпучести. Для улучшения текучести порошка с целью увеличения фракции укрупненных и утяжеленных частиц использовали гранулирование.
Изученные технологические характеристики субстанции галавита показали, что прямое прессование в данном случае неприемлемо, поэтому необходимо провести поиск вспомогательных веществ, улучшающих технологические характеристики субстанции.
Выбор вспомогательных веществ для таблетирования галавита
Так как галавит легко растворим в воде, в качестве гранулирующей жидкой фазы выбрали 95% этиловый спирт, а в качестве гранулирующего агента использовали легко растворимую в нем 1% или 2% этилцеллюлозу. Были разработаны две модельные смеси для таблетирования:
| № 1 | № 2 |
| Галавита – 0,05 г | Галавита – 0,05 г |
| Сорбита – 0,55 г | Фруктозы – 0,55 г |
Каждую смесь увлажняли 1% или 2% раствором этилцеллюлозы в 95% этиловом спирте и сушили на воздухе при температуре 20 ± 2 °С и влажности 60 % в течение 1 ч (до высыхания). Затем гранулят растирали в ступке, просеивали через сито с диаметром отверстий 0,5 мм и таблетировали на лабораторном прессе ударного типа фирмы Erweka.
Обе смеси хорошо спрессовались, но составы, увлажненные 1%-ным раствором этилцеллюлозы, были недостаточно прочными. Поэтому в дальнейшей работе для грануляции использовали 2% раствор этилцеллюлозы в 95% этиловом спирте.
Через сутки таблетки с фруктозой набрали влагу (стали влажными). Так как фруктоза более сладкая, чем сорбит, для коррекции вкуса решили не отказываться от данного вспомогательного вещества и изучили возможность использования различных смесей, содержащих сорбит и фруктозу в разных соотношениях.
При масштабировании смеси для таблетирования с фруктозой не высыхали на воздухе после грануляции. При подсушивании в сушильном шкафу при температуре +20 – +40 °С образовывалась карамель. Поэтому в дальнейшей работе от применения в качестве вспомогательного вещества фруктозы отказались и использовали сорбит.
Для улучшения вкусовых качеств и внешнего вида таблеток в гранулируемую смесь в качестве дополнительного вспомогательного вещества ввели ментол и лактозу, а также уменьшили дозу галавита в 2 раза.
После введения в состав гранулируемой массы сорбита, крахмала и лактозы, а также применения влажной грануляции, фракционный состав гранул для таблетирования стал более гомогенным (размеры частиц около 0,5 мм), насыпная масса составила 0,15 г/см3, а сыпучесть стала равномерной и составила 3,0 г/с, смесь не электризовалась (табл. 6).
Таблица 6
Некоторые технологические характеристики субстанции галавита и гранул для таблетирования
| Наименование технологической характеристики | Субстанция | Гранулы для таблетирования |
| Фракционный состав, мм | 0,25-0,5 | 0,5 |
| Насыпная масса, г/см3 | 0,09 | 0,15 |
| Сыпучесть, г/с | 0,1 | 3,0 |
Во избежание залипания гранулята на пуансоны при прессовании использовали опудривающую смесь следующего состава: крахмал – 0,03 г, стеарат кальция – 0,005 г, тальк – 0,015 г.
Некоторые модельные смеси для таблетирования приведены в табл. 7.
Таблица 7
Модельные смеси для таблетирования галавита
| Модельные смеси для таблетирования | Результат |
| Галавита – 0,05 г Сорбита – 0,30 г Фруктозы – 0,35 г | Хорошо прессовались. Через сутки набрали влагу. |
| Галавита – 0,05 г Сорбита – 0,35 Фруктозы – 0,30 г | Хорошо прессовались. Через сутки набрали влагу. |
| Галавита – 0,05 г Сорбита – 0,40 г Фруктозы – 0,25 г | Хорошо прессовались. Через сутки набрали влагу. |
| Галавит – 0,05 г Сорбит – 0,55 г | Хорошо прессовались. Готовая таблетка крошилась и слоилась. Горький вкус. |
| Галавита – 0,05 г Сорбита – 0,45 г Крахмала – 0,10 г | Хорошо прессовались. Готовая таблетка слоилась. Горький вкус. |
| Галавита – 0,05 г Сорбита – 0,40 г Крахмала – 0,15 г | Хорошо прессовались. На готовой таблетке сколы. Горький вкус. |
| Галавита – 0,05 г Сорбита – 0,35 г Крахмала – 0,20 г | Хорошо прессовались. Таблетки по внешнему виду хорошего качества, без сколов, но шероховатая поверхность. Горький вкус. |
| Галавита – 0,025 г Сорбита – 0,315 г Крахмала – 0,1 г Лактозы – 0,1 г | Хорошо прессовались. Таблетки по внешнему виду хорошего качества, без сколов, поверхность глянцевая. Горький вкус чувствуется гораздо меньше. |
| Галавита – 0,025 Сорбита – 0,315 Крахмала – 0,2 | Хорошо прессовались, по внешнему виду таблетки хорошего качества, без сколов, с глянцевой поверхностью. Горький вкус чувствуется слабо. |
В итоге был выбран следующий состав таблеток галавита:
Галавита (ФСП 42-0098-0227-00) – 0,025 г
Сорбита – 0,315 г
Крахмала – 0,1 г
Лактозы – 0,1 г
Опудривающая смесь (крахмал – 0,03, кальция стеарат – 0,005, тальк – 0,015, ментол) – 0,06 г
Масса таблетки 0,6 г.
Полученные таблетки упаковывали в блистеры по 10 штук.
Технологическая схема получения таблеток галавита представлена на рис. 1.
Химико-фармацевтический анализ таблеток галавита
На сублингвальные таблетки галавит разработан проект Фармакопейной статьи предприятия, в который включены разделы, характерные для контроля качества таблеток.
В разделе Описание изложены требования к внешнему виду таблеток. Все испытанные серии препарата представляли собой таблетки белого цвета с блестящими точечными вкраплениями. Диаметр таблеток 12±2 мм, однако нанесение риски не проводилось, поскольку разделения таблетки при сублингвальном применении не предусмотрено.
Подлинность галавита в таблетках определяли методом ТСХ одновременно с определением посторонних примесей, а так же методом УФ-спектрофотометрии одновременно с количественным определением.
При просмотре высушенной пластинки в УФ-свете при длине волны 260 и 366 нм активное вещество в пробе таблеток проявлялось в виде голубовато-зеленого пятна, соответствующего по положению и интенсивности окрашивания пробе стандартного вещества (субстанции галавита).
Определение средней массы таблеток проводили гравиметрически в соответствии с требованиями ГФ ХI. Средняя масса, определенная взвешиванием 20 таблеток, находилась в пределах 0,570 – 0,630 г, отклонение массы 18 из 20 таблеток удовлетворяло фармакопейным требованиям и не превышало пределов, определенных ГФ ХI (± 5 %).
Определение распадаемости таблеток проводили согласно требованиям ГФ ХI, вып. 2. Таблетки всех испытанных серий препарата распадались в воде без использования дисков в течение не более 15 мин.
Для оценки посторонних примесей в таблетках галавита использован метод хроматографии в тонких слоях сорбента на пластинках Kieselgel 60 F 254 фирмы «Merck», Германия. Галавит из таблеток извлекали, взбалтывая растертый порошок с водой с последующим фильтрованием. На линию старта хроматографической пластинки наносили по 5 мкл фильтрата (50 мкг галавита), раствора стандартного образца вещества-свидетеля СОВС-1 (50 мкг субстанции галавита), раствора стандартного образца вещества-свидетеля СОВС-2 (0,1 мкг галавита) и раствора стандартного образца вещества-свидетеля СОВС-3 (0,01 мкг галавита). Хроматографировали восходящим способом в системе растворителей н-бутанол – спирт этиловый 95 % – аммиак концентрированный 3:1:1. При проявлении УФ-светом при длинах волн 254 и 366 нм в пробе таблеток обнаруживали основное пятно галавита, по положению и интенсивности окрашивания соответствующее пятну стандартного образца вещества-свидетеля СОВС-1. В пробе таблеток также возможно появление дополнительных пятен выше и ниже основного, по интенсивности окрашивания не превышающих пятно пробы стандартного образца вещества-свидетеля СОВС-2 (не более 0,2 % каждой индивидуальной примеси в препарате). Суммарное содержание примесей в препарате не должно превышать 1,0 %.
Пригодность хроматографической системы оценивали по проявлению в УФ-свете пятна стандартного образца вещества-свидетеля СОВС-3 (0,01 мкг галавита).
Для количественного определения основного действующего вещества в препарате применен метод прямой спектрофотометрии с использованием раствора рабочего стандартного образца. В электронном спектре поглощения галавита наблюдаются 3 характеристических полосы поглощения с максимумами при длинах волн 260 ± 2 нм, 297 ± 2 нм, 347 ± 2 нм. Максимум при 297 нм имеет аналитическое значение и расположен в той части спектра, где не поглощают излучения вспомогательные вещества, использованные для получения таблеток галавита. Кроме того, как показала статистическая обработка полученных результатов, использование длины волны 297 нм позволяет получить наиболее воспроизводимые результаты. Специально проведенные исследования показали, что поглощение растворов лекарственной формы галавита подчиняется закону Бугера-Ламберта-Бера в диапазоне концентраций 0,010 – 0,050 мг/мл.
Во всех исследованных образцах лекарственной формы содержание галавита укладывалось в определенные ФСП пределы – от 22,5 до 27,5 мг/таблетка (25 мг ± 10 %).
Предложенная методика спектрофотометрического определения галавита в таблетках достаточно чувствительна, обладает высокой точностью и воспроизводимостью, при этом ошибка определения среднего результата не превышает 2,0 %.
Поскольку в сублингвальных таблетках галавита содержится менее 50 мг активного вещества, в соответствии с требованиями ГФ ХI определяли однородность дозирования методом УФ-спектрофотометрии из отдельной таблетки. Отклонение содержания галавита в каждой таблетке не превышало ± 15 %.
Полученные серии таблеток отвечают требованиям стандартности и по изученным химико-фармацевтическим характеристикам очень близки между собой. В табл. 8 приведены результаты количественного определения галавита в различных сериях лекарственной формы.
Таблица 8
Результаты количественного определения галавита в таблетках*
| Серия препарата | Оптическая плотность | Найдено Галавита, мг/таблетка | Метрологические характеристики определения |
| 010705 | 0,326 0,335 0,329 0,322 0,319 0,325 | 25,1 25,8 25,3 24,8 24,5 25,0 | |
| 020705 | 0,281 0,288 0,276 0,292 0,279 0,285 | 24,5 25,1 24,1 25,4 24,3 24,8 | |
| 011205 | 0,325 0,335 0,328 0,320 0,325 0,332 | 25,5 26,3 25,8 25,1 25,5 26,1 |
*Р=95 %, t P, f=2,57, n=6
Серии таблеток заложены на хранение при температуре 20±2 °С, проведенные анализы показали стабильность лекарственной формы в течение 2 лет при заданных условиях хранения.
Иммуномодулирующая активность галавита
У мышей после внутрибрюшинного и сублингвального введения галавита отмечали достоверное увеличение пролиферативной активности мононуклеарных клеток крови, которое оценивали в колориметрическом тесте с использованием витального красителя AlamarBlue (Biosours, США) в стерильных условиях. Суспензию МНК в обогащенной среде РПМИ 1640 вносили в 96-луночные планшеты в количестве 10103 клеток/лунку, инкубировали в течение 4 сут в стандартных условиях культивирования. По окончании инкубации в лунки вносили краситель AlamarBlue (10 %). Флюоресценцию измеряли после 4-часовой инкубации при 37 °С, 5% СО2 на флюориметре VersaFluor V13 (Vtocal) при длине волны возбуждения 530–560 нм, эмиссии 590 нм и выражали в условных единицах (у.е.) флюоресценции. Рассчитывали индекс стимуляции (ИС), представляющий собой отношение пролиферативной активности МНК у особей после введения галавита МНК и интакных животных. Более выраженный эффект наблюдали у мышей при воздействии инъекционной формы препарата (табл. 9). Спонтанная НК-активность мононуклеарных клеток крови составила 32 % и повышалась при введении инъекционной формы галавита до 58 %, при сублингвальной – до 51 % (табл. 10).
Таблица 9
Влияние галавита на пролиферативную активность мононуклеарных клеток крови селезенок мышей
| Условия культивирования | Оптическая плотность, у.е M±m | Индекс стимуляции, М±m | Жизнеспособные клетки, % М±m | |
| Контроль | 0,095±0,02 | – | 96,0±0,2 | |
| Галавит | Инъекционная форма | 0,255±0,05* | 2,68* | 95,9±0,6 |
| Сублингвальная форма | 0,137±0,04* | 1,44* | 97,3±0,9 | |
*Статистически значимые различия (р<0,05) по t-критерию Стьюдента для сопряженных пар признаков по сравнению с интактными мышами.
Таблица 10
НК-активность мононуклеарных клеток крови селезенок мышей линии СВА после введения галавита, %
| Препарат | Цитотоксичность | |
| Контроль | 32,0±4,0 | |
| Галавит | инъекционная форма | 58±3,8* |
| сублингвальная форма | 51,±5,3* | |
*Статистически значимые различия (р<0,05) по t-критерию Стьюдента для сопряженных пар признаков по сравнению с интактными мышами.
При исследовании субпопуляционного состава мононуклеарных лейкоцитов селезенки мышей после парентерального и сублингвального введения галавита отмечалось увеличение экспрессии на мембранах мононуклеарных лейкоцитов активационных молекул (CD25) и антигенов НК (NK1.1). Содержание в популяции мононуклеарных лейкоцитов клеток, экспрессирующих Т-клеточные дифференцировочные антигены (CD3, CD4, CD8) и молекулы антигенной презентации (MCH) не отличалось от контроля (табл. 11). Хотя сублингвальная форма галавита в меньшей степени влияла на увеличение в популяции мононуклеарных лейкоцитов CD25+-клеток и НК, тем не менее, эти изменения были достоверными по сравнению с интакным контролем.
Таблица 11
Уровни экспрессии поверхностных маркеров мононуклеарных лейкоцитов (МЛ) селезенок мышей линии СВА при воздействии инъекционной и сублингвальной форм галавита
| МЛ селезенки | СD3 | CD4 | CD8 | NK | CD25 | MHC I | MHC II |
| Интактных мышей | 45,6±3,5 | 30,2±2,5 | 4,3±0,4 | 1,5±0,3 | 5,4±0,3 | 12,3±0,1 | 12,2±0,2 |
| Галавит инъекционная форма | 48,3±5,2 | 23,7±3,8 | 7,3±0,5 | 22,3±3,8* | 29,5±3,4* | 13,2±0,5 | 15,7±1,3 |
| Галавит сублингвальная форма | 46,2±5,3 | 26,7±2,0 | 7,3±0,5 | 16,3±2,0* | 22,2±4,6* | 12,2±1,5 | 14,7±2,4 |
*Статистически значимые различия (р<0,05) по t-критерию Стьюдента для сопряженных пар признаков по сравнению с мононукларными клетками крови интактных мышей
Сублингвальное и внутрибрюшинное введение галавита приводит к повышению уровня цитокинов IFN-, TNF-, IL-1, IL-12 в сыворотке крови (рис. 2). При этом в наибольшей степени по сравнению с контрольной группой повышается уровень IL-1 (с 20,8±3,2 пг/мл у интактных животных до 44,8±4,8 пг/мл и 44,8±2,9 пг/мл при внутрибрюшинном и сублингвальном введении галавита соответственно; р<0,05) и TNF- (с 13,3±2,1пг/мл у интактных животных до 28,7±3,1пг/мл и 24,3±3.2пг/мл при в/бр и сублингвальном введении галавита соответственно; р<0,05). Кроме того, отмечается очевидная тенденция к увеличению сывороточных концентраций IFN- и IL-12 у мышей, получавших галавит, по сравнению с животными контрольной группы.
Полученные данные свидетельствуют о том, что сублингвальная форма препарата галавит оказывает иммуномодулирующее действие сходное с таковым при воздействии инъекционной формы препарата.
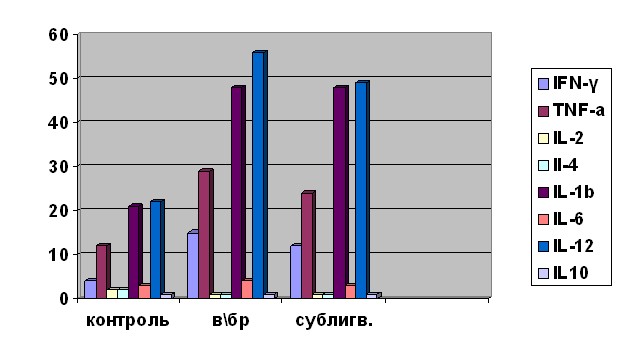
Рис. 2. Концентрации сывороточных цитокинов у мышей при воздействии инъекционной и сублингвальной форм галавита:
по оси ординат концентрация цитокинов (пг/мл);
по оси абсцисс: контроль – контрольная группа; в/бр внутрибрюшинное введение инъекционной формы галавита, сублингв. – введение сублингвальной формы галавита.
Выводы
- Разработаны состав и технология получения таблеток амиронина и сублингвальных таблеток галавита. Показано, что прямое прессование порошков амиронина и галавита неприемлемо. Для получения таблетированной лекарственной формы, содержащей 0,25 г амиронина, выбраны вспомогательные вещества крахмал, натрия хлорид, аэросил, а для получения сублингвальных таблеток, содержащих 0,025 г галавита, выбраны вспомогательные вещества крахмал, сорбит, лактоза, ментол.
- Модифицированы методики для оценки качества новых таблетированных лекарственных форм амиронина и галавита методами прямой УФ-спектрофотометрии, а также тонкослойной хроматографии на пластинках «Силуфол УФ-254» (амиронин) и «Kieselgel 60 F 254» фирмы «Merck», Германия (галавит).
- Разработаны методики количественного определения амиронина и галавита в таблетированной лекарственной форме методом прямой УФ-спектрофотометрии, обладающие высокой точностью и воспроизводимостью. Относительная ошибка методики для амиронина не превышает 1,5 %. Ошибка определения среднего результата для галавита не превышает 2,0 %.
- Противоопухолевая эффективность таблеток амиронина, подтвержденная на перевитой мышам аденокарциноме Са-755, по критериям торможения роста опухоли и увеличения продолжительности жизни не уступает субстанции.
- Исследование иммунологической активности галавита показало, что препарат стимулирует НК-активность и повышает пролиферативную активность мононуклеарных клеток, повышает уровень сывороточных провоспалительных и регуляторных цитокинов (IFN-, TNF-, IL-1, IL-12). Сублингвальная форма препарата галавит по своей способности активировать врожденный иммунитет приближается к инъекционной.
- Правильность выбора технологических решений при производстве лабораторных серий таблеток амиронина и галавита подтверждена аналитическими данными, характеризующими качество готовой продукции и стабильность ее в заданных условиях и сроках хранения.
- На основании результатов исследований разработаны проекты фармакопейных статей предприятия «Амиронин таблетки 250 мг» и «Галавит таблетки сублингвальные 25 мг».
Список работ, опубликованных по теме диссертации
- Барышникова М.А., Орлова О.Л., Полозкова А.П., Голубева И.С., Яворская Н.П., Оборотова Н.А., Смирнова Л.И., Партолина С.А. Разработка лекарственной формы амиронина для перорального применения. Материалы Всероссийской научно-практической конференции «Отечественные противоопухолевые препараты». Российский биотерапевтический журнал. 2006г. Том 5, №1, С. 11.
- Барышникова М.А., Орлова О.Л., Шпрах З.С., Уколова Е.М., Полозкова А.П., Партолина С.А., Жилова Л.Н., Юдина Л.П., Оборотова Н.А. Разработка новой лекарственной формы галавита в виде сублингвальных таблеток. Российский биотерапевтический журнал. 2006г. Том 5, №1, С.86-90.
- Барышникова М.А., Орлова О.Л., Шпрах З.С., Уколова Е.М., Полозкова А.П., Партолина С.А., Жилова Л.Н., Юдина Л.П., Оборотова Н.А. Разработка сублингвальной таблетированной лекарственной формы галавита. Материалы Российской научно-практической конференции с международным участием «Современные методы лечения онкологических больных: достижения и неудачи», Барнаул, 2006г., С. 70
- Барышникова М.А., Доненко Ф.В., Шубина И.Ж., Киселевский М.В. Влияние сублингвальной формы галавита на иммунофенотип и функциональную активность клеток мышей. Российский биотерапевтический журнал. 2006г.Том 5, №4, С.43-46.
- Барышникова М.А., Орлова О.Л., Полозкова А.П., Шпрах З.С., Оборотова Н.А. Разработка лекарственной формы амиронина в виде таблеток. Российский биотерапевтический журнал. 2006г. Том 5, №4,С. 89-93.
- Барышникова М.А., Ахматова Н.К., Карамзин А.М. Иммуномодулирующая активность сублингвальной формы галавита. Российский биотерапевтический журнал. 2007г. Том 6, №2,С. 55-58.

