Фалахати количественное определение и сравнительная фармакокинетика препаратов анастрозола
На правах рукописи
САЛАР ЭИСА ЗАДЕХ ФАЛАХАТИ
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ И СРАВНИТЕЛЬНАЯ
ФАРМАКОКИНЕТИКА ПРЕПАРАТОВ АНАСТРОЗОЛА
15.00.02 – фармацевтическая химия, фармакогнозия
Автореферат
диссертация на соискание ученой степени
кандидата фармацевтических наук
МОСКВА-2008
Работа выполнена в ГОУ ВПО Московская медицинская академии им. И.М.Сеченова.
Научные руководители:
академик РАМН, доктор медицинских наук
профессор Кукес Владимир Григорьевич
доктор фармацевтических наук,
профессор Раменская Галина Владиславовна
Официальные оппоненты:
доктор медицинских наук,
профессор Жердев Владимир Павлович
кандидат фармацевтических наук,
доцент Балабаньян Вадим Юрьевич
Ведущая организация:
ФГУП Центр по химии лекарственных средств (ЦХЛС-ВНИХФИ)
Защита состоится «___»_________2008 г. в _____ч. на заседании диссертационного совета Д.208.040.09 при ГОУ ВПО Московская медицинская академия им. И.М.Сеченова, по адресу: 119019, Москва, Никитский бульвар, 13.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Московская медицинская академия имени И.М.Сеченова, по адресу: 117998, Москва, Нахимовский проспект,49.
Автореферат разослан «___»___________2008г.
Ученый секретарь
диссертационного совета Д.208.040.09
доктор фармацевтических наук,
профессор Наталья Петровна Садчикова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Лекарственные средства занимают важное место в лечение злокачественных заболеваний. Насыщение фармацевтического рынка противоопухолевыми лекарственными средствами является весьма актуальной проблемой [Lonning PE, Geisler J, Dowsett M. 1998]. Появление в клинической практике эффективных и доступных лекарственных средств возможно осуществить с помощью дженериков, то есть препаратов, содержащих одно и то же лекарственное вещество в одинаковой дозе и в той же лекарственной форме, что и соответствующее оригинальное лекарственное средство, но выпускаемыми на разных производствах. Доступность дженерических лекарственных средств связана с упрощенной процедурой регистрации лекарственного средства, за счет отсутствия проведения ряда исследований, включая широкомасштабные клинические исследования. В связи с этим актуальной проблемой становится терапевтическая эквивалентность аналогов оригинальным препаратам. Оценка биоэквивалентности или фармакокинетической эквивалентности лекарственных средств, в настоящее время считается основным видом медико-биологического контроля качества дженериковых препаратов [Shein-Shung Chow, Jen-Pei Liu, 1992]. Эти исследования предполагают, что биоэквивалентные оригиналу дженериковые препараты обеспечивают одинаковую биодоступность лекарственного вещества, (то есть степень, в которой лекарственное средство всасывается в кровоток и скорость, с которой этот процесс происходит). Считается, что равная биодоступность двух лекарственных форм должна означать и терапевтическую эквивалентность. Большинство исследований биоэквивалентности проводится с участием здоровых людей, однако в соответствии с методическими указаниями по проведению качественных исследований биоэквивалентности лекарственных средств, если после однократного приема лекарственного средства высока вероятность возникновения серьезных побочных эффектов, исследования по биоэквивалентности могут быть заменены оценкой относительной биодоступности препарата на крупных лабораторных животных [Кукес В.Г. с соавт, 2004]. Использование различных видов животных может отразиться на результатах исследования, что диктует необходимость проведения сравнительного анализа фармакокинетических показателей для выявления наиболее оптимальной модели исследования.
В связи с предстоящим внедрением таблеток лекарственных средств-дженериков анастрозола в лечебную практику представляется актуальным изучение их фармакокинетики и относительной биодоступности, для чего необходима постановка воспроизводимой, чувствительной методики определения анастрозола в биологических жидкостях.
Все выше изложенное определило цель и задачи настоящего исследования.
Цель и задачи исследования
Цель исследования: разработать методику определения анаcтрозола в плазме крови животных c последующим ее использованием в изучении сравнительной фармакокинетики и относительной биодоступности генерических таблеток анастрозола.
Задачи исследования:
- Исследовать хроматографическое поведение анастрозола и разработать методику хроматографического анализа анастрозола в растворах и плазме крови.
- Определить фармакокинетические параметры анастрозола после однократного перорального приема таблеток Анастера.
- Определить фармакокинетические параметры анастрозола после однократного перорального приема таблеток Веро-анастрозол.
- Провести сравнительное изучение фармакокинетики препаратов Аримидекс и Анастера.
- Провести сравнительное изучение фармакокинетики препаратов Аримидекс и Веро-анастрозол.
- Определить относительную биодоступность дженерических препаратов анастрозола.
- Сопоставить фармакокинетические параметры анастрозола, получаемые на различных видах животных с аналогичными параметрами у людей.
Научная новизна
Разработана высокочувствительная ВЭЖХ - методика определения анастрозола в плазме крови животных.
Впервые изучены фармакокинетические параметры и биоэквивалентность новых таблеток анастрозола Анестера и Веро-анастрозол.
Впервые проведен сравнительный анализ фармакокинетических показателей при исследовании биоэквивалентности препаратов анастрозола у двух видов животных (собаки, мини-свиньи) и людей.
Практическая значимость
На основании результатов изучения хроматографического поведения анастрозола выбраны оптимальные условия количественного определения анастрозола в плазме крови животных методом ВЭЖХ.
Определенны значения основных фармакокинетических параметров анастрозола после однократного приема новых дженерических таблеток Анестера и Веро-анастрозол. Для решения вопроса о разрешении медицинского применения препаратов Анестера и Веро-анастрозол показана их биоэквивалентность по отношению к препарату Аримидекс.
Внедрение в практику
Методика анализа анастрозола в плазме крови внедрена в Филиале «Клиническая фармакология» НЦ Биомедицинских технологий РАМН и Институте клинической фармакологии ФГУ «НЦ ЭСМП» Росздравнадзора.
По результатам изучения фармакокинетики и биоэквивалентности таблеток Веро-анастрозола и Анестера по-сравнению с препаратом Аримидекс составлены итоговые отчеты, представленные на утверждение в Росздравнадзор, с целью разрешения медицинского применения препаратов Анестера и Веро-анастрозол.
Апробация работы
Апробация работы проведена на совместной научно-практической конференции кафедр клинической фармакологии и пропедевтики внутренних болезней и фармацевтической химии ММА имени И.М.Сеченова, Института клинической фармакологии НЦ ЭСМП, филиала «Клиническая фармакология» НЦ Биомедицинских технологий РАМН.
Связь исследования с проблемным планом
Диссертационная работа выполнена в соответствии с научным направлением кафедры клинической фармакологии и пропедевтики внутренних болезней «Оптимизация фармакотерапии заболеваний внутренних органов посредством разработки рациональных методов контроля клинически значимых параметров фармакокинетики лекарственных средств» (номер государственной регистрации – 01.206.110468).
Публикация результатов исследования
По результатам исследований опубликовано 3 печатных работы.
Основные положения, выносимые на защиту
- Методика количественного определения анастрозола в растворах и плазме крови животных.
2. Результаты изучения фармакокинетики и относительной биодоступности таблеток Веро-анастрозол.
3. Результаты изучения фармакокинетики и относительной биодоступности таблеток Анестера.
4. Сравнение фармакокинетических параметров анастрозола у собак. Мини-свиней и людей.
Объем и структура диссертации
Диссертация изложена на 93 страницах машинописного текста и состоит из введения, обзора литературы, экспериментальной части, выводов, списка литературы из 97 названий (87 из которых зарубежные). Работа иллюстрирована 15 рисунками и 12 таблицами.
Во введении раскрыта актуальность темы, определены цели и задачи исследования, научная новизна и практическая значимость.
В первой главе, на основании анализа литературных данных, рассмотрены особенности фармакокинетики и фармакологического действия анастрозола; представлены методы анализа анастрозола; дана характеристика новых дженерических таблеток анастрозола российского производства.
Вторая глава посвящена подбору хроматографических условий определения анастрозола, выбору условий изолирования анастрозола из плазмы крови собак и мини-свиней, оценке воспроизводимости и пригодности разработанной методики.
В третьей главе представлены результаты динамики концентрации, фармакокинетических параметров и относительной биодоступности препарата Веро-анастрозол после однократного перорального введения у животных по-сравнению с препаратом Аримидекс.
В четвертой главе представлены результаты фармакокинетического исследования и относительной биодоступности препарата Анестера у животных по-сравнению с препаратом Аримидекс.
В пятой главе обсуждаются данные по фармакокинетике анастрозола, полученные у животных (собаки, мини-свиньи) с ретроспективными данными у человека после однократного перорального приема анастрозола.
Результаты экспериментов обработаны статистически, обобщены в таблицах, проиллюстрированы графиками и рисунками.
СОДЕРЖАНИЕ РАБОТЫ
Количественный анализ анастрозола методом высокоэффективной
жидкостной хроматографии
В настоящее время метод высокоэффективной жидкостной хроматографии (ВЭЖХ) получил широкое распространение в медицине и фармации. Он включен в виде общих статей или их разделов в Фармакопею США, Британскую Фармакопею, Международную Фармакопею.
В работе использован высокоэффективный жидкостной хроматограф “Gilson” (Франция) с УФ-спектрофотометрическим детектором с переменной длиной волны, оборудованный петлей ввода на 100 мкл и оснащенный компьютерной программой обработки данных «702».
Экстракция. К 1 мл плазмы добавляли 5 мл дихлорметана, экстрагировали при энергичном встряхивании 10 минут, затем центрифугировали 10 минут при 4500 об/мин. Органический слой переносили в колбы для упаривания и упаривали досуха под вакуумом. К сухому остатку добавляли 250 мкл подвижной фазы, фильтровали и аликвоту (100 мкл) использовали для хроматографирования.
Хроматографический анализ. Анализ проводили на высокоэффективном жидкостном хроматографе “Gilson” с УФ-спектрофотометрическим детектором с переменной длинной волны при длине волны 215 нм. Использовалась хроматографическая колонка LC-18-ОВ 4,5*150. Элюирование проводили подвижной фазой состава: ацетонитрил – 0,01 М КН2РО4 в соотношении 27 – 73. Подвижную фазу перед использованием дегазировали под вакуумом. Скорость элюирования составляла 1,0 мл/мин. Образцы хроматограмм представлены на рисунке 1.
Количественное определение проводили методом абсолютной калибровки по высоте пиков. Калибровочная зависимость в диапазоне концентраций 10 - 200 нг/мл носила линейный характер.
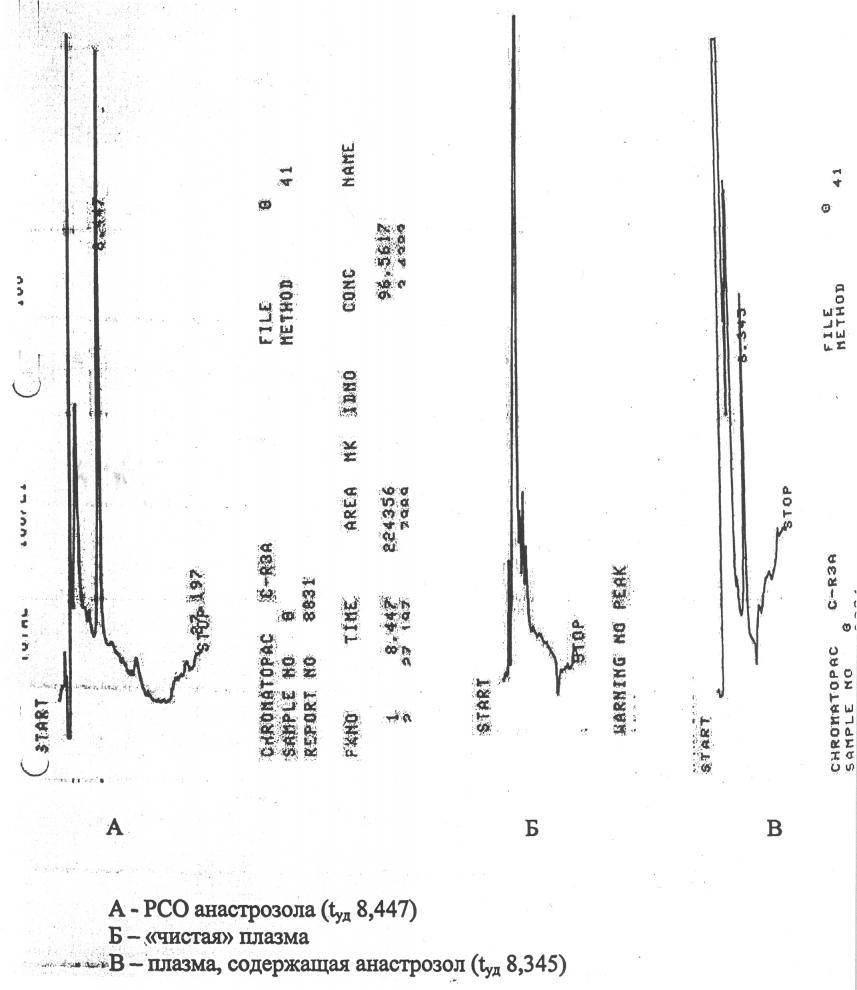
Рисунок 1. Образцы хроматограмм.
Изучение биоэквивалентности анастрозола на мини-свиньях
Работа, связанная с содержанием животных, введением препарата и отбором проб крови осуществлялась в ГУ «Научный центр биомедицинских технологии РАМН» (Москва) в лаборатории биомедицины. Исследование выполнено на 12 мини-свиньях светлогорской популяций (MSY) (самцы) с живой массой 45,1-51,8 кг. (Светлогорские миниатюрные свиньи являются анатомически и физиологически нормальными животными, обладающими принципиальными отличиями от конвенциональных пользовательных свиней – карликовыми размерами, и, соответственно, небольшой массой тела).
В работе использованы препараты, содержащие 1 мг анастрозола - Веро-анастрозол (Test) и Аримидекс (Reference). Исследуемые препараты вводили перорально в дозе 2 мг одного из препаратов (согласно плану рандомизации). Отбор крови осуществлялся до и спустя 1, 1.5, 2, 3, 4, 6, 8, 10, 12, 24, 48 и 72 часа после приема препарата.
Отбирали пробы крови в объеме 5 мл в стеклянные пробирки. Плазму отделяли центрифугированием (2500 об/мин в течение 10 минут). Пробирки с плазмой направляли в фармакокинетическую лабораторию и хранили при -350С до анализа.
Динамика концентрации анастрозола в плазме крови животных после однократного перорального введения 2 мг представлена на рисунках 2, 3. Результаты расчетов фармакокинетических параметров анастрозола после введения изучаемых препаратов представлены в таблице 1.
Следует отметить, что через 72 часа после введения препарата концентрация анастрозола во всех пробах была ниже предела определения. Полученные данные показывают, что значения фармакокинетических параметров после введения изучаемых препаратов статистически достоверно не различались.
Параметры относительной биодоступности анастрозола после однократного введения препарата Веро-анастрозол по отношению к препарату Аримидекс представлены в таблице 2.
Из приведенных данных видно, что среднее значение относительной биодоступности (f) препарата Веро-анастрозол по отношению к препарату Аримидекс составило 0,96 + 0,13. Среднее значение отношений максимальных концентраций составило 0,94 + 0,25.
Дисперсионный анализ значений AUC0-t, Cmax, Cmax/AUC0-t, проведенный после их логарифмического преобразования не выявил статистически значимых различий между препаратами.
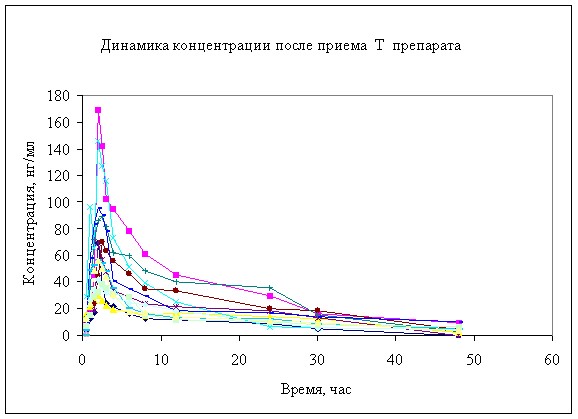
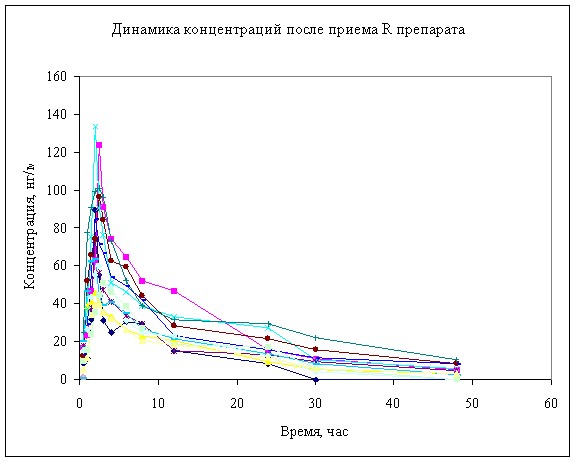
Рисунок 2. Динамика концентрации анастрозола в в крови мини-свиней после однократного перорального введения 2 мг.
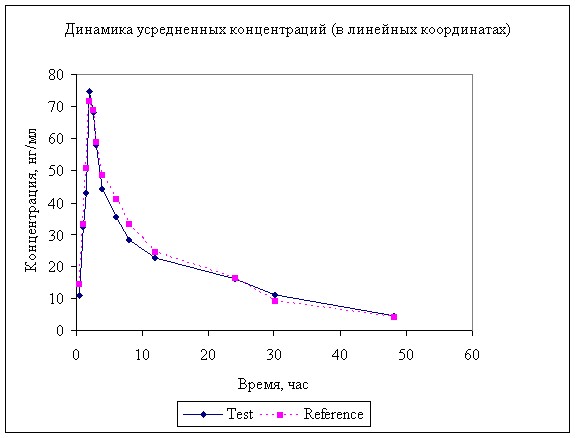
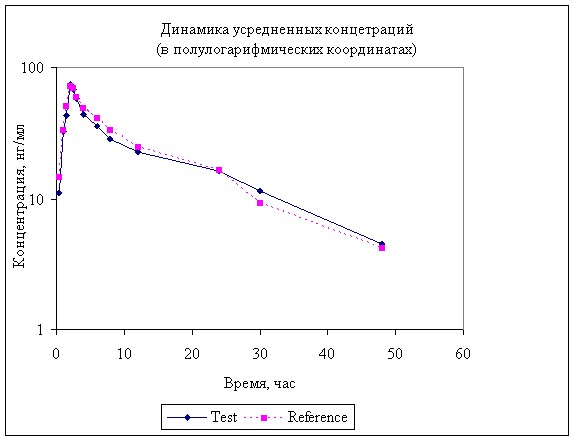
Рисунок 3. Усредненная динамика концентрации анастрозола в в крови мини-свиней после однократного перорального введения 2 мг.
Таблица 1
Фармакокинетические параметры анастрозола
| Cmax, нг/мл | Tmax, час | AUC0-t, нг*ч/мл | Cmax /AUC0-t | |
| Веро-анастрозол | ||||
| Mean | 77,6 | 2,1 | 882,3 | 0,089 |
| GMean | 68,7 | 2,1 | 816,7 | 0,084 |
| SD | 42,1 | 0,2 | 375,5 | 0,033 |
| Median | 69,6 | 2,0 | 729,9 | 0,087 |
| L-95% | 52,0 | 2,0 | 653,5 | 0,069 |
| Up-95% | 192,1 | 2,3 | 1111,0 | 0,109 |
| Аримидекс | ||||
| Mean | 80,4 | 2,3 | 907,2 | 0,091 |
| GMean | 75,2 | 2,3 | 856,6 | 0,088 |
| SD | 30,0 | 0,3 | 323,1 | 0,030 |
| Median | 79,4 | 2,25 | 766,6 | 0,083 |
| L-95% | 62,1 | 2,1 | 710,4 | 0,073 |
| Up-95% | 98,7 | 2,5 | 1104,0 | 0,110 |
Таблица 2
Параметры относительной биодоступности у мини-свиней
| № п/п | f, % | fII, % |
| Mean | 0,96 | 0,94 |
| SD | 0,13 | 0,25 |
| CV | 13 | 27 |
| Доверительный интервал | 0,88 1,04 | 0,79 1,10 |
Изучение биоэквивалентности анастрозола на собаках
Исследование проводили на 12-ти беспородных собаках (самцах весом от 15 до 21 кг). Каждой из собак вводили обе формы препарата с интервалом 18 дней. Очередность введения препаратов была рандомизирована. В работе использованы препараты, содержащие 1 мг анастрозола - Анастера и Аримидекс. Препарат вводили внутрь с небольшим количеством творога в дозе 2 мг (2 таблетки по 1 мг). Введение препаратов осуществляли натощак, кормление животных проводили через 3 часа после введения препарата. Пробы крови в объеме не менее 3 мл отбирали из подкожной вены голени в интервале от 0 до 72 часов после введения препаратов. Плазму крови отбирали после центрифугирования (10 минут при 3000 об/мин) и хранили при –35°С до анализа.
Динамика концентрации анастрозола в плазме крови животных после однократного перорального введения 2 мг представлена на рисунках 4, 5, а результаты расчетов фармакокинетических параметров в таблице 3.
Следует отметить, что через 72 часа после введения препарата концентрация анастрозола во всех пробах была ниже предела определения. Полученные данные показывают, что значения фармакокинетических параметров после введения изучаемых препаратов статистически достоверно не различались.
Параметры относительной биодоступности анастрозола после однократного приема препарата Анастера по отношению к препарату Аримидекс представлены в таблице 4.
Из приведенных данных видно, что среднее значение относительной биодоступности (f) препарата Анастера по отношению к препарату Аримидекс составило 1,01 + 0,19. Среднее значение отношений максимальных концентраций составило 1,04 + 0,22.
Дисперсионный анализ значений AUC0-t, Cmax, Cmax/AUC0-t, проведенный после их логарифмического преобразования не выявил статистически значимых различий между препаратами.
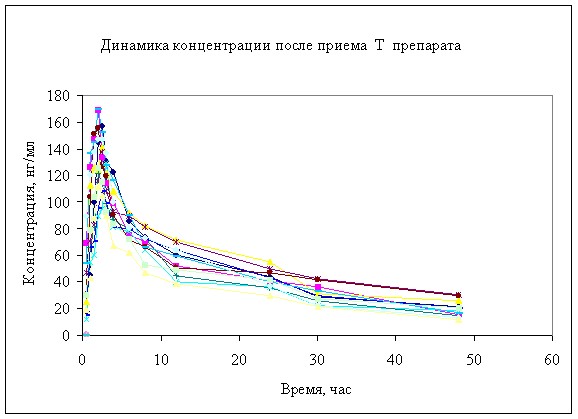
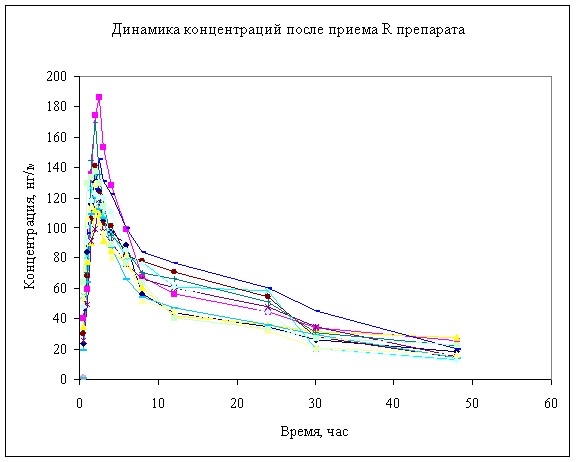
Рисунок 4. Динамика концентрации анастрозола в в крови собак после однократного перорального введения 2 мг.
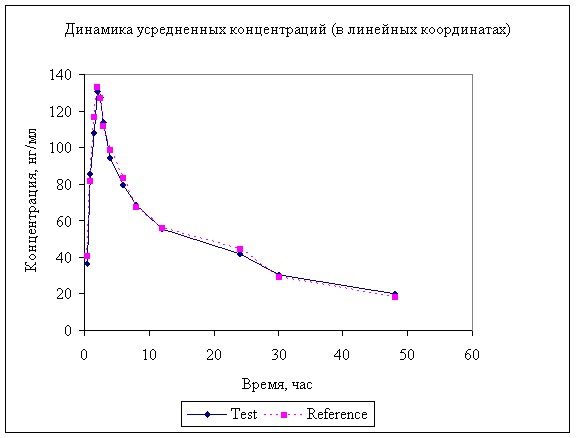
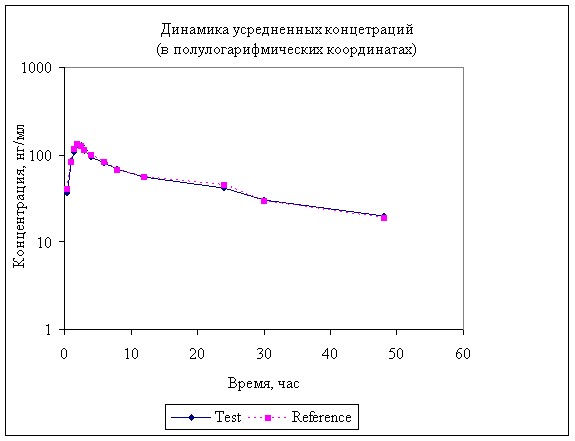
Рисунок 5. Усредненная динамика концентрации анастрозола в в крови собак после однократного перорального введения 2 мг.
Таблица 3
Фармакокинетические параметры анастрозола
| Cmax, нг/мл | Tmax, час | AUC0-t, нг*ч/мл | Cmax /AUC0-t | |
| Анастера | ||||
| Mean | 139,3 | 2,3 | 2195,7 | 0,064 |
| GMean | 137,9 | 2,3 | 2171,7 | 0,064 |
| SD | 20,7 | 0,3 | 329,0 | 0,008 |
| Median | 139,3 | 2,25 | 2232,1 | 0,065 |
| L-95% | 126,7 | 2,1 | 1995,3 | 0,059 |
| Up-95% | 170,7 | 2,5 | 2396,1 | 0,069 |
| Аримидекс | ||||
| Mean | 137,4 | 2,1 | 2210,8 | 0,062 |
| GMean | 136,0 | 2,1 | 2192,7 | 0,062 |
| SD | 21,5 | 0,2 | 302,4 | 0,008 |
| Median | 133,0 | 2,0 | 2182,9 | 0,062 |
| L-95% | 124,3 | 2,0 | 2026,6 | 0,058 |
| Up-95% | 150,5 | 2,3 | 2395,0 | 0,067 |
Таблица 4
Параметры относительной биодоступности у собак
| № п/п | f, % | fII, % |
| Mean | 1,01 | 1,04 |
| SD | 0,19 | 0,22 |
| CV | 19 | 21 |
| Доверительный интервал | 0,89 1,12 | 0,90 1,17 |
ОБЩИЕ ВЫВОДЫ
- Разработана методика количественного определения анастрозола в крови животных (собак и мини-свиней) методом высокоэффективной жидкостной хроматографии с УФ-детектированием. В качестве экстрагента предложен дихлорметан.
- Определенны фармакокинетические параметры анастрозола после однократного перорального введения 2 мг анастрозола в виде таблеток Анастера у собак (Сmax = 139,3+20,7 нг/мл, Tmax =2,3+0,3 ч, AUC0-t = 2195,7+329,0 нг*ч/мл).
- Определены фармакокинетические параметры анастрозола после однократного перорального введения 2 мг анастрозола в виде таблеток Веро-анастрозол у мини-свиней (Сmax= 77,6+42,1 нг/мл, Tmax =2,1+0,2 ч, AUC0-t = 882,3+375,5 нг*ч/мл).
- Проведено сравнительное изучение фармакокинетики препаратов Аримидекс и Анастера у собак. Не выявлено статистически достоверных различий в процессе всасывания (как по полноте, так и по скорости) анастрозола у собак после приема препаратов Анастера и Аримидекс.
- Проведено сравнительное изучение фармакокинетики препаратов Аримидекс и Веро-анастрозол у мини-свиней. Не выявлено статистически достоверных различий в процессе всасывания (как по полноте, так и по скорости) анастрозола у мини-свиней после приема препаратов Веро-анастрозол и Аримидекс.
- Среднее значение относительной биодоступности препарата Веро-анастрозол по отношению к препарату Аримидекс составило 0,96 + 0,13. Среднее значение отношений максимальных концентраций составило 0,94 + 0,25. Среднее значение относительной биодоступности препарата Анастера по отношению к препарату Аримидекс составило 1,01 + 0,19. Среднее значение отношений максимальных концентраций составило 1,04 + 0,22.
- При сопоставлении полученных результатов динамики концентрации анастрозола на животных (собаках и мини-свиньях) с ретроспективными данными динамики концентрации анастрозола после приема в аналогичной дозе у людей отмечено, что профиль концентрации анастрозола у животных повторяет профиль концентрации у человека, а фармакокинетические параметры с учетом дозы на килограмм веса близки.
Список работ, опубликованных по теме диссертации
- Салар Эйса Задех фалахатий, Кукес В. Г., Капанадзе Г.Д., Фармакокинетика анастрозола// ж.“Фармация“ №2, 2008, с.36.
- Салар Эйса Задех фалахатий, Раменская Г.В., Капанадзе Г.Д., Доклинические исследования анострозола на крупных лабораторных животных (мини свиньи), ж. Биомедицина, 2008, №2, с. 17.

