Исследование антирадикальной активности композиций на базе диквертина
На правах рукописи
ИЛЬЯСОВ ИГОРЬ РАВИЛЕВИЧ
ИССЛЕДОВАНИЕ АНТИРАДИКАЛЬНОЙ АКТИВНОСТИ КОМПОЗИЦИЙ НА БАЗЕ ДИКВЕРТИНА
15.00.02 – фармацевтическая химия, фармакогнозия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата фармацевтических наук
МОСКВА – 2009
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования Московская медицинская академия имени И.М. Сеченова Федерального агентства по здравоохранению и социальному развитию
Научный руководитель:
доктор фармацевтических наук, профессор Белобородов Владимир Леонидович
Официальные оппоненты:
доктор химических наук, профессор Харитонов Юрий Яковлевич
доктор фармацевтических наук, профессор Берлянд Александр Семенович
Ведущая организация:
Государственное учреждение Всероссийский научно-исследовательский институт лекарственных и ароматических растений Российской академии сельскохозяйственных наук
Защита диссертации состоится «16» февраля 2009 г. в 14 часов на заседании диссертационного совета Д.208.040.09 при Московской медицинской академии имени И.М. Сеченова по адресу: 121019, г. Москва, Никитский бульвар, 13.
С диссертацией можно ознакомиться в библиотеке Московской медицинской академии имени И.М. Сеченова по адресу: 117998, г. Москва, Нахимовский проспект, 49.
Автореферат разослан «____» января 2009 г.

Ученый секретарь
диссертационного совета Д.208.040.09
доктор фармацевтических наук, профессор Садчикова Наталья Петровна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Избыточная продукция свободных радикалов в организме является центральным фактором риска сердечно-сосудистых, онкологических заболеваний, атеросклероза, гипертонии и других патологий. Необходимость коррекции заболеваний, в патогенезе которых ведущую роль играет свободнорадикальное окисление, определяет актуальность поиска перспективных средств антиоксидантной фармакотерапии. Среди экзогенных природных антиоксидантов (АО) ведущее место занимают флавоноиды, которые, как правило, обладают широким спектром биологического действия и антирадикальной активностью (АРА). На протяжении ряда лет на кафедре органической химии в содружестве с другими научными учреждениями ведутся работы по созданию флавоноидсодержащих фитопрепаратов. Одним из таких препаратов является диквертин – новое антиоксидантное и капилляропротекторное средство, представляющее собой флавоноидный экстракт из древесины лиственницы сибирской с доминирующим содержанием дигидрокверцетина. В последние годы наметился интерес к созданию композиций природных АО с целью оптимизации их использования в лечении и профилактике патологий, вызванных оксидативным стрессом.
Проблема скрининга антиоксидантной активности природных соединений и оценки их эффективности является актуальной задачей, как для выявления механизмов их биологического действия, так и для создания препаратов на их основе. Одним из методологических подходов в рамках этой задачи является изучение АРА как одной из составляющих антиоксидантной активности потенциальных АО. В настоящее время разработаны разнообразные методы оценки АРА как индивидуальных соединений, так и композиционных смесей. Однако получаемые разными методами результаты не всегда сопоставимы и зависят от выбранного методологического подхода и способа оценки. Для эффективного поиска перспективных АО необходимо применение таких методов, которые позволяют не только проводить оценку АРА индивидуальных соединений и многокомпонентных смесей, но и выявлять возможность проявления синергизма или антагонизма как компонентов, входящих в состав композиций, так и компонентов с эндогенными АО. В настоящей работе для решения этой проблемы развиты два методологических подхода, основанных на применении радикал-катионов 2,2/-азино-бис(3-этилбензтиазолин-6-сульфоновой кислоты) диаммониевой соли (ABTS•+) для характеристики АРА в условиях in vitro.
Цель и задачи исследования. Цель работы состояла в характеристике общей антирадикальной активности ряда флавоноидов, эндогенных АО и композиций диквертина и его компонентов с эндогенными АО на основании их ингибирующей способности по отношению к генерируемым в модельных условиях радикал–катионам ABTS•+.
В соответствии с поставленной целью разработаны две стратегии характеристики АРА: (1) способ, основанный на предварительном генерировании радикал-катионов ABTS•+ и последующем измерении восстанавливающей способности изучаемых объектов в фиксированной временной точке (деколоризационный способ), и (2) способ, основанный на генерировании радикал-катионов ABTS•+ в присутствии потенциальных АО (кинетический способ).
Для достижения поставленной цели необходимо было решить следующие задачи.
- Обосновать применимость каждого из двух способов для адекватной оценки АРА индивидуальных соединений и многокомпонентных составов.
- Валидировать методики измерения ингибирующей способности потенциальных АО для каждого из двух способов.
- Охарактеризовать АРА ряда флавоноидов и эндогенных АО (аскорбиновой кислоты, глутатиона, -токоферола).
- Выявить параметры, пригодные для скрининга АРА потенциальных АО, и параметры, отражающие взаимодействие компонентов композиционных составов.
- Произвести оценку АРА композиций диквертина и его компонентов с эндогенными АО. Выявить возможный синергизм или антагонизм антирадикальных свойств компонентов композиций.
- Выявить в ряду флавоноидов взаимосвязь «структура – антирадикальные свойства».
Научная новизна. Обоснована валидность двух спектрофотометрических методов характеристики АРА индивидуальных соединений, многокомпонентных смесей и композиционных составов, основанных на способности ингибировать генерируемые в модельных условиях радикал-катионы ABTS•+.
Дана оценка АРА ряда флавоноидов, эндогенных АО, многокомпонентных смесей и композиционных составов, охарактеризованная показателями TEAC, IC50 и удельной ингибирующей концентрации. Установлено, что АРА исследованных объектов изменяется в ряду: кверцетин > морин > апигенин > дигидрокверцетин > диквертин > нарингенин > пикногенол > рутин > аскорбиновая кислота > глутатион > -токоферол. Охарактеризована взаимосвязь «структура – антирадикальные свойства» в ряду исследованных флавоноидов.
Получены кинетические кривые развития радикал-катионов ABTS•+в присутствии исследованных объектов, охарактеризована степень и скорость, с которой исследованные объекты восстанавливают данные радикал-катионы.
Обнаружен значительный синергизм композиции диквертин–глутатиона, и незначительный антагонизм композиции диквертин–аскорбиновая кислота. Величина эффекта определяется соотношением концентраций компонентов композиции.
Для композиции диквертин–-токоферол установлено, что АРА композиции соответствует рассчитанной аддитивной сумме вкладов ее компонентов. Кинетические кривые свидетельствуют, что вначале расходуется быстрореагирующий -токоферол, а затем компоненты диквертина.
Практическая и теоретическая значимость. Валидированная методика оценки АРА, основанная на предварительном генерировании радикал-катионов ABTS•+, позволяет осуществлять скрининг потенциальных АО и может служить как простой, надежный и воспроизводимый метод для исследования как индивидуальных веществ, так и многокомпонентных смесей, в том числе природного растительного сырья и фитопрепаратов.
Предложенная методика изучения кинетического поведения соединений с АРА, основанная на генерировании ABTS•+ в присутствии потенциальных АО и, дополняет арсенал методов исследования АРА и может использоваться для изучения особенностей взаимодействия компонентов сложных смесей и выявления механизма их действия.
Характеристика АРА ряда флавоноидов и эндогенных АО, полученная в настоящем исследовании, может использоваться при разработке новых препаратов антиоксидантного действия.
Основные положения, выносимые на защиту.
- Обоснование применимости двух спектрофотометрических способов оценки АРА для характеристики антирадикальных свойств соединений и многокомпонентных составов.
- Валидированные методики определения АРА, основанные на предварительном генерировании радикал-катионов ABTS•+ и последующем измерении восстанавливающей способности, и на генерировании радикал-катионов в присутствии потенциальных АО.
- Способы расчета основных показателей АРА.
- Характеристика общей АРА ряда флавоноидов и эндогенных АО в различных показателях.
- Результаты изучения кинетических зависимостей проявления антирадикальных свойств исследованных объектов.
- Результаты исследования взаимодействия компонентов композиций диквертина и флавоноидов с аскорбиновой кислотой, глутатионом и -токоферолом.
- Тенденции взаимозависимости «структура – антирадикальные свойства» в ряду флавоноидов.
Апробация работы. Основные положения работы доложены на VIII международном съезде «Актуальные проблемы создания новых лекарственных препаратов природного происхождения» (Финляндия, Миккели 2004), на VI Симпозиуме по фенольным соединениям (Москва 2004), на XIV Российском национальном конгрессе «Человек и лекарство» (Москва 2007), Всероссийской научно-методической конференции «Пути и формы совершенствования фармацевтического образования. Создание новых физиологически активных веществ» (Воронеж 2007), V Конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины» (Москва 2008).
Публикации. По теме диссертации опубликовано 8 печатных работ
Связь задач исследования с проблемным планом фармацевтических наук. Диссертационная работа выполнена в рамках комплексной темы кафедры органической химии ММА им. И.М. Сеченова: «Физико-химические основы стандартизации и биотрансформации лекарственных средств и биологически активных добавок к пище». Номер госрегистрации 01 2006 06 352.
Объем и структура диссертации. Диссертация изложена на 148 страницах машинописного текста и состоит из введения, обзора литературы, двух глав, отражающих собственные экспериментальные исследования, выводов, списка литературы и приложения. Работа иллюстрирована 23 таблицами, 32 рисунками. Библиографический список включает 59 отечественных и 104 зарубежных источников.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Характеристика основных объектов и методов исследования. Объектами настоящего исследования служили природные полифенольные соединения в виде индивидуальных веществ или многокомпонентных смесей и их композиции с некоторыми эндогенными АО. В качестве стандарта АРА использовали водорастворимый аналог -токоферола – тролокс.
Многокомпонентные смеси. Диквертин (ДКВ) – отечественный фитопрепарат, обладающий широким спектром биологического действия. Основным действующим компонентом является дигидрокверцетин (ДГК) (не менее 90%). Используемый образец ДКВ по данным ВЭЖХ содержит 90,23±0,32% ДГК, 0,67±0,05% дигидрокемпферола, 0,28±0,03% нарингенина и 2,21±0,11% кверцетина (Р 0,95). Пикногенол – экстракт коры приморской сосны (Pinus maritima Mill.). Основными компонентами пикногенола являются процианидины и фенолокислоты (феруловая, кофейная, п-гидроксибензойная), в состав пикногенола также входит ДГК.
Индивидуальные соединения. Флавоноиды – ДГК (флаванонол); кверцетин и морин (флавонолы); нарингенин (флаванон); апигенин (флавон) и дигликозид кверцетина рутин. Эндогенные антиоксиданты – аскорбиновая кислота, -липоевая кислота, -токоферол, глутатион (восстановленная форма).
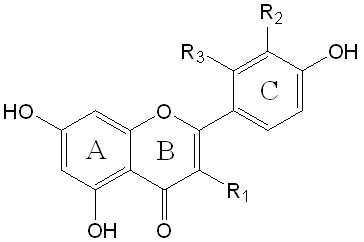
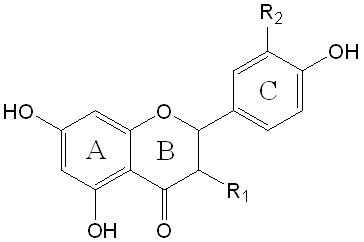
кверцетин R1=R2=OH, R3=H дигидрокверцетин R1=R2=OH
морин R1=R3=OH, R2=H нарингенин R1=R2=H
апигенин R1=R2=R3=H
рутин R1=O-Rut, R2=OH, R3=H
Композиционные составы. В последние годы наметилась тенденция к созданию композиций природных АО с целью оптимизации их использования в лечении и профилактике болезней «оксидативного стресса». На основе композиции ДКВ и аскорбиновой кислоты создан препарат «Асковертин»; комбинация ДКВ, -липоевой и аскорбиновой кислот – основа БАД «Липовертин». В связи с этим особый интерес представляло изучение АРА композиций ДКВ с эндогенными АО.
Одной из основных задач работы была оценка АРА и определение степени взаимного влияния компонентов следующих композиций.
Композиции на основе диквертина: ДКВ–аскорбиновая кислота; ДКВ– -токоферол; ДКВ–глутатион; ДКВ–ацетилсалициловая кислота; ДКВ–аскорбиновая кислота–-липоевая кислота.
Композиции на основе индивидуальных флавоноидов: ДГК–аскорбиновая кислота; кверцетин–аскорбиновая кислота; нарингенин–аскорбиновая кислота; рутин–аскорбиновая кислота.
Композиции эндогенных антиоксидантов: аскорбиновая кислота–-токоферол.
Составы композиций варьировали в широком диапазоне соотношений концентраций компонентов.
Основным аналитическим методом, используемым в работе, являлся метод спектроскопии в УФ и видимой областях спектра. Для количественной характеристики компонентов ДКВ использовался метод ВЭЖХ.
ИССЛЕДОВАНИЕ АНТИРАДИКАЛЬНОЙ АКТИВНОСТИ РЯДА
ФЛАВОНОИДОВ И НЕКОТОРЫХ ЭНДОГЕННЫХ АНТИОКСИДАНТОВ
С ИСПОЛЬЗОВАНИЕМ РАДИКАЛ-КАТИОНОВ ABTS•+
На данный момент не существует единой унифицированной методики определения антирадикальной активности соединений, как одной из составляющих антиоксидантной активности. Для получения как можно более полной информации об антирадикальных свойствах исследуемого объекта необходимо использовать различные стратегии, каждая из которых будет предоставлять свою уникальную информацию. В настоящей работе разрабатывались два методологических варианта характеристики АРА по отношению к радикал-катионам ABTS•+: (1) способ, основанный на предварительном генерировании радикал-катионов ABTS•+ и последующем измерении восстанавливающей способности исследуемых объектов в фиксированной временной точке и (2) способ, основанный на генерировании радикал-катионов в присутствии потенциальных антиоксидантов и измерении индукционного периода появления радикал-катионов ABTS•+.
1. Способ, основанный на предварительном генерировании
радикал-катионов ABTS•+ (деколоризационный способ)
1.1. Физико-химические основы метода
В основу данного подхода положен метод, предложенный Re R. et al. (1999), с нашей модификацией, касающейся расширения экспериментальных возможностей и приемов математической обработки результатов. Для сопоставления АРА исследуемых объектов применен общий стандартизованный подход, основанный на их способности ингибировать генерируемые в модельных условиях ABTS•+. Добавляемые в инкубационную среду анализируемые вещества подавляют поглощение ABTS•+ в соответствии с их АРА.
Генерирование радикал-катионов ABTS•+. К раствору ABTS в солевом фосфатном буфере (PBS) рН 7,4 добавляли раствор пероксидисульфата калия в том же буфере. Максимальная концентрация ABTS•+ достигается через 6 ч после добавления инициатора. ABTS•+ имеет три полосы поглощения в длинноволновой области спектра с максимумами при 647, 730 и 812 нм (рис. 1, верхняя кривая). Конечную концентрацию ABTS•+ в рабочей смеси готовили такой, чтобы поглощение в максимуме при 730 нм составляло 0,7±0,05 единиц оптической плотности (b 1 см).

Рис. 1. Спектр поглощения ABTS•+ в отсутствие (верхняя кривая) и в присутствии
ДКВ (нижняя кривая)
Рабочие растворы АО готовили, создавая такие концентрации в PBS, добавление которых в объеме 5, 10, 15, 20, 25 мкл к 3,9 мл раствора ABTS•+ вызывало подавление поглощения ABTS•+ в интервале от 20 до 60%. Реакцию проводили в темноте при 30 оС в течение 4 мин и затем записывали спектр в интервале 600-850 нм. Конечная точка реакции была выбрана после серии экспериментов, показавших, что восстановление ABTS•+ АО протекает в течение 1–2 мин и практически заканчивается к 4 мин. Процент ингибирования ABTS•+ (доля, на которую снижается концентрация свободных радикалов в системе под действием соединения, обладающего АРА) вычисляли по формуле: %ингибирования=100•(1–А2/А1), где А1 – оптическая плотность раствора ABTS•+ на длине волны 730 нм без добавления исследуемого образца, А2 – оптическая плотность раствора ABTS•+ через 4 мин после добавления образца.
Валидация методики. Специфичность методики заключается в том, что все исследуемые объекты, обладающие АРА, вызывают уменьшение интенсивности поглощения ABTS•+, как это показано на примере ДКВ (рис. 1, нижняя кривая). Ацетилсалициловая и -липоевая кислоты, не проявляющие АРА, не изменяли интенсивность поглощения ABTS•+. Полосы поглощения ABTS•+ находятся в той длинноволновой области спектра, в которой большинство исследуемых веществ и их радикалов не имеет собственного поглощения. Метод применим как для индивидуальных соединений, так и многокомпонентных смесей (ДКВ, пикногенола). Для каждого из исследованных объектов получены линейные зависимости процента ингибирования ABTS•+ в интервале 15-70% от концентрации образца в растворе вида y=ax+b, где у – степень ингибирования ABTS•+, (%); х – концентрация АО. Линейные зависимости характеризуются коэффициентами корреляции от 0,959 (кверцетин) до 0,998 (токоферол). Воспроизводимость методики охарактеризована степенью совпадения результатов индивидуальных определений на примере трех концентраций тролокса (табл. 1). Представленные данные свидетельствуют о хорошей воспроизводимости результатов.
Таблица 1. Оценка воспроизводимости результатов определения процента
ингибирования ABTS•+ тролоксом
| Концентрация, мкмоль/л | xср±xср, % | n | S | ср |
| 6,56 | 30,1±1,3 | 9 | 1,9 | 4,2 |
| 9,80 | 43,3±2,4 | 8 | 3,4 | 5,5 |
| 13,19 | 56,9±2,6 | 7 | 3,6 | 4,6 |
1.2. Антирадикальная активность индивидуальных соединений и
многокомпонентных смесей
Для оценки АРА рассчитывали наиболее распространенные показатели – IC50 и TEAC – на основании уравнений линейной регрессии, используя интервал концентраций, приводящих к ингибированию ABTS•+ в диапазоне 20-60%.
IC50 (inhibition concentration) – концентрация АО, при которой нейтрализуется 50% свободных радикалов. Для расчета величин IC50 использовали полученные уравнения линейных зависимостей.
Наиболее универсальной относительной характеристикой АРА является TEAC (trolox equivalent antioxidant capacity) – эквивалент антиоксидантной активности в пересчете на тролокс, активность которого принимают за 1,0. Для индивидуальных соединений значения ТЕАС выражали как миллимолярную концентрацию тролокса, имеющую такую же АРА, как раствор исследуемого вещества с концентрацией 1 ммоль/л (TEACM). Для многокомпонентных смесей ТЕАС выражали как концентрацию тролокса (ммоль/л), соответствующую по АРА концентрации 1 г/л изучаемого объекта (TEACg). Расчетные величины TEAC20-60% получены как среднее значение для всего диапазона ингибирования ABTS•+. Для сравнительного анализа рассчитывали также значения TEACIC50 для IC50 (табл. 2).
Таблица 2. Характеристика антирадикальной активности исследуемых соединений
на основе молярных концентраций
| ТЕАСM20-60% | ТЕАСMIC50 | IC50 (мкмоль/л) | ||
| Уменьшение АРА | Кверцетин | 5,52±0,07 | 5,07±0,06 | 1,94±0,02 |
| Морин | 3,34±0,07 | 2,90±0,06 | 3,39±0,07 | |
| Рутин | 3,28±0,15 | 2,76±0,12 | 3,56±0,16 | |
| Дигидрокверцетин | 2,73±0,08 | 2,27±0,06 | 4,32±0,12 | |
| Апигенин | 2,52±0,08 | 2,24±0,08 | 4,39±0,15 | |
| Нарингенин | 2,28±0,10 | 1,94±0,08 | 5,05±0,21 | |
| Глутатион | 1,30±0,04 | 1,15±0,04 | 8,52±0,28 | |
| -Токоферол | 0,89±0,01 | 0,79±0,01 | 12,45±0,17 | |
| Аскорбиновая кислота | 0,83±0,01 | 0,71±0,01 | 13,74±0,25 |
В литературных источниках часто приводятся значения TEAC для какой-либо одной произвольно выбранной концентрации. Сопоставительный анализ величин TEAC20-60% и TEACIC50 показал, что значения, полученные исходя из диапазона ингибирования ABTS•+, превышают таковые, полученные для концентрации IC50 в среднем на 13,4±1,8%. Учитывая, что зависимость степени ингибирования от концентрации АО не является строго прямой пропорциональностью, на наш взгляд, для оценки АРА предпочтительнее использовать показатель TEAC, получаемый в диапазоне концентраций.
Результаты оценки АРА многокомпонентных смесей в сравнении с таковой индивидуальных веществ (АРА которых пересчитана в эквивалентах TEACg) представлены в табл. 3.
Как видно из данных табл. 3, АРА ДКВ в 1,6 раза больше таковой пикногенола, что позволяет предположить перспективность ДКВ как антиоксидантного лекарственного средства. Важно отметить, что прогнозируемое значение TEAC ДКВ (из расчета, на 90%-ное содержание ДГК), оказалось на 10% меньше экспериментального. АРА ДКВ практически не отличается от таковой ДГК (8,83 и 8,99 соответственно), что, по-видимому, является следствием вкладов присутствующих в его составе других флавоноидов в общую АРА.
Таблица 3. Характеристика антирадикальной активности исследуемых объектов
на основе массовых концентраций
| ТЕАСg20-60% | ТЕАСgIC50 | IC50 (мг/л) | ||
Уменьшение АРА  | Кверцетин | 18,26±0,22 | 16,76±0,20 | 0,59±0,01 |
| Морин | 11,06±0,23 | 9,59±0,20 | 1,02±0,02 | |
| Апигенин | 9,33±0,39 | 8,27±0,35 | 1,19±0,05 | |
| Дигидрокверцетин | 8,99±0,22 | 7,47±0,20 | 1,31±0,04 | |
| Диквертин | 8,83±0,22 | 7,31±0,20 | 1,34±0,04 | |
| Нарингенин | 8,39±0,38 | 7,14±0,32 | 1,37±0,06 | |
| Пикногенол | 5,56±0,21 | 4,88±0,19 | 2,03±0,06 | |
| Рутин | 5,38±0,18 | 4,52±0,15 | 2,17±0,07 | |
| Аскорбиновая кислота | 4,69±0,07 | 4,06±0,06 | 2,42±0,03 | |
| Глутатион | 4,24±0,08 | 3,75±0,07 | 2,62±0,05 | |
| Токоферол | 2,06±0,02 | 1,83±0,02 | 5,36±0,06 |
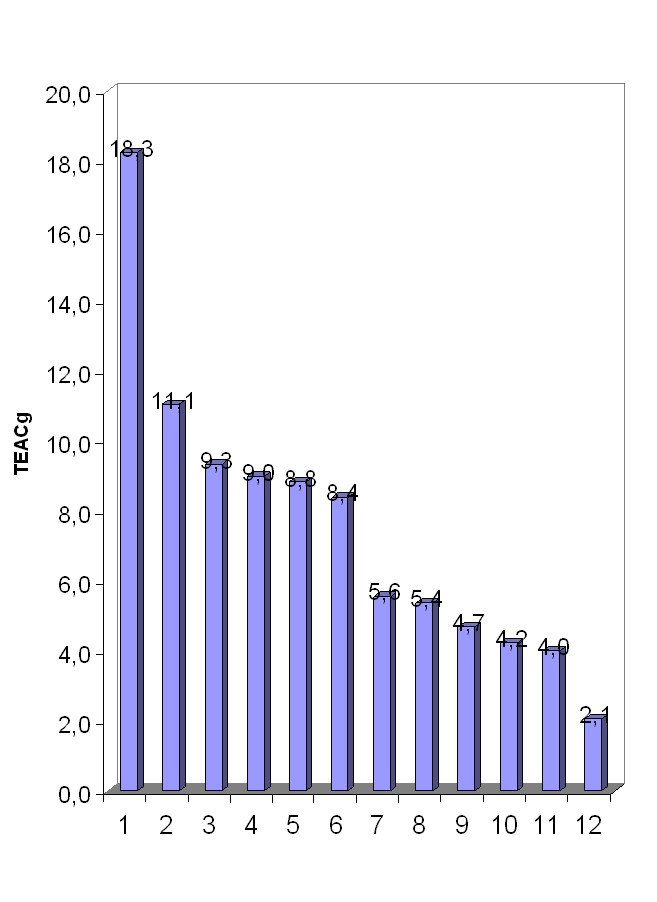

Рис. 2. Антирадикальная активность индивидуальных соединений и многокомпонентных
смесей
По значениям TEACg исследуемые объекты располагаются в следующий ряд: кверцетин > морин > апигенин > ДГК ДКВ > нарингенин > пикногенол > рутин > аскорбиновая кислота > глутатион > токоферол (рис. 2). Значения АРА в единицах TEACM аскорбиновой кислоты, глутатиона и токоферола близки к таковой тролокса, что отмечалось многими исследователями.
1.3. Антирадикальная активность композиционных составов
АРА композиций исследована в широком диапазоне мольных соотношений. Концентрации компонентов рассчитывали таким образом, чтобы добавление раствора композиции в инкубируемую смесь в объеме 5-25 мкл вызывало подавление поглощения раствора ABTS•+ на 20-60%. Достоверное превышение экспериментальных значений АРА над теоретически рассчитанной аддитивной суммой вкладов компонентов свидетельствовало об эффекте синергизма, в противоположном случае – об эффекте антагонизма компонентов.
Для композиций ДКВ–аскорбиновая кислота (табл. 4) и ДКВ–-токоферол обнаружен эффект антагонизма, величина которого зависит от соотношения концентраций компонентов композиции. Максимально этот эффект проявляется для композиции ДКВ–аскорбиновая кислота при содержании компонентов 1:10 (антагонизм 23,6±8,1%), а для композиции ДКВ–-токоферол 1:2,5 (антагонизм 23,3±9,4%). Для композиции ДКВ–-липоевая кислота–аскорбиновая кислота в соотношении 1,2:1:5 эффект антагонизма достоверно не отличается от проявляемого композицией ДКВ–аскорбиновая кислота 1,2:5 и составляет 13,7±6,3%.
Таблица 4. Степень отклонения антирадикальной активности композиций
ДКВ–аскорбиновая кислота от аддитивной суммы вкладов компонентов
| Композиция ДКВ-аскорбиновая кислота (мольные соотношения) | Антагонизм, % |
| 10:1 | 8,2±7,4 |
| 5:1 | 11,7±8,9 |
| 3:1 | 20,2±13,5 |
| 1:1 | 17,3±10,2 |
| 1:3 | 22,2±11,7 |
| 1:5 | 21,0±10,2 |
| 1:10 | 23,6±8,1 |
Для композиций аскорбиновой кислоты с флавоноидами, являющимися компонентами ДКВ, также обнаружен небольшой антагонизм, с максимальными значениями для композиции ДГК–аскорбиновая кислота при соотношении компонентов 1:10 (32,7±10,2%) и для композиции кверцетин–аскорбиновая кислота 3:1 (20,9±7,0%). Характер эффекта композиции нарингенин–аскорбиновая кислота зависел от преобладания одного из компонентов в смеси. При преобладании нарингенина выявлен эффект синергизма с максимальным значением при соотношении 10:1 (синергизм 17,2±7,6%). При преобладании аскорбиновой кислоты обнаружен антагонизм до 18,7±5,2% (при соотношении 1:10).
Для композиции рутин–аскорбиновая кислота с массовым соотношением компонентов 1:1 (соответствует содержанию в препарате «Аскорутин») не обнаружено достоверного отклонения от аддитивной суммы вкладов компонентов в общую АРА.
Композиция эндогенных АО -токоферола и аскорбиновой кислоты проявляла антагонизм до 17,1±8,9% (при соотношении 5:1).
2. Способ, основанный на измерении индукционного периода
(кинетический способ)
С целью получения более полной информации о характере проявления антирадикальных свойств потенциальных антиоксидантов и кинетических закономерностях радикалулавливающей активности, нами разработана альтернативная стратегия, основанная на ингибировании накопления продукта окисления ABTS – радикал-катиона ABTS•+.
2.1. Физико-химические основы метода
Инициатор образования ABTS•+ (пероксидисульфат калия), субстрат (ABTS) и исследуемое вещество одновременно смешиваются на начальной стадии эксперимента. Наличие в реакционной среде АО ведет к восстановлению ABTS•+, что отражается в появлении индукционного периода (ИП), т. е. задержки во времени образования характерных для радикал-катиона полос поглощения в области 600-900 нм. Продолжительность ИП определяется природой АО, его реакционной способностью и концентрацией. Разработаны условия анализа в двух инкубационных средах – в растворе PBS (рН 7,4) и в этаноле. Кинетику образования ABTS•+ записывали в максимуме 730 нм в PBS и 747 нм в этаноле. Концентрации реагентов подбирали так, чтобы оптическая плотность инкубационной смеси без добавления антиоксиданта к 15-й мин составляла 1,24±0,05 (b 1 см) для растворов в PBS и 0,43±0,03 для растворов в этаноле.
В отсутствие АО образование ABTS•+ начинается сразу же после добавления в инкубационную среду пероксидисульфата калия (рис. 3.). Все измерения проводили при температуре 22 оС. Рабочие растворы объектов готовили в таких концентрациях, добавление которых к инкубационной смеси в объеме 5-25 мкл вызывало задержку появления полос поглощения ABTS•+ от 4 до 120 мин.

Рис. 3. Кинетические кривые развития ABTS•+ в растворе PBS в отсутствие (1) и при
добавлении 10, 15, 20, 25 мкл (2, 3, 4, 5 соответственно) 6,6 ммоль/л раствора ДГК
Ось абсцисс – время после введения K2S2O8 (t, мин), ось ординат – концентрация ABTS•+ (С, ммоль/л)


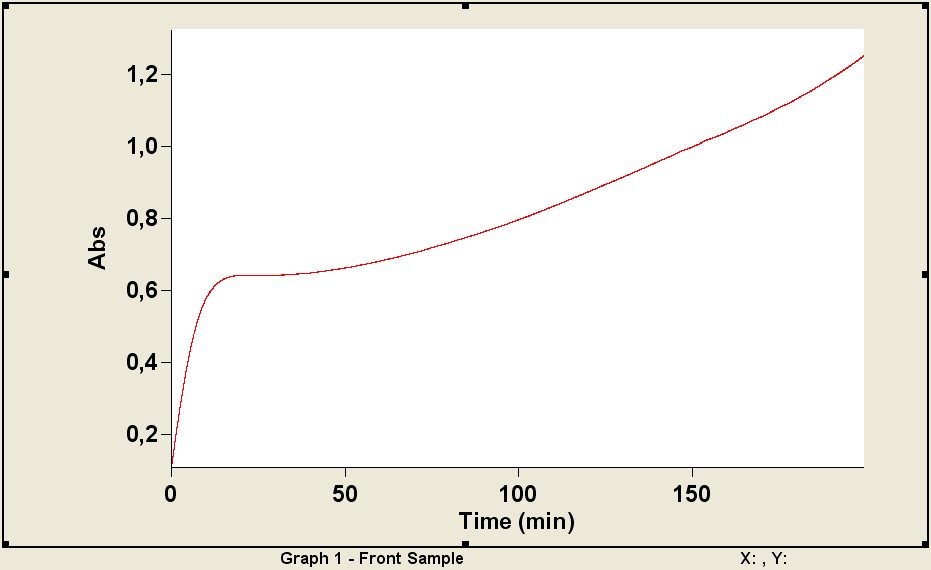
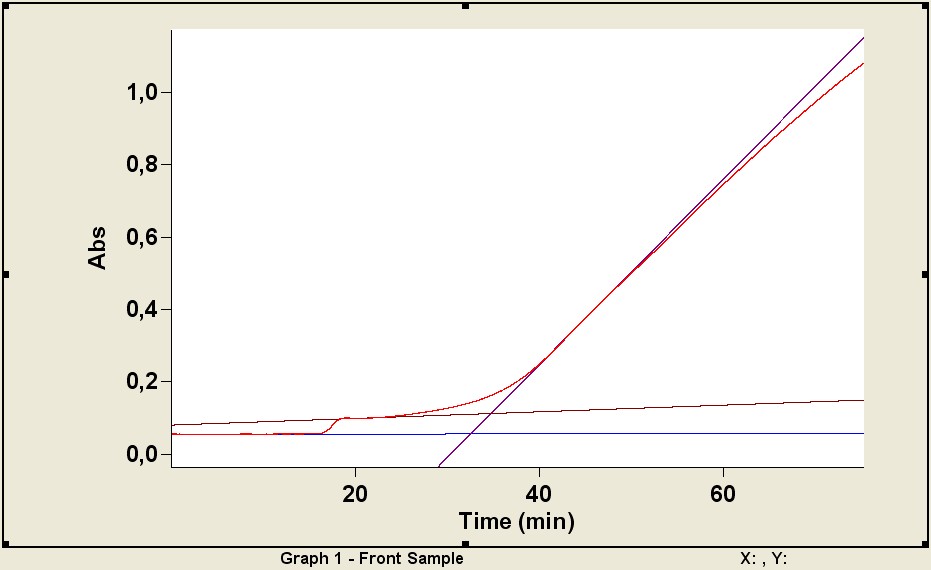

Рис. 4. Кинетические кривые развития ABTS•+ в растворе PBS в присутствии: а – тролокса
или токоферола; б – ДКВ, ДГК, кверцетина, рутина или глутатиона; в – морина; г – апигенина или нарингенина
– продолжительность ИП; V - точка максимальной скорости образования ABTS•+. Ось абсцисс – время после введения K2S2O8, ось ординат – оптическая плотность инкубационного раствора
Предварительными исследованиями установлено, что добавляемые в инкубационную среду АО нейтрализуют непосредственно ABTS•+, а не его образование через нейтрализацию инициатора – пероксидисульфата калия. Исключение составила аскорбиновая кислота, которая реагирует с пероксидисульфатом калия.
Валидация методики. Для каждого из исследованных объектов, кроме нарингенина и апигенина, получены линейные зависимости величин продолжительности ИП от концентрации АО вида y=ax+b, где y – продолжительность ИП, мин; x – концентрация АО. Линейные зависимости характеризуются коэффициентами корреляции от 0,989 (кверцетин) до 0,999 (-токоферол).
Воспроизводимость методики охарактеризована степенью совпадения результатов индивидуальных определений ИП на примере трех концентраций тролокса (табл. 5). Хорошая воспроизводимость методики подтверждена степенью совпадения результатов определений ИП на примере трех концентраций тролокса.
Таблица 5. Оценка воспроизводимости ИП на примере тролокса
| Концентрация, мкмоль/л | ИП, xср±xср, мин | n | S | ср |
| 15,37 | 4,4±0,1 | 5 | 0,2 | 3,1 |
| 30,73 | 9,2±0,5 | 5 | 0,6 | 5,3 |
| 46,10 | 14,2±0,5 | 5 | 0,6 | 3,8 |
2.2. Кинетические характеристики антирадикальной активности
индивидуальных соединений и многокомпонентных смесей
Введение исследуемых растворов АО, кроме нарингенина, вызывало появление ИП. Продолжительность ИП пропорционально возрастала с увеличением концентрации АО. Процесс, происходящий в инкубационной смеси, можно представить следующими уравнениями реакций:
2ABTS + S2O82- 2ABTS•+ + 2SO42- k1
ABTS•+ + RH ABTS + H+ + R• k2
(где RН – антиоксидант, k1 и k2 – константы скоростей первой и второй реакций соответственно).
Кинетические кривые образования ABTS•+ определяются природой антиоксиданта. Различие в форме кинетических кривых вероятно обусловлено разными значениями констант ингибирования.
При введении тролокса или -токоферола образование ABTS•+ начиналось с максимальной скоростью сразу после окончания ИП (рис. 4а). Добавление в инкубационную смесь ДКВ, ДГК, кверцетина, рутина или глутатиона приводило к появлению одного, а морина – двух периодов плато, и затем плавному переходу горизонтальной части кинетической кривой в восходящую (рис. 4б, 4в). Можно предположить, что для тролокса и -токоферола k2 >> k1 – как следствие к моменту окончания индукционного периода АО расходуется полностью. В случае с ДКВ, ДГК, кверцетином, морином и глутатионом k2 k1, т. е. при значительном расходовании АО процессы начинают конкурировать. Точка максимальной скорости образования ABTS•+ (V) предположительно является моментом полного расходования АО. Определение продолжительности ИП по кинетическим кривым представлено на рис. 4.
При добавлении к инкубационной смеси нарингенина или апигенина возникновения ИП не наблюдалось (рис. 4г). Интенсивность поглощения при 730 нм росла до определенного максимума после чего некоторое время оставалась неизменной или уменьшалась (в зависимости от концентрации АО) – этот промежуток времени можно считать отсроченным ИП. Затем рост поглощения ABTS•+ возобновлялся. Причиной такого характера кинетических кривых вероятно является относительно малая, по сравнению с другими АО, скорость взаимодействия нарингенина и апигенина с ABTS•+ (k1>>k2). Возникновение отсроченного ИП можно отнести к реакциям накопившихся интермедиатов для которых k2 k1.
Для получения сравнительных характеристик АРА, применены такие показатели как удельная ингибирующая концентрация и TEAC.
Удельная ингибирующая концентрация (IC) – концентрация АО, при которой время задержки появления полос поглощения ABTS•+ равно 1 мин. IC рассчитывалась делением концентрации АО на соответствующее время задержки.
Значения ТЕАС рассчитывали по формуле TEAC=IC1/IC2, где IC1 – удельная ингибирующая концентрация стандарта тролокса, IC2 – то же исследуемого объекта. Полученные значения IC и TEAC представлены в табл. 6.
Величины IC и TEAC характеризуют относительную АРА исследуемых объектов. Значения TEAC, полученные кинетическим и деколоризационным способами хорошо коррелируют между собой (r=0,9213). Последовательности изменения АРА кверцетин>ДГК>ДКВ>тролокс>глутатион в растворе PBS и ДКВ>-токоферол>тролокс в этанольном растворе хорошо согласуются с литературными данными. Необходимо отметить, что диапазон значений TEAC, полученных кинетическим методом меньше, чем в деколоризационном (диапазон TEACg 1,62-8,15, и 2,06-18,26 соответственно). Значения, получаемые кинетическим способом оценки АРА, отражают степень и скорость, с которой исследуемые объекты восстанавливают ABTS•+. Например нарингенин медленно восстанавливает ABTS•+, но в целом
Таблица 6. Характеристика антирадикальной активности исследуемых объектов
| TEACg | TEACM | IС (мг/л)/мин | |
| Растворы в PBS | |||
| Тролокс | 4,00 | 1,00 | 0,83±0,02 |
| Кверцетин | 8,15±0,58 | 2,76±0,20 | 0,41±0,03 |
| Морин | 6,53±1,35 | 1,98±0,41 | 0,65±0,13 |
| Рутин | 2,75± 0,39 | 1,68±0,24 | 1,21±0,17 |
| Диквертин | 5,28±0,66 | 1,79±0,22 | 0,63±0,08 |
| Дигидрокверцетин | 5,48±0,8 | 1,67±0,24 | 0,60±0,09 |
| Глутатион | 1,62±0,05 | 0,50±0,02 | 2,04±0,06 |
| Растворы в этаноле | |||
| Тролокс | 4,00 | 1,00 | 0,32±0,03 |
| Кверцетин | 7,09±0,55 | 2,40±0,19 | 0,18±0,01 |
| Диквертин | 4,69±0,18 | 1,31±0,05 | 0,27±0,01 |
| -Токоферол | 2,83±0,09 | 1,22±0,04 | 0,45±0,01 |
обладает сравнительно высокой АРА. Относительно более высокую АРА проявляют «быстрореагирующие» (k2>>k1) АО тролокс и -токоферол. Значения TEAC ДКВ, ДГК, кверцетина и глутатиона уменьшились по-сравнению с таковыми, полученными деколоризационным методом.
2.3. Кинетические характеристики антирадикальной активности
композиционных составов
Кинетическим методом исследовали АРА композиций ДКВ–глутатион и ДКВ–-токоферол в диапазоне мольных соотношений компонентов от 1-1 до 1-10 (ДКВ в пересчете на 90% содержание ДГК). Для исследования АРА композиции ДКВ–глутатион использовали модельную инкубационную смесь в растворе PBS, для композиции ДКВ–-токоферол – инкубационную смесь в этаноле. Перед измерением ИП исследуемой композиции измеряли ИП растворов АО составляющих композицию в тех же конечных концентрациях, что и в исследуемой композиционной смеси. Если экспериментально измеренный ИП исследуемой композиции превышал аддитивную сумму ИП компонентов, составляющих композицию, – отмечали синергизм, если оказывался меньше аддитивной суммы ИП – отмечали антагонизм.
ДКВ–глутатион. Добавление в инкубационную смесь ДКВ (рис. 5, кривая 1) или глутатиона (рис. 5, кривая 2) приводило к плавному переходу горизонтальной части кинетической кривой в восходящую – аналогичную картину наблюдали для композиций ДКВ–глутатион (рис. 5, кривая 3). Комбинация АО вызывает длительное подавление образующихся ABTS•+.
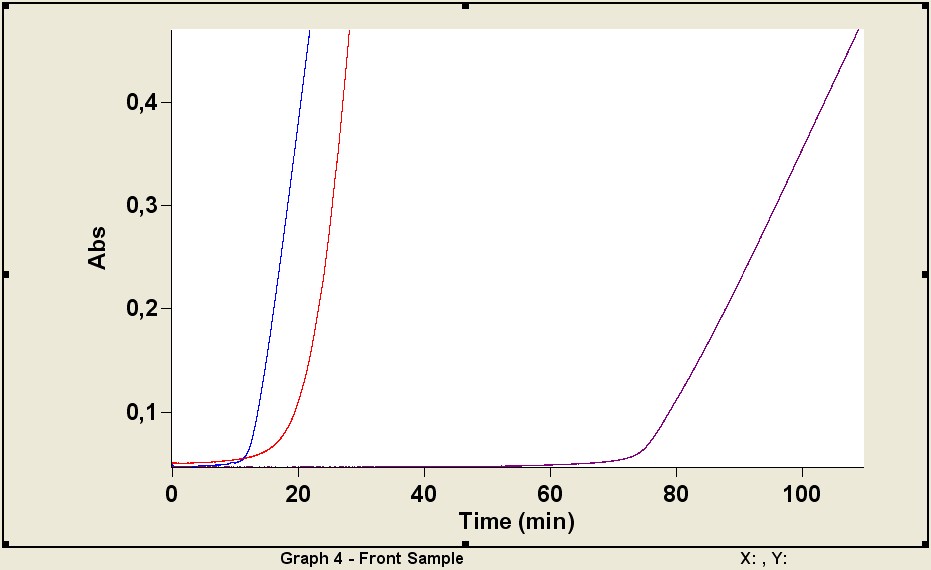

Рис. 5. Кинетические кривые развития ABTS•+ в растворе PBS при добавлении ДКВ
(концентрация 29,6 мкмоль/л) (1), глутатиона (концентрация 147,9 мкмоль/л) (2), и смеси содержащей ДКВ и глутатион в тех же концентрациях (3)
Ось абсцисс – время после введения K2S2O8 (t, мин), ось ординат – оптическая плотность раствора
Таблица 7. Характеристика антирадикального действия
композиции ДКВ–глутатион
| Композиция ДКВ–глутатион (мольные соотношения) | n | Синергизм, % |
| 1:1 | 3 | 15,8±22,3 |
| 1:2,5 | 3 | 70,1±10,5 |
| 1:5 | 3 | 108,9±15,2 |
| 1:10 | 3 | 150,5±22,1 |
Синергетический характер антирадикального действия композиции ДКВ–глутатион следует из значительного превышения экспериментального ИП композиции по сравнению с расчетной аддитивной суммой (табл. 7).
Величина наблюдаемого синергизма растет с увеличением доли глутатиона в композиции. Очевидно, это является следствием взаимодействия глутатиона с окисленными формами ДГК, в результате которого происходит полное или частичное восстановление последнего. Можно предположить, что параллельно происходят следующие реакции:
GSH + ABTS•+ 1/2GSSG + ABTS + H+ (1)
FlOH + ABTS•+ FlO• +ABTS + H+ (2)*
GSH + FlO• 1/2GSSG + FlOH (3)*
*участвует одна из фенольных гидроксильных групп ДГК
Предположительно, наибольшее влияние на проявление антирадикальных свойств оказывает наличие пирокатехиновой группировки в кольце B. Восстановление глутатионом этих гидроксильных групп более выгодно в контексте проявления антирадикальных свойств. Чем выше концентрация глутатиона по сравнению с таковой ДКВ и ABTS•+ – тем большая часть молекул глутатиона, наряду с взаимодействием с ABTS•+, должна восстанавливать окисленный ДГК по реакции (3), причем на более раннем этапе окисления последнего. Полученный кинетическим методом TEAC глутатиона равен 0,50±0,02, ДГК – 1,67±0,24 – т. е. ДГК более чем в три раза эффективнее. Логично предположить, что молекула глутатиона, пошедшая на восстановление окисленной формы ДГК, в конечном итоге косвенно подавляет большее количество молекул ABTS•+ – это может являться основой их синергетического антирадикального действия.
ДКВ–-токоферол. На кинетической кривой, характерной для развития поглощения раствора ABTS•+ в присутствии композиции ДКВ–-токоферол, можно условно выделить три стадии (рис. 6). Стадия 1 – от начала инкубирования до точки 1 – индукционный период (ИП1) в течение которого можно наблюдать полное подавление ABTS•+. Затем происходит кратковременный резкий рост поглощения раствора, который сменяется периодом медленного увеличения концентрации ABTS•+ (стадия 2) и плавно переходит в восходящую ветвь кинетической кривой – стадию 3.
Предположительно параллельно происходят следующие реакции:
-Toc + ABTS•+ -Toc• + ABTS + H+ (1)*
FlOH + ABTS•+ FlO• +ABTS + H+ (2)**
-Toc• + FlOH -Toc + FlO• (3)
* -Toc – -токоферол; **участвует одна из фенольных гидроксильных групп ДГК
Для определения величины индукционного периода стадии 2 (ИП2) проводили касательную к восходящей части в точке максимальной скорости развития ABTS•+. Общая длительность индукционного периода (ИП1+2) композиции ДКВ–-токоферол – сумма ИП1 и ИП2 – период от начала инкубирования до точки (рис. 6). Продолжительность ИП1+2 для всех соотношений компонентов достоверно не отличалась от расчетной аддитивной суммы вкладов компонентов. Сравнение данных полученных для композиции и ее компонентов, показало, что длительность ИП2 остается неизменной и практически не отличается от ИП ДКВ, а длительность ИП1 возрастает с увеличением доли -токоферола в композиции и равна продолжительности ИП -токоферола в тех же концентрациях. Данные представлены в таблицах 8 и 9.
Ранее нами было установлено, что -токоферол является «быстрореагирующим» в данной модельной системе: он улавливает большую часть образующихся ABTS•+ до полного своего расходования по реакции (1), формируя ИП1. Подавление ДКВ радикал-катионов ABTS•+ по реакции (2), очевидно, преимущественно, происходит после расходования -токоферола в смеси, чему соответствует на кинетической кривой ИП2.


Рис. 6. Кинетические кривые развития ABTS•+ в присутствии композиции ДКВ–
-токоферол при соотношении компонентов 1:10
Ось абсцисс – время после введения K2S2O8, ось ординат – оптическая плотность раствора
Таблица 8. Антирадикальная активность ДКВ и -токоферола
| Концентрация, мкмоль/л | ИП, мин | |
| Диквертин | 6 | 6,4±0,2 |
| -Токоферол | 6 | 4,1±0,2 |
| 30 | 24,7±1,8 | |
| 60 | 48,6±2,3 |
Таблица 9. Антирадикальная активность композиции ДКВ–-токоферол
| Композиция ДКВ–-токоферол | ИП1+2 | ИП1 | ИП2 | Аддитивная сумма ИП (расчетная) |
| 1:1* | 10,8±1,1 | 3,8±0,6 | 7,0±0,5 | 9,6±0,3 |
| 1:5** | 31,8±3,3 | 24,8±2,4 | 7,0±0,9 | 30,2±2,0 |
| 1:10*** | 53,4±3,9 | 47,1±3,6 | 6,3±0,3 | 54,1±2,6 |
*6 мкмоль/л ДКВ + 6 мкмоль/л -токоферола, **6 мкмоль/л ДКВ + 30 мкмоль/л -токоферола, ***6 мкмоль/л ДКВ + 60 мкмоль/л -токоферола
Характерный вид кинетических кривых и сравнение результатов, полученных для композиции и ее компонентов, дает основание полагать, что в композиционном составе они реагируют независимо друг от друга.
2.4. Взаимосвязь «структура-антирадикальная активность»
в ряду флавоноидов
Среди флавоноидов наибольшей восстанавливающей способностью обладает кверцетин. Высокая АРА кверцетина обусловлена стабильностью образующегося феноксильного радикала, неспаренный электрон которого делокализован по единой сопряженной системе колец А, В и С флавонола.
Наличие орто-дигидроксизамещения кольца В (пирокатехиновый тип) в сочетании с гидроксильной группой в положении 3 кольца С делает возможным образование хиноидной структуры, вносящей вклад в стабилизацию бирадикала. Структурный изомер кверцетина – морин имеет в 1,65 раза меньшую АРА, что связано с мета-дигидроксизамещением кольца В и, следовательно, невозможностью стабилизации бирадикала за счет образования хиноидной структуры. Гликозилирование 3-ОН гидроксильной группы ведет также к снижению АРА, как это видно на примере рутина по сравнению с кверцетином.
Отсутствие сопряжения между кольцами В и С в ДГК характеризуется двукратным уменьшением АРА по сравнению с кверцетином. Можно отметить, что значения TEAC апигенина и его насыщенного аналога нарингенина отличаются незначительно (2,52 и 2,28 соответственно), что подтверждает важность сочетания гидроксильной группы в положении С-3 с двойной связью у С-2 – С-3 для проявления высокой АРА.
Таблица 10. Количество радикал-катионов ABTS•+ восстанавливаемых одной
молекулой антиоксиданта (N)
| N, кинетический метод | |
| Тролокс | 1,7 |
| Кверцетин | 4,7 |
| Морин | 3,3 |
| Рутин | 2,8 |
| Диквертин | 2,7 |
| Дигидрокверцетин | 2,8 |
| Глутатион | 0,8 |
| -Токоферол | 1,9 |
Проведенный нами анализ числа радикал-катионов ABTS•+, восстанавливаемых одной молекулой антиоксиданта, показал, что для перечисленных флавоноидов оно находится в диапазоне от 2,7 до 4,7 (табл. 10).
ВЫВОДЫ
- Обоснована валидность спектрофотометрической методики оценки антирадикальной активности, основанной на способности соединений ингибировать предварительно генерируемые в модельных условиях радикал-катионы ABTS•+. Методика обладает специфичностью (ингибирование осуществляют только соединения, обладающие антирадикальной активностью), линейностью в интервале 15-70% ингибирования и воспроизводимостью (относительная ошибка определения среднего результата 5,5%) и может использоваться как сравнительно простой и доступный метод для характеристики антирадикальной активности индивидуальных соединений, многокомпонентных смесей и композиций in vitro. Показано, что расчет показателей антирадикальной активности на основе линейных зависимостей обладает большей точностью и воспроизводимостью, по сравнению с расчетами на основе процента ингибирования для конкретной концентрации.
- Обоснована применимость разработанного спектрофотометрического метода оценки антирадикальной активности, основанного на регистрации индукционного периода кинетических кривых при генерировании радикал-катиона ABTS•+ в присутствиии АО. Метод обладает хорошей воспроизводимостью (относительная ошибка определения 3,1-5,3%). Метод характеризует кинетические закономерности антирадикальных свойств, степень и скорость, с которой исследованные объекты востанавливают данные радикал-катионы.
- Осуществлена оценка антирадикальной активности ряда флавоноидов и некоторых эндогенных АО в эквивалентах тролокса ТЕАС и концентрации, ингибирующей 50% свободных радикалов IC50. Антирадикальная активность исследованных объектов изменяется в ряду: кверцетин > морин > апигенин > дигидрокверцетин > диквертин > нарингенин > пикногенол > рутин > аскорбиновая кислота > глутатион > -токоферол. Антирадикальная активность диквертина в 1,6 раза выше, чем пикногенола.
- Значения параметра ТЕАС, полученные кинетическим способом коррелируют (r=0,9213) с таковыми полученными деколоризационным способом.
- Для композиций дигидрокверцетин–аскорбиновая кислота, кверцетин–аскорбиновая кислота обнаружен эффект антагонизма. Величина эффекта зависит от соотношений концентраций компонентов и может достигать значений до -32,7±10,2%, (соотношение флавоноидов и аскорбиновой кислоты 1:10). Характер эффекта композиций нарингенин–аскорбиновая кислота зависел от преобладания концентрации одного из компонентов в смеси. При преобладании нарингенина выявлен эффект синергизма с максимальным значением при соотношении 10:1 17,2±7,6%. При десятикратном преобладании аскорбиновой кислоты обнаружен антагонизм 18,7±5,2%.
- Для композиций диквертин–глутатион обнаружен эффект синергизма. Величина эффекта зависит от соотношения концентраций компонентов, максимальный эффект составляет 150±22% (при мольном соотношении 1:10).
- Для композиций диквертин–-токоферол установлено, что её антирадикальная активность соответствует рассчитанной аддитивной сумме вкладов компонентов. Кинетические кривые свидетельствуют, что вначале расходуется быстрореагирующий -токоферол, а затем компоненты диквертина.
- Для композиций диквертин–аскорбиновая кислота обнаружен эффект антагонизма, величина которого зависит от соотношения концентраций компонентов. Наиболее выражено этот эффект проявляется при содержании компонентов 1:10 (антагонизм 23,6±8,1%). Эффект антагонизма композиции диквертин–аскорбиновая кислота–-липоевая кислота в соотношении 1,2:5:1 достоверно не отличался от проявляемого композицией диквертин-аскорбиновая кислота 1,2:5 и составлял 13,7±6,3%.
- Выявлена тенденция взаимозависимости между величиной антирадикального эффекта и структурными фрагментами молекул в ряду флавоноидов.
Список работ опубликованных по теме диссертации
- Ильясов И.Р., Белобородов В.Л., Тюкавкина Н.А. Оценка антирадикальной активности композиций диквертина и аскорбиновой кислоты // Материалы VI Симпозиума по фенольным соединениям. М., 2004. – С. 120.
- Ильясов И.Р., Белобородов В.Л., Тюкавкина Н.А. и др. Антирадикальная активность диквертина и композиций на его основе // Материалы VIII международного съезда «Актуальные проблемы создания новых лекарственных препаратов природного происхождения». Финляндия, Миккели. – 2004. – С. 56-61.
- Ильясов И.Р. Оценка антиоксидантной активности композиций на базе диквертина // Тезисы работ участников открытого Российского конкурса на лучшую научную работу студентов 2004 года по разделу «Медицинские науки». М. – 2005. – С.70-71.
- Ильясов И.Р., Белобородов В.Л., Веровская Е.В. Выявление синергизма антирадикальной активности композиции нарингенина и аскорбиновой кислоты // Материалы Всероссийской научно-методической Конференции «Пути и формы совершенствования фармацевтического образования. Создание новых физиологически активных веществ» Ч. 1. Интеграция науки и образовательного процеса. Создание новых физиологически активных веществ. Воронеж. – 2007. – С. 146-148.
- Ильясов И.Р., Белобородов В.Л. Веровская Е.В. Исследование антирадикальной активности композиций диквертина, кверцетина, рутина и нарингенина с аскорбиновой кислотой // Материалы XIV Российский нац. конгр. «Человек и лекарство», М. – 2007. – С. 383.
- Ильясов И.Р. Сопоставительная оценка антирадикальной активности компонентов диквертина с природными антиоксидантами // Тезисы V Конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины» Москва. – 2008. – С. 171.
- Ильясов И.Р., Белобородов В.Л., Тюкавкина Н.А. и др. Применение радикал-катионов ABTS•+ в оценке антиоксидантной активности флавоноидов // Фармация. – 2008. – №6. – С. 15-18.
- Ильясов И.Р., Белобородов В.Л., Тюкавкина Н.А. Индукционный период образования ABTS•+ как характеристика антирадикальной активности ряда природных антиоксидантов // Фармация. – 2008. – №8. – С. 14-17.

