Разработка состава, технологии и стандартизация суппозиториев для подготовки шейки матки к родам.
На правах рукописи
ЗОТОВА АННА ВЯЧЕСЛАВОВНА
РАЗРАБОТКА СОСТАВА, ТЕХНОЛОГИИ И СТАНДАРТИЗАЦИЯ СУППОЗИТОРИЕВ ДЛЯ ПОДГОТОВКИ ШЕЙКИ МАТКИ К РОДАМ.
15.00.01 – технология лекарств и организация фармацевтического дела
15.00.02 – фармацевтическая химия, фармакогнозия.
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата фармацевтических наук
Москва 2008 г.
Работа выполнена в ГОУ ВПО Московская Медицинская Академия им. И.М. Сеченова Росздрава
Научные руководители:
д.п.н, д.ф.н., профессор, академик РАО Попков Владимир Андреевич
д.ф.н., профессор Краснюк Иван Иванович
Официальные оппоненты:
д.ф.н, профессор Белобородов Владимир Леонидович
д.ф.н, профессор Гузев Константин Сергеевич
Ведущая организация: Всероссийский Научно-исследовательский Институт Лекарственных и Ароматических Растений (ВИЛАР) РАСХН.
Защита состоится «___» _________ 2008 г. на заседании
диссертационного совета Д.208.040.09 при ГОУ ВПО Московская Медицинская Академия им. И.М. Сеченова Росздрава по адресу: 121019, г. Москва, Никитский бульвар, д. 13.
С диссертацией можно ознакомиться в библиотеке ММА имени И.М. Сеченова
(117998, г. Москва, Нахимовский проспект, 49)
Автореферат разослан «___» ____________ 2008 г.
Ученый секретарь
Диссертационного совета Д.208.040.09
д.ф.н., профессор Наталья Петровна Садчикова
ВВЕДЕНИЕ
Актуальность темы. Поиск и разработка новых эффективных лекарственных средств для подготовки шейки матки к родам обусловлены существующей проблемой в акушерской практике. Во-первых, эта проблема нередко возникает ко времени родов у беременных женщин с незрелой или недостаточно зрелой шейкой матки, что может привести к осложненному течению родов и ухудшению состояния плода. Во-вторых, подготовка шейки матки имеет важное значение в случае необходимости досрочного родоразрешения беременных с различной патологией. В-третьих, подготовка шейки матки осуществляется перед операцией искусственного аборта, что особенно важно с клинической точки зрения в случае необходимости прерывания беременности у первобеременных женщин в поздние сроки.
Для консервативного расширения шейки матки при родовспоможении наряду с другими лекарственными препаратами используется мифепристон, антипрогестиновый препарат, ингибирующий гестагены на уровне рецепторов прогестерона. Успешной схемой применения является как монотерапия мифепристоном, так и его сочетание с простагландинами и другими лекарственными средствами. Однако мифепристон используется на сегодняшний день только в виде таблеток, что зачастую приводит к нежелательным побочным эффектам в виде тошноты и головокружения.
С другой стороны, анализ литературных данных и патентной документации показал, что возрос интерес исследователей к использованию лекарственного растительного сырья, поскольку в растениях находится ряд биологически активных веществ, комплексно действующих на организм. В акушерской практике таким сырьем является ламинария, которая в качестве расширителя шейки матки использовалась еще с середины прошлого столетия. На сегодняшний день ламинария используется в виде палочек. Механизм расширения шейки матки при использовании палочек ламинарии не ограничивается только осмодилатацией, а имеет значительно более сложный гуморальный генез. Высказано предположение, что палочки из ламинарии индуцируют эндогенный синтез простагландинов, которые способствуют размягчению шейки матки за счет высвобождения свободной арахидоновой кислоты из палочек ламинарии во время их дилатации. Недавно проведенные биохимические исследования цервикальной слизи беременных женщин показали, что после применения палочек из ламинарии в слизи значительно возрастает активность эластазы, концентрация интерлейкина-1, интерлейкина-8, простагландинов Е2 и F2. В связи с этим, является перспективным и актуальным изучение фармакологического влияния биологически активных веществ ламинарии на процесс созревания шейки матки роженицы. Однако следует отметить, что ламинарии, применяемые в качестве расширителя шейки матки в виде палочек, имеют ряд недостатков: использование их достаточно сложно и болезненно, т.к. однократно нужно вводить несколько стержней, причем, каждый последующий стержень вводится строго параллельно предыдущему и придерживается в месте введения примерно 15 секунд для предотвращения выталкивания его из цервикального канала за счет сокращений матки. Учитывая все вышеизложенное, можно сделать вывод о том, что назрела необходимость в разработке эффективного и безопасного препарата для подготовки шейки матки к родам с наименьшим дискомфортом для пациенток.
Среди различных форм лекарственных средств, используемых в акушерстве и гинекологии, наиболее перспективными, удобными в использовании и удачно сочетающими в себе особенности местного применения и периферического действия, являются суппозитории. К основным достоинствам суппозиториев относятся: простота введения, быстрота всасывания активного вещества, местное воздействие, возможность назначения лекарственного препарата, инактивирующегося в желудочно-кишечном тракте, а также исключения эффекта первого прохождения через печень.
В связи с трудностями исследования поведения лекарственных препаратов в условиях влагалища в силу социальных, психологических, а также технических причин, является целесообразной разработка модельных условий in vitro, позволяющих проводить сравнительную оценку вагинальных препаратов в месте введения. Это позволит использовать более совершенный подход в разработке вагинальных лекарственных форм, направленных на оптимизацию их составов и технологии.
Цель исследования. С учетом всего вышеизложенного основной целью исследования явилась разработка состава и технологии вагинальных суппозиториев с мифепристоном и ламинариями для подготовки шейки матки к родам или искусственному прерыванию беременности, а также разработка метода их испытаний in vitro, позволяющего проводить сравнительную оценку поведения вагинальных препаратов.
Задачи исследования. Для достижения поставленной цели нужно было решить следующие задачи:
- Разработать состав и технологию вагинальных суппозиториев с мифепристоном и измельченными слоевищами ламинарии фармакопейных видов.
- Апробировать методики качественного и количественного анализа мифепристона и действующих веществ ламинарии на разработанных лекарственных формах.
- Оценить качество разработанных суппозиториев в соответствии с требованиями ГФ XI, вып. 2.
- Разработать модельную систему in vitro, позволяющую провести сравнительную оценку поведения вагинальных лекарственных форм с мифепристоном и ламинариями.
- Изучить стабильность разработанных суппозиториев в процессе хранения в естественных условиях и установить их срок годности.
Научная новизна. Впервые научно и экспериментально обоснованы составы и технология вагинальных суппозиториев с мифепристоном и измельченными слоевищами ламинарии. Изучено влияние вспомогательных веществ на биофармацевтические характеристики вагинальных лекарственных форм. Установлены сроки хранения препаратов. Получен патент РФ № 2319495 для суппозиториев на основе измельченных слоевищ ламинарии: «Средство для расширения шейки матки на основе лекарственного растительного сырья». Разработана модельная система in vitro для сравнительной оценки поведения вагинальных суппозиториев по определенным параметрам.
Практическая значимость работы. На основании проведенных исследований разработаны состав и технология вагинальных суппозиториев, содержащих мифепристон и измельченные слоевища ламинарии для подготовки шейки матки к родам.
Апробация работы. Апробация работы проведена на научно-практической межкафедральной конференции кафедры Общей химии Московской Медицинской Академии им. И.М. Сеченова.
Публикации материалов исследования. По теме диссертации опубликовано 6 научных работ (см. список печатных работ) и получен патент РФ №2319495.
Связь задач исследования с проблемным планом фармацевтических наук. Диссертационная работа выполнена в рамках отраслевой научно- исследовательской программы ММА им. И.М. Сеченова «Разработка и совершенствование технологии подготовки специалистов с высшим медицинским и фармацевтическим образованием» (шифр, 16 утвержденный МЗ РФ); в соответствии с комплексной темой кафедры общей химии стоматологического факультета ММА им. И.М. Сеченова: «Новые знания и подходы в оценке качества и сертификации биологически активных соединений синтетического и природного происхождения, лекарственных препаратов, изделий медицинской техники (технологические аспекты)» (№ государственной регистрации 01.200.118796.)
Основные положения, выносимые на защиту.
- Результаты по разработке состава и технологии вагинальных суппозиториев, содержащих мифепристон и измельченные слоевища ламинарии.
- Результаты биофармацевтических исследований по высвобождению действующих веществ из суппозиториев методом «in vitro».
- Изучение влияния технологических факторов на биофармацевтическую активность препаратов методом «in vitro».
- Результаты проведения комплексных исследований с использованием физико-химических и технологических методов по оценке качества лекарственных форм.
- Результаты изучения стабильности и условий хранения суппозиториев, содержащих мифепристон и измельченные слоевища ламинарии, для обоснования сроков годности.
- Результаты сравнительной оценки поведения вагинальных лекарственных форм на разработанной системе «in vitro».
Объем и структура диссертации. Диссертационная работа состоит из введения, обзора литературы, описания материалов и методов исследования, экспериментальных глав, выводов по каждой главе, общих выводов, списка литературы, приложений.
Работа изложена на 151 странице компьютерного текста, содержит 38 таблиц, 19 рисунков, список литературы включает 160 источников.
В обзоре литературы (глава первая) проанализированы лекарственные вещества, используемые на сегодняшний день для расширения шейки матки, описаны преимущества лекарственной формы суппозитории, описаны современные основы, используемые для приготовления суппозиториев, обобщены методы оценки качества суппозиториев и методы оценки поведения суппозиториев на моделях in vitro.
Вторая глава включает материалы и методы исследований, характеристики объектов исследования и вспомогательных веществ, входящих в состав суппозиториев.
Третья глава посвящена выбору оптимального состава и технологии получения суппозиториев с мифепристоном и измельченными слоевищами ламинарии на основании которых разработана технологическая схема для наработки экспериментальных серий препарата. Представлены результаты по оценке качества, данные по изучению стабильности и определению сроков годности разработанных суппозиториев.
В четвертой главе отражены исследования по разработке методики in vitro для сравнительной оценки функционирования лекарственных препаратов и сравнительный анализ экспериментальных суппозиториев на модели.
В работе использованы физические, физико-химические, технологические и микробиологические методы исследования.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
- Объекты, материалы и методы исследования
При выполнении диссертационной работы были использованы: субстанция мифепристона производства ЗАО «Мир-фарма» (г. Обнинск), регистрационный номер (002340/01 – 2003) и измельченное сырье слоевищ ламинарии (Thalli Laminariae) – морские водоросли, встречающиеся в северных и дальневосточных морях. В акушерстве и гинекологии используются фармакопейные виды ламинарии: Ламинария японская (Laminaria japonica) и Ламинария сахаристая (Laminaria saccharina) (ГФ XI, вып. 2, стр. 377).
В работе использованы суппозиторные основы Суппорин М, Витепсол W-35, Твердый жир марки А, Супацир NaS; вспомогательные вещества янтарная кислота, натрия бензоат, вода очищенная.
Внешний вид, однородность, среднюю массу, отклонения от средней массы, время полной деформации или растворения суппозиториев определяли с помощью общепринятых фармакопейных методик.
Для стандартизации действующих веществ использовали спектрофотометрический метод исследования.
Приготовление реактивов, применяемых в экспериментальной части исследования, осуществляли согласно требованиям ГФ XI, вып. 2.
2. Разработка состава и технологии суппозиториев с мифепристоном и измельченными слоевищами ламинарии
Важнейшей задачей современной фармации является создание рациональных, эффективных и биологически доступных лекарственных препаратов, не оказывающих побочных воздействий на организм.
Лекарственные формы суппозитории занимают значительное место среди всех лекарственных форм. Это объясняется их положительными свойствами и отсутствием негативных эффектов, характерных для пероральных и инъекционных лекарственных форм. В связи с этим, вагинальные суппозитории, наряду с вагинальными таблетированными препаратами и вагинальными мазями, являются наиболее перспективными, удобными в использовании и удачно сочетающими в себе особенности местного применения и периферическое действие.
Эффективность действия суппозиториев во многом зависит от выбора вспомогательных веществ и основы, которые обеспечивают стабильность и биологическую доступность лекарственного вещества. Важными факторами при создании суппозиториев, отвечающих требованиям ГФ XI, вып. 2, являются равномерное распределение лекарственного вещества и вспомогательных веществ в основе и высвобождение лекарственного вещества из основы. В связи с этим при оценке качества суппозиториев учитывались параметры, позволяющие выбрать их оптимальный состав. К этим параметрам относятся: скорость высвобождения лекарственного вещества из суппозиториев, рН и реологические параметры, время полной деформации, время растворения и микробиологическая чистота в процессе хранения.
При создании вагинальных суппозиториев с мифепристоном и измельченными слоевищами ламинарии в качестве компонента, оказывающего дополнительное антибактериальное и репаративное действие, была использована кислота янтарная в количестве 0,01 г на один суппозиторий. Для уменьшения раздражающего действия кислоты на ткани был использован широко применяемый в медицине натрия бензоат в количестве 0,006 г на один суппозиторий, который также обладает антибактериальным действием. В качестве поверхностно-активного вещества в некоторых композициях был использован Эмульгатор Т-2.
Основы должны быть агрегативно устойчивыми системами. Суппозитории должны соответствовать технологическим требованиям: время полной деформации суппозиториев должно быть не более 15 минут; время растворения суппозиториев должно быть не более 1 часа.
Составы разработанных суппозиториев представлены в табл. 1 и 2.
Для создания суппозиториев на липофильной основе в предварительно расплавленную основу вводили мифепристон или измельченный порошок слоевищ ламинарии, в зависимости от прописи, кислоту янтарную и натрия бензоат, тщательно перемешивали при помощи пропеллерной мешалки (Vвращ. = 300 мин-1). Полученную смесь разливали в предварительно охлажденные и смазанные мыльно-глицериновой смесью формы на 2,0 г.
Дифильные композиции с использованием в качестве гидрофильной составляющей ПЭГ готовили по следующей технологической схеме: активное вещество диспергировали в ПЭГ 400 с добавлением кислоты янтарной и натрия бензоата, затем, в расплавленную заранее основу вводили раствор активного вещества в ПЭГ.
Таблица 1 Таблица 2
Основы, использованные Основы, использованные
для приготовления суппозиториев для приготовления суппозиториев
| № композиции основ | Ингредиенты, г (на 10 суппозиториев) | |||||
| ПЭГ | Витепсол | Супацир-NaS | Твердый жир А | Суппорин-М | Эмульгатор Т-2 | |
| 2.1 | 19 | |||||
| 2.2 | 19 | |||||
| 2.3 | 19 | |||||
| 2.4 | 18,8 | 0,2 | ||||
| 2.5 | 19 | |||||
| 2.6 | 2,0 | 17 | ||||
с мифепристоном по 0,2 г на один суппозиторий с измельченными слоевищами ламинарии по
0,1 г на один суппозиторий
| № композиции основ | Ингредиенты, г (на 10 суппозиториев) | |||||
| ПЭГ | Витепсол | Супацир-NaS | Твердый жир А | Суппорин-М | Эмульгатор Т-2 | |
| 1.1 | 18 | |||||
| 1.2 | 18 | |||||
| 1.3 | 18 | |||||
| 1.4 | 17,8 | 0,2 | ||||
| 1.5 | 18 | |||||
| 1.6 | 2,0 | 16 | ||||
Суппозитории на гидрофильной основе ПЭГ готовили по следующей технологической схеме: активное вещество диспергировали в ПЭГ 400 (1 часть) с добавлением кислоты янтарной и натрия бензоата, затем, в расплавленную заранее основу ПЭГ 1500 (9 частей) вводили раствор активного вещества в ПЭГ 400.
Суппозиторные формы, заполненные суппозиторной массой, помещали в холодильник для формирования суппозиториев.
Полученные после освобождения из охлажденной формы суппозитории оценивались по следующим показателям: внешний вид, средняя масса, отклонения от массы, время полной деформации или растворения по методикам, описанным в ГФ XI, однородность, цвет, запах, отсутствие механических включений.
Микробиологическая чистота разработанных суппозиториев исследовалась согласно ГФ XI изд. и изменению № 3 к данной статье в разделе: «Требования, предъявляемые к микробиологической чистоте готовых лекарственных средств, основного сырья (субстанции) и вспомогательных материалов», включающих в себя количественное определение бактерий и грибов, а также выявление определенных видов микроорганизмов, наличие которых недопустимо в вагинальной лекарственной форме. При испытаниях на микробиологическую чистоту были количественно определены жизнеспособные бактерии и грибы, а также проводились испытания на выявлене микроорганизмов Pseudomonas aeruginosa, Staphylococus aureus и семейства Enterobacteriacea. Посевы проводили на мясо-пептонный агар и агарезированную среду Сабуро. По результатам микробиологических исследований суппозитории с мифепристоном и измельченными слоевищами ламинарии соответствуют требованиям Государственной Фармакопеи.
Обобщенная технологическая схема получения вагинальных суппозиториев с мифепристоном и измельченными слоевищами ламинарии представлена на рис. 1.
Результаты исследований суппозиториев с мифепристоном и измельченными слоевищами ламинарии показали, что использованные в эксперименте основы обеспечивают получение суппозиториев, отвечающих требованиям ГФ XI (т. 2, с. 151-153). Время полной деформации варьирует в допустимых пределах, растворение суппозиториев на ПЭГ-основе также соответствует общепринятым стандартам ГФ. Введение ПЭГ в основу Суппорин-М обеспечивает требуемое время полной деформации и растворение в воде, с другой стороны ПЭГ улучшает введение лекарственного вещества в основу, так как лекарственное вещество вводится в растворенном виде, что позволяет суппозиториям быть более стабильными.
3. Идентификация основных действующих веществ
Идентификацию мифепристона в субстанции проводили по инфракрасному спектру поглощения препарата в области от 1600 до 400 см-1.
Инфракрасный спектр поглощения препарата (6% раствор в хлороформе) в области от 1600 до 400 см-1 должен совпадать по положению и относительной интенсивности полос поглощения с прилагаемым спектром на рис. 2.

Рис. 1. Технологическая схема производства вагинальных суппозиториев с мифепристоном и измельченными слоевищами ламинарии.
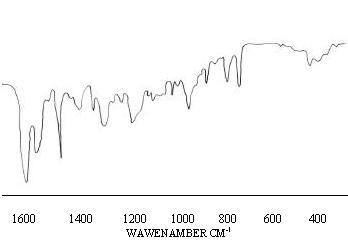
Рис. 2. ИК - спектр поглощения мифепристона в области от 1600 до 400 см-1.
Идентификацию мифепристона в суппозиториях проводили СФМ методом. Ультрафиолетовый спектр 0,001% раствора мифепристона из суппозиторной вытяжки в этиловом спирте в области от 220 до 400 нм имеет максимумы поглощения при 256 нм ± 2 нм, 306 нм ± 2 нм и минимумы поглощения при 226 нм ± 2 нм, 276 нм ± 2 нм. Спектр получают относительно раствора сравнения.
Идентификацию основных действующих веществ ламинарии проводили хроматографическим методом в системе гексан : ацетон (1:1). Для хроматографии использовали хроматографические пластинки «Силуфол УФ 254» размером 15 х 6 см, микропипеткой наносили 0,04 мл исследуемого извлечения. На хроматограмме видны 4 основных пятна: с Rf - 0,55 оранжевого цвета, с Rf - 0,66 зеленоватого цвета, с Rf - 0,8 зеленоватого цвета, с Rf - 0,9 оранжевого цвета (каротиноиды, хлорофилл, фитоцианиды, стерины).
Хроматографическое определение аминокислот проводили восходящим методом, используя очищенные водные извлечения. Хроматограммы обрабатывали 0,25% раствором нингидрина в ацетоне. Аминокислоты в видимом свете визуализировались в виде розово-пурпурных пятен, для пятен вычисляли Rf (табл. 3).
Таблица 3
Результаты тонкослойной хроматографии аминокислот в системе растворителей бутанол-пиридин-вода (6:4:3).
| № пятна | Rf | Цвет пятна после обработки 0,25% раствором нингидрина | Аминокислота |
| 1 | 0,62 | пурпурный | лейцин |
| 2 | 0,55 | синий | фенилаланин |
| 3 | 0,52 | синий | тирозин |
| 4 | 0,38 | пурпурный | валин |
| 5 | 0,38 | пурпурный | аланин |
| 6 | 0,34 | пурпурный | треонин |
| 7 | 0,30 | серовато-красный | глицин |
| 8 | 0,28 | пурпурный | серин |
| 9 | 0,22 | пурпурный | глутаминовая кислота |
| 10 | 0,20 | синий | аспарагиновая кислота |
| 11 | 0,23 | серовато-красный | гистидин |
| 12 | 0,18 | пурпурный | аргинин |
| 13 | 0,15 | пурпурный | лизин |
Идентификацию полисахаридов в суппозиториях с измельченными слоевищами ламинарии проводили СФМ методом при длине волны 450 нм.
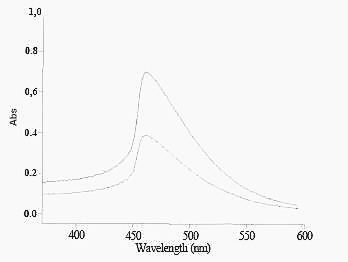
Рис. 3. УФ-спектр полисахаридов (вытяжка из ламинарии).
4. Количественное определение основных действующих веществ
Количественное содержание мифепристона в суппозиториях определяли спектрофотометрическим методом при длине волны 306 нм. Спектр представлен на рис. 4. Количество действующего вещества (мифепристона) в суппозиториях составляет 0,2 ± 0,0046 г.
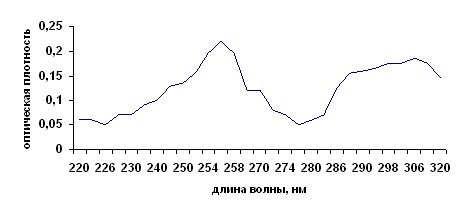
Рис. 4. УФ-спектр мифепристона.
Количественное содержание суммы полисахаридов ламинарии в суппозиториях определяли спектрофотометрическим методом при длине волны 450 нм. Количество полисахаридов (в пересчете на глюкозу) в измельченных слоевищах ламинарии в суппозиториях составляет 0,02 ± 0,00084 г.
5. Биофармацевтическое исследование суппозиториев
Одним из показателей качества лекарственной формы является высвобождение из нее активной субстанции. С целью определения высвобождения действующих веществ из исследуемых суппозиториев изучали высвобождение в опытах in vitro методом равновесного диализа через полупроницаемую пленку толщиной 0,25 мм по методу Крувчинского.
Динамика высвобождения мифепристона из суппозиторных основ представлена на рис. 5. Динамика высвобождения действующих веществ ламинарии из суппозиторных основ представлена на рис. 6.
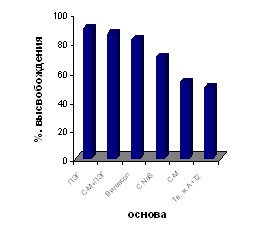
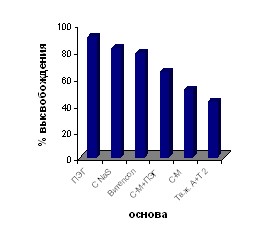
Рис. 5. Сравнительная оценка Рис. 6. Сравнительная оценка
полноты высвобождения мифепристона высвобождения ДВ натуральной
из суппозиторных основ в опытах in vitro ламинарии из суппозиторных основ
в опытах in vitro.
По результатам данных высвобождения действующих веществ из суппозиториев были отобраны: для получения суппозиториев с мифепристоном основы 1.2 (Витепсол) и 1.6 (Суппорин-М с добавлением ПЭГ), для получения суппозиториев на основе измельченных слоевищ ламинарии основы 2.2 (Витепсол) и 2.3 (Супацир NaS), как наиболее оптимальные по всем показателям.
6. Изучение стабильности полученных суппозиториев
Изучение стабильности суппозиториев на основе мифепристона и измельченных слоевищ ламинарии при хранении проводили с помощью физико-химических методов анализа. Внешний вид, запах, цвет в процессе хранения не изменяются. На основании полученных данных в процессе хранения суппозиториев с мифепристоном и измельченными слоевищами ламинарии можно сделать вывод о том, что разработанные суппозитории стабильны в течение 1 года, в процессе хранения не наблюдается выделение гидрофильной или липофильной фазы, лекарственные препараты представляют собой агрегативно устойчивые системы (табл. 4 и 5).
Таблица 4.
Показатели качества суппозиториев с мифепристоном в процессе хранения.
| № серии | Срок хранения | Описание: торпедовидная форма, гладкая поверхность, твердые, на внешней поверхности и на срезе вкраплений, блесток и кусочков основы не наблюдается, цвет суппозиториев – от светло-желтого до желтого | Средняя масса, 2,0 г ± 5%. | Подлинность | Однородность | Посторонние примеси | Количественное содержание мифепристона 0,2 ± 5% |
| СФМ | |||||||
| Максимум при 306± 2 нм. | |||||||
| 010406 | начало | соответствует | 2,04 | 306 | однородны | отсутствуют | 0,1970 |
| 3 мес. | 1,97 | 306 | 0,1960 | ||||
| 6 мес. | 2,01 | 305 | 0,1883 | ||||
| 9 мес. | 1,96 | 304 | 0,1882 | ||||
| 1 год | 1,93 | 304 | 0,1845 | ||||
| 020406 | начало | соответствует | 1,95 | 308 | однородны | отсутствуют | 0,1963 |
| 3 мес. | 1,98 | 308 | 0,1942 | ||||
| 6 мес. | 2,04 | 307 | 0,1904 | ||||
| 9 мес. | 1,97 | 307 | 0,1883 | ||||
| 1 год | 1,92 | 307 | 0,1853 | ||||
| 030406 | начало | соответствует | 1,98 | 307 | однородны | отсутствуют | 0,1903 |
| 3 мес. | 1,97 | 306 | 0,1857 | ||||
| 6 мес. | 1,95 | 306 | 0,1856 | ||||
| 9 мес. | 1,94 | 306 | 0,1843 | ||||
| 1 год | 1,96 | 305 | 0,1831 |
Таблица 5.
Показатели качества вагинальных суппозиториев с измельченными слоевищами ламинарии в процессе хранения.
| № серии | Срок хранения | Описание: торпедовидная форма, гладкая поверхность, твердые, на внешней поверхности и на срезе вкраплений, блесток и кусочков основы не наблюдается, цвет суппозиториев – от светло-серого до бурого | Средняя масса, 2,0 г ± 5%. | Подлинность | Однородность | Посторонние примеси | Количественное содержание полисахаридов 0,02 ± 5% |
| СФМ | |||||||
| Максимум при 450 ± 2 нм. | |||||||
| 010406 | начало | соответствует | 2,10 | 451 | однородны | отсутствуют | 0,0190 |
| 3 мес. | 1,95 | 450 | 0,0195 | ||||
| 6 мес. | 2,03 | 450 | 0,0185 | ||||
| 9 мес. | 1,94 | 449 | 0,0196 | ||||
| 1 год | 1,92 | 451 | 0,0198 | ||||
| 020406 | начало | соответствует | 2,04 | 449 | однородны | отсутствуют | 0,0200 |
| 3 мес. | 1,98 | 450 | 0,0198 | ||||
| 6 мес. | 2,07 | 450 | 0,0198 | ||||
| 9 мес. | 1,96 | 450 | 0,0188 | ||||
| 1 год | 1,93 | 451 | 0,0193 | ||||
| 030406 | начало | соответствует | 2,10 | 448 | однородны | отсутствуют | 0,0194 |
| 3 мес. | 2,05 | 450 | 0,0192 | ||||
| 6 мес. | 1,99 | 450 | 0,0199 | ||||
| 9 мес. | 1,93 | 449 | 0,0186 | ||||
| 1 год | 1,91 | 449 | 0,0184 |
7. Разработка модельной системы in vitro для сравнительной оценки функционирования лекарственных препаратов
Поведение лекарственного препарата в организме человека является необходимым критерием оценки его эффективности и безопасности. Изучение функционирования лекарственного препарата, который находится на стадии разработки, в человеческом организме крайне сложная задача из-за существующих социальных и психологических проблем. В нашем случае речь идет об изучении поведения лекарственных препаратов в среде влагалища. Поэтому является целесообразным разработка модельной системы, которая будет полностью соответствовать физиологическим и биохимическим показателям влагалища и использование которой позволит более полно оценить разработанные вагинальные лекарственные препараты. Тем более что в литературе на сегодняшний день немного сведений о поведении лекарственных препаратов в среде влагалища, и разработка вагинальных препаратов ведется эмпирически.
Разработанные суппозитории исследовали на модельной системе in vitro из искусственных материалов и оценивали по следующим показателям: распадаемость, распределение по поверхности, высвобождение и способность удерживаться на поверхности, расположенной под наклоном, которая зависит от слизистой оболочки влагалища.
За стандарты, по которым в дальнейшем проходил подбор искусственной модели, в данной работе был взяты наиболее важные показатели слизистой оболочки влагалища и влагалищного отделяемого: объем и рН влагалищного отделяемого, плотность, растворимость в среде влагалища гидрофильных и липофильных веществ, вязкость влагалищного отделяемого, смачивание отделяемым влагалищной стенки, адгезивные свойства отделяемого по отношению к слизистой влагалища.
Из литературных источников известно, что влагалищное отделяемое представляет собой коллоидный раствор белковых и кислотных соединений, который по своим физическим характеристикам близок к растворам некоторых полимеров, которые обладают большой вязкостью, но не имеющих в своем строении пространственной надмолекулярной структуры, что придает им свойство текучести. Вагинальное отделяемое хорошо растворимо в воде, а с маслами образует эмульсии типа масло/вода. Поверхностно-активные и адгезивные свойства слизистой оболочки влагалища позволяют отделяемому равномерно распределяться по поверхности влагалища и удерживаться на слизистой вертикально под углом.
Для экспериментальной работы нами были выбраны несколько производных целлюлозы, которые по своим характеристикам полностью попадают под наши критерии отбора: реологические свойства растворов целлюлозы близки по своим параметрам к влагалищному отделяемому, растворы целлюлозы безопасны в применении, просты в использовании, доступны.
Растворы метилцеллюлозы (МЦ), натриевой соли поликарбоксиметилового эфира целлюлозы (NaКМЦ), натриевой соли гидрированной формы поликарбоксиметилового эфира целлюлозы (NaНКМЦ), с концентрациями от 2 до 4% исследовали по показателю вязкости, по показателям краевого угла смачивания на слизистой оболочке влагалища, изучались их адгезивные свойства.
По результатам исследований нами был выбран модельный раствор, который по всем показателям (вязкость, краевой угол смачивания, время стекания по поверхности слизистой) наиболее близок к влагалищному отделяемому 3,7% NaКМЦ. Сравнительные характеристики влагалищного отделяемого и модельного раствора 3,7% NaКМЦ представлены в табл. 3.
В качестве модельной слизистой был взят полиакриламид поскольку его физико-химические характеристики близки к показателям нативной слизистой оболочки влагалища по таким критериям как: соответствие адгезии и растекания модельного отделяемого на выбранной модели поверхности растекания и адгезии нативной цервикальной жидкости на слизистой оболочке влагалища, с другой стороны полиакриламид, как модель слизистой оболочки влагалища, прост для исполнения, удобен в использовании (возможность использования неоднократно), безопасен, стандартен по физико-химическим показателям и прогнозируем по взаимодействиям с различными веществами.
Таблица 6.
Сравнительные показатели вагинального отделяемого и раствора
3,7% NaКМЦ
| Вязкость, Пас | Краевой угол, град | Скорость стекания раствора, мм/с | ||||
| 10* | 30* | 50* | 70* | |||
| Вагинальное отделяемое | 2,58±0,24 | 25,4±0,6 | 0,26±0,02 | 0,61±0,05 | 1,92±0,05 | 3,74±0,09 |
| Раствор 3,7 % NaКМЦ | 2,60±0,20 | 28,5±0,5 | 0,12±0,03 | 0,63±0,02 | 1,39±0,04 | 3,21±0,07 |
* - Угол наклона подложки (слизистой оболочки влагалища) к горизонтальной поверхности
Оценку поведения разработанных вагинальных суппозиториев с мифепристоном и измельченными слоевищами ламинарии на экспериментальной модели осуществляли по способности суппозиториев, приготовленных по различным прописям, адгезироваться и распределяться по модели слизистой оболочки влагалища. Учитывая результаты экспериментов, нами были выбраны для дальнейшего изучения суппозитории по прописям 1.2 (Витепсол), 1.6 (Суппорин-М с добавлением ПЭГ), 2.2 (Витепсол), 2.3 (Супацир NaS), которые способны максимально распределяться по поверхности слизистой оболочки влагалища, удерживаться на ней в течение необходимого времени, не вызывая при этом побочных явлений таких как дегидратация.
Общие выводы
- В работе впервые разработаны составы и технология вагинальных суппозиториев на основе мифепристона и измельченных слоевищ ламинарии для консервативного расширения шейки матки. Показано, что наиболее рациональными для изготовления суппозиториев с мифепристоном являются композиции на липофильных и дифильных основах, такие как Витепсол и Суппорин-М с добавлением ПЭГ, а для изготовления суппозиториев с измельченными слоевищами ламинарии наиболее рациональными являются композиции на основах Витепсол и Супацир NaS.
- На основании исследования физико-химических и биохимических параметров влагалища, определяющих функционирование лекарственных форм, разработана модельная система in vitro для сравнительной оценки поведения вагинальных суппозиториев, включающая в качестве модельного отделяемого раствор NaKМЦ и пленку из полиакриламидного геля в качестве модели слизистой оболочки влагалища.
- Впервые проведены сравнительные исследования разработанных суппозиториев с мифепристоном и измельченными слоевищами ламинарии на модели in vitro.
- Изучено качество разработанных суппозиториев в соответствии с требованиями ГФ XI и Фармакопеи Великобритании (BPh) по статье «Дезинтеграция», в соответствии с ГФ XI определена микробиологическая чистота. Суппозитории на основе мифепристона и измельченных слоевищ ламинарии соответствуют данным требованиям.
- Впервые проведены исследования количественного определения действующих веществ в суппозиториях по стандартным методикам.
- Разработанные вагинальные суппозитории стабильны в процессе хранения в течение 1 года (срок наблюдения) в условиях холодильника (температура 5±2 С).
Список опубликованных работ
- Патент № 2319495 РФ для суппозиториев на основе измельченных слоевищ ламинарии: «Средство для расширения шейки матки на основе лекарственного растительного сырья».
- Зотова А.В. Анализ терминов и понятий, используемых при рассмотрении проблемы расширения шейки матки. // Мат. 4-ой Международной научно-практической конференции «Здоровье и образование в XXI веке» - Москва; 2003 г. - С. 257.
- Зотова А.В. Анализ способов определения величины набухания веществ, используемых для изготовления цервикальных суппозиториев. //Мат. 4-ой Международной научно-практической конференции «Здоровье и образование в XXI веке» - Москва; 2003 г – С. 257-258.
- Зотова А.В. Современные методы подготовки шейки матки к родам. // Материалы конференции Пятигорской Государственной Фармацевтической Академии «Разработка, исследование и маркетинг новой фармацевтической продукции»– 2005 - с. 344-345.
- Зотова А.В. Попков В.А. Изучение технологии и состава современных суппозиториев для акушерской практики. // Материалы заочной международной конференции «Приоритеты фармацевтической науки и практики» Московская Медицинская Академия им. И.М. Сеченова. – 2006 – С. 198-200.
- Зотова А.В. Вагинальные суппозитории, применяемые в терапии женской половой сферы. //Мат. IV Росс. научно-практ. конф. «Актуальные проблемы инноваций нетрадиционных природных ресурсов и создание функциональных продуктов» РАЕС.: М – 2007 – С. 104.
- Зотова А.В., Попков В.А., Краснюк И.И. Использование лекарственных препаратов для раскрытия шейки матки в родах. Российский медицинский журнал. – М.: 2008, №1 – С. 33-35.

