Разработка состава, технологии и стандартизации воспроизведенных таблетированных препаратов атенолола-акри, микозорала и диазолина.
На правах рукописи
АВАКЯН СЕРЯН БЕНИКОВИЧ
Разработка состава, технологии и стандартизации воспроизведенных таблетированных препаратов
Атенолола-Акри, Микозорала и Диазолина.
15.00.01 — технология лекарств и организация фармацевтического дела
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата фармацевтических наук
Москва - 2007
Диссертационная работа выполнена в Центре научных исследований и разработок ОАО «АКРИХИН» и Всероссийском научно-исследовательском институте лекарственных и ароматических растений (ВИЛАР) РАХСН
Научный руководитель:
Профессор, доктор фармацевтических
наук Сокольская Татьяна Александровна
Официальные оппоненты:
- доктор фармацевтических наук,
профессор Краснюк Иван Иванович
- доктор химических наук, профессор Скачилова Софья Яковлевна
Ведущая организация:
Государственное учреждение Научно-исследовательский институт фармакологии имени В.В. Закусова Российской академии медицинских наук
Защита состоится «14» мая 2007 г в 14-00 часов на заседании диссертационного совета Д 006.070.01 во Всероссийском научно-исследовательском институте лекарственных и ароматических растений (ВИЛАР) РАСХН по адресу: 117216, г. Москва, ул. Грина, 7
С диссертацией можно ознакомиться в библиотеке ВИЛАР по адресу: 117216, г.Москва, ул. Грина, 7
Автореферат разослан «12» апреля 2007 г.
Ученый секретарь диссертационного совета
Д 006.070.01,
доктор фармацевтических наук А.И.Громакова
Актуальность темы.
Важнейшей задачей современной фармацевтической науки является разработка новых и совершенствование существующих лекарственных препаратов. Успехи современной фармакотерапии связаны не только с созданием новых оригинальных лекарственных средств, но и с разработкой оптимального состава и технологии уже применяемых в медицине лекарственных препаратов.
В последние годы под влиянием различных факторов фармацевтический рынок России интенсивно меняется. За счет жестких правил оценки безопасности, биоэквивалентности и клинических испытаний лекарственных форм на основе новых лекарственных субстанций продвижение препарата на фармацевтическом рынке составляет в среднем от 10 до 15 лет. Поэтому актуальны исследования и разработки по оптимизации состава и технологии лекарственных препаратов хорошо известных и проверенных лечебной практикой лекарственных веществ. В связи с этим на фармацевтическом рынке, как в России, так и в других странах, происходит расширение ассортимента лекарственных препаратов за счет воспроизведенных лекарств (дженериков). Так объем воспроизведенных лекарственных препаратов в мире составляет: в Германии – 35 %, в Великобритании – 55 %, в Польше – 61 %, России – 78%.
В промышленно-развитых странах выпуск дженериковых препаратов стимулируется на государственном уровне. Кроме того, использование широкого ассортимента вспомогательных веществ, в том числе высокомолекулярных соединений (ВМС), позволяет производителям улучшить биофармацевтические характеристики имеющихся в номенклатуре лекарственных препаратов путем создания современных терапевтических систем доставки лекарственных веществ. Применение природных и синтетических ВМС в производстве лекарств открывает большие перспективы не только в разработке нового поколения традиционных лекарственных форм, но и в создании препаратов с регулируемым, контролируемым высвобождением и направленным транспортом лекарственного вещества.
В целом создание дженерика (генерика) существенно менее затратно по сравнению с оригинальным препаратом, поэтому дженерик всегда значительно дешевле, а лечиться высококачественным дженериком гораздо выгоднее, чем оригинальным дорогостоящим препаратом.
Таким образом, рассматривая данную проблему с учетом достоинств генерических лекарственных препаратов, становится очевидна перспектива их дальнейшего производства, тем более что доля непатентованных препаратов на мировом рынке с каждым годом увеличивается. Поэтому разработка оптимальной технологической схемы производства воспроизведенных препаратов и улучшение их технологических и биофармацевтических свойств с помощью новых высокомолекулярных соединений является на сегодняшний день актуальной и перспективной задачей.
Цель и задачи исследования.
Целью настоящего исследования является проведение комплекса исследований по разработке состава, технологии, стандартизации и внедрению в производство отечественных твердых дозированных лекарственных форм на основе атенолола, кетоконазола и диазолина. Для достижения поставленной цели необходимо было решить следующие задачи:
- Исследовать физико-химические свойства субстанций атенолола, кетоконазола и диазолина;
- Обосновать выбор вспомогательных веществ с учётом их технологических характеристик и разработать оптимальные составы таблетированных лекарственных форм, позволяющих получить препараты с требуемым высвобождением действующих веществ;
- Разработать рациональную технологию получения таблеток на основе атенолола, кетоконазола и диазолина; изучить физико-химические и технологические характеристики полученных гранулятов и таблеток атенолола-Акри, микозорала и диазолина;
- Изучить профили теста «растворения» разработанных таблеток и препаратов сравнения. Обосновать выбор методов оценки качества полученных препаратов по разделам «Подлинность», «Количественное определение», «Посторонние примеси»;
- Изучить стабильность таблеток атенолола-Акри, микозорала и диазолина для обоснования срока годности;
- Разработать на основании проведённых исследований нормативную документацию (ФСП и опытно-промышленные регламенты);
- Изучить биоэквивалентность разработанных таблеток с препаратами сравнения, предложенными Институтом доклинической и клинической экспертизы лекарственных средств;
- Оценить экономическую эффективность разработанных таблеток в сравнении с импортными аналогами.
Поставленные задачи решались путём обобщения и критического рассмотрения данных литературы и результатов собственных экспериментальных исследований.
Научная новизна работы
Теоретически обоснована и экспериментально подтверждена необходимость определения физико-химических и технологических свойств действующих субстанций и вспомогательных веществ для разработки технологии получения таблеток.
Разработаны оригинальные составы и технология получения таблеток атенолола-Акри, микозорала и диазолина с использованием вспомогательных веществ с заданными технологическими характеристиками.
Установлены оптимальные условия проведения анализов и разработаны методики для оценки качества полученных препаратов и их стандартизации по показателям «Подлинность», «Посторонние примеси», «Однородность дозирования», «Количественное определение».
Установлены профили по тесту «растворение» разработанных таблеток и импортных аналогов.
Разработка таблетированных лекарственных форм атенолола-Акри, микозорала и диазолина выполнена на уровне изобретений (патенты РФ № 2256447, 2005г. «Фармацевтическая композиция кардиоселективного бета-адреноблокатора»; № 2266745, 2005г., «Противогрибковая фармацевтическая композиция» и № 2264814, 2005г., «Антигистаминная фармацевтическая композиция»).
Практическая значимость работы.
На основании проведенных исследований разработаны и внедрены:
- Оптимальные составы и технология получения отечественных лекарственных препаратов - таблеток атенолола-Акри, микозорала и диазолина;
- Промышленные регламенты на производство: «Атенолола-Акри таблетки 0,05 г и 0,1 г; ПР 00480495-211-05», «Микозорал таблетки 0,2 г;
ПР 254/17/03» и пусковой регламент на производство «Диазолин таблетки 50 и 100 мг; ПУР 00480495-272-05» ;
- ФСП-42-00174207-03 на таблетки «Атенолол-Акри», ФСП 42-00173894-03 на таблетки «Микозорал», ФСП 42-00175566-04 на таблетки «Диазолин».
- Эффективность препаратов, полученных по разработанной технологии, их токсикологические характеристики и биоэквивалентность на здоровых добровольцах сопоставимы с препаратами сравнения.
- Установлена экономическая эффективность разработанных таблеток в сравнении с импортными аналогами.
Основные положения, выдвигаемые на защиту.
- результаты исследований по разработке и теоретическому обоснованию состава, технологии получения и стандартизации отечественных таблеток атенолола-Акри, микозорала и диазолина;
-исследования по технологическим параметрам субстанций, гранулятов и полученных таблеток;
- методики контроля качества таблеток «Атенолола –Акри 0,05 г и 0,1 г», «Микозорала 0,2г» и «Диазолина 0,05 г и 0,1 г»;
- результаты исследования стабильности и установления сроков годности разработанных таблеток;
- изучение профилей «растворения» активных веществ из разработанных таблеток в сравнении с импортными аналогами;
- результаты изучения доклинических исследований и сравнительной биоэквивалентности разработанных таблеток с импортными аналогами;
- оценка экономической эффективности разработанных таблеток в сравнении с импортными аналогами.
Апробация работы.
Материалы диссертационной работы доложены на научно –практической конференции ГУ ВИЛАР (г. Москва, 2006г.), заседании Экспертного Совета ОАО «АКРИХИН» (г. Старая Купавна, 2006г.) и XII Конгрессе «Человек и лекарство», (Москва, 2005).
Связь выполненной работы с планом научных работ.
Диссертационная работа выполнена в соответствии с комплексной программой «Импортозамещение» Центра научных исследований и разработок ОАО «АКРИХИН»
Публикации.
По материалам диссертации опубликовано 3 печатные работы и получено 3 патента РФ.
Объем и структура диссертации.
Диссертационная работа изложена на 173 страницах компьютерного текста, состоит из введения, обзора литературы (глава1), трех глав экспериментальной части, выводов, списка литературы, включающего 182 источника, в том числе 84 иностранных, приложений. Работа содержит 31 рисунок, 49 таблиц и 3 схемы.
Во введении обоснована актуальность темы, сформулированы цели и задачи исследования, представлены научная новизна и практическая значимость работы.
В первой главе на основании обзора данных литературы проведен анализ рынка дженериковых препаратов, обоснована их роль в обеспечении населения эффективными лекарствами. Показана значимость вспомогательных веществ в производстве таблеток и влияние современных высокомолекулярных соединений на технологические и биофармацевтические свойства таблетированных препаратов; рассмотрены методы таблетирования и системы in vitro по высвобождению лекарственных веществ из таблеток.
Глава вторая содержит характеристики используемых материалов и описание методик проведения исследований.
Глава третья посвящена разработке состава и технологии таблеток Атенолола-Акри 0,05 г и 0,1 г, Микозорала 0,2г и Диазолина 0,05 г и 0,1 г. Изучены структурно-механические и технологические характеристики субстанций и таблеточных смесей. Изучено влияние вспомогательных веществ на процесс получения таблеток. На основании проведенных исследований были предложены оптимальные составы, отвечающих требованиям ГФ ХI и технологические схемы получения указанных таблеток с использованием метода влажного гранулирования. Представлены методики оценки качества и стандартизации таблеток Атенолола-Акри, Микозорала и Диазолина.
В четвертой главе изложены результаты исследования профилей «растворения», стабильности, токсичности, сравнительной биоэквивалентности и экономической эффективности разработанных таблеток и препаратов сравнения
Каждая глава имеет заключение, в котором дается анализ проведенных исследований.
Основное СОДЕРЖАНИЕ РАБОТЫ
Объекты и методы исследования.
При разработке состава и технологии получения таблеток Атенолола-Акри 0,05 г и 0,1 г, Микозорала 0,2г и Диазолина 0,05 г и 0,1 г. использовали субстанции: атенолол, отвечающую требованиям НД 42-10458-99 фирмы «Копран Лимитед» Индия; кетоконазол, отвечающую требованиям НД 42-10696-00 фирмы «Global Bulk Drugs Fine Chemicals Ltd» Индия и диазолин (мебгидролин) - НД 42-10899-99 («Ерегиере» Италия).
Вспомогательные вещества, используемые при разработке составов таблеток, представлены в таблице 1.
Таблица 1.
Вспомогательные вещества, использованные при разработке состава и технологии таблеток атенолола-Акри, микозорала и диазолина
| Наименование ингредиента | НД |
| Желатин | ГОСТ 11293-89 |
| Поливинилпирролидон (коллидон 90F) | НД 42-8482-98 |
| Натрия гликолята крахмал (Примогель) | НД 42-11282-00 |
| Аэросил | ГОСТ 14922-77 |
| Кальция фосфат двузамещенный | НД 42-11282-00 |
| Кислота стеариновая | ГОСТ 9419-78 |
| Крахмал картофельный | ГОСТ 7699-97 или НД 42-10337-99 |
| Крахмал кукурузный | ГОСТ 7697-82, сорт высший |
| Лактоза | ОСТ 49-63-97 или ТУ 9229-128-04610209-2003 |
| Тальк | ФС 42- 0066-01 |
| Магния карбонат основной | ГФ СССР Х изд., ст. 388 |
| Магния стеарат | ФС 42-1324-97 |
| Крахмал прежелатинизированный Starch 1500 | USP ХХVIII |
| Микрокристаллическая целлюлоза Avicel 102, Merck, «Профезим», «Вивапур» 102, 101; 200. | ВР 2001, ФС 42-3728-99 или ТУ 22331-107-05742755-96, USP ХХVIII. |
| Поливиниловый спирт | ФС 42-2299-85 |
| Поливинилпирролидон низкомолекулярный для медицинских целей или «Повидон 8000», «Коллидон 25» | ФСП 42-0345-4368-03 или USP 28 НД 42-8790-98 или НД 42-1194-98 |
| Пудра сахарная | ГОСТ 2294 |
| Натриевая соль карбоксиметилцеллюлозы (примеллоза) | НД 42-11281-00 |
| Вода очищенная | ФС 42-2619-97 |
| Оксипропилметилцеллюлоза | USP ХХVIII |
| Оксипропилцеллюлоза | USP ХХVIII |
Структурно-механические и технологические характеристики порошков, таблеточной массы и таблеток определяли с помощью общепринятых в фармацевтической практике методик. Форму и размер частиц определяли с помощью микроскопа МБИ-2б.
Сыпучесть определяли по массовой скорости истечения и углу естественного откоса. Наcыпная масса определялась на приборе с вибрирующей воронкой. Плотность порошков определяли пикнометрически. Расчет пористости проводили, исходя из значений плотности и насыпной массы. Определение внешней удельной поверхности проводили путем измерения воздухопроницаемости через слой спрессованного порошка при постоянном перепаде давления. Прессуемость определяли по величине нагрузки сжатия, с учетом формы и размеров таблеток. Определение остаточной влажности проводили ускоренным методом на влагомере термогравиметрическом инфракрасном МА 30 (Sartorius, Германия). Определение гранулометрического состава проводили ситовым методом.
Оценку качества таблеток проводили методами, описанными в ГФ ХI. При разработке методов количественного определения, однородности дозирования, посторонних примесей и теста «растворение» использовали методы: ТСХ, УФ-спектрофотометрии, ВЭЖХ. Процесс высвобождения действующих веществ из разработанных таблеток и таблеток сравнения изучали на приборах «Вращающаяся корзинка» и «Лопастная мешалка» производства фирмы «Еrveka».
Исследования по определению микробиологической чистоты разработанных таблеток проведены в лаборатории микробиологии отдела контроля качества ОАО «Акрихин» в соответствии с методикой, рекомендованной ГФ XI, вып. 2, стр. 193 статьи «Испытания на микробиологическую чистоту» и «Изменение № 3».
Статистическую обработку полученных в ходе исследования данных проводили с использованием t-критерия Стьюдента в соответствии с требованиями ГФ XI.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
С целью выбора оптимальных технологий и состава таблеток Атенолола-Акри 0,05 г и 0,1 г, Микозорала 0,2г и Диазолина 0,05 г и 0,1 г.были изучены физико-химические и технологические свойства субстанций, которые показали, что исследуемые субстанции имеют неудовлетворительную прессуемость и сыпучесть. Поскольку эти свойства не обеспечивают нормативных требований к лекарственной форме «таблетки», то проведение исследований требует дополнительного введения различных вспомогательных веществ и использование технологических приемов.
В таблице 2 представлены результаты исследований технологических свойств субстанций.
Таблица 2.
Основные технологические характеристики субстанций
атенолола, кетоконазола и диазолина
| атенолол | кетоконазол | диазолин | ||
| Форма и размер частиц | Белые продолговатые кристаллы в виде удлиненных пластинок и их фрагментов | Белые кристаллы в виде многогранных пластинок и их фрагментов | Белый со слегка кремоватым оттенком цвета кристаллический порошок в виде слоистых пластин | |
| Фракционный состав | до 10 мкм - 30 %, от 10-50 мкм - 45 % более 50 мкм - 25 %. | до 10 мкм - 34,5 % 10-50 мкм - 64,2% 50 -100 мкм -1,3% | до 10 мкм - 98,0 % 10-50 мкм - 2,0 % | |
| Сыпучесть, г/с | 0,8 ± 0,032 | 0,9 ± 0,02 | 0,9 ± 0,02 | |
| Угол естественного откоса, ° | 53,7 ± 1,43 | 58,0 ± 1,53 | 59,0 ± 1,52 | |
| Насыпная масса, г/см3 | 0,371 ± 0,023 | 0,425 ± 0,033 | 0,439 ± 0,024 | |
| Прессуемость,К пр г/см | 0,64 ± 0,016 | 0,71 ± 0,015 | 0,75 ± 0,018 | |
| Плотность, г/см3 | 1,070 ± 0,05 | 1,062 ± 0,06 | 1,058 ± 0,05 | |
| Влагосодержание, % | Не > 0,5 | Не > 0,5 | Не > 0,5 | |
| Удельная поверхность, см/г | 8200 ± 75 | 4880 ± 40 | 6300 ± 10 | |
| Эквивалентный диаметр, мкм | 5,0 | 9,0 | 7,0 | |
С целью выбора оптимального состава и технологии получения лекарственных препаратов изучены технологические схемы таблетирования: влажное гранулирование и прямое прессование смеси компонентов. Оценку предложенных составов и технологии проводили по основным показателям качества таблеток согласно требованиям ГФ ХI. Препаратами сравнения служили «Атенолол таблетки 50 мг и 100 мг» фирмы ЛаборМед Фарма С.А. Румыния, «Низорал таблетки» фирмы Янссен Фармацевтик, Бельгия и «Диазолина таблетки 50 мг и100 мг» фирмы «Фармак» Украина.
Высвобождение действующих компонентов изучали на приборах типа «лопастная мешалка» и «вращающаяся корзинка». Количество высвободившегося активного компонента в отобранных пробах определяли методом УФ-спектрофотометрии.
В исследованиях по разработке состава таблеток атенолола-Акри дозировкой 0,05 г в качестве наполнителя и разрыхляющих веществ были использованы микрокристаллическая целлюлоза и модифицированный крахмал 1500, улучшающий смачиваемость субстанции атенолола. Кроме того, МКЦ, введенная в состав таблеток в количестве 15-20% обеспечивает необходимую механическую прочность таблеток и улучшает сыпучесть таблеточной массы.
На основании изучения физико-химических и технологических свойств (сыпучесть, прессуемость) субстанции атенолола наиболее оптимальным для получения таблеток методом прямого прессования оказался состав, представленный в таблице 3.
Таблица 3.
Состав таблеток атенолола–Акри 0,05 г
| Наименование компонентов | Содержание, г |
| 1 | 2 |
| Атенолол (НД42-10458-99) | 0,050 |
| Крахмал 1500 (USP ХХVIII) | 0,1100 |
| Микрокристаллическая целлюлоза (ФС 42-3728-99) | 0,1240 |
| Поливинилпирролидон(НД 42-8482-98) | 0,0100 |
| Аэросил А-380 (ГОСТ 14922-77) | 0,0030 |
| Магния стеарат (ФС 42-1324-97) | 0,0030 |
| Масса таблетки: | 0,300 |
Разработанные в результате проведённых исследований состав и технология получения таблеток атенолола-Акри с дозировкой 0,05 г легли в основу разработки таблеток с дозировкой 0,1 г. Однако, получить таблетки с дозировкой 0,1 г при таблетировании в промышленных условиях с более высокой прочностью по ранее разработанной технологии предложенного состава не удалось, так как наблюдалось залипание таблетной массы на поверхностях пресс-инструмента, кроме того поверхность таблеток оказывалась бугристой. В связи с этим были проведены исследования, в которых опробовались различные наполнители и вспомогательные вещества, а также был использован метод влажного гранулирования, который был предложен и для таблеток 0,05 г в целях унификации.
В качестве увлажняющих агентов применяли растворы ПВП - 10 и 15 %, крахмального клейстера - 5 % и раствор желатина - 3 %.
В конечном итоге выбор остановили на комбинации магния карбоната основного с крахмалом кукурузным (37 % от массы таблетки). При этом, следует отметить, что использование именно кукурузного крахмала, а не картофельного, позволило получить гладкую поверхность таблеток. Наилучшую поверхность имели таблетки, содержащие 35-40 % крахмала кукурузного.
Однако, таблетки, имея хороший внешний вид, оказались недостаточно прочными, поэтому дальнейшие исследования были направлены на поиск вспомогательных веществ, повышающих прочность таблеток. Для этого использовали микрокристаллическую целлюлозу (МКЦ), гидроксипропил-целлюлозу (ГПЦ), гидроксипропилметилцеллюлозу (ГПМЦ), Коллидон-25, Коллидон-90F, сахар молочный, крахмал прежелатинизированный (STARCH 1500). Полученные таблетки оценивали по показателям «прочность на излом», «распадаемость, «прочность на истирание», результаты представлены в таблице 4.
Таблица 4.
Показатели качества таблеток атенолола-Акри 0,05
| № п/п | Вспомогательное вещество | % от массы таблетки | Показатели качества таблеток | ||
| Прочность на излом, кгс | Распадаемость, мин | Прочность на истирание, % | |||
| 1 | МКЦ | 25 | 22-24 | Более 30 | 99,60 |
| 2 | ГПЦ | 2,5 | 20-22 | Более 30 | 99,70 |
| 3 | ГПМЦ | 1,5 | 21-23 | Более 30 | 99,60 |
| 4 | Сахар молочный | 25 | 6-8 | 10-12 | 98,50 |
| 5 | Коллидон | 25,5 | 15-18 | Более 15 | 99,50 |
| 6 | Коллидон 90F | 3 | 18-21 | Более 15 | 99,90 |
| 7 | Крахмал 1500 | 10 | 25-27 | 9-12 | 99,97 |
Как видно из результатов таблицы 4, наибольшую прочность
имели таблетки, содержащие в составе крахмал 1500 (10 %), и при этом их
распадаемость (9-12 минут) и истираемость (0,03 %) оказались минимальными.
Однако, при апробации данной рецептуры и технологии таблеток в промышленных условиях, в составе которых содержался крахмал 1500, время распадаемости полученных таблеток увеличилось до 15 минут. Для уменьшения времени распадаемости в состав таблетной массы включили крахмал гликолата натриевую соль (Примогель), эффективный супердезинтегрант, в количестве 0,5 %, 1,0 %, 1,5 %, 2,0 %, 2,5 % и изучили зависимость времени распадаемости таблеток обеих дозировок от его количества, а также степень высвобождения атенолола из таблеток в зависимости от содержания Примогеля. (Рис.1 и 2).
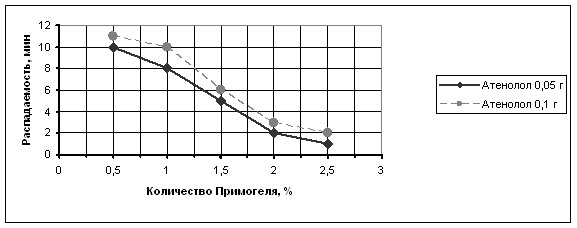
Рис. 1. Зависимость времени распадаемости таблеток
Атенолол-Акри 0,05 г и 0,1 г от количества Примогеля
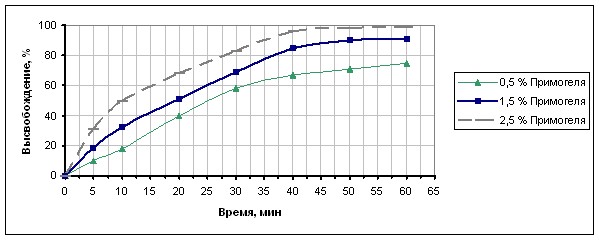
Рис. 2. Высвобождение атенолола из таблеток 0,05 в зависимости
от количества натриевой соли крахмала гликолята (Примогеля)
Оптимальным оказалось содержание Примогеля в количестве 2,0-2,5 % от массы таблетки. На основании проведенных исследований был предложен оптимальный состав (табл. 5) для получения таблеток атенолола-Акри с дозировкой 0,05 г и 0,1г. В качестве увлажняющего агента наиболее рациональным оказался 3% раствор желатина.
Таблица 5.
Состав таблеток Атенолола -Акри 0,05 г и 0,1 г
| Ингредиенты | таблетка 0,05 г | таблетка 0,1 г | % |
| Атенолол | 0,05 г | 0,1г | 16,7 |
| Крахмал кукурузный | 0,0750 г | 0,1500 г | 25,0 |
| Магния карбонат | 0,1297 г | 0,2594 г | 43,25 |
| Крахмал прежелатинизированный STRACH -1500 | 0,0300 г | 0,0600 г | 10,0 |
| Желатин медицинский | 0,0063 г | 0,0126 г | 2,1 |
| Магния стеарат | 0,0030 г | 0,0060 г | 1,0 |
| Крахмалгликолят натрия | 0,0060 г | 0,0120 г | 2,0 |
| Масса таблетки | 0,3000 г | 0,6000 г | 100 |
С целью выявления оптимального режима таблетирования было проведено изучение зависимости основных характеристик таблеток от величины давления прессования.
Качество приготовленных таблеток оценивали по времени распадаемости и механической прочности (рис. 3 и 4).
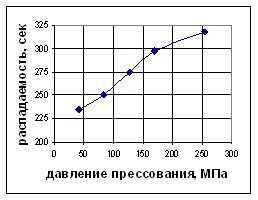 | 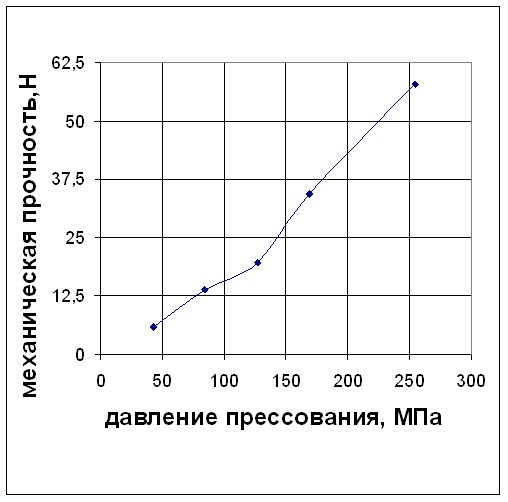 |
| Рис. 3. Зависимость распадаемости таблеток 0,05 атенолола-Акри от давления прессования | Рис. 4. Зависимость механической прочности на сжатие таблеток 0,05 атенолола-Акри от давления прессования |
Исходя из данных, представленных на рис. 3 и 4 можно сделать вывод, что при увеличении давления прессования увеличивается механическая прочность на сжатие и время распадаемости.
Однако, во всём рассмотренном диапазоне, время распадаемости не превышает установленные пределы, а механическая прочность удовлетворяет требованиям только в последних трёх случаях. Таким образом, оптимальный диапазон давления прессования составляет от 120 до 250 МПа.
При разработке состава и технологии таблеток микозорала 0,2 г на основании изучения технологических свойств субстанции в качестве метода получения таблетной смеси была выбрана влажная грануляция.
Для реализации поставленной цели были проведены исследования по изучению влияния вспомогательных веществ на технологические характеристики таблетируемой массы и готовых таблеток.
Использование в качестве гранулирующей жидкости растворов МЦ-100 и ПВП позволило добиться достаточной механической прочности таблеток и высокой сыпучести гранулята. Таблетки, гранулированные крахмальным клейстером, обладали меньшей прочностью, а грануляты сыпались хуже.
Наилучшие результаты имел гранулят и таблетки, в которых в качестве увлажнителя использовали 20 %-й раствор ПВП, т.е. получали более прочный гранулят и, соответственно более прочные таблетки. Для обеспечения распадаемости таблеток и теста «растворение» был выбран состав № 1, в который в дальнейшем добавляли различные количества традиционного разрыхлителя - крахмала картофельного, изучая зависимость высвобождения действующего вещества от его количества. (рис.5)
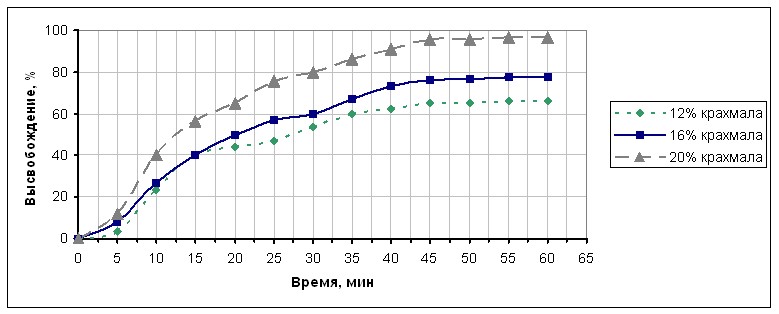 Рис. 5. Зависимость высвобождения кетоконозола из таблеток Микозорал 0,2 г от количества крахмала картофельного.
Рис. 5. Зависимость высвобождения кетоконозола из таблеток Микозорал 0,2 г от количества крахмала картофельного.
Кривые зависимостей прочности и распадаемости представлены на рис.6 и 7.
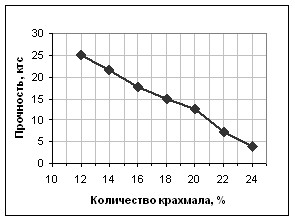 |  |
| Рис. 6. Зависимость прочности таблеток Микозорал 0,2 г от количества крахмала картофельного | Рис. 7. Зависимость времени распадаемости таблеток Микозорал 0,2 г от количества крахмала картофельного |
Помимо изучения влияния содержания картофельного крахмала на прочность и распадаемость таблеток, было установлено и влияние влажности гранулята на качество таблеток Микозорала. Оптимальным содержание влаги в грануляте оказалось влажность от 3 до 6 %.
На основании проведенных исследований был предложен следующий состав (табл. 6) таблеток Микозорала 0,2 г. средней массой 0,32 г.
Таблица 6.
Состав таблеток Микозорал 0,2г
| Наименование ингредиента (НД) | Состав на одну таблетку | |
| Г | % | |
| 1 | 2 | 3 |
| Кетоконазол (НД 42-10696-00) | 0,2 | 62,5 |
| Крахмал картофельный (НД 42-10337 -99) «Avebe» Нидерланды | 0,0600 | 18,80 |
| Лактоза моногидрат 80 меш (USP ХХV111. NF №18 с. 2258) | 0,016 | 5,0 |
| Поливинилпирролидон (Повидон 8000) (НД 42-8790-98) | 0,0226 | 7,0 |
| Аэросил А-380 (ГОСТ 14922 -77) | 0,0120 | 3,8 |
| Тальк (ФС42-0066-01) | 0,0062 | 1,9 |
| Магния стеарат (ФС 42-1324-97) | 0,0032 | 1,0 |
На основании предложенного состава и технологии был разработан и внедрен в производство промышленный регламент.
При разработке состава и технологии таблеток диазолина с дозировкой 0,05 г и 0,1 г на основании анализа физико-химических и технологических свойств субстанции диазолина были исследованы несколько составов таблеток с использованием различных вспомогательных веществ, показана необходимость применения метода влажного гранулирования.
В качестве увлажняющего агента были использованы 10 % раствор крахмального клейстера, 5% раствор метилцеллюлозы (МЦ), и 5 %, 15 % и 20% растворы поливинилпирролидона (ПВП).
Использование в качестве гранулирующего раствора МЦ-100 и растворов ПВП 15% и 20 % позволило добиться достаточной механической прочности таблеток и высокой сыпучести гранулята. Однако таблетки из гранулята, полученного с помощью 5 % раствора МЦ и 20 % раствора ПВП имели распадаемость более 15 минут. Таблетки, гранулированные 5 % раствором ПВП и 10 % раствором крахмального клейстера, обладали меньшей прочностью и у гранулятов ухудшалась сыпучесть.
В связи с этим, в дальнейшем изучалась распадаемость, прочность таблеток и высвобождение диазолина от содержания крахмала картофельного в составе таблеток. (Рис. 8, 9,10).
 | 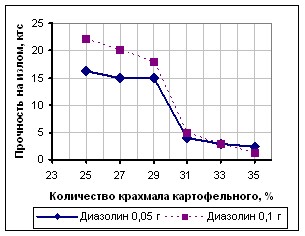 |
| Рис. 8. Зависимость времени распадаемости таблеток Диазолина 0,05 г и 0,1 г от количества крахмала картофельного | Рис. 9. Зависимость прочности таблеток Диазолин 0,05 г и 0,1 г от количества крахмала картофельного |
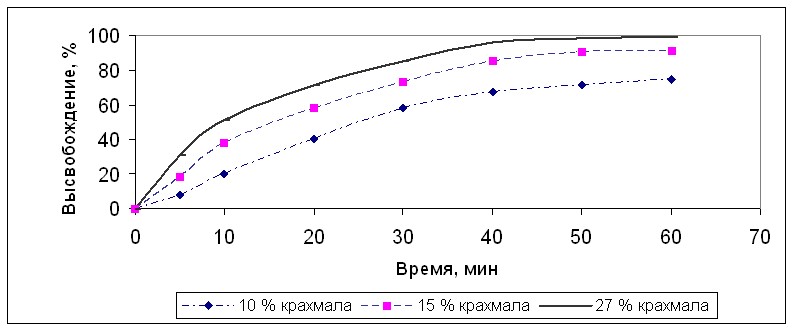 | |
Рис.10. Высвобождение диазолина из таблеток 0,05 г. в зависимости
от содержания крахмала картофельного фирмы (AVEBE)
Как видно из представленных кривых наилучшие результаты имел гранулят и таблетки, в которых количество крахмала картофельного составляло около 27 % от средней массы таблетки.
Помимо изучения влияния содержания картофельного крахмала, фирмы (AVEBE), на прочность, распадаемость и тест «растворение» таблеток, было изучено влияние влажности гранулята на качество таблеток диазолина. Оптимальной оказалась влажность от 2 до 6 %.
На основании проведенных исследований был предложен следующий состав таблеток диазолина.
Таблица 7.
Состав таблеток Диазолина 0,05 г и 0,1 г
| Ингредиенты | таблетка 0,05 г | таблетка 0,1 г | % |
| Диазолин (НД42-6702-02) | 0,0500 | 0,100 | 33,0 |
| Сахар молочный (лактоза моногидрат 200 меш) (Британская ф., 1998г., т. 1, с.770 или Европейская ф., 111,2005 г., с.1081 или Ф. США, XXУ11, фирма BORCULO, Голландия) | 0,0480 | 0,096 | 32,0 |
| Крахмал картофельный (НД 42-10337-99) фирма "AVEBE", Нидерланды | 0,0415 | 0,083 | 27,0 |
| Поливинилпирролидон марки Коллидон 25 (НД 42-8482-98, USP XXУII, 2004, с. 1267, фирма BASF, Германия) | 0,0090 | 0,018 | 6,0 |
| Магния стеарат (ФС 42-1324-97) (фирма-поставщик Kirsh Pharma, Германия) | 0,0015 | 0,003 | 1,0 |
| Масса таблетки | 0,1500 | 0,300 | 100 |
Для окончательного вывода об адекватности разработанных составов изучали профили теста «растворения» полученных таблеток с препаратами сравнения в соответствии с требованиями ОФС 42-0003-04. Полученные профили «растворения» свидетельствовали о фармацевтической эквивалентности разработанных таблеток с препаратом сравнения. (Рис 11, 12 и 13).

Рис. 11. Профили растворения таблеток Атенолол–Акри и препарата сравнения (Румыния)

Рис. 12. Профили растворения таблеток Микозорала и препарата сравнения (Бельгия)
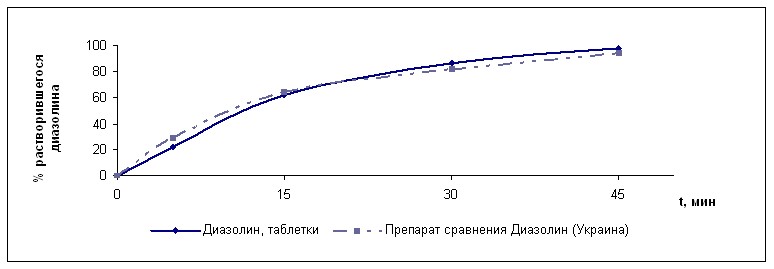
Рис. 13. Профили растворения таблеток диазолина и препарата сравнения (Украина)
На пяти экспериментальных сериях предложенных составов Атенолола-акри Микозорала, Диазолина были разработаны показатели качества, включенные в НД.
Препараты при хранении в стандартных условиях и методом ускоренного старения в течение 2 лет и 3-х месяцев не изменили нормируемых свойств, что позволило установить для них срок годности 2 года.
Сравнительная оценка составов разработанных таблеток и препаратов сравнения (табл. 8) показала, что разработанные таблетки Атенолола-акри не содержат лаурилсульфат натрия, а имеют в своем составе Примогель – супердезинтегрант, введение которого позволило уменьшить время распадаемости таблеток.
Таблица 8.
Сравнительная таблица составов разработанных таблеток и препаратов сравнения
| №п/п | Атенолол | Микозорал (Кетоконазол) | Диазолин | |||
| Атенолол-Акри (Акрихин) | Низорал (Янсен Фармацевтик, Бельгия) | Микозорал (Акрихин) | Диазолин (Фармак, Украина) | Диазолин (Акрихин) | ||
| Желатин | Желатин | Крахмал кукурузный | Крахмал картофельный (AVEBE) | Сахар | Лактоза (моногидрат) (AVEBE) | |
| Крахмал кукурузный | Крахмал кукурузный | Лактоза (моногидрат) (AVEBE) | Лактоза (моногидрат) (AVEBE) | Патока крахмальная | Крахмал картофельный (AVEBE) | |
| Магния карбонат | Магния карбонат | ПВП | ПВП | Масло подсолнечное | ПВП | |
| Магния стеарат | Магния стеарат | МКЦ | МКЦ | Воск | Магния стеарат | |
| Тальк | Примогель | Аэросил | Аэросил | Тальк | - | |
| Лаурилсуль-фат натрия | Крахмал прежелатини-зированный | Магния стеарат | Магния стеарат | - | - | |
| - | - | - | Тальк | - | - | |
Состав таблеток Микозорала содержит дополнительно тальк, введение которого улучшило сыпучесть гранулята и уменьшило прилипаемость таблеток к пуансонам. Состав таблеток диазолина был изменен полностью по сравнению с составом препарата сравнения. Отечественные таблетки микозорала и диазолина разработаны впервые.
Исследования биоэквивалентности и безопасности проводились на базах: кафедра клинической фармакологии Российского Государственного Медицинского Университета, (6-я городская клиническая больница г. Москва) и ГУ Центральный научно-исследовательский кожно-венерологический институт МЗ РФ г. Москва.
Изучение токсичности показало, что разработанные препараты являются нетоксичными и безвредными как при однократном, так и при многократном введении. Установлено, что показатели острой и хронической токсичности разработанных лекарственных форм не имеют достоверных отличий от препаратов аналогов.
Проведенные исследования показали, что сравниваемые лекарственные формы по основным фармакокинетическим параметрам: максимальной концентрации(Сmах), времени достижения максимальной концентрации (Tmax), показателю скорость всасывания (Cmax /AUCo,), среднему времени удерживания препарата (MRT) достоверно не отличаются друг от друга. По результатам статистического анализа был сделан вывод о биоэквивалентности двух исследованных лекарственных форм разработанных таблеток и препаратов сравнения.
Исходя из данных маркетингового анализа, была составлена таблица сравнительных цен (табл. 9) разработанных таблеток и препаратов аналогов иностранных фирм. Из данных таблицы видно, что стоимость одной упаковки таблеток атенолола-Акри и диазолина производства «Акрихин» в два раза ниже, чем у импортных аналогов. Таблетки Микозорала отечественного производства впервые были выпущены предприятием «Акрихин» и стоимость их в 2,5 раза ниже, чем фирмы Янссен–Фарм (Бельгия).
Таблица 9.
Сравнительный анализ цен разработанных препаратов
| № | Название препарата и дозировка | Производитель | Цена Акрихина по прайс- листам | Средняя цена упаковки в аптеках (в руб.) |
| Атенолол-Акри: | ||||
| 1 | Табл. 0,05 №30 | Акрихин | 12,80 | 21,5 |
| Табл. 0,05 №30 | ЛаборМед (Румыния) | 35,0 | ||
| Табл. 0,1 №30 | Акрихин | 14,00 | 24,5 | |
| Табл. 0,1 №30 | Ратиофарм (Германия) | 60,0 | ||
| 2 | Микозорал: | |||
| Табл. 0,2 №30 | Акрихин | 250,00 | 242,5 | |
| Низорал Табл. 0,2 №30 | ЯнссенФарм (Бел) | 620,0 | ||
| 3 | Диазолин: | |||
| Табл. 0,05 №10 | Акрихин | 5,6 | ||
| Табл. 0,05 №10 | Витамин. завод (Укр) | 12,0 | ||
| Табл. 0,1 №10 | Акрихин | 7,4 | ||
| Табл. 0,1 №10 | Фармак (Укр) | 10,0 | ||
Таким образом, на основании проведенных исследовании дана оценка экономической эффективности разработанных таблеток, которая составила для таблеток Атенолола-акри – 501 050 рублей в год ; для таблеток Микозорала, внедренных в отечественное производство впервые, приблизительно 1 200 000 рублей в год, для таблеток Диазолина - 231350 рублей в год.
Разработка нормативной документации
На основании проведенных экспериментальных исследований разработаны и оформлены:
- Промышленные регламенты на производство: «Атенолола-Акри таблетки 0,05 г и 0,1 г; ПР 00480495-211-05», «Микозорал таблетки 0,2 г;
ПР 254/17/03» и пусковой регламент на производство «Диазолин таблетки 50 и 100 мг; ПУР 00480495-272-05» ;
- ФСП-42-00174207-03 на таблетки «Атенолол-Акри», ФСП 42-00173894-03 на таблетки «Микозорал», ФСП 42-00175566-04 на таблетки «Диазолин», согласно которым осуществляется стандартизация и контроль качества выпускаемых таблеток.
Общие выводы
- Проведено экспериментальное изучение свойств субстанций атенолола, кетоконазола, диазолина: форма и размер частиц, технологические характеристики.
- На основании изученных технологических характеристик субстанций и теоретических обоснований установлена принципиальная возможность разработки оригинальных составов таблетированных лекарственных форм атенолола-Акри, микозорала, диазолина.
- Показано, что получение таблетированных лекарственных форм с использованием изученных субстанций необходимо проводить методом влажной грануляции.
- Исследованы структурно–механические характеристики разработанных твердых дозированных лекарственных форм, изучено влияние технологических факторов на показатели качества таблеток.
- Экспериментально обоснована оптимальная промышленная технология производства препаратов атенолола-Акри, микозорала, диазолина.
- Изучение качественных показателей таблеток атенолола-Акри, микозорала и диазолина, полученных по разработанной промышленной технологии, свидетельствует об их фармацевтической и фармакологической эквивалентности препаратам сравнения «Атенолол таблетки 50 мг и 100 мг» фирмы ЛаборМед Фарма С.А., «Низорал таблетки» фирмы Янссен Фармацевтика, «Диазолин таблетки 50 мг и 100 мг» фирмы «Фармак».
- Разработка промышленной технологии получения таблетированных форм лекарственных препаратов Атенолол –Акри, Микозорал и Диазолин позволила впервые организовать их отечественное производство и обеспечить здравоохранение эффективными и доступными лекарственными средствами.
( П.Р № 00480495-211-05 на производство: «Атенолола-Акри таблетки 0,05 г и 0,1 г, ПР № 254/17/03 «Микозорал таблетки 0,2 г; » и ПУР№ 00480495-272-05» на производство «Диазолин таблетки 50 и 100 мг;)
Список работ опубликованных по теме диссертации.
- Воскобойникова И.В.,. Авакян С.Б., Сокольская Т.А., Тюляев И.И., Багирова В.Л., Колхир В.К., Сакович Г.С.. «Современные вспомогательные вещества в производстве таблеток. Использование высокомолекулярных соединений для совершенствования лекарственных форм и оптимизации технологического процесса» // Химико-фармацевтический журнал-2005- т. 2005- №1 – С 22-28
- Воскобойникова И. В., Авакян С. Б., Сокольская Т. А.,. Тюляев И. И, Багирова В.Л., Колхир В.К., Сакович Г.С. «Применение супердезинтеграторов в твердых дозированных лекарственных формах» // Фармация – 2005г– №2, -С 35-37
- Авакян С. Б., Тюляев И.И., Зуев А.П., Воскобойникова И. В.,. Сокольская Т.А, Багирова В. Л.. «Оптимизация состава и технологии получения таблеток– ядер тарицина» - XII Конгресс «Человек и лекарство» Тезисы докладов - Москва -2005 - С.630
- Зуев А.П., Авакян С.Б, Емшанова С.В., Тюляев И.И., Юрченко Н..И., Петрушин Н.П., Панфилов В.А., Новикова Н.С., Демченко Б.И. Патент РФ № 2256447, 30.01. 2004г, «Фармацевтическая композиция кардиоселективного бета-адреноблокатора»
- Петрушин Н.П., Авакян С.Б,Тюляев И.И., Панфилов В.А., Новикова Н.С., Емшанова С.В,. Демченко Б.И.,.Юрченко Н..И., Зуев А.П
Патент РФ № 2266745, 18.02.2005г,
«Противогрибковая фармацевтическая композиция».
- Авакян С.Б., Новикова Н.С., Емшанова С.В.,Тюляев И.И. Демченко Б.И.,.Юрченко Н..И., Зуев А.П., Петрушин Н.П., Панфилов В.А.
Патент РФ № 2264814, 29.12.2003г,
«Антигистаминная фармацевтическая композиция».

