Сравнительное изучение капсулированных препаратов циклоспорина а (контроль качества и терапевтический лекарственный мониторинг)
На правах рукописи
ЛЕДОВСКИХ МАРИЯ ВЛАДИМИРОВНА
СРАВНИТЕЛЬНОЕ ИЗУЧЕНИЕ КАПСУЛИРОВАННЫХ ПРЕПАРАТОВ ЦИКЛОСПОРИНА А (КОНТРОЛЬ КАЧЕСТВА И ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ)
15.00.02 – фармацевтическая химия, фармакогнозия
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
кандидата фармацевтических наук
Москва 2006
Работа выполнена в ГОУ ВПО Московская медицинская академия имени И.М.Сеченова и НИИ клинической онкологии ГУ РОНЦ им. Н.Н.Блохина РАМН.
Научные руководители:
доктор фармацевтических наук,
профессор Садчикова Наталья Петровна
доктор биологических наук Байкова Валентина Николаевна
Официальные оппоненты:
доктор фармацевтических наук,
профессор Казьмина Эма Максимовна
кандидат биологических наук Неугодова Наталья Петровна
Ведущая организация: Всероссийский научный центр по безопасности биологически активных веществ.
Защита состоится «___» _____2006 г. в ___ часов на заседании Диссертационного Совета
Д 208.040.09 при Московской медицинской академии имени И.М.Сеченова (121019,
г.Москва, Никитский б-р, 13).
С диссертацией можно ознакомиться в библиотеке Московской медицинской академии имени И.М.Сеченова (117998, г.Москва, Нахимовский пр-т, 49).
Автореферат разослан «___»_____2006 г.
Учёный секретарь
Диссертационного
Совета Д 208.040.09
доктор фармацевтических наук,
профессор Садчикова Наталья Петровна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Значительный прогресс в области трансплантологии, наблюдаемый в последние десятилетия, связан с разработкой и введением в клиническую практику иммуносупрессивных препаратов, обеспечивших радикальное увеличение сроков выживаемости трансплантатов и пациентов и сделавших стандартной саму процедуру трансплантации. Циклоспорин А, циклический полипептид, способность которого селективно ингибировать Т-хелперную субпопуляцию лимфоцитов была открыта в 1972 г., вот уже на протяжении 20 лет является одним из наиболее важных звеньев иммуносупрессивной терапии при трансплантации органов и, несмотря на введение в практику новых иммунодепрессантов, остаётся препаратом выбора [Kahan, 1999].
В последние 10 лет актуальнейшей проблемой является введение в клиническую практику воспроизведённых (дженериковых) лекарственных форм циклоспорина А. На начало 2006 г. в Российской Федерации зарегистрировано 11 препаратов и 3 субстанции циклоспорина А отечественных и зарубежных производителей. Принимая во внимание противоречивость данных об эффективности и безопасности применения дженериков циклоспорина А, а также угрожающие жизни пациента последствия применения некачественного препарата, на этапе фармацевтической экспертизы крайне важно оценить фармацевтическую (in vitro) эквивалентность воспроизведённых препаратов циклоспорина А с учётом современных подходов к проведению подобных исследований и критериев оценки количественных результатов для последующего контроля эффективности воспроизведённых лекарственных средств и обоснования их целевого назначения. Эти результаты в совокупности с нормативными показателями качества могут быть полезными при выявлении контрафактной продукции на фармацевтическом рынке Российской Федерации.
Главной особенностью клинического применения препаратов циклоспорина А является необходимость проведения терапевтического лекарственного мониторинга (ТЛМ), подразумевающего контроль концентрации препарата в крови для обеспечения адекватной иммуносупрессии и сведения к минимуму возможных токсических реакций у каждого пациента [Shaw, 1999]. Существует несколько схем ТЛМ циклоспорина А. Так, в течение долгого времени для этого использовался показатель С0 – концентрация препарата в крови до приёма очередной дозы, т.е. минимальная концентрация, достигаемая между двумя приёмами препарата. Однако, данный показатель не отражает вариабельность скорости и степени абсорбции, экспозиции циклоспорина, а также не является достоверным прогностическим фактором клинической эффективности [Johnston,2000]. В последние годы в качестве параметра для ТЛМ циклоспорина предложено использование точки С2 (концентрация циклоспорина А в крови через 2 часа после перорального приёма). В связи с этим представляется актуальным оценка эффективности мониторирования иммуносупрессивной терапии циклоспорином А по показателю С2 у больных после аллогенной трансплантации почки.
Цель и задачи исследования
Цель настоящего исследования - сравнительное изучение капсулированных лекарственных форм циклоспорина А путём сопоставления уровня требований, методов стандартизации и стабильности препаратов различных фирм-производителей, а также оценка эффективности мониторирования терапии циклоспорином А у пациентов после аллогенной трансплантации почки.
Для достижения поставленной цели были сформулированы следующие задачи:
- Провести информационно-аналитические исследования по проблеме стандартизации препаратов циклоспорина А и их определению в биологических жидкостях при проведении терапевтического лекарственного мониторинга для обоснования выбора методов определения циклоспорина А в лекарственных формах и биологических жидкостях.
- Провести экспериментальную оценку существующих методик определения циклоспорина А в лекарственных формах с применением метода ВЭЖХ и обосновать оптимальные условия определения циклоспорина А и родственных соединений.
- Дать сравнительную оценку капсулированных лекарственных форм циклоспорина А, зарегистрированных в Российской Федерации, по показателю «Посторонние примеси».
- Изучить высвобождение циклоспорина А из мягких желатиновых капсул в условиях теста «Растворение», на основании полеченных данных построить профили растворения.
- Изучить изменение качества капсулированных лекарственных форм циклоспорина А при хранении.
- Изучить в сравнительном аспекте мягкие желатиновые капсулы циклоспорина А различных производителей путём определения диаметра и распределения частиц по размерам.
- Провести терапевтический лекарственный мониторинг циклоспорина А у пациентов после аллогенной трансплантации почки методом флуоресцентно-поляризационного иммунного анализа.
Научная новизна результатов. Впервые разработана ВЭЖХ-методика определения циклоспорина А и посторонних примесей в капсулированных препаратах.
Установлены условия проведения испытания «Растворение» для капсулированных препаратов циклоспорина А, получены профили растворения препаратов «Сандиммун Неорал» («Новартис Фарма»), «Циклоспорин Гексал» («Гексал»), «Экорал» (Айвэкс»), «Циклопрен» («Верофарм»).
Практическая значимость результатов исследования. Разработанная методика ВЭЖХ-анализа для установления подлинности, количественного определения циклоспорина А и посторонних примесей предложена для стандартизации капсулированных лекарственных форм циклоспорина А и апробирована в отделе апробации фармакологических и лекарственных средств Института стандартизации лекарственных средств ФГУ НЦ ЭСМП Росздравнадзора.
Полученные данные о высвобождении циклоспорина А из капсулированных форм позволяют судить о фармацевтической эквивалентности препаратов-дженериков и могут быть использованы для решения вопроса о целесообразности их дальнейшего фармакокинетического исследования в условиях клиники.
Полученные профили растворения могут быть использованы при выборочном контроле лекарственного средства и для подтверждения постоянства состава и технологии производства в течение всего срока регистрации в Российской Федерации.
Предложенная схема терапевтического лекарственного мониторинга циклоспорина А используется в Московском городском центре трансплантации почки.
Апробация работы. Основные положения диссертационной работы доложены и обсуждены на научно-практической конференции ФГУ «Научный центр экспертизы средств медицинского применения» «Современные методы стандартизации и контроля качества лекарственных средств» (Москва, 2006 г.), межкафедральной конференции ММА им. И.М.Сеченова.
Публикации. По материалам диссертации опубликованы 4 печатные работы.
Связь темы исследования с проблемным планом фармацевтических наук.
Диссертационная работа выполнена в рамках комплексной темы кафедры фармацевтической химии ММА им. И.М.Сеченова «Совершенствование контроля качества лекарственных средств» (№ гос. регистрации 01.200.110545).
Объём и структура диссертации. Диссертация изложена на стр. машинописного текста и состоит из ведения, обзора литературы, экспериментальной части (материалы и методы, результаты исследования и их обсуждение), выводов и библиографического указателя. Работа иллюстрирована 13 таблицами и 43 рисунками. Библиографический указатель включает 130 источников, 121 из них – иностранные.
Основные положения, выносимые на защиту:
- результаты исследований по подбору оптимальных условий определения циклоспорина А и родственных соединений методом ВЭЖХ;
- результаты сравнительного анализа капсулированных препаратов циклоспорина А четырёх производителей по показателю «Посторонние примеси»;
- результаты сравнительного изучения высвобождения циклоспорина А из капсулированных препаратов четырёх производителей;
- результаты оценки стабильности при хранении капсулированных препаратов циклоспорина А.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
- Объекты исследования
Объектами исследования являлись мягкие желатиновые капсулы циклоспорина А: оригинальный препарат «Сандиммун Неорал» 25 мг, 50 мг («Новартис Фарма», Швейцария) и три воспроизведённых препарата «Циклоспорин Гексал» 25 мг, 50 мг, («Гексал», Германия), «Экорал» 25 мг, 50 мг («Айвэкс», Чешская Республика), «Циклопрен» 25 мг, 50 мг («Верофарм», РФ).
Для оценки стабильности капсулированных лекарственных форм циклоспорина А использовали вышеуказанные препараты с истёкшим на момент испытания сроком годности (до 2004 г.), и те, срок годности которых был ограничен 2006 г.
При оценке эффективности терапевтического лекарственного мониторинга циклоспорина А было проведено наблюдение за 23 пациентами после аллогенной трансплантации почки в течение 50+3 суток после операции. Все больные получали трёхкомпонентную иммуносупрессию: Сандиммун Неорал в дозе 8 – 10 мг/кг/сут, Селлсепт 2000 мг/сут и преднизолон 0,5 мг/кг/сут.
2. Оборудование и условия испытаний
2.1. Высокоэффективная жидкостная хроматография
Исследование проводили в условиях обращено-фазовой ВЭЖХ. В работе использовали ВЭЖХ хроматограф Agilent 1100 Series. Колонка LiChrospher 100 RP18 (250 мм х 4 мм, С18, 5 мкм). Температура колонки 700 С. Объём пробы 20 мкл (инжектор Rheodyne). Детектирование: УФ.-детектор при длине волны 210 нм. Управление прибором и расчёт хроматографических параметров осуществляли с использованием программы «Chemstation».
2.2. Тест «Растворение»
Изучение высвобождения циклоспорина А из капсулированных препаратов циклоспорина А четырёх производителей проводили на приборе Distek Dissolution System 2100C типа «Лопастная мешалка» в условиях теста «Растворение»: среда растворения 0,1 н хлороводородная кислота, содержащая 0,5% натрия додецилсульфата, объём среды растворения 500 мл, температура 37+0,5 0С, скорость вращения 75 оборотов/мин. Отбор проб осуществляли каждые 10 минут в течение 1 часа. Отобранные аликвоты фильтровали с использованием мембранного фильтра «Капрон», «БиоХимМак» с размером пор 0,2 мкм. Определение содержания циклоспорина А, высвободившегося в среду растворения, проводили методом ВЭЖХ.
2.3. Измерение диаметров и оценку распределения частиц содержимого капсул по размерам проводили с использованием метода корреляционной спектроскопии светорассеяния (динамического лазерного светорассеяния) на приборе Nano-Sizer (Cultronics, США), включающем He-Ne лазер с длиной волны 632,8 нм. Исследуемые образцы готовили непосредственно перед проведением измерений. Вскрывали капсулы скальпелем и разводили содержимое в дистиллированной воде. Концентрацию образца подбирали эмпирически таким образом, чтобы частота фотоимпульсов, поступающих на фотоэлектронный умножитель, составляла 200-400 кГц.
2.4. Флуоресцентно-поляризационный иммунный анализ
Концентрацию циклоспорина А в цельной крови пациентов после трансплантации почки определяли через 12 часов (точка С0) и через 2 часа (точка С2) после приёма Сандиммуна Неорала 2 раза в неделю методом флуоресцентно-поляризационного иммунного анализа на приборе TDх/FLх (Abbott, США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
1. Разработка методики ВЭЖХ-определения циклоспорина А и посторонних примесей в капсулированных лекарственных формах.
В результате проведённых информационно-аналитических исследований установлено, что ВЭЖХ является основным аналитическим методом стандартизации препаратов циклоспорина А и включёна в соответствующую нормативную документацию.
Для получения картины хроматографического поведения циклоспорина А и родственных соединений в разных условиях и обоснования оптимальных условий хроматографирования были экспериментально оценены существующие методики определения циклоспорина А в лекарственных формах с применением метода ВЭЖХ по монографиям зарубежных фармакопей и литературным данным (табл.1). Для определения разделительной способности хроматографической системы использовали смесь стандартов циклоспорина А и двух примесей – циклоспорина Н и дигидроциклоспорина А (Европейская Фармакопея).
Табл. 1. Условия ВЭЖХ-определения циклоспорина А
| Условия ВЭЖХ | Монографии на субстанцию циклоспорина А USP 27, Ph Eur IV | Монография на капсулы циклоспорина А USP 27 |
| Колонка | 250 мм х 4 мм, наполнитель С18, 3-5 мкм | 250 мм х 4 мм, наполнитель С18, 5 мкм |
| Температура | 800 С | 700 С |
| Подвижная фаза | вода/ацетонитрил/трет-бутилметиловый эфир/ Н3РО4 в соотношении 520:430:50:1 | вода/ацетонитрил/метанол/ Н3РО4 в соотношении 400:550:50:0,5 |
| Вид градиента | Изократический | Изократический |
| Скорость потока ПФ | 1,2 мл/мин | 1 мл/мин |
| Объём пробы | 20 мкл | 20 мкл |
| Детекция | УФ-детекция, длина волны 210 нм | УФ-детекция, длина волны 210 нм |
Приготовление смеси стандартов для определения разделительной способности системы: около 0,0005 г стандартов циклоспорина А, циклоспорина Н и дигидроциклоспорина А помещали в мерную колбу на 10 мл, растворяли в 5мл смеси ацетонитрила и воды бидистиллированной в соотношении 1:1 и доводили растворителем до метки.
Приготовление стандартного раствора циклоспорина А (1): около 0,01 г стандарта циклоспорина А (точная навеска) помещали в мерную колбу вместимостью 10 мл и доводили объём до метки растворителем (смесь ацетонитрила и воды бидистиллированной в соотношении 1:1). Концентрация стандартного раствора циклоспорина А (1) составила 1,02 мг/мл.
Приготовление стандартного раствора циклоспорина А концентрацией 0,0002 мг/мл для проверки чувствительности системы: 100 мкл стандартного раствора циклоспорина А (1) помещали в мерную колбу вместимостью 10 мл и доводили объём до метки растворителем. 200 мкл полученного раствора концентрацией 0,0102 мг/мл помещали в мерную колбу вместимостью 10 мл и доводили объём до метки растворителем. Концентрация стандартного раствора циклоспорина для проверки чувствительности системы составила 0,0002 мг/мл.
Приготовление раствора смеси стандартов примесей и продуктов деградации: около 0,01 г смеси стандартов примесей и продуктов деградации циклоспорина А помещали в мерную колбу вместимостью 10 мл и доводили объём до метки растворителем.
Хроматограммы смеси стандартов циклоспорина А, циклоспорина Н и дигидроциклоспорина А в вышеуказанных условиях представлены на рисунке 1.
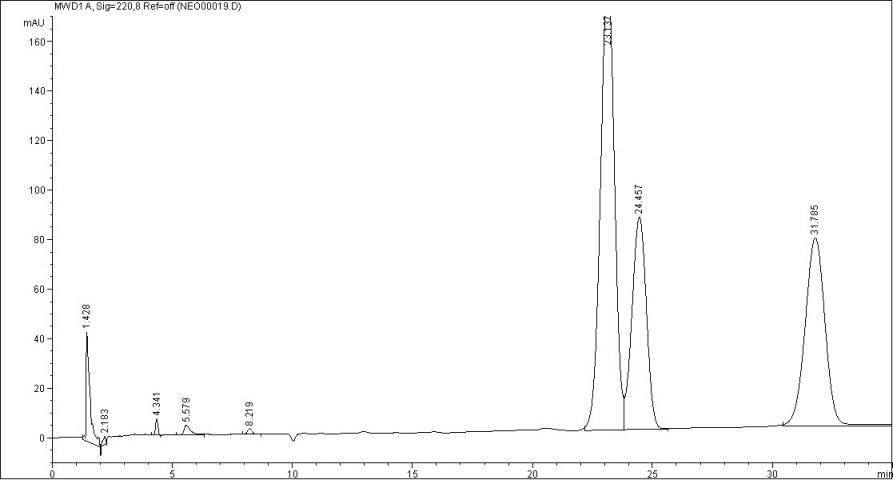
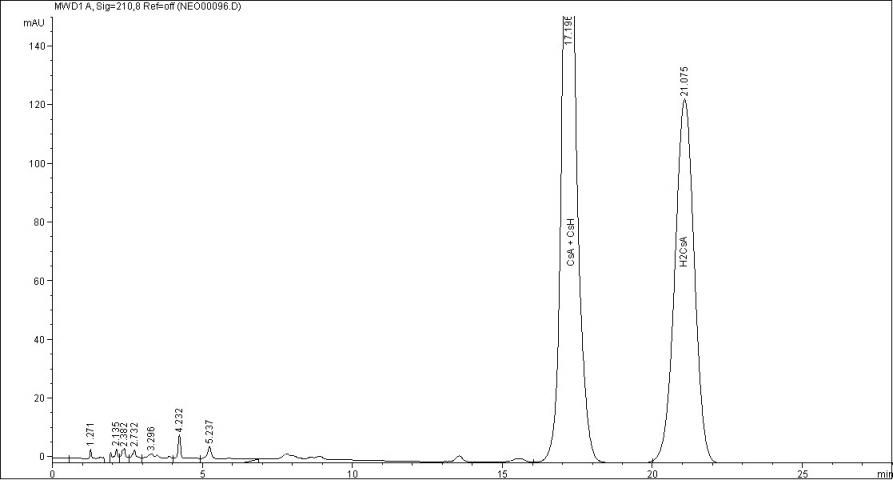
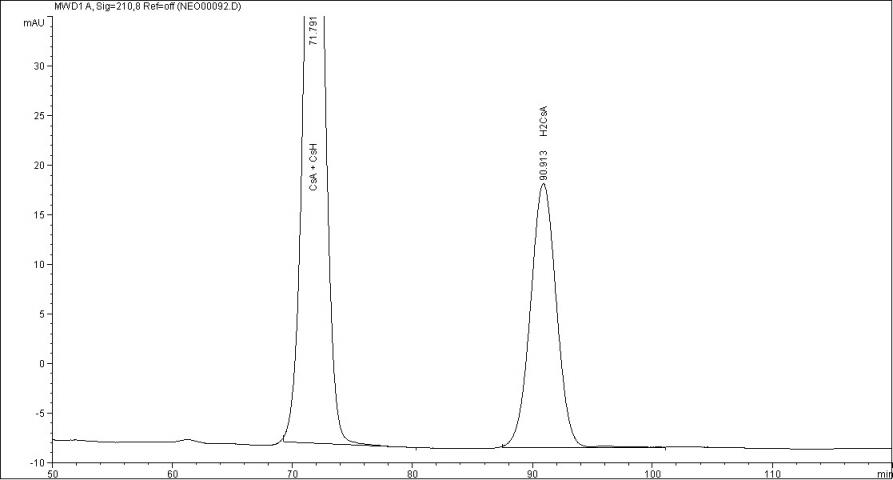
Рис. 1. Хроматограмма смеси стандартов
циклоспорина А, циклоспорина Н и дигидро-
циклоспорина А в условиях:
а. ПФ вода/ацетонитрил/метанол/
ортофосфорная кислота 400:550:50:0,5,
скорость подвижной фазы 1 мл/мин.
б. ПФ вода/ацетонитрил/ третбутилмети- ловый эфир/ортофосфорная кислота
520:430:50:1, скорость 1,2 мл/мин.
в. ПФ тетрагидрофуран/ортофосфорная ки-
слота 0,05М 45:55, скорость 1 мл/мин.
Как следует из рис.1, использование первых двух методик не обеспечивало разделение пиков циклоспорина А и циклоспорина Н, в условиях третьей методики разрешение было недостаточным, кроме того время удерживания циклоспорина А по методикам зарубежных фармакопей слишком велико, что неприемлемо для рутинного использования в хроматографическом анализе лекарственных форм циклоспорина А.
Нами были оптимизированы условия разделения циклоспорина А и посторонних примесей на основе методики определения циклоспорина А в субстанции по монографиям Американской и Европейской фармакопей. В результате предложены следующие условия хроматографирования: подвижная фаза вода/ ацетонитрил / трет-бутилметиловый эфир/ ортофосфорная кислота 85% в соотношении 500:450:150:1,3; скорость потока 1,5 мл/мин; температура колонки 800 С; объём пробы 20 мкл; изократический градиент; УФ-детекция при 210 нм. В данных условиях время удерживания пика циклоспорина А на хроматограмме стандартного раствора (1) составляет 18,34+0,05 мин (n=6) (рис.2). Разработанная методика соответствовала требованиям пригодности хроматографической системы, регламентируемым USP27 (табл. 2), обладала достаточной чувствительностью (рис.3) а также обеспечивала удовлетворительное разделение примесей и продуктов деградации циклоспорина А (рис.4).
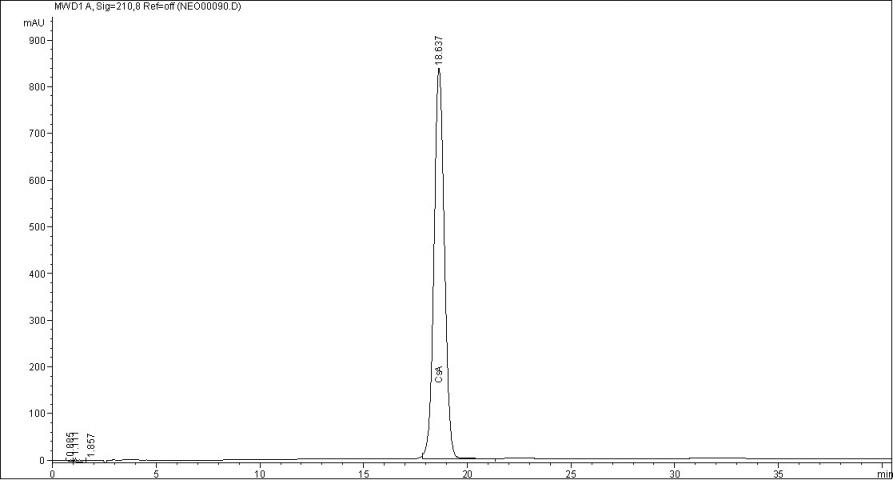
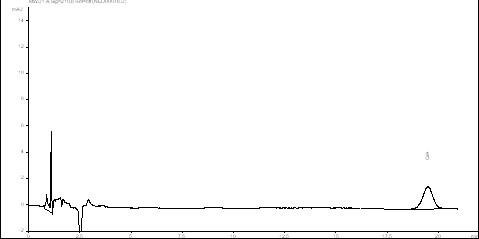
Рис.2. Хроматограмма стандартного рас- Рис.3 Хроматограмма стандартного раство-
твора циклоспорина А ра циклоспорина А (0,0002 мг/мл)
Рис. 4. Хроматограмма смеси стандартов примесей и продуктов деградации циклоспорина А
Табл. 2. Параметры пригодности хроматографической системы для циклоспорина А
| Параметры пригодности хроматографической системы | USP27, монография на капсулы циклоспорина А | Разработанная методика |
| Эффективность колонки (N) Воспроизводимость (RSD%,n=6) Фактор симметрии пика стандартного раствора циклоспорина А Разрешение между пиком циклоспорина А и циклоспорина Н | не менее 700 < 1 % < 1,5 -------- | 6950 0,54% 0,93 2,43 |
Таким образом, в результате подбора оптимальных условий хроматографирования была разработана методика ВЭЖХ-определения циклоспорина А и родственных соединений, позволяющая количественно определить лекарственное вещество и примеси в капсулах.
2. Сравнительная оценка капсулированных препаратов циклоспорина А по показателю «Посторонние примеси».
Монографии на пероральные ЛФ циклоспорина А не регламентируют содержание посторонних примесей. Однако оценка их по данному показателю представляется крайне важной, поскольку позволяет судить о качестве и уровне технологии производства препарата. Для проведения эксперимента использованы мягкие желатиновые капсулы циклоспорина А Сандиммун Неорал 50 мг, Циклоспорин Гексал 50 мг, Экорал 50 мг и Циклопрен 50 мг. Определение содержания циклоспорина А и посторонних примесей в лекарственных формах проводили методом ВЭЖХ в условиях разработанной методики.
Приготовление раствора образца: вскрывали 5 капсул исследуемого препарата с помощью скальпеля, количественно переносили их содержимое растворителем в мерную колбу вместимостью 250 мл и доводили объём до метки растворителем. Перемешивали содержимое колбы в течение 10 мин на магнитной мешалке и фильтровали с использованием мембранного фильтра «Капрон», «БиоХимМак», с размером пор 0,2 мкм.
Идентификацию примесей проводили по временам удерживания с использованием смеси стандартов примесей и продуктов деградации циклоспорина А. Количественное содержание примесей вычисляли относительно площади пика циклоспорина А на хроматограмме стандартного раствора 0,01 мг/мл.
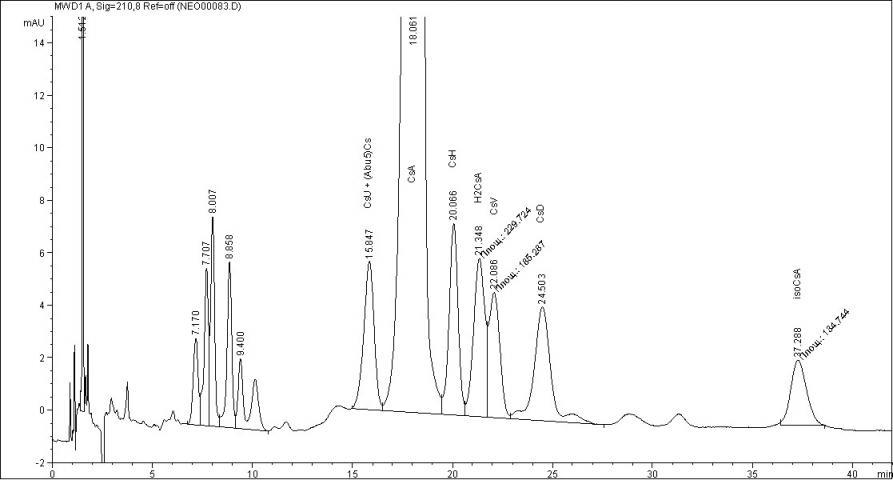
Содержание действующего вещества – циклоспорина А – в исследуемых препаратах находилось в пределах регламентируемых норм (90% - 110%) и составило для Сандиммуна Неорала 96,03+0,29%, для Экорала 94,17+0,19%, для Циклоспорина Гексал 95,16+0,16%, для Циклопрена 95,65+0,18%. В то же время, хроматографическая картина была различна как в отношении числа посторонних примесей, так и их количества. Содержание циклоспорина Н в Экорале составило 0,06+0,002%, 0,11+0,02% в Циклопрене, в двух других препаратах обнаружены только следовые количества этой примеси. Дигидроциклоспорин А и циклоспорин V присутствуют во всех препаратах в количестве от 0,23+0,02% (Циклопрен) до 0,39+0,03% (Сандиммун Неорал). Циклоспорин D обнаружен в Циклоспорине Гексал в количестве 0,23+0,02% и в Циклопрене в количестве 0,40+0,02%, в других препаратах данная примесь найдена в следовых количествах. Во всех препаратах, кроме Циклопрена, обнаружено присутствие изоциклоспорина А, содержание которого варьирует от 0,11+0,02% (Циклоспорин Гексал) до 0,40+0,03% (Сандиммун Неорал). Суммарное содержание неидентифицированных примесей в исследуемых препаратах составляет от 0,81+0,12% (Циклоспорин Гексал) до 1,76+0,22% (Экорал). На рисунках 5 - 8 представлены хроматограммы исследуемых препаратов.
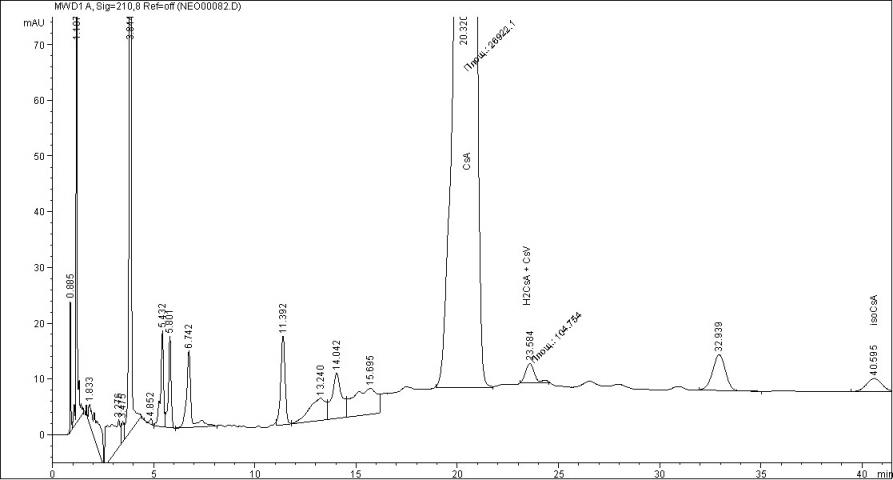
Рис.5 Хроматограмма препарата Сандиммун Неорал
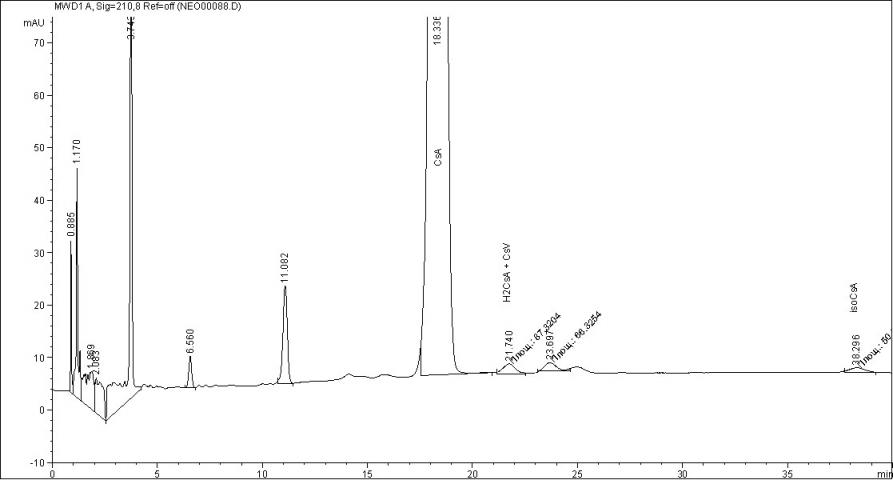
Рис.6 Хроматограмма препарата Циклоспорин Гексал
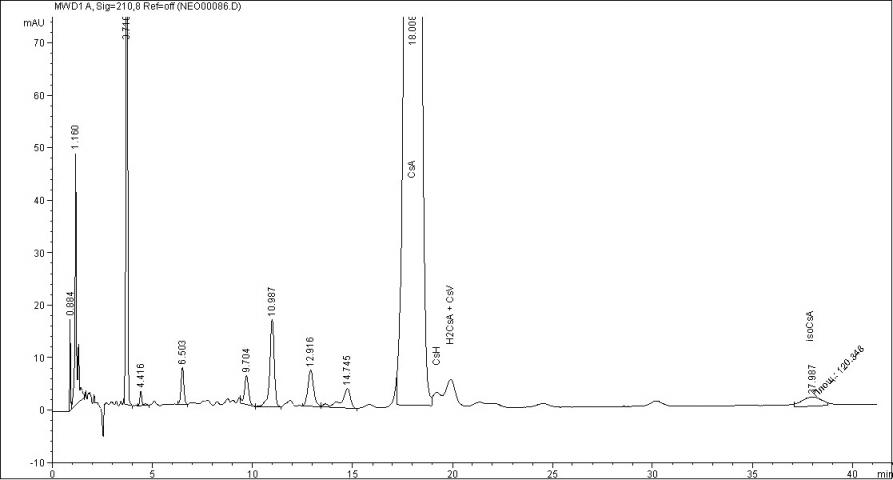
Рис.7 Хроматограмма препарата Экорал
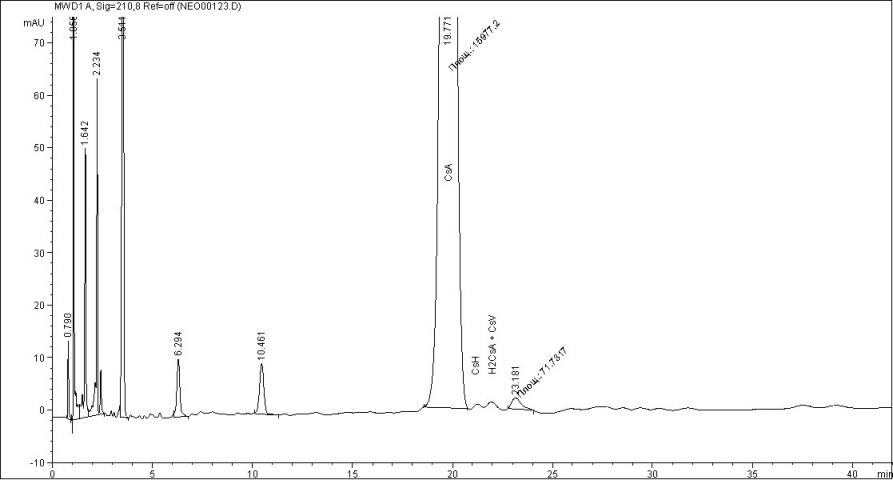
Рис.8 Хроматограмма препарата Циклопрен
Таким образом, предложенная методика ВЭЖХ позволяет селективно определять циклоспорин А и родственные соединения в мягких желатиновых капсулах. В результате проведённого исследования выявлена различная хроматографическая картина исследуемых препаратов в отношении числа посторонних примесей и их количества.
3. Изучение высвобождения циклоспорина А in vitro из капсулированных лекарственных форм.
Исследование растворения in vitro остаются ключевыми при определении фармацевтической эквивалентности воспроизведённых лекарственных средств.
Для проведения эксперимента использованы мягкие желатиновые капсулы циклоспорина А Сандиммун Неорал 25 мг, Циклоспорин Гексал 25 мг, Экорал 25 мг и Циклопрен 25 мг. Изучение высвобождения циклоспорина А из анализируемых объектов проводилось в условиях теста «Растворение». Результаты представлены в таблице 3.
Табл.3 Высвобождение циклоспорина А из мягких желатиновых капсул разных производителей
| Время, мин. | Показатель растворения, %, n=6 (M+m) | ||||
| Сандиммун Неорал | Экорал | Циклоспорин Гексал | Циклопрен | ||
| 0 | 0 | 0 | 0 | 0 | |
| 10 | 10,42 + 0,41 | 15,91 + 2,88 | 34,39 + 0,45 | 10,02 + 1,24 | |
| 20 | 54,40 + 2,28 | 47,73 + 4,92 | 76,19 + 1,81 | 34,19 + 3,54 | |
| 30 | 86,48 + 2,32 | 59,29 + 4,18 | 88,55 + 0,35 | 43,53 + 5,58 | |
| 40 | 89,73 + 1,80 | 72,29 + 1,40 | 89,29 + 0,69 | 52,71 + 2,86 | |
| 50 | 90,21 + 1,89 | 81,21 + 0,75 | 90,47 + 0,41 | 60,06 + 1,67 | |
| 60 | 90,76 + 1,91 | 86,07 + 0,85 | 91,77 + 0,42 | 69,98 + 4,97 | |
На рисунке 9 представлены усреднённые профили высвобождения. Как следует из рисунка, высвобождение циклоспорина А из Сандиммуна Неорала и Циклоспорина Гексал на участке 10 мин – 30 мин происходит пропорционально, причём, высвобождение из Циклоспорина Гексал в каждой точке этого временного отрезка примерно на 20% выше, а к 30 минуте высвобождение из обоих препаратов становится равным и выходит на плато.
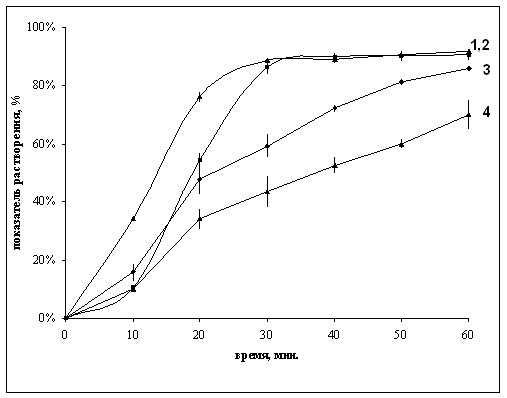
Рис.9 Профили высвобождения циклоспорина А из мягких желатиновых капсул четырёх производителей
Цифровые обозначения кривых (профилей растворения) на рис.1: 1 – Циклоспорин Гексал (Гексал), 2 – Сандиммун Неорал (Новартис), 3 – Экорал (Айвэкс), 4 – Циклопрен (Верофарм).
На протяжении всего времени наблюдения высвобождение циклоспорина А из Экорала и Сандиммуна Неорала было различно, однако к 60 минуте величина растворения достигала близких значений: 86,07 + 0,85% и 90,76 + 1,91% соответственно.
Высвобождение Циклоспорина А из Циклопрена происходит значительно медленнее, более равномерно (прирост высвобождения за каждые 10 минут на участке 20 мин – 60 мин составляет примерно 9%), однако конечный уровень высвобождения за 60 минут остаётся ниже уровня высвобождения из оригинального препарата на 21% и составляет 69,98 + 4,97%.
Сопоставимость полученных профилей высвобождения оценивалась с помощью коэффициентов различия и подобия, методика определения которых была одобрена Center for Drug Evaluation and Research (FDA) в качестве критериев оценки подобия профилей растворения in vitro. Коэффициент различия f1 отражает процент ошибки между двумя кривыми по всем точкам времени и рассчитывается по формуле (1):
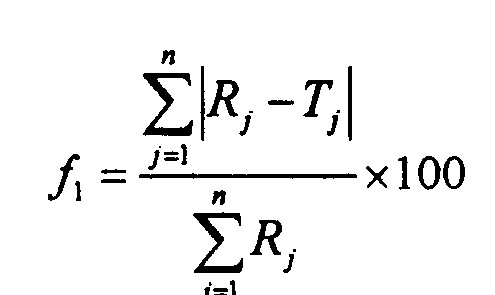
(1) где n – число точек времени; Rj и Tj – процентное содержание ЛВ, высвободившегося в среду растворения, в каждый момент времени j.
Коэффициент различия равен нулю, если профили испытуемого и стандартного ЛС идентичны. По мере увеличения несходства между двумя профилями высвобождения значение коэффициента различия возрастает.
Коэффициент подобия (f2) – это величина, представляющая собой логарифмическое преобразование значения суммы квадратов ошибок, рассчитанных по разности между испытуемым Tj и стандартным Rj продуктом во всех точках времени. Коэффициент подобия рассчитывается по формуле (2):
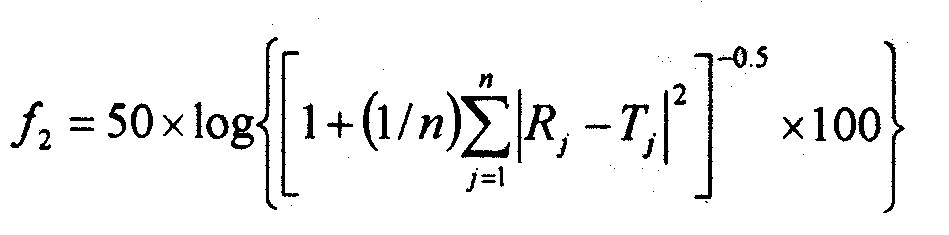
(2), где n – число точек времени; Rj и Tj – процентное содержание ЛВ, высвободившееся в среду растворения, в каждый момент времени j.
Значение коэффициента подобия находится в интервале от 0 до 100. По мере увеличения несходства кривых профилей высвобождения значение коэффициента подобия приближается к 0.
Профили растворения принято считать подобными, если значение f1 находится в пределах от 0 до 15, а значение f2 – в пределах от 50 до 100.
Результаты сравнения профилей высвобождения циклоспорина А из МЖК трёх производителей с профилем высвобождения оригинального препарата Сандиммун Неорал по указанной выше методике представлены в таблице 4.
Табл.4. Коэффициенты различия и подобия профилей высвобождения мягких желатиновых капсул циклоспорина А
| Препарат | Значение коэффициентов | Подобие | |
| f1 | f2 | ||
| Циклоспорин Гексал | 12,51 | 43,82 | нет |
| Экорал | 17,79 | 42,22 | нет |
| Циклопрен | 38,23 | 27,04 | нет |
Представленные в таблице данные подтверждают различный характер высвобождения циклоспорина А из МЖК разных производителей при достижении сопоставимых показателей растворения за 60 минут.
4. Определение размера частиц содержимого капсулированных препаратов циклоспорина А
Различие профилей растворения капсулированных препаратов циклоспорина А может быть объяснено различным компонентным составом содержимого капсул, а также размером частиц. Принимая во внимание, что содержимое капсул представляет собой дисперсную систему, полученную различными технологическими приёмами и с использованием разных вспомогательных веществ, для нас представляло интерес изучить размер частиц исследуемых объектов. Кроме того, размер образующихся в водной среде частиц является одной из основных характеристик, влияющих на биодоступность пероральных ЛФ циклоспорина.
С целью изучения содержимого капсул циклоспорина А было проведено определение диаметра и характера распределения частиц исследуемых препаратов по размерам. Результаты исследования представлены в таблице 5.
Табл.5. Распределение по размерам частиц, образующихся из мягких желатиновых капсул циклоспорина А
| Название препарата | Содержание частиц в % | Размер частиц, нм |
| Сандиммун Неорал | 100% | 22,1 |
| Циклопрен | 100% | 29,1 |
| Циклоспорин Гексал | 70,7% | 255,7 |
| 29,3% | 34,2 | |
| Экорал | 47,5% | 1683,4 |
| 38,7% | 213,7 | |
| 13,9% | 44,6 |
Как следует из приведённых данных, самую тонкую и однородную эмульсию образуют препараты Сандиммун Неорал и Циклопрен с размером частиц 22,1 нм и 29,1 нм, соответственно. Эмульсия, образованная Циклоспорином Гексал, представлена частицами двух размеров: 70,7% частиц – 255,7 нм и 29,3% - 34,2 нм. Самую крупную и неоднородную дисперсию образует Экорал: 47,5% частиц имеют диаметр 1,68 мкм, 38,7% - 213,7 нм и 13,9% - 44,6 нм. Такие различия в строении исследуемых препаратов обусловлены уникальным составом вспомогательных веществ каждой лекарственной формы циклоспорина А и, очевидно, технологией получения сложной системы содержимого капсул.
5. Изучение стабильности капсулированных препаратов циклоспорина А.
С целью получения наиболее полного представления о стабильности капсулированных препаратов циклоспорина А, нами была проведена оценка изменения показателей «Содержание действующего вещества», «Посторонние примеси» и «Растворение» у препаратов с разными сроками годности.
Для проведения эксперимента были использованы препараты с истёкшим сроком годности и такие, срок годности которых ограничен 2006 годом. Результаты определения содержания циклоспорина А и посторонних примесей в исследуемых препаратах представлены в таблице 6.
Табл. 6. Определение содержания циклоспорина А и посторонних примесей в мягких желатиновых капсулах разных производителей
| Содержание циклоспорина А (% от заявленного количества) и примесей (n=5) | ||||||
| Числовые показатели | САНДИММУН НЕОРАЛ | ЭКОРАЛ | ЦИКЛОСПОРИН ГЕКСАЛ | |||
| До 2004 г | До 2006 г | До 2004 г | До 2006 г | До 2004 г | До 2006 г | |
| Циклоспорин А | 91,53+ 0,25 | 96,03+ 0,29 | 88,27+ 0,32 | 94,17+ 0,19 | 90,39+ 0,38 | 95,16+ 0,16 |
| ПРИМЕСИ | ||||||
| Циклоспорин Н | 0,40 + 0,04 | следовые количества | 0,19+ 0,01 | 0,06+ 0,002 | следовые количества | следовые количества |
| Сумма дигидро-циклоспорина А и циклоспорина V | 0,96+ 0,04 | 0,39+ 0,03 | 0,91+ 0,01 | 0,26+ 0,02 | 0,38+ 0,02 | 0,29+ 0,02 |
| Циклоспорин D | следовые количества | следовые количества | следовые количества | следовые количества | 0,35+ 0,03 | 0,23+ 0,02 |
| Изоциклоспорин А | 0,75+ 0,05 | 0,40+ 0,03 | 0,56+ 0,03 | 0,32+ 0,02 | 0,28+ 0,03 | 0,11+ 0,02 |
| Неидентифи- цированные примеси (сумма) | 3,55+ 0,46 | 0,81+ 0,12 | 5,63+ 0,34 | 1,76+ 0,22 | 4,39+ 0,51 | 0,92+ 0,17 |
При исследовании образцов с истёкшим сроком годности (до 2004 г.) отмечено снижение уровня действующего вещества - циклоспорина А – в среднем на 5,06% при возрастании содержания примесных соединений, как индивидуальных идентифицированных, так и суммарного содержания неидентифицированных примесей.
Таким образом, снижение содержания действующего вещества в препаратах с истёкшим сроком годности и соответствующее увеличение уровня примесей в образцах с истёкшим сроком годности позволяет предположить образование родственных соединений из циклоспорина А в процессе хранения.
Для получения наиболее полной картины изменения качества препаратов циклоспорина А в процессе хранения представлялось целесообразным, наряду с испытаниями «Содержание действующего вещества» и «Посторонние примеси», изучить его высвобождение из исследуемых образцов. Результаты проведённой работы представлены в таблице 7.
Табл.7. Высвобождение циклоспорина А из мягких желатиновых капсул разных производителей
| Время, мин. | Значение показателя растворения, % (n=6) | |||||
| Сандиммун Неорал | Экорал | Циклоспорин Гексал | ||||
| Срок годности до 2004 г. | Срок годности до 2006 г. | Срок годности до 2004 г. | Срок годности до 2006 г. | Срок годности до 2004 г. | Срок годности до 2006 г. | |
| 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 10 | 0 | 10,42 + 0,41 | 57,05+5,58 | 15,91 + 1,88 | 4,37+0,44 | 34,39 + 0,45 |
| 20 | 8,87+1,38 | 54,40 + 2,28 | 62,18+2,86 | 47,73 + 3,92 | 18,86+2,10 | 76,19 + 1,81 |
| 30 | 29,76+1,39 | 86,48 + 2,32 | 63,18+3,09 | 59,29 + 4,18 | 59,66+4,25 | 88,55 + 0,35 |
| 40 | 53,52+5,40 | 89,73 + 1,80 | 65,36+1,94 | 72,29 + 1,40 | 84,69+1,35 | 89,29 + 0,69 |
| 50 | 65,27+3,37 | 90,21 + 1,89 | 67,27+1,34 | 81,21 + 0,75 | 86,98+0,76 | 90,47 + 0,41 |
| 60 | 73,46+1,53 | 90,76 + 1,91 | 68,33+1,18 | 86,07 + 0,85 | 87,99+0,58 | 91,77 + 0,42 |
На основании данных результатов были получены профили растворения. На рисунках 10 – 12 представлены профили растворения циклоспорина А в исследуемых препаратах.
Установлено, что по истечении срока годности снижается показатель «Растворение» и изменяется профиль высвобождения циклоспорина А из капсулированных лекарственных форм.
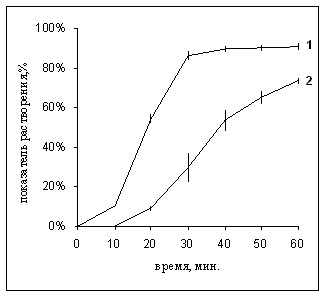
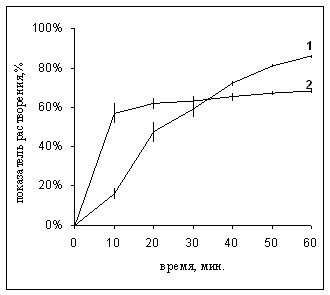
Рис. 10. Профили растворения циклоспорина А Рис. 11. Профили растворения циклоспорина
в препарате Сандиммун Неорал сроком А в препарате Экорал сроком годности до
годности до 2006 г. (1) и до 2004 г. (2) 2006 г. (1) и до 2004 г. (2)
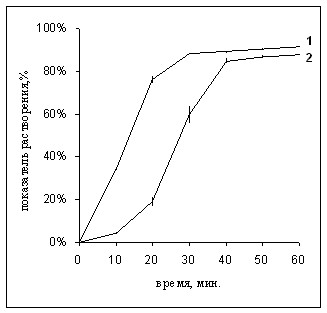
Рис.12. Профили растворения циклоспорина А в
препарате циклоспорин Гексал сроком годности
до 2006 г. (1) и до 2004 г. (2)
Таким образом, в результате исследования капсулированных препаратов циклоспорина А с разными сроками годности было установлено изменение их качества по показателям «Содержание действующего вещества» и «Посторонние примеси». Показано, что по истечении срока годности наблюдается уменьшение содержания циклоспорина А в среднем на 5,06%. При этом содержание примесей возрастает как суммарно, так и в отношении индивидуальных родственных соединений: циклоспорина Н, дигидроциклоспорина А, циклоспорина V, циклоспорина D и изоциклоспорина А.
Установлено, что по истечении срока годности снижается показатель «Растворение» и изменяется профиль высвобождения циклоспорина А из капсулированных лекарственных форм.
6. Оценка эффективности терапевтического лекарственного мониторинга циклоспорина А по точке С2 у пациентов после аллогенной трансплантации почки.
Терапевтический лекарственный мониторинг (ТЛМ) является неотъемлемой частью иммуносупрессивной терапии циклоспорином А и обеспечивает её успешное проведение с максимальной эффективностью и минимальной токсичностью. В настоящее время в качестве параметра для терапевтического лекарственного мониторинга циклоспорина рекомендуется использование точки С2 (концентрация циклоспорина в крови через 2 часа после перорального приёма). Целью исследования явилась оценка эффективности ТЛМ циклоспорина А по точке С2 у пациентов после аллогенной трансплантации почки.
Исследование проводилось на базе Московского городского центра трансплантации почки ГКБ №7 с июля 2003 года по февраль 2004 года. Проведено наблюдение за 23 реципиентами почечного трансплантата. Период наблюдения составил 50+3 суток после операции. Все пациенты получали трёхкомпонентную иммуносупрессию:
Сандиммун Неорал в дозе 8 – 10 мг/кг/сут, Селлсепт 2000 мг/сут и преднизолон 0,5 мг/кг/сут. Концентрацию циклоспорина А в цельной крови определяли через 12
часов (С0) и через 2 часа (С2) после приёма Сандиммуна Неорала 2 раза в
неделю методом флуоресцентно-поляризационного иммунного анализа.
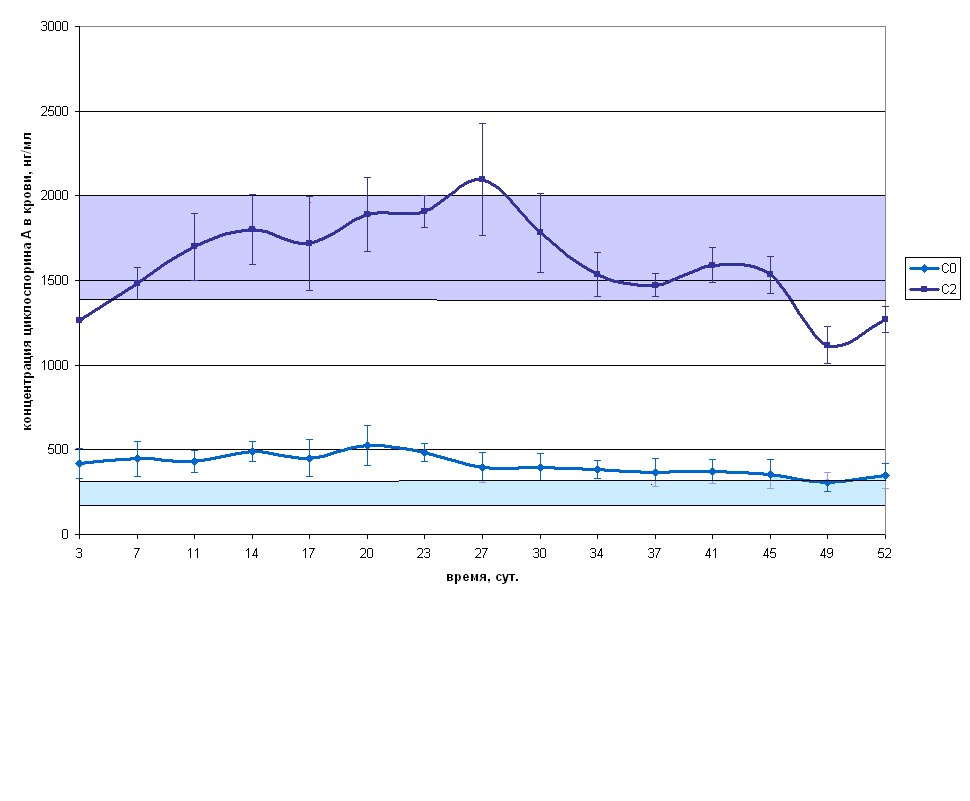
Согласно рекомендациям по проведению С2 мониторинга Сандиммуна Неорала, целевые концентрации циклоспорина А в точке С2 для пациентов после трансплантации почек составляют 1400 – 2000 нг/мл (терапевтический диапазон для концентраций С2). В соответствии с этим все реципиенты, включённые в исследование, по уровню концентрации циклоспорина А были ретроспективно распределены на 3 группы. Первую группу составили 6 пациентов, которые достигали рекомендуемого диапазона концентраций А в крови в точке С2 в первые 7 суток после трансплантации (табл.8, рис.13).
Табл.8. Динамика фармакокинетических показателей в первой группе пациентов (n=6)
| Сутки после трансплантации | Доза CsA, мг /сут | Концентрация CsA в точке С0,нг/мл | Концентрация CsA в точке С2, нг/мл |
| 3 7 11 14 17 20 23 27 30 34 37 41 45 49 52 | 733,3+115,5 733,3+115,5 733,3+115,5 713,3+150,1 700,0+123,2 700,0+123,2 700,0+123,2 633,3+115,5 600,0+146,2 567,7+122,8 567,7+122,8 525,0+116,7 525,0+116,7 475,0+147,5 450,0+112,1 | 418,81+90,51 447,65+103,37 433,23+65,18 490,64+60,65 449,74+108,37 523,89+117,09 485,10+52,92 395,26+89,87 398,21+78,51 383,57+53,88 366,95+82,89 373,55+69,47 356,77+83,29 308,68+56,73 346,28+75,51 | 1261,88+190,54 1482,02+94,96 1698,21+198,21 1800,34+206,95 1720,36+278,29 1890,32+217,65 1907,39+93,81 2097,93+331,46 1782,97+233,22 1535,77+128,21 1471,05+67,82 1590,72+105,44 1533,59+109,91 1118,81+109,91 1270,57+78,76 |
Необходимо отметить, что уровню циклоспорина А в точке С2 выше 1400 нг/мл соответствовали концентрации циклоспорина в точке С0, значительно превышающие обычно рекомендуемый для этого показателя диапазон 200 – 300 нг/мл.
Вторую группу составили 7 пациентов, которые достигали рекомендуемого диапазона концентраций циклоспорина А в точке С2 на 8 – 12 сутки после операции (табл.9, рис.14).
Табл. 9. Динамика фармакокинетических показателей во второй группе пациентов (n=7).
| Сутки после трансплантации | Доза CsA, мг/ сут | Концентрация CsA в точке С0,нг/мл | Концентрация CsA в точке С2, нг/мл |
| 3 7 11 14 17 20 23 27 30 34 37 41 45 49 52 | 667,7+115,5 667,7+115,5 667,7+115,5 633,37+138,2 633,37+138,2 700,0+25,9 680,0+28,3 610,0+70,7 630,0+42,4 630,0+42,4 600,0+28,5 540,0+28,3 530,0 +42,4 530,0+42,4 530,0+42,4 | 344,54+52,1 270,01+44,07 438,39+67,79 440,74+89,46 393,85+75,25 453,22+68,54 398,56+99,35 260,76+69,83 319,60+57,31 382,69+73,85 339,71+86,21 249,69+25,19 296,55+55,09 390,34+73,91 320,79+36,42 | 1054,79+291,07 1098,74+247,91 1493,36+135,53 1930,27+336,08 1760,31+149,14 1870,13+168,91 1838,16+394,65 1541,39+125,03 1563,57+239,4 1592,83+229,2 1692,81+124,21 1630,59+285,2 1655,12+250,2 1463,55+38,1 1546,55+34,9 |
Наконец, в третью группу вошли 10 пациентов, концентрация циклоспорина А в крови у которых к 8 – 12 суткам была менее 1400 нг/мл (табл. 10, рис.15).
Табл. 10. Динамика фармакокинетических показателей в третьей группе пациентов (n=10)
| Сутки после трансплантации | Доза CsA, мг/ сут | Концентрация CsA в точке С0,нг/мл | Концентрация CsA в точке С2, нг/мл |
| 3 7 11 14 17 20 23 27 30 34 37 41 45 49 52 | 755,5+88,2 766,7+86,6 772,2+75,4 800,0+86,6 800,0+75,5 757,5+135,8 715,0+127,4 651,2+119,4 573,7+140,5 542,5+125,9 512,5+120,9 501,2+117,9 528,7+110,7 500,8+129,1 487,5+113,1 | 165,97+40,25 264,67+80,21 267,52+76,78 419,43+62,84 348,27+66,18 586,07+119,64 451,48+81,71 567,84+76,14 448,08+94,17 374,29+60,87 493,33+106,73 376,94+50,32 336,01+61,02 358,23+85,52 309,31+29,57 | 810,82+207,81 1064,22+191,84 899,85+204,75 1087,40+286,12 1439,97+286,64 1745,72+367,31 1654,26+262,09 1934,15+307,77 1749,13+294,21 1510,79+251,94 1586,48+365,90 1554,75+362,97 1445,64+258,43 1542,33+166,84 1453,11+272,51 |
Следует отметить тот факт, что несмотря на превышение концентрации циклоспорина А в точке С0 рекомендуемого диапазона 200-300 нг/мл, у пациентов третьей группы концентрация циклоспорина А в точке С2 в течение первых двух недель после операции оставалась значительно ниже диапазона 1400-2000 нг/мл, то есть наблюдалось сниженное всасывание препарата, что подтверждают литературные данные о существовании
популяции c нарушенной абсорбцией циклоспорина.
Рис. 13. Динамика концентраций циклоспорина А С2 и С0 в первой группе пациентов, ![]() - рекоменду-
- рекоменду-
емый диапазон для С2,
![]() - рекомендуемый диапа-
- рекомендуемый диапа-
зон для С0.
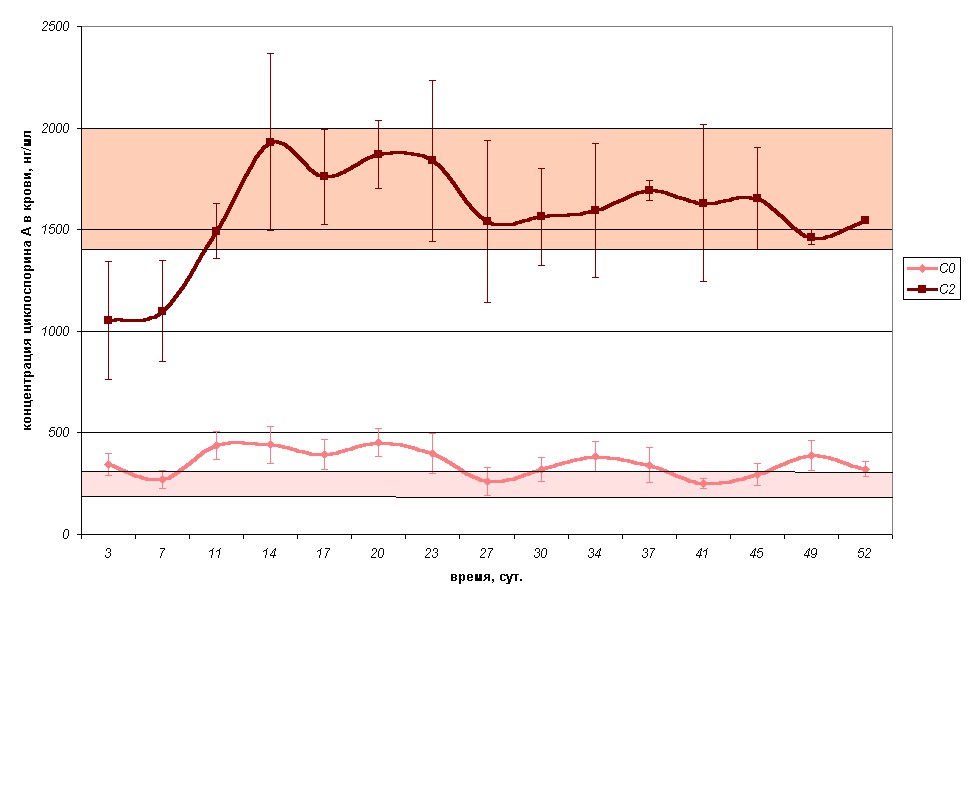
Рис. 14. Динамика концентраций циклоспорина А С2 и С0 во второй группе пациентов, ![]() - рекоменду-
- рекоменду-
емый диапазон для С2,
![]() - рекомендуемый диапа-
- рекомендуемый диапа-
зон для С0
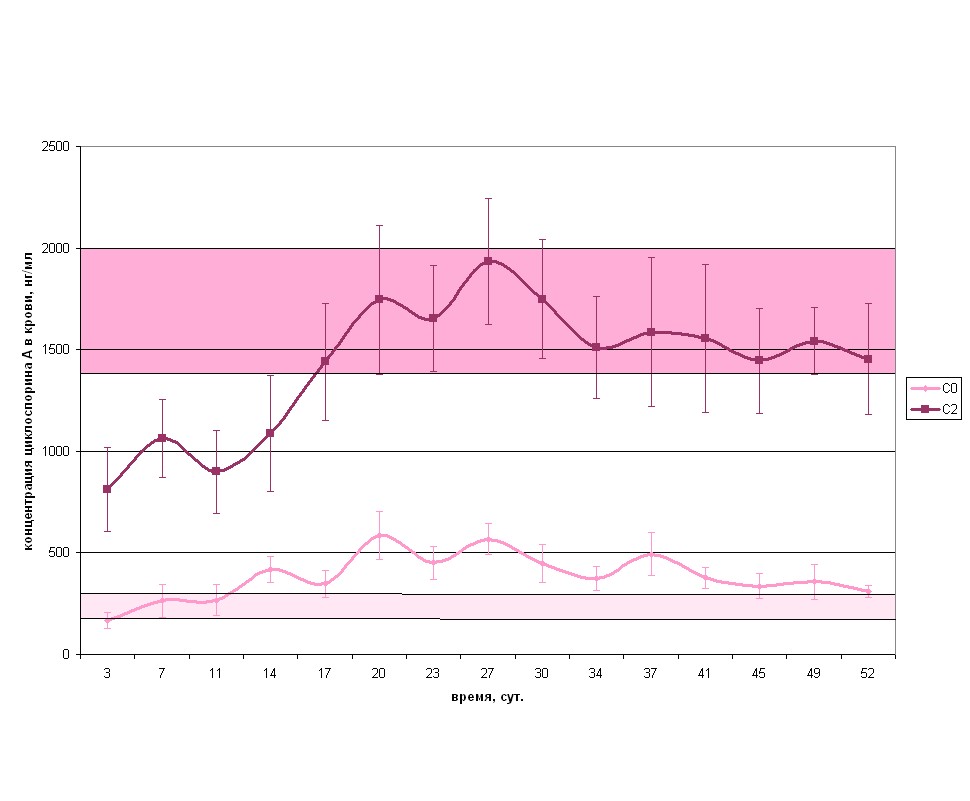
Рис. 15. Динамика концентраций циклоспорина А С2 и С0 в третьей группе пациентов, ![]() - рекоменду-
- рекоменду-
емый диапазон для С2,
![]() - рекомендуемый диапа-
- рекомендуемый диапа-
зон для С0.
Фармакокинетические особенности каждой группы пациентов нашли следующее отражение в клинических проявлениях. У пациентов первых двух групп кризы отторжения не были отмечены. В третьей группе у 4 больных возникли острые кризы отторжения, подтверждённые морфологическими исследованиями. То есть, частота острых кризов отторжения среди исследуемых реципиентов почечного трансплантата составила 17% (n=23), а в третьей группе пациентов с недостаточным уровнем С2 циклоспорина А в крови - 40% (n=10).
Таким образом, нами продемонстрирована эффективность использования точки С2 для мониторирования терапии с целью обеспечения адекватной иммуносупрессии и снижения токсичности циклоспорина А. Выявлена зависимость между ранним (в течение 7 суток после трансплантации) достижением уровня циклоспорина А в крови на второй час после приёма в пределах 1400 – 2000 нг/мл и снижением частоты острого отторжения трансплантата.
ВЫВОДЫ
- Проведены информационно-аналитические исследования по проблеме стандартизации препаратов циклоспорина А и их определению в биологических жидкостях при проведении терапевтического лекарственного мониторинга для обоснования выбора методов определения циклоспорина А в лекарственных формах и биологических жидкостях.
- Разработана методика ВЭЖХ-определения циклоспорина А и родственных соединений в капсулированных препаратах.
- Методом ВЭЖХ проведено определение циклоспорина А и родственных соединений в мягких желатиновых капсулах четырёх производителей. Выявлена различная хроматографическая картина исследуемых препаратов циклоспорина А в отношении числа посторонних примесей и их количества.
- В условиях теста «Растворение» изучено высвобождение циклоспорина А из мягких желатиновых капсул четырёх производителей и получены профили растворения относительно препарата сравнения «Сандиммун Неорал, мягкие желатиновые капсулы 25 мг».
- На основании экспериментальных результатов рассчитаны коэффициенты подобия и различия для выбранных объектов, которые свидетельствуют о различии высвобождения действующего вещества из препаратов разных производителей при достижении сопоставимых значений показателей растворения в конечной точке исследования.
- Установлено изменение во времени качества мягких желатиновых капсул циклоспорина А по показателям «Содержание действующего вещества», «Посторонние примеси» и «Растворение». Показано, что по истечении срока годности наблюдается уменьшение содержания циклоспорина А в среднем на 5,06%. При этом содержание примесей возрастает как суммарно, так и в отношении индивидуальных родственных соединений: циклоспорина Н, дигидроциклоспорина А, циклоспорина V, циклоспорина D и изоциклоспорина А. Установлено, что по истечении срока годности снижается показатель «Растворение» и изменяется профиль высвобождения циклоспорина А из капсулированных лекарственных форм.
- Проведено определение диаметра и характера распределения частиц по размерам в мягких желатиновых капсулах циклоспорина А четырёх производителей. Выявлено различное строение эмульсий, образуемых препаратами циклоспорина А разных производителей в водной среде.
- Продемонстрирована эффективность использования точки С2 (концентрации циклоспорина А в крови через два часа после перорального приёма препарата) для мониторирования терапии с целью обеспечения адекватной иммуносупрессии и снижения токсичности циклоспорина А. Выявлена зависимость между ранним (в течение 7 суток после трансплантации) достижением уровня циклоспорина А в крови на второй час после приёма в пределах 1400 – 2000 нг/мл и снижением частоты острого отторжения трансплантата.
Список работ, опубликованных по теме диссертации
- Арзамасцев А.П., Багирова В.Л., Нечаева Е.Б., Ледовских М.В. Изучение высвобождения циклоспорина А in vitro из капсулированных лекарственных форм // Химико-фармацевтический журнал. – 2006. – Том 40. - №2. – С.40 – 43.
- Арзамасцев А.П., Садчикова Н.П., Ледовских М.В. и др. Изучение стабильности капсулированных лекарственных форм циклоспорина А // Российский биотерапевтический журнал. – 2006. – Том. 5. - №1. – С.80 – 85.
- Ледовских М.В., Садчикова Н.П., Арзамасцев А.П. и др. Изучение профилей растворения циклоспорина А в капсулированных лекарственных формах // Человек и лекарство: Тез. докл. XIII Росс.нац.конгр. – Мос., 2006. – С.788.
- Ледовских М.В., Садчикова Н.П., Арзамасцев А.П. и др. Оценка качества капсулированных лекарственных форм циклоспорина А по показателям «Содержание действующего вещества» и «Посторонние примеси» // Человек и лекарство: Тез. докл. XIII Росс.нац.конгр. – Мос., 2006. – С.788.

