Применение метода вэжх в изучении фармакокинетики домперидона у лиц с различным генотипом
На правах рукописи
ФАЙНШТЕЙН СВЕТЛАНА ЛЕОНИДОВНА
ПРИМЕНЕНИЕ МЕТОДА ВЭЖХ В ИЗУЧЕНИИ ФАРМАКОКИНЕТИКИ ДОМПЕРИДОНА У ЛИЦ С РАЗЛИЧНЫМ ГЕНОТИПОМ
15.00.02 - фармацевтическая химия, фармакогнозия
Автореферат
диссертации на соискание ученой степени
кандидата фармацевтических наук
МОСКВА-2007
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования Московская Медицинская Академия им. И.М. Сеченова Федерального агентства по здравоохранению и социальному развитию
Научный руководитель:
доктор фармацевтических наук,
профессор Раменская Галина Владиславовна
Официальные оппоненты:
доктор фармацевтических наук,
профессор Казьмина Эма Максимовна
кандидат фармацевтических наук Нечаева Екатерина Борисовна
Ведущая организация:
Государственное учреждение Научно-исследовательский институт фармакологии Томского научного центра Сибирского отделения РАМН (ГУ НИИФ ТНЦ СО РАМН)
Защита состоится «__» _________2007 г. В __ часов на заседании диссертационного совета Д.208.040.09 при ГОУ ВПО Московская Медицинская Академия им. И.М.Сеченова по адресу: 119019, г. Москва, Никитский бульвар, 13.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Московская Медицинская Академия им. И.М. Сеченова, по адресу: 117998, г. Москва, Нахимовский проспект, д. 49
Автореферат разослан «____»_____________2007 г.
Ученый секретарь
Диссертационного Совета Д.208.040.09,
Доктор фармацевтических наук,
Профессор Наталья Петровна Садчикова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Домперидон, являясь антидопаминергическим препаратом периферического действия, в настоящее время широко используется в РФ при нарушениях моторики желудочно-кишечного тракта. Являясь производным бензимидазола, молекула домперидона липофильна, обладает большой конформационной вариабельностью и имеет большое сродство к транспортному белку Р-гликопротеину [El Ela A., 2004; А.С. Логинов 1996; А.А. Шептулин, 1996].
P-гликопротеин играет важнейшую роль в фармакокинетике ЛС. Он препятствует проникновению, распределению ЛС и способствует их выведению из клетки. Если активность Р-гликопротеина в тканях снижена, то концентрация ЛС в организме может увеличиться, что приведет к развитию побочных эффектов. Известно, что активность Р-гликопротеина зависит от генетических особенностей, влияя тем самым на фармакокинетику ЛС, в том числе домперидона [El Ela A., 2004; Tsujikawa K, 2003; Faassen F., 2003].
Одним из самых распространенных и перспективных методов для изучения фармакокинетики ЛС является метод высокоэффективной жидкостной хроматографии (ВЭЖХ). Метод ВЭЖХ имеет ряд существенных преимуществ по сравнению с другими: отсутствие ограничений по термоустойчивости и летучести анализируемого препарата, возможность работы с водными растворами, возможность собирать разделённые фракции для их последующей идентификации, анализировать большое количество проб, а также высокая чувствительность, точность, скорость, и экономичность анализа.
Таким образом, исследование применения метода ВЭЖХ в изучение фармакокинетики домперидона у лиц с различным генотипом Р-гликопротеина представляется актуальным.
Цель и задачи исследования
Целью исследования является исследование применения метода высокоэффективной жидкостной хроматографии в изучении фармакокинетики домперидона у лиц с различным генотипом.
Для достижения поставленной цели необходимо было решить следующие задачи:
- Изучить хроматографическое поведение домперидона и обосновать условия его определения в плазме крови методом высокоэффективной жидкостной хроматографии.
- Разработать методику экстракции домперидона из плазмы крови.
- Изучить фармакокинетику домперидона после его однократного перорального приёма.
- Провести генотипирование гена MDR1, кодирующего Р-гликопротеин, методом ПЦР у лиц московской популяции из этнической группы русских.
- Сопоставить результаты фармакокинетического исследования домперидона после его однократного приёма у лиц с различным генотипом гена MDR1.
Научная новизна
Изучены хроматографические свойства домперидона методом ВЭЖХ.
Определены фармакокинетические параметры домперидона в плазме крови после однократного перорального приёма.
Изучено распределение ТТ, СТ и СС генотипов по полимофному маркеру С3435Т гена MDR1, кодирующего Р-гликопротеин, у лиц московской популяции из этнической группы русских.
Впервые проведено сопоставление результатов фенотипирования и генотипирования Р-гликопротеина у лиц московской популяции из этнической группы русских.
Практическая значимость
Разработана оригинальная доступная методика определения домперидона в плазме крови методом ВЭЖХ, характеризующаяся быстротой анализа, чувствительностью, высокой точностью и воспроизводимостью результатов измерений.
Показана необходимость оценки активности Р-гликопротеина у лиц с различным генотипом гена MDR1 путем генотипирования (методом полимеразной цепной реакции) или определения концентрации домперидона в плазме крови (методом высокоэффективной жидкостной хроматографии) при назначении лекарственных средств-субстратов Р-гликопротеина.
Методика количественного определения домперидона методом ВЭЖХ в плазме крови используется при проведении фармакокинетических исследований в Филиале «Клиническая фармакология» НЦ БМТ РАМН.
Апробация работы
Апробация работы проведена на кафедре фармацевтической химии с курсом токсикологической химии ММА имени И.М.Сеченова.
Результаты работы доложены на XIII конгрессе «Человек и лекарство» (Москва, 2006); на Всероссийской конференции Государственного регулирования в сфере обращения лекарственных средств и медицинских изделий– «ФармМедОбращение – 2006» (Москва, 2006); на эллективах кафедры фармацевтической химии с курсом токсикологической химии и кафедры клинической фармакологии и пропедевтики внутренних болезней ММА им. И.М. Сеченова (Москва, 2006).
Публикация результатов исследования
По результатам проведенных исследований опубликовано 3 печатных работ.
Связь исследования с проблемным планом фармацевтических наук
Диссертационная работа выполнена в рамках комплексной темы кафедры фармацевтической химии с курсом токсикологической химии фармацевтического факультета ММА им. И.М.Сеченова «Совершенствование контроля качества лекарственных средств» (№ государственной регистрации 01.200.110545).
Основные положения, выносимые на защиту
- Разработанная методика определения домперидона в плазме крови с помощью метода ВЭЖХ.
- Результаты фармакокинетического исследования домперидона, проведённого на 36-и здоровых испытуемых московской популяции из этнической группы русских после однократного перорального приёма домперидона в дозе 20 мг.
- Результаты определения частоты появления полиморфизма С3435Т гена MDR1, кодирующего выработку Р-гликопротеина у 103 человек московской популяции из этнической группы русских, проведенного методом ПЦР-ПДРФ, и результаты сопоставления с распределением генотипов у группы из 36 индивидуумов, участвующих в фармакокинетическом исследовании домперидона.
- Сопоставление результатов фармакокинетического и фармакогенетического исследований Р-гликопротеина у лиц московской популяции из этнической группы русских.
Объем и структура диссертации
Диссертация изложена на 100 страницах машинописного текста и состоит из введения, обзора литературы, экспериментальной части, выводов, списка литературы, из 124 названий (113 из которых зарубежные) и приложения. Работа иллюстрирована 19 рисунками и 20 таблицами.
СОДЕРЖАНИЕ РАБОТЫ
Оборудование и реактивы
Для анализа домперидона в плазме крови использовали высокоэффективный жидкостной хроматограф фирмы SHIMADZU с насосом модели LC-6A, инжектором Rheodyne с петлёй 50 мкл, c различными хроматографическими колонками (Supelcosil LC-8 150><4,6 мм 5 m, YMC 5 m 250><6 мм, LUNA C18 150><2,1мм 3 m, Zorbax ODS 150><4,6 мм) и флуориметрическим детектором E-530. Регистрацию хроматограмм осуществляли с помощью самописца METROHM (E586 LABOGRAPH). Кроме того, использовали необходимое лабораторное оборудование и материалы. Все реактивы, использованные для анализа были марок: «ХЧ», «ЧДА», «Для ВЭЖХ». Все реактивы были отечественного производства. Для разработки количественного определения домперидона в плазме крови использовали образец субстанции домперидона малеата с содержанием вещества 99,4%.
Для генотипирования полиморфизма С3435Т гена MDR1, кодирующего выработку Р-гликопротеина у индивидуумов московской популяции использовали амплификатор МС2 («ДНК Технология»).
Тактика исследования
Для изучения фармакокинетики домперидона сначала была разработана методика количественного определения домперидона в плазме крови с помощью ВЭЖХ.
Изучение фармакокинетики домперидона у лиц с различным генотипом Р-гликопротеина проводили у 36 человек после однократного перорального приёма домперидона (Мотилиум, «Янссен», Бельгия, таблетки 10 мг) в дозе 20 мг (2 таблетки). Исследование проводили в рамках изучения биоэквивалентности ЛС (протокол утверждён Комиссией по клинической фармакологии, одобрен Комитетом по Этике при Федеральном органе контроля качества, эффективности и безопасности лекарственных средств). В качестве испытуемых привлекались мужчины и женщины, добровольно изъявившие желание участвовать в исследовании, прошедшие клинико-физиологическое обследование и отвечающие критериям включения и исключения. Прием препарата осуществлялся per os в 8 часов утра в дозе 20 мг. Отбор крови осуществлялся из кубитальной вены в количестве 5 мл в стеклянные гепаринизированные пробирки до приема препарата и спустя 0.33, 0.66, 1, 1.5, 2, 3, 4, 6, 10, 12 и 24 часа после приема препарата. Пробы крови центрифугировали 10 минут при 3000 об/мин, плазму крови переносили в чистые пробирки и хранили при -350С до анализа.
Частоту появления полиморфизма С3435Т гена MDR1, кодирующего выработку Р-гликопротеина, определяли у 103 человек московской популяции из этнической группы русских. Для чего отбирали 1-2 мл крови из кубитальной вены в пробирку «Эппендорф» с 1 мл 0,5 М этилендиаминтетраацетата двунатриевой соль (ЭДТА•Na2) (рН 8,5), помещали в пробирку марлевый тампон и хранили при температуре 4С до анализа. Определение наличия данного полиморфизма определяли методом ПЦР-ПДРФ.
ДНК из крови выделяли стандартным фенольным методом с модификациями: к 600 мкл крови добавляли 600 мкл буфера PBS, калия фосфат, натрия фосфат для отделения форменных элементов, центрифугировали 5 мин, выливали супернатант, а к остатку добавляли буфер для лизиса (трис, ЭДТА, SDS) и протеиназу К. Затем очищали с помощью фенола и хлороформа на Vortex.
Раствор выделенной ДНК в количестве 2 мкл использовали для ПЦР в реакционной смеси объёмом 25 мкл. ПЦР проводили с использованием стандартной Taq-полимеразы в KCl, буфере производителя и пары праймеров (MDR1for 5’ – GAT GGC AAA GAA ATA AAG CGA CTG – 3’ и MDR1rev 5’ – ACC AGC CCC TTA TAA ATC AAA CTA – 3’), добавляли 2мМ магния хлорида. Температура отжига составляла 65°С. В результате ПЦР синтезировался фрагмент длиной 280 пар нуклеотидов (п.н.), который затем подвергался рестрикции рестриктазой MboI («Fermentas», Литва) при температуре 37°С в буфере производителя. Разрезался фрагмент, содержащий вариант «С», в то время как фрагмент, содержащий вариант «Т», оставался нерасщепленным. В случае расщепления образовывались фрагменты длиной 133 и 147 п.н. соответственно. Результаты рестрикции анализировали с помощью электрофореза в 10% полиакриламидном геле (ПААГ) на стандартном трис-боратном буфере. Визуализацию результатов проводили в ультрафиолетовом свете (312 нм) после окрашивания раствором бромистого этидия.
Расчёт фармакокинетических параметров и статистическая
обработка результатов
Фармакокинетические параметры домперидона рассчитывали с помощью программы KineticaТМ2000 модельно-независимым методом. Рассчитывались следующие параметры: максимальная концентрация Cmax – максимальное значение из измеренных, нг/мл; время ее достижения Tmax – время, при котором измерялась максимальная концентрация, час; площадь под фармакокинетической кривой – в пределах длительности наблюдений (AUC0-t) рассчитывали методом трапеций, нг*ч/мл; относительная величина Cmax /AUC0-t - характеристика скорости всасывания.
Полученные экспериментальные данные были подвержены статистической обработке с помощью пакета Systat w5 для персонального компьютера. Рассчитывались следующие статистические параметры: среднее арифметическое значение (Mean), среднее геометрическое значение (Geom Mean), стандартное отклонение среднего результата (SD), медиана (Median). Достоверность различий изученных параметров оценивали при р < 0,05. Для оценки различий динамики концентрации домперидона в плазме крови лиц с различным генотипом использовали дисперсионный анализ (ANOVA). Для метрологической характеристики методики определения домперидона методом ВЭЖХ определяли следующие параметры: – истинное значение измеряемой величины, f- число степеней свободы, x- средняя выборки, s2- дисперсия, s- стандартное отклонение, P- доверительная вероятность, t(P,f)- критерий Стьюдента, x- полуширина доверительного интервала величины;, %- относительная ошибка отдельного результата (по ГФ XI).
Разработка методики количественного определения домперидона
методом ВЭЖХ
В результате серии экспериментов нами была выбрана колонка Zorbax ODS 150><4,6 мм.
При подборе состава элюента применялись подвижные фазы с различным соотношением водной и органической фаз: метанол – вода – триэтиламин – уксусная кислота в соотношении (60:40:0,02:0,3); 0,02М фосфатный буфер (pH 3,5) – метанол (45:55); 5 M аммония ацетат – ацетонитрил в соотношении (82,5:17,5); ацетонитрил : 0,01 M калия дигидрофосфат (с добавлением о-фосфорной кислоты до рН 3,2) в соотношении (25 : 75) и другие. Результаты исследования показали, что при использовании колонки Zorbax ODS 150><4,6 мм оптимальное разделение домперидона наблюдается при использовании подвижной фазы ацетонитрил : 0,01 M калия дигидрофосфат (с добавлением о-фосфорной кислоты до рН 3,2) в соотношении (25 : 75).
Скорость потока подвижной фазы выбирали исходя из времени анализа и давления на хроматографической колонке, которое не должно превышать 3000 psi. Оптимальной по указанным параметрам была скорость потока элюента 1 мл/мин.
В этих условиях время удерживания составляло 4,2 ± 0,2 мин, а предел обнаружения 1 нг/мл. На рисунке 1 представлена хроматограмма стандартного раствора домперидона (3 мкг/мл).
Рассчитывали параметры характеризующие удерживание определяемого вещества в колонке (BP, Ph. Eur.). В описанных условиях достигается хорошая эффективность колонки (N=2443 >2000), хорошая разделяющая способность хроматографической системы (Rs= 13,5 > 1); количественное определение достаточно точно (сигнал в 26,7 раз превышает шум) с высокой воспроизводимостью результатов измерений (RSD%=1,22< 2).

Рисунок 1. Хроматограмма стандартного раствора домперидона.
Методика определения домперидона в плазме крови методом ВЭЖХ
Экспериментальным путём были предложены следующие условия определения домперидона в плазме крови.
Экстракция. К 1 мл плазмы крови добавляли 100 мкл 2М NaOH, встряхивали на vortex 5 сек, затем добавляли 5 мл хлороформа, смесь перемешивали и экстрагировали 10 минут на шейкере. Затем пробы центрифугировали при 4500 об/мин – 10 минут. Органический слой переносили в колбы для упаривания и упаривали под вакуумом при 37 0С. Сухой остаток растворяли в 100 мкл подвижной фазы и аликвоту (50 мкл) вводили в хроматограф.
Хроматографический анализ. Флуориметрический детектор, ex = 282 нм, em = 328 нм. Хроматографическая колонка: Zorbax ODS (4,6*150 мм). Подвижная фаза – ацетонитрил: 0,01 M дигидрофосфат калия (с добавлением о-фосфорной кислоты до рН 3,2) в соотношении 25 : 75. Подвижную фазу перед использованием дегазировали под вакуумом. Скорость элюирования 1 мл/мин.
Образцы хроматограмм представлены на рисунке 2.


Рисунок 2. Хроматограмма домперидона изолированного из плазмы крови испытуемого.
Количественное определение проводили методом абсолютной калибровки по высоте пиков. Для этого к 1 мл плазмы, не содержащей домперидон, добавляли стандартный раствор домперидона (1 мкг/мл) в количестве 2 мкл, 10 мкл, 20 мкл, 30 мкл, 40 мкл так чтобы концентрация домперидона составила: 2, 10, 20, 30 и 40 нг/мл. Затем пробы обрабатывали как указано выше. Калибровочная зависимость в диапазоне концентраций 2 - 40 нг/мл носила линейный характер (рисунок 3).
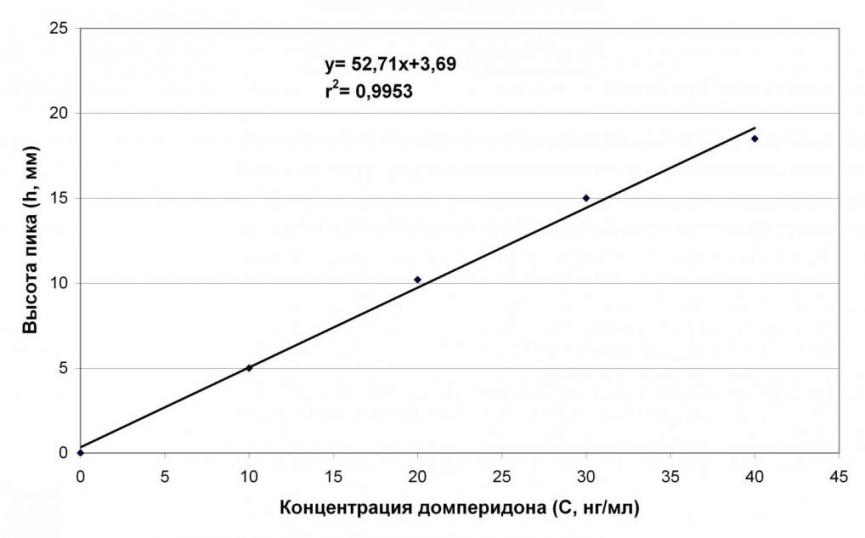
Рисунок 3. Калибровочный график зависимости между концентрацией
домперидона в плазме крови и высотой пика на хроматограммах.
Метрологические характеристики метода анализа представлены в таблице 4.
Таблица 4
Метрологические характеристики метода анализа (n=5)
| f | x | s2 | s | P | t(P,f) | x | , % | |
| 10нг/мл | 4 | 9,94 | 0,11 | 0,34 | 95 | 2,78 | 0,42 | 4,3 |
| 20нг/мл | 4 | 19,82 | 0,31 | 0,55 | 95 | 2,78 | 0,69 | 3,4 |
| 30 нг/мл | 4 | 29,88 | 0,56 | 0,75 | 95 | 2,78 | 0,93 | 3,1 |
Примечание: t1= |-x|* m / s= 0,39 < 2,78; t2=|-x|* m / s= 0,73 < 2,78; t3= |-x|* m / s= 0,36 < 2,78
Данные метрологические характеристики доказывают, что результаты выборок концентрации домперидона в плазме крови свободны от систематической ошибки.
Результаты фармакокинетического исследования домперидона
Фармакокинетическое исследование домперидона на 36–и индивидуумах московской популяции показало значительный разброс в динамике содержания домперидона в плазме крови испытуемых (CV=43-63 %) и в значениях фармакокинетических показателей этого препарата (CV=32-47 %). Этот разброс можно объяснить наблюдаемой частотой полиморфизма C3435T гена MDR1 (30,6 % - ТТ; 50,0 % - СТ), кодирующего Р-гликопротеин у индивидуумов московской популяции. Динамика концентрации домперидона в плазме крови 36-и здоровых добровольцев после однократного перорального приема 20 мг препарата представлена в таблице 5. Значения фармакокинетических показателей домперидона у 36-и здоровых добровольцев после однократного перорального приема 20 мг составили: Cmax 24,5±11,5 нг/мл; Tmax 0,98±0,31ч; AUC0-t 118,9±46,9 нг*ч/мл; Cmax /AUC0-t 0,21±0,07 (таблица 6). Профили индивидуальных фармакокинетических кривых представлены на рисунке 4. Усредненная фармакокинетическая кривая представлена на рисунке 5.
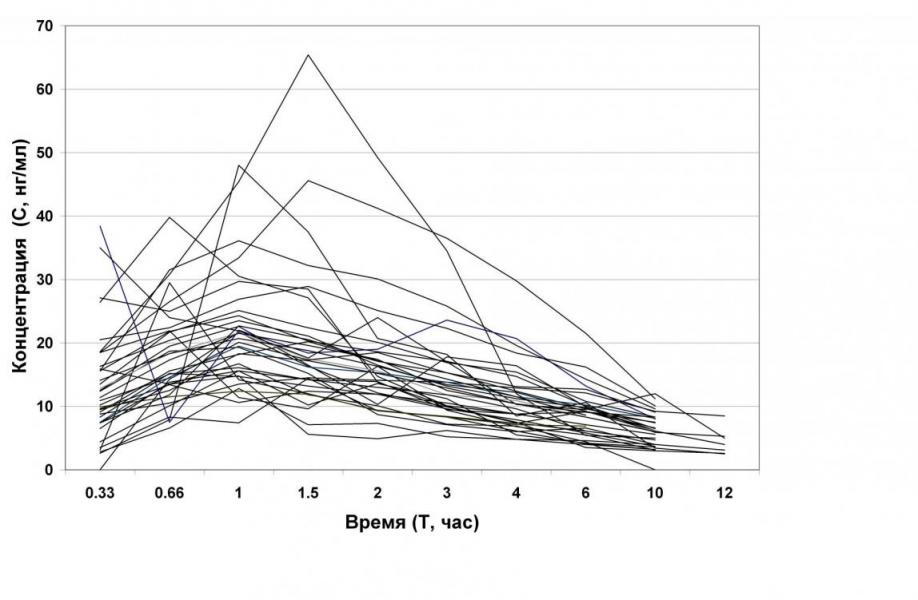
Рисунок 4. Динамика содержания домперидона в плазме крови испытуемых (n=36).
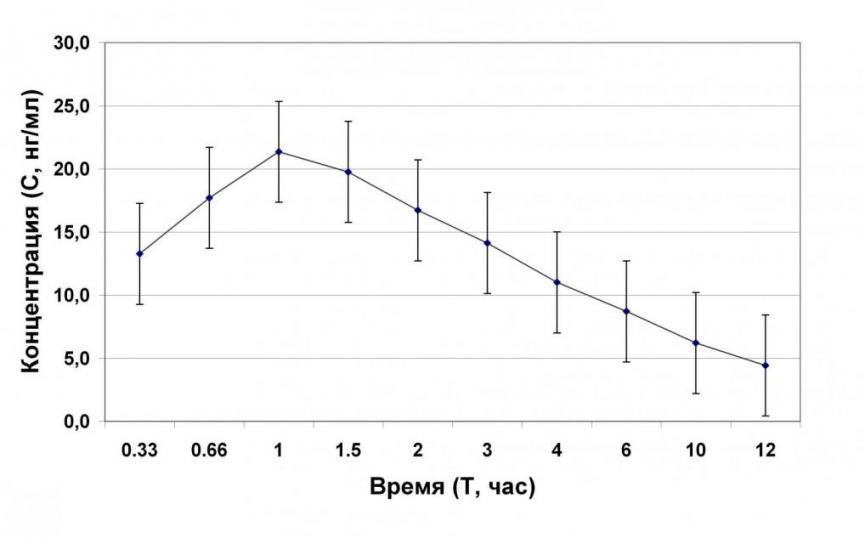
Рисунок 5. Средняя динамика содержания домперидона в плазме крови испытуемых (n=36).
Таблица 5
Динамика содержания домперидона в плазме крови испытуемых, после
однократного перорального приема (нг/мл)
| № | Время после приема домперидона, час | ||||||||||
| 0.33 | 0.66 | 1 | 1.5 | 2 | 3 | 4 | 6 | 10 | 12 | 24 | |
| Mean | 13,3 | 17,7 | 21,4 | 19,8 | 16,7 | 14,1 | 11,0 | 8,7 | 6,2 | 4,4 | - |
| GMean | 10,9 | 16,2 | 19,8 | 17,5 | 15,1 | 12,8 | 10,1 | 8,0 | 5,9 | 4,1 | - |
| SD | 8,4 | 7,5 | 8,9 | 11,3 | 8,7 | 7,1 | 5,2 | 3,8 | 2,7 | 2,1 | - |
| CV | 63 | 42 | 41 | 57 | 52 | 50 | 46 | 43 | 44 | - | - |
| Median | 11,4 | 15,4 | 20,4 | 17,3 | 15,3 | 12,7 | 10,4 | 8,9 | 6,2 | 4,0 | - |
мпо - менее предела обнаружения
Таблица 6
Фармакокинетические параметры домперидона
| № | Cmax, нг/мл | Tmax, час | AUCo-t, нг*ч/мл | Cmax /AUCo-t |
| Mean | 24,5 | 0,98 | 118,9 | 0,21 |
| GMean | 22,5 | 0,92 | 110,5 | 0,20 |
| SD | 11,5 | 0,31 | 46,9 | 0,07 |
| CV | 47 | 31 | 39 | 33 |
| Median | 21,55 | 1,00 | 114,0 | 0,19 |
Генотипирование P-гликопротеина у добровольцев из московской
популяции
Изучение гена MDR1, кодирующего выработку Р-гликопротеина у индивидуумов московской популяции необходимо для определения активности этого белка. Известны четыре аллельных варианта (полиморфных маркёров) гена MDR1, которые представляют собой замены в последовательности ДНК одного нуклеотида на другой – т.н. полиморфизмы одного нуклеотида, однако наиболее значимым является С3435Т в 26 экзоне. Этот полиморфизм ведёт к изменению фармакокинетики лекарственных средств, являющихся субстратами Р-гликопротеина. Генотипирование проводили с помощью полимеразной цепной реакции – полиморфизм длины рестрикционных фрагментов (ПЦР-ПДРФ).
Исследование генотипа гена MDR1 у 103 индивидуумов московской популяции из этнической группы русских методом ПЦР-ПДРФ показало значительное количество полиморфного маркёра С3435Т гена MDR1, кодирующего Р-гликопротеин. Из 103 индивидуумов число человек с ТТ генотипом составило 30,1 % (n=31) испытуемых, с СТ генотипом – 50,5 % (n=52) испытуемых и с СС генотипом – 19,4 % (n=20) испытуемых. Распределение генотипов представлено на рисунке 6.
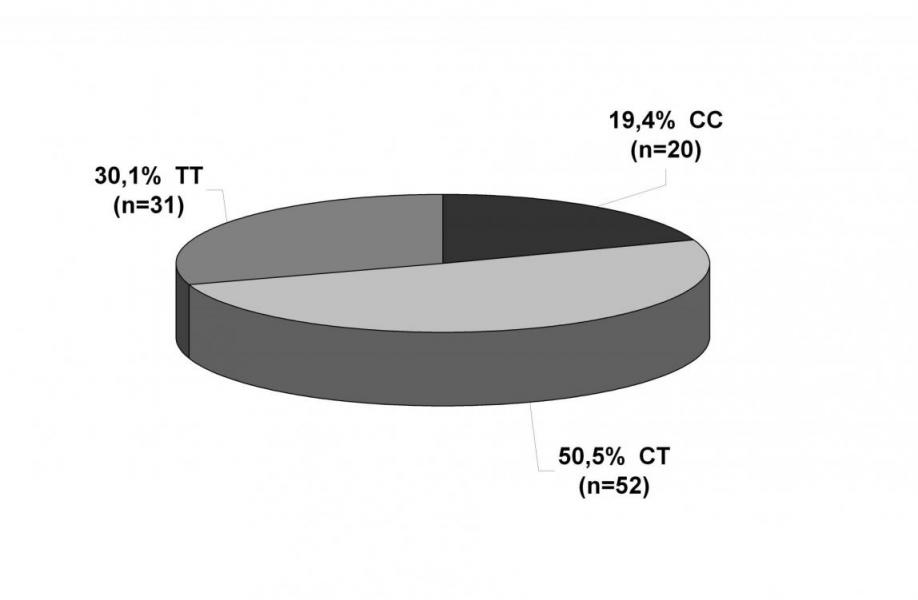
Рисунок 6. Соотношение полиморфных и нормальных генотипов у индивидуумов московской популяции гена MDR1, кодирующего Р-гликопротеин (n=103).
Также определяли наличие полиморфизма С3435Т гена MDR1 у 36 индивидуумов московской популяции из этнической группы русских, участвующих в фармакокинетическом исследование домперидона. При этом распределение генотипов в этой группе лиц совпадало с распределением генотипов 103 индивидуумов московской популяции из этнической группы русских (рисунок 7).
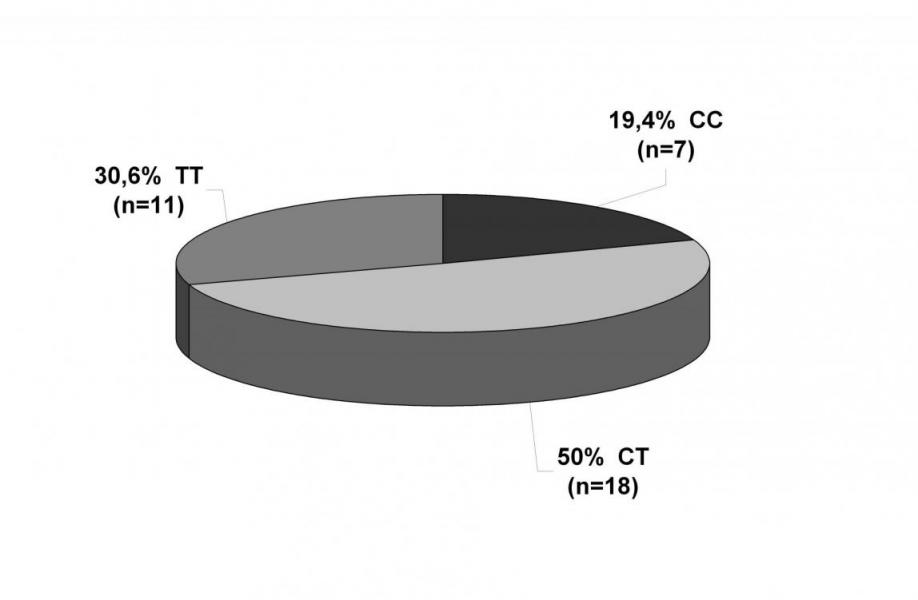
Рисунок 7. Соотношение полиморфных и нормальных генотипов у индивидуумов московской популяции гена MDR1, кодирующего Р-гликопротеин (n=36).
Следовательно, распределение генотипов у индивидуумов, отобранных нами для фармакокинетического исследования домперидона соответствует общей картине распределения генотипов у лиц московской популяции из этнической группы русских.
Сопоставление результатов фармакокинетического исследования и
генотипирования
Нами была изучена фармакокинетика субстрата P-гликопротеина домперидона в зависимости от носительства генотипов СС, СТ и ТТ по полимофному маркеру С3435Т гена MDR1. Предполагаемую связь изменений в фармакокинетике домперидона с полиморфизмом C3435T гена MDR1, кодирующего Р-гликопротеин у индивидуумов московской популяции исследовали сопоставлением данных фенотипирования и генотипирования Р-гликопротеина.
Для наглядности зависимости генотипа индивидуумов от фармакокинетики домперидона и его фармакокинетических показателей результаты исследования разделили на 3 группы: для индивидуумов с СС генотипом, СТ генотипом и ТТ генотипом.
Из данных представленных в таблице 7 и на рисунке 8 видно, что концентрация домперидона в плазме крови у лиц с генотипом ТТ статистически достоверно выше (р<0,05), чем у лиц с генотипами СТ и СС. При этом следует отметить, что у лиц с генотипом СС концентрация домперидона в плазме крови через 12 часов после приема препарата была ниже предела обнаружения. В то время, как у лиц с генотипами ТТ и СТ через 12 часов после приема препарата домперидон еще определялся в плазме крови.
Таблица 7
Содержание домперидона в плазме крови у лиц московской
популяции с различным генотипом MDR1 гена, после однократного перорального приема, (нг/мл)
| генотип | Время после приёма, час | ||||||||||
| 0.33 | 0.66 | 1 | 1.5 | 2 | 3 | 4 | 6 | 10 | 12 | 24 | |
| СС | 11,3 | 15,9 | 17,8 | 13,9 | 11,8 | 9,6 | 8,5 | 6,5 | 4,0 | - | - |
| СТ | 10,9 | 16,4 | 17,7 | 15,5 | 14,4 | 12,3 | 9,9 | 8,2 | 6,2 | 4,4 | - |
| ТТ | 18,0 | 21,1 | 29,6 | 30,5 | 23,7 | 20,0 | 14,5 | 11,0 | 7,2 | 4,6 | - |
 Рисунок 8. Усреднённая динамика концентрации домперидона в плазме крови после однократного приёма 20 мг у лиц московской популяции с различным генотипом MDR1 гена.
Рисунок 8. Усреднённая динамика концентрации домперидона в плазме крови после однократного приёма 20 мг у лиц московской популяции с различным генотипом MDR1 гена.
У испытуемых с генотипом ТТ максимальная концентрация домперидона была статистически достоверно выше (р=0,0032), по сравнению с лицами с генотипом СС. Значение площади под кривой также было статистически достоверно выше у испытуемых с ТТ генотипом по сравнению с СС (р=0,0002). Однако время наступления максимальной концентрации и отношение Cmax/AUC0-t статистически достоверно не различались у лиц с генотипом ТТ и СС (р>0,05) (для СС генотипа: Cmax 18,0±2,5 нг/мл; Tmax 0,90±0,25 ч; AUC0-t 80,9±24,3 нг*ч/мл; Cmax /AUC0-t 0,23±0,04; для ТТ генотипа: Cmax 35,1±14,8нг/мл; Tmax 1,09±0,38ч; AUC0-t 160,5±46,9 нг*ч/мл; Cmax /AUC0-t 0,23±0,09). Подобные особенности фармакокинетики домперидона у лиц с генотипом ТТ могут быть связаны с полученным снижением экспрессии гена MDR1 у лиц с данным генотипом, следствием чего является низкое количество и функциональная активность Р-гликопротеина прежде всего в кишечнике, печени, почках.
У добровольцев с генотипом СТ по сравнению с генотипом СС отмечалась тенденция к повышению значений всех фармакокинетических показателей, но статистически достоверно выше (незначительно, р=0,0407) было только значение площади под фармакокинетической кривой (для СС генотипа: Cmax 18,0±2,5 нг/мл; Tmax 0,90±0,25 ч; AUC0-t 80,9±24,3 нг*ч/мл; Cmax /AUC0-t 0,23±0,04; для СТ генотипа: Cmax 20,6±6,0 нг/мл; Tmax 0,94±0,28 ч; AUC0-t 108,1±34,5 нг*ч/мл; Cmax /AUC0-t 0,20±0,07). У испытуемых с генотипом ТТ максимальная концентрация домперидона была статистически достоверно выше (р=0,0089), по сравнению с лицами с генотипом СT. Значение площади под кривой также было статистически достоверно выше у испытуемых с ТТ генотипом по сравнению с СT (р=0,0052). Однако время наступления максимальной концентрации и отношение Cmax/AUC0-t статистически достоверно не различались у лиц с генотипом ТТ и СT (р>0,05). То есть индивиды с СТ генотипом имели Р-гликопротеин с промежуточной активностью, большей, чем у индивидов с ТТ полиморфным генотипом, но меньшей по сравнению с активностью Р-гликопротеина у индивидуумов с нормальным СС генотипом (таблицы 8-10, рисунок 9), то есть ТТ<СТ<СС.
Таблица 8
Фармакокинетические показатели у индивидуумов московской популяции с различным генотипом MDR1 гена
| генотип | Cmax, нг/мл | Tmax, час | AUCo-t, нг*ч/мл | Cmax /AUCo-t |
| СС | 18,0** | 0.90 | 80.9*** | 0,23 |
| СТ | 20.6 | 0.94 | 108,1* | 0.20 |
| ТТ | 35.1 | 1,09 | 160.5 | 0.23 |
Примечание: *- р < 0,05, **- р < 0,01, *** - р < 0,001.
Таблица 9
Изменение фармакокинетических показателей в зависимости от генотипа MDR1 гена
| генотип | Cmax, нг/мл | Tmax, час | AUCo-t, нг*ч/мл | Cmax /AUCo-t |
| СС | ||||
| СТ | ||||
| ТТ |
Примечание: -наименьший-увеличивается -наибольший
Таблица 10
Статистическая достоверность различий фармакокинетических показателей у индивидуумов с СС, СТ и ТТ генотипом
| Показатель | Генотип ТТ n=11 | Генотип СТ n=18 | Генотип СС n=7 | ртт-сс | рст-сс | ртт-ст |
| Cmax, нг/мл | 35,1±14,8 | 20,6± 6,0 | 18,0±2,5 | 0,0032 | 0,1457 | 0,0089 |
| Tmax, час | 1,09±0,38 | 0,94±0,28 | 0,90±0,25 | 0,2343 | 0,7467 | 0,2859 |
| AUC0-t, нг*ч/мл | 160,5±46,9 | 108,1±34,5 | 80,9±24,3 | 0,0002 | 0,0407 | 0,0052 |
| Cmax /AUC0-t | 0,23±0,09 | 0,20±0,07 | 0,23±0,04 | 0,7776 | 0,1777 | 0,4486 |

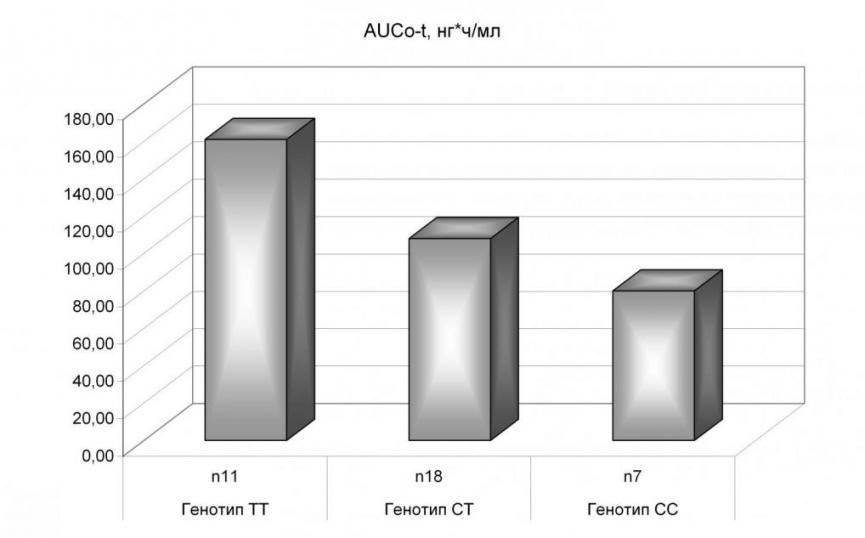


Рисунок 9. Изменение фармакокинетических показателей в зависимости от генотипа MDR1 гена.
ВЫВОДЫ
- Изучено хроматографическое поведение домперидона и предложены условия его определения в плазме крови методом высокоэффективной жидкостной хроматографии с флуориметрическим детектором.
- Подобраны условия экстракции домперидона из плазмы крови хлороформом в среде 2М NaOH. В разработанных условиях изолирования эффективность экстракции домперидона составила 85%.
- Разработанная методика анализа домперидона характеризуется быстротой анализа (время удерживания домперидона 4,2 мин), точностью и воспроизводимостью (относительная ошибка 3,6 %), чувствительностью (предел обнаружения 1 нг/мл, предел количественного определения 2 нг/мл) и может быть предложена для фармацевтического анализа и фармакокинетических исследований домперидона.
- Изучена фармакокинетика домперидона после его однократного перорального приёма. Показан значительный межиндивидуальный разброс в динамике содержания домперидона в плазме крови испытуемых (CV=43-63 %) и в значениях основных фармакокинетических параметров (CV=32-47 %).
- Проведено генотипирование гена MDR1, кодирующего синтез Р-гликопротеина, методом ПЦР у лиц московской популяции из этнической группы русских. Показано, что в московской популяции из этнической группы русских число лиц с ТТ генотипом - 30,1 %, лиц с СТ генотипом – 50,5 %, лиц с СС генотипом – 19,4%.
- Выявлены статистически достоверные отличия в фармакокинетике домперидона у лиц с различным генотипом гена MDR1 (Cmax= 35.1 нг/мл, AUC0-t=160,5 нг*ч/мл для лиц с ТТ генотипом; Cmax= 20.6 нг/мл, AUC0-t=108,1 нг*ч/мл для лиц с СТ генотипом; Cmax= 18,0 нг/мл, AUC0-t= 80,9 нг*ч/мл для лиц с СС генотипом).
Список работ, опубликованных по теме диссертации
- Файнштейн С.Л. Влияние функционального состояния Р-гликопротеина на фармакокинетику домперидона. // Мат. XIII Российского национального конгресса «Человек и лекарство». – 2006г. – С. 468.
- Файнштейн С.Л., Сычев Д.А., Игнатьев И.В. Определение полиморфного маркёра С3435Т гена MDR1, кодирующего Р-гликопротеин у лиц московской популяции. // Мат. XIII Российского национального конгресса «Человек и лекарство». – 2006г. – С. 468.
- Раменская Г.В., Файнштейн С.Л., Сычёв Д.А. Значение изменения функциональной активности и количества экспрессируемого Р-гликопротеина в фармакокинетике лекарственных средств. // Экспериментальная и клиническая фармакология. – 2007г. - Том 70, №1. – С. 73-80.

