Кылосова инна александровна синтез, свойства и биологическая активность 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов и их функциональных производных
На правах рукописи
Экземпляр № ___
КЫЛОСОВА ИННА АЛЕКСАНДРОВНА
Синтез, свойства и биологическая активность 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов и их функциональных производных
15.00.02 – Фармацевтическая химия, фармакогнозия
Автореферат диссертации на соискание ученой степени кандидата фармацевтических наук
ПЕРМЬ 2007
Работа выполнена на кафедре физической и коллоидной химии ГОУ ВПО «Пермская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель: доктор химических наук,
профессор Гейн В.Л.
Официальные оппоненты: доктор фармацевтических наук,
профессор Коркодинова Л.М.
доктор химических наук,
профессор Масливец А.Н.
Ведущая организация:
Пермский институт технической химии УрО РАН РФ
Защита состоится «18» сентября 2007 в 13.00 часов на заседании диссертационного совета Д 208.068.01 при Пермской государственной фармацевтической академии по адресу: 614990, г. Пермь, ул. Ленина,48.
С диссертацией можно ознакомиться в библиотеке Пермской государственной фармацевтической академии.
Автореферат разослан «___» _____________ 2007 г.
Ученый секретарь
Диссертационного совета Метелева Е.В.
В В Е Д Е Н И Е
Актуальность темы. 5-Арил-1,4-дизамещенные тетрагидропиррол-2,3-дионы представляют собой пятичленные азотистые гетероциклы, содержащие в положении 1 алкильный или арильный функционализованный заместитель и в положении 4 различной природы ацильный остаток. Тетрагидропиррол-2,3-дионы составляют значительный класс доступных и устойчивых органических веществ. Наряду с этим они легко вступают в реакции с различными нуклеофильными реагентами за счет высокореакционноспособной карбонильной группы в положении 3 гетероцикла. Наличие последней, а также карбонильная группа боковой цепи позволяют в реакциях с бинуклеофильными реагентами формировать различные конденсированные системы из гетероциклов.
Синтез на основе 1,4,5-тризамещенных тетрагидропиррол-2,3-дионов биологически активных веществ является одним из перспективных путей использования этого класса соединений. Ранее было установлено, что соединения этого ряда, 1,4,5-тризамещенные 3-гидрокси-3-пирролин-2-оны, обладают противовоспалительной, анальгетической, противомикробной, ноотропной, антиагрегантной по отношению к тромбоцитам и противовирусной активностью. Продолжая поиск биологически активных соединений среди 1,4-дизамещенных 3-гидрокси-3-пирролин-2-онов и их производных, представляло интерес осуществить синтез соединений, содержащих в положении 1 алкильный заместитель, содержащий в своем составе карбоксильную группу или функциональные производные последней, в положении 4 ацетильную или ароильную группы и оценить каким образом эти изменения могут оказать влияние на химические свойства и биологическую активность полученных соединений.
Цели и задачи исследования. Целью исследования является изыскание новых малотоксичных соединений, построенных на основе естественных метаболитов с противовоспалительной, анальгетической, противомикробной и ноотропной активностью в ряду 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов и их производных.
В связи с вышеизложенным нами были поставлены следующие задачи:
- осуществить синтез 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов, а также функциональных производных соответствующих кислот;
- изучить реакции полученных 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов с моно- и бинуклеофильными реагентами;
- провести фармакологический скрининг полученных соединений на наличие того или иного вида активности с целью выявления новых биологически активных соединений и их дальнейшего углубленного изучения.
Научная новизна исследования. На основе трехкомпонентной реакции метиловых эфиров ацилпировиноградных кислот со смесью ароматического альдегида и аминокарбоновой кислоты (ее эфира или амида) разработан простой способ синтеза 5-арил-4-ацил-1-карбоксиалкил-3-гидрокси-3-пирролин-2-онов и их функциональных производных. Установлено, что при использовании в реакции формирования пирролидинового цикла глицинамида образуются 3-бензоилметилен-5-арилметиленпиперазин-2,6-дионы.
Изучено взаимодействие 5-арил-4-ацил-1-карбоксиалкил-3-гидрокси-3-пирролин-2-онов с моно- и бинуклеофилами. При использовании в качестве исходных соединений 5-арил-4-ацетил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов в реакциях с ароматическими аминами атака нуклеофильного реагента переносится на карбонильную группу боковой цепи и единственным продуктом реакции являются 5-арил-4-(1-ариламиноэтилиден)-1-карбоксиалкилпиррол-2,3-дионы. Взаимодействие 5-арил-4-ацил-1-карбоксиалкил-3-гидрокси-3-пирролин-2-онов с гидразингидратом приводит к образованию конденсированной системы пирролопиразола.
На основании данных ИК- и ЯМР1Н-спектроскопии, масс-спектрометрии и рентгеноструктурного анализа установлена структура полученных соединений.
Осуществлен синтез 104 новых веществ, 48 из которых подвергнуто фармакологическому скринингу на различные виды биологической активности.
Практическая значимость работы. Разработаны препаративные методы синтеза 5-арил-4-ацил-3-гидрокси-1-карбоксиметил-3-пирролин-2-онов, 5-арил-4-ацил-3-гидрокси-1-(2-карбоксиэтил)-3-пирролин-2-онов, 5-арил-4-ацил-3-гидрокси-1-(3-карб-оксипропил)-3-пирролин-2-онов, 5-арил-4-ацил-3-гидрокси-1-(3-карбокси-2-фенилпропил)-3-пирролин-2-онов, 5-арил-4-ацил-3-гидрокси-1-(5-карбоксипентил)-3-пирролин-2-онов и их производных: 5-арил-4-ацил-3-гидрокси-1-метоксикарбонилметил-3-пирролин-2-онов, 5-арил-4-ацил-3-гидрокси-1-этоксикарбонилметил-3-пирролин-2-онов, 1-аминокарбонилметил-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов, 5-арил-4-ацил-3-гидрокси-1-(3-метоксикарбо-нил-2-фенилпропил)-3-пирролин-2-онов, а также 5-арил-3-ариламино-4-бензоил-1-карбоксиалкил-3-пирролин-2-онов, 5-арил-4-(1-ариламиноэтилиден)-1-карбоксиалкилпир-рол-2,3-дионов, 3-амино-4-бензоил-1-карбоксиалкил-5-фенил-3-пирролин-2-онов, 5-карбоксиалкил-3,4-диарилпирроло[3,4-с]пиразол-6-онов.
Среди полученных соединений обнаружены вещества с антиамнестической, антифлогистической, анальгетической и антимикробной активностью, а также мочегонным и миорелаксантным действием, сравнимыми с активностью препаратов, применяемых в медицинской практике.
Публикации. По материалам диссертации опубликована 1 статья в центральной печати и 11 тезисов-докладов на конференциях различного уровня.
Апробация работы. Материалы диссертационной работы обсуждались на юбилейной научно-практической конференции «Актуальные проблемы фармацевтической науки» (г. Пермь, 2000 г.); на VII Российском национальном конгрессе «Человек и лекарство» (г. Москва, 2000 г.); на V молодежной научной школе-конференции по органическому синтезу (г. Екатеринбург, 2002 г.); на межвузовской научной конференции студентов и молодых ученых (г. Курск, 2002 г.); на III молодежной школе-конференции по органическому синтезу «Органический синтез в новом столетии» (г. С.-Петербург, 2002 г.), на межвузовской научно-практической конференции, посвященной 85-летию высшего образования на Урале (г. Пермь, 2001 г.), на российской научно-практической конференции «Рациональное использование лекарств» (г. Пермь, 2004 г.), на научной конференции профессорско-преподавательского состава ПГФА (г. Пермь, 2004 г.).
Структура и объем диссертации. Содержание работы изложено на 143 страницах машинописного текста и состоит из введения, 4 глав, приложений, выводов. Список литературы включает 128 работ отечественных и зарубежных авторов. Диссертация содержит 36 таблиц и 1 рисунок.
На защиту выносятся:
- Синтез 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов, их функциональных производных, а также взаимодействие 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов с нуклеофильными реагентами.
- Установление структуры полученных соединений на основе спектральных исследований.
- Результаты биологических испытаний по изучению острой токсичности, анальгетического, противовоспалительного, мочегонного и миорелаксантного действия, а также ориентировочно – исследовательского поведения.
Основное содержание работы
- Синтез 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов
С целью синтеза 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов нами была изучена трехкомпонентная реакция эфиров ацилпировиноградных кислот со смесью ароматического альдегида и аминокарбоновой кислоты (в качестве последних были использованы: гликокол, -аланин, -аминомасляная, -аминокапроновая, -фенил--аминомасляная кислоты и их производные).

Iа-ч, IIа-е, IIIа-д,
IVа-е, Vа-х
Iа-ч: R1 = С6Н5 (а-г), СН3 (ж-с), 4-Cl-C6H4 (д), 4-NO2-C6H4 (е), 4-Br-C6H4 (т-х), (CH3)3C (ч); R2 = 2-Cl (а), 3-F (б,с,ф), 4-F (о), 3-CH3O (в,р), 4-CH3O (д,л), 3,4-(CH3O)2 (п,т), H (к,ч), 2-NO2 (г,е), 3-NO2 (и), 4-NO2 (н,у), 3-CH3O, 4-OН (ж), 4-OН (з), 4-СН3 (м,х); R3 = CH2COOH
IIа-е: R1 = CH3 (а,б), C6H5 (в,г), 4-Cl-C6H4 (д), (CH3)3C (е); R2 = 2-F (а), 4-Cl (б), H (в,е), 3-NO2 (д), 4-N,N-(CH3)2 (г); R3 = (CH2)2COOH;
IIIа-п: R1 = CH3 (а,б), C6H5 (в-о), (CH3)3C (п); R2 = 3-CH3O, 4-OН (д), 2-NO2 (е,н), 2-Cl (ж), 4-Cl (к), 2-F (з), 4-F (б, г), 2,4-Cl2 (и), 4-Br (л), 3-OCH3 (о), 2,5-(OCH3)2 (м), 4-N,N-(CH3)2 (а), H (в,п); R3 = (CH2)3COOH
IVа-е: R1 = CH3 (а-г), C6H5 (д), 4-Cl-C6H4 (е); R2 = 4-Cl (б,е), 4-OCH3 (б), 3-NO2 (г), 2-F (д), H (а); R3 = CH2СН(Ph)СН2COOH
Vа-х: R1 = 4-NO2-C6H4 (а-в,е-и), 4-Сl-C6H4 (г), 4-Br-С6H4 (д), (СН3)3С (к,р-т), СН3 (л-о), C6H5 (п), 3,4-(OCH3)2-C6H3 (у-х); R2 = 2-F (о) 4-F (а,г,с,), 4-ОН (б,у), 2-ОСН3 (в,н,п), 4-Br (д,х), 4-СН3 (е), 4-N,N-(СН3)2 (ж), 2-Cl (з), H (к,л,ф), 4-Сl (м,р), 4-NО2 (и,т); R3 = (CH2)5COOH
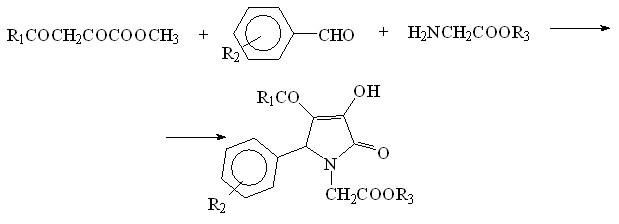
Нами было установлено, что реакция протекает при кратковременном нагревании в водно-спиртовой или спиртовой среде метиловых эфиров ацилпировиноградных кислот со смесью ароматического альдегида и соответствующей аминокарбоновой кислоты с образованием 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов (Iа-ч, IIа-е, IIIа-п, IVа-е, Vа-х).
В случае гликокола используется водно-спиртовая смесь, что связано с плохим растворением данной аминокарбоновой кислоты в спирте. При использовании гидрохлорида 4-амино-3-фенилбутановой кислоты взаимодействие также протекает в водно-спиртовой среде при добавлении эквимолярного количества бикарбоната натрия. В остальных случаях реакция протекает в спирте.
Природа кислоты и характер заместителя в ароматическом альдегиде и эфире ацилпировиноградной кислоты оказывают влияние на образование продуктов реакции. Так, в ряду гликокол – -аланин – -аминомасляная кислота – -аминокапроновая кислота с увеличением остатка аминокислоты повышается выход продукта реакции, что, по-видимому, связано с положительным индуктивным эффектом метиленовых групп и повышением нуклеофильности аминогруппы. Электроноакцепторные заместители в альдегиде и эфире арилпировиноградной кислоты способствуют более легкому протеканию реакции и существенно повышают выход продукта.
В спектрах ИК соединений (Iа-ч, IIа-е, IIIа-п, IVа-е, Vа-х) присутствуют полоса поглощения лактамной карбонильной группы при 1688 – 1696 см-1, кетонной карбонильной группы при 1666 – 1676 см-1, поглощение, обусловленное карбонилом карбоксильной группы, при 1708 – 1712 см-1, а также полоса поглощения гидроксильной группы при 3110 – 3120 см-1.
В спектрах ЯМР1Н соединений (Iа-ч, IIа-е, IIIа-п, IVа-е, Vа-х) наблюдаются сигналы метинового протона в положении 5 гетероцикла при 5,38 – 5,18 м.д., дублеты протонов метиленовой группы (С1Н2) алкильного заместителя в положении 1 гетероцикла при 4,26 – 4,18 и 3,41 – 3,18 м.д. в случае соединений Iа-ч с J = 18 Гц. В случае соединений IIа-е - мультиплеты при 3,69 – 3,65 м.д. и при 2,91 – 2,87 м.д., а также триплет при 2,60 – 2,51 м.д., для соединений IIIа-п - мультиплеты при 3,63 – 3,35 м.д. и 2,91 – 2,18 м.д. и при 2,21 – 2,13 м.д. и 1,75 – 1,57 м.д., для соединений IVа-е – мультиплеты при 3,90 – 3,80 м.д. и 2,91 – 2,65 м.д., при 2,52 – 2,45 м.д. и триплет при 3,45 – 3,31 м.д., а в случае соединений Vа-щ – мультиплеты при 3,55 – 3,45 м.д., 2,68 – 2,12 м.д., 1,59 –1,50 м.д., 1,38 – 1,15 м.д., 1,46 – 1,41 м.д., 2,24 – 2,18 м.д., а также мультиплет ароматических протонов в положении 5 гетероцикла и боковой цепи при 7,85 – 6,78 м.д., уширенный сигнал гидроксильной группы при 11,98 – 12,23 м.д.
Все соединения (Iа-ч, IIа-е, IIIа-п, IVа-е, Vа-х) дают вишневое окрашивание с раствором FeCl3, что наряду с данными спектров подтверждает их существование преимущественно в енольной форме.
Полученные соединения (Iа-ч, IIа-е, IIIа-п, IVа-е, Vа-х) представляют собой бесцветные кристаллические вещества, нерастворимые в воде и растворимые в этаноле, уксусной кислоте, ДМФА, ДМСО.
2. Синтез функциональных производных 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов
Принимая во внимание, что в полученных соединениях находится карбоксильная группа, представляло интерес получить функциональные производные имеющихся гетероциклических аминокислот (VIа-з, VIIа-н, VIIIа,б, Ха-г).
Так, при взаимодействии эфира ацилпировиноградной кислоты со смесью ароматического альдегида и гидрохлорида метилового эфира гликокола в спирте в присутствии эквимолярного количества водного раствора бикарбоната натрия при кратковременном нагревании были получены 5-арил-4-ацетил-3-гидрокси-1-метоксикарбонилметил-3-пирролин-2-оны (VIа-з).
VIа-з, VIIа-н
VIа-з: R1 = CH3; R2 = H (а), 4-СН3ООС (б), 4-С2Н5 (в), 3-пиридил (г), 4-СН3О (д), 3-СН3О (е), 4-F (ж), 4-NO2 (з); R3 = СН3
VIIа-н: R1 = CH3 (а-в), 4-Cl-С6Н4 (г-н); R2 = Н (а,г), 3-NO2 (б,з), 4-NO2 (ж), 2-F (в,л), 3-F (к), 4-F (и), 4-CH3 (д), 2-Cl (е), 4-OCH3 (н), 3,4-OCH3 (м); R3 = С2Н5
Аналогично при использовании в качестве аминокомпоненты гидрохлорида этилового эфира гликокола в спирте в присутствии эквимолярного количества водного раствора бикарбоната натрия при кратковременном нагревании образуются 5-арил-4-ацил-3-гидрокси-1-этоксикарбонилметил-3-пирролин-2-оны (VIIа-н).
Полученные соединения (VIа-з, VIIа-н) представляют собой бесцветные кристаллические вещества, растворимые в этаноле, уксусной кислоте, ДМСО, ДМФА и нерастворимые в воде.
В спектрах ИК соединений (VIа-з, VIIа-н) присутствуют полоса поглощения лактамной карбонильной группы при 1670 – 1678 см-1, кетонной карбонильной группы при 1650 – 1654 см-1, поглощение, обусловленное карбонилом карбоксильной группы, при 1690 – 1710 см-1, а также полоса поглощения гидроксильной группы при 3110 – 3190 см-1.
В спектрах ЯМР1Н соединений (VIа-з, VIIа-н), наряду с сигналами ароматических протонов и этокси- и метоксигрупп, наблюдается синглет протонов ацетильной группы при 3,47 – 2,12 м.д., сигнал метинового протона в положении 5 гетероцикла при 6,03 – 5,37 м.д., дублеты протонов метиленовой группы в положении 1 гетероцикла при 4,62 – 4,12 м.д. и 3,71 – 3,36 м.д. с J = 18 Гц.
Соединения (VIа-з, VIIа-н) дают вишневое окрашивание с раствором FeCl3, что наряду с данными спектров подтверждает их существование преимущественно в енольной форме.
При взаимодействии эфира бензоилпировиноградной кислоты со смесью ароматического альдегида и глицинамида гидрохлорида в присутствии гидрокарбоната натрия нами лишь в двух случаях были получены 1-аминокарбонилметил-5-арил-4-бензоил-3-гидрокси-3-пирролин-2-оны (VIIIа,б).
VIIIа,б
R = Н (а), 2-F (б)
Следует отметить, что трехкомпонентная реакция эфиров ароилпировиноградных кислот со смесью ароматического альдегида и гидрохлорида глицинамида в присутствии основания протекает неоднозначно.

Так, в ряде случаев нами были выделены 3-бензоилметилен-5-арилметиленпиперазин-2,6-дионы (IХа-и).
IXа-и
R1 = 3-NO2 (а), 2-NO2 (б), 4-NO2 (в), 3,4-(ОСН3)2 (г), 2,4-(ОСН3)2 (д), 4-ОСН3 (е), 4-F (ж), 4-Br (з), 4-Cl (и)
Полученные соединения (IXа-и) представляют собой красно-оранжевые кристаллические вещества, растворимые в этаноле, уксусной кислоте, ДМФА, ДМСО и нерастворимые в воде.
В спектрах ИК соединений IХа-и наблюдается полоса поглощения лактамной карбонильной группы в положениях 2 и 6 гетероцикла при 1659 – 1704 см-1, полоса поглощения кетонной карбонильной группы, сопряженной с двойной связью, при 1602 – 1625 см-1 и полоса поглощения, обусловленная валентными колебаниями NH-связи при 3056 – 3101 см-1 и 3155 – 3207 см-1.
В спектрах ЯМР1Н соединений IХа-и наблюдается мультиплет ароматических протонов в области 8,30 – 7,58 м.д., сигналы метиновых протонов при 7,69 – 6,75 м.д. и 7,81 – 6,98 м.д., сигнал N4H протона при 12,25 – 12,13 м.д. и N1Н протона при 13,50 – 13,22 м.д.
Такое протекание реакции с глицинамидом гидрохлоридом объясняется, по-видимому, тем, что на первой стадии образуется пиперазин, который в дальнейшем реагирует с ароматическим альдегидом с образованием конечного продукта.
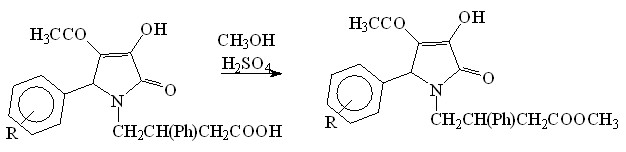
Попытки получения 5-арил-4-ацетил-3-гидрокси-1-(3-метоксикарбонил-2-фенилпропил)-3-пирролин-2-онов на основе реакции ароматического альдегида, эфира ацилпировиноградной кислоты и мефебута в качестве алифатического амина не привели к желаемому результату. 5-Арил-4-ацетил-3-гидрокси-1-(3-метоксикарбонил-2-фенилпропил)-3-пирролин-2-оны (Xа-г) были получены метилированием соответствующих 5-арил-4-ацил-3-гидрокси-1-(3-карбокси-2-фенилпропил)-3-пирролин-2-онов. Было установлено, что реакция протекает в метаноле при добавлении концентрированной серной кислоты.
Xа-г
R = Н (а), 4-СН3 (б), 3-F (в), 4-F (г)
В спектрах ЯМР1Н соединений (Xа-г) наблюдается синглет протонов ацетильной группы при 2,29 – 2,24 м.д., сигнал метинового протона в положении 5 гетероцикла при 4,68 – 4,58 м.д., мультиплет протонов метиленовой группы в положении 1 гетероцикла (С3Н2) при 3,83 – 3,78 м.д., триплет (С2Н) при 3,57 – 3,30 м.д., мультиплеты (С1НАНВ) при 2,61 – 2,55 м.д. и 3,45 – 3,39 м.д., сигнал ОСН3-групп остатка аминокислоты при 3,59 – 3,47 м.д., мультиплет ароматических протонов при 7,31 – 7,21 м.д.
Данные спектров и положительная качественная реакция со спиртовым раствором хлорида железа III свидетельствует о существовании соединений (Xа-г) в енольной форме.
- Взаимодействие 5-арил-4-бензоил-3-гидрокси-1-карбоксиалкил-
3-пирролин-2-онов с ароматическими аминами
В продолжение синтеза новых биологически активных соединений и изучения химических свойств полученных 3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов по отношению к нуклеофильным реагентам, нами было исследовано взаимодействие 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов с такими нуклеофилами как ароматические амины и гидразингидрат. В качестве ароматических аминов нами были использованы: анилин, п-, м-, о-толуидин, п-анизидин, п-фенетидин.
При изучении взаимодействия 5-арил-4-бензоил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов с ароматическими аминами обнаружено, что реакция протекает при кипячении реагентов в уксусной кислоте в течение 1,5 – 2 часов и приводит к 3-ариламино-5-арил-4-бензоил-1-карбоксиалкил-3-пирролин-2-онам (XIа-ф).
XIа-ф
XIIа-д
XIа-ф: n = 1 (в,з,с), 2 (ж,о,р,ф), 5 (а,б,г-е,к-н,п,т,у); R1 = Н (а,в,е-и,н,о,р,с,у,ф), 4-Br (б,г,л,п,т), 4-Cl (д,м), 4-NО2 (к); R2 = Н (а,в,е-и,н,о,р,с,у,ф), 4-Br (б,г,л,п,т), 4-F (д,м), 4-ОСН3 (к); R3 = Н (а-в), 4-СН3 (г-к), 3-СН3 (л-о), 2-СН3 (п-с), 4-ОСН3 (т), 4-ОС2Н5 (у,ф)
XIIа-д: n = 1 (г,д), 3 (в), 5 (а,б); R2 = Н (а-г), 4-Br (д); R3 = H (а), 4-СН3 (б,в), 4-ОСН3 (г,д)
Полученные соединения (XIа-ф, XIIа-д) представляют собой желтые кристаллические вещества, растворимые в этаноле, уксусной кислоте, ДМСО, ДМФА и нерастворимые в воде.
В спектрах ИК соединений XIг,л,м,п присутствуют полосы поглощения лактамной карбонильной группы при 1687 – 1688 см-1, кетонной карбонильной группы при 1649 – 1670 см-1, поглощение, обусловленное карбонилом карбоксильной группы, при 1706 – 1720 см-1, а также полоса поглощения NH-группы при 3075 – 3122 см-1.
В спектрах ЯМР1Н соединений (XIа-ф), наряду с сигналами ароматических протонов и протонов метиленовых групп алкильного заместителя, наблюдается сигнал метинового протона в положении 5 гетероцикла при 5,72 – 5,22 м.д.и сигнал протона NH-группы при 9,22 – 8,22 м.д.
В масс-спектре соединения XIа присутствует пик молекулярного иона с m/z (I, %): 468 (15,0%) [М+] и фрагментных ионов 105 (100%) [C6H5CO]+, 77 (75,0%) [C6H5]+. В масс-спектре соединения XIг присутствует пик молекулярного иона с m/z (I, %): 640 (11,5%) [М+] и фрагментных ионов 183 (80,7%) [4-Br-C6H4CO]+, 91 (65,4%) [4-CH3-C6H4]+, 155 (34,6%) [4-Br-C6H4] +. Такая фрагментация соединений XIа и XIг полностью соответствует структуре.
Все полученные соединения (XIа-ф) не дают реакции со спиртовым раствором хлорида железа III. Данные спектров и отрицательная качественная реакция свидетельствуют о существовании соединений (XIа-ф) в енаминной форме.
Было обнаружено, что при использовании в качестве исходных соединений 5-арил-4-ацетил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов в реакциях с ароматическими аминами атака нуклеофильного реагента переносится на карбонильную группу боковой цепи, о чем свидетельствует образование в качестве единственного продукта 5-арил-4-(1-ариламиноэтилиден)-1-карбоксиалкилтетрагидропиррол-2,3-дионов (XIIа-д). Реакция протекает при кипячении реагентов в уксусной кислоте в течение 1,5 – 2 часов.
В спектрах ЯМР1Н соединений (XIIа-г) наряду с остальными сигналами наблюдается синглет протонов метильной группы при 1,78 – 1,70 м.д. Смещение сигнала в более сильное поле, наряду с литературными данными, свидетельствует об образовании указанной структуры.
Для определения строения соединений XIIа-г нами было проведено рентгеноструктурное исследование кристалла соединения XIIб, полученного медленной кристаллизацией из спиртового раствора. Строение молекулы изображено на рисунке 1.
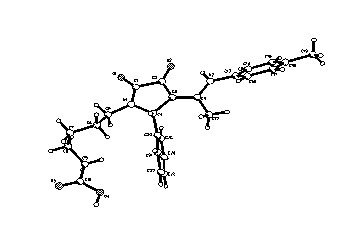
гетероцикла находятся в аксиальном положении, остальные заместители расположены в экваториальной позиции. В кристалле возможны внутримолекулярная водородная связь между атомом кислорода в положении 3 гетероцикла и протоном NH-группы.
- Взаимодействие 5-арил-4-бензоил-3-гидрокси-1-карбоксиалкил-
3-пирролин-2-онов с нуклеофильными реагентами

В продолжение изучения свойств 3-пирролин-2-онов нами были исследована реакция последних с мочевиной и было установлено, что сплавление эквивалентных количеств реагентов при температуре 190 – 200 0С до прекращения газовыделения приводит к 3-амино-4-бензоил-1-карбоксиалкил-5-фенил-3-пирролин-2-онам (XIIIа-г).
XIIIа-г
n = 1 (г), 2 (б), 3 (а), 5 (в)
Полученные соединения (XIIIа-г) представляют собой кремовые кристаллические вещества, растворимые в этаноле, уксусной кислоте, ДМСО, ДМФА и нерастворимые в воде.
В спектрах ЯМР1Н соединений (XIIIа-г) наряду с сигналами протонов метиленовых групп в положении 1 гетероцикла и ароматических протонов в положении 5 гетероцикла и боковой цепи наблюдается сигнал метинового протона в положении 5 гетероцикла при 5,54 – 5,49 м.д. и сигнал протонов NH2-группы при 12,11 – 11,15 м.д.
Все полученные соединения не дают реакции со спиртовым раствором хлорида железа III, что свидетельствует о замещении атома кислорода карбонильной группы в положении 3 гетероцикла. Данные спектров и отрицательная качественная реакция свидетельствуют о существовании соединений (XIIIа-г) в енаминной форме.
Образование соединений XIIIа-г, по-видимому, объясняется разложением мочевины до аммиака в условиях проведения реакции, который затем реагирует с пиррол-2,3-дионом.
Синтезированные нами 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-оны содержат при атомах С4 и С3 реакционоспособные карбонильные группы, которые, как было установлено ранее в ряду 3-пирролин-2-онов принимают участие в реакциях с бинуклеофильными реагентами и могут быть использованы в качестве исходных веществ для получения разнообразных конденсированных гетероциклических систем.
В связи с этим нами было изучено взаимодействие полученных соединений с гидразингидратом и было обнаружено, что при кипячении в ледяной уксусной кислоте эквимолярных количеств реагентов образуются 5-(5-карбоксипентил)-4-арил-3-метилпирроло [3,4-с]пиразол-6-оны (XIVв,г) и 5-(5-карбоксиалкил)-3,4-диарилпирроло[3,4-с]пиразол-6-оны (XIVа,б,д-з). Исходя из уже имеющихся литературных данных на первой стадии, очевидно, образуются соответствующий гидразон, который затем циклизуется в конденсированную систему пирроло[3,4-с]пиразола (XIVа-з).

XIVа-з
n = 1 (е), 3 (б,д), 5 (а,в,г,ж,з); R1 = С6Н5 (а,б,д,е), СН3 (в,г), 4-NО2-С6Н4 (ж), 4-Cl-С6Н4 (з); R2 = Н (а-в), 4-Cl-С6Н4 (г,д,ж), 2-Cl-С6Н4 (е), 4-F-С6Н4 (з)
Полученные соединения XIVа-з представляют собой бесцветные или желтоватые кристаллические вещества, растворимые в этаноле, ацетоне, ДМФА, ДМСО и нерастворимые в воде.
В спектрах ИК соединений ХIVг,д,е присутствуют полоса поглощения лактамной карбонильной группы при 1670 – 1690 см-1, поглощение, обусловленное карбонилом карбоксильной группы, при 1700 – 1710 см-1, а также полоса поглощения NH-группы при 3060 – 3125 см-1.
В спектрах ЯМР1Н полученных соединений XIVа-з присутствуют синглет метинового протона в положении 4 гетероцикла при 6,09 – 5,42 м.д., группа сигналов ароматических протонов при 7,43 – 7,29 м.д., синглет протона NH-группы в гетероцикле при 14,19 – 13,93 м.д.
5. Биологическая активность полученных соединений
Полученные соединения были изучены на наличие различной биологической активности.
Противомикробная активность изучалась на кафедре микробиологии Пермской государственной фармацевтической академии доцентом Ворониной Э.В., зав. кафедрой д.ф.н. Одегова Т.Ф.
Противомикробную активность определяли методом последовательных разведений раствора исследуемого соединения в мясопептонном бульоне (МПБ) и изучали активность по отношению к St. аureus и E. coli. Исследования показали, что в ряду 1,4,5-тризамещенных 3-гидрокси-3-пирролин-2-онов и их производных минимальная ингибирующая концентрация в отношении St. аureus и E. coli составляет от 62,5 до 1000 мкг/мл.
Варьирование заместителей в положениях 1,3,4,5 оказывает влияние на противомикробное действие соединений. У соединений, содержащих в 1 положении гетероцикла 2-карбоксиэтильный, 3-карбоксипропильный, 5-карбоксипентильный, этоксикарбонилметильный, метоксикарбонилметильный и другие заместители, наблюдается слабое противомикробное действие, МИК составляет 500 – 1000 мкг/кг в отношении St. аureus и E. coli. При введении в положение 1 карбоксиметильного заместителя противомикробная активность несколько повышается и составляет у некоторых соединений 250 – 500 мкг/кг в отношении St. аureus и E. coli. Введение в положение 1 аминокарбоксиметильного остатка способствует увеличению антимикробной активности, которая составляет 125 мкг/кг в отношении St. аureus и E. coli. 3-Ариламинопроизводные 3-пирролин-2-онов проявляют значительно меньшую активность в отношении штаммов St. аureus и E. coli по сравнению с исходными кислотами. Введение в положения 5 и 4 электронодонорных заместителей приводит к снижению активность. Кроме того, положение заместителя в ароматическом кольце также оказывает влияние на противомикробную активность соединений. Наиболее активными в отношении St. аureus и E. coli оказались соединения VIIIа,б.
| № соед. | Вид активности | |
| St. aureus | E. coli | |
| МИК, мкг/мл | МИК, мкг/мл | |
| I а | 250 | 500 |
| VI г | 250 | 250 |
| VIII а | 125 | 125 |
| VIII б | 125 | 125 |
| Х а | 250 | 250 |
| Х г | 500 | 500 |
| XI а | 250 | 250 |
| XI е | 250 | 250 |
| XI р | 500 | 500 |
| XI у | 250 | 250 |
| XII д | 500 | 500 |
| XIV д | 62,5 | 125 |
| Этакридина лактат | 2000 | 2000 |
| Ртути дихлорид | 1000 | 1000 |
Основываясь на результатах предварительного исследования антимикробной активности, можно сделать вывод, что соединения в целом обладают слабой антимикробной активностью, близкой к активности этакридина лактата и дихлорида ртути. Наибольшую активность проявили соединения, содержащие в структуре электроноакцепторные группы, что подтверждают уже установленные ранее факты связи структура – активность.
Острая токсичность, анальгетическая, противовоспалительная, диуретическая активность, миорелаксирущее и антиамнестическое действие, а также ориентировочно-исследовательское поведение изучались на кафедре фармакологии Пермской государственной фармацевтической академии асс. Шуклиной Н.В., Губановой М. С., зав. кафедрой проф. Юшков В.В.
Острую токсичность определяли по экспресс-методу Прозоровского В.Б. Исследования показали, что соединение XIIд относится к мало токсичным и умеренно опасным по классификации Сидорова. Все остальные соединения являются практически нетоксичными и мало опасными по классификации Сидорова, что делает их перспективными для биологических исследований.
Анальгетическое действие оценивали по модели термического раздражения (метод «горячая пластинка»). Также отслеживалась реакция хвоста на сжатие пинцетом. Исследования показали, что все испытанные соединения (IXв,и, XIо,р, XIIд) обладают в различной степени анальгетическим эффектом.
Соединения IXв, IXи, XIo, XIIд удлиняют время проявления оборонительного рефлекса достоверно по отношению к контролю, т.е. обладают слабым анальгетическим действием. Реакция на сжатие хвоста исчезает при введении соединений XIp, XIo, XIIд.
| № соед. | Исходное время рефлекса, сек. | Время оборонительного рефлекса, сек., через | |||
| 0,5 часа | 1 час | 2 часа | 3 часа | ||
| IX в | 10,0 ± 1,9 | 8,3 ± 1,8 | 12,0 ± 3,1* | 10,3 ± 1,3* | 10,0 ± 2,2 |
| IX и | 10,0 ± 0,01 | 9,6 ± 2,2 | 8,6 ± 1,4 | 8,3 ± 2,1 | 9,9 ± 0,25 |
| XI р | 8,3 ± 1,1 | 12,0 ± 1,5* | 10,6 ± 2,8* | 9,6 ± 2,1 | 9,6 ± 0,9 |
| XI о | 11,6 ± 2,1* | 12,6 ± 2,8* | 12,6 ± 2,9* | 10,3 ± 1,9* | 10,0 ± 1,1 |
| XII д | 9,6 ± 2,2 | 12,0 ± 3,9* | 9,0 ± 1,8* | 9,3 ± 4,9 | 8,6 ± 3,2 |
| Контроль | 7,8 ± 0,5 | 6,8 ± 0,9 | 5,0 ± 1,7 | 6,0 ± 0,7 | 7,0 ± 1,1 |
| Анальгин | 10,8 ± 0,70 | 15,4 ± 2,20 | 31,8 ± 2,40 | 24,0 ± 1,90 | 18,0 ± 3,10 |
* - достоверно отличается от контроля при р 0,05
О противовоспалительной активности соединений судили по выраженности воспалительной реакции через 1, 3 и 5 часов после моделирования патологического процесса (оценивали онкометрически по измерению объема воспаленной конечности). В результате проведенных исследований установлено, что соединениям IXв, IXи, XIIд, Vи, XIp, XIo присуще самостоятельное противовоспалительное действие. Такие соединения как IXв, Vи, XIp проявили выраженный противовоспалительный эффект на 3 и 5 часе наблюдения.
| № соед. | Доза в мг/кг | Процент торможения каррагенинового отека, через | ||
| 1 час | 3 часа | 5 часов | ||
| V ж | 50 | 0 | 15,8 | 16,5 |
| V и | 50 | 0 | 31,3* | 10,2 |
| IX в | 50 | 0 | 32,2* | 46,2*** |
| 100 | 0 | 16,8 | 9,8 | |
| IX ж | 50 | 0 | 0 | 0 |
| IX и | 50 | 52,0*** | 0 | 35,3** |
| XI к | 50 | 0 | 0 | 10,7 |
| XI а | 50 | 0 | 0 | 0 |
| XI е | 50 | 0 | 0 | 0 |
| XI у | 50 | 0 | 0 | 0 |
| XI р | 50 | 0 | 38,2** | 30,0* |
| XI о | 50 | 0 | 32,0*** | 16,3 |
| 100 | 32,8 | 36,6*** | 15,7 | |
| XII д | 50 | 25,3 | 7,2 | 57,5*** |
| Ортофен | 10 | 22,3 | 29,0 | 38,7 |
* - достоверно отличается от контроля при р 0,001
** - достоверно отличается от контроля при р 0,01
*** - достоверно отличается от контроля при р 0,05
На основании проведенных исследований можно сделать вывод о том, что соединения данного ряда обладают противовоспалительным действием, что свидетельствует о перспективности поиска среди них потенциально активных противовоспалительных средств.
Проведенные исследования на наличие мочегонного действия показали, что 3-бензоилметилен-5-(п-фторфенилметилен)-пиперазин-2,6-дион (IXж) обладает мочегонным действием.
| Серии опытов | Количество животных | Количество мочи, мл, через 5 часов | Количество мочи, мл, через 24 часа | Увеличение диуреза мл, за 19 часов |
| IX ж | 10 | 3,04 ± 0,64 | 9,12 ± 1,56 р < 0,001 | 6,08 ± 0,96 р < 0,001 |
| Контроль | 10 | 4,60 ± 0,80 | 6,88 ± 0,94 | 2,28 ± 0,24 |
Для оценки ориентировочно – исследовательского поведения использовали методику открытого поля (J.R. Bossier et al.). Соединения IXи, XIp снижают спонтанную двигательную активность мышей. Соединение XIp повышает тонус вегетативной нервной системы, о чем говорит появление горошин. Все соединения способствуют проявлению груминга.
| № соед. | Время выхода из центра,сек. | Количество вертикальных стоек | Количество полей | Количество отверстий | Количество горошин | Количество проявлений груминга |
| IX и | 8,6 ± 2,8 | 6,6 ± 5,1 | 33,3 ± 7,3* | 21,0 ± 3,3* | 0 | 3 ± 0,001* |
| XI р | 4,6 ± 2,8 | 8,6 ± 3,2 | 40,6 ± 13,9* | 34,3 ± 8,2 | 2 ± 0,01 | 5,6 ± 2,3* |
| Контроль | 5,6 ± 2,9 | 10 ± 3,2 | 72,0 ± 9,5 | 37,3 ± 5,9 | 0 | 0,7 ± 0,5 |
- - достоверно к контролю при р 0,05
Для оценки миорелаксирующего действия были использованы две модели: «вращающийся стержень» и рефлекс подтягивания на проволоке. В ходе исследования установлено, что достоверным миорелаксирующим действием обладает соединение XIp в течение 2 часов после перорального введения. Соединение IXи достоверно способствовало исчезновению рефлекса подтягивания у мышей только через 1 час после введения, не повлияв на способность мышей держаться на вращающемся стержне.
| № соед. | Количество мышей (в %), упавших со стержня (1) и без рефлекса подтягивания на проволоке (2), через | |||||||
| 0,5 часа после введения | 1 час после введения | 2 часа после введения | 3 часа после введения | |||||
| 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | |
| IX в | - | 33 ± 17,3 | - | 33 ± 17,3 | - | - | - | - |
| IX и | - | 33 ± 17,3 | - | 100* | - | 33 ± 17,3 | - | - |
| XI р | - | 66 ± 10,6* | 66 ± 10,6* | 100* | 66 ± 10,6* | 66 ± 10,6* | - | - |
| XI о | - | - | - | 33 ± 17,3 | 33 ± 17,3 | - | - | - |
| XII д | - | 33 ± 17,3 | - | 33 ± 17,3 | - | - | - | - |
| Контроль | - | - | - | - | - | - | - | - |
* - достоверно к контролю при р 0,05
Принимая во внимание некоторое структурное сходство синтезированных нами соединений с пирацетамом (ноотропил) проведено изучение степени выраженности антиамнестического действия у 9 веществ. Для оценки антиамнестического действия использовали методику психогенной амнезии, предложенной Л.В. Лоскутовой и Р.Ю. Ильюченком.
| № соед. | Количество животных | Первый день | Второй день | t, сек. | ||
| Время в темном отсеке, сек. | Процент крыс, зашедших в темный отсек | Время в темном отсеке, сек. | Процент крыс, зашедших в темный отсек | |||
| Ia | 10 | 161,8 | 100 | 113,2 | 80 | 46,8 |
| Iв | 10 | 159,3 | 100 | 145,9 | 100 | 14,6 |
| Iг | 10 | 169,2 | 100 | 159,5 | 100 | 9,7 |
| Iз | 5 | 163,7 | 100 | 136,6 | 90 | 27,1 |
| Ip | 5 | 163,8 | 100 | 152,3 | 100 | 11,5 |
| Vц | 5 | 166,4 | 100 | 22,6 | 40 | 139,6 |
| Vч | 5 | 139,0 | 100 | 9,8 | 40 | 129,2 |
| Vш | 10 | 163,4 | 100 | 39,8 | 60 | 123,6 |
| Vщ | 10 | 165,8 | 100 | 17,0 | 20 | 149,4 |
| Контроль | 20 | 159,7 | 100 | 139,1 | 100 | 20,6 |
| Пирацетам | 15 | 161,7 | 100 | 31,5 | 40 | 130,2 |
Полученные данные свидетельствуют о том, что соединения, содержащие в положении 1 гетероцикла карбоксиметильные группы (Iа,в,г,з,р), практически не обладают ноотропной активностью. Соединения, содержащие в положении 1 гетероцикла остаток аминокапроновой кислоты (Vц,ч,ш,щ), показали антиамнестическое действие на уровне ноотропила.
Выводы
- Установлено, что взаимодействие метиловых эфиров ацилпировиноградных кислот со смесью ароматического альдегида и аминокарбоновой кислоты приводит к образованию 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов.
- При использовании в качестве аминокомпоненты гидрохлорида метилового и этилового эфира гликокола образуются 5-арил-4-ацил-3-гидрокси-1-метоксикарбонил-3-пирролин-2-оны и 5-арил-4-ацил-3-гидрокси-1-этоксикарбонил-3-пирролин-2-оны соответственно.
- При взаимодействии эфира ацилпировиноградной кислоты со смесью ароматического альдегида и глицинамида гидрохлорида были получены 1-аминокарбонилметил-5-арил-4-ацил-3-гидрокси-3-пирролин-2-оны и 3-бензоилметилен-5-арилметилен-пиперазин-2,6-дионы.
- 5-Арил-4-ацил-3-гидрокси-1-(3-метоксикарбонил-2-фенилпропил)-3-пирролин-2-оны были получены реакцией этерификации соответствующих 5-арил-4-ацил-3-гидрокси-1-(3-карбокси-2-фенилпропил)-3-пирролин-2-онов.
- Установлено, что взаимодействие 1-замещенных 5-арил-4-бензоил-3-гидрокси-3-пирролин-2-онов с ароматическими аминами приводит к 3-ариламинозамещенным 3-пирролин-2-онам.
- При использовании в качестве исходных соединений 5-арил-4-ацетил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов в реакциях с ароматическими аминами атака нуклеофильного реагента переносится на карбонильную группу боковой цепи, о чем свидетельствует образование в качестве единственного продукта 5-арил-4-(1-ариламиноэтилиден)-1-карбоксиалкилтетрагидропиррол-2,3-дионов. Строение последних доказано на основании данных РСА.
- Сплавление эквивалентных количеств 3-пирролин-2-онов с мочевиной при температуре 190 – 2000 С приводит к 3-амино-4-бензоил-1-карбоксиалкил-5-фенил-3-пирролин-2-онам.
- Показана возможность формирования гетероциклической системы пирроло[3,4-с]пиразола на основе реакции взаимодействия 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов с гидразингидратом.
- Фармакологическому скринингу подвергнуто 48 соединений, среди которых были найдены вещества с антиамнестической, анальгетической, противовоспалительной активностью, а также мочегонным и миорелаксантным действием, сравнимым с активностью препаратов, применяемых в медицине.
Основное содержание диссертационной работы опубликовано в работах:
- «Трехкомпонентный синтез 3-бензоилметилен-5-арилметиленпиперазин-2,6-дионов» / В.Л. Гейн, Л.Ф. Гейн, И.А. Шевченко // Журнал общей химии – 2003.- Т. 73. Вып. 4. С. – 700.
- «Взаимодействие 5-арил-4-ацетил-3-гидрокси-1 карбоксиалкил-3-пирролин-2-онов с ароматическими аминами. Структура полученных соединений» / И.А. Кылосова, Л.Ф. Гейн, В.Л. Гейн, Н.Ф. Ракшина, В.В. Юшков, З.Г. Алиев // «Вестник ПГФА». г. Пермь. 2007 г. № 2. С. 152 – 154.
- «Синтез и антиамнестическое действие 1-замещенных 4-ацил- и 4-метилсульфонил-5-арил-3-гидрокси-3-пирролин-2-онов» / В.Л. Гейн, И.А. Шевченко [и др.] // «Актуальные проблемы фармацевтической науки». г. Пермь. 2000 г. ПГФА. С. 98.
- «Синтез 5-арил-4-ароил-3-гидрокси-1-карбоксиалкил-3-пиролин-2-онов и их взаимодействие с ариламинами» / В.Л. Гейн, И.А. Шевченко [и др.] // Там же. С. 80.
- «Синтез и противомикробная активность 5-замещенных 4-ацил-3-гидрокси-2,5-дигидрофуран-2-онов» / И.А. Шевченко, Э.В. Воронина, В.Л. Гейн, // Тезисы докладов VII Российского национального конгресса «Человек и лекарство». г. Москва. 2000 г. С. 485-486.
- «Взаимодействие тетрагидропиррол-2,3-дионов с бинуклеофильными реагентами» / В.Л. Гейн, Л.Ф. Гейн, И.А. Шевченко // Тезисы межвузовской научно-практической конференции, посвященной 85-летию высшего образования на Урале. г. Пермь. 2001 г. С. 66.
- «Взаимодействие эфиров ацилпировиноградных кислот со смесью глицинамида с ароматическими альдегидами» / И.А. Шевченко, В.Л. Гейн, Л.Ф. Гейн, В.В. Юшков [и др.] // Там же. С 68.
- «Трехкомпонентный синтез 3-бензоилметилен-5-арилметиленпиперазин-2,6-дионов» / В.Л. Гейн, Л.Ф. Гейн, И.А. Шевченко // Тезисы V молодежной научной школы-конференции по органическому синтезу. г. Екатеринбург. 2002 г. С. 88.
- «Синтез и противомикробная активность 1,4,5-тризамещенных 3-гидрокси-3-пирролин-2-онов и их 3-ариламинопроизводных» / И.А. Шевченко, Э.В. Воронина, В.Л. Гейн, // Тезисы 67 межвузовской научной конференции студентов и молодых ученых. г. Курск. 2002 г. С. 163-164.
- «Синтез производных 1,4,5-тризамещенных 3-гидрокси-3-пирролин-2-онов» / И.А. Шевченко, Шептуха М.А., В.Л. Гейн [и др.] // Тезисы III молодежной школы-конференции по органическому синтезу «Органический синтез в новом столетии». г. Санкт-Петербург. 2002 г. С. 111а.
- «Взаимодействие 3-пирролин-2-онов с этилендиамином и о-фенилендиамином» / В.Л. Гейн, Л.Ф. Гейн, И.А. Шевченко // Тезисы межвузовской научно-практической конференции «ВУЗы и регионы». г. Пермь. 2002 г. С. 41 – 42.
- «Изучение влияния заместителей на константы ионизации 1,4,5-тризамещенных 3-гидрокси-3-пиррлин-2-онов» / В.Л. Гейн, И.А. Шевченко [и др.] // Материалы российской научно-практической конференции «Рациональное использование Лекарств». г. Пермь. 2004 г. С. 19 – 20.

