Методологические аспекты разработки технологии твердых быстрорастворимых лекарственных форм
На правах рукописи
Шевченко Александр Михайлович
Методологические аспекты разработки технологии твердых быстрорастворимых
лекарственных форм
15.00.01 – Технология лекарств и организация фармацевтического дела
Автореферат
на соискание ученой степени доктора фармацевтических наук
Пятигорск – 2009
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Пятигорская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию»
Научный консультант:
- доктор фармацевтических наук, профессор.
Степанова Элеонора Федоровна
Официальные оппоненты:
- доктор фармацевтических наук, профессор Демина Наталья Борисовна, I ММА им. И.М.Сеченова (г. Москва)
- доктор фармацевтических наук, профессор
Гузев Константин Сергеевич, ООО «Ретиноиды» (г. Москва)
- доктор фармацевтических наук, профессор
Егорова Светлана Николаевна, Казанский государственный медицинский университет.
Ведущая организация: ГОУ ВПО «Башкирский ГМУ Росздрава»
Защита состоится «12» октября 2009 г. в ____ часов на заседании диссертационного совета Д 006.070.01 при Всероссийском научно-исследовательском институте лекарственных и ароматических растений (ВИЛАР) РАСХН по адресу: 117216, Москва, Грина, 7.
С диссертацией можно ознакомиться в библиотеке ВИЛАР по адресу: 117216, Москва, Грина, 7.
Автореферат разослан «______» ________________ 2009 г.
Ученый секретарь
диссертационного совета
Д 006.070.01
д.фарм.н. А.И. Громакова
Общая характеристика работы
Актуальность проблемы. Одной из наиболее важных задач современной фармацевтической технологии является создание лекарственных форм, способствующих повышению биологической доступности лекарственных средств. Это достигается различными способами, среди которых можно выделить использование специальных вспомогательных веществ (газообразующих смесей, супердезинтегрантов, комплексообразователей, солюбилизаторов) и технологических приемов (получение твердых дисперсий, УЗ- и криомикронизация), повышающих растворимость или диспергируемость лекарственных компонентов. Среди группы быстрорастворимых лекарственных форм особое место принадлежит шипучим препаратам, в которых эффект быстрой дезинтеграции достигается за счет введения газообразующих компонентов. К преимуществам быстрорастворимых лекарственных форм следует отнести высокую биологическую доступность, возможность снижения побочных реакций, совмещения взаимореагирующих компонентов и корригирования неприятных органолептических свойств лекарственных веществ.
Общий рост номенклатуры быстрорастворимых лекарственных препаратов, зарегистрированных в России, в последнее время наблюдался в основном за счет импортных поставок. Это связано с тем, что их создание требует не только специальной технологии и оборудования, но и разработки единой методологии производства. В то же время в России появились возможности решения указанной проблемы благодаря развитию производственной базы фармацевтических заводов, расширения номенклатуры вспомогательных веществ. Проведены исследования по отдельным группам лекарственных препаратов (Галиуллина Т.Н., 2003). Однако в расширении производства и номенклатуры шипучих лекарственных форм имеется ряд нерешенных вопросов. Несмотря на кажущуюся близость по форме, шипучие таблетки и гранулы значительно отличаются от традиционных по составу и сущности технологии, так как основными их составляющими являются газообразующие компоненты. Учитывая это, наиболее актуальным направлением становится теоретическое обоснование и разработка практических рекомендаций по выбору оптимального состава вспомогательных веществ, в том числе газообразующих компонентов, антиадгезионных добавок, стабилизаторов, корригентов. Важными аспектами, требующим теоретического обоснования, являются разработка способов обеспечения стабильности газообразующих смесей, а также возможности введения лекарственных веществ в лекарственную форму в зависимости от их физико-химических свойств. Эти способы должны соответствовать главному требованию: сохранять стабильность лекарственных веществ, и, следовательно, их терапевтическую активность. Кроме того, существующие технологические подходы к созданию быстрорастворимых «нешипучих» таблеток (т.н. диспергируемых, ородисперсных и др.) не всегда могут быть успешными, так как не учитывают многогранности их состава и направленности фармакологического действия. В связи с этим возникает необходимость разработки интеграционной оценки технологических параметров масс для таблетирования. Решение настоящих задач позволит разработать единый методологический подход к технологии быстрорастворимых лекарственных препаратов, способствующий расширению их номенклатуры. В первую очередь это касается сердечно-сосудистых, спазмолитических, отхаркивающих, актопротекторов, влияющих на ЦНС, а также лекарственных препаратов других групп, фармакологический эффект которых должен быть наиболее полным и незамедлительным. Существенно могут расширить номенклатуру быстрорастворимых лекарственных форм композиции на основе БАВ растений, солевые комплексы минеральных вод и их сочетания. Все это свидетельствует о том, что разработка методологии создания быстрорастворимых лекарственных форм является актуальной проблемой фармацевтической науки и практики. Ее решение позволит внедрить в производство современные высокоэффективные лекарственные средства, значительно расширить их номенклатуру, обогатить современное фармацевтическое производство новыми технологиями и оборудованием.
Цель настоящих исследований заключается в разработке методических основ создания быстрорастворимых лекарственных форм, обеспечивающих стабильность лекарственных веществ, оптимальные условия газообразования, заданное время растворения, необходимый уровень корригирования, апробации этих подходов на моделях лекарственных средств с различными физико-химическими свойствами и внедрении в фармацевтическую практику.
Для реализации поставленной цели необходимо было выполнить следующие задачи:
- Исследовать механизм и кинетику взаимодействия сухих органических кислот с карбонатами и гидрокарбонатами щелочных и щелочноземельных металлов в шипучих лекарственных формах и выявить условия стабильности их смесей.
- Изучить свойства газообразующих смесей и предложить расчеты их оптимального состава в шипучих таблетках и гранулах, а также оптимальную технологию производства гранулятов.
- Выяснить влияние различных технологических характеристик гранулятов на качество шипучих таблеток.
- На основании методики дисперсионного анализа разработать способ построения единого обобщённого показателя качества, при котором несколько наиболее значимых откликов объединяется в единый количественный признак.
- Разработать способ выбора оптимального состава быстрорастворимых диспергируемых, ородисперсных таблеток, таблеток с модифицированным высвобождением (типа «рапид»), основанный на интеграционной балльной оценке технологических параметров масс для таблетирования.
- Обосновать достоверную методику выбора корригентов для шипучих лекарственных форм, основанную на расчете коэффициента конкордации.
- На основании выявления общих закономерностей выбора вспомогательных веществ и технологических приемов предложить общую методологическую схему создания быстрорастворимых лекарственных форм.
- Реализовать разработанные методологические подходы на моделях быстрорастворимых гранул и таблеток с различными БАВ: актопротекторами, гастропротекторами, включающими солевые комплексы минеральных вод, фитоминеральные комплексамы, спазмолитиками, аминогликанами, флавоноидами.
- Провести необходимые биофармацевтические исследования, направленные на доказательство преимуществ использования предложенных моделей в быстрорастворимых лекарственных формах.
- Разработать методики, необходимые для стандартизации предложенных лекарственных препаратов и определить их стабильность.
- Определить фармакологическую активность, острую и хроническую токсичность предложенных лекарственных препаратов и парафармацевтических средств.
- Разработать НД на полученные лекарственные препараты и провести работу по их внедрению.
Научная новизна и теоретическая значимость. В результате исследований разработана единая методология создания быстрорастворимых лекарственных форм, включающая два основополагающих вопроса. Первый – разработана концепция создания стабильных основообразующих смесей (газообразующих, солюбилизирующих, дезинтеграционных). Второй – разработаны принципы включения в указанные смеси лекарственных веществ с различными физико-химическими свойствами, а также выбора необходимых вспомогательных веществ, обеспечивающих комплексные условия газообразования, растворения, стабильности и соответствующие вкусовые качества.
- Для характеристики стабильности газообразующих смесей изучена кинетика потери их массы за счет выделения углерода диоксида в зависимости от размера частиц и используемых пленкообразователей. Определено значение скорости процесса и ее константа.
- Разработаны методы расчета оптимального количества газообразующих смесей, включаемых в лекарственные формы, для характеристики которых впервые введены коэффициенты газообразования и газонасыщения
- Установлены оптимальные параметры процесса производства шипучих таблеток, обеспечивающие соответствие предъявляемым к ним специфическим требованиям: давление прессования, состав и количество антиадгезионных добавок, а также условия производства (температура, влажность воздуха).
- Обоснованы способы введения лекарственных веществ в газообразующие смеси в зависимости от их физико-химических свойств и агрегатного состояния (раздельный, совместный или комбинированный способы грануляции).
- Предложена унифицированная методика оценки органолептических свойств быстрорастворимых таблеток и гранул, достоверность которой основана на определении коэффициента конкордации.
- Изучены технологические характеристики газообразующих смесей, на основании которых с помощью математического планирования эксперимента получены линейное и неполное квадратичное уравнения регрессии, показывающие зависимость технологического качества шипучих таблеток от основных параметров гранулята и позволяющие прогнозировать оптимальные значения частных параметров.
- Проведенные методологические исследования обобщены в виде блок-схемы разработки технологии шипучих таблеток и гранул.
- Впервые разработан оригинальный лекарственный препарат – быстрорастворимые таблетки дротаверина гидрохлорида, позволяющие повысить скорость наступления спазмолитического эффекта в 2 раза по сравнению с обычными таблетками.
- Разработан способ выбора оптимального состава быстрорастворимых диспергируемых, ородисперсных и таблеток-рапид, основанный на интеграционной балльной оценке технологических параметров масс для таблетирования и использовании критерия оптимальности БОФа.
- Использование современных вспомогательных веществ и методов производства быстрорастворимых таблеток глюкозамина гидрохлорида позволило значительно упростить технологический процесс, повысить их биологическую доступность и уменьшить раздражающее влияние на стенки желудка.
- Разработанные методологические подходы реализованы при создании новых видов быстрорастворимых таблетируемых и гранулируемых БАД к пище: шипучих гранул и таблеток с адаптогенами и витаминами, шипучих солевых комплексов минеральных вод, шипучих фитоминеральных комплексов, флавоноидами.
Практическая значимость работы и внедрение результатов исследований.
По результатам комплексных лабораторных и опытно-промышленных исследований разработана и утверждена нормативная документация для организации промышленного производства серии быстрорастворимых лекарственных форм и парафармацевтических средств, показана их производственная значимость, возможность внедрения и масштабирования предложенных технологий:
- шипучих таблеток дротаверина гидрохлорида (составлены ФСП, опытно-промышленный регламент ОПР 46351058-36-2006, отчет о доклинических исследованиях для предприятия «Центрально-Европейская фармацевтическая компания» г. Москва, акт внедрения от 3.11.06);
- таблеток глюкозамина гидрохлорида по 0,3 г (составлен промышленный регламент ПР 01899876-Т-19, утверждена ФСП 42-0068-2823-02 и получено регистрационное удостоверение Р №003621/01, товарное название «Аминоартрин» для ОАО «Московская фармацевтическая фабрика»);
- солевого комплекса минеральной воды «Ессентуки №17» в виде шипучих гранул и таблеток, на основании которого производится минерализованная вода “Бонус” (г. Славянск-на-Кубани, ООО «Бонус», акт внедрения от 10.10.2000 г.). Утверждены на региональном уровне ТУ и ТИ на шипучие гранулы “Гипресс” №4 с солевым комплексом “Ессентуки” №4 и настойкой зверобоя;
- шипучих таблеток “Гастрослав”, включающих солевой комплекс воды “Славяновская” и комплексный экстракт из коры крушины, цветков ромашки, календулы и травы тысячелистника, внедряемых на предприятии “Максфарм” г. Рязань (акт внедрения от 3.11.06). Указанный комплексный экстракт использован в составе раствора для приема внутрь «Гастрофит», разработанного для ОАО «Фармстандарт-Лексредства» (г. Курск), на который утверждена ФСП 42-00332671-02 и получено регистрационное удостоверение (Р №002416/01-2003);
- проведены наработки опытных партий шипучих таблеток «Бромгексин» (ОАО «Сантэфарм», г. Копейск, Челябинской обл., июнь 2003), «Дротаверина гидрохлорид, 0,04»;
- разработаны ТУ и ТИ на шипучие гранулы “Элесан”, “Родосан”, “Схизавит”, “Гиперовит”, утвержденные на региональном уровне. Технология шипучих гранул “Элесан” апробирована в заводских условиях (Георгиевский биохимический завод, акт апробации от 25.07.1996 года, Тюменский ХФЗ, июнь 2003);
- получены акты о выпуске опытных партий шипучих гранул «Родосан» (ICN-Полифарм, г. Челябинск, июнь 2003), «Панаксовит» (Екатеринбургская фарм. фабрика, июнь 2003).
- разработаны ТУ и ТИ на быстрорастворимые в полости рта таблетки «Биофлавит» и получен акт внедрения (ООО «Биотехнология-07», г.Нальчик, февраль 2009)
Апробация работы и публикаци.
Основные положения диссертационной работы представлены на международных съездах «Актуальные проблемы создания лекарственных препаратов природного происхождения» (г. Великий Новгород, г. Санкт-Петербург, г. Пушкин, г. 2000 – 2003 г.), на Международных конференциях: «Теорiя i практика створення лiкарских препаратiв» (Харьков, 1996), «Естествознание на рубеже столетий» (Дагомыс, 2001), на национальном конгрессе «Человек и лекарство» (2000, 2004), на Всероссийских научно-практических конференциях: «Химия в технологии и медицине» (Махачкала; сентябрь 2002), «Современные принципы и технологии разработки лекарственных средств» (28.02-1.03.2006, г. Москва), Втором Всероссийском съезде фармацевтических работников (5-7 июня 2005 г.; Сочи), на общероссийской научной конференции «Новейшие технологические решения и оборудование» (г. Кисловодск, 19-21 апреля 2004 г.), на региональных научно-практических конференциях по фармакологии и фармации (г. Пятигорск, 1990-2009 г.)
Основное содержание диссертации представлено в 39 публикациях, из них 1 авторское свидетельство, 2 патента, 9 статей в изданиях, рекомендуемых ВАК. Всего по теме диссертации опубликовано 71 печатная работа, 11 работ опубликовано без соавторов.
На защиту выносятся:
- Результаты разработки алгоритма создания быстрорастворимых лекарственных форм.
- Результаты оценки стабильности гранулятов для шипучих таблеток, основанные на определении критической скорости потери массы за счет выделения углерода диоксида.
- Результаты выбора состава и количества газообразующих компонентов на основе определения коэффициентов газообразования и газонасыщения.
- Результаты выбора состава корригентов, основанные на оценке органолептических свойств по девятибалльной шкале и оценке согласованности мнений экспертов путем расчета коэффициента конкордации.
- Результаты расчета обобщенного критерия технологического качества шипучих таблеток.
- Результаты обоснования состава быстрорастворимых «нешипучих» таблеток (диспергируемых, ородисперсных и таблеткок типа «рапид»), основанные на расчете средневзвешенных оценок технологических показателей модельных гранулятов и использовании критерия оптимальности БОФа.
- Результаты исследований технологических особенностей производства и контроля качества шипучих таблеток дротаверина гидрохлорида, быстрорастворимых таблеток глюкозамина гидрохлорида, шипучих таблеток и гранул с адаптогенами и витаминами («Элесан», «Панаксовит», «Родосан»), солевыми комплексами минеральных вод («Ессентуки», «Славяновская»), фитоминеральными комплексами («Гипресс №4», «Гастрослав»), лингвальных быстрорастворимых таблеток «Биофлавит».
- Итоги внедрения результатов исследований в фармацевтическую практику.
Связь задач исследования с проблемным планом научно-исследовательских работ Пятигорской государственной фармацевтической академии. Диссертационная работа выполнена в соответствии с планом научно – исследовательских работ Пятигорской государственной фармацевтической академии (номер государственной регистрации 01200101058) в рамках проблемы «Фармация».
Объем и структура диссертации. Диссертация изложена на 311 страницах машинописного текста и состоит из восьми глав: обзора литературы, объектов и методов исследования, 6 глав собственных исследований, общих выводов, списка литературы и приложений. Работа иллюстрирована 100 таблицами, 35 рисунками. Библиографический список включает 288 литературных источников, в том числе 66 иностранных.
Основное содержание работы
1 Объекты, материалы и методы исследования
В работе были использованы лекарственные и вспомогательные вещества, отвечающие требованиям действующей нормативной документации.
Все технологические процессы осуществляли на лабораторном и технологическом оборудовании: просев на ручных ситах, сушку - в лабораторных шкафах, грануляцию - на грануляторе типа 3027 или под вакуумом на роторном испарителе ИР-1М, снабженном форсункой для введения увлажняющих растворов, измельчение - на мельнице РМ-1, таблетирование - на таблеточной машине РТМ-12, оснащенной специальным пресс-инструментом. Необходимые реологические, технологические и структурно-механические характеристики порошков (фракционно-дисперсный состав, сыпучесть и угол естественного откоса, насыпную массу, прочность таблеток на радиальное сжатие, давление прессования, силу и давление выталкивания) определяли по известным методикам. Предельное напряжение сдвига увлажненных таблеточных масс определяли с помощью конического пластомера (пенетрометра) КП-3.
Посторонние примеси и продукты разложения определяли методом высокоэффективной жидкостной хроматографии на жидкостном хроматографе «Милихром А-02» и с помощью тонкослойной хроматографии на пластинах «Силуфол» или «Сорбфил» с просмотром при УФ-облучении в диапазоне 254 нм. Определение содержания диоксида углерода проводили с помощью аппарата Читтика (Chittick).
Определение биологической доступности разработанных лекарственных форм проводили на лабораторных животных (крысах, мышах и кроликах). Концентрацию действующего вещества в сыворотке крови определяли методом высокоэффективной жидкостной хроматографии и спектрофотометрически. Вычисление степени биологической доступности и других констант фармакокинетики осуществляли методами, описанными в литературе.
Доклиническое изучение разработанных лекарственных форм (острая, хроническая или субхроническая токсичность, специфическая активность, аллергизуемость и др.) осуществляли в соответствии с требованиями Фармакологического государственного комитета МЗ СССР и МЗСР РФ.
2 Исследование общих закономерностей процесса гранулирования и таблетирования шипучих быстрорастворимых лекарственных форм
Шипучие таблетки и гранулы включают до 10 различных групп вспомогательных веществ (солюбилизаторы, комплексообразователи, корригенты запаха, цвета и вкуса, наполнители, связывающие, антиадгезионные добавки, пеногасители, стабилизаторы, «внутренние дегидратанты» и др). В связи с этим выбор состава является чрезвычайно сложной задачей и должен преследовать цель: достижение максимальной биологической доступности и стабильности лекарственных веществ. Основными компонентами шипучих лекарственных форм являются газообразующие, составляющие до 95% и более общей массы всей композиции. Это оправдано тем, что в основном за счет газообразующих компонентов достигается повышение растворимости и ускорение всасывания действующих веществ. Поэтому изучение физико-химических и технологических характеристик газообразующих систем, выбор условий введения лекарственных веществ и их максимальной стабильности позволит определить общие закономерности получения шипучих лекарственных форм.
Для изучения условий стабильности газообразующих смесей исследовали кинетику процесса взаимодействия сухих порошков и гранул кислоты лимонной безводной (КЛ) и натрия гидрокарбоната (НГК) при хранении в естественных условиях (относительная влажность воздуха 60%, температура 200С). Наиболее простым и точным способом оценки происходящего взаимодействия явилось определение потери массы за счет выделения диоксида углерода (M). Вначале изучалась зависимость потери массы в процессе хранения газообразующих смесей от степени измельчения ингредиентов, затем - от использования различных способов грануляции (совместной или раздельной) и состава связующих растворов ВМВ.
Для анализа зависимости потери массы газообразующих смесей от времени хранения был проведен расчет на персональном компьютере с использованием программы Statistika (Regress). Графически эти данные выглядят следующим образом (рисунок 1).
При этом в той же программе вычислены значения зависимостей M от времени Т:
Фракция 1 (менее 0,25мм):
Mi = 0,005 + 0,04Ti 3,536104Ti2 3,819106Ti3 + 8,53108Ti4 4,0061010Ti5
Фракция 2 (0,25-0,5мм):
Mi = 0,003 + 0,031Ti 1,588104Ti2 4,68106Ti3 + 7,92108Ti4 3,0451010Ti5
Фракция 3 (0,5-1мм):
Mi = 0,002 + 0,015Ti + 2,116104Ti2 6,668106Ti3 + 4,793108Ti4 9,6151011Ti5
Фракция 4 (1-2мм):
Mi = 0,001 + 0,01Ti 4,566104Ti2 8,625107Ti3 + 1,369108Ti4 +1,2821010Ti5
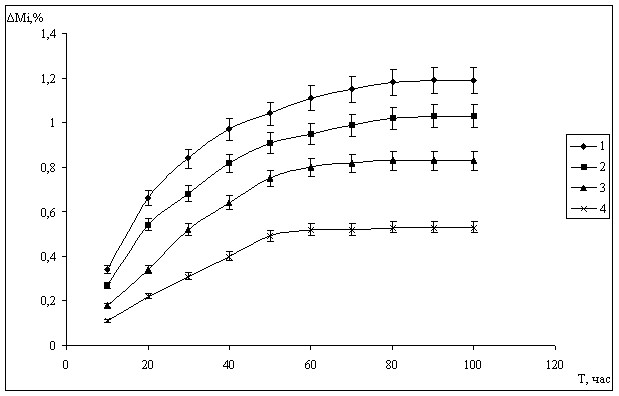
Рисунок 1 - Кинетика потери массы смесей КЛ и НГК различной степени измельчения за счет выделения диоксида углерода (1- менее 0,25мм; 2 – 0,25-0,5мм; 3 – 0,5-1мм; 4 - 1-2мм)
Как следует из рисунка 1, кинетические кривые потери массы находятся в полиномиальной зависимости от времени хранения. Процесс стабилизируется при пассивации поверхности кристаллов лимонной кислоты за счет образования слоя цитрата натрия. При этом скорость реакции обратно пропорциональна размеру частиц, что также следует из рисунка 1
Процессом пассивации можно и необходимо управлять путем выбора условий проведения реакции и введения вспомогательных веществ – пленкообразователей (растворов ВМВ).
В данном случае скорость реакции пропорциональна полиному изменения массы за промежуток времени Т:
![]() (2.1)
(2.1)
При этом кажущаяся константа скорости будет равна:
![]() (2.2)
(2.2)
Чтобы проверить, является ли указанное соотношение истинным, был проведен расчет констант скорости при всех значениях М. При этом оказалось, что величины констант неравнозначны и уменьшаются с увеличением времени экспозиции и размера частиц. Однако, на первых этапах взаимодействия, когда зависимость потери массы от времени имеет линейный характер, они имеют близкие значения для частиц определенной степени мелкости. Константа скорости указанной реакции второго порядка зависит от времени полупревращения или в данном случае времени полустабилизации системы. В действительности, в этот период скорость реакции имеет линейный характер. Для оценки происходящего взаимодействия период полустабилизации наиболее важен. Расчет среднего времени полустабилизации, согласно исходным данным рисунка 1, показал, что для всех степеней измельчения кислоты лимонной оно находится в пределах 17,5 – 24,09 часа. Для преобладающей фракции (71,4%) с размером частиц 0,25-0,5 мм, оно равно 19,07 ч или 6,86·104 с. Константа скорости реакции, рассчитанная по вышеуказанному уравнению, равна при этом 7,54-8 с-1.
Потеря массы М1/2 течение периода полустабилизации системы 6,86·104 с, согласно данным рисунка 1, равна 0,51%. Скорость реакции при этом будет следующей:
v=k·М1/2=7,54-8 с-1 · 0,51%=3,85·10-8 (%с-1) (2.3)
Рассчитанная скорость потери массы может служить критерием оценки стабильности гранулятов для шипучих таблеток и гранул как лекарственных форм.
Для оценки стабилизирующей способности различных ВМВ при совместном и раздельном способах получения гранулятов проводили расчет скорости потери массы за счет выделения диоксида углерода, а также контролировали время растворения гранулятов и качество получающихся растворов. Результаты приведены в таблице 1. Из таблицы 1 следует, что максимальная стабильность гранулятов достигается при использовании спиртовых растворов шеллака и коллидона 90 при обоих способах грануляции, однако время их растворения и качество получающихся растворов были неудовлетворительны.
Для более полной сравнительной оценки различных способов грануляции с помощью различных ВМВ необходимо было изучить газообразующие свойства гранулятов. При этом возможны варианты медленного газообразования за счет малорастворимого покрытия и быстрого, но при этом недостаточного газонасыщения. Для оценки этого процесса нами введены коэффициенты газообразования и газонасыщения. Коэффициент газообразования – это отношение массовой доли выделившегося диоксида углерода МЭ к теоретически возможному МТ:  , характеризует степень реагирования газообразующей смеси в процессе производства и хранения. Коэффициент газонасыщения – отношение массовой доли диоксида углерода в полученном растворе МР к массовой доле его в шипучей таблетке Мэ:
, характеризует степень реагирования газообразующей смеси в процессе производства и хранения. Коэффициент газонасыщения – отношение массовой доли диоксида углерода в полученном растворе МР к массовой доле его в шипучей таблетке Мэ: ![]() характеризует фактическое насыщение раствора диоксидом углерода. Для определения диоксида углерода в шипучих лекарственных формах использовали метод Читтика, согласно которому фиксируется его объем, вытесненный из лекарственной формы под воздействием раствора серной кислоты, далее по специальным таблицам рассчитывается массовая доля диоксида углерода в лекарственной форме. Результаты определения указанных коэффициентов при использовании совместного и раздельного способа грануляции и различных ВМВ также приведены в таблице 1.
характеризует фактическое насыщение раствора диоксидом углерода. Для определения диоксида углерода в шипучих лекарственных формах использовали метод Читтика, согласно которому фиксируется его объем, вытесненный из лекарственной формы под воздействием раствора серной кислоты, далее по специальным таблицам рассчитывается массовая доля диоксида углерода в лекарственной форме. Результаты определения указанных коэффициентов при использовании совместного и раздельного способа грануляции и различных ВМВ также приведены в таблице 1.
Таблица 1 – Оценка способов приготовления гранулятов и эффективности использования различных ВМВ
| Наименование увлажняющего раствора ВМВ | Способ гранулирования | ||||||||||||||||
| Совместный | Раздельный | ||||||||||||||||
| v, % / с1 | Время раство-рения, с | Качество раствора* | Кг/о | Кг/н | v, % / с1 | Время раство-рения, с | Качество раствора* | Кг/о | Кг/н | ||||||||
| Р-р ПВП с/м 10% спиртовый | 2,4· 10-8 | 20 | +++ | 0,78 | 0,54 | 2,9· 10-8 | 24 | +++ | 0,82 | 0,57 | |||||||
| Р-р коллидона 25 10% спиртовый | 2,1· 10-8 | 17 | +++ | 0,80 | 0,55 | 2,7· 10-8 | 20 | +++ | 0,83 | 0,60 | |||||||
| Р-р коллидона 30 10% спиртовый | 1,8· 10-8 | 24 | ++ | 0,82 | 0,57 | 2,4· 10-8 | 28 | ++ | 0,85 | 0,62 | |||||||
| Р-р коллидона 90 5% спиртовый | 1,0· 10-8 | 62 | – | 0,91 | 0,57 | 1,1· 10-8 | 70 | – | 0,93 | 0,61 | |||||||
| Р-р шеллака 5% спиртовый | 0,7· 10-8 | 115 | – – | 0,94 | 0,60 | 0,9· 10-8 | 122 | – – | 0,96 | 0,64 | |||||||
| Р-р ПВС 16/05 5% водный | - | - | - | - | - | 6,5· 10-8 | 24 | + | 0,63 | 0,42 | |||||||
| Р-р МЦ-16 3% водный | - | - | - | - | - | 10,9·10-8 | 20 | ++ П | 0,54 | 0,47 | |||||||
| Р-р Na-КМЦ 3% водный | - | - | - | - | - | 4,8· 10-8 | 22 | ++ П | 0,57 | 0,49 | |||||||
| Р-р колликута (МАЕ 100 Р) 10% спиртовый | 1,3· 10-8 | 45 | + | 0,87 | 0,52 | 1,5· 10-8 | 55 | + | 0,90 | 0,56 | |||||||
| Р-р плаздона (S 630) 10% спиртовый | 2,2· 10-8 | 15 | +++ | 0,83 | 0,61 | 2,6·10-8 | 18 | +++ | 0,86 | 0,64 | |||||||
| Контроль: смесь НГК и КЛ (1,3:1) без увлажнения | 3,85·10-8 | 12 | +++ | 0,96 | 0,72 | 3,85 ·10-8 | 12 | +++ | 0,96 | 0,72 | |||||||
| *Примечание: +++ раствор прозрачен, без осадка; ++ легкая опалесценция; + опалесценция; | – мутность; – – легкая хлопьевидная взвесь; – – – хлопьевидная взвесь, осадок П – пенообразование при растворении | ||||||||||||||||
Из таблицы 1 следует, что грануляты, приготовленные раздельным способом, обладали более высокой газообразующей способностью, чем при совместном гранулировании. Более высокие результаты получены при использовании спиртовых растворов коллидона 90, шеллака и колликута. Однако, коэффициенты газонасыщения при использовании этих ВМВ оставались относительно небольшими, что связано с гидофобизацией поверхности гранул, всплыванием на поверхность растворов и выделением СО2 в атмосферу. Сопоставление результатов таблицы 1 показывает, что наиболее приемлемые результаты по совокупности показателей получены при совместной грануляции под вакуумом смесей КЛ и НГК спиртовыми растворами коллидона 25, коллидона 30 и плаздона S630. Оценивая оба способа грануляции можно заключить, что с точки зрения простоты технологии и стабильности гранулятов более предпочтительным является способ совместной грануляции. Однако реакционная смесь газообразующих компонентов может повлиять на стабильность лекарственных веществ. Поэтому этот метод может быть использован для сухих веществ нейтрального характера, стабильных при воздействии слабых кислот и щелочей. Способ раздельной грануляции более многоплановый и может быть использован для введения в состав шипучих таблеток или гранул влагосодержащих компонентов (жидких, густых и сухих растительных экстрактов, кристаллогидратов, гигроскопичных веществ), а также веществ, стабильных в кислой или в щелочной среде. Кроме того, раздельно приготовленные грануляты не требуют специальных условий хранения при пониженной влажности воздуха до их смешения. Отрицательным моментом раздельной грануляции является двухпоточная схема, длительность процесса, меньшая стабильность гранулятов после смешивания, возможная мозаичность или мраморность поверхности таблеток.
Учитывая это, нами предложен оригинальный способ грануляции – комбинированный, включающий совместную грануляцию газообразующих компонентов неводным раствором ВМВ с целью пассивации их поверхности и отдельную грануляцию остальных компонентов, включая лекарственные вещества, для предотвращения их реакции с газообразующей смесью. Это позволяет минимизировать влияние влажности окружающей среды, повысить стабильность входящих ингредиентов, нарабатывать газообразующую систему впрок. В дальнейшем все три способа грануляции апробированы на различных моделях.
На основании изучения технологических характеристик газообразующих систем представляло интерес разработать способ построения единого обобщённого показателя качества, при котором несколько наиболее значимых откликов объединяется в единый количественный признак и определить, в какой области находятся основные характеристики качества шипучих таблеток. Изучение физико-химических и технологических свойств таблетируемых газообразующих масс, а также данных нормативной документации позволило обобщить наиболее значимые известные и определенные нами показатели качества шипучих таблеток, влияющие на них показатели гранулята и их оптимальные значения (таблица 2).
Таблица 2 - Зависимость основных показателей качества шипучих таблеток от технологических параметров гранулята
| Показатель качества таблеток | Норматив | Влияющий показатель гранулята | Оптимальное значение | Результат несоответствия нормативу |
| Отклонения в ср.массе (m,%) | Не более 5 | Фракционный состав. Сыпучесть (г/с) | Однород ный, 8,6-12,0 | Непостоянство массы таблеток (брак) |
| Прочность «на ребро» (Р, Н) | 70-180 | Прессуемость (Н) | 70-180 | Брак при фасовке, транспортировке |
| Внешний вид | Ровная гладкая поверхность (согласно НД) | Давление выталкивания Рв (адгезия к пресс-инструменту) (МН/м2) | 4-6 | Сколы по краям, шероховатая поверхность |
| Распадаемость (,мин.) | Не более 5 | Время растворения модельных таблеток (,мин.) | Не более 5 | Несоответствие НД |
| Содержание СО2 (%) | 15- 22 | Коэффициент газообразования (Кг/о) | 0,7-0,9 | Недостаточное газонасыщение. |
| Влагоустойчивость (W,%) | не более ±1,0 | Критическая скорость потери массы гранулята (v,% / с1 ) | Не более 3,8510-8 | Нестабильность при хранении |
Анализ и экспертная оценка данных таблицы 2 позволили установить, что наибольшее влияние на конечные параметры качества шипучих таблеток оказывают время растворения модельных шипучих таблеток (), давление выталкивания (адгезия к пресс-инструменту) (Рв) и коэффициент газообразования (Кг/о). Все остальные показатели можно перевести в разряд ограничений, так как до 95% в составе гранулята занимают газообразующие компоненты и наполнители, обеспечивающие относительное постоянство фракционного состава и прессуемости.
Таблица 3 - Пределы натуральных значений показателей качества шипучих таблеток.
| Наименование показателя | Натуральные значения | Интервал варьирования | ||
| Возможные (экстремаль- ные) | Допустимые | Оптимальные | ||
| x1 – Время растворения (, мин.) | 0,5-10 | 1-5 | 1,5-2,5 | 0,5 |
Продолжение таблицы 3
| x2 - Давление выталкивания (Рв, МН/м2 ) | 1-10 | 3-7 | 4-6 | 1,0 |
| x3 - Коэффициент газообразования (Кг/о) | 0,1-1,0 | 0,5-0,9 | 0,7-0,9 | 0,1 |
В таблице 3 показаны основные уровни и интервалы варьирования указанных факторов, установленные на основании экспертных оценок процесса.
Все выбранные переменные непрерывны и меняются в диапазоне собственных значений.
Значения уровней варьирования выбирали исходя из возможного диапазона изменения каждого фактора и возможности применения линейной аппроксимации функции отклика в выбранных диапазонах изменений параметров. При этом натуральные значения переводили в баллы. Математическая модель была представлена в виде полинома — отрезка ряда Тейлора, в который разлагается неизвестная функция:
 (2.4)
(2.4)
Вычисление коэффициентов полинома осуществляли на основе обработки результатов реализации наиболее простых планов, в которых каждый фактор принимает только два значения vi, min или vi, max, расположенные симметрично относительно центра плана по данному фактору. Для анализа взаимного влияния этих параметров составлена матрица планирования полного факторного эксперимента (ПФЭ) для трех факторов (количество точек N =23). Линейная функция отклика была описана уравнением множественной регрессии:
 (2.5)
(2.5)
где: — результирующий показатель, ![]() — существенные факторы,
— существенные факторы,
![]() —случайный фактор,
—случайный фактор, ![]() — параметры регрессии.
— параметры регрессии.
С помощью функции «Регрессия» программы MS EXEL получены следующие параметры регрессии:
b0=0,0895; b1= -0,0140; b2=0,0089; b3=0,0642 и соответствующее им уравнение, которое в рассматриваемой области характеризует технологическое качество шипучих таблеток:
 (2.6)
(2.6)
Предварительную проверку соответствия модели выборочным данным осуществляли с помощью исправленного коэффициента детерминации:
![]() 0,845 (2.7)
0,845 (2.7)
где ![]() = 0,065— полная сумма квадратов (total sum of squares),
= 0,065— полная сумма квадратов (total sum of squares),
![]() = 0,0101— сумма квадратов ошибок (error sum of squares).
= 0,0101— сумма квадратов ошибок (error sum of squares).
Полученный коэффициент детерминации близок к 1, модель хорошо описывает выборочные данные, 84,5% изменения результата обусловлено изменением рассматриваемых факторов.
Таким образом, в рассматриваемой области технологическое качество шипучих таблеток может быть аппроксимировано уравнением (натуральный вид): 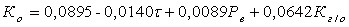 (2.8)
(2.8)
Расчеты показали, что оптимальные значения обобщенного критерия технологического качества КО, выраженные в баллах, находятся в пределах 0,1-0,2 (в среднем 0,15).
Для получения более точных результатов была построена модель в виде неполного квадратичного полинома второго порядка:
= b0+b1x1+b2x2+b3x3+b12x1x2+b13x1x3+b23x2x3+b123x1x2x3
Выполнив замену переменных, проведя аналогичные действия с помощью функции «Регрессия» программы MS EXEL, получили следующее уравнение:
=-0,0255+0,00305x1+0,0029x2+0,5992x3+-0,0004x1x2+ +0,0992x1x3+ -0,0602x2x3+ 0,0102x1x2x3 (2.9)
Исправленный коэффициент детерминации модели ![]() 0,999 очень близок к 1, модель хорошо описывает выборочные данные, так как 99,9% изменения результата обусловлено изменением рассматриваемых факторов. Все параметры модели значимы, F- критерий Фишера выполняется.
0,999 очень близок к 1, модель хорошо описывает выборочные данные, так как 99,9% изменения результата обусловлено изменением рассматриваемых факторов. Все параметры модели значимы, F- критерий Фишера выполняется.
Таким образом, получено два вида зависимостей: линейная и неполная квадратичная. Обе формулы пригодны для прогноза на области допустимых значений факторов. Задавая, требуемый показатель качества и значение двух параметров можно рассчитывать значение третьего фактора. Линейная зависимость наиболее проста для вычислений. Неполная квадратичная может быть использована для методов градиентной оптимизации.
Практическое применение найденного критерия и его значений следующее. Расчет К0 позволяет определить, будут ли соответствовать будущие таблетки основным требованиям НД. В случае, если К0 выходит за рамки оптимальных значений (пределы варьирования от 0,1 до 0,2), оптимизируются частные параметры: давление выталкивания, время растворения, коэффициент газообразования, добиваясь оптимума. Кроме того, зная оптимальные значения обобщенного критерия можно определить, в каких пределах должны находиться значения частных параметров, а знание пределов соответственно сокращает число экспериментальных попыток.
Обобщая проведенные исследования, необходимо разработать единый подход к созданию технологии шипучих таблеток и гранул. Такой подход позволит сократить число экспериментальных попыток и при известных направлениях исследований обоснованно аргументировать технологию тех или иных шипучих препаратов. В основу методологической схемы нами заложены основные свойства лекарственных веществ, на основании которых проводится выбор способа гранулирования. Затем проводится выбор вспомогательных веществ и расчет их количества. После операции гранулирования проводится оценка показателей гранулята: стабильность, определяемая по скорости потери массы за счет выделения диоксида углерода (v, %/с1); обобщенный критерий технологического качества и средневзвешенная оценка вкуса, на основании которых делается вывод о возможности получения шипучих таблеток или гранул с заданными свойствами. После операции таблетирования проводится анализ на соответствие разработанных составов принятым нормам качества. Методологическая схема показана на рисунке 2.

Рисунок 2 – Основные этапы разработки технологии шипучих таблеток и гранул (блок- схема).
Реализация указанной схемы осуществлена на моделях лекарственных препаратов и парафармацевтических средств с различным составом и свойствами.
3 Разработка и исследование шипучих таблеток дротаверина гидрохлорида
Выбор настоящего объекта для апробации разработанных методологических подходов обусловлен его востребованностью, высокой фармакологической эффективностью, а также физико-химическими свойствами. В связи с малой массой действующего вещества (0,04 г), содержание вспомогательных веществ в таблетках достигает 98,5%, и они определяют основные технологические характеристики гранулята. Поэтому задачей первого этапа исследований явился выбор способа производства, соотношения газообразующих компонентов, обеспечивающих заданный уровень рН, а также подбор корригентов. Известно, что дротаверина гидрохлорид легко разрушается, особенно при повышенной температуре и влажности, а также в щелочной среде с образованием пернаралдина и 3,4-диэтоксибензойной кислоты, поэтому возможным способом его производства является комбинированный способ грануляции. Для выбора состава корригентов проведена оценка органолептических свойств 6 модельных прописей шипучих таблеток (таблица 4), в которых варьировали соотношением натрия гидрокарбоната (от эквивалентного соотношения до преобладания кислотной фракции), а также добавками различных ароматизаторов, сочетающимися с горьким вкусом и подсластителей.
Таблица 4 – Состав модельных прописей шипучих таблеток дротаверина гидрохлорида
| Наименование компонентов | Содержание (г) в различных модельных составах | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Дротаверина гидрохлорид | 0,04 | 0,04 | 0,04 | 0,04 | 0,04 | 0,04 |
| Сахар молочный | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Натрия гидрокарбонат | 1,3 | 1,2 | 1,1 | 1,0 | 0,9 | 0,8 |
| Аспартам | 0,015 | 0,02 | 0,025 | 0,03 | 0,04 | 0,045 |
| Кислота лимонная | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| Ароматизатор сухой «Апельсин» | 0,05 | |||||
| Ароматизатор сухой «Лимон» | 0,05 | 0,02 | 0,05 | |||
| Ароматизатор сухой «Грейпфрут» | 0,05 | |||||
| Ароматизатор сухой «Мята» | 0,04 | 0,02 | ||||
| И Т О Г О | 2,895 | 2,810 | 2,705 | 2,620 | 2,490 | 2,435 |
| рН раствора | 5,76 | 5,68 | 5,49 | 5,28 | 5,02 | 4,65 |
Для оценки органолептических свойств и степени корригирования указанных составов использовали девятибалльную шкалу, принятую в пищевой промышленности, приспособленную нами для дегустации растворов шипучих препаратов. При этом каждый состав оценивался по трем показателям (внешний вид, цвет, вкус и аромат), на основании которых рассчитывалась средневзвешенная оценка. Для определения согласованности мнений экспертной группы рассчитывался коэффициент конкордации:
![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]()
где: V – коэффициент конкордации;
I – число экспертов;
j – число образцов;
S – сумма квадратов Dj;
Rj – сумма баллов по каждому образцу;
Qij – оценка в баллах, присвоенная i–экспертом j-образцу;
Экспертная оценка органолептических свойств модельных смесей, проведенная в соответствии с требованиями к дегустационному анализу продуктов, показала, что наиболее приемлемым является состав №5. При этом коэффициент конкордации составил 0,69, т.е. находился на значительном уровне (0,75-0,5).
Оценка технологических характеристик гранулята состава №5 и модельных шипучих таблеток дротаверина гидрохлорида (таблица 5), а также проведенный с помощью методов ТСХ и ВЭЖХ анализ возможных продуктов разложения показали, что комбинированный способ обеспечивает достаточную стабильность предложенной композиции.
Таблица 5 – Оценка технологических характеристик модельного гранулята и шипучих таблеток дротаверина гидрохлорида (х,n=6)
| Наименование показателя | Значение |
| Насыпная масса (г/см3) | 0,64 ±0,02 |
| Сыпучесть (г/сек) | 10,12±0,01 |
| Прессуемость (Н) | 152,4±5,04 |
| Влагоустойчивость W,% | -0,51±0,03 |
| Время растворения, мин. | 1'44''±9'' |
| Коэффициент газообразования Кг/о | 0,82±0,05 |
| Давление выталкивания Рв МН/м2 | 4,4±0,3 |
| Обобщенный критерий технологического качества К0 | 0,158±0,009 |
Изучение фармакокинетических параметров предложенной лекарственной формы проводили сравнительно со стандартными таблетками дротаверина гидрохлорида, произведенными ООО «Биовитек» (г. Москва).

Рисунок 3 – Динамика изменений концентрация дротаверина г/х в сыворотке крови после введения шипучих и стандартных таблеток*
Из приведенных данных следует, что введение дротаверина гидрохлорида в виде шипучих таблеток имеет ряд преимуществ перед стандартной таблетированной формой, а именно:
- Существенным образом повышается биодоступность дротаверина гидрохлорида (на 45,7 %).
- Время достижения максимальной концентрации дротаверина гидрохлорида в сыворотке крови подопытных животных сокращается в 2 раза, сравнительно со стандартными таблетками.
Эксперименты по изучению общетоксического действия в условиях субхронического эксперимента (острой, хронической токсичности, поведенческие реакции животных, местнораздражающее действие, исследование показателей крови, гистологическое изучение органов животных и др.) не выявили достоверных различий в токсичности разработанных шипучих и традиционных таблеток дротаверина гидрохлорида.
4 Исследования по разработке шипучих таблеток и гранул с адаптогенами и витаминами
Поиск и разработка эффективных лечебно-профилактических средств общеукрепляющего, адаптогенного и иммуномодулирующего действия является в настоящее время актуальной задачей в связи с возрастанием числа заболеваний, связанных с ослаблением естественной сопротивляемости организма, влиянием неблагоприятных факторов внешней среды, возрастанием нервно-психических нагрузок и стрессовых ситуаций на фоне несбалансированного питания.
Целью настоящих исследований явилась разработка технологии и норм качества сухих гранулированных шипучих напитков, содержащих комплекс витаминов и адаптогенов (с экстрактами элеутерококка, родиолы розовой и настойкой женьшеня с добавками витаминов групп С и В), условно названых «Элесан», «Родосан» и «Панаксовит». Следуя разработанной методологической схеме, гранулы получали методом раздельной грануляции.
С целью выбора оптимального состава напитков, приготовлено 9 модельных гранулятов (по 3 состава на каждый вид напитка), состоящих из двух фракций: карбонатной и кислотной. Соотношение карбонатных и кислотных компонентов изменяли от стехиометрического (1,3:1) до преобладания кислотных (1:1), создающих рН на уровне 4,0-5,0. Это позволило обеспечить полноту газообразования и придать приятный кисловатый вкус напиткам. Для обеспечения равной массы обеих фракций, что было удобно в технологическом аспекте, а также для увеличения стабильности гранул и улучшения органолептических характеристик в их состав вводились наполнители (сахароза или лактоза). Для корригирования органолептических показателей напитков в состав прописей введены подсластители, ароматизаторы и красители. Последние подбирались в соответствии с ароматом (например, солнечный закат – апельсин, кислотный красный – малина и т.п.).
Оценку технологических и физико-химических показателей полученных гранул и, соответственно, выбор ВМВ проводили на основании определений скорости потери массы за счет выделения диоксида углерода, времени растворения гранул, коэффициентов газообразования и газонасыщения, рН, а также качества растворов гранул (внешний вид, прозрачность) и их органолептических свойств. При этом оптимальными технологическими характеристиками и органолептическими свойствами обладали следующие составы шипучих напитков (таблица 6).
Таблица 6 – Состав сухих шипучих напитков с адаптогенами и витаминами
| Наименование веществ | «Элесан» | «Родосан» | «Панаксовит» | ||||
| г/доза | % | г/доза | % | г/доза | % | ||
| Экстракт элеутерококка мл (г*) | 0,3 (0,018) | 6,0 (0,36) | |||||
| Экстракт родиолы мл (г*) | 0,3 (0,015) | 6,0 (0,30) | |||||
| Настойка женьшеня мл (г*) | 0,4 (0,008) | 8,0 (0,16) | |||||
| Сахар свекловичный (пудра) | 1,45 | 29,03 | 1,43 | 28,21 | 1,43 | 28,49 | |
| Сахар молочный | 1,25 | 24,82 | 1,25 | 24,82 | 1,24 | 24,88 | |
| Натрия гидрокарбонат | 1,0 | 19,85 | 1,0 | 19,85 | 1,0 | 20,06 | |
| Аспартам | 0,02 | 0,40 | 0,02 | 0,40 | 0,02 | 0,40 | |
| Кислота аскорбиновая | 0,1 | 1,99 | 0,2 | 3,97 | 0,1 | 2,00 | |
| Рибофлавин | 0,005 | 0,10 | |||||
| Кислота лимонная б/в | 1,1 | 21,84 | 1,0 | 19,85 | 1,1 | 22,07 | |
| Ароматизатор сухой «Апельсин» | 0,05 | 0,99 | |||||
| Ароматизатор сухой «Малина» | 0,05 | 0,99 | |||||
Продолжение таблицы 6
| Ароматизатор сухой «Дюшес» | 0,05 | 1,00 | ||||
| Краситель «Солнечный закат» | 0,001 | 0,02 | 0,001 | 0,02 | ||
| Краситель «Кислотный красный» | 0,001 | 0,02 | ||||
| Коллидон 25 | 0,03 | 0,60 | ||||
| Плаздон S 630 | 0,03 | 0,60 | ||||
| Коллидон 30 | 0,03 | 0,60 | ||||
| Колликут (МАЕ 100Р) | 0,005 | 0,1 | 0,01 | 0,20 | ||
| Шеллак | 0,005 | 0,1 | ||||
| Итого | 5,036 | 100,0 | 5,001 | 100,0 | 4,994 | 100,0 |
*- в скобках дана масса сухих веществ в фитопрепаратах в г и %.
Проведена оценка адаптогенной активности гранул на модели гипобарической гипоксии. Результаты опытов показали, что время пребывания животных в барокамере после введения шипучих гранул «Элесан» увеличилось на 96,8%, после введения шипучих гранул «Родосан» - на 98,2%, «Панаксовит» - на 83,5.
Используя методику вращающегося стержня, исследовали влияние шипучих гранул на двигательную активность мышей после введения барбитала натрия. Установлено, что время пребывания животных на вращающемся стержне под влиянием гранул увеличивалось в среднем в 2,3 раза.
Поскольку гранулы имели непродолжительный срок хранения (не более 6 месяцев) и учитывая сложность в изготовлении (двухпоточная грануляция), исследовали возможность получения шипучих таблеток. При этом исследовали два варианта технологии: с использованием раздельной грануляции (как при получении гранул) и комбинированного способа. Оценку полученных таблеток проводили по влагоустойчивости, газообразующей способности, давлению выталкивания (Рв МН/м2) и времени их растворения (, мин.) (таблица 7).
Таблица 7 - Сравнительная оценка качества модельных таблеток, полученных различными способами
| Наименование показателя | «Элесан» | «Родосан» | «Панаксовит» | |||
| к* | р* | к* | р* | к* | р* | |
| Влагоустойчивость W,% | -1,2 | -1,8 | -0,8 | -1,4 | -1,5 | -2,4 |
| Время растворения, мин. | 3,4 | 3,1 | 2,8 | 3,5 | 4,0 | 4,6 |
| Коэффициент газообразования Кг/о | 0,82 | 0,74 | 0,84 | 0,78 | 0,80 | 0,72 |
| Давление выталкивания Рв МН/м2 | 4,5 | 6,8 | 3,3 | 5,6 | 4,8 | 7,0 |
| Обобщенный критерий технологического качества К0 | 0,135 | 0,154 | 0,133 | 0,140 | 0,128 | 0,133 |
к* – комбинированный способ грануляции;
р* - раздельный способ грануляции
Как следует из таблицы 7, оба способа обеспечивают величины обобщенного критерия в границах оптимума (0,1-0,2). Однако, учитывая простоту в осуществлении комбинированного способа грануляции и лучшую влагоустойчивость модельных таблеток, мы остановили свой выбор на этой технологии. Основываясь на требованиях ГФ ХI (статья «Таблетки»), зарубежных фармакопей на шипучие таблетки, а также НД на соответствующие фитопрепараты, определены следующие параметры стандартизации шипучих таблеток с адаптогенами (таблица 8):
Таблица 8 - Основные требования к стандартизации шипучих таблеток «Элесан», «Родосан» и «Панаксовит»
| Наименование показателя | Размеренность, метод | Требования НД | Нормативная документация |
| Описание внешнего вида таблеток и раствора препарата в воде | Органолептический | Согласно НД | - |
| Геометрические размеры | мм | 24,0±0,1 h 6,5±0,1 | ОСТ 64-072-89 |
| Средняя масса и отклонения в средней массе | %, г | не более 5% 4,465 – 4,935 | ГФ ХI изд., вып. 2, стр.154 |
| Распадаемость (Время растворения) | мин. | не более 5 | Европейская фармакопея, изд. 5, стр. 626-628 |
| рН раствора | - | 4,5-5,5 | ГФ ХI изд., вып.1, стр.113 |
| Кислото-нейтрализующая ёмкость | Ммоль HCl | не менее 5 | USP 24/NF 19 |
| Наличие элеутерозидов, панаксозидов, салидрозида и розавина (качественные реакции) | ТСХ | Rf пятен на ТСХ в соответствии с НД | Экстракт элеутерококка жидкий - ФС 42- 2833-92, ФСП 42-0218309502; настойка женьшеня - ФСП 42- 0068215001, экстракт родиолы жидкий - ФС 42-2163-96, ФСП 42-0218234402; |
| Количественное определение витаминов Кислота аскорбиновая Рибофлавин («Панаксовит») | Йодатоме- трический Флюориметрический | «Элесан» и «Панаксовит» 0,095–0,105г «Родосан» 0,19–0,21 г 4,5-5,5 мг | ГФ ХI изд., вып.2, с.41-60). |
Установлен срок годности разработанных таблеток, который составил не менее 2 лет. Фармакологическая активность шипучих таблеток изучалась по методике создания ишемии центральной нервной системы лягушки. Установлено, что наибольшим временем задержки угасания простых и сложных рефлексов и наименьшим временем восстановления рефлексов после реперфузии обладали таблетки «Родосан».
5 Разработка и исследование шипучих минеральных комплексов
Широкая распространенность заболеваний органов пищеварения, наклонность к рецидивам и осложнениям вызывает необходимость поиска новых средств для их лечения и профилактики. Лечебно-профилактические свойства минеральных вод региона КМВ известны во всем мире. Для лечения заболеваний печени и ЖКТ широко используются минеральные воды типа «Ессентуки», «Славяновская» и др. Однако использование преимуществ бальнеотерапии благодаря уникальным источниками КМВ не всегда доступно из-за удаленности многих регионов, сложностью транспортировки минеральных вод в районы с различными климатическими условиями (особенно в районы Крайнего Севера), небольшим сроком их хранения (6-12 мес.). Поэтому вполне обосновано возникает вопрос создания сухих солевых комплексов минеральных вод, оптимальной формой для которых могут быть шипучие таблетки или гранулы.
При создании гранулированных и таблетированных солевых комплексов минеральных вод мы учитывали требования ГОСТ 13273-88 на воды минеральные питьевые, лечебные и лечебно-столовые, протоколы анализов ГосНИИ курортологии и физиотерапии и литературные данные по составу минеральных вод. При этом мы пользовались следующей методологической схемой (рисунок 4):
| Определение полного ионного состава | ||||||
| Расчет гипотетического состава солей и газообразующих добавок | ||||||
| Выбор условий грануляции | ||||||
| Выбор связывающих веществ | Выбор способа грануляции | |||||
| Гранулы | Гранулят | |||||
| Установление норм качества и разработка НД | Определение оптимальных условий таблетирования | |||||
| Фармакологическое изучение | Таблетки | |||||
Рисунок 4 - Блок- схема разработки солевых гранулированных и таблетированных солевых комплексах минеральных вод
Схема реализована при разработке солевых гранулированных и таблетированных солевых комплексах минеральных вод типа «Ессентуки №4 и №17» и «Славяновская». При получении гранулятов мы сравнивали два метода – совместный и раздельный. Оценка различных способов приготовления гранулятов солевого комплекса «Ессентуки №17» и эффективности использования различных ВМВ приведена в таблице 9.
Таблица 9 - Оценка различных способов приготовления гранулятов солевого комплекса «Ессентуки №17» и эффективности использования различных ВМВ (х, n=6)
| Наименование увлажняющего раствора ВМВ | Способ гранулирования | |||||
| Совместный | Раздельный | |||||
| v, % / с1 | Время растворения, с | Качест-во раствора* | v, % / с1 | Время раство-рения, с | Качест-во раствора* | |
| Р-р ПВП с/м 10% спиртовый | 1,6·10-8 | 25 | +++ | 2,4·10-8 | 24 | +++ |
| Р-р коллидона 25 10% спиртовый | 1,5·10-8 | 27 | +++ | 2,1·10-8 | 21 | +++ |
| Р-р коллидона 30 10% спиртовый | 1,1·10-8 | 22 | ++ | 1,8·10-8 | 26 | ++ |
| Р-р плаздона (S 630) 10% спиртовый | 1,6·10-8 | 24 | +++ | 2,2·10-8 | 18 | +++ |
*Примечание: +++ раствор прозрачен, без осадка;
++ легкая опалесценция;
Как следует из таблицы, совместный способ гранулирования показал более высокую стабильность гранулятов. Учитывая простоту в осуществлении и экономичность, он принят нами за основу при разработке технологии шипучих гранул и таблеток солевых комплексов минеральных вод.
При разработке технологии шипучих таблеток солевых комплексов проводили расчет оптимального давления выталкивания и количества антиадгезионных добавок, используя следствие из формулы обобщенного критерия технологического качества:
 (5.1)
(5.1)
Оценку технологических параметров полученных таблеток проводили по МН/м2) и времени их растворения (, мин.). Полученные результаты послужили основанием для разработки окончательного состава, технологической схемы производства, параметров стандартизации шипучих таблетированных солевых комплексов типа «Ессентуки». влагоустойчивости, газообразующей способности, давлению выталкивания (Рв, Методом хранения в естественных условиях установлен срок годности разработанных таблеток, который составил не менее 5 лет.
Исследование специфической активности шипучих гранул солевых комплексов «Ессентуки» показало, что предварительный курсовой прием шипучих гранул «Ессентуки № 17» оказал больший профилактический эффект, чем природная минеральная вода, так как степень поражения СОЖ после этого снизилась на 58%, (природная на 23%) Р<0,01 от контрольных значений. Анализ корреляционной матрицы показателей ПОЛ у крыс с нейродистрофическим повреждением желудка при курсовом природной и искусственной гранулированной минеральной воды «Ессентуки №17» показал, что при воздействии в гранулированном виде искусственная минеральная вода практически не оказывала стимулирующего влияния на уровень холестерина в крови, что выгодно отличает ее от природной воды «Ессентуки № 17».
Также проведены исследования по выбору состава и технологии шипучих таблеток на основе солевого комплекса воды «Славяновская». Разработаны нормы качества и промышленный способ производства. Состав и технология получения минеральных комплексов типа «Ессентуки» и «Славяновская» в виде шипучих таблеток и гранул запатентованы.
6 Исследования по созданию корригированных гастропротекторов и шипучих фитоминеральных комплексов
Целью дальнейшей работы явилось создание сухих шипучих фитоминеральных комплексов, содержащих солевые комплексы минеральных вод и фитопрепараты гастропротекторного действия. На основе солевого комплекса минеральной воды "Славяновская" разработан фитоминеральный комплекс, условно названный нами «Гастрослав». Для усиления и придания направленности фармакологического действия в него введен комплексный экстракт из коры крушины, цветков ромашки травы тысячелистника и цветков календулы, взятых в соотношении 5:2:1:1. Этот экстракт был испытан в составе раствора для приема внутрь «Гастрофит», разработанного нами по заказу ОАО «ICN-Лексредства» (г. Курск). Проведенные фармакологические доклинические и клинические испытания показали, что раствор обладает легким послабляющим, противовоспалительным, спазмолитическим, желчегонным свойствами. Причем наиболее эффективно эти свойства проявлялись при курсовом приеме. На раствор утверждена ФСП 42-00332671-02 и получено регистрационное удостоверение (Р №002416/01-2003). В настоящее время налажен его выпуск (теперь ОАО «Фармстандарт-Лексредства»).
Клинические испытания лекарственного препарата «Гастрофит» показали, что по фармакологическому эффекту он близок к минеральной воде «Славяновская». Поэтому решено было использовать фитокомплекс препарата в составе минерального комплекса воды «Славяновская». Согласно разработанной блок-схемы (рисунок 2), грануляцию проводили раздельным методом, позволяющим включать в состав шипучих форм различные жидкие фитопрепараты. Во избежание преждевременного реагирования обеих фракций, снижение влажности проводилось на всех этапах технологии, начиная от предварительной грануляции до сушки ингредиентов, применения оптимальных пленкообразователей, внутренних дегидратантов ограничивающих реагирование фракций, заканчивая упаковкой и хранением в присутствии влагопоглотителей.
Выбор вспомогательных веществ проведен на основании расчетов фактора влагоустойчивости и обобщенного критерия технологического качества. Установлены нормы качества фитоминерального комплекса «Гастрослав» и срок годности (методом хранения в естественных условиях), составивший 4 года.
7 Разработка быстрорастворимых таблеток с использованием способов и систем повышения биологической доступности
В последнее время на фармацевтическом рынке кроме шипучих появились также другие типы быстрорастворимых таблеток - диспергируемые таблетки (Dispersible tablets), ородисперсные таблетки (Orodispersible tablets), таблетки типа «рапид». Их объединяет наличие системы вспомогательных веществ, регулирующей резорбцию лекарственных веществ в организме и обеспечивающей более высокую их биологическую доступность. Время дезинтеграции (растворения) указанных таблеток обычно не превышает 3-5 минут. В отличие от шипучих, в составе указанных таблеток преобладает вещество субстанции и оно определяет основные технологические параметры гранулята и выбор той или иной технологии.
Нами исследована возможность разработки интеграционной оценки технологических параметров масс для таблетирования. Для этого на основании требований НД, экспериментальных или литературных данных устанавливаются границы допустимых значений показателей качества гранулятов. При составлении формулы балльных оценок показателя учитывалось, что в пределах допустимых значений рассматриваемых показателей с увеличением некоторых показателей (например, сыпучести и прессуемости) качество таблеток возрастает, а при увеличении других (например, давления выталкивания и распадаемости) качество падает.
Максимальная балльная оценка каждого показателя принята равной 100, учитывая, что при приближении к этой оценке качество оптимизируется. Выведенные формулы для расчета балльной оценки имеют вид:
Балльная оценка максимизируемых показателей (сыпучесть, прессуемость и т.п.) -
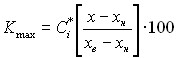 (7.1)
(7.1)
Балльная оценка минимизируемых показателей (давление выталкивания, распадаемость) -
![]() (7.2)
(7.2)
где: х – натуральное значение технологического показателя; хн, хв – верхний и нижний пределы его допустимых значений; ![]() - нормированный весовой коэффициент, рассчитанный в соответствии с рангом показателя. При этом интеграционная оценка i-состава рассчитывается как сумма взвешенных оценок по всем показателям:
- нормированный весовой коэффициент, рассчитанный в соответствии с рангом показателя. При этом интеграционная оценка i-состава рассчитывается как сумма взвешенных оценок по всем показателям:
![]() (7.3)
(7.3)
7.1 Разработка состава и технологии таблеток глюкозамина гидрохлорида
Выбор наиболее приемлемого состава с использованием вышеуказанного метода был проведен на примере таблеток глюкозамина гидрохлорида, которые внедрены нами на ОАО «Московская фармацевтическая фабрика» (соавт. Компанцев В.А., Компанцев Д.В. и др.). На основании изучения формы и размера частиц субстанции сделано предположение о возможности получения таблеток глюкозамина гидрохлорида методом прямого прессования с добавлением вспомогательных веществ, обеспечивающих достаточную прочность таблеток (прессуемость), низкую абразивность таблеточной массы, хорошую сыпучесть и высокую скорость дезинтеграции таблеток. Последний показатель был необходим для повышения биологической доступности лекарственной формы и для снижения раздражающего действия глюкозамина гидрохлорида на стенки желудка.
Доза глюкозамина гидрохлорида на одну таблетку установлена 0,3 г. В качестве связывающих компонентов исследованы комбинации ПВП и МКЦ. Для ускорения дезинтеграции таблеток исследовано влияние добавок супердезинтегранта коллидона CL производства фирмы BASF, который одновременно улучшает текучесть таблеточной массы и ее прессуемость. В качестве скользящего вещества (глиданта) опробован тальк, а смазывающего (лубриканта) – кальция стеарат, наиболее часто используемые с этой целью. Для выбора оптимального состава таблеток нами исследовано 8 модельных композиций с последовательным увеличением вышеуказанных компонентов в смеси в разрешенных или рекомендуемых НД пределах (таблица 10). При этом содержание вспомогательных веществ в таблеточной смеси увеличивалось от 5 до 40%.
Таблица 10 –Состав модельных смесей для таблеток глюкозамина гидрохлорида
| № | Наименование компонентов | Количество компонентов в различных составах (%) | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 1 | Глюкозамина гидрохлорид | 95 | 90 | 85 | 80 | 75,0 | 70 | 65 | 60 |
| 2 | Целлюлоза Микрокристаллическая "AVICEL-рН 101" | 2,5 | 5,0 | 7,5 | 10,0 | 12,5 | 15,0 | 17,5 | 20,0 |
| 3 | Поливинилпирролидон среднемолекулярный медицинский | 1,5 | 3,0 | 4,5 | 6,0 | 7,5 | 9,0 | 10,5 | 12,0 |
| 4 | Коллидон CL | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 |
| 5 | Тальк | 0,375 | 0,750 | 1,125 | 1,500 | 1,875 | 2,250 | 2,625 | 3,000 |
| 6 | Кальция стеарат | 0,125 | 0,250 | 0,375 | 0,500 | 0,625 | 0,750 | 0,875 | 1,000 |
| ИТОГО | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | |
| Ср. масса таблетки | 0,316 | 0,333 | 0,353 | 0,375 | 0,400 | 0,429 | 0,462 | 0,500 | |
Для установления необходимых количеств вспомогательных веществ были определены основные технологические показатели модельных смесей и их средневзвешенные оценки (таблица 11).
Таблица 11 - Результаты определения физико-химических и технологических показателей модельных смесей для получения таблеток глюкозамина гидрохлорида
| Наименование показателя | Обобщенный средневзвешенный балл | ||||||||
| Распадаемость (мин.) | Прессуемость (Н) | Давление выталкивания из матрицы (МПа) | Сыпучесть (г/с) | ||||||
| Допуст. значение | 1-15 | 50-180 | 2-10 | 3-12 | 100 | ||||
| Значение показателей (Хi) и их средневзвешенные баллы (Ki) | |||||||||
| № сост. | Хi | Ki | Хi | Ki | Хi | Ki | Хi | Ki | |
| 1 | 0,5 | 0 | 28 | 0 | 14,8 | 0 | 7,6 | 5,1 | 5,1 |
| 2 | 1,1 | 39,7 | 41 | 0 | 12,3 | 0 | 8,3 | 5,9 | 45,6 |
| 3 | 1,4 | 38,8 | 52 | 0,5 | 9,6 | 1,0 | 8,7 | 6,3 | 46,6 |
| 4 | 1,8 | 37,7 | 63 | 3,0 | 7,8 | 5,5 | 9,0 | 6,7 | 52,9 |
| 5 | 2,2 | 36,6 | 75 | 5,8 | 6,8 | 8,0 | 9,2 | 6,9 | 57,3 |
| 6 | 4,1 | 31,1 | 81 | 7,2 | 6,5 | 8,75 | 9,4 | 7,1 | 54,2 |
| 7 | 5,2 | 28,0 | 88 | 8,8 | 6,2 | 9,5 | 10,0 | 7,8 | 54,1 |
| 8 | 6,5 | 24,3 | 92 | 9,7 | 6,0 | 10,0 | 10,7 | 8,5 | 52,5 |
Как следует из таблицы, наибольшее значение обобщенного средневзвешенного балла принадлежит составу №5. Разработанная система оценок позволяет определить, какой показатель следует оптимизировать при переходе к следующему составу. Из таблицы 11 также следует, что постепенное увеличение количества тех или иных вспомогательных компонентов на определенном этапе может снизить общую оценку определенного состава, как это произошло с составами 7 и 8.
Таблица 12 -Состав таблеток глюкозамина гидрохлорида
| Наименование ингредиентов | Количество | |
| г/таб | % | |
| Глюкозамина гидрохлорид (ФСП 42-03141478-01) | 0,3 | 75,0 |
| Целлюлоза микрокристаллическая (ФС 42-3728-99) | 0,05 | 12,5 |
| Поливинилпирролидон среднемолекулярный медицинский 35000±5000 (ФС 42-2238-98) | 0,03 | 7,5 |
| Коллидон CL (НД 42-8871-98) | 0,01 | 2,5 |
Продолжение таблицы 12
| Тальк (ВФС 42-2550-95) | 0,0075 | 1,875 |
| Кальций стеариновокислый (ТУ 6-09-4233-76) | 0,0025 | 0,625 |
| ИТОГО | 0,400 | 100,000 |
Приведенный состав послужил основой для разработки промышленного регламента на производство препарата «Аминоартрин, таблетки 0,3 г», в котором за основу технологии взят метод прямого прессования. Установлены нормы качества таблеток и срок годности, составивший 3 года. На таблетки глюкозамина гидрохлорида для ОАО «Московская фармацевтическая фабрика» разработаны и утверждены ФСП 42-0068-2823-02 (товарное название «Аминоартрин»), промышленный регламент (ПР 01899876-Т-19), получено регистрационное удостоверение (Р №003621/01 от 6.07.2004) и налажен промышленный выпуск. Способ производства запатентован (Пат.№2247536 РФ).
7.2 Разработка состава и технологии быстрорастворимых в полости рта таблеток «Биофлавит»
Учитывая широкий спектр биологической активности дигидрокверцитина, ее особую ценность в плане сохранения здоровья, нами поставлена задача разработки корригированной БАД к пище в форме быстрорастворимых в полости рта таблеток, включающих дигидрокверцитин и кислоту аскорбиновую. Изучение свойств субстанции «Дигидрокверцетин» показало, что это мелкокристаллический порошок светло-желтого цвета, горьковатого вкуса с насыпной массой 0,31 г/см3 и плохой сыпучестью (1,3 г/с). Получение таблеток из такой субстанции, тем более ородисперсных, возможно только с использованием предварительного влажного гранулирования массы. Для выбора количественного и качественного состава вспомогательных веществ (связывающих, скользящих, дезинтегрантов, корригентов) нами составлено 8 модельных прописей гранулятов, показанных в таблице 20. В приведенных составах варьировали составом наполнителей (сорбит-лактоза), вкусоароматических добавок, подсластителя. В качестве супердезинтегранта использован полипласдон XL10 – поливинилпирролидон с молекулярной массой 1,5 млн. и размером частиц не более 30 мкм, который обладает сильной набухающей способностью, поглощая равный объем воды без нарушения сыпучести, кроме того, улучшает прессуемость массы, выполняет функции лубриканта, глиданта и внутреннего дегидратанта. Согласно рекомендациям фирмы ISP, он вводится в гранулят в качестве обсыпки (опудривающей смеси), как самостоятельно, так и в смеси с кальция стеаратом. В качестве связывающего вещества использовали водный раствор ПВП среднемолекулярного, концентрация и количество которого выбиралось путем изучения предельного напряжения сдвига. Для этого модельную смесь, состоящую из 6,9% ДГК,15,6% кислоты аскорбиновой и 77,5% лактозы увлажняли растворами ПВП различной концентрации (0-25%), пластические свойства масс измеряли на пенетрометре КП-3 через каждый 1% введенного увлажнителя. Результаты показаны на рисунке 5

Рисунок 5 – Зависимость предельного напряжения сдвига от концентрации и количества увлажнителя
Как следует из рисунка, достижение критического влагосодержания наблюдается при введении раствора ПВП в концентрации от 10 до15% в количестве 10% по отношению к массе смеси, после чего масса переходит в суспензионное состояние и пластическая прочность резко падает. Состав модельных гранулятов для таблеток «Биофлавит» представлен в таблице 13
Таблица 13 - Состав модельных гранулятов для таблеток «Биофлавит»
(в пересчете на 1 таблетку)
| № | Наименование компонентов | Количество компонентов в различных составах (мг) | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 1 | Дигидрокверцетин | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 |
| 2 | Кислота аскорбиновая | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 |
| 3 | Сахар молочный | 245 | 245 | 245 | 245 | ||||
| 4 | Сорбит | 250 | 250 | 250 | 250 | ||||
| 5 | Вкусоароматические добавки: «Мед» АП-454 | 0,5 | 0,5 | ||||||
| 6 | «Лесная ягода» АК 1289 | 0,6 | 0,5 | ||||||
| 7 | «Лимон» АК 777 | 0,6 | 0,5 | ||||||
| 8 | «Ананас» АК 865 | 0,6 | 0,6 | ||||||
| 9 | Сахарозаменитель «Аспасвит» | 0,5 | 0,4 | 0,4 | 0,4 | 5 | 3 | 3 | 3 |
| 10 | Полипласдон XL10 | 23 | 22 | 21 | 20 | 21 | 23 | 23 | 23 |
| 11 | ПВП с/м* | 3,0 | 3,0 | 3,0 | 3,0 | 3,5 | 3,5 | 3,5 | 3,5 |
| 12 | Кальция стеарат | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 |
*Примечание. ПВП использовался в качестве связывающего вещества в виде 10% водного раствора
Результаты определения физико-химических и технологических показателей указанных составов приведены в таблице 14.
Таблица 14 - Результаты определения физико-химических и технологических показателей модельных прописей таблеток БАД «Биофлавит»
| № п/п | Наименование показателя | № модельной прописи таблеток | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 1 | Сыпучесть (г/с) | 6,6 | 6,1 | 6,8 | 7,3 | 7,8 | 8,4 | 9,2 | 8,8 |
| 2 | Угол естественного откоса (0) | 34 | 38 | 33 | 36 | 37 | 35 | 32 | 33 |
| 3 | Насыпная масса (г/см3) | 0,68 | 0,65 | 0,62 | 0,60 | 0,69 | 0,66 | 0,64 | 0,62 |
| 4 | Прессуемость (Н) | 65 | 71 | 76 | 84 | 69 | 82 | 91 | 84 |
| 5 | Давление выталкивания из матрицы (МПа) | 9,4 | 8,6 | 7,4 | 7,8 | 8,1 | 7,2 | 5,6 | 6,3 |
| 6 | Распадаемость (мин.) | 6,3 | 5,8 | 6,2 | 6,5 | 0,8 | 1,1 | 1,4 | 1,8 |
| 3 | Прочность на истирание (%) | 96,3 | 98,2 | 98,5 | 99,2 | 97,2 | 97,8 | 99,4 | 99,0 |
Указанные составы подвергались также органолептической оценке. Однако, оценочная шкала, разработанная для растворов шипучих таблеток, не соответствовала параметрам качества оромукозальных таблеток, поэтому для них нами разработана специальная оценочная шкала, представленная в таблице 15:
Таблица 15. - Балльная оценочная шкала, предложенная для оценки органолептических свойств оромукозальных таблеток
| Ранг показателя качества и его весовой коэффициент | Характеристика | Оценка в баллах |
| 1 | 2 | 3 |
| 1. Вкус, аромат (0,4) | а) Характерный полный вкус, соответствующий аромату с длительным приятным послевкусием б) Хороший вкус, соответствующий аромату в) Выраженный вкус, но слабый аромат, с появлением другого послевкусия менее чем через 2 минуты после рассасывания г) Слабо выраженный вкус и аромат, с появлением другого послевкусия через 2 минуты и более после рассасывания д) Плохо выраженный вкус с посторонним тоном в ощущении и неприятным послевкусием | 9 (отлично) 7 (хорошо) 5 (приемлемо) 3 (удовлетво- рительно) 1 (плохо) |
| 2.Распадае- мость в полости рта (0,3) | а) Легко распадаются («тают во рту») без ощущения шероховатости и посторонних включений б) Хорошо распадаются (до 1,5 мин.), ощущаются легкая шероховатость при рассасывании в) Хорошо распадаются (1,5-2,0 мин.), но ощущаются небольшое количество отдельных комочков или кристаллов при рассасывании г) Медленно распадаются (2,0-3,0 мин.) с ощущением шероховатости таблетки, небольшого количества отдельных нерастворимых включений д) Плохо распадаются (более 3 минут), ощущается шероховатость таблетки, отдельные нерастворимые включения, комочки или кристаллы при рассасывании | 9 (отлично) 7 (хорошо) 5 (приемлемо) 3 (удовлетво- рительно) 1 (плохо) |
| 3. Внеш- ний вид (0,2) | а) Ровная гладкая однородная поверхность, соответствующая НД; б) Ровная гладкая поверхность, слабая мраморность, соответствующая НД; в) Ровная гладкая поверхность с заметными вкраплениями, соответствующими НД г) Неоднородная поверхность или двухцветная пятнистость, соответствующая НД д) Наличие сколов, шероховатость боковой поверхности, срыв насечки, несоответствие внешнего вида, высоты и диаметра таблетки НД | 9 (отлично) 7 (хорошо) 5 (приемлемо) 3 (удовлетво- рительно) 1 (плохо) |
| 4. Цвет (0,1) | а) Ярко выраженный цвет, соответствующий запаху и вкусу; б) Ярко выраженный цвет, но не сочетающийся либо со вкусом, либо с запахом; в) Невыраженный цвет, соответствующий вкусу и запаху; г) Невыраженный цвет, не сочетающийся либо со вкусом, либо с запахом; д) Грязный цвет, не соответствующий запаху и вкусу | 9 (отлично) 7 (хорошо) 5 (приемлемо) 3 (удовлетво- рительно) 1 (плохо) |
По указанным показателям экспертная группа, состоящая из 8 здоровых добровольцев в возрасте 20-25 лет, не страдающих нарушениями восприятия цвета, вкуса и запаха, провела оценку органолептических показателей модельных прописей таблеток «Биофлавит». Оценка согласованности мнений экспертной группы проводилась по разбросу оценок по каждому показателю, для чего рассчитывался коэффициент конкордации. Результаты показаны в таблице 8.16
Таблица 16 - Результаты оценки органолептических показателей модельных прописей таблеток «Биофлавит»
| Наименование показателя | Сумма взвешенных оценок модельных прописей таблеток Qigi, (n=8) | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Вкус и аромат | 15,2 | 16,0 | 16,8 | 18,4 | 20,0 | 22,4 | 21,6 | 23,2 |
| Распадаемость в полости рта | 9,6 | 11,1 | 9,6 | 10,8 | 16,2 | 16,8 | 19,2 | 17,4 |
| Внеш. вид | 6,8 | 6,8 | 6,8 | 6,8 | 11,2 | 11,2 | 12,8 | 12,8 |
| Цвет | 3,4 | 3,6 | 3,6 | 3,6 | 5,6 | 4,2 | 5,6 | 4,8 |
| Средневзвешенная оценка | 4,37 | 4,69 | 4,60 | 4,95 | 6,62 | 6,83 | 7,40 | 7,28 |
| Коэф. конкордации | 0,74 | 0,66 | 0,64 | 0,68 | 0,70 | 0,66 | 0,73 | 0,72 |
Как следует из таблицы 16, наивысшим балом органолептических показателей обладали модельные таблетки прописей 6, 7 и 8. При этом коэффициент конкордации составил в среднем 0,69, что соответствовало значительному уровню согласованности мнений (0,74-0,50).
Исходя из результатов исследования технологических, физико-химических и органолептических показателей модельных составов нами проведены расчеты их средневзвешенных оценок по методике, описанной в разделе 8.1. Для выбора оптимального состава оценивались 5 наиболее важных показателей, представленных в таблице 17:
Таблица 17 - Основные показатели модельных составов таблеток «Биофлавит»
| № п/п | Наименование показателя | Доп. границы | № модельной прописи таблеток | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |||
| 1 | Сыпучесть (г/с) | 3,0-12,0 | 6,6 | 6,1 | 6,8 | 7,3 | 7,8 | 8,4 | 9,2 | 8,8 |
| 2 | Прессуемость (Мн) | 50-180 | 65 | 71 | 76 | 84 | 69 | 82 | 91 | 84 |
| 3 | Давление выталкивания из матрицы (МПа) | 2-10 | 9,4 | 8,6 | 7,4 | 7,8 | 8,1 | 7,2 | 5,6 | 6,3 |
| 4 | Распадаемость (мин.) | 0,5-3,0 | 6,3 | 5,8 | 6,2 | 6,5 | 0,8 | 1,1 | 1,4 | 1,8 |
| 5 | Средневзвешенная оценка вкуса | 3,0-9,0 | 4,37 | 4,69 | 4,60 | 4,95 | 6,62 | 6,83 | 7,40 | 7,28 |
Результаты балльной оценки вышеуказанных показателей, рассчитанных по приведенным формулам показаны в таблице 18
Таблица 18 - Результаты расчета средневзвешенных оценок технологических и органолептических показателей модельных составов таблеток «Биофлавит»
| № состава | Показатели качества (средневзвешенные баллы) | |||||
| Хр | Хв | Хп | Хд | Хс | ||
| 1 | 0 | 2,9 | 2,3 | 1,0 | 2,8 | 9,0 |
| 2 | 0 | 2,5 | 3,2 | 2,3 | 2,4 | 10,4 |
| 3 | 0 | 3,0 | 4,0 | 4,2 | 3,0 | 14,2 |
| 4 | 0 | 2,5 | 5,2 | 3,6 | 3,3 | 14,6 |
| 5 | 29,0 | 11,5 | 2,9 | 3,1 | 3,7 | 50,2 |
| 6 | 25,1 | 20,9 | 4,9 | 4,6 | 4,2 | 59,7 |
| 7 | 21,1 | 23,2 | 6,3 | 7,2 | 4,8 | 62,6 |
| 8 | 15,8 | 21,5 | 5,2 | 6,0 | 4,5 | 53,0 |
Таким образом, интегральная оценка технологических и органолептических характеристик показала, что модельные составы № 6,7 и 8 можно взять за основу (таблица 19):
Таблица 19 - Ингредиентный состав в расчете на 1 таблетку
| Наименование сырья | Обозначение НД | Содержание в 1 таблетке, мг |
| Дигидрокверцетин | ТУ 2455-001-74904438 | 22 |
| Кислота аскорбиновая | ФС 42-0218-07 | 50 |
| Сахар молочный | ТУ 9229-128-04610209-2003 | 248 |
| Кальций стеариновокислый | ТУ 6-09-4233-76 | 3 |
| Вкусоароматические добавки: «Мед» АП-454, или «Лесная ягода» АК 1289, или «Лимон» АК 777 | ТУ РБ 14576927-002-95, изм.1-6 РЦ РБ 100534628.780-2005 | 0, 5 |
| Сахарозаменитель «Аспасвит» | ТУ 9197-001-49929776-02 | 3 |
| Полипласдон XL10 | НД 42-10113-07 | 20 |
| Поливинилпирролидон среднемолекулярный медицинский | ФСП 42-03454369-03 | 3,5 |
| ИТОГО | 350 | |
Согласно разработанной технологии проведена наработка 6 опытных серий быстрорастворимых в полости рта таблеток «Биофлавит». Полученные таблетки подвергались контролю по физико-химическим и органолептическим показателям согласно требованиям, разработанным нами в ТУ 9197-002-74904438-2009 на БАД «Биофлавит» (таблица 20).
Таблица 20 - Физико-химические и органолептические показатели БАД «Биофлавит»
| Наименование показателей | Характеристика и норма | Метод контроля |
| Описание | Плоскоцилиндрической формы таблетки, одинакового размера, с ровными без сколов краями. | ОСТ 64-072-89 |
| Вкус | Кисло-сладкий, слегка горьковатый | СТ СЭВ 4710-84 |
| Цвет | Светло-бежевый | СТ СЭВ 4710-84 |
| Запах | Специфический для ароматизатора | СТ СЭВ 4710-84 |
| Подлинность | Наличие витамина C, флавоноидов | Р 4.1.1672 п.5 и п. 11.3. |
| Размеры | Диаметр 10 ± 0,2 мм, высота 3,5 ± 0,3 мм | ОСТ 64-072-89 |
| Распадаемость, мин | не более 3 | по ГФ XI, вып. 2, ст. «Таблетки», приложение 3, с. 154. |
| Средняя масса таблеток, г | 0,35 ± 0,018 | по ГФ XI, вып. 2, ст. «Таблетки», приложение 3, с. 154. |
| Количественное содержание в пересчете на среднюю массу одной таблетки, в мг | ||
| Дигидрокверцетин | Не менее 20,0 | Р 4.1.1672 п.11.3. |
| Кислота аскорбиновая | Не менее 50,0 | Р 4.1.1672 п.5. |
По указанным параметрам установлен срок годности препарата, составивший 3 года. Препарат внедрен на ООО «Биотехнология-07», г.Нальчик.
Общие выводы
- На основании экспериментально-теоретических исследований разработан алгоритм создания быстрорастворимых лекарственных форм и парафармацевтических средств, позволяющий как оптимизировать состав и количество вспомогательных веществ, так и определить основные закономерности их технологии в условиях отечественного производства.
- Впервые предложен способ оценки стабильности гранулятов для шипучих таблеток и гранул, основанный на определении критической скорости потери массы за счет выделения углерода диоксида, равной 3,85·10-8 (%с-1)
- Методом экспертных оценок найдены границы оптимальных значений основных технологических показателей гранулятов для шипучих таблеток и гранул: коэффициента газообразования, времени растворения и давления выталкивания, на основании которых с помощью полинома — отрезка ряда Тейлора рассчитан обобщенный критерий технологического качества, выраженный в баллах, оптимальные значения которого находятся в пределах 0,1-0,2.
- Обоснована методика оценки органолептических свойств шипучих таблеток и гранул по девятибалльной шкале, достоверность которой повышается путем расчета коэффициента конкордации.
- С учетом разработанных методологических подходов обоснованы состав и технология шипучих таблеток дротаверина гидрохлорида, позволяющих ускорить время достижения максимальной концентрации действующего вещества в крови в 2 раза по сравнению с традиционными таблетками.
- Разработана технология, нормы качества сухих гранулированных и таблетированных шипучих напитков с экстрактами элеутерококка, родиолы розовой, настойкой женьшеня и витаминами, представленных в виде БАД к пище. Показано, что оптимальной технологией основного этапа производства сухих шипучих напитков является раздельная грануляция карбонатных и кислотных компонентов. Выбор необходимых корригентов осуществлен с использованием девятибалльной оценочной шкалы и коэффициента конкордации.
- Разработана технология, нормы качества и проведено исследование фармакологической активности сухих гранулированных и таблетированных шипучих солевых комплексов минеральных вод типа «Ессентуки» и «Славяновская». В качестве способа гранулирования использована совместная грануляция солевых и газообразующих компонентов. Показано, что разработанный состав «Ессентуки №17» производит больший профилактический эффект, чем природная минеральная вода, так как степень поражения СОЖ после курсового приема снижается на 58% (природная на 23%).
- На базе минерального комплекса «Ессентуки-4» и настойки травы зверобоя разработаны шипучие гранулы «Гипресс», проведены их фармакологические исследования, подтверждающие значительную противоязвенную активность предложенной композиции: в пилорическом и фундальном отделе желудка площадь язвы снижалась на 83-88%.
- На базе солевого комплекса воды «Славяновская» и комплексного экстракта коры крушины, цветков ромашки, календулы, травы тысячелистника предложены шипучие таблетки «Гастрослав». Фармакологические исследования данного состава показали выраженный гепатозащитный эффект, который обусловлен достоверным увеличением показателей активности АЛТ на 215% и ЩФ – 61%.
- Составлены формулы балльных оценок технологических показателей модельных составов быстрорастворимых «нешипучих» таблеток (диспергируемых, ородисперсных и таблеткок типа «рапид»). Для выбора лучшего состава и технологии использован критерий оптимальности БОФа, основанный на ранжировании показателей и расчете их средневзвешенных оценок.
- Обоснован состав вспомогательных веществ и разработана технология быстрорастворимых таблеток глюкозамина гидрохлорида. Средневзвешенная оценка технологических показателей модельных смесей позволили установить оптимальный состав для прямого прессования, обеспечивающий необходимую прочность полученных таблеток и время их дезинтеграции в течение не более 3 минут.
- Разработан состав и технология быстрорастворимых в полости рта таблеток «Биофлавит», содержащих дигидрокверцитин и кислоту аскорбиновую. Для выбора концентрации и количества увлажнителя впервые использовано определение пластической прочности увлажненных масс на пенетрометре КП-3.. Для оценки органолептических свойств оромукозальных таблеток разработана специальная оценочная шкала, учитывающая вкус, аромат, распадаемость в полости рта, внешний вид и цвет таблеток. Ингредиентный состав таблеток «Биофлавит» был выбран на основе определения средневзвешенных оценок пяти основных технологических показателей модельных гранулятов.
- Апробация разработанных подходов осуществлена на реальных социально значимых моделях лекарственных препаратов и парафармацевтических средств с различными физико-химическими показателями, многие из которых внедрены в фармацевтическую практику.
Список основных работ, опубликованных по теме диссертации
- А.с. 1741804 СССР, МКИ А61 К31/60 Способ производства сухих шипучих напитков /соавт. А.Н. Стачинский, Ю.Г.Пшуков, О.В.Мичник, С.В.Волокитин (СССР). - Заявл. 16.04.90.; Опубл. 23.06.92, Бюл. №23.
- Пат. 2247536 Российская Федерация, МПК А61 К31/71, 9/20 Способ получения твердой лекарственной формы, содержащей глюкозамина гидрохлорид / соавт. В.А.Компанцев, М.В. Гаврилин, Д.В.Компанцев (РФ). – Заявл. 16.06.2003; Опубл. 10.03.2005, Бюл. №7.
- Пат. 2271729 Российская Федерация МПК А23 LК2/38 Композиция для получения минерализованной воды / соавт. Е.И. Распопов (РФ). – Заявл. 22.12.2003; Опубл. 20.03.2006, Бюл. №8.
- Разработка технологии и норм качества эффервесцентных гранул с растительными адаптогенами и витаминами / соавт. А.Н.Стачинский, С.В.Волокитин, С.В.Клочков [и др.] // Формирование приоритетов лекарственной политики: Материалы докл. Рос. нац. конф. 28-29 июня 1995 г. – М., 1995. – С. 80-81.
- Исследование эффервесцентных гранул с фитокомплексами и витаминами / соавт. В.И.Погорелов, А.Н.Стачинский, Шатило В.В.[и др.] // Традиционная медицина: теоретические и практические аспекты: Материалы 2 науч. конгр. 21-23 мая 1996 г. – Чебоксары, 1996. – С. 106.
- Особенности получения эффервесцентных форм солевых комплексов минеральных вод с фитопрепаратами / соавт. Е.И. Распопов, В.В. Шатило, Амеззиан Кхалид // Актуальные вопросы использования природ., преформир. факторов, фитотерапии и др. традиционных методов в комплексном лечении органов пищеварения и обмена веществ: Материалы науч.-практ. конф. науч. и санаторно-курорт. учреждений КМВ (2; 1997; Ессентуки). - Ессентуки, 1997. – С. 162-164.
- Разработка и исследование шипучих гранул на основе солевых комплексов минеральных вод с фитопрепаратами / соавт. В.В. Шатило, А.С. Саушкина // Теорiя i практика створення лiкарских препаратiв: Матерiали мiжнарод. конф., присвяч. 75-рiччю з дня нарождення ректора ХФI, проф. Сала Д.П. - Харькiв, 1998. – С. 344-349.
- Перспективы создания эффервесцентных форм солевых комплексов минеральных вод с фитопрепаратами / соавт. Е.И. Распопов, В.В. Шатило // От Мateria Меdiса к современным медицинским технологиям: Материалы Всерос. науч. конф. 13-15 мая 1998 г. - С.-Пб, 1998. – С. 188-189.
- Новая лекарственная форма гастропротекторного действия / соавт. Е.Н.Вергейчик, Е.В.Компанцева, Ю.Г.Пшуков [и др.] // Человек и лекарство: Тез. докл. 7 Рос. нац. конгресса 19-23 апр. 2000 г. – М., 2000. – С. 481.
- Общие закономерности получения шипучих таблетированных фитоминеральных комплексов / соавт. В.В. Шатило // Актуальные проблемы создания новых лекарственных препаратов природного происхождения: Материалы междунар. съезда (4; 29 июня – 1 июля 2000; Великий Новгород). – С.-Пб., 2000. – С. 114-115.
- К вопросу создания шипучих таблетированных форм бромгексина и дротаверина гидрохлорида/ без соавт. // Регион. конф. по фармации, фармакологии и подготовке кадров (56; 2001; Пятигорск): материалы... -Пятигорск: ПятГФА, 2001. - С. 78-79.
- Разработка и исследование шипучих таблеток «Гастрослав» /соавт. В.В.Шатило, Е.И.Распопов, И.С.Данилова // Регион. конф. по фармации, фармакологии и подготовке кадров (56; 2001; Пятигорск): Материалы... -Пятигорск: ПятГФА, 2001. - С. 81-82.
- Таблетированные лекарственные формы как определяющие развитие фармпроизводств в России / соавт. Э.Ф.Степанова, А.В.Кузнецов, А.Ю.Петров // Естествознание на рубеже столетий.:материалы междунар. конф. 8-10 окт.2001 г. Дагомыс.-, М.: «Академия естествознания», 2001.- Т.2 «Мед. науки».- С.128-129.
- Изучение гастропротекторного действия шипучих таблеток «Гастрослав» / соавт. И.И. Клишина // Химия в технологии и медицине: Материалы Всеросс. науч.-практ. конф..сентябрь 2002 г. – Махачкала, 2002. – С.154-156.
- Исследование противоязвенной активности шипучих таблеток «Гастрослав» / соавт. В.Ф.Репс, И.И. Клишина,В.В.Шатило // Актуальные проблемы создания новых лекарственных препаратов природного происхождения: Материалы междунар. съезда (6; 4-6 июля 2002; С.-Пб). - С.-Пб., 2002. - С. 532 – 534.
- Разработка методологических подходов к таблетированию синтетических, природных компонентов и газообразующих смесей /соавт. Э.Ф.Степанова, А.В.Кузнецов, А.Ю.Петров // Разработка, исследования и маркетинг новой фармацевтической продукции: Материалы межрегион. конф. по фармации и фармакологии (58; 2003; Пятигорск), Пятигорск: ПятГФА, 2003. - С. 158-160.
- К оценке газообразующих свойств шипучих таблеток / без соавт. // Разработка, исследования и маркетинг новой фармацевтической продукции: Материалы межрегион. конф. по фармации и фармакологии (58; 2003; Пятигорск), Пятигорск: ПятГФА, 2003. - С. 172-175.
- Обоснование выбора вспомогательных веществ для производства шипучих таблеток дротаверина гидрохлорида / без соавт. // Успехи современного естествознания. - 2003 г. - №1. – С.68-72.
- Стандартизация нового лекарственного препарата глюкозамина гидрохлорид, таблетки по 0,3 г. / соавт. М.В.Гаврилин, Д.В.Компанцев, В.И.Погорелов //– Пятигорск, 2003. - 15 с.- Деп. В ВИНИТИРАН 17.04. 03, №743 – в – 2003.
- Обоснование выбора состава и способа производства шипучих таблеток с экстрактом элеутерококка и аскорбиновой кислотой / соавт. Э.Ф. Степанова // Актуальные проблемы создания новых лекарственных препаратов природного происхождения: Материалы междунар. съезда «Фитофарм-2003» (7; 3-5 июля 2003; С.-Пб. – Пушкин). - С.-Пб., 2003. – С.106 – 108.
- Разработка и исследование твердых лекарственных форм с повышенной биодоступностью / соавт. Э.Ф. Степанова // Современные наукоемкие технологии. – 2004. - №1 – С. 68-69.
- Основные направления и перспективы развития технологии корригированных препаратов в отечественном фармацевтическом производстве / соавт. И.Н. Андреева, Э.Ф. Степанова // Успехи современного естествознания. – 2004. - №1. – С. 99-100.
- Разработка критериев выбора вспомогательных компонентов и способа гранулирования для шипучих лекарственных форм / соавт. Э.Ф. Степанова, Н.Н. Богдашев // Фармация – 2004. - №1. – С. 32-34.
- Особенности производства быстрорастворимых лекарственных форм / без соавт. // Медицинский бизнес. – 2005. - №2-3. – С. 50-51.
- Обоснование выбора состава корригентов для сухих шипучих напитков с адаптогенами и витаминами / без соавт. // Рациональное питание, пищевые добавки и биостимуляторы. – 2005. - №3. – С.71-73.
- Исследование возможностей использования фитопрепаратов и бальнеологических факторов в санаторно-курортной практике / соавт. Э.Ф. Степанова, З.Д. Хаджиева // Всерос. съезд фармацевтических работников (2; 5-7 июня 2005; Сочи): материалы… - Сочи, 2005. – С. 141-142.
- Разработка и фармакокинетическое исследование шипучих таблеток дротаверина гидрохлорида / соавт. Э.Ф. Степанова, В.Е. Погорелый // Кубанский научный медицинский вестник. – 2005. - №3-4. – С. 36-37.
- Разработка и исследование шипучих таблеток бромгексина и дротаверина гидрохлорида/ соавт. Степанова Э.Ф., Мичник О.В.//Разработка, исследование и маркетинг новой фармацевтической продукции: сб. науч. тр. Пятигорск. ГФА. – Вып. 60. – Пятигорск, 2005.– С.167 -169.
- Совершенствование методов анализа шипучих таблеток с адаптогенами и витаминами/ соавт. В.В.Шатило, С.В.Волокитин, С.В.Клочков //Разработка, исследование и маркетинг новой фармацевтической продукции: сб. науч. тр. Пятигорск. ГФА. – Вып. 60. – Пятигорск, 2005.– С.297-298.
- Разработка и исследование шипучих минеральных и фитоминеральных комплексов/ соавт. Е.И.Распопов//Разработка, исследование и маркетинг новой фармацевтической продукции: сб. науч. тр. Пятигорск. ГФА. – Вып. 61. – Пятигорск, 2006.– С.148-149.
- Изучение стабильности таблеток дротаверина гидрохлорида шипучих/ соавт. А.С.Саушкина, Т.Ю.Арчинова//Разработка, исследование и маркетинг новой фармацевтической продукции: сб. науч. тр. Пятигорск. ГФА. – Вып. 61. – Пятигорск, 2006.– С.148-149.
- Оценка способов приготовления гранулята для шипучих таблеток дротаверина гидрохлорида/без соавт. // Изв. Вузов. Сев.-Кавк. регион. Естеств. Науки. Спецвыпуск. Фармакология. 2006.- С.66-68.
- Разработка и исследование шипучих таблеток, содержащих морской кальций и витамин Д3 / соавт. И.А.Атласова// Изв. Вузов. Сев.-Кавк. регион. Естеств. науки. Спецвыпуск. Фармакология. -2006. -С.68-69.
- Некоторые аспекты разработки технологии быстрорастворимых таблеток глюкозамина гидрохлорида / соавт. Д.В. Компанцев // Вестник Воронежского гос. ун-та. Серия: Химия. Биология. Фармация. – 2006.- №2.- С. 416-420.
- К вопросу о технологическом качестве шипучих таблеток / без соавт. // Вестник Воронежского гос. ун-та. Серия: Химия. Биология. Фармация. – 2006.- №2.- С. 413-416.
- Исследование сравнительной антиульцерогенной активности минеральной воды «Ессентуки №17» и ее искусственных аналогов / соавт. В.Ф. Репс // Вестник Воронежского гос. ун-та. Серия: Химия. Биология. Фармация. – 2006.- №2.- С. 423-426.
- Перспективы производства и применения твердых быстрорастворимых лекарственных форм / без соавт. // Вестник Воронежского гос. ун-та. Серия: Химия. Биология. Фармация. – 2006.- №2.- С. 420-423.
- Разработка и исследование шипучих солевых комплексов минеральных вод / без соавт. // Вестник новых медицинских технологий. – 2006. – Т. 13. -№4. - С. 169-170.
- Производство таблеток в соответствии со стандартом GMP: Учебное пособие (на компакт-диске) / соавт. В.И. Погорелов, А.В.Пантюхин // Реком. УМО по мед. и фарм.образованию ВУЗов России (протокол от 25.01.07).- Пятигорск: Пятигорск.ГФА.,2005.-239 Мб
Шевченко Александр Михайлович
Методологические аспекты разработки технологии твердых быстрорастворимых
лекарственных форм
15.00.01 – Технология лекарств и организация фармацевтического дела
Автореферат
на соискание ученой степени доктора фармацевтических наук
Подписано к печати __.__.2009 Формат бумаги 60x84 1/16
Бумага книжно-журнальная. Печать ротапринтная. Усл. печ. л. 2,0.
Тираж 100 экз. Заказ №
Государственное образовательное учреждение высшего профессионального образования «Пятигорская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию» (357532, г. Пятигорск, пр. Калинина, 11)

