Методы и средства многочастотной электроимпедансометрии тканей человека для онкохирургии
На правах рукописи
БЕЛИК Кирилл Дмитриевич
МЕТОДЫ И СРЕДСТВА МНОГОЧАСТОТНОЙ ЭЛЕКТРОИМПЕДАНСОМЕТРИИ ТКАНЕЙ ЧЕЛОВЕКА ДЛЯ ОНКОХИРУРГИИ
Специальность 05.11.17 - Приборы, системы и изделия медицинского назначения
Автореферат
диссертации на соискание ученой степени кандидата технических наук
Новосибирск - 2010
Работа выполнена в Государственном образовательном учреждении
высшего профессионального образования
"Новосибирский государственный технический университет"
Научный руководитель: доктор технических наук, профессор
Губарев Василий Васильевич
Официальные оппоненты: доктор технических наук, доцент
Лисицина Лилия Ивановна
кандидат технических наук, профессор Пеккер Яков Семенович
Ведущая организация - ГОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск
Защита диссертации состоится «09» ноября 2010 г. в 14-00 часов на заседании диссертационного совета Д 212.173.08 при Государственном образовательном учреждении высшего профессионального образования «Новосибирский государственный технический университет» по адресу: 630092, Новосибирск, пр. К. Маркса, 20.
С диссертацией можно ознакомиться в библиотеке Новосибирского государственного технического университета.
Автореферат разослан «___» октября 2010г.
Ученый секретарь
диссертационного совета,
кандидат технических наук, доцент В.Л. Полубинский
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность
В настоящее время онкологические заболевания наносят огромный экономический ущерб — в 2010 г. в России он может составить около 200 млрд. рублей за год.
При лечении онкозаболеваний наибольшее распространение вследствие своей большей эффективности имеет хирургический метод. Однако, несмотря на его постоянное совершенствование, некоторые определяющие результаты операций по удалению онкоопухолей практически не изменились в мире за последние 30 лет. Например, в среднем только 30 – 40 % радикально оперированных больных раком легких переживают контрольный 5-летний срок, вследствие того, что у большинства из них в течение 2 – 3 лет после операции происходит прогрессивное развитие опухолевого процесса с региональным метастазированием.
Аналогичная ситуация и в хирургическом лечении онкозаболеваний на других органах человека. Она усугубляется тем, что опухоли выявляются чаще всего на III-IV, реже на II клинических стадиях.
Главными причинами таких результатов лечения в современной онкохирургии являются: а) невозможность на основании результатов рентгеновской или ультразвуковой диагностики определить проекцию внутритканевой опухоли на поверхность части органа, открытой к хирургическому доступу, то есть проекцию ее границ, а также глубину локализации опухоли от этой поверхности; б) затрудненность выявления метастазированных лимфатических узлов. Это не позволяет хирургу проводить удаление пораженной ткани в полном объеме, в особенности, если либо сама опухоль в процессе проведения хирургической операции не определяется макроскопически, либо ее конфигурация или конфигурация области с гистологически измененной тканью являются сложными.
Современная технология подготовки образца ткани, полученного в результате биопсии, к проведению морфологического анализа исключает возможность его эффективного применения в рамках проведения хирургической операции. Сложность определения фактических геометрических размеров онкоопухоли и гистологически измененной ткани приводит к: 1) удалению участков здоровой ткани, что увеличивает сроки послеоперационной реабилитации и повышает риски последующей инвалидизации пациента; 2) невключению в область абляции участков измененной ткани и метастазированных лимфатических узлов, что происходит чаще и приводит к летальности в ближайшем периоде.
В связи с этим необходима разработка таких методов и средств диагностики, которые были бы свободны от этих недостатков и обеспечивали необходимую диагностику во время хирургического вмешательства.
Цель диссертационной работы - разработка методов определения наличия, границ и степени злокачественности патологии ткани органов человека и создание на их основе многочастотной электроимпедансной системы, обеспечивающей автоматическое сопровождение различения здоровых и патологических тканей в ходе хирургического вмешательства.
Для достижения поставленной цели необходимо решение следующих задач, определяющих основное содержание диссертационной работы:
- Обосновать целесообразность использования многочастотной электроимпедансометрии для автоматизации сопровождения хирургических операций по удалению опухолей.
- Ввести диагностические показатели, позволяющие осуществлять выявление патологий, в частности, внутритканевых опухолей, определения их границ и типа на основе многочастотной электроимпедансометрии.
- Разработать методы измерения введенных диагностических показателей в ходе хирургической операции.
- Разработать методы и средства обеспечения достоверности выявления опухоли и ее границ в условиях влияния основных видов технических и клинических факторов, характерных для хирургической операционной.
- Создать многочастотную электроимпедансную электрохирургическую систему, обеспечивающую автоматизацию процедур локализации опухоли внутри здоровой ткани и ее последующее удаление.
Объектом исследования в настоящей диссертационной работе являются медицинские технические средства, позволяющие автоматически различать во время операции здоровые и опухолевые биологические ткани органов организма человека.
Предметом исследования являются диагностические показатели, принципы построения, методы, средства измерения электрического импеданса[1] биологических тканей и введенных диагностических показателей, технические (аппаратные и программные) решения и методики, предназначенные для распознавания здоровых и патологически измененных (опухолевых) тканей, выявления в ходе операции разделяющих эти ткани границ.
Методами исследования являются: электроимпедансометрия биологических тканей, гистологические, статистические, математического моделирования, сравнительного (в т.ч. SWOT) анализа.
Результаты, выносимые на защиту, и их научная новизна
- Итоги обоснования целесообразности применения многочастотной электроимпедансометрии для решения поставленных в работе задач.
- Три оригинальных диагностических показателя выявления и дифференциации опухолевых тканей (средний по диапазону частот импеданс, интегральный коэффициент поляризации и относительный коэффициент соседней поляризации), отличающиеся использованием электрических импедансов тканей, измеренных на нескольких частотах, расположенных на разных участках частотных характеристик тканей, и расчетный индекс, позволяющие отличать опухолевые ткани от здоровых и различать опухолевые ткани по степени злокачественности.
- Двухэтапный метод неинвазивного определения наличия и границ опухоли одного органа, отличающийся тем, что на первом этапе проводится контрольное измерение электрического импеданса заведомо здоровых тканей органа, подлежащего оперированию, а на втором - поиск опухолевой ткани в этом органе, определение места ее расположения и границ.
- Метод неинвазивной аппаратной диагностики метастазов в лимфатических узлах, основанный на сравнении значений предложенного интегрального коэффициента поляризации электрического импеданса, измеренного с поверхности исследуемого лимфатического узла, с его значениями, определенными для заведомо здоровых лимфатических узлов того же органа в том же анатомическом регионе.
- Многочастотная электроимпедансная система для онкохирургии, реализующая теоретические результаты исследований и позволяющая неинвазивно обнаруживать внутритканевую опухоль, определять ее границы, маркировать их, осуществлять последующее удаление опухоли в соответствии с этими границами, выявление метастазированных лимфатических узлов, управление рабочим процессом и его визуализацию.
Изобретательская новизна предлагаемых решений подтверждается следующими патентами РФ на изобретения: «Электрическая система для онкохирургии», RU2354327 C1, публ.10.05.2009г., приоритет от 23.11.2007г.; «Система электроимпедансной онкологической диагностики», RU2376933 C1, публ.27.12.2009г., приоритет от 14.04.2008 г.; «Система диагностики биотканей», RU 2387372 C1, публ.27.04.10г., приоритет от 02.10.2008 г.
Степень достоверности и обоснованности результатов исследований. Сформулированные в диссертации научные положения, выводы и рекомендации обоснованы приводимыми в работе теоретическими и экспериментальными исследованиями, не противоречат известным положениям физики, измерительной техники, информатики, методов обработки данных и биотехнических систем, базируются на строго доказанных выводах, подтверждаются апробацией на различных конференциях и семинарах. На основе результатов исследований создан опытный образец электрохирургической электроимпедансной системы. При проведении экспериментальных исследований были получены значения импеданса на каждой частоте измерительного диапазона для тканей желудка, печени, легкого, головного мозга, матки, кишечника, пищевода, селезенки, поджелудочной железы, сосудов in vivo у более, чем 200 пациентов. В процессе выполнения работы на сегодняшний день для 215 обследуемых получены и гистологически подтверждены значения электрического импеданса здоровых и содержащих опухоль тканей in vivo и ex vivo. Результаты измерений электрического импеданса здоровых и опухолевых тканей подтверждены гистологическими исследованиями, проведенными специалистами Томского НИИ онкологии СО РАМН, патоморфологических отделений Городской клинической больницы №1, Городской клинической больницы №25, Новосибирского областного онкологического диспансера, Новосибирского НИИ травматологии и ортопедии, Государственной Новосибирской областной клинической больницы, за что автор выражает им благодарность.
Теоретическая значимость результатов работы. В работе решены задачи разработки методов и технических средств для автоматизированного выявления внутритканевых опухолей в биотканях органов человека, определения их степени злокачественности в ходе хирургической операции и обеспечивающих удаление опухоли с минимальным включением здоровой ткани в зону абляции, имеющих существенное значение для хирургии опухолей и обеспечивающих сокращение послеоперационного реабилитационного периода.
Практическая значимость полученных результатов. Внедрение разработанных методов и средств позволяет: автоматизировать процесс определения патологий в тканях, усовершенствовать медицинские технологические процессы с точки зрения уменьшения времени операции, улучшения качества ее проведения, обеспечения максимального сохранения здоровых тканей; обеспечить уверенное удаление опухоли для типовых клинических случаев при использовании существующих операционных технологий; повысить уровень автоматизации медицинских технологий за счет полностью автоматического различения здоровой и опухолевой тканей; сократить время операции и нахождения больного в стационаре.
Практическое использование разработанной электроимпедансной медицинской системы, сопровождающей удаление онко- и доброкачественных опухолей, не требует особых условий для ее применения в лечебной практике медицинских учреждений РФ кроме необходимости соответствующей специальной подготовки врачей и среднего медицинского персонала, непосредственно работающих с системой.
Проведенные маркетинговые исследования подтверждают востребованность таких систем для онкохирургии.
Работа выполнялась в рамках следующих НИР: в 2006 году - «Исследование свойств биологических тканей человеческого организма для проведения технических испытаний параметров электрохирургических аппаратов»; в 2007 году - «Создание класса медицинских систем по достоверному удалению онко- и доброкачественных опухолей (на основе определения электрических параметров здоровых и патологических биотканей человека)» ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технического комплекса России на 2007-2012 годы»; в 2008 году - «Создание модели измерительного блока системы для достоверного удаления онко- и доброкачественных опухолей печени человека»; в 2009 - 2010 годах - «Исследование параметров электрического импеданса кровеносных и лимфатических сосудов человека», АВЦП «Развитие научного потенциала высшей школы».
Внедрение результатов работы. Создана реально действующая электроимпедансная система для онкохирургии, которая получила Большую золотую медаль Сибирской ярмарки на выставке МедСиб-2008 и Серебряный диплом на 4-й Сибирской Венчурной ярмарке в 2010 году. На базе Сибирского научно-исследовательского и испытательного центра медицинской техники проводятся ее приемочные технические испытания. Ведется ее подготовка к клиническим испытаниям.
Публикации. Основное содержание диссертационной работы и ее результатов полностью отражено в 10 научных работах, в том числе в 1 монографии, 2 статьях в изданиях, рекомендованных ВАК РФ, 4 материалах российских и международных конференций, 3 патентах РФ на изобретения электроимпедансных систем.
Апробация работы. Материалы работы были доложены на школе-семинаре «Технологии высоких энергий для биологии и медицины» - 07.10.09 г. (ИЯФ СО РАН); на 8-й и 9-й международных конференциях «Актуальные проблемы электронного приборостроения» (АПЭП) в 2006 и 2008 годах; на 4-й Российско-Баварской конференции по биомедицинской инженерии в 2008 году; на проблемной комиссии Новосибирского НИИТО по нейрохирургии в 2008 году, на научных сессиях НГТУ в 2008-2009 гг.
Личный вклад автора в полученные результаты. Все выносимые на защиту результаты получены автором самостоятельно. Участие соавторов сводится к методическим консультациям и участию в получении экспериментальных результатов по предложенным автором постановке задач и технологиям.
Структура и объем работы. Диссертационная работа состоит из введения, четырех глав, заключения, списка литературы и трех приложений. В работе приведен список литературы, состоящий из 94 наименований. Работа изложена на 162 стр., включает 17 таблиц, и иллюстрируется 32 рисунками.
СОДЕРЖАНИЕ ДИССЕРТАЦИИ
Во введении обоснована актуальность темы диссертационной работы, определены цель и задачи исследования, отмечена научная новизна и практическая значимость полученных результатов, приведены сведения о внедрении, апробации работы и публикациях по теме диссертации, сформулированы основные положения, выносимые на защиту.
В первой главе приведено теоретическое обоснование целесообразности использования многочастотной электроимпедансометрии для автоматизации сопровождения хирургических операций по удалению опухолей.
В начале первой главы диссертации приводятся известные физические основы, касающиеся электрического импеданса биологических тканей. В частности, важные для понимания дальнейшего: эквивалентная электрическая схема биологической ткани, сведения о структурных уровнях поляризации биологических тканей, значения времени релаксации для разных объектов поляризации (тканевых слоев, клеток, их структурных элементов, воды и электролитов), частотные диапазоны, в которых наиболее значимо проявляется поляризация перечисленных структурных элементов ткани, а также качественный характер зависимости электроимпеданса ткани от частоты воздействующего на ткань периодического электрического поля. Приведены принципиально важные для решения задач известные сведения о различии структур здоровых и патологических клеток. Показана определяющая роль этих различий в поляризационной способности элементов клетки.
Далее дается обзор публикаций по теме диссертации. Показывается, что в них не отражены решения задач, поставленных в диссертации.
Проведен анализ используемых в клинической электроимпедансометрии схем подключения измерительных электродов к телу пациента, по результатам которого определена схема, которая может использоваться для измерения электрического импеданса с поверхности внутреннего органа в условиях как полостной операции, так и операции с малым доступом.
Затем дается сравнительный анализ способов воздействия на ткань при использовании существующих типов хирургических аппаратов (плазменных, лазерных, ультразвуковых, электрохирургических) и обосновывается целесообразность применения для решения поставленных задач именно электрохирургических аппаратов, обеспечивающих наилучшую аппаратно-программную реализацию методов измерения электрического импеданса тканей в ходе хирургического вмешательства.
В п.1.3 диссертации рассматриваются ожидаемые факторы, которые могут сопутствовать хирургическим операциям и влиять на погрешность измерения импеданса, производных от них показателей и, как следствие, на достоверность различения опухолевых и здоровых тканей (определение достоверности дано в п. 3.4 диссертации).
Выделены факторы, сопутствующие хирургическим операциям и влияющие на измерение импеданса. Такими факторами являются: электромагнитные помехи; клинические условия (наличие кровотечения, рубцовой ткани и т.д.); изменение площади касания и силы прижатия измерительного электрода к ткани; индивидуальные особенности оперируемых и их органов; погрешности, вносимые самой измерительной системой. Показано, что важной проблемой электроимпедансометрии тканей во время хирургической операции является наличие широкополосного помехового фона, источником которого является преимущественно хирургическое оборудование, работающее в операционной.
В п.1.4 дается SWOT-анализ описанных в публикациях решений по электроимпедансной диагностике опухолевых и здоровых тканей. В результате анализа выявлены те задачи, без решения которых нельзя осуществить автоматизацию определения наличия опухоли, окруженной здоровой тканью, степени ее злокачественности и локализации в ходе хирургического вмешательства.
В связи с этим в п.1.5 конкретизируется постановка задач диссертационного исследования.
Во второй главе исследовано влияние внешних факторов на результаты электроимпедансометрии тканей, описаны методики измерения электрического импеданса при проведении экспериментальных исследований, приведены и проанализированы недостатки двухчастотных импедансных методов и систем.
Вначале исследуются частотные зависимости импедансов разных видов тканей для областей, содержащих патологию, в том числе не являющуюся опухолью, и для областей, не содержащих ее. Показано, что структурная патология ткани приводит к значительному отличию импеданса тканей, содержащих эту патологию, от импеданса здоровых тканей.
Многочастотные исследования, проведенные in vivo для тканей различных органов (желудка, печени, легкого, головного мозга, матки, кишечника, пищевода, селезенки, поджелудочной железы, сосудов), отраженные в отчетах по НИР, показали, во-первых, нелинейно спадающий характер зависимости импеданса от частоты воздействующего на ткань периодического напряжения, во-вторых, значимое, хорошо различимое отличие импеданса здоровых тканей от структурно измененных тканей, в-третьих, значимое влияние таких клинических факторов как наличие рубцов, поверхностное кровотечение, абсцесс, на значение импеданса и его частотную зависимость. В диссертации приводятся примеры графиков таких зависимостей (рис. 1 и 2) с указанием коэффициентов вариации по группе индивидуумов.
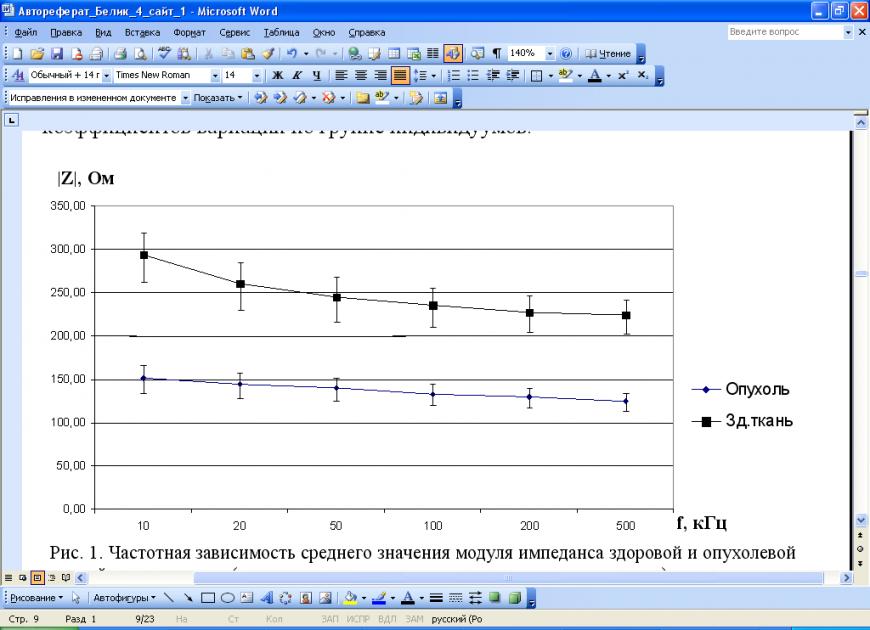
Рис. 1. Частотная зависимость среднего значения модуля импеданса здоровой и опухолевой тканей одного органа (желудок при измерении со стороны слизистого слоя), полученная по 180 измерениям (опухоли T1N0M0)
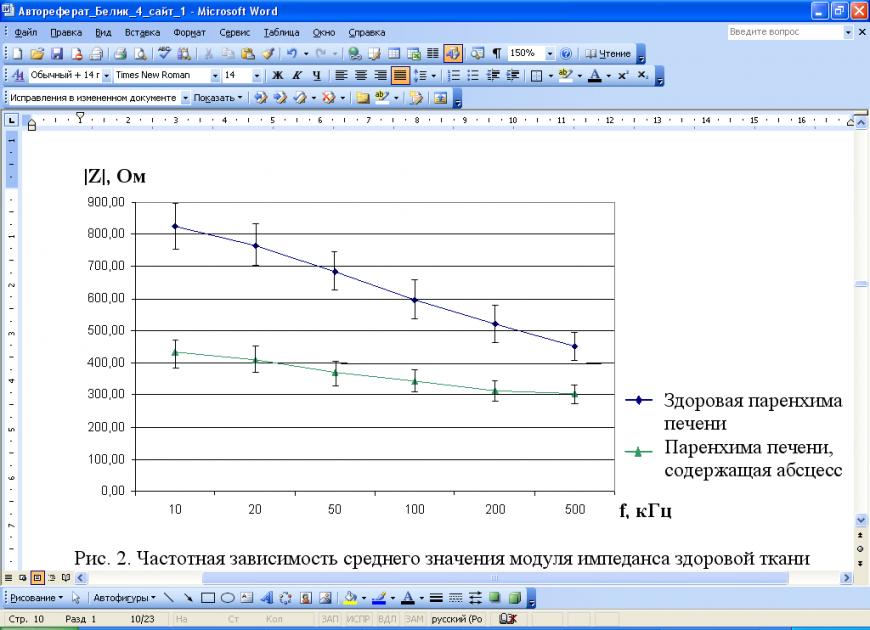
Рис. 2. Частотная зависимость среднего значения модуля импеданса здоровой ткани паренхимы печени и этой же ткани, содержащей абсцесс (моделирование при помощи 0,9% раствора NaCl), полученная по 120 измерениям
Результаты исследований подтвердили: во-первых, принципиальную возможность различения здоровых и патологических тканей на основе значений импеданса, измеренных на разных участках частотного диапазона, во-вторых, целесообразность проведения измерений на здоровых и патологических тканях того же пациента и органа тем же методом для устранения индивидуальных особенностей, характерных для каждого органа и пациента, в-третьих, необходимость учитывать наличие клинических факторов в ходе операции.
Важным фактором, влияющим на погрешность измерения импеданса тканей, являются электромагнитные помехи, возникающие от работы в операционной различного оборудования и воздействующие на результаты измерения импеданса тканей оперируемого органа. Для исследования характера таких помех в хирургической операционной была проведена серия из 40 физических имитационных экспериментов по анализу амплитудно-частотных характеристик помех в точках измерения на поверхности ткани пациента.
Кроме того анализировался частотный состав помех, наводимых на цепь измерения измерителя импеданса, находящегося на разном расстоянии от источника помех, когда источником являлся электрохирургический аппарат ЭХВЧ-250-6, работающий в типовых режимах: коагуляция, резание, смешанный и «спрэй». В качестве примера в диссертации приводятся 8 графиков амплитудно-частотных характеристик подобных помех, усредненных по результатам 5 измерений каждый, для указанных режимов работы аппарата, находящегося на расстоянии 1м и 3м от измерителя. На основе полученных результатов исследований показаны: 1) существенная неравномерность пиковых значений наводимых помех в зависимости от используемого режима работы источника помех, 2) значимость влияния помех на результат измерения в виде отношения максимального значения наведенного напряжения к величине измерительного напряжения (до 23%).
В п.2.4 диссертации рассматриваются недостатки существующих методов и средств двухчастотной электроимпедансометрии с точки зрения решаемых задач. Среди них невозможность их непосредственного использования для обнаружения внутритканевой опухоли, определения ее границ и степени злокачественности в ходе работы в хирургической операционной, вызванная высокой чувствительностью к выбору частот, на которых производятся измерения в условия влияния широкополосных помех. Обсуждаются вопросы затруднения устранения этих недостатков приемами, связанными с усреднением разнесенных по времени многократных измерений, осуществленных в периоды минимального уровня помех, и обосновывается предпочтительность перехода к многочастотной электроимпедансометрии.
Это позволяет обеспечить: соблюдение временных регламентов на выполнение хирургической операции за счет однократности осуществления измерительных процедур; различение тканей по частотным характеристикам их импеданса, зависящим как от вида тканей (для здоровых тканей), так и от наличия опухолей в них; определение границ опухолей и степени их гистологической измененности (злокачественности); устранение или уменьшение погрешностей измерения импедансов путем учета влияния факторов, сопутствующих операции, в разных частотных диапазонах.
Третья глава диссертации посвящена неинвазивным методам выявления внутритканевых патологий, а именно описанию и исследованию вводимых электроимпедансных диагностических показателей для определения наличия внутритканевых опухолей, определения их границ и степени злокачественности через исследования их поляризационных способностей, о чем говорится в начале первой главы диссертации, и вопросам снижения погрешностей измерения этих показателей. В начале главы рассматривается известный двухчастотный диагностический показатель поляризации ткани Тарусова  где f1 и fn - крайние значения диапазона частот измерительного поля и обосновывается его малая пригодность для решения поставленных в работе задач.
где f1 и fn - крайние значения диапазона частот измерительного поля и обосновывается его малая пригодность для решения поставленных в работе задач.
В п.3.1 для достижения поставленной в работе цели введены три оригинальных диагностических показателя (средний по диапазону частот импеданс, интегральный коэффициент поляризации и относительный коэффициент соседней поляризации), позволяющие выявлять внутритканевую опухоль, определять ее границы и степень злокачественности на основе многочастотной электроимпедансометрии.
Для повышения помехоустойчивости результатов измерения импеданса и обеспечения различения тканей, предложены и исследованы два новых интегральных показателя. Первый - средний по диапазону частот импеданс
 , (1)
, (1)
где n – количество частот, на которых происходит измерение импеданса |Z|, |Zi| - результат измерения на i-ой частоте, преимущественно характеризующий среднюю для используемых частот электрического поля поляризованность (энергию поляризации) элементов (преимущественно внутриклеточных органелл и белковых макромолекул) клеток и некоторых групп полярных диэлектриков межклеточной среды, входящих в состав исследуемой ткани.
Он предназначен для решения задачи выявления внутритканевых опухолей и отличается меньшей подверженностью влиянию внешних факторов на результат измерения и принимаемые диагностические решения, в связи с усреднением результатов, полученных на разных частотах f1,..., fn.
Второй показатель - интегральный коэффициент поляризации
 (2)
(2)
где |Zi| и |Zj| – модули электрического импеданса, измеренные на частотах fi и fj, соответственно, а n1 и n2 - количество рабочих частот, используемых при оценке поляризационных характеристик элементов. Этот показатель характеризует соотношение между значениями поляризованности (энергиями поляризации) медленнополяризующихся (имеющих относительно большую молекулярную массу либо размер) и быстрополяризующихся (имеющих относительно малую молекулярную массу либо размер) групп преимущественно внутриклеточных элементов, для двух нормированных диапазонов частот f1,..., fn1 и f2,..., fn2. Предполагается, что по значению коэффициента Kz можно судить об электродинамических свойствах дипольных элементов (преимущественно внутриклеточных органелл и белковых макромолекул) клеток, т.е. о наличии или отсутствии и степени патологии ткани. Определено, что интегральный коэффициент поляризации может использоваться только при обнаружении и определении внутритканевой опухоли, объем которой в значительно превышает объем окружающей ее здоровой ткани. Использование среднего по диапазону частот импеданса в числителе и знаменателе, по сравнению с коэффициентом поляризации по Тарусову, позволяет уменьшить статистические погрешности измеряемого показателя. Повышенная помехоустойчивость показателей подтверждена экспериментально, измерением введенных диагностических показателей в условиях имитации максимальной погрешности измерения импеданса Zf. Определено количество частот равное шести, достаточное для обеспечения отклонений введенных показателей на уровне 10% при среднем значении максимальной погрешности 15% на четырех из них.
Для обнаружения и распознавания внутритканевой опухоли, предлагается использовать значения электрического импеданса, определенные на частотах измерительного поля, соответствующих областям поляризации, преимущественно характеризующим диэлектрическую восприимчивость внутриклеточных структур тканей паренхиматозных и мышечных органов. Исходя из этого, выбран измерительный диапазон частот: 10 - 500 кГц.
На базе предложенного интегрального показателя Kz разработан метод неинвазивной аппаратной диагностики метастазов в лимфатических узлах. Он основан на сравнении значений Kz, измеренного с поверхности исследуемого лимфатического узла, с его значениями, определенными для заведомо здоровых лимфатических узлов того же органа в том же анатомическом регионе. Проведено экспериментальное исследование метода. Результаты проведенных исследований (табл. 1)[2] для лимфатических узлов желудка подтверждают возможность выявления лимфаденопатий, вызванных метастазами злокачественных опухолей.
Таблица 1
Значения интегрального коэффициента поляризации Kz здоровых и метастазированных лимфатических узлов желудка
| Ткань лимфатического узла | Интегральный коэффициент поляризации | Количество исследованных лимфатических узлов |
| Здоровая | 1,58±0,16 | 15 |
| Метастазы | 1,31±0,02 | 11 |
| Метастазы на стадии TNM4 | 1,18±0,01 | 9 |
В ходе исследований обнаружена тенденция уменьшения значений Kz при развитии некротических процессов злокачественных клеток в лимфатическом узле, вызванных развитием онкологического процесса. Установлено, что лимфатический узел может быть признан метастазированным, если значения его коэффициента Kz отклоняются от значений этого показателя для здорового лимфатического узла более, чем на 10%.
Затем приводятся результаты исследования возможности применения показателей Zs и Kz для неинвазивного выявления разных онкологических патологий, в частности карциноидной опухоли, аденокарциномы желудка, находящихся в разных стадиях развития патологии (табл. 3.4 и 3.5 диссертации) при измерении импеданса со стороны слизистой и серозной тканей, проведенного совместно со специалистами НГМУ. В результате исследования подтверждена пригодность среднего по диапазону частот импеданса и непригодность интегрального коэффициента поляризации для обнаружения внутритканевых опухолей.
Для повышения чувствительности дифференцирования онкопатологических тканей, отличающихся поляризованностью (энергией поляризации) отдельных групп ее элементов и, следовательно, удельным сопротивлением, по степени злокачественности, в п. 3.1.3 введен третий диагностический показатель - относительный коэффициент соседней поляризации (ОКСП) n в виде
 (4)
(4)
где Zfn - импеданс на частоте fn; fn, fn+1 - соседние частоты из последовательности f1, f2,..., fm, на которых происходит измерение импеданса заведомо здоровой либо для предположительно опухолевой ткани. ОКСП определяет поляризованность (энергию дипольной поляризации) относительно небольших групп преимущественно внутриклеточных элементов здоровой и патологической тканей. С использованием этого коэффициента разработан метод распознавания опухолевых тканей по степени злокачественности, основанный на учете степени электрической неоднородности клеточных структур. В рамках этого метода для определения характера патологий через поляризованность элементов ткани, был введен показатель
 , (5)
, (5)
рассчитываемый на основе упорядоченных наборов значений ОКСП, где i - значения ОКСП, рассчитанные по результатам измерения импеданса на частотах последовательности (10; 20; 50; 100; 200; 500) кГц, а i - порядковый номер ОКСП в этом наборе. Степень злокачественности при этом определяется по величине соотношения между значениями показателя, измеренными для здоровой ткани, от этих показателей для обследуемой патологической ткани.
Далее проводилось исследование введенных показателей.
Результаты исследования и, примеры которых приведены в табл. 2, показали различие между параметрами поляризации (поляризационной способностью) структурных элементов: а) различных типов здоровых тканей, составляющих один орган; б) тканей злокачественных и доброкачественных новообразований, как в отличие от здоровых тканей, так и между собой. Это позволяет по набору значений и различать между собой как здоровые ткани, составляющие один орган, так и злокачественные и доброкачественные опухоли, локализованные в здоровых тканях.
Таблица 2
Значения и здоровых и опухолевых тканей желудка
| Описание злокачественности | Ткани по степени злокачественности | (10-20),% | (20-50), % | (50-100), % | (100-200), % | (200-500), % | Клеточ ный индекс (), % | Коли чество тканей |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Доброкачественная | Железистый полип (доброкачественный) | 6,1±0,2 | 9,0±0,3 | 8,9±0,3 | 11,8±0,4 | 18,5±0,6 | 54,3±0,6 | 11 |
| Здоровая | Здоровая слизистая ткань желудка | 3,8±0,1 | 6,2±0,2 | 5,5±0,2 | 7,0± 0,2 | 13,5±0,5 | 36,0±0,5 | 123 |
| Здоровая мышечная ткань желудка | 4,2±0,1 | 4,1±0,1 | 4,3±0,2 | 6,7± 0,2 | 10,3±0,3 | 29,6±0,3 | 114 |
Продолжение табл. 2
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Злокачественная | Умереннодиффе ренцированная аденокарцинома (низкая степень злокачественности) | 1,7±0,1 | 3,7±0,1 | 3,4±0,1 | 4,6± 0,1 | 8,8± 0,3 | 22,2±0,3 | 45 |
| Низкодиффе ренцированная аденокарцинома (средняя степень злокачественности) | 1,9±0,1 | 3,5±0,1 | 3,3±0,1 | 4,1± 0,1 | 7,9± 0,2 | 20,7±0,2 | 39 | |
| Недифференциро ванная аденокарцинома (высокая степень злокачественности) | 1,0±0,1 | 2,6±0,1 | 2,8±0,1 | 4,0± 0,1 | 8,7± 0,3 | 19,1±0,3 | 28 |
Далее в п. 3.2 рассматриваются методы локализации опухоли, окруженной здоровой тканью. Вначале дается анализ возможных решений задачи локализации опухоли: схема продольного размещения электродов с изменяемым углом и параллельного расположения с коническим измерительным сектором. Обосновывается выбор полезного варианта - на основе конического сектора, для которого вводятся необходимые расчетные соотношения. Разработан двухэтапный метод неинвазивного определения наличия и границ опухоли, окруженной здоровой тканью. Согласно методу, на первом этапе проводится контрольное измерение электрического импеданса заведомо здоровых тканей органа, подлежащего оперированию, а на втором - поиск опухолевой ткани в этом органе, определение места ее расположения и границ. При этом признаком центра опухоли является максимальное отличие значения среднего по диапазону частот импеданса, находящегося за пределами диапазона значений этого показателя, определенного для здоровой ткани, от значений границ этого диапазона. Признаком границы опухоли является минимальное отличие измеренного значения среднего по диапазону частот импеданса, находящегося за пределами этого диапазона, от значений, являющихся границами диапазона.
Введенные расчетные математические соотношения описывают локализацию и электрический импеданс опухоли в здоровой ткани при следующих условиях:
- диагностика проводится для одного органа;
- измерительный сектор имеет коническую форму (рис. 3);
- имеет место закон Ома;
- расстояния между измерительным и нейтральным электродами равны для каждой точки измерения.
Показано, что максимальное значение площади сечения обнаруживаемой (и распознаваемой) опухоли на уровне ее срединной линии для конического измерительного сектора определяется неравенством
 (6)
(6)
где rопух - максимальный радиус опухоли, обнаруживаемой на глубине hопух, при расстоянии от центра измерительного электрода до центра пассивного электрода hТК., Dпэ - диаметр нейтрального электрода, включенного в цепь измерения. Для повышения чувствительности метода обнаружения внутритканевой опухоли и определения ее границ, предложено использование секционного нейтрального электрода.
Рис. 3. Графическая интерпретация метода неинвазивного определения наличия и границ внутритканевой опухоли: Zзо - импеданс (средний по диапазону частот), измеренный для ткани, содержащей опухоль; Zз - импеданс (средний по диапазону частот), измеренный для заведомо здоровой ткани; Zопух - импеданс (средний по диапазону частот) опухоли; Zздор(1,2,3) - импеданс (средний по диапазону частот) областей здоровой ткани
Определено отношение
 (7)
(7)
определяющее глубину расположения опухоли hопух (ее нижнюю границу), где l - высота опухоли - ожидаемое максимальное значение высоты опухоли, рассчитанное по данным компьютерной томографии.
Далее приводятся результаты экспериментальных модельных исследований, подтверждающих практическую пригодность предложенного метода для определения нижней границы внутритканевой опухоли (табл. 3, где hопух_измер - результаты измерения границ «опухоли» после ее препарирования, а hопух_расч - результаты расчета, получаемые согласно (7) до препарирования).
Таблица 3
Результаты экспериментальных исследований по определению расстояния от поверхности ткани до нижней границы внутритканевой «опухоли» (hопух) для паренхимы печени
| Высота препарата, hтк, мм | Импеданс в точках «здоровая ткань», «граница» и «центр «опухоли» на частотах 10, 100 и 500 кГц | Высота «опухоли», l, мм | hопух_расч на частотах 10;100;500 кГц, мм | hопух_измер, мм | Относительная погрешность определения hопух на частотах 10;100;500 кГц, % | |||||
| здоровая ткань | центр опухоли | |||||||||
| 10 | 100 | 500 | 10 | 100 | 500 | |||||
| 32 | 494,48±17,54 | 360,56±27,65 | 270,76±10,51 | 298,01±7,41 | 165,72±8,35 | 139,01±5,27 | 6 | 15,1±1,4 13,6±1,1 14,1±1,1 | 16 | 5,65 15,06 12,06 |
| 15 | 507,40±21,14 | 396,97±31,76 | 284,79±19,74 | 321,87±6,76 | 201,80±10,34 | 146,28±10,98 | 4 | 10,0±0,9 9,0±0,8 9,0±0,8 | 9 | 10,61 0,31 0,06 |
| 12 | 527,05±42,91 | 407,27±34,59 | 290,30±25,70 | 338,32±6,52 | 200,35±8,40 | 158,76±12,23 | 4 | 7,5±0,10 6,7±0,8 6,9±0,8 | 8 | 8,83 17,03 13,60 |
| 10 | 505,09±12,90 | 386,20±17,06 | 272,27±6,49 | 296,10±9,47 | 179,24±11,40 | 133,30±8,97 | 4 | 7,2±0,1 6,6±0,1 6,7±0,1 | 7 | 10,52 18,06 16,69 |
В таблице 3 представлены значения, усредненные по серии из 16 экспериментов, и их максимальные отклонения от среднего.
Затем приводится официальное определение понятия «достоверность», используемое в клинических методах исследования (на основании Приказа Минздрава России № 223 от 05.06.1996) и рассматриваются методы повышения достоверности определения границ и распознавания тканей внутритканевых опухолей по степени злокачественности.
Глава завершается описанием разработанной клинической методики, регламентирующей действия хирурга и среднего медицинского персонала при работе с предложенными методами обнаружения патологий и локализации опухоли внутри здоровой ткани. Клиническая методика включает следующие этапы: обнаружение опухоли, определение ее границ, распознавание ее по степени злокачественности; обнаружение метастазированных лимфатических узлов; маркирование границ опухоли и лимфатических узлов специальным веществом; удаление патологии.
Четвертая глава посвящена техническим решениям, реализующим предложенные во второй и третьей главах теоретические подходы.
После вводных замечаний, касающихся технологических и технических методов нивелирования или устранения описанных в п.1.3 влияющих на результаты измерения факторов, в п.4.1 рассматриваются технические приемы, введенные для этого.
Вначале п.4.1 рассматриваются предлагаемые конструкции измерительного, в форме «чашки», и нейтрального электродов.
Секционный нейтральный электрод представляет собой пластины из нержавеющего металла круглой формы равного диаметра - секции электрода, расположенные согласно рис. 4 и разделенные между собой диэлектриком (например, эластомером любого биосовместимого типа). Подключение каждой из секций пассивного электрода к блоку измерения импеданса может производиться отдельно от других секций.

Рис. 4. Схема секционного расположения проводящих элементов пассивного электрода
Далее описывается аппаратное решение для уменьшения влияния помех на результаты измерения с помощью компенсационных приемов на базе схемы, изображенной на рис. 5.
Идея предлагаемого метода основана на гипотезе одинакового влияния электромагнитных помех, спектр которых находится в частотном спектре сигнала измерительного генератора на «живые» импедансы тканей и на импедансы искусственных элементов, состоящих из полевых транзисторов и варикапов, а также на измерительную аппаратуру. В качестве элемента, эквивалентного импедансу ткани Zбт исследуемого органа, используется ее электрическая модель, представляющая собой электрическую цепь с импедансом Zэбт, состоящую из полевых транзисторов и варикапов.
Рис. 5. Схема определения импеданса биотканей Zбт с настройкой эквивалентного комплексного сопротивления Zэбт
Предложенный принцип компенсации сводится к настройке активных сопротивлений (полевые транзисторы) и емкостей (варикапы) эквивалентного импеданса Zэбт(f) таким образом, чтобы мгновенные значения тока, протекающего через него, имели отклонения на величину не более чем 10% от мгновенных значений тока, протекающего через измеряемую ткань (Zбт(f)) в тех же условиях (1-2![]() 0). Для этого полевой транзистор и варикап каждого модуля эквивалентной схемы настраиваются блоком обработки на средние значения C и R, полученные в результате анализа большого количества предшествующих измерений этих значений для тканей того же типа и объема. В дальнейших расчетах в качестве измеренного значения импеданса ткани на частоте f используется значение Zэбт(f).
0). Для этого полевой транзистор и варикап каждого модуля эквивалентной схемы настраиваются блоком обработки на средние значения C и R, полученные в результате анализа большого количества предшествующих измерений этих значений для тканей того же типа и объема. В дальнейших расчетах в качестве измеренного значения импеданса ткани на частоте f используется значение Zэбт(f).
Описывается как аппаратно реализован Zэбт.
В этом же пункте описывается еще два подхода к повышению достоверности решаемых задач. Первый подход основан на подготовке измеренных значений импеданса и дальнейшей их обработке. Суть его состоит в проверке измеренных значений импеданса тканей на соответствие условиям Z(200кГц)-0,15Z(200кГц)<Z(500кГц)+0,15Z(500кГц) и Z(10кГц)-0,15Z(10кГц)<Z(20кГц)+0,15Z(20кГц) и отбраковке этих значений если одно из условий выполняется. Второй подход основан на калибровке измерительной системы путем настройки его на здоровую ткань оперируемого органа конкретного пациента и определении средних значений импедансов, измеренных за время 10 секунд на каждой частоте.
Наконец, в пп.4.2 и 4.3 описывается реальная действующая онкохирургическая многочастотная электроимпедансная система, в которой реализованы теоретические и практические наработки, изложенные ранее.
Представлена структура и описана работа аппаратно-программных частей системы, позволяющих обнаруживать метастазированные лимфатические узлы и опухоль, распознавать опухоль, маркировать ее границы и обеспечивать хирургическое воздействие на ткань, включая удаление опухоли в соответствии с этими границами, управление рабочим процессом и его визуализацию. При этом за счет определения границ опухоли, ее удаление осуществляется с минимальным допустимым захватом здоровой ткани и, за счет этого становится возможной минимизация времени послеоперационной реабилитации.
В онкохирургической системе реализованы следующие как принципиально новые, так и отличающие ее от аналогов схемотехнические решения: а) использование разработанных диагностических показателей, методов и средств; б) использование многочастотного генератора измерительного сигнала; в) наличие модуля подачи вещества-маркера и осветителя, вызывающего люминесценцию этого вещества, для нанесения пограничных линий на ткань; г) использование для диагностики многосекционного нейтрального электрода вместо односекционного.
Разработанный оригинальный блок обработки осуществляет:
- вычисление значений среднего по диапазону частот импеданса, интегрального коэффициента поляризации;
- проверку соблюдения закономерности Z(f)~Хс(f) для измеренных значений импеданса;
- установку значений емкости и сопротивления компенсирующих элементов Zэбт;
- вычисление расстояния между измерительным и пассивным электродами;
- принятие решения о выключении/включении секций нейтрального электрода из/в цепь измерения;
- вычисление значений Zопух, Zздор, глубины локализации опухоли, относительного коэффициента соседней поляризации и его показателей ();
- сравнение трех измеренных значений среднего по диапазону частот импеданса и интегрального коэффициента поляризации для здоровой ткани для выбора области гарантированно здоровой ткани при калибровке;
- сравнение значений среднего по диапазону частот импеданса и интегрального коэффициента поляризации для здоровой и предположительно опухолевой ткани, что необходимо для обнаружения патологических тканей на основе установленного коэффициента вариации, а также определения центра патологии и ее границ;
- нахождение разности значений среднего по диапазону частот импеданса между текущей и предыдущей точками измерения, позволяющей выявить направление движения измерительного электрода относительно центра опухоли;
- передачу рассчитанных значений показателей и команд в блок управления и визуализации системы.
Описываются функции, выполняемые блоком обработки (нахождение Zs, Kz,, ; определение условий наличия, центра и границ опухоли; расчет нижней границы опухоли; установка Zэбт, и т.д.).
Далее описывается структура и функции блока управления и визуализации (БУВ), модуля подачи вещества-маркера, люминесцентного осветителя. Затем описывается встроенное программное обеспечение блока обработки. Оно разработано в среде MATLAB с последующей перекомпиляцией в код AHDL. Программное обеспечение блока управления и визуализации разработано в среде Delphi, функционирует в операционной среде Windows XP/Vista и состоит из четырех последовательно загружаемых модулей, работающих во взаимодействии с программным обеспечением блока обработки: установки типа органа и ткани, калибровки системы, маркирования границ опухоли и онкорезекции, а также загружаемого отдельно пятого модуля формирования отчета. Описывается работа программных модулей и системы в целом, которая основана на: а) разработанных методах обнаружения, определения границ, глубины локализации и степени злокачественности опухоли; б) существующих принципах онкологии; в) современных клинических онкохирургических технологиях.
Управление алгоритмом работы программного обеспечения выполняется хирургом при помощи подключенных педалей и элементов управления, расположенных как виртуально на зрительном интерфейсе, так и на передней панели корпуса системы.
В заключение диссертации кратко перечислены основные результаты работы, и указаны клинические перспективы использования результатов исследования.
В приложениях содержатся описание результатов анализа конкурентоспособности онкохирургической электроимпедансной системы и технические характеристики платы осциллографа, используемой для исследования электромагнитных помех в операционной.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ РАБОТЫ И ВЫВОДЫ
В диссертационной работе получены научно обоснованные технические и технологические разработки для автоматизации обнаружения, локализации и щадящего удаления патологически измененных элементов биологических тканей, имеющие существенное значение для онкохирургии, а именно:
- обоснована целесообразность использования многочастотной электроимпедансометрии для автоматизации сопровождения хирургических операций по удалению опухолей;
- введены и исследованы диагностические показатели, позволяющие на основе многочастотной электроимпедансометрии выявлять внутритканевые опухоли, определять их границы и распознавать по степени злокачественности, а так же выявлять метастазированные лимфатические узлы;
- разработаны и исследованы методы измерения введенных диагностических показателей в ходе хирургической операции, а также обеспечения достоверности выявления опухоли и ее границ в условиях влияния основных видов технических и клинических факторов, характерных для хирургической операционной;
- создана многочастотная электроимпедансная электрохирургическая система, обеспечивающая автоматизацию процедур локализации опухоли внутри здоровой ткани и ее последующее удаление.
Созданная электроимпедансная система обеспечивает неинвазивное (без проникновения в ткань) определение границ и распознавание внутритканевой опухоли, маркирование этих границ, а также выявление метастазированных лимфатических узлов, последующее удаление опухоли по этим границам, управление рабочим процессом и его визуализацию.
При проведении экспериментальных исследований для рабочего диапазона частот были получены значения импеданса здоровых тканей желудка, печени, легкого, головного мозга, матки, кишечника, пищевода, селезенки, поджелудочной железы, сосудов in vivo более, чем у 200 пациентов.
Ожидается, что внедрение разработанных методов и средств онкохирургического вмешательства с использованием неинвазивной диагностики тканей в хирургическую практику приведет к снижению смертности на 10-15% по сравнению с сегодняшним состоянием в первые 5 лет после операции за счет максимально возможного включения опухолевой ткани и ее метастазов в зону абляции, а также к снижению объема послеоперационного восстановительного лечения на 10 %. Для уточнения указанного эффекта необходим период наблюдения пациентов после проведенной операции как в период реабилитации, так и спустя не менее пяти лет.
Разработанные методы и средства пригодны к использованию в процессе хирургического вмешательства и ориентированы на гарантированное удаление опухоли, минимизацию объема удаляемой здоровой ткани органа и, как следствие, времени послеоперационной реабилитации пациента.
Основные результаты диссертации опубликованы в следующих работах:
- Белик Д.В. Контрактивная биоэлектрокинетика. Аспекты лечебного применения физиовоздействий / Д.В. Белик, К.Д. Белик. Научное издание. Новосибирск: Сибирское книжное издательство, 2005. 304с.
- Белик Д.В. Повышение информативности при определении малых массивов онкоопухолей многочастотной импедансометрией / Д.В. Белик, К.Д. Белик // Медицинская техника. 2007. №4. С. 13-17.
- Белик К.Д. Методы моделирования при измерении импеданса и оценке глубины расположения объекта в среде с известной электрической проводимостью / К.Д. Белик, В.В. Губарев // Научный вестник НГТУ, 2009. № 4(37). С. 17-24.
- Белик Д.В.. Пат. РФ №2354327 на изобретение. Электрическая система для онкохирургии / Д.В. Белик, К.Д. Белик // Опубл.10.05.2009. бюл. № 13.
- Белик К.Д.. Пат. РФ №2376933 на изобретение. Система электроимпедансной онкологической диагностики / К.Д. Белик, Д.В. Белик // Опубл. 27.12.2009. бюл. № 36.
- Белик К.Д.. Пат. РФ №2387372 на изобретение. Система диагностики биотканей/ К.Д. Белик, Д.В. Белик // Опубл.27.04.2010. бюл. № 12.
- Белик К.Д. Параметры частотнозависимой дипольной поляризации при определении здоровых и опухолевых биотканей желудка человека / К.Д. Белик // Материалы IX международной конференции «Актуальные проблемы электронного приборостроения» АПЭП-2008. Новосибирск, 2008. Т.5. С. 87-92.
- Белик К.Д. Диагностика метастазов рака в лимфатических узлах методом многочастотной электроимпедансометрии / К.Д. Белик, В.С. Севрюков // Материалы IX международной конференции «Актуальные проблемы электронного приборостроения» АПЭП-2008. Новосибирск, 2008. Т.5. С. 93-99.
- Белик Д.В. Аппаратные подходы к практике измерения импеданса биотканей in vivo в условиях различной помеховой обстановки ЛПУ / Д.В. Белик, К.Д. Белик // Материалы VIII международной конференции «Актуальные проблемы электронного приборостроения» АПЭП-2006. Новосибирск, 2006. Т.5. С. 125-129.
- D.V. Belik. Multifrequency electrical impedance diagnostics of biotissues in oncological surgery / D.V. Belik, K.D. Belik // Proceedings of the 4th Russian-Bavarian on Biomedical Engineering. Moscow.: MIET, 2008. P. 334-338.
Подписано в печать ___.___.2010
Формат 84х60х1/16
Бумага офсетная. Тираж 100 экз. Печ. Л.
Заказ № _
Отпечатано в типографии
Новосибирского государственного технического университета
630092, г. Новосибирск, пр. К. Маркса, 20
[1] В работе словосочетания «измерение импеданса» и «значения импеданса» понимаются как «измерение модуля импеданса» и «значение модуля импеданса».
[2] В таблицах 1-2 указаны средние значения показателей и их максимальные отклонения.

