Морфогенез и его регуляция в культуре эпидермальных клеток человека
На правах рукописи
ВОРОТЕЛЯК Екатерина Андреевна
МОРФОГЕНЕЗ И ЕГО РЕГУЛЯЦИЯ В КУЛЬТУРЕ ЭПИДЕРМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА
Специальность – 03.03.04. клеточная биология, цитология, гистология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора биологических наук
Москва
2012
Работа выполнена в Учреждении Российской академии наук Институте биологии развития им. Н.К. Кольцова РАН
Научный консультант:
Доктор биологических наук, профессор Терских Василий Васильевич
Официальные оппоненты:
Член-корреспондент РАМН, доктор биологических наук, профессор Ярыгин Константин Никитич (НИИ биомедицинской химии им. В.Н. Ореховича РАМН)
Доктор биологических наук, Григорян Элеонора Норайровна (Институт биологии развития им. Н.К. Кольцова РАН)
Доктор биологических наук, Лагарькова Мария Андреевна (Институт общей генетики им. Н.И. Вавилова РАН)
Ведущая организация: МГУ имени М.В. Ломоносова, биологический факультет, кафедра клеточной биологии и гистологии
Защита состоится 21 марта 2012 г. в ______часов на заседании диссертационного совета Д002.238.01 Учреждения Российской академии наук Института биологии развития им. Н.К. Кольцова РАН по адресу: 119334 Москва, ул. Вавилова, д. 26;
e-mail: [email protected];
Факс: 8-499-135-80-12;
http://idbras.comcor.ru
С диссертацией можно ознакомиться в библиотеке Учреждения Российской академии наук Института биологии развития им. Н.К. Кольцова РАН и на сайте Института http://idbras.comcor.ru
Автореферат разослан февраля 2012 г.
Ученый секретарь
диссертационного совета
кандидат биологических наук Е.Б. Абрамова
1. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. В последние несколько десятилетий клеточная биология и биология развития значительно продвинулись в понимании закономерностей регенерации и морфогенеза у многоклеточных организмов. Одним из инструментов, позволивших сделать это, явилось развитие техники культивирования клеток и тканей. При этом выяснилось, что с одной стороны эти подходы могут быть с успехом применены в фундаментальных исследованиях, а с другой – открывают совершенно новые перспективы для регенеративной медицины.
Эпидермис был одной из первых тканей, которую начали культивировать in vitro (Green, 2008). Способность эпидермальных клеток к реконструкции многослойного пласта с последующим встраиванием в нормальные ткани после пересадки позволила успешно применять культивированные кератиноциты для закрытия ожоговых дефектов кожи и ран (Терских В.В., Васильев А.В., 1995). Одновременно был открыт путь к изучению особенностей биологии эпидермальных клеток. При этом наибольшее число исследований касалось пролиферативной активности эпидермальных клеток и ее стимуляции, а также закономерностей дифференцировки. Связано это, прежде всего, с большим количеством травм и заболеваний кожи у человека, сопровождающихся гиперпролиферацией и нарушением программы дифференциации. Поиск стимулирующих пролиферацию агентов также позволил повысить эффективность культивирования эпидермальных клеток. С ростом интереса к проблеме стволовых клеток появилась серия исследований, посвященных структурно-функциональной организации эпидермиса и регенеративному потенциалу различных клеточных компартментов, его составляющих (Blanpain & Fuchs, 2006). Однако подавляющее большинство подобных работ было проведено с использованием лабораторных животных, часто генетически модифицированных. При кажущейся гистологической однородности эпидермиса оказалось, что его функционирование поддерживается сложной иерархической системой клеточных популяций. До сих пор динамическую структуру этой ткани нельзя считать окончательно выясненной. Еще меньше ясности имеется относительно развития этой системы в онтогенезе и ее восстановлении в ходе регенерации. При этом закономерности регенерации и морфогенеза эпидермиса у человека исследуются недостаточно. Между тем, на наш взгляд, подходы с использованием культуры клеток, могут многое прояснить в этой области. Восстановление многослойной структуры эпидермального пласта в культуре с возможностью его длительного культивирования указывает на прохождение процессов регенерации, которые представляют собой вторичное развитие. Возможность воспроизведения в культуре начальных этапов регенерации наиболее сложно устроенных структур – придатков кожи человека – позволит детально изучить механизмы их развития, а также патогенез многих заболеваний кожи и волос.
В то же время, накоплена значительная информация относительно развития и функционирования придатков кожи, в частности волосяных фолликулов у животных (Tiede et al., 2007; Fuchs, 2009). У мыши исследование данного объекта оказалось чрезвычайно плодотворным для определения механизмов эпителио-мезенхимного взаимодействия в ходе морфогенеза и регенерации (Botchkarev et al., 1999; Rendl et al., 2005). Выяснилось также, что волосяной фолликул содержит несколько популяций стволовых клеток, имеющих разное происхождение. Потенциал этих клеток кажется сегодня настолько широким, что кожу можно рассматривать в качестве весьма перспективного источника клеточного материала для регенеративной медицины. Однако закономерности эпителио-мезенхимных взаимодействий, регенерации и морфогенеза, а также структуру и потенциал клеточных популяций волосяного фолликула у человека невозможно в достаточной мере изучить только с помощью методов, используемых на лабораторных животных. Это привело к возникновению пробела в изучении структурно-функциональной организации эпидермиса, эпителио-мезенхимных взаимодействий в ходе морфогенеза и регенерации у человека. Поэтому возникла необходимость разработки новых подходов. Настоящая работа посвящена изучению этих вопросов.
Цель исследования. Изучение морфогенетических процессов и механизмов их регуляции в культуре эпидермальных кератиноцитов человека.
Задачи:
- Исследовать закономерности формирования эпидермального пласта из кератиноцитов человека и возможность реконструкции структурно-функциональных единиц in vitro.
- Определить способ и механизмы миграции многоклеточных кластеров на пластике и коллагеновом геле in vitro.
- Охарактеризовать динамику пролиферативной активности мигрирующих клеток.
- Определить сохраняются ли стволовые/прогениторные эпидермальные кератиноциты в культуре, и каковы их характеристики.
- Создать клеточную модель, позволяющую изучать эпителио-мезенхимные взаимодействия и эпидермальный морфогенез in vitro, использовать ее для моделирования фолликулогенеза и изучения его механизмов.
- Разработать методы для выделения и культивирования клеток дермальной папиллы (волосяного сосочка) и охарактеризовать фенотип, дифференцировку и морфогенетический потенциал этих клеток.
- Оценить динамику транскрипции генов ключевых сигнальных путей в клетках дермальной папиллы при культивировании.
Научная новизна и теоретическая значимость работы. Впервые показано, что культивированные эпидермальные клетки человека сохраняют способность к морфогенезу вне организма, в частности, в ходе эпителио-мезенхимных взаимодействий. Обоснована возможность реконструкции в культуре структурно-функциональных единиц кожи человека.
Найден новый клеточный механизм коллективной миграции кластера эпидермальных кератиноцитов человека. Впервые изучены ультраструктурные особенности таких кластеров. Продемонстрирована активация эпидермальных клеток при культивировании и способность к миграции клеток высокого уровня дифференцировки. Обнаружен феномен базальной миграции эпидермальных клеток в отсутствие сыворотки и митогенов.
Установлены закономерности эпителизации коллагенового геля эпидермальными кератиноцитами человека при взаимодействии с различными компонентами матрикса и мезенхимными клетками, включенными в состав геля. Впервые на основании этих данных разработана модель, воспроизводящая ключевые события морфогенеза волосяного фолликула человека в культуре. Продемонстрировано, что клетки дермальной папиллы человека полипотентны, индуцируют эпидермальный морфогенез и ангиогенез.
Полученные результаты вносят значительный вклад в понимание механизмов эпидермального морфогенеза у человека, а также биологии клеток кожи. Обозначено новое научное направление, позволяющее решать проблемы как фундаментального, так и прикладного характера в области регуляции гомеостаза кожи и коррекции ее патологий.
Практическая значимость работы. Результаты работы могут быть использованы в образовательных курсах по клеточной биологии, цитологии, гистологии, эмбриологии, применены для разработки новых тканеинженерных конструкций с включением культивированных клеток и методов стимуляции регенерации и морфогенеза, в частности реконструкции кожных придатков. По результатам работы запатентован метод подготовки кожных трансплантатов, позволяющий значительно стимулировать их васкуляризацию и приживление. Разработаны способы модификации матрикса для повышения эффективности его эпителизации, что может быть использовано для разработки новых тканевых эквивалентов. В волосяном фолликуле обнаружена популяция стволовых клеток, пригодных для использования в регенеративной медицине. Разработанная модель эпидермального морфогенеза может быть использована для моделирования патологических состояний волосяных фолликулов человека, а также тестирования лекарственных препаратов.
Основные положения, выносимые на защиту.
1. Реконструкция паттерна организации культуры кератиноцитов in vitro, сходного с тем, что наблюдается в эпидермисе in vivo, позволяет предположить, что самоорганизация клеток в эпидермисе является внутренне присущим кератиноцитам свойством и обеспечивает восстановление морфологической и динамической структуры популяции эпидермальных клеток при культивировании.
2. Коллективная миграция является универсальным клеточным механизмом, обеспечивающим эпителизацию. В многослойном эпидермальном пласте она осуществляется за счет одновременного активного движения нескольких рядов активированных клеток лидирующего края пласта.
3. В процессе культивирования происходит активация эпидермальных клеток, что позволяет им эффективно эпителизовать коллагеновый матрикс. Присутствие мезенхимных клеток модифицирует поведение кератиноцитов и реализует их морфогенетический потенциал.
4. Волосяной фолликул человека содержит несколько популяций стволовых клеток с широким спектром дифференцировок. В ходе длительного культивирования клеток дермальной папиллы волосяного фолликула человека изменяются уровни транскрипции генов ряда ключевых сигнальных путей.
5. В культуре эпидермальных кератиноцитов сохраняются стволовые/прогениторные клетки. Стволовые клетки способны переходить в состояние покоя и длительное время сохранять пролиферативный потенциал.
6. В культуральных условиях возможна реконструкция начальных этапов морфогенеза кожных придатков. В этом случае в клетках активируются соответствующие сигнальные пути.
Апробация работы. Материалы диссертации были представлены и обсуждены на российских и международных конгрессах и конференциях, в частности: Республиканский научный симпозиум "Пролиферативные заболевания кожи", 1996, Москва; European Study Group for Cell Proliferation, Маклесфилд, Великобритания, 1999; 1-й съезд Общества клеточной биологии, Санкт-Петербург, 2003, European Study Group of Cell Proliferation, Прага, 2004; Международный симпозиум по биологии клетки в культуре «Стволовые клетки, регенерация, клеточная терапия», 2004, Санкт-Петербург; 66th Annual Meeting of the Society for Investigative Dermatology, St. Louis, США; II Международная конференция «Молекулярная медицина и биобезопасность», 2005, Москва; Биология стволовых клеток. Фундаментальные аспекты, 2005, Москва; Клеточные, молекулярные и эволюционные аспекты морфогенеза, 2007, Москва; Российский Медицинский Форум, Симпозиум «Клеточные технологии в медицине», 2007, Москва; Всероссийская научная школа-конференция для молодежи «Аутологичные стволовые клетки: экспериментальные и клинические исследования», 2009, Москва; VI международная конференция «Молекулярная медицина и биобезопасность», 2009, Москва; Второй международный форум красоты и здоровья, 2009, Москва; Здравоохранение 2009, Москва; Stem Cell Meeting on Mesa. 2009. La Jolla, США; Первый Санкт-Петербургский конгресс по косметологии и эстетической медицине, 2010 год, Санкт-Петербург; III форум красоты и здоровья, 2010, Москва; 3rd Annual Congress of Regenerative Medicine & Stem Cell-2010, Шанхай; Второй Санкт-Петербургский конгресс по косметологии и эстетической медицине «Невские берега», 2011, Санкт-Петербург; Морфогенез в индивидуальном и историческом развитии, 2011, Москва, III конференция «Биология стволовых клеток: фундаментальные аспекты», памяти Н.Г. Хрущова, 2011, Москва, Всероссийская научная школа-конференция для молодежи «Аутологичные стволовые клетки: экспериментальные и клинические исследования», 2011, Москва.
Личное участие автора в получении результатов, изложенных в диссертации. Все экспериментальные результаты получены лично автором, под его непосредственным руководством или при его непосредственном участии в планировании и проведении экспериментов. Имена соавторов указаны в соответствующих публикациях.
Публикации. По теме диссертации опубликовано 27 статей в отечественных журналах, соответствующих перечню ВАК, и 3 – в международных рецензируемых журналах, имеется 1 патент.
Структура и объем. Диссертация состоит из следующих разделов: Введение. Обзор литературы. Материалы и методы. Результаты и их обсуждение. Заключение. Выводы. Список литературы. Работа содержит 305 страниц текста, документирована 71 рисунком и 4 таблицами. Список литературы содержит 475 источников.
2. МАТЕРИАЛЫ И МЕТОДЫ
Выделение и культивирование клеток человека
Эпидермальные кератиноциты. Фрагменты кожи получали в ходе хирургических косметологических операций с информированного согласия пациентов. Кератиноциты получали ферментативной обработкой кожи по методу Рейнвальда и Грина (Rheinwald and Green, 1987). Суспензию кератиноцитов вносили в культуральные сосуды в смеси сред ДМЕМ:F12 (1:1) с 10% эмбриональной телячьей сыворотки (ЭТС) с добавлением инсулина (5 мкг/мл, Sigma), изопротеренола (10-6М, Sigma), эпидермального фактора роста (10 нг/мл, Sigma). Клетки инкубировали при +370С в атмосфере воздуха, содержащем 3 % СО2 и насыщающей влажности. Для получения колоний кератиноциты вносили в концентрации 150 тыс/мл в чашки Петри диаметром 30 мм, на дно которых помещали покровное стекло. На коллагеновый гель суспензию высаживали в концентрациях 300 тыс/мл и 1млн/мл. В некоторых случаях для этих целей использовали кератиноциты 1-го пассажа.
Для выделения клеток интерфолликулярного эпидермиса волосяные фолликулы отделяли от эпидермиса под контролем бинокуляра с помощью микрохирургических ножниц. Затем эпидермис обрабатывали, как описано выше.
Линии клеток А-431 и HaCaT. Клетки эпидермоидной карциномы человека А-431 и иммортализованные кератиноциты человека HaCaT были получены из коллекции клеточных культур (Институт цитологии РАН). Клетки культивировали в среде Игла или ДМЕМ с 10% ЭТС.
Выделение клеток дермальной папиллы (ДП) волосяного фолликула. Выделенные пинцетом фолликулы инкубировали в 0,1%-ном растворе коллагеназы I типа в среде ДМЕМ, содержащей 10% ЭТС, в течение 7 ч при 37С. ДП ресуспендировали в среде ДМЕМ с 10% ЭТС (Биолот), 4mML-глутамина (Sigma). Клетки ДП вибрисс крыс выделяли с помощью микрохирургических манипуляций под контролем бинокуляра и культивировали в среде ДМЕМ, содержащей 10% ЭТС.
Электронно-микроскопическое исследование. Материал фиксировали в 2,5%-ном растворе глутаральдегида на 0,1 М какодилатном буфере (рН 7,2-7,4) с добавлением сахарозы, дофиксировали в 1%-ном растворе осмиевой кислоты на том же буфере, обезвоживали в спиртах возрастающей концентрации и заключали в смесь эпон-аралдит методом плоско-параллельной заливки. Ультратонкие срезы контрастировали уранил-ацетатом и цитратом свинца, после чего исследовали в электронном микроскопе JEM-100CХ:11.
Радиоавтографическое исследование. Клетки, предварительно проинкубированные с 3Н-тимидином (1 мкКи/мл; уд. акт. 48,6 Ки/моль), фиксировали в 70%-ном этаноле. Затем препараты промывали в 96%-ном этаноле и высушивали. После этого наносили фотоэмульсию типа М, расплавленную при 370С, и экспонировали в течение 25 сут. Затем препараты проявляли в проявителе D-19 (5 мин), промывали в дистиллированной воде и фиксировали в 40%-ном растворе гипосульфита натрия в течение 7,5 мин. Полученные препараты окрашивали красителем Гимза или гематоксилином.
Определение скорости миграции эпидермальных клеток в рану. Клетки HaCaT или А-431 вносили в чашки Петри в концентрации 150 тыс/мл (1,5 мл на чашку) в среде Игла с 10% ЭТС. Через 24 ч среду меняли на бессывороточную и инкубировали в течение 72 ч. После этого пластмассовым шпателем удаляли часть клеточного монослоя в центре чашки. Скорость миграции определяли, измеряя ширину раны в пяти точках с помощью окуляр-микрометра сразу же после нанесения раны и через 24, 48 и 72 ч.
Приготовление живого эквивалента кожи. Коллагеновый гель готовили на льду во избежание быстрого застывания. Эмбриональные фибробласты вносили в последнюю очередь из расчета 2,5*104 клеток/мл геля. Гель с клетками заливали в чашки Петри диаметром 30 мм, на дно которых была предварительно уложена лавсановая сеточка «Линтекс-Эслан», и помещали в СО2-инкубатор при +370С. Через 1 час коллагеновый гель полностью желатинизировался. Суспензию кератиноцитов высевали на поверхность коллагенового геля после его полного застывания в концентрации 3*105 клеток/мл, заливали полученный эквивалент средой для культивирования кератиноцитов (см. выше) и помещали в СО2-инкубатор при +370С.
Включение BrdU. В среду для культивирования вносили BrdU в концентрации 10мМ. На пятый день инкубирования среду с меткой удаляли и заливали культуры средой без метки, среду меняли каждые три дня. В некоторых опытах BrdU в концентрации 2,5 мМ вносили в среду во время культивирования кератиноцитов в пластиковых культуральных флаконах на следующий день после посадки и далее в течение семи суток. На восьмой день приготовляли живой эквивалент кожи, который заливали средой без метки, среду меняли через день. Пласты кератиноцитов фиксировали на 18, 26 и 28 сутки разбавления.
Иммуногистохимические исследования
Иммунофлуоресценция. Культуры фиксировали в 4%-ном растворе параформальдегида (ПФА), затем после промывки фосфатным буфером (PBS) пермеабилизировали в 0,5%-ном растворе Triton X-100. Затем промывали PBS и наносили блокирующий раствор или раствор нормальной сыворотки и инкубировали с первыми антителами в течение 18 ч при 40С. После промывки в PBS наносили вторые антитела, конъюгированные с флуорохромами (Alexa), и изучали препараты с помощью флуоресцентной и конфокальной микроскопии (Конфокальный микроскоп Leica TCS SP с программным обеспечением Leica LCS, флуоресцентный микроскоп Leica DM RXA2).
Иммунофлуоресцентное исследование поперечных срезов колоний кератиноцитов проводили на колониях, выращенных на коллагеновом геле. Культуры фиксировали, как описано выше и пропитывали 20%-ным раствором сахарозы в течение 12 ч. Затем замораживали в парах азота. Срезы толщиной 10 мкм делали на криостате. Далее срезы обрабатывали, как описано выше.
Окраска с помощью диаминобензидина (ДАБ). Депарафинизированные срезы промывали в PBS и инкубировали в 3%-ом растворе Н2О2 в течение 10 мин при комнатной температуре. Затем промывали в PBS и помещали в 0,5%-ный раствор Triton-X100 (в PBS) на 20 мин при комнатной температуре. После повторной промывки в PBS инкубировали 20 мин в растворе нормальной сыворотки. Затем наносили первые антитела на 12 ч при +40 C. После промывки в PBS наносили вторые антитела на 30 мин при комнатной температуре. Отмывали в PBS 3 раза по 5 мин и окрашивали с помощью ДАБ (DAB, BD Pharmingen) до проявления окраски, реакцию останавливали перемещением в дистиллированную воду. При необходимости докрашивали гематоксилином.
Гистохимическое окрашивание. Для окрашивания культуры клетки при достижении конфлуентного монослоя фиксировали 10%-ным раствором формалина в течение 10 мин при комнатной температуре; промывали проточной водой. Для окраски срезов кожи, срезы депарафинировали в ксилоле и регидратировали, поочередно инкубируя в спиртах понижающейся концентрации. Материал окрашивали 0,1%-ным раствором толуидинового синего (pH-2.0) в 30% этаноле в течение 20 мин; 1%-ным раствором альцианового синего (pH-2.84) в 3% уксусной кислоте в течение 30 мин; затем споласкивали дистиллированной водой. Обезвоживали препараты через спирты возрастающей концентрации и ксилол, заключали в канадский бальзам. Индукция и детекция остео- и адипогенной дифференцировок. Для индукции остеогенной дифференцировки клетки культивировали до достижения конфлуэнтного слоя. Затем среду меняли на среду следующего состава: среда ДМЕМ/F-12, 10% ЭТС, 0.01 мкМ 1,25-дигидрокси витамин Д3 (Sigma), 50 мкМ аскорбат-2-фосфат (Sigma), 10 мМ -глицерофосфат (Sigma). Клетки культивировали в течение 21 сут, среду меняли каждые 3 дня. Кальцификацию внеклеточного матрикса определяли с помощью окраски ализариновым красным. Для этого клетки промывали в PBS, затем фиксировали 4% ПФА 30 мин при комнатной температуре, после чего клетки промывали PBS и окрашивали 1%-ным раствором ализаринового красного (Sigma) в течение 2 мин, промывали дистиллированной водой, затем в подкисленном этаноле.
Для индукции адипогенной дифференцировки клетки культивировали в среде следующего состава: среда ДМЕМ/F-12, 10% ЭТС, 0.5 мМ изобутил-метилксантин, 1 мкМ дексаметазон, 10 мкМ инсулин, 200 мкМ индометацин. Смену среды проводили каждые 3 дня. Для окраски клеток липофильным красителем Oil Red-O (Sigma) их промывали в PBS, фиксировали в 4%-ном ПФА 30 мин при комнатной температуре, инкубировали 15 мин в 60%-ном изопропаноле и затем окрашивали в течение 15 мин профильтрованным раствором Oil Red-O. После этого клетки споласкивали в 60%-ном изопропаноле, тщательно промывали в дистиллированной воде и докрашивали гематоксилином.
Выявление активности щелочной фосфатазы. Клетки фиксировали в 70%-ном этаноле в течение 10 мин, промывали в PBS и инкубировали в растворе NBT/BCIP (Roche) в течение 15 мин при комнатной температуре в темноте и промывали дистиллированной водой.
Статистическая обработка результатов. При обработке результатов оценивали значение средней величины и стандартное отклонение. Построение графиков проводили в программе Excel. Различие считали статистически достоверным, если уровень значимости был p<0,05, что является мерой достаточной надежности биологических результатов.
Выделение и очистка РНК. Суспензию клеток в растворе RNAlater разбавляли стерильным раствором PBS в 2 раза, клетки собирали центрифугированием в течение 10 мин при 13400 оборотов в минуту в центрифуге Eppendorf MiniSpin. Супернатант удаляли, а к осадку добавляли 350 мкл лизирующего раствора из набора для выделения РНК QIAGEN Rneasy Mini Kit. Суспензию гомогенизировали до получения полностью прозрачного лизата. Дальнейшее выделение осуществляли с использованием центрифугирования колонок. После всех промывок РНК с колонки элюировали двумя порциями (25 мкл) стерильной свободной от РНКаз воды, предварительно нагретой до 55оС. Концентрацию РНК в полученных образцах измеряли с помощью минифлюориметра Qubit (Invitrogen). Выход РНК составлял, в зависимости от исходного количества клеток, от 5 до 40 мкг. Качество полученных препаратов РНК контролировали с помощью Биоанализатора Agilent.
Обратная транскрипция. Для синтеза кДНК использовали набор First Strand cDNA Synthesis Kit фирмы Fermentas с oligo(dT)18-праймером. Качество полученных препаратов кДНК проверяли с помощью контрольных реакций амплификации кДНК глицеральдегид-3-фосфат-дегидрогеназы (GAPDH) в соответствии с рекомендациями фирмы-производителя набора. Из 1,3 мкг исходной РНК получали 20 мкл раствора кДНК и использовали ее как матрицу для ПЦР с детекцией в реальном времени – по 1 мкл на 25 мкл реакцию.
ПЦР с детекцией в реальном времени. Праймеры синтезировали в компании Синтол (Москва). Качество праймеров контролировали с помощью классической ПЦР с электрофоретической детекецией конечного продукта.
Для проведения реакций ПЦР в реальном времени использовали набор Maxima SYBR Green Master Mix (2X) компании Fermentas и детектирующий амплификатор ДТ-322 компании «ДНК-Технология». Программа амплификации состояла из предварительной инкубации 10 мин при 95оС для активации ДНК-полимеразы Maxima Hot Start Taq DNA polymerase и 60 циклов [95оС-15 сек – 58оС-60 сек], после завершения которых прибор переходил в режим хранения образцов. Детекция флюоресценции в канале Fam и первичная обработка результатов осуществлялись программным обеспечением, поставляемым с прибором, в автоматическом режиме. В качестве внутреннего стандарта, относительно которого вычислялись концентрации всех остальных мРНК, служила мРНК GAPDH.
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1. Формирование многослойного эпидермального пласта в культуре.
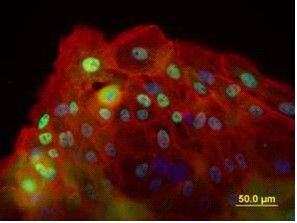
Адгезия критична для формирования тканей животных из индивидуальных клеток как первое событие морфогенеза. Изолированные кератиноциты, при культивировании образуют агрегаты. Мы изучили формирование этих агрегатов и их состав. В результате слипания образуются мелкие агрегаты, которые хорошо прикрепляются к субстрату и достаточно быстро распластываются. В составе прикрепившихся агрегатов распластывание кератиноцитов усиливается, причем можно выделить плотно упакованные, компактизованные клетки в центре агрегата и хорошо распластанные клетки на его периферии. Среди распластанных клеток обнаруживаются клетки, экспрессирующие белок Ki67 (Рис. 1а), ассоциированный с пролиферацией.
 |   |
| Рис. 1а. Первичная колония кератиноцитов человека. Стрелкой помечена Ki67+- клетка. Иммуногистохимия. Окраска диаминбензидином. Докрашено гематоксилином и эозином. Масштабный отрезок 50 мкм. | Рис. 1б. Первичная колония кератиноцитов человека. Экспрессия р63. Иммуногистохимия. Окраска диаминобензидином. Масштабный отрезок 50 мкм. |
Доля Ki67-положительных клеток в первые 8 часов культивирования не превышает 30%. В культуре обнаруживаются кератиноциты, экспрессирующие транскрипционный фактор р63 – мастер-ген эпидермальной дифференцировки и маркер столовых/прогениторных клеток (Рис. 1б). На 2-3 сут культивирования число p63-положительных клеток достигает 35+7% и располагаются они в агрегатах случайным образом. Эти кератиноциты обладают большим пролиферативным потенциалом и участвуют в формировании многослойного пласта. В первые дни присутствуют одиночные клетки, исчезающие в последующие сутки культивирования. Они либо погибают в результате апоптоза, либо входят в состав агрегатов. В течение первой недели еще не образуется конфлуентный слой клеток, и нет крупных клеточных колоний, но всегда сохраняются небольшие агрегаты, обычно состоящие из нескольких плотно контактирующих клеток и рыхло расположенного окружения. В начальные сроки культивирования преобладают процессы пролиферации, поскольку происходит увеличение плотности клеточного пласта. После пассирования способность кератиноцитов к самоорганизации и формированию агрегатов сохраняется. При этом между агрегатами возникали контакты, образованные длинными ламеллоподиями.
Компактизация клеток и адгезия – важнейшие элементы морфогенеза. Агрегация кератиноцитов в условиях культуры отражает процесс формирования структурно-функциональных единиц (СФЕ) in vivo. Дезагрегированные эпидермальные кератиноциты сохраняют необходимую информацию для воссоздания путем самосборки трехмерных структур, которые после трансплантации в организм формируют СФЕ.
Реконструкция паттерна организации культуры кератиноцитов in vitro, сходного с тем, что наблюдается в эпидермисе, в отсутствие элементов окружения, существующих in vivo, позволяет предположить, что самоорганизация клеток в эпидермисе может быть внутренне присущим кератиноцитам свойством. Это обеспечивает восстановление морфологической и кинетической структуры популяции эпидермальных клеток при культивировании, и позволяет культивированному эпидермису встраиваться в структуры организма после трансплантации.
3.2. Клеточные механизмы коллективной миграции многоклеточных кластеров кератиноцитов.
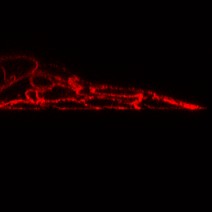
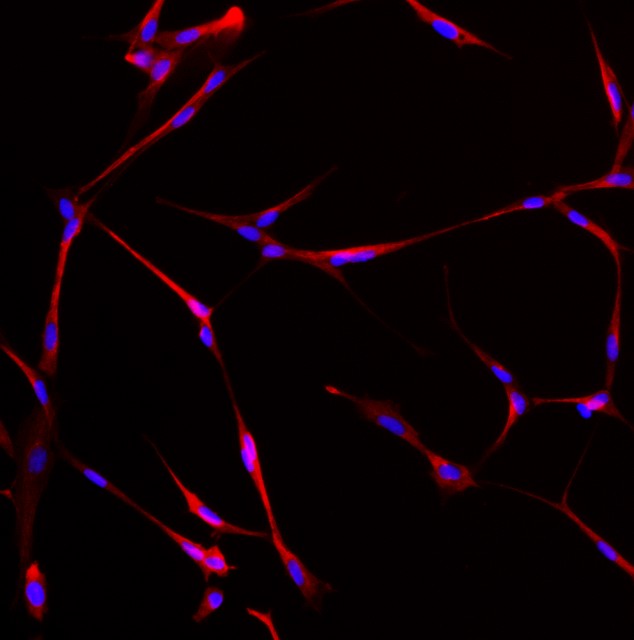
К 7-14 суткам культивирования кератиноцитов достаточно крупные колонии, содержащие несколько тысяч клеток, начинают активно мигрировать. Ведущий край колоний составляют кератин 14- и р63-позитивные клетки (Рис. 2а, б), т.е. кератиноциты с фенотипом клеток базального слоя с высоким пролиферативным потенциалом. Окраска колоний на актин показала, что в этих клетках плотность кольца филаментов, характерного для эпителиальных клеток, снижена, а в некоторых кератиноцитах оно практически отсутствует (Рис. 2в). В то же время, большинство клеток остаются соединенными с помощью плотных контактов (Рис. 2г). Таким образом, они представляют собой типичные лидирующие кератиноциты, находящиеся в состоянии псевдо эпителио-мезенхимного перехода.
  |  | ||
| Рис. 2а. Ведущий край колонии кератиноцитов. Иммунофлуоресценция. Красный цвет – актин, синий – DAPI, зеленый – р63. | Рис. 2б. Ведущий край колонии кератиноцитов. Иммунофлуоресценция. Синий – DAPI, зеленый – К14. | ||
 |  | ||
| Рис. 2в. Клетки ведущего края колонии, окрашенные антителами против актина. Иммунофлуоресценция. | Рис. 2г. Белок плотных контактов ZO-1 в мигрирующей колонии кератиноцитов. Иммунофлуоресценция. | ||
Механизм миграции пластов стратифицирующихся эпителиев неясен. На модели повреждения роговицы у мышей были получены некоторые экспериментальные свидетельства того, что клетки у края раны могут, чередуясь, переползать друг через друга – так называемая модель «чехарды» (Danjo Y. et al., 2002). В то же время, есть указания на то, что стратифицирующиеся эпителии мигрируют единым пластом, «скользя» по субстрату (Zhao M. et al., 2003.). Эти две модели рассматриваются как основные. Наше исследование мигрирующих колоний эпидермальных кератиноцитов человека с помощью конфокального микроскопа, цейтраферной съемки и электронной микроскопии показало, что клетки пласта, расположенные в первых 5-6 рядах от края колонии, образуют ламеллоподии, подползающие под впереди лежащую клетку и направленные в сторону миграции пласта (Рис. 3а., б). В центре колонии в базальном слое располагаются малодифференцированные клетки с признаками стволовых/прогениторных (высокое ядерно-цитоплазматическое соотношение, слабо развитые органеллы, малое число кератиновых филаментов), а в супрабазальном – высокодифференцированные кератиноциты, экспрессирующие кератин 10 – маркер дифференцированных клеток.
  |   |
| Рис. 3а. Тангенциальный срез колонии. Клетки нескольких рядов ведущего края, образующие ламеллоподии. Трансмиссионная электронная микроскопия. | Рис. 3б. Тангенциальный оптический срез колонии. Окраска флуоресцентным мембранным трейсером DiI. Конфокальная микроскопия. Масштабный отрезок 30 мкм. |
Таким образом, миграция эпидермального пласта in vitro осуществляется за счет кооперативной миграционной активности первых нескольких рядов клеток, которые остаются связанными между собой лабильными межклеточными контактами (Рис. 4). Описанный механизм коллективной миграции эпидермальных клеток обнаружен впервые и позднее подтвердился в работе зарубежных коллег, проведенной на линии клеток эпителия почки собаки MDCK (Farooqui R. et al., 2005).

Исследование пролиферативной активности в многоклеточных кластерах первичных эпидермальных кератиноцитов, а также иммортализованных и трансформированных клеток, показало, что различия в числе пролиферирующих клеток в разных частях колонии мало влияют на выбор кластером клеток направления движения, однако, обработанные митомицином С неделящиеся клетки никогда не оказываются в первом ряду ведущего края колонии. Для интенсивной миграции, вероятно, необходима активация клетки. Активация эпидермальных клеток, происходящая при культивировании, включает в себя усиление пролиферации. Культивированные кератиноциты, поэтому, можно сопоставить с клетками, мигрирующими в рану in vivo. Трансформированные эпителиоциты также характеризуются повышением подвижности и пролиферативной активности, причем интенсивность размножения коррелирует со способностью клетки к активной миграции.
3.3. Эффект факторов роста на миграцию. Базальный уровень миграции.
В ране in vivo содержится широкий спектр цитокинов, включая факторы роста. Питательная среда для культивирования кератиноцитов также содержит факторы роста, которые оказывают влияние на все клеточные процессы, включая морфогенез, через управление, в частности, пролиферацией и миграцией клеток. На модели «раны», нанесенной на монослой культивируемых клеток, мы установили ряд интересных фактов о регуляции факторами роста пролиферации и миграции. Исследования проводили в культуре иммортализованных кератиноцитов человека HaCaT.
Анализ миграции клеток в рану показал, что при выращивании культур в среде с 10% ЭТС максимальная скорость миграции наблюдается в первые 24 ч после нанесения раны, а через 72 ч рана первоначальной ширины 2,5 мм полностью закрывается. Радиоавтография раны показала, что пролиферация идет интенсивно во всех участках культуры, и преимущественной пролиферации на краю раны не наблюдается. В первые 24 ч в культуре наблюдается самый высокий уровень включения меченого тимидина. Это можно объяснить тем, что впоследствии общее повышение плотности культуры снижает темпы пролиферации. Сходные данные по темпам пролиферации были получены позднее на культуре клеток почки собаки MDCK. Пик пролиферации приходился на первые 12-24 часа после нанесения раны в зависимости от ее ширины (Farooqui R. et al., 2005). Эмбриональная телячья сыворотка, используемая при культивировании клеток, содержит большое количество митогенов, гормонов и компонентов внеклеточного матрикса. Все эти агенты влияют на миграцию клеток и маскируют действие изучаемых веществ. Поэтому клетки выращивали в среде с сывороткой до образования субконфлуентного монослоя, а затем среду меняли на бессывороточную и выращивали клетки до образования конфлуентного монослоя, после чего наносили рану. В этих условиях через 72 ч после нанесения раны остается незакрытой более половины ширины раны. При добавлении в среду культивирования эпидермального фактора роста (EGF) наблюдали значительную стимуляцию миграции (Рис. 5).


Как известно, EGF не только влияет на миграцию эпидермальных клеток, но и вызывает ряд других эффектов, в том числе стимулирует пролиферацию. Поэтому мы изучили действие EGF на миграцию клеток, в которых подавлена пролиферация. Для подавления пролиферации клетки обрабатывали митомицином С (20 мкг/мл). Через 72 ч включение меченого тимидина в таких культурах падало до 4+0,5% от контроля. На монослой наносили рану и изучали действие EGF на миграцию в таких культурах. После обработки митомицином С сохранялся базальный уровень миграции, но клетки теряли способность отвечать на добавление фактора роста (Рис. 6). Аналогичные результаты мы получили в ходе исследования действия фактора роста кератиноцитов на миграцию.
Следовательно, для реализации мотогенного эффекта факторов роста на эпидермальные клетки необходимо, чтобы они находились в пролиферирующем состоянии. В то же время, для базальной миграции наличие пролиферативной активности необязательно. Сходные данные по миграции клеток после их обработки митомицином С позднее наблюдали в культуре MDCK, когда в течение 10 часов динамика миграции в рану не отличалась от контрольной (Poujade et al., 2007). В организме базальная миграция ответственна за немедленную миграцию эпителиальных клеток в ответ на повреждение. Независимость от пролиферативного потенциала клеточной популяции и статуса отдельных клеток делает возможным возникновение реакции эпителия на свободный край в кратчайшие сроки. Это обеспечивает скорейшее восстановление барьерной функции. В дальнейшем на ведущем крае мигрирующего кластера эпителиальных клеток оказываются активированные пролиферирующие клетки, что обеспечивает «заселение» лишенного эпителия участка клетками с высокими регенеративными возможностями.
3.4. Структурно-функциональная организация эпителия in vitro.
3.4.1. Длительно сохраняющие метку клетки в эпидермальном пласте.
После формирования в культуре многослойного эпидермального пласта устанавливается баланс между пролиферацией и гибелью клеток, частично воспроизводящий ситуацию in vivo. В условиях достаточного снабжения базальных клеток питательными веществами эпидермис можно культивировать месяцами. Критичным в такой ситуации становится вопрос о сохранении стволовых/прогениторных клеток, способных обеспечить самоподдержание пласта. Наличие их также необходимо для успешного приживления эпидермиса после трансплантации пациентам. Поэтому перед нами стояла задача идентификации стволовых/прогениторных клеток в эпидермисе человека in vitro. Одной из главных характеристик стволовых клеток считается длительное сохранение метки.
Мы разработали метод по определению локализации длительно сохраняющих метку клеток с использованием живого эквивалента кожи (ЖЭК), в качестве аналога дермы содержащего коллагеновый гель с дермальными фибробластами. Кератиноциты вносили после предварительного культивирования на пластике для оптимального роста на поверхности геля. Многослойные эпидермальные пласты формировались на поверхности геля через 7-10 суток после посадки. Модель ЖЭК позволяла проводить культивирование кератиноцитов до 30 суток. После 8-10 суток, в течение которых происходило разбавление метки, количество меченых ядер по отношению к общему числу ядер составило 30+6%. Через 26 суток в нескольких полях зрения определялось по одной меченой клетке. Через 28 суток в препарате (размером примерно 4х5 мм) обнаружено 5 меченых клеток с мелкими ядрами в базальном слое.
Таким образом, мы показали, что в условиях культивирования можно получить кератиноциты, которые длительно сохраняют метку, то есть с точки зрения динамики клеточной популяции могут рассматриваться как стволовые покоящиеся клетки. Использованный подход может послужить полезным инструментом для исследований в области стволовых эпидермальных клеток, с которыми часто отождествляют длительно сохраняющие метку клетки. Он позволяет сопоставлять функциональный признак стволовых клеток (длительное сохранение метки) с экспрессией маркеров стволовых эпидермальных кератиноцитов.
3.4.2. Маркеры стволовых и прогениторных эпидермальных клеток в культуре.
Первичная культура включает клетки различной степени дифференциации. При ферментативной обработке попадают туда и стволовые клетки. Идентификация стволовых/прогениторных эпидермальных клеток по экспрессии специфичных маркеров в условиях культуры является нетривиальной задачей. Список маркеров, которые могут предположительно указывать на принадлежность к компартменту стволовых эпидермальных клеток, весьма обширен.
Среди маркеров стволовых эпидермальных клеток указываются кератины 15 и 19. В первичной культуре обнаруживаются кератиноциты, позитивные по кератину 15 и кератину 19. Мы подробно изучили характер и динамику экспрессии кератина 19.
В коже взрослого человека кератин 19 (К19) обнаруживается только в волосяном фолликуле. Наши исследования многочисленного биопсийного материала кожи и индивидуальных фолликулов показали, что К19+-клетки в фолликуле на стадии анагена обнаруживаются в наружном корневом влагалище в области бугорка, матрикса или в нижней трети фолликула. Исследование первичной культуры на ранних сроках культивирования выявило единичные К19+-клетки (менее 1% от общего числа клеток). При культивировании в течение 6 дней доля К19+-клеток в культуре возрастала до 20%. Двойное иммуногистохимическое окрашивание на кератин 19 и Ki-67 показало, что после суток культивирования К19+-клетки не окрашивались антителами против Ki-67, т.е. находились в пролиферативном покое, в то время как К19--клетки уже пролиферировали. Однако на 6-е сутки культивирования 15% К19+-кератиноцитов одновременно были позитивны по антигену Ki-67, что в среднем соответствовало доле пролиферирующих клеток среди К19–-клеток. Это означает, что пролиферативная активность К19+-клеток в культуре возрастает, что могло приводить к увеличению их доли в популяции кератиноцитов. Для уточнения пролиферативной активности К19+-клеток кератиноциты базального слоя диссоциировали с помощью ферментативной обработки и в момент пассирования добавляли BrdU. Количество К19+-кератиноцитов в начале опыта составляло 20+8% и возрастало до 30% через 21 ч культивирования. В то же время, доля К19+-клеток, включивших метку BrdU, не возрастала. Таким образом, наблюдающееся в культуре увеличение К19+-клеток без интенсификации их пролиферации свидетельствовало об индукции экспрессии К19. Чтобы прояснить этот вопрос, мы исследовали динамику изменения количества К19+-клеток после ингибирования пролиферации митомицином С. Обработку клеток митомицином C производили через сутки после инициации культуры. В первичной культуре на момент обработки митомицином C содержание К19+-клеток составляло около 1%. На 6 сутки содержание К19+-клеток возрастало до 25%. Однако полученные данные не исключали возможности увеличения доли К19+-клеток за счет преимущественной гибели К19–-клеток. Известно, что простые цитокератины, в частности, кератин 8 и 18, защищают клетки от апоптоза, индуцированного фактором некроза опухолей альфа (TNF-) (Oshima RG. 2002). Мы проверили, защищены ли К19+-клетки от TNF-индуцированного апоптоза лучше, чем К19–-клетки. Культуру кератиноцитов обрабатывали TNF- в присутствии циклогексимида и выявляли апоптотические клетки методом TUNEL совместно с окрашиванием на К19 (Рис. 7). Проверяли также уровень апоптоза в культурах, не обработанных TNF. Анализ препаратов показал, что процент апоптотических клеток был одинаков в популяциях К19+ и К19–-кератиноцитов. Таким образом, интенсивность гибели путем апоптоза не может быть причиной возрастания доли К19+ клеток в культуре первичных кератиноцитов.

Полученные данные свидетельствуют об индукции экспрессии К19 в культуре. Учитывая характер экспрессии К19 in vivo, а также данные литературы, мы считаем, что К19 может служить маркером активированного эпидермиса, а также регенеративного потенциала и способности к самообновлению кератиноцитов. Экспрессия К19 может не только указывать на принадлежность клетки к субпопуляции стволовых или прогениторных, но также свидетельствовать об ее реакции на нарушение эпидермального гомеостаза и изменение программы дифференцировки в результате смены микроокружения.
3.5. Морфогенез эпидермиса в ходе эпителио-мезенхимных взаимодействий.
3.5.1. Эпителизация коллагенового матрикса.
Задачей данного раздела работы было создать систему, позволяющую моделировать эпидермальный морфогенез в культуре клеток человека. В качестве матрикса для культивирования мы использовали коллагеновый гель, что позволяет изучать взаимодействие клеток с матриксом, регуляцию пролиферации и дифференциации клеток, а также создает возможность выявить факторы, способствующие росту и миграции эпидермальных кератиноцитов.
При внесении суспензии первичных кератиноцитов на коллагеновый гель в концентрации 300 тыс. клеток/мл, характер роста клеток отличен от роста первичных кератиноцитов, высаженных в такой же концентрации на пластик. Суспендированные клетки сравнительно слабо распластывались на геле и не образовывали мигрирующих колоний, а превращались в сфероиды дифференцированных клеток. Анализ радиоавтографов показал, что индекс меченных 3Н-тимидином клеток на вторые сутки культивирования на пластике был существенно выше, чем на геле (Рис. 8). К пятым суткам культивирования количество клеток, синтезирующих ДНК на пластике возрастало до 32%, в то время как на коллагеновом геле процент меченых клеток оставался низким (3.2%). Мы также модифицировали поверхность коллагенового геля, нанося на него дополнительные компоненты внеклеточного матрикса. Предварительная

обработка поверхности коллагенового геля полилизином перед посадкой на него суспензии кератиноцитов в концентрации 300 тыс/мл увеличивает рост клеток на 86% по сравнению с контролем. Модификация поверхности коллагенового геля фибронектин-подобным белком также вызывала увеличение количества клеток, приходящихся на единицу площади, но лишь на 26%. Для сравнения на этой же диаграмме показан рост кератиноцитов на пластиковой поверхности. Видно, что рост кератиноцитов на пластике идет значительно лучше, чем на коллагеновом геле. Обработка пластиковой поверхности синтетическим аналогом фибронектина незначительно увеличивала рост клеток, а сорбированный на пластик полилизин отрицательно влиял на рост кератиноцитов, уменьшая его на 30%. Внесение в коллагеновый гель эмбриональных фибробластов значительно улучшало рост кератиноцитов. Анализ радиоавтографов показал, что включенные в коллагеновый гель фибробласты стимулируют рост культуры первичных кератиноцитов на коллагеновом геле. Так, на вторые сутки культивирования индекс меченых 3Н-тимидином клеток в среднем составлял 1.07%, а к пятым суткам количество клеток, синтезирующих ДНК, возрастало до 25.5%. Рост высаженных на коллагеновый гель в концентрации 300 тыс. клеток/мл пассированных кератиноцитов значительно отличается от роста на геле первичных кератиноцитов. Вторичные кератиноциты одинаково хорошо распластывались как на коллагеновом геле, так и на пластиковой поверхности. Анализ радиоавтографов культуры кератиноцитов 1-го пассажа показал, что уже на вторые сутки культивирования индекс меченных 3Н-тимидином клеток выше, чем в культуре первичных кератиноцитов и одинаков для культур на пластике и геле (Рис. 8).

Для оценки функциональных свойств клеток используется способность кератиноцитов контрактировать коллагеновый гель. Кератиноциты 1-го пассажа быстрее и значительно эффективнее контрактируют коллагеновый гель (Рис. 9).
Полученные данные позволяют заключить, что кератиноциты первого пассажа отличаются по пролиферативным и функциональным параметрам от первичных кератиноцитов. Пассированные кератиноциты обладают повышенной пролиферативной активностью и уже на третьи сутки после посадки формируют пласт, состоящий из нескольких слоев клеток. Это подтверждает предположение об активации кератиноцитов в культуре.
3.5.2. Миграция эпидермальных клеток по коллагеновому гелю.
Поскольку для формирования трехмерных эпителиальных структур необходим этап клеточной миграции, на основании полученных результатов мы создали оригинальную модельную систему для изучения миграции эпидермальных клеток по коллагеновому гелю. После внесения вторичных кератиноцитов в лунки колец, помещенных на коллагеновый гель, клетки хорошо распластываются и формируют пласт, имеющий вид ровного круга. Спустя 24-48 ч кератиноциты начинали мигрировать за пределы круга. На 3-4 сутки после посадки происходила поляризация округлых колоний с образованием мигрирующих кластеров. В процессе поляризации пласты компактизовались и, таким образом, площади образующихся колоний были меньше исходной площади круга приблизительно в 6 раз. Колонии приобретали асимметричную форму с выгнутым (ведущим) и вогнутым (ведомым) краями. Морфология колоний была аналогична таковой колоний первичных кератиноцитов на пластике. Гистологическое исследование колоний на коллагеновом геле показало, что кератиноциты базального слоя контактируют с субстратом частью своей поверхности. Прикрепившаяся к субстрату клетка, как правило, образует длинный тонкий отросток (ламеллоподию), направленный в сторону движения колонии, и короткий – в противоположную. Основная часть этой клетки, включая ядро, располагается во втором слое пласта, контактируя своей базальной поверхностью с таким же отростком следующей за ней клетки. Таким образом, морфология клеток кластера аналогична таковой в описанных выше колониях, мигрирующих по пластику. Это позволяет утверждать, что коллективная миграция кластеров кератиноцитов является универсальным механизмом эпителизации.
Внесение в состав коллагенового геля эмбриональных фибробластов коренным образом изменяло поведение кератиноцитов 1-го пассажа, высеянных в лунки на коллагеновый гель. На 2-3 сутки после посадки кератиноциты начинали выползать за границы образующегося круга, при этом характер их миграции отличался от отмеченного в контрольных экспериментах. Краевые клетки начинают формировать большое число мигрирующих фронтов. К 4 суткам культивирования кератиноциты на коллагеновом геле, содержащем фибробласты, формируют звездчатые фигуры с различными направлениями миграции. В некоторых случаях один из фронтов становится ведущим и имеет очень большую протяженность.
Таким образом, результаты проведенных экспериментов на этом этапе работы позволили сделать предварительные выводы относительно возможности моделирования морфогенетических процессов в культуре эпидермальных кератиноцитов человека. Стало очевидным, что для этих целей необходимо использовать пассированные клетки, способные более эффективно взаимодействовать с трехмерным внеклеточным матриксом, мигрировать и пролиферировать на нем. Была разработана новая модель для изучения миграции эпидермальных клеток, которая впоследствии с небольшими модификациями была применена для моделирования начальных этапов фолликулогенеза. Результаты также свидетельствовали о стимуляции миграции кластеров вторичных кератиноцитов на коллагеновом геле при внесении в его состав эмбриональных фибробластов. В дальнейшем, результаты экспериментов по влиянию мезенхимных клеток на поведение кератиноцитов на коллагеновом геле были использованы нами для разработки модели эпидермального морфогенеза.
3.5.3. Дермальная папилла – резервуар специализированных мезенхимных клеток, индуцирующих эпидермальный морфогенез.
Результаты, полученные на предыдущих этапах работы, ясно демонстрируют, что мезенхимные клетки оказывают существенное влияние на особенности морфогенетических процессов в культуре эпидермальных клеток. Их использование позволяет моделировать эпидермальный морфогенез. Для того чтобы создать адекватную модель начальных этапов формирования придатков кожи, необходимо было использовать мезенхимные клетки, являющиеся естественными индукторами этих процессов in vivo. Такими клетками являются клетки дермальной папиллы (ДП) волосяного фолликула.
Была проведена характеристика клеток ДП человека. Выделенные нами клетки ДП в культуре пролиферировали, организовывали группы и даже при достижении монослоя формировали многослойные агрегаты (так называемые псевдопапиллы). Выявлен также ряд функциональных особенностей клеток ДП. Мы впервые сравнили клетки ДП волосяного фолликула человека и фолликула вибриссы крысы по способности к контракции и лизису коллагенового геля. Клетки ДП вибрисс сжимали гель сильнее, чем клетки ДП волосяного фолликула человека (60 и 40% от контроля, соответственно), а добавление кератиноцитов в обоих случаях способствовало усилению контракции коллагенового геля (75 и 56%, соответственно). Через неделю клетки ДП крысы, культивируемые вместе с кератиноцитами, дезагрегировали и лизировали гель. Через 3 недели клетки ДП крысы лизировали коллагеновый гель и без помощи кератиноцитов, однако, при помещении в коллагеновый гель клеток ДП волосяного фолликула человека лизиса геля не наблюдали даже при кокультивировании с кератиноцитами.
В литературе имеются указания на то, что волосяной фолликул является источником мезенхимных стволовых клеток (МСК), которые участвуют в восстановлении дермы при ее повреждении (Jahoda & Reynolds, 2001). Мы исследовали экспрессию поверхностных маркеров клеток ДП, клеток стромы жировой ткани и постнатальных фибробластов дермы. Маркеры СD49d, CD105 и STRO-1 являются характерными для клеток стромы жировой ткани. CD105 и STRO-1 являются поверхностными маркерами мезенхимных стволовых клеток из костного мозга. Анализ экспрессии данных маркеров показал, что клетки ДП экспрессируют CD49d на том же уровне, что и клетки стромы жировой ткани, однако уровень экспрессии CD105 и STRO-1 – ниже. Фибробласты дермы имеют низкий уровень экспрессии CD49d, единичные клетки в популяции экспрессируют STRO-1 и не экспрессируют CD105. Таким образом, клетки ДП и клетки стромы жировой ткани обладают схожим фенотипом.
Мы исследовали потенции клеток ДП человека дифференцироваться в клетки костной и жировой ткани, а также в нейральном направлении при культивировании в индукционных средах. Отложение липидных капель в цитоплазме и экспрессию лептина (маркер зрелых адипоцитов) наблюдали только в 20-30% клеток ДП (Рис. 10а). Адипогенная дифференцировка клеток ДП была менее выражена по сравнению с клетками стромы жировой ткани. Спонтанную дифференцировку клеток ДП не наблюдали. Для определения способности клеток ДП дифференцироваться в клетки костной ткани при культивировании в индукционной среде исследовали уровень экспрессии молекулярных маркеров остеогенеза, в частности, остеопонтина (Рис. 10б). На 21 сутки в клетках ДП обнаруживали экспрессию этих маркеров на уровне, сопоставимом с клетками стромы жировой ткани. Постнатальные фибробласты не обладали такими свойствами. В контрольной среде небольшое количество клеток ДП спонтанно дифференцировались в клетки костной ткани. Остеогенная дифференцировка подтверждалась окраской клеток ализариновым красным. В индукционной среде наблюдали дифференцировку ДП в нейральном направлении (Рис. 10в).
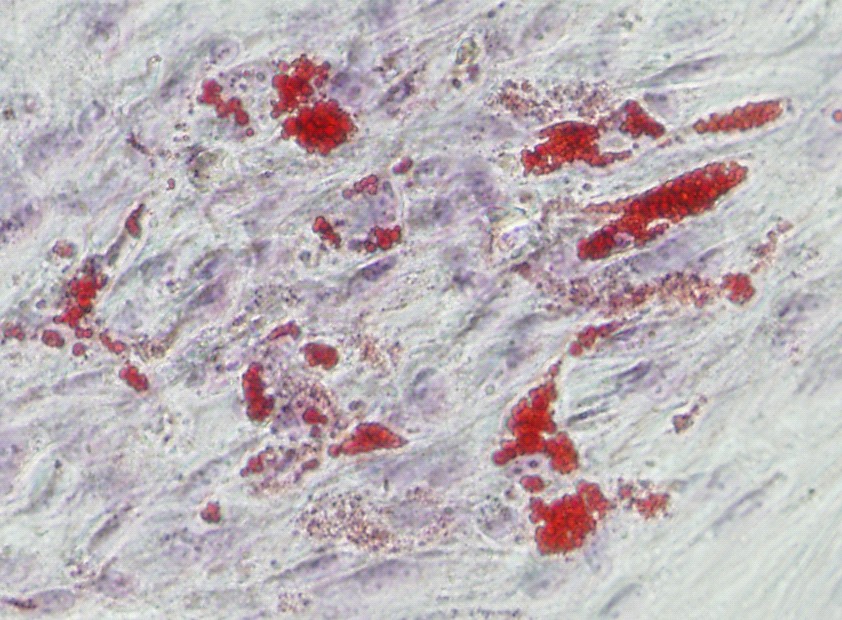  | 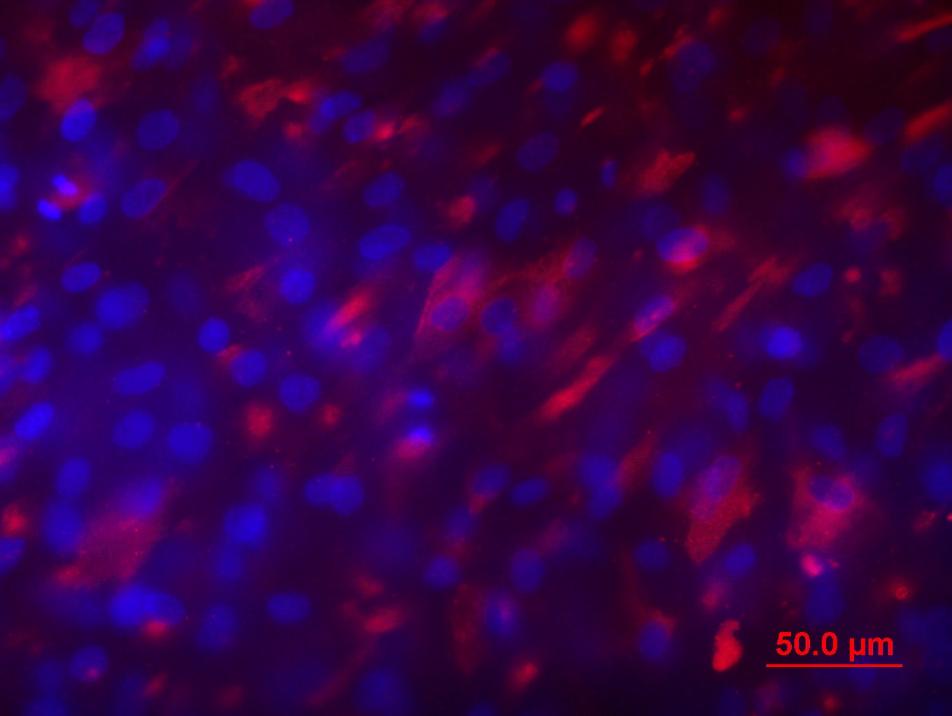  |   | |
| Рис. 10. Дифференцировка клеток дермальной папиллы. а. Адипогенная дифференцировка. Окраска на нейтральные жиры красителем Oil Red O. Масштабный отрезок 50 мкм. б. Остеогенная дифференцировка. Иммуногистохимическое окрашивание на остеопонтин. в. Нейральная дифференцировка. Иммуногистохимическое окрашивание на маркер нейронов (белок ассоциированный с микротрубочками 2, MAP-2). Масштабный отрезок 100 мкм. | |||
В экспериментах по трансплантации клеток ДП в кожу человека была обнаружена способность этих клеток стимулировать ангиогенез (Рис. 11).
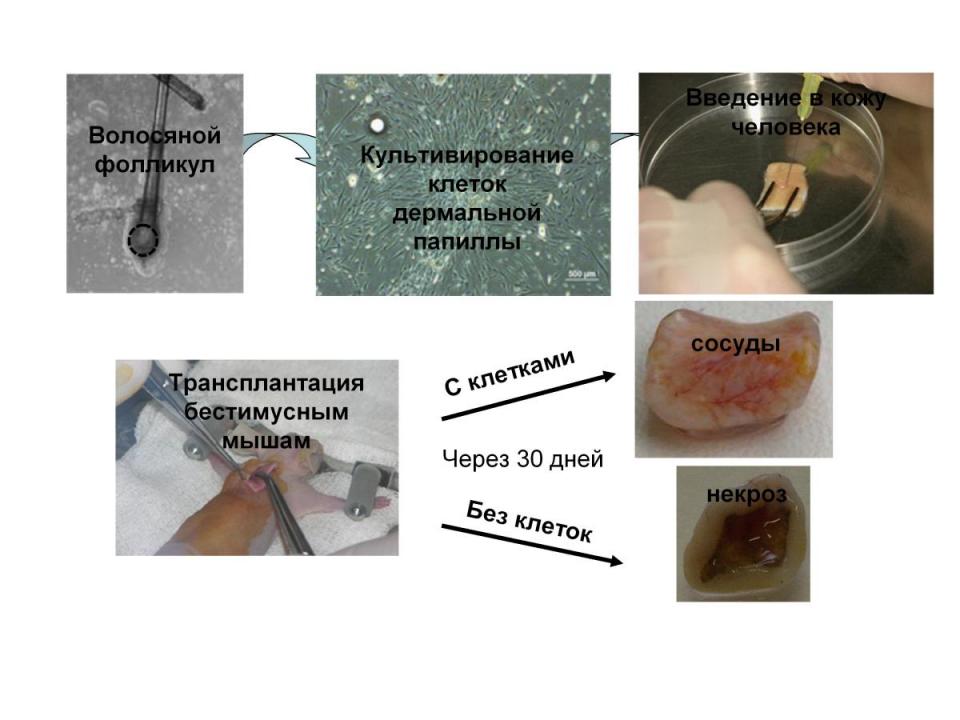
Рис. 11. Стимуляция ангиогенеза клетками дермальной папиллы человека. Схема эксперимента.
При культивировании клетки ДП теряют способность индуцировать фолликулогенез. В связи с этим данные клетки являются очень удобной моделью для исследования изменений в транскрипции генов, а также поисков сигнальных систем и групп генов, ответственных за уникальную способность клеток ДП индуцировать эпидермальный морфогенез. Совместно с В.В. Ашапкиным (НИИ ФХБ им. А.Н. Белозерского, МГУ), была проанализирована транскрипция (концентрации мРНК) генов, составляющих «сердцевину» транскрипционного статуса клеток ДП. Целью этого исследования было выяснить, как изменяется уровень транскрипции каждого из этих генов при культивировании клеток ДП и при их индуцированной дифференцировке в остеобласты.
При культивировании клеток ДП в стандартных условиях в 3-6 раз возрастает уровень транскрипции генов BMP6, FGFR1 и NDP, в 1,4-2 раза – генов FGFR2, ALX4, NOG, SOX, HHIP, HEY1, WIF1, LTBP1 и PRSS12. Уровень транскрипции генов ALPL, FGF10 и TWIST1, наоборот, заметно (в 2-5 раз) уменьшается (Таблица 1). Уровень транскрипции остальных генов варьирует в небольших пределах. Все перечисленные гены кодируют белки, так или иначе, связанные с передачей сигналов и регуляцией базовых клеточных процессов. При индуцированной дифференцировке клеток ДП в остеобласты в 2-3 раза возрастает уровень транскрипции трех генов, FGFR2, TWIST1 и CRABP1, и в 1,3-1,5 раза – генов SOSTDC1, GDF10 и CRABP2. Уровень транскрипции генов ALPL, BMP4, FGF7, FGFR1, ALX4, SOX, HEY1, WIF1 и NDP уменьшается в 1,5-2 раза.
Таблица 1. Уровни транскрипции генов в клетках ДП первого (ДП0) и седьмого (ДП7) пассажей
| Ген | ДП0 | ДП7 | Примечание |
| BMP6 | 1.4x10-5 | 0.9x10-4 | Поддерживает статус клеток ДП |
| NOG | 5x10-2 | 10-1 | Ингибитор сигнального пути BMP |
| SOX2 | 4.5x10-2 | 10-1 | Маркирует клетки ДП в развитии |
| HHIP | 6.6x10-3 | 10-2 | Антагонист Hh сигналинга |
| HEY1 | 6.9x10-4 | 1.1x10-3 | Индуцируется в ДП, ген-мишень сигнального пути Notch |
| TWIST1 | 0.8x10-3 | 4.5x10-4 | Twist homolog 1 (Drosophila), участвует в остеогенной дифференцировке в зубах |
| FGF10 | 0.5 | 1.3x10-1 | Негативно регулирует путь wnt, экспрессия возрастает в волосяном фолликуле в фазе анаген. |
| FGFR1 | 1.2x10-3 | 6.9x10-3 | Уровень FGF1R возрастает в фазе позднего анагена и катагене. |
| WIF1 | 0.9x10-4 | 1.4x10-4 | Ингибитор пути wnt. |
| NDP | 5x10-4 | 1.5x10-3 | Norrie disease (pseudoglioma), активирует путь wnt через ингибирование frizzled-4 |
В последующем было проведено более обширное исследование уровней транскрипции генов в этих клетках в масштабах целого транскриптома на геномном анализаторе компании Иллюмина. Общее число активно транскрибируемых генов, транскрипция которых при культивировании клеток заметно повышается, весьма значительно, поэтому для дальнейшего рассмотрения мы выбрали только те из них, транскрипция которых увеличивается в 3 или более раз. Таких генов оказалось около 70. Большинство генов, транскрипция которых при культивировании клеток ДП заметно повышается, кодируют белки цитоскелета и межклеточного матрикса, участвующие в процессах клеточной адгезии, межклеточных контактах, регуляции пролиферации, дифференцировки, апоптозе, миграции клеток, явлениях эндо- и экзоцитоза и т.п. Почти столь же обширна группа генов, кодирующих белки, участвующие в работе различных сигнальных систем. Несколько меньше в этой категории генов, кодирующих белки-регуляторы экспрессии других генов и клеточного цикла. Интересно, что аналогичные категории преобладают и среди генов, транскрипция которых при культивировании уменьшается, хотя общее их число примерно в два раза меньше.
Полученные результаты показывают, что при культивировании стволовых клеток в неиндуцирующих условиях происходят спонтанные эпигенетические процессы, заметно изменяющие их внутренние свойства. Культура клеток ДП дает уникальную возможность сопоставления этих процессов и изменения функциональной активности клеток.
3.5.4. Разработка модели эпидермального морфогенеза.
3.5.4.1. Клетки дермальной папиллы индуцируют эпидермальный морфогенез in vitro.
На основании разработанной модели исследования миграции эпидермальных кератиноцитов по трехмерному коллагеновому гелю был разработан метод изучения эпидермального морфогенеза в культуре (Рис. 12).
Клетки ДП помещали в коллагеновый гель, а сверху на коллагеновый гель высевали пассированные кератиноциты. В качестве контроля использовали коллагеновый гель, содержащий фибробласты человека.
Через 10 дней в присутствии клеток ДП кератиноциты мигрировали в коллагеновый гель и формировали тубулярные выросты (ТВ). При этом происходила контракция верхнего слоя коллагенового геля кератиноцитами, что облегчало наблюдение за клетками. Постнатальные фибробласты не вызывали миграции кератиноцитов внутрь геля и формирования ТВ. Использование в эксперименте среды, кондиционированной клетками ДП, показало, что индукция тубулогенеза происходит в среде кондиционированной клетками ДП. Поэтому в дальнейшем в качестве индуктивного сигнала использовали кондиционированную среду. Такая система дала возможность оценивать и анализировать получаемые выросты, поскольку ТВ формировались в горизонтальном направлении, а использование кондиционированной среды позволило избежать сильной контракции геля, вызываемой клетками ДП. При помещении кератиноцитов в колагеновый гель и культивировании их в среде, кондиционированной клетками ДП, мы наблюдали формирование ТВ различной формы. ТВ начинают формироваться через 4-5 дней после посадки, и к 10-14 суткам достигают в среднем 1-2 мм.
Рис. 12. Модель изучения эпидермального морфогенеза в культуре
Электронно-микроскопическое исследование показало, что ТВ состоят из клеток различной степени дифференцировки. На срезе одного уровня можно найти молодые клетки, зрелые, содержащие кератогиалиновые зёрна в цитоплазме, и отмирающие, с разрушающимися ядром и клеточными мембранами. При этом наблюдалась закономерность распределения клеток, имеющих разную степень дифференцировки. Ближе к центру располагались молодые кератиноциты, а зрелые и отмирающие – на периферии. При панорамной реконструкции одного из срезов было отмечено спиральное расположение клеток. По крупным межклеточным пространствам и наличию многочисленных выростов и ворсинок можно судить о том, что клетки находятся в движении.
 а а | 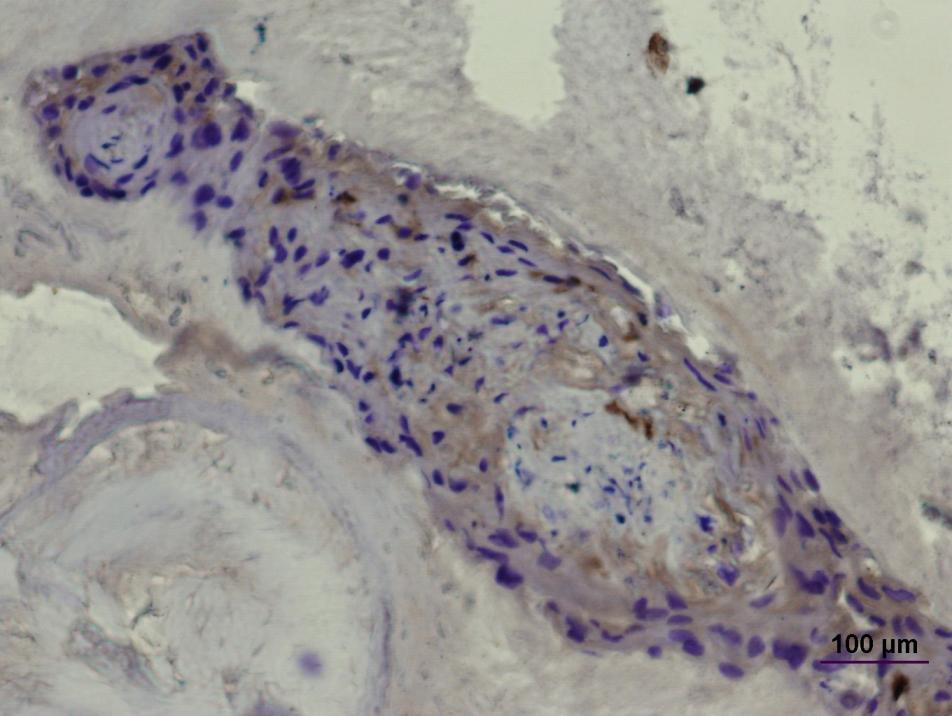 б б | 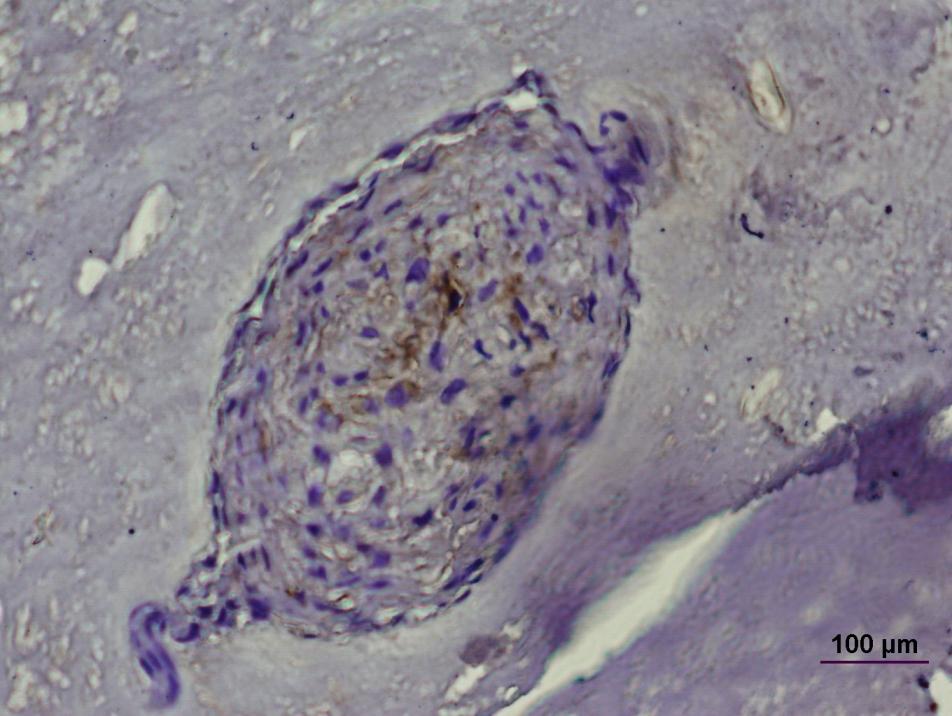 в в |
| Рис. 13. Поперечные срезы средней части ТВ. Иммуногистохимия. Окраска диаминобензимидом. Докрашено гематоксилином. а – кератин 14, б – кератин 10, в – кератин 19. | ||
Изучение экспрессии кератина 10 (К10) показало, в растущем крае доля К10+-клеток мала, а в средней части выростов дифференцированные кератиноциты распределяются по периферии (Рис. 13). При изучении экспрессии К19 какой-либо закономерности в распределении К19+-клеток обнаружено не было. Экспрессия кератина 14 была выявлена в клетках ведущего края эпидермального выроста.
Фолликулогенез de novo во взрослом эпидермисе может происходить по-разному (Inamatsu et al., 2006). При рекомбинации взрослого эпидермиса с эмбриональными дермальными конденсатами и последующей трансплантацией бестимусным мышам фолликулы формируются с прохождением стадии плакоды, т.е. с полной рекапитуляцией эмбрионального фолликулогенеза. Рекомбинация эпидермиса с ДП из взрослой кожи также приводит к формированию фолликулов, но образования плакод не наблюдается. В этом случае фолликулы образуются за счет активной пролиферации и миграции эпидермальных клеток в дерму, т.е. фолликул сразу оказывается на стадии анагена. Мы полагаем, что именно такие события имитирует наша модель. Несомненно, она является удобным инструментом для изучения сигнальных путей, вовлеченных в фолликулогенез и факторов, которые могут на него влиять.
3.5.4.2. Роль факторов роста и некоторых сигнальных путей в морфогенезе кератиноцитов человека in vitro
В контрольной среде, не содержащей факторов роста, ТВ не образовывались. При добавлении в среду EGF и фактора роста кератиноцитов (KGF) был отмечен активный рост ТВ. Их форма и размеры были схожи со структурами, образующимися при культивировании в среде, кондиционированной клетками ДП. При этом формирование ТВ в этих двух вариантах опытов началось позже (на 5-6 сут) и продолжалось дольше, чем в опытах с кондиционированной клетками ДП средой и фактором роста гепатоцитов (HGF) (новые выросты образовывались и на 10-14 сут).
Как известно, эти факторы стимулируют митотическую активность и миграцию эпидермальных клеток. EGF in vivo продуцируется фибробластами кожи. Он стимулирует пролиферацию культуры кератиноцитов и усиливает миграцию краевых клеток в колониях (Barrandon, Green, 1987). Ранее мы продемонстрировали в модели заживления раны в культуре, что EGF значительно сокращает время эпителизации. KGF синтезируется фибробластами дермы и, попадая в эпидермис, активирует ряд генов, которые прямо или косвенно влияют на пролиферацию, дифференцировку и миграцию кератиноцитов. Синтез KGF значительно усиливается в процессе эпителизации ран (Marchese et al., 1995). Стимуляция пролиферации и миграции кератиноцитов под действием EGF и KGF, вероятно, вносит существенный вклад в инициацию тубулярных структур в использованной нами модели.
Инсулиноподобный фактор роста и основной фактор роста фибробластов индуцировали незначительное число ТВ. При добавлении HGF в среду культивирования наблюдали самые протяженные и ветвящиеся ТВ. Известно, что HGF индуцирует инвазию кератиноцитов в дерму и участвует в морфогенезе и регуляции роста волосяного фолликула в органотипической культуре клеток мыши (Lindner et al., 2000), однако индукция морфогенеза в культуре кератиноцитов человека HGF была показана впервые.
Следует, однако, отметить, что не все из изученных факторов постоянно присутствуют в микроокружении волосяного фолликула in vivo (Botckkarev and Paus, 2003). Кроме того, как было отмечено выше, существует большое количество других регуляторов морфогенеза. Изменение спектра факторов, а также инициация их синтеза в клетках мезенхимного компартмента являются компонентами регуляторного механизма, обеспечивающего формирование волосяного фолликула из эмбрионального эпидермиса в онтогенезе, а также смену фаз роста и дегенерации волосяного фолликула на протяжении жизни организма.
Мы предприняли попытку определить активацию некоторых сигнальных путей при воздействии факторов клеток дермальной папиллы на эпидермальные клетки. Для этого кератиноциты культивировали в среде, кондиционированной клетками ДП и в контрольной среде. Методом ПЦР в реальном времени определяли экспрессию кератина 17, LEF1, Shh и Wnt10b. Результаты исследований показали, что под действием кондиционированной клетками ДП среды повышается экспрессия генов Shh и Wnt10b, однако абсолютные значения невелики. Экспрессия LEF1 и К19 изменялась разнонаправлено. Несомненно, дальнейшие исследования на основе созданной модели позволят получить ценные данные о регуляции индукции фолликулогенеза у человека. Открываются перспективы по поиску агентов, эффективно регулирующих этот процесс.
Заключение
Разработка методов культивирования клеток способствовала значительному прогрессу в клеточной биологии. При культивировании часть характеристик клетки сильно изменяется. Однако по мере развития техники культивирования, клетка in vitro стала отдельным биологическим объектом и все шире применяется в медицине и биотехнологии. Задача стоит в управлении свойствами культивируемых клеток: обнаружении закономерностей поведения клеток в культуре, поиске тех элементов, которые аналогичны их поведению в организме и определении факторов, которые могут модулировать поведение клеток. Особенно актуально это в отношении клеток человека. Представленная работа демонстрирует, что в культуре клеток кожи человека возможна реконструкция ключевых моментов начальных этапов морфогенеза – компактизация клеток, миграция, дифференцировка и формирование многоклеточных трехмерных структур в матриксе. Во многом, эти события отражают внутренние, присущие кератиноцитам свойства, а для реализации некоторых из них необходимо присутствие компетентных мезенхимных клеток.
Кожа – легкодоступный источник двух основных типов клеток (эпителиальных и мезенхимных). Мы показали, что эпидермальные стволовые клетки в культуре сохраняются. На основании проведенных нами исследований можно также с уверенностью заключить, что волосяной фолликул кожи человека является источником специализированных мультипотентных стволовых клеток. Мы продемонстрировали, что клетки ДП волосяного фолликула могут быть эффективно выделены, культивированы и использованы для моделирования эпидермального морфогенеза у человека, изучения эпигенетических изменений, происходящих в клетках, в том числе стволовых, в процессе культивирования, а также, вероятно, в прикладных исследованиях, направленных на реконструкцию волосяного фолликула и/или стимуляцию собственных фолликулов, разработку новых способов лечения алопеции, тестирование лекарственных препаратов.
Кожа – первый после костного мозга орган, подвергшийся тканеинженерной (клеточной) реконструкции. Представленная работа обосновывает возможность реконструкции в культуре не только эпидермального пласта, но и сложно устроенной структурно-функциональной единицы кожи человека, включающей волосяные фолликулы и другие придатки кожи. Проведенные исследования позволяют воспользоваться свойствами клеток кожи и особенностями их поведения в культуре для моделирования фундаментальных процессов морфогенеза и тканевого гомеостаза, а также для создания новых технологий регенерационной медицины.
ВЫВОДЫ
1. Кератиноциты in vitro сохраняют способность к образованию гистотипических структур, сходных с межфолликулярным эпидермисом. Они обладают пролиферативной активностью и формируют кластеры, аналогичные структурно-функциональным единицам эпидермиса in vivo.
2. Для коллективной миграции кластеров эпидермальных клеток на плоском субстрате in vitro характерна зависимость от пролиферации отдельных клеток: на ведущем крае мигрирующего кластера находятся клетки, обладающие высокой пролиферативной активностью; миграция эпидермального пласта in vitro осуществляется за счет кооперативной миграционной активности первых нескольких рядов клеток. Существует базальный уровень миграции, не зависимый от подавления пролиферации и действия факторов роста и обеспечивающий быстрый ответ клеток эпидермиса на появление свободного края.
3. На модели эпителизации коллагенового геля выявлена морфогенетическая роль мезенхимных клеток. При миграции эпидермальных кератиноцитов человека в коллагеновом геле происходит образование тубулярных структур. Этот морфогенетический процесс сходен с ранними стадиями развития волосяного фолликула. Предложенная модель может служить для определения морфогенетического потенциала клеток in vitro.
4. Мезенхимные стволовые клетки, находящиеся в волосяном сосочке (дермальной папилле) волосяного фолликула, в культуре индуцируют эпидермальный морфогенез. Факторы роста HGF, EGF и KGF могут частично заменить указанное действие клеток дермальной папиллы.
5. Культивируемые клетки дермальной папиллы обладают свойством дифференцироваться в остеогенном, нейрогенном, и, в меньшей степени, адипогенном направлениях. Они способны реорганизовывать внеклеточный матрикс, стимулировать ангиогенез, формировать псевдопапиллы.
6. В процессе культивирования клеток дермальной папиллы человека происходит значительное повышение уровня транскрипции генов BMP6, FGFR1 и NDP и понижение уровня транскрипции генов ALPL, FGF10 и TWIST1.
7. Культивированные клетки волосяного фолликула человека могут быть использованы для разработки новых технологий для регенеративной медицины как легкодоступный источник клеток, обладающих широкими дифференцировочными и функциональными возможностями для стимуляции эпителизации, ангиогенеза и фолликулогенеза.
Список основных публикаций по теме диссертации.
Статьи в рецензируемых журналах
1. Васильев А.В., Воротеляк Е.А., Терских В.В. Моделирование регенерации эпидермиса in vitro: совместное действие сыворотки и эпидермального фактора роста // Онтогенез. 1994. Т. 25. №3. С. 74-79.
2. Воротеляк Е.А., Васильев А.В., Гусев С.А., Повалий Т.М., Терских В.В. Альфа-фетопротеин подавляет пролиферацию кератиноцитов in vitro // Известия РАН. Серия биол. 1996. №1. С. 117-120.
3. Воротеляк Е.А., Леонова О.Г., Шинин В.В., Васильев А.В., Терских В.В. Рост эпидермальных кератиноцитов человека на коллагеновом геле // Доклады Академии Наук. 1999. Т. 369. № 5. С. 695-697.
4. Воротеляк Е.А., Шихвердиева А.Ш., Васильев А.В., Терских В.В. Моделирование процесса миграции эпидермальных кератиноцитов человека по трехмерному коллагеновому гелю // Известия РАН. Серия биол. 2002. №1. С. 30-37.
5. Воротеляк Е.А., Шихвердиева А.Ш., Васильев А.В., Терских В.В. Фибробласты стимулируют эпителизацию коллагенового геля // Известия РАН. Серия биол. 2002. №4. С. 421-426.
6. Терских В.В., Васильев А.В., Воротеляк Е.А. Структурно-функциональные единицы эпидермиса // Известия РАН. Серия биол. 2003. №6. С. 645-649.
7. Васильев А.В., Воротеляк Е.А., Крохина Т.Б., Цитрин Е.Б., Терских В.В., Хрущов Н.Г. Нестинположительные клетки базального слоя эпидермиса человека в культуре // Доклады Академии наук. 2004. Т. 394. С. 555-557.
8. Воротеляк Е.А., Цитрин Е.Б., Васильев А.В., Терских В.В. Кератиноциты человека, длительно сохраняющие метку в культуре // Доклады Академии наук. 2005. Т. 402. № 3, С. 418-420.
9. Воротеляк Е.А., Чермных Э.С., Васильев А.В., Терских В.В. Организация популяции кератиноцитов в культуре in vitro // Известия РАН. Серия биол. 2005. №6. С. 645-649.
10. Терских В.В., Васильев А.В., Воротеляк Е.А. Стволовые клетки: эволюция концепции // Вестник дерматологии и венерологии. 2005. № 2. С. 4-8.
11. Терских В.В., Васильев А.В., Воротеляк Е.А. Стволовые клетки и структура эпидермиса // Вестник дерматологии и венерологии. 2005. № 3. С. 11-15.
12. Воротеляк Е.А., Чермных Э.С., Васильев А.В., Терских В.В. Экспрессия кератина 19 в культуре эпидермальных кератиноцитов человека // Доклады Академии наук. 2006. Т. 408. №6. С. 835-837.
13. Терских В.В., Васильев А.В., Воротеляк Е.А. Ниши стволовых клеток // Известия РАН. Серия биол. 2007. № 3. С. 261-272.
14. Воротеляк Е.А., Чермных Э.С., Ткаченко С.Б., Васильев А.В., Терских В.В. Экспрессия и функция гена р63 в эпителиальных клетках // Известия РАН. Серия биол. 2007. № 4. С. 389-393.
15. Терских В.В., Васильев А.В., Воротеляк Е.А. Поляризация и асимметричное деление стволовых клеток // Цитология. 2007. Т. 49. № 11. С. 933-938.
16. Чермных Э.С., Воротеляк Е.А., Ткаченко С.Б., Васильев А.В., Терских В.В. Пролиферация кератин 19-положительных эпидермальных кератиноцитов человека in vitro // Доклады Академии наук. 2007. Т. 416. №4. С. 555-557.
17. Терских В.В., Васильев А.В., Воротеляк Е.А. Сохранение генетической информации в стволовых клетках // Генетика. 2008 Т. 44, № 3. С. 305-308.
18. Терских В.В., Васильев А.В., Воротеляк Е.А. SP-фенотип стволовых клеток // Известия РАН. Серия биол. 2008. №5. С. 517-521.
19. Васильев А.В., Воротеляк Е.А., Киселев И.В., Терских В.В. Реконструкция эпителиальных тканей с использованием клеточных технологий // Вестник РАМН. 2008. №2. С. 45- 53.
20. Киселева Е.В., Чермных Э.С., Воротеляк Е.А., Воложин А.И., Васильев А.В., Терских В.В. Сравнение дифференцировочных потенций фибробластоподобных клеток стромы костного мозга, жировой ткани, волосяного сосочка и фибробластов дермы человека // Цитология. 2009. Т. 51. №1. С. 12-19.
21. Гнедева К.Ю., Чермных Э.С., Воротеляк Е.А., Васильев А.В., Терских В.В. Влияние факторов роста на морфогенез кератиноцитов человека in vitro // Известия РАН. Серия биол. 2009. №3. С. 368-372.
22. Воротеляк Е.А., Терских В.В., Стволовые клетки эпителиальных тканей // В кн.: Биология стволовых клеток и клеточные технологии. Под ред. М.А. Пальцева. Москва. «Медицина» «Шико». 2009. С. 53-74.
23. Терских В.В., Васильев А.В., Воротеляк Е.А. Микроокружение стволовых клеток // В кн.: Биология стволовых клеток и клеточные технологии. Под ред. М.А. Пальцева. Москва. «Медицина» «Шико». 2009. С. 44-66.
24. Терских В.В., Воротеляк Е.А., Васильев А.В. Самоподдержание стволовых клеток // Actae Natura. 2009. №2 C. 67-72.
25. Терских В.В., Васильев А.В., Воротеляк Е.А. Самоподдержание стволовых клеток: роль асимметричного деления // Известия РАН. Серия биол. 2009. №5. С 509-514.
26. Terskikh V. V., Vasiliev V. A., and Vorotelyak E. A. Daughter Cells Self-Renew through Asymmetric Division // In: Daughter Cell, Ed. A. Hitomi and M. Katoaka, Nova Science Publishers Inc. 2010. Р. 267-282.
27. Chermnykh E.S., Vorotelyak E.A., Gnedeva K.Y., Moldaver M.V., Yegorov Y.E., Vasiliev A.V. and Terskikh V.V. Dermal papilla cells induce keratinocyte tubulogenesis in culture // Histochemistry and Cell Biology. 2010. V. 133, Issue 5. P. 567-576.
28. Чермных Э.С., Радюхина Н.В., Руткевич П.Н., Шевелев А.Я., Власик Т.Н., Воротеляк Е.А., Васильев А.В., Терских В.В. Культивированные клетки волосяного фолликула человека способны встраиваться в структуру кожи in vivo // Цитология. 2010. Т. 52. №3. С. 219-224.
29. Гнедева К.Ю., Воротеляк Е.А., Терских А.В., Васильев А.В, Терских В.В. Дифференцировочный и морфогенетический потенциал клеток дермальной папиллы крысы // Известия РАН. Серия биол. 2011. № 6. С. 653-658.
30. Terskikh V.V., Vasiliev A.V., Vorotelyak E.A. Label retaining cells and cutaneous stem cells // Stem Cell Review and Reports. 2011. DOI: 10.1007/s12015-011-9299-6.
Патент
E. Vorotelyak, A. Vasiliev, E. Chermnykh, N. Tankovich. Angiogenically induced transplants and methods for their use and manufacture. – US20090148416.

