Морфофункциональное изменение миозинового фенотипа и других структурных компонентов мышечной ткани при функциональной разгрузке и реадаптации
На правах рукописи
КАРТАШКИНА НАТАЛИЯ ЛЕВОНОВНА
МОРФОФУНКЦИОНАЛЬНОЕ ИЗМЕНЕНИЕ МИОЗИНОВОГО ФЕНОТИПА И ДРУГИХ СТРУКТУРНЫХ КОМПОНЕНТОВ МЫШЕЧНОЙ ТКАНИ ПРИ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ И РЕАДАПТАЦИИ
03.03.04 клеточная биология, цитология, гистология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Московская медицинская академия имени И.М.Сеченова» и в Государственном научном центре Российской Федерации Институте медико-биологических проблем Российской Академии Наук.
Научные руководители:
Член-корр. РАМН, профессор Кузнецов Сергей Львович
Доктор биологических наук Немировская Татьяна Леонидовна
Официальные оппоненты:
Доктор медицинских наук, профессор Павлов Алексей Владимирович
Доктор медицинских наук, профессор Дубовая Татьяна Клеониковна
Ведущая организация:
Московский государственный медико-стоматологический университет
Защита диссертации состоится « » __________ 2010 года в часов на заседании диссертационного совета Д.208.040.01 при Московской медицинской академии им. И.М.Сеченова по адресу: 119992, Москва, ул. Трубецкая д.8 стр.2.
С диссертацией можно ознакомиться в библиотеке Московской медицинской академии
им. И.М.Сеченова по адресу: г. Москва, Нахимовский пр-т, д.49.
Автореферат разослан « _ » ………г.
Ученый секретарь диссертационного совета
ГОУ ВПО ММА им. И.М.Сеченова Бартош Н.О.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Известно, что скелетная мышца обладает высокой степенью пластичности. Механо-зависимая пластичность скелетной мышцы – это ее способность отвечать глубокой структурно-функциональной перестройкой на изменение режима сократительной активности.
При длительных однонаправленных изменениях функциональной активности изменяются формирующие мышцу мышечные волокна. Наиболее важные изменения, обнаруживаемые в мышечных волокнах при пониженной сократительной активности, сопровождаются перестройкой всех основных систем, осуществляющих сократительную деятельность мышцы.
Ранее многими авторами придавалось большое значение механическому напряжению мышечных волокон, как фактора, влияющего на соотношение анаболических и катаболических процессов в мышце. Растяжение, как фактор, моделирующий естественное механическое напряжение, приводит к увеличению вероятности актомиозинового взаимодействия [Proske U., 1999], напряжению цитоскелетных и мембранных структур [Ohira Y., 1997, 2000]. В диссертационной работе Туртиковой О. В. [Туртикова О.В., 2008] было показано, что ни облучение ионизирующей радиацией, ни блокирование системы mTOR, ни отсутствие сарколеммального белка дистрофина (у мышей линии mdx) не приводят к снижению размера мышечных волокон и не изменяет миозиновый фенотип при растяжении мышцы. Растяжение мышцы приводит также к увеличению концентрации в ней оксида азота [Koh T.J., 1999].
При хроническом растяжении мышц на фоне гравитационной разгрузки наблюдается уменьшение степени атрофии мышечных волокон [Goldspink D.F., 1997, Jaspers S., 1988]. Выделяют рефлекторный и местный компоненты [Ohira Y., 1997, 2000], которые могут быть задействованы в предотвращении атрофии в этих условиях. Есть некоторые данные, указывающие на существенную роль афферентного входа в реализации профилактического эффекта хронического растяжения [Falempin M., 1999]. Однако в диссертационной работе Т.Л.Немировской было показано, что при перерезке афферентного входа не наблюдается атрофия мышечных волокон при растяжении мышцы [Немировская Т.Л., 2003]. Следовательно, активацию афферентных входов, конвергирующих на спинальные мотонейроны, и продуцирующих соответствующий элементарный рефлекторный сократительный ответ при растяжении мышцы, нельзя считать стимулом, предотвращающим атрофию скелетных мышц при её функциональной разгрузке и растяжении.
С другой стороны известно, что при уменьшении механической активности мышц происходит их атрофия и соотношение волокон, содержащих быстрые и медленные изоформы тяжелых цепей миозина, меняется в быструю сторону [Oganov V.S., 1982, Ohira Y., 2000, Pette D., 2001]. Эти изменения, непосредственно обусловлены характеристиками импульсной активности двигательных единиц мотонейронов [Diffee G.M., 1991]. Показана преимущественная инактивация двигательных единиц медленного типа в условиях гравитационной разгрузки [Kozlovskaya I., 1988]. Обнаружено увеличение электромиографического ответа постуральных синергистов мышц конечностей при искусственной стимуляции опорных зон стопы методом оказания пневматического давления на стопу во время космического полета [Layne CS, 1998]. Весовая нагрузка на мышцы при этом отсутствовала. Было показано, что сама опорная стимуляция целиком, или частично предотвращает атрофию скелетных мышц при реальной, или моделируемой гравитационной разгрузке при отсутствии нагруженного сокращения мышцы. Однако осталось невыясненным, предотвращает ли такое профилактическое воздействие изменение соотношения тяжелых цепей миозина в быструю сторону. Вопрос о соотношении вклада центрального и локального уровней регуляции мышечной деятельности в поддержании ее миозинового фенотипа остаётся открытым.
В настоящее время также остаётся не изучен вопрос о видовой специфичности ответа скелетных мышц на функциональную разгрузку. Не известно одинаково изменяются ли структурно-метаболические характеристики скелетных мышц разных животных в космическом полёте? Поиск новых экспериментальных моделей с иной реакцией на функциональную разгрузку и исследование механизмов формирования видоспецифического ответа может помочь в поиске эффективных путей предотвращения негативных последствий снижения мышечной активности.
В последнее время всё большее внимание различных исследователей фокусируется на механизмах восстановления мышц после снижения их функциональной активности (или гравитационной разгрузки). Ранее было показано, что наиболее эффективное воздействие гипоксическими условиями обычно наблюдают при повышенной активности исследуемой мышцы [Немировская Т.Л., 2003]. Учитывая крайне низкое значение кислородного запроса неработающей мышцы [Hepple R.T., 2002], очевидно, что наибольшее значение кислородных градиентов следует ожидать при повышенной активности мышцы. В то же время известно, что m. soleus в условиях постгипокинетической реадаптации испытывает весьма существенные нагрузки, вплоть до значительного вклада эксцентрического компонента [Riley D.A., 1998]. Однако в настоящее время не исследовано, может ли применение гипоксического воздействия при реадаптации ускорить восстановительные процессы в скелетных мышцах.
В связи с вышеизложенным, целью настоящего исследования являлся анализ структурных изменений мышечных волокон в условиях функциональной разгрузки на фоне различных протекторных воздействий и в период реадаптации.
Для достижения поставленной цели были сформулированы следующие задачи:
- Выявить роль оксида азота в поддержании структуры мышечных волокон в условиях функциональной разгрузки.
- Исследовать возможность участия нейрональной NO-синтазы в поддержании структуры мышечных волокон при длительной функциональной разгрузке в условиях иммобилизации мышцы в растянутом состоянии.
- Определить влияние пониженной функциональной активности на изоформный состав тяжелых цепей миозина и размеры волокон камбаловидной мышцы.
- Оценить степень выраженности структурных изменений мышечных волокон после космического полета у монгольских песчанок.
- Изучить влияние гипоксического воздействия после функциональной разгрузки на скорость реадаптации путем оценки уровня атрофических изменений через 7 суток восстановления.
Положения, выносимые на защиту
- Введение донора оксида азота во время функциональной разгрузки поддерживает структуру мышечных волокон и активацию миосателлитов.
- Использование электростимуляции мышц и стимуляции опорных проприоцепторов в ходе моделирования гравитационной разгрузки способствует снижению атрофических изменений мышечных волокон.
- Изменение миозинового фенотипа и размеров мышечных волокон в условиях космического полета имеет видовые особенности.
- Гипоксическое воздействие позволяет увеличить скорость реадаптации скелетных мышц после функциональной разгрузки.
Научная новизна работы
- Выявлено протекторное действие оксида азота на структуру мышечных волокон в условиях функциональной разгрузки. Обнаружено, что увеличение концентрации оксида азота во время функциональной разгрузки мышц препятствует падению в ней количества миосателлитов, а предотвращение снижения мышечной массы при растяжении мышц не связано с работой нейрональной NO-синтазы.
- Показано, что электростимуляция предотвращает изменение миозинового фенотипа и размеров волокон камбаловидной мышцы человека после 7-суточного экспонирования в условиях «сухой» иммерсии.
- Показано, что у нового объекта с измененным водно-солевым обменом - монгольской песчанки - имеет место меньшая выраженность атрофических изменений мышечных волокон после 12-суточного космического полета по сравнению с крысами в полетах аналогичной длительности. В то же время трансформация мышечных волокон в быструю сторону отсутствует.
- Выявлена положительная роль гипоксического воздействия в условиях реадаптации мышц после функциональной разгрузки (за счет набора сухой массы мышцы).
Теоретическая и практическая значимость
В нашей работе получены новые данные об адаптации скелетных мышц к понижению их сократительной активности, а также клеточных механизмах, запускающих процессы адаптации. Повышение длительности космических полетов и усложнение условий работы экипажей диктуют необходимость разработки новых средств и методов профилактики неблагоприятных последствий невесомости. Базисные закономерности структурно-метаболической адаптации скелетных мышц являются составной частью теоретических основ разработки таких средств и методов.
Выявление протекторного действия препарата L-аргинина, электростимуляции, навязанного растяжения мышцы может способствовать поиску методов профилактики негативных последствий функциональной разгрузки.
Полученные результаты могут быть использованы для научного обоснования разработки новых методов коррекции гипокинетических мышечных синдромов, а также в разработке новых эргогенных технологий в спортивной и экстремальной медицине и новых программ тренировки спортсменов.
Результаты исследования используются в учебном процессе в Московской медицинской академии им. И.М. Сеченова.
Апробация работы
Диссертация апробирована на совместном заседании кафедры гистологии ММА им. И.М.Сеченова и лаборатории миологии ГНЦ ИМБП РАН. Результаты исследований и основные положения работы были представлены и обсуждены на: 38-й европейской мышечной конференции (Лиль, Франция, 2009); 17-м Международном симпозиуме «Человек в космосе» (Москва, Россия, 2009); 8-ой Конференции молодых ученых, специалистов и студентов, посвященных дню космонавтики (ИМБП, Москва, 2009), конференции «Ломоносов 2009» (Москва, Россия, 2009), 14-й международной конференции по биохимии упражнений (Гюэльф, Канада, 2009), 30-м симпозиуме по гравитационной физиологии (Сиань, Китай, 2009).
Публикации
По теме диссертации опубликовано 8 печатных работ на русском и английском языках.
Структура и объем диссертации
Диссертационная работа состоит из введения, обзора литературы, описания организации экспериментов и методик обработки биологического материала, изложения результатов исследования и их обсуждения, общего заключения, выводов и списка цитируемой литературы. Работа изложена на 124 страницах печатного текста, включает 26 рисунков, 4 таблицы и список литературы из 265 наименований.
материалы и методы исследования
В работе применяли иммуногистохимические и биохимические методы анализа.
Пробы ткани брали из камбаловидной мышцы, освобождали от соединительной и жировой ткани, ориентировали, заключали в среду Tissue Tek (O.C.T.TM Compound 4583) и замораживали в изопентане, охлажденном в жидком азоте. Пробы хранили при - 80° C вплоть до обработки.
Для иммуногистохимического анализа делали поперечные срезы мышечной ткани толщиной 10 мкм при -20°С в криостате фирмы Leica. Срезы располагали на покрытых адгезивом гистологических стеклах. Иммуногистохимическое окрашивание включало следующие основные этапы: фиксация срезов и блокирование в нормальной сыворотке для предотвращения неспецифического связывания антител, инкубация с первичными антителами к исследуемому белку, инкубация с вторичными антителами, конъюгированными с флуоресцентной или пероксидазной меткой, при пероксидазном мечении – проявление окраски с помощью раствора диаминобензидина и перекиси водорода. Все этапы реакции проводились во влажной камере, после каждого этапа проводилась трехкратная пятиминутная отмывка препарата в PBS. При флуоресцентном мечении препараты заключали в среду, стабилизирующую флуоресцентную метку (Fluoromount-G), при пероксидазном – обезвоживали в спиртах возрастающей концентрации и заключали в канадский бальзам.
Выявление тяжелых цепей миозина (ТЦМ) стандартным методом
Инкубацию срезов мышечной ткани с первичными антителами против быстрых или медленных изоформ тяжелых цепей миозина (NCL-МHCf и NCL-MHCs (Novocastra, США) проводили при температуре 37°С в течение 60 мин, со вторичными антителами, конъюгированными с FITC,– в течение 60 мин в темноте при комнатной температуре.
Выявление тяжелых цепей миозина (ТЦМ) по методике двойного мечения
Поперечные срезы мышечной ткани в течение 1 часа при 37 или 1,5 часа при комнатной температуре инкубировали с первичными моноклональными антителами против изоформ ТЦМ I типа (1:60, Novocastra, NCL-MHCs), затем со вторичными поликлональными антителами, конъюгированными с флуоресцентной меткой (GAM, 1:1000, Alexa546, Molecular probes) в течение 1 часа в темном месте. После окончания реакции препараты тщательно промывали в PBS в течение 30 минут, далее применяли блокирующий буфер (100% лошадиная сыворотка) на 20 минут при комнатной температуре. Для выявления изоформ ТЦМ II типа были использованы первичные моноклональные антитела мыши в разведении 1:40 (компании DSMZ), затем, после промывки и блокирования сывороткой, вторичные поликлональные антитела, конъюгированные с флуоресцентной меткой (GAM, 1:1000, Alexa350, Molecular probes). Срезы заключали во Fluoromount (Electronic Microscopy Science).
Выявление дистофина и миоядер
Волокна контурировали антителами к субсарколеммальному белку дистрофину с одновременным окрашиванием ядер. Для предотвращения неспецифического связывания вторичных антител срезы мышечной ткани блокировали в течение 45 мин при комнатной температуре с антителами козы против иммуноглобулинов мыши. Срезы инкубировали с первичными антителами против дистрофина (Novocastra, NCL-DYSI) при температуре 37°С в течение 60 мин. Использовали вторичные антитела против иммуноглобулинов мыши, конъюгированные с флуоресцентной меткой Alexa, в темноте при комнатной температуре в течение 60 мин. На заключительном этапе реакции срезы инкубировали в течение 10 мин с DAPI в концентрации 1-2 мкг/мл для окраски миоядер.
Окрашивание на 5’-бром,- 2’- дезоксиуридин (BrdU) – выявление ядер делящихся клеток
Срезы мышц фиксировали в спиртовом растворе уксусной кислоты (90 % этанола, 5 % уксусной кислоты, 5 % воды) в течение 30 мин, после чего промывали в PBS. Cрезы блокировали в течение 45 мин антителами против иммуноглобулинов мыши. После этого наносили раствор нуклеазы с мышиными моноклональными антителами против BrdU (Amersham Bioscienses) и инкубировали 1 час при 37°С. Срезы инкубировали при комнатной температуре в течение часа в биотинилированных овечьих антителах против иммуноглобулинов мыши (в разведении 1:200), а затем в течение 30 мин в стрептавидине, конъюгированном с пероксидазой хрена (1:100) (Amersham Bioscienses). Реакцию проявляли раствором DAB в PBS с 3% перекисью водорода.
Выявление клеток-миосателлитов
Окрашивание на М-кадгерин. Срезы мышечной ткани фиксировали в 4% растворе параформальдегида в PBS 15 мин, затем отмывали. Срезы блокировали в течение 40 мин в 5% блокирующей сыворотке (Horse serum, Novocastra) содержащей 1% Triton X-100. Затем срезы инкубировали в первичных антителах против M-cad, разведенных в блокирующей сыворотке с добавлением 0,3% Triton X-100 при +4 оС в течение 15 часов. Были использованы первичные антитела goat monoclonal anti M-cadherin sc-6740 (Santa cruz). Вторичные антитела – rabbit anti goat FITC-conjugated (Имтек) разводили в PBS (1:150) с добавлением 5% блокирующей сыворотки и 0,1% Triton X-100 при комнатной температуре в темноте в течение часа. Для окрашивания ядер применяли DAPI.
Биохимический анализ. Для выявления -актина использовали метод элетрофореза. С каждой пробы m.soleus были сделаны срезы толщиной 20 мкм, помещены в лизирующий буфер. Электрофорез проводили в 12% разделяющем акриламидном геле и 5% концентрирующем акриламидном геле. Электрофорез проводили при 15 мА на гель в мини-системе Bio-Rad при комнатной температуре в течение 1 часа. Вестернблоттинг проводили при 350 мА 30 минут при температуре +4C в системе mini Trans-Blot (Bio-Rad) в течение 30 минут. Для выявления -актина были использованы первичные моноклональные антитела (monoclonal anti-a-sarcomeric actin, clone 5c5 mouse ascites fluid, 1:1000). Для визуализации полос использовали вторичные биотинилированные поликлональные антитела (GAM, Имтек, 1:500). Инкубации проводили 1 час при комнатной температуре. В качестве субстрата и хромогена брали перекись водорода и диаминобензидин. Сигнал анализировали сканером GS-800 (Bio-Rad) и программой ImageJ. Вестернблоттинг был повторен от 3х до 5 раз.
Анализ полученных препаратов
Препараты фотографировали при 40-кратном увеличении с использованием флуоресцентного микроскопа фирмы Leica (Германия), снабженного цифровой видеокамерой Leica DC 300F. Все измерения длины разрыва дистрофинового слоя ко всему периметру волокна. Препараты анализировались на фотографиях с помощью программного обеспечения Leica. Подсчитывали процентное содержание волокон с поврежденным дистрофиновым слоем и вычисляли отношение менее 100 волокон с каждого среза. При определении ППС МВ (площадь поперечного сечения мышечного волокна) анализировали не менее 100 МВ, при измерении периметра и числа миоядер, количества ядер c включенным BrdU – не менее 200 МВ, при подсчете относительного содержания быстрых и медленных изоформ ТЦМ – не менее 500 МВ. Для идентификации собственных ядер МВ (миоядер) волокна контурировали антителами к субсарколеммальному белку дистрофину. Все ядра, находящиеся в пределах области, ограниченной продуктами иммуногистохимической реакции, считали миоядрами. Обработку данных проводили с помощью программ Excel и SigmaPlot. При статистическом анализе результатов использовали одномерный вариант ANOVA и t-критерий Стьюдента.
ОРГАНИЗАЦИЯ ИССЛЕДОВАНИЙ, РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Проведены следующие серии исследований:
1. Эксперименты с функциональной разгрузкой задних конечностей крыс и модулированием работы нейрональной NO-синтазы
В эксперименте использовали 42 самца крыс Wistar (по 7 животных в каждой из 6 экспериментальных групп) из вивария ГНЦ РФ Института Медико-биологических проблем РАН в возрасте 2,5 месяца с массой 220-240 г. Все животные, отобранные для эксперимента, получали корм и воду в соответствии с рационом для лабораторных животных и содержались в виварии при температуре 22°C со сменой светового дня 12/12 часов. Вывешивание крыс проводили в течение 14 дней в стандартных клетках за хвост по методу Новикова-Ильина (задние конечности не касались земли, а передние опирались на пол). Тело крыс при этом располагалось под углом 45° к полу клетки. При растяжении экстензоров голени обе задние конечности крыс были иммобилизованы в голеностопном суставе под углом 35о. Растяжение проводили под нембуталовым наркозом (нембутал применяли внутрибрюшинно в дозе 10 мг/кг массы тела животного). Эксперимент проводился в соответствие с нормативными положениями о правилах обращения с лабораторными животными. Экспериментальные группы: Группа «Контроль - К». Животные этой группы находились в виварии в течение всего эксперимента; Группа «Вывешивание - В»; Группа «Вывешивание с введением L-аргинина (донор NO) – ВЛ». Животным этой группы ежедневно с водой вводили L-агринин в концентрации 500мг/кг веса крысы; Группа «Вывешивание с введением L-NAME (L-NAME – N – nitro L-arginine methyl ester hydrochloride) блокатор NO – ВН». Животным данной группы ежедневно с водой вводили L-NAME в концентрации 90мг/кг веса крысы; Группа «Вывешивание с растяжением m. soleus и введением L-NAME - РН». Крысы данной группы были вывешены с иммобилизацией задних конечностей с ежедневным введением L-NAME аналогично группе ВН; Группа «Вывешивание с растяжением m. soleus - Р». Крысы данной группы были вывешены с иммобилизацией обеих задних конечностей.
Через 24 ч. после окончания эксперимента крыс забивали введением сверх дозы нембутала (200 мг/кг). Перед забоем у всех животных забирали пробы мышечной ткани под нембуталовым наркозом (20 мг/кг). Иммуногистохимически выявляли тяжелые цепи миозина для определения соотношения быстрых и медленных изоформ, определяли ППС МВ. Иммуногистохимически выявляли дистрофин и миоядра. Проводили анализ процентного содержания волокон с поврежденным дистрофиновым слоем, процентного отношения длины разрывов в дистрофиновом слое и количества миоядер. Клетки-сателлиты визуализировали путем иммуногистохимического выявления их антителами против M-кадгерина (М-cad).
Данные по весу m. soleus и площади поперечного сечения мышечных волокон (ППС МВ) представлены в таблице 1.
Таблица 1
Вес m.soleus и площадь поперечного сечения мышечных волокон (ППС МВ)
| Значение/группа | К | В | ВЛ | ВН | Р | РН | |
| Вес m.soleus, г | 101±4 | 55±2* | 67±5*$ | 56±4* | 93±6 | 101±3 | |
| ППС, µс2 | МВ I | 2085±159 | 1154±60* | 1547±59*$ | 1260±73* | 2264±586 | 2377±168 |
| МВ II | 1737±174 | 1249±80* | 1495±75$ | 1300±50* | 1527±351 | 1540±75 | |
| % волокон | МВ I | 85±4 | 74±3* | 81±4 | 77±4 | 77±2 | 80±6 |
| МВ II | 19±3 | 26±2* | 26±1* | 29±4 | 23±2 | 20±6 | |
* - достоверные отличия от К, p<0,05, $ - достоверные отличия от В, p<0,05.
К-контроль, В-вывешивание, ВЛ - вывешивание с введением L-аргинина,
ВН - вывешивание с введением L-NAME, РН - вывешивание с растяжением m.soleus и введением L-NAME, Р - вывешивание с растяжением.
Вес крыс во всех группах не отличался от уровня контроля. Вес m.soleus был снижен в группах В и ВН (на 46 и 45%, p<0,05, соответственно) относительно группы контроля. В то же время у группы ВЛ вес мышцы был на 21% выше, чем в группе В (p<0,05). У крыс, вывешенных с растяжением m.soleus (гр. Р, РН), вес мышцы не отличался от гр.К (табл.1). Аналогичные результаты получены для ППС МВI и МВII. В группе В она была снижена на 45% и 28% соответственно (p<0,05), а в группе ВН на 40% и 25% по сравнению с гр.К (p<0,05, табл.1). ППС МВI и МВII волокон в группе ВЛ была существенно выше, чем в группе В на 25% и 16% (p<0,05) соответственно. Атрофия МВII волокон в гр. ВЛ была предотвращена полностью, т.к. их ППС существенно не отличалась от группы К (табл.1). ППС МВ во всех группах, вывешенных с растяжением m.soleus, не отличалась от гр.К. При вывешивании животных (группа В) доля мышечных волокон, содержащих миозин как «медленного», так и «быстрого» типа достоверно снижалась.
При введении L-аргинина на фоне вывешивания (группа ВЛ) не происходит снижение мышечных волокон «медленного» типа. В группах, где применяли растяжение (Р, РН) отличий от контрольной группы по соотношению волокон не обнаружено (табл.1).
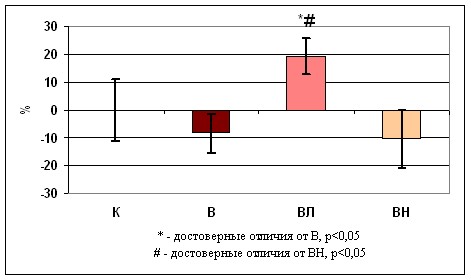
Рис. 1. Содержание -актина в различных экспериментальных группах.
В группе с введением L-аргинина содержание -актина не отличалось от уровня контроля, но было на 28% выше, чем в группе вывешивания (p<0,05) (В) (рис. 1).
Процентное содержание волокон с поврежденным дистрофиновым слоем и процентное отношение длины разрывов в дистрофиновом слое в группе В было в 4 раза выше, чем в группе К (р< 0,05). В группе ВЛ разрушения в дистрофиновом слое были существенно меньше, чем в гр. В (табл.2). В группе Р разрушения в дистрофиновом слое были на том же уровне, что и в группе К. Блокирование NO синтазы (группа РН) привело к тому, что разрушения в дистрофиновом слое стали достоверно выше, чем в группе Р (табл.2).
Таблица 2
Процентное содержание волокон с повреждённым дистрофиновым слоем (А) и поцентное отношение длины разрыва дистрофинового слоя ко всему периметру волокна (Б)
| Значение/группа | К | В | ВН | ВЛ | РН | Р |
| А. | 9±2 | 39±5* | 31±6* | 14±6# | 26±4*$ | 10±5# |
| Б. | 4±1 | 21±6* | 15±1* | 10±1* | 8±1*$ | 4±1# |
* - достоверные отличия от К, p<0,05; # - достоверные отличия от В, p<0,05 ; $ - достоверные отличия от Р, p<0,05.
Количество миосателлитов было снижено на 29% в группе В и на 31% в гр.ВН, по сравнению с гр.К (p<0,05) (табл.3). В гр. ВЛ эта величина остается на уровне контроля. У животных гр. Р количество миосателлитов превышало контрольную группу на 68% (p<0.05). В группе РН количество миосателлитов не увеличивалось и оставалось на уровне контрольной группы (табл.3).
Таблица 3
Количество миосателлитов, меченных с помощью маркера сателлитов М-кадгерина (А)
| Значение/группа | К | В | ВН | ВЛ |
| А. | 2.11±0.14 | 1.51±0.07* | 1.61±0.04* | 2.03±0.1$# |
* - достоверные отличия от К, p<0,05, $ - достоверные отличия от В, p<0,05, # - достоверные отличия от ВН, p<0,05.
Количество ядер, меченных DAPI, было существенно снижено в группах В и ВН по сравнению с группой контроля (табл.4). Двухнедельное вывешивание с введением L-аргинина полностью предотвращает уменьшение количества ядер и сохраняет эту величину на уровне контроля.
Таблица 4
Число миоядер, приходящихся на поперечный срез мышечного волокна m. soleus крысы (А)
| Значение/группа | К | В | ВЛ | ВН | Р | РН |
| А. | 0,35±0,02 | 0,25±0,01* | 0,35±0,01$# | 0,24±0,02* | 0,59±0,06* | 0,46±0,06 |
* - достоверные отличия от К, p<0,05, $ - достоверные отличия от В, p<0,05, # - достоверные отличия от ВН, p<0,05.
При двухнедельном растяжении (Р) m.soleus на фоне вывешивания и растяжении с введением L-NAME (РН) количество ядер с включенным BrDU увеличилось на 91% и 31% соответственно (p<0,05) по сравнению с контрольной группой. Однако, количество ядер с BrDU в группе с растяжением мышцы и блокированием NO-синтазы (РН) было существенно меньше (p<0,05), чем в группе Р (табл.5).
Таблица 5
Число ядер с включенным BrdU в m. soleus крыс, приходящихся на одно мышечное волокно
| Значение/группа | К | В | РН | Р |
| А. | 1,571±0,108 | 1,874±0,186 | 2,061±0,121*# | 3,005±0,309*$ |
* - достоверные отличия от К, p<0,05, $ - достоверные отличия от В, p<0,05, # - достоверные отличия от Р, p<0,05.
Согласно нашим данным, функциональная разгрузка мышц сопровождается снижением количества ядер в мышечных волокнах и количества миосателлитов. Аналогичные данные были получены Ingalls C.P. и соавторами [Ingalls C.P.1999]. Нами было обнаружено после 2-х недельного вывешивания у крыс групп В и ВН снижение концентрации NO в m.soleus. Снижение концентрации NO способно повысить степень адгезии м-кадгерина в комплексе мышечное волокно-ламина [Anderson J.E.,2000], что уменьшает способность миосателлитов к пролиферации. Некоторые авторы полагают, что атрофия мышц может быть связана со снижением количества в них миосателлитов и миоядер [Ingalls C.P., 2003]. В таком случае все эти процессы могут быть предотвращены при увеличении в мышце концентрации NO во время разгрузки. Действительно, атрофия m.soleus при введении L-аргинина (группа ВЛ) была ниже, чем у животных группы В, в то время, как количество миоядер и миосателлитов у них оставалось на уровне контроля, как и концентрация NO. Известно, что повышение концентрации NO способно активировать фактор роста гепатоцитов, который взаимодействует с c-met рецептором миосателлитов, имеющим отношение к их пролиферации [Anderson J.Е., 2004]. Можно предположить, что увеличение концентрации NO при функциональной разгрузке мышц могло активировать миосателлиты, что предотвратило снижение количества миоядер. Нельзя исключать, что активация миосателлитов могла привести и к снижению степени атрофии m.soleus. В то же время имеются сообщения и о том, что NO способен активировать синтез некоторых цитоскелетных белков (талина и винкулина), а также ингибировать активность -кальпаинов мышц, что может также предотвращать их атрофию [Tidball J.G., 1999].
В ходе нашего эксперимента мы обнаружили, что в группе вывешенных животных (В) произошли значительные разрушения дистрофинового слоя. Разрушение дистрофина при вывешивании ранее было показано [Сhockalingam et al. 2002, Сhopard et al, 2001]. Chopard и соавторы на более длительных сроках (3 и 6 недель вывешивания крыс) показали, что содержание дистрофина на данных сроках воздействия было достоверно снижено на 20% и 30 % (p<0,05) соответственно по сравнению с контрольной группой. Нами было показано, что при введении L-аргинина (ВЛ) потеря дистрофина в мышцах у вывешенных животных была частично предотвращена. Также нами было обнаружено, что концентрация -актина в вывешенной группе (В) не отличалась от уровня контроля. Аналогичные результаты были получены в эксперименте Chopard и соавт. Ими было показано, что содержание -актина на более длительных сроках (3-е недельного вывешивания крыс) не изменилось, как и в нашем исследовании при 2-х недельное вывешивании крыс (В) и только после 6-ти недельного вывешивания снизилось на 17% по сравнению с контрольной группой. При введении донора NO L-аргинина (ВЛ) содержание -актина было достоверно выше (на 28%), чем в группе вывешенных животных (В). Итак, мы видим, что введение донора NO L-аргинина частично предотвращает развитие атрофии мышц и разрушение цитоскелетных белков.
К тому же NO способен усиливать кровоток и, как следствие, увеличивать метаболическую активность [Fryburg D.A., 1996], что могло бы влиять на степень атрофии мышечных волокон при вывешивании. Однако ранее было показано, что введение вазодилататора при 2х-недельном вывешивании не предотвращало развитие этого процесса в m.soleus [Aboudrar S., 1992]. Можно заключить, что введение L-аргинина при вывешивании снижает степень атрофии мышцы и поддерживает уровень миоядер и миосателлитов в пределах нормы.
У крыс, вывешенных с иммобилизацией конечности и растяжением m.soleus (Р), развитие атрофии было предотвращено. Этот результат согласуется с предыдущими исследованиями [Таракина М.В., 2008]. Механизм поддержания мышечной массы остаётся неизвестным. Ряд авторов показали, что при растяжении мышцы активируется работа nNOS, что приводит к увеличению в ней концентрации NO [Koh T.J., 1999]. Tidball and Koh в работе с культурой мышечных клеток обнаружили, что NO вовлечён в продуцирование гипертрофии скелетной мышцы снижением белковой деградации и увеличением белкового синтеза [Koh T.J., 1999]. Мы предположили, что NO при растяжении активирует и миосателлиты, которые могут участвовать в поддержании мышечной массы. Действительно, в группе Р количество миосателлитов, приходящихся на мышечное волокно, было существенно выше, чем в группе контроля, как и число делящихся ядер. В наших экспериментах в группе с введением L-NAME при вывешивании (РН), количество миосателлитов не отличалось от группы контроля, а количество миоядер было существенно ниже, чем в группе Р. Это свидетельствует о том, что блокирование NO препятствует новообразованию миосателлитов и делению миоядер. В этой группе атрофии m.soleus также не наблюдалось, как и в группе Р. Можно заключить, что 1. иммобилизация мышцы в растянутом состоянии препятствует развитию атрофических изменений, сдвигу паттерна ТЦМ и приводит к увеличению числа миоядер и миосателлитов в волокнах камбаловидной мышцы крысы после 14-суточного антиортостатического вывешивания; 2. введение L-аргинина как донора оксида азота предотвращает снижение ППС и поддерживает уровень миоядер и миосателлитов в волокнах камбаловидной мышцы крыс после 14-суточной функциональной разгрузки; 3. введение L-NAME в качестве блокатора NO - синтазы на фоне растяжения мышцы не влияет на поддержание миозинового фенотипа и размеров мышечных волокон, приводя, тем не менее, к снижению количества миосателлитов.
2. Эксперимент 7-суточная «сухая» иммерсия
Цель настоящего эксперимента - исследование влияния опорной разгрузки на механизмы реализации опорных сигналов, а также испытание эффективности применения механо - и электромиостимуляции в профилактике неблагоприятного воздействия безопорности на двигательную систему. Кроме того, целью данного исследования было установить, является ли 1) стимулирование опорных проприоцепторов во время иммерсии основным фактором, способным предотвратить запуск атрофических процессов в мышцах-экстензорах голени, 2) можно ли с помощью электростимуляции мышц голени во время иммерсии предотвратить их атрофию.
Исследования проводили с участием здоровых добровольцев-мужчин в возрасте 20-30 лет (9 человек) последовательно с одновременным тестированием одного человека.
Характеристика испытуемых в группах представлена в таблице № 6.
Таблица 6
Характеристика испытуемых по группам
| Группа/№ исп. | А/Д, мм рт. ст. | Пульс, уд./мин | Вес, кг |
| «Чистая иммерсия» | |||
| 1 | 115/72 | 66 | 65 |
| 2 | 118/75 | 69 | 69 |
| 3 | 115/72 | 70 | 64 |
| «Компенсатор опорной разгрузки» | |||
| 4 | 110/67 | 60 | 76 |
| 5 | 125/86 | 70 | 67 |
| 6 | 115/76 | 68 | 79 |
| 7 | 118/75 | 69 | 80 |
| «Элетромиостимуляция» | |||
| 8 | 111/73 | 57 | 87 |
| 9 | 120/81 | 69 | 66 |
Испытуемые в течение 7 суток находились в иммерсионной ванне; перед воздействием в течение 7 суток и после него в течение 7 суток осуществлялись экспериментальные исследования и медицинский контроль. Испытуемые в течение 7 суток находился в условиях «чистой» иммерсии. Все испытуемые были предупреждены об условиях эксперимента и дали письменное информированное согласие на участие в нем в соответствии с Хельсинской Декларацией и нормами российского и международного права. Эксперимент был одобрен Физиологической секцией Российской Национальной комиссии по биологической этике.
Испытуемые были разделены на 3 группы:
1) «Чистая иммерсия» – группа, находящаяся в условиях «чистой» иммерсии. Метод чистой иммерсии заключается в погружении испытуемого в термостатируемую ванну с водой. Температура водной среды поддерживалась постоянной на уровне 330С. При этом испытуемый отделен от воды водонепроницаемой тонкой тканью, площадь которой существенно превышает площадь зеркала воды. Помещенный в ванну человек, таким образом, оказывается свободно «вывешенным» в толще воды. Давление воды на различные части его тела уравновешено, что создает близкие к безопорности условия. 2) «КОР» – иммерсионного воздействия вместе с применением компенсатора опорной разгрузки (КОР). Применение механической стимуляции опорных зон стоп не сопровождалось риском для испытуемых. Нагнетаемое давление в 35 кПа не сопровождалось дискомфортными ощущениями. Стимуляция опорных зон производится во время пребывания испытуемого в иммерсионной ванне. При этом пневмокамеры наполнялись воздухом через пластиковые воздуховоды посредством компрессора, находящегося за пределами иммерсионной ванны, что исключало возможность электротравмы. 3) «Электростимуляция» – иммерсионного воздействия с применением высокочастотной электромиостимуляции. Для стимуляции использовался макет высокочастотного электромиостимулятора, разработанный ФГУ ВНИИФК. Тренировочная программа состояла из изотонических сокращений четырехглавой мышцы бедра (ЧБМ), трехглавой мышцы голени (ТМГ) и передней большеберцовой мышцы (ПБМ) в ответ на прямое электрическое раздражение. Макет стимулятора представлял собой источник переменного синусоидального тока звуковой (несущей) частоты 2000 Гц, прерываемого прямоугольными импульсами с частотой 50 Гц (полная амплитуда модуляции) и длительностью 10 с. Стимуляционная тренировка ЧБМ, ТМГ и ПБМ проводилась на двух конечностях испытуемого способом прямого биполярного электрического раздражения мышц по методике Коц и Хвилон (1971), но в изотоническом режиме сокращения мышц в положении лежа. Угол в коленном суставе составлял 180°, в голеностопном – порядка 130°. Физиотерапевтические токопроводящие прямоугольные электроды (40100 мм – для ПБМ; 45200 мм и 40160 мм – для ЧМБ и 40160 мм и 40100 мм – для ТМГ) располагались по всей ширине стимулируемой мышцы. Во время тренировки сила электрического раздражения подбиралась индивидуально – до порога переносимости. Тренировочная процедура состояла из 10 повторных стимуляций, каждая в режиме 10 секундной стимуляции и 50 секундного отдыха. Стимуляционная тренировка продолжалась 6 дней, на протяжении которых ежедневно 5 дней подряд (от понедельника до пятницы включительно) проводились стимуляционные процедуры. Затем следовал один день отдыха (суббота).
До 7-суточной иммерсии и через 4-6 часов после ее окончания забирали пробы мышечной ткани из m. soleus методом пункционной биопсии по Бергстрему. Для проведения этой процедуры проводили внутрикожную инъекцию 2% раствора лидокаина (с предварительной пробой на переносимость). После этого проводили прокол кожи 0,5 см одноразовыми стерильными хирургическими лезвиями и взятие пробы ткани с помощью биопсийной иглы (с помощью пневматического подсоса).
Методика проведения «чистой» иммерсии и все медицинские процедуры были одобрены комиссией по биомедицинской этике ГНЦ РФ Института медико-биологических проблем Российской Академии Наук. Определяли площадь поперечного сечения мышечных волокон и соотношение быстрых и медленных изоформ ТЦМ.
Данные ППС волокон «медленного» и «быстрого» типа представлены на рисунках 2 (а, б).

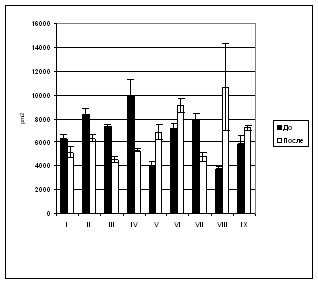
Рис. 2. Площадь поперечного сечения «медленных» (а) и «быстрых» (б) волокон m.soleus испытуемых.
В группе «иммерсия» площадь поперечного сечения как «медленных», так и «быстрых» мышечных волокон снизилась в результате воздействия, в тоже время у «медленных» волокон это была тенденция к снижению, а у «быстрых» мышечных волокон это снижение было достоверным. В группе профилактики (с применением стимулятора опоры стопы) у части испытуемых площадь поперечного сечения волокон снижалась, как и в группе «иммерсия» без профилактики, в то время как у других испытуемых профилактика полностью предотвращала развитие атрофии, и даже несколько превышала уровень, который наблюдался до иммерсии. В группе, где применялась электростимуляция во время иммерсии, размеры как «медленных», так и «быстрых» мышечных волокон у испытуемых были выше, чем до иммерсии (рис. 2 а, б). Однако из-за маленькой выборки мы не обнаружили достоверности.
Соотношение мышечных волокон во время иммерсии ни в одной из групп не менялось (рис. 3 а, б).


Рис. 3. Процент «медленных» (а) и «быстрых» (б) мышечных волокон m.soleus испытуемых.
Пребывание в условиях реальной или моделируемой микрогравитации приводит к значительным изменениям структуры и функции скелетных мышц млекопитающих. В нашем эксперименте было обнаружено, что в группе «Иммерсия» снизилась в результате воздействия ППС как «медленных», так и «быстрых» мышечных волокон. Ранее показано, что за трое суток сухой иммерсии ППС волокон m.vastus lateralis как медленного, так и быстрого типов составило 5-9%, а к семи суткам воздействия - 15-18% [Шенкман Б.С., 1999]. Одним из феноменов, сопровождающих кратковременное пребывание в условиях гравитационной разгрузки (иммерсия, космический полет), является дегидрадация [Григорьев А.И.,1978], очевидно, затрагивающая как объем циркулирующей плазмы и внеклеточную воду, так и внутриклеточную воду [Лобачик В.И., 1998]. Таким образом, можно предположить, что редукция ППС мышечных волокон может быть обусловлена, как уменьшением объема белкового, так и небелкового (главным образом водного) компонентов.
Результаты нашего исследования показывают, что в группе профилактики (с применением стимулятора опоры стопы) у части испытуемых ППС МВ снижалась, как и в группе «иммерсия» без профилактики, в то время, как у других испытуемых профилактика полностью предотвращала развитие атрофии, и даже несколько превышала уровень, который наблюдался до иммерсии.
Нами вперые исследовалось применение электростимуляции во время иммерсии. Было обнаружено, что в группе, где применялась электростимуляция во время иммерсии, размеры как «медленных», так и «быстрых» мышечных волокон у испытуемых были выше, чем до иммерсии.
Наши данные согласуются с данными в экспериментах Немировской и соавт. (2002). Ими было показано, что применение опорной стимуляции стопы предотвращало трансформацию «медленных» волокон в быструю сторону при вывешивании крыс. Эти данные были подтверждены в экспериментах De Doncker с соавторами (2001) с вибростимуляцией опорных зон стопы у вывешенных крыс. В нашем исследовании ни в одной из групп («чистая иммерсия», «КОР», «Электромиостимуляция») достоверных изменений соотношения мышечных волокон не обнаружено.
На основании полученных нами данных можно сделать вывод, что стимуляция сократительной активности (как методом электростимуляции, так и с использованием компенсатора опорной разгрузки) способствует предотвращению атрофии и изменения изоформ ТЦМ в волокнах камбаловидной мышцы человека в условиях 7-суточной «сухой» иммерсии.
3. Организация космического эксперимента на борту биоспутника
ФОТОН-М3
Проведение космического полета монгольских песчанок
Для проведения летных экспериментов на монгольских песчанках был создан модуль «КОНТУР» малого объема с автономной системой жизнеобеспечения. Через клетку в направлении «верх-низ» был организован постоянный ламинарный поток газовой среды с линейной скоростью 0,3 м/с. Животные в полете содержались в клетке с габаритами ВхШхГ=125х255х370 мм. Клетка была выполнена из сетки нержавеющей стали с ячейкой 8х8 мм. В полете животные получали брикетированный корм. Полетная (опытная) группа животных составили 12 самцов монгольских песчанок. Животные были загружены в модуль за 2 суток до старта после чего была задействована система газообеспечения модуля.
После приземления биоспутника животные были перевезены в ГНЦ РФ – ИМБП РАН в летной клетке в специальном контейнере на самолете и осмотрены.
Проведение наземного (синхронного) эксперимента
Наземный (синхронный) эксперимент проводился в ГНЦ РФ – ИМБП РАН. Контрольная группа животных составила 11 самцов монгольских песчанок массой 60,1 г.
За 2 суток до начала эксперимента животных разместили в клетке в гермокамере макета НА «Контур». Была задействована система газообеспечения.
Параметры работы стенда поддерживались в соответствии с данными телеметрии.
К концу эксперимента вес животных уменьшился – 55,3.
Все процедуры с животными были одобрены комиссией по биомедицинской этике ГНЦ РФ - ИМБП РАН.
Экспериментальные группы:
Группа «Полет» - в течение 12 суток подвергалась действию невесомости на борту спутника; Группа «Синхронный контроль» - содержалась в аналогичных условиях за исключением действия гравитационной разгрузки. Через сутки после приземления проводили забор материала (m.soleus) указанным выше способом. Забой осуществлялся с помощью декапитации. В ходе эксперимента иммуногистохимически выявляли тяжелые цепи миозина для определения соотношения быстрых и медленных изоформ и для определения ППС МВ.
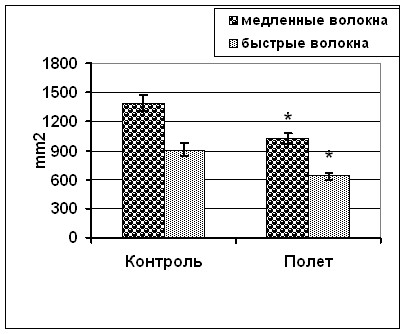

Рис. 4. ППС волокон «медленного» и «быстрого» типа m.soleus песчанок (а) и процентное содержание волокон «медленного» и «быстрого» типа m.soleus песчанок (б).
*- достоверно отличается от контроля, р<0,05.
ППС волокон «медленного» и «быстрого» типа m. soleus песчанок в полетной группе была снижена на 26% и 30% (p<0,05) соответственно по сравнению с контрольной группой (рис. 4а).
Достоверных различий в количестве волокон, содержащих миозин «медленного» типа, в полетной и контрольной группах не наблюдается. Однако, число волокон, содержащих миозин «быстрого» типа после полета было выше (на 9%, р<0,05), чем в группе синхронного контроля. При этом 6% волокон в полетной группе содержали оба типа миозинов (рис. 4б).
Песчанка (Meriones unguiculatus) как лабораторный объект давно использовалась для изучения особенностей адаптационных механизмов водного, солевого, белкового и энергетического обмена, развившихся у данного вида в условиях зоны его обитания (ареал вида относительно компактен и целиком укладывается в пределы зоны северных пустынь и сухих степей Восточной Азии. Особое внимание привлекали механизмы адаптации этого вида грызунов к водной депривации, временами – длительной. Было выявлено, что почки этого грызуна обладают очень высокой концентрационной способностью, за счет особенностей строения нефрона. Также было показано, что при водной депривации зверьки пропорционально теряют объемы плазмы, вне- и внутриклеточной жидкости. Механизм преимущественного сохранения объема циркулирующей крови у них не развит [Edwards BA., 1991]. Композиция тела при водной депривации изменяется вследствие потери жировой массы тела (возможно, его распад восполняет часть недостатка жидкости тела за счет метаболической воды). Под действием стресса или введения 1-24 АКТГ надпочечники песчанки секретируют глюкокортикоиды, но не альдостерон. Это свидетельствует о том, что для активации секреции альдостерона более важно повышение температуры.
Ichimura E. с соавторами (1991) показали, что в период более чем 3-хнедельной водной депривации у монгольской песчанки характерным образом изменялись вес тела и осмолярность плазмы. Морфометрический анализ позволил выявить, что динамика снижения объема воды тела и роста осмолярности плазмы соответствовали признакам активации синтетической деятельности клеток-продуцентов ренина и вазопрессина [Ichimura E, et al., 1992].
Отмечено, что у пустынных грызунов роль кишечника в регуляции осмотического гомеостаза особенно. Во время длительной (свыше 25 дней) водной депривации активность абсорбции натрия и калия в кишечнике возрастают многократно, восполняя почечные потери электролитов. Было выявлено, что в механизме устойчивости к дегидратационному стрессу принимают участие гормоны щитовидной железы.
Ранее было показано, что после космических полетов и в наземных моделях невесомости у мышей и крыс наблюдались значительные изменения в миозиновом фенотипе и размерах мышечных волокон [Adams G.R., 2003]. Ряд авторов показали, что после 14-ти дневного космического полета [Allen D.L., 1996], а также антиортостатического вывешивания крыс [Caiozzo V.J., 2007] значительно уменьшается процентное соотношение волокон «медленного» типа ТЦМ и увеличивался процент волокон «быстрого» типа ТЦМ, при этом ППС МВ при данных воздействиях уменьшается почти в два раза. В нашем эксперименте на песчанках в полетной группе, мы обнаружили, что процентное отношение волокон «медленного» типа не изменилось, а процент волокон «быстрого» типа увеличилось незначительно (на 9%) по сравнению с контрольной группой, тогда как у крыс доля волокон, содержащих миозин «медленного» и «быстрого» типа после космического полета изменяется в среднем на 20 % [Stevens L., 1993].
ППС МВ «медленного» и «быстрого» типа уменьшилось на 26% и 30% соответственно, а не в два раза, как, например, у крыс или мышей [Adams G.R., 2003]. Можно предположить, что ППС МВ песчанок во время космического полета могла снизиться в меньшую сторону из-за большей гидратации мышечных волокон, связанную с изменением водно-солевого обмена.
Можно заключить, что снижение ППС примерно на 26-30% и отсутствие изменений изоформного состава ТЦМ волокон камбаловидной мышцы монгольских песчанок после 12-суточного космического полета свидетельствует о меньшей выраженности последствий функциональной разгрузки по сравнению с таковыми у крыс в полетах аналогичной длительности.
4. Эксперимент «Реадаптация в условиях гипоксического воздействия»
В задачу настоящего исследования входила попытка использования нормобарической гипоксии в интервальном режиме для увеличения интенсивности восстановительных процессов в m. soleus крысы в начальном периоде реадаптации после гипокинезии. Для этого эксперимента была разработана и испытана 7-суточная реадаптация после 14-суточного гипокинетического воздействия (антиортостатическое вывешивание задних конечностей). В течение всего эксперимента животные получали стандартный корм для грызунов и воду ad libitum. В эксперименте использовали 28 самцов крыс Wistar (по 7 животных в каждой из 4 экспериментальных групп) массой 220-250 грамм. Экспериментальные группы: 1 группа – Группа «Контрольные животные (К)», содержавшиеся в виварии; 2 группа – Группа «Вывешивание без восстановления» (В); 3 группа – Группа «Вывешивание с последующим восстановлением в течение 7 дней в стандартных условиях вивария – ВН 7»; 4 группа – Группа «Вывешивание с последующим 7-суточным восстановлением в условиях интервальной нормобарической гипоксии - (ВГ 7)».
Для создания гипоксических условий животных помещали в специальную камеру с регулируемой подачей кислорода. Схема адаптации к гипоксии: 1 день животные помещались в камеру, куда подавался воздух со сниженной концентрацией кислорода (12% О2) по 15 минут с 7 минутными перерывами на нормоксию в течение 2 часов. 2 день – общее время содержания животных в камере увеличивалось до 3 часов, концентрация кислорода и режим подачи газовой смеси был таким же, как и в 1 день. С 3-го дня животным ежедневно подавался воздух с концентрацией О2 10% по 15 минут с 7-минутными перерывами на нормоксию в течение 3 часов. Для морфологического исследования брали камбаловидную мышцу и определяли площадь поперечного сечения мышечных волокон и соотношение быстрых и медленных изоформ ТЦМ.
Результаты изменения массы крыс при различных условиях восстановления представлены в таблице 7.
Таблица 7
Изменение массы тела крыс при вывешивании животных и при восстановлении в течение 7 суток в нормальных и гипоксических условиях
| Параметр | К | В | ВГ 7 | ВН 7 |
| Масса тела, г | 247,71+8,46 | 245,0+20,85 | 244,00+7,76 | 230,2+8,4 |
К-контроль, В-вывешивание, ВН 7- вывешивание с последующим восстановлением в течение 7 дней в стандартных условиях вивария, ВГ 7 - вывешивание с последующим 7-суточным восстановлением в условиях интервальной нормобарической гипоксии.
Масса крыс в группе ВН 7 была несколько ниже, по сравнению с группой В. Достоверных отличий между группами ВГ 7 и К нет (табл.7).
Таблица 8
Изменение сырой и сухой массы камбаловидной мышцы при вывешивании животных и при восстановлении в течение 7 суток в нормальных и гипоксических условиях
| Параметр | Контроль (К) | Вывешивание (В) | Вывешивание+ восстановление в норме 7 суток (ВН 7) | Вывешивание + восстановление в гипоксии 7 суток (ВГ 7) |
| Масса m.soleus, мг | 104,18+2,51 | 62,0+3,99* | 91,13+4,02*# | 124,00+7,90*# |
| Сухой вес m.soleus, мг | 30,53+1,90 | 15,26+1,10* | 21,30+2,23*# | 31,50+3,81# |
# - достоверные отличия от В, р<0,01,* - достоверные отличия от К, р<0,01.
Данные проведенного исследования позволяют с уверенностью говорить о существенном (почти на 40%) снижении веса камбаловидной мышцы крыс в группе В по сравнению с контрольной группой животных. Восстановление животных в нормальных условиях вивария в течение 7 суток (ВН 7) привело к значительному повышению массы мышцы (на 27,14 мг). Семь суток гипоксического воздействия в период восстановления после вывешивания (ВГ 7) приводит к увеличению массы m. soleus (табл.8).
Важно отметить, что при вывешивании, параллельно со снижением массы сырой камбаловидной мышцы, наблюдается уменьшение сухого веса мышцы (табл.8). Следовательно, потеря массы мышцы не может быть обусловлена только потерей воды. Т.е. при разгрузке в течение 14 суток происходит значительное снижение количества белка, что не может не отразиться на функциональной способности мышцы. Следует отметить, что гипоксическое воздействие позволяет увеличить массу высушенной мышцы (табл.8).

Рис. 5. Изменение площади поперечного сечения «быстрых» и «медленных» волокон m.soleus крыс.
При определении площади поперечного сечения (ППС) волокон было обнаружено, что ППС «медленных» и «быстрых» мышечных волокон у крыс после 2-х недель вывешивания достоверно уменьшилась по сравнению с контрольной группой (Р<0,05). ППС волокон m.soleus в группе восстановления в условиях гипоксии и в условиях нормоксии по отношению к контролю достоверно изменилась, а ППС «быстрых» волокон по отношению к контролю не изменилась. По сравнению с группой вывешивания наблюдаются достоверные изменения площади поперечного сечения «быстрых» волокон в группах восстановления в условиях нормоксии и гипоксии. Достоверных изменений ППС «медленных» волокон между этими группами нет (рис. 5).

Рис. 6. Распределение типов волокон m.soleus крыс.
Количество волокон, содержащих тяжелые цепи миозинов медленного типа, достоверно снизилось по отношению к контролю в группе 2-х недельного вывешивания. В результате недельного восстановления, последовавшего после вывешивания, в условиях гипоксии и нормоксии количество волокон, содержащих «медленные» миозины, не достигло контрольного уровня, однако, при восстановление в норме количество «медленных» волокон достоверно увеличилось в 1,1 раза по сравнению с группой В. За 7 суток восстановления в гипоксии количество гибридных волокон увеличивается по сравнению со всеми другими экспериментальными группами (рис. 6).
Изменения скелетных мышц, наблюдаемые в условиях гипокинезии на модели антиортостатического вывешивания в нашем эксперименте в целом соответствуют известным по литературным данным. Так, наблюдается атрофия (уменьшение сырого и сухого веса мышцы, площади поперечного сечения мышечных волокон), изменение распределения типов мышечных волокон в сторону преобладания волокон с быстрыми изоформами тяжелых цепей миозина [Шенкман Б.С, 2002]. На фоне раннего периода реадаптации (в течение первой недели после экспозиции в условиях гипокинезии) были выявлены феномены, напоминавшие ранее известные из литературы [Литвинова К.С., 2007]. За неделю было обнаружено почти полное восстановление сырого веса и размеров мышечных волокон. Примерно на 50% восстановился сухой (белковый) вес мышцы. Понятно, что полное восстановление сырого веса обеспечивалось, главным образом, регидратацией мышцы, обезвоженной в условиях гипокинезии. Ранее отмечалось различное по динамике восстановление сухой массы и водного компонента мышц [Литвинова К.С., 2007]. За неделю после гипокинезии не удалось наблюдать полного восстановления миозинового профиля мышцы, уменьшенного в условиях гипокинезии. Экспериментальные испытания действия интервальной гипоксии на восстановительные процессы в постуральной мышце в ранний период реадаптации после гипокинезии показали, что на фоне почти 50% восстановления как сырой, так и сухой массы m. soleus у животных, подвергнутых гипоксическому воздействию, наблюдалось более интенсивное восстановление этих параметров. Более того, средние значения сухой массы мышцы после гипоксического воздействия оказались больше значений интактного виварного контроля. Такая интенсивность восстановления вполне сравнима с данными, полученными при воздействии теплового стресса [Goto K., 2004]. То, что при действии гипоксии наблюдалось более интенсивное восстановление не только сырой массы мышцы и площади поперечного сечения волокон на замороженных срезах, но и сухой массы, свидетельствует о том, что гипоксия приводит к реальному восстановлению белкового содержимого волокна, а не стимулирует регидратацию мышцы [Литвинова К.С., 2007]. Мало того, отсутствие существенных различий по сырой массе m. soleus между группами животных, подвергнутых гипоксии и восстанавливавшихся в нормоксических условиях, свидетельствует о том, что гипоксическое воздействие даже несколько снижало интенсивность регидратации мышцы.
Таким образом, использование гипоксического воздействия в начальном периоде реадапатации после 14-суточной функциональной разгрузки у крыс приводит к более раннему восстановлению сухой массы камбаловидной мышцы по сравнению с восстановлением в условиях нормоксии.
ВЫВОДЫ
- Введение L-аргинина в качестве донора оксида азота после 14-суточной функциональной разгрузки снижает степень атрофии m.soleus и поддерживает уровень миоядер и миосателлитов в волокнах камбаловидной мышцы крыс, что указывает на NO-зависимость этих процессов.
- Введение L-NAME в качестве блокатора NO-синтазы на фоне растяжения мышцы не оказывает влияния на размер мышечных волокон и миозиновый фенотип.
- Стимуляция сократительной активности (методами электростимуляции и с использованием компенсатора опорной разгрузки) в волокнах камбаловидной мышцы человека в условиях 7-суточной «сухой» иммерсии способствует предотвращению атрофии мышечных волокон и изменению изоформ тяжелых цепей миозина.
- После 12-суточного космического полета в волокнах камбаловидной мышцы монгольских песчанок (в отличие от крыс) снижается на 26-30% площадь поперечного сечения, а также отсутствуют изменения изоформного состава тяжелых цепей миозина, что может свидетельствовать о меньшей выраженности последствий функциональной разгрузки.
- Использование гипоксического воздействия в начальном периоде реадапатации приводит у крыс к более раннему восстановлению сухой массы камбаловидной мышцы, по сравнению с восстановлением в условиях нормоксии.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Липец Е.Н., Пономарева Е.В., Огнева И.В., Вихлянцев И.М., Карадулева Е.В., Карташкина Н.Л., Кузнецов С.Л., Подлубная З.А., Шенкман Б.С «Сократительные характеристики волокон и цитоскелетные белки мышц задних конечностей песчанок после космического полета»// Авиакосмическая и экологическая медицина, 2009, Т.43, №3, С. 34-39.
- Lomonosova Y., Kartashkina N., Bugrova A., Kalamkarov G., Nemirovskaya T. «Effect of NO on desmin degradation of unweighted m.soleus in rats.»// 38th Eur. Muscle Conf. Abstract. Lille, France. – 2009. – P.28.
- Lomonosova Y., Kartashkina N., Bugrova A., Kalamkarov G., Nemirovskaya T. «Role NO in prevention of cytoskeletal proteins degradation under various level of muscle’s contractile activity»// 38th Eur. Muscle Conf. Abstract. Lille, France. – 2009. – P.29.
- Lomonosova Yu.N., Kartashkina N.L., Shevchenko T.F, Bugrova A.E, Kalamkarov G.R, Nemirovskaya T.L «Prevention of muscle fibers atrophy during gravitational unloading: the effect of L-arginine administration»// 17th IAA Human in Space Symposium. Abstract. Moscow, Russia. – 2009. – P. 81.
- Карташкина Н.Л., Ломоносова Ю.Н., Бугрова А.Е., Аболтин П.В. «Предотвращение атрофии мышечных волокон при гравитационной разгрузке: эффекты введения L-аргинина»// Тезисы VIII Конференции молодых ученых, специалистов и студентов, посвященной дню космонавтики. – Москва, Россия. – 2009. – С. 22-23.
- Y. Lomonosova, N. Kartashkina, A.Е. Bugrova, G.R. Kalamkarov, T.L. Nemirovskaya «Prevention of muscle fibers atrophy during gravitational unloading: the effect of L-arginine administration»// 14th International conference biochemistry of exercise. Abstract. Canada – 2009. – P.74.
- Y. Lomonosova, N. Kartashkina, A.E. Bugrova, G.R. Kalamkarov, T.L. Nemirovskaya «Prevention of muscle fibers atrophy during gravitational unloading: the effect of L-arginine administration»// 30th Annual International gravitational physiology meeting Abstract. Xian, China. – 2009. – P.112.
- Ломоносова Ю.Н., Карташкина Н.Л., Бугрова А.Е., Аболтин П.В. «Уровень мРНК атрогена -1 при снижении функциональной активности скелетных мышц: эффекты введения L-аргинина»// Тезисы научной конференции «Ломоносов 2009», Москва, Россия. – 2009. С. 21-22.
Исследование поддержано грантом РФФИ № 08-04-01599а.

