Токсический эффект синергичного воздействия цитостатика циклофосфана и экзогенной днк
На правах рукописи
Долгова Евгения Владимировна
ТОКСИЧЕСКИЙ ЭФФЕКТ СИНЕРГИЧНОГО ВОЗДЕЙСТВИЯ ЦИТОСТАТИКА ЦИКЛОФОСФАНА И ЭКЗОГЕННОЙ ДНК
03.03.04 – клеточная биология, цитология, гистология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Новосибирск 2012
Работа выполнена в Федеральном государственном бюджетном учреждении науки Институте цитологии и генетики Сибирского отделения Российской академии наук в лаборатории молекулярной биологии клетки, г. Новосибирск.
Научный руководитель: доктор биологических наук,
Богачев Сергей Станиславович
Официальные оппоненты: Омельянчук Леонид Владимирович
доктор биологических наук,
заведующий лабораторией генетики
клеточного цикла
Федеральное государственное бюджетное
учреждение науки Институт молекулярной и
клеточной биологии СО РАН, г. Новосибирск
Елисафенко Евгений Анатольевич
кандидат биологических наук,
старший научный сотрудник лаборатории
эпигенетики развития
Федеральное государственное бюджетное
учреждение науки Институт цитологии и генетики СО РАН, г. Новосибирск
Ведущая организация: Федеральное государственное бюджетное учреждение науки Институт химической биологии и фундаментальной медицины СО РАН, г. Новосибирск
Защита диссертации состоится « » 2012 г. на утреннем заседании диссертационного совета по защите диссертаций на соискание ученой степени кандидата наук, на соискание ученой степени доктора наук (Д 003.011.01) в ИЦиГ СО РАН в конференц-зале Института по адресу:
пр. академика Лаврентьева 10, г. Новосибирск, 630090
тел/факс: (383) 363-49-06 (1321); e-mail: [email protected].
факс: (383) 333-12-78
С диссертацией можно ознакомиться в библиотеке ИЦиГ СО РАН.
Автореферат разослан « » 2012 г.
Ученый секретарь
диссертационного совета,
доктор биологических наук Т.М. Хлебодарова
ВВЕДЕНИЕ
Актуальность.
При воздействии на живой организм -радиации и химических цитостатиков в первую очередь и в наибольшей степени страдают клетки эпителия, волосяных фолликул и стволовые клетки крови (СКК).
Показано, что инъекции экзогенной фрагментированной геномной ДНК связаны с эффектами, при которых затрагивается функциональная целостность СКК. Так, в экспериментах, выполненных в работе (Likhacheva et al., 2007) отмечалось появление селезеночных колоний у смертельно облученных мышей после своевременных инъекций экзогенной ДНК. Это наблюдение свидетельствовало о том, что экзогенная ДНК при внутрибрюшинном (в/б) введении достигает клеток костного мозга (ККМ) и воздействует на CD34+ (поверхностный гликопротеин, являющийся маркером гемапоэтических прогениторных клеток) СКК таким образом, что сохраняется их жизнеспособность. Потомки выживших СКК формируют колонии в селезенке, которые способствуют восстановлению иммунной системы экспериментального животного. Таким образом, СКК (ККМ), по-видимому, являются первыми и наиболее легкодоступными клетками-мишенями, на которые как химические агенты и радиация, так и экзогенная ДНК, интродуцированная в организм, действуют в первую очередь.
Считается, что наиболее важным фактором, определяющим участие фрагментов экзогенной ДНК в репаративных процессах, является появление в ядре двуцепочечных разрывов (ДЦР) хромосом (Лихачева и др., 2008). При появлении таких повреждений активируется каскад иерархических киназ и их субстратов, что приводит к остановке клеточного цикла и запуску репарационно-рекомбинационной молекулярной машины клетки. Если в этот момент времени в ядерном пространстве присутствуют фрагменты экзогенной ДНК, то они становятся равноправными участниками репаративного процесса (Kohzaki et al., 2007; Rodrigue et al., 2006; Лихачева и др., 2008).
В настоящее время в практике лечения онкологических заболеваний совместно с кросслинкирующими цитостатиками все чаще используют лейкостимулирующие препараты на основе ДНК (деринат, дезоксинат, полидан). Однако в современной литературе отсутствуют данные о возможных эффектах, которые может оказывать экзогенная ДНК, попадая в организм в момент воздействия цитостатика. Исследуя на мышах лейкостимулирующее действие экзогенной ДНК после миелосупрессии, вызванной цитостатиком циклофосфаном (ЦФ), было обнаружено следующее явление. Инъекции экзогенной ДНК в препаративных количествах на фоне предобработки ЦФ приводят к появлению характерного симптомокомплекса (набору специфических признаков заболевания мышей) и гибели экспериментальных животных. В предлагаемой работе предпринята попытка как можно ближе подойти к пониманию механизмов, определяющих возникновение губительного для организма эффекта.
Цель и задачи работы.
Целью настоящей работы являлось изучение механизмов синергичного воздействия цитостатика циклофосфана и экзогенной ДНК на организм мышей.
В рамках цели предлагаемой работы были поставлены следующие задачи:
- Определить критический промежуток времени введения препарата ДНК после инъекции циклофосфана, который определяет появление характерного симптомокомплекса и гибель мышей, используя в качестве маркерного признака параметр «выживаемость».
- Получить экспериментальные доказательства доставки фрагментов экзогенной ДНК в клетки костного мозга мышей как при инъекциях in vivo, так и при совместном культивировании в системе ex vivo. Дать количественные и качественные характеристики доставляемой экзогенной ДНК.
- Определить динамику формирования и репарации двуцепочечных разрывов, возникающих как обязательный интермедиат при репарации межцепочечных сшивок, индуцированных цитостатиком циклофосфаном.
- Сопоставить временной промежуток введения препарата ДНК после инъекции циклофосфана, в результате чего у экспериментальных животных проявляются патологические процессы, со временем репарации двуцепочечных разрывов в клетках костного мозга мышей.
- Дать характеристику некоторым патологическим процессам, происходящим в клетках костного мозга при одновременном присутствии в ядерном пространстве двуцепочечных разрывов и фрагментов экзогенной ДНК: а) оценить количественные изменения умеренных повторов в геноме экспериментальных животных; б) определить уровень и длительность апоптоза клеток костного мозга в норме и при синергичном действии циклофосфана и препарата ДНК; в) охарактеризовать морфологические изменения хромосом, произошедшие в результате проведенных обработок; г) выявить изменения в различных популяциях клеток костного мозга, вызванные совместным действием циклофосфана и экзогенной ДНК.
- Провести патологоморфологический анализ тканей и органов животных в период развития заболевания. Дать заключение о возможных причинах гибели экспериментальных животных.
Научная новизна.
- Впервые показано, что при совместном инкубировании с экстракоропорально сгенерированными клетками костного мозга мышей, фрагменты экзогенной ДНК достигают внутреннего пространства указанного типа клеток в исходном виде без проведения процедуры трансфекции.
- Впервые описаны некоторые особенности молекулярных процессов, протекающих в клетках костного мозга, и в частности в CD34+ стволовых клетках крови, подтверждающие, что экзогенная ДНК принимает участие в процессе репарации двуцепочечных разрывов, нарушая правильный ход репарационного процесса как у мышей стандартного содержания, так и у животных с присвоенным статусом SPF (Specific Pathogen Free).
- Впервые продемонстрировано, что сочетание воздействия циклофосфана и препарата экзогенной ДНК приводит к патологическим изменениям в органах и тканях экспериментальных мышей стандартного содержания. При использовании SPF-мышей характерный симптомокомплекс не развивается.
Положения, выносимые на защиту.
Совместные инъекции цитостатика циклофосфана и экзогенной ДНК мышам стандартного содержания приводят к аберрантному митозу, гибели и разрушению функции популяции костномозговых предшественников, ответственных за развитие лимфоидного ряда кроветворения.
Практическая значимость.
Результаты проведенных исследований могут являться основанием для выбора безопасных временных параметров при использовании лейкостимулирующих препаратов на основе ДНК (деринат, дезоксинат, полидан, панаген) в терапевтической практике при лечении онкологических заболеваний с применением кросслинкирующих цитостатиков.
Апробация работы.
Результаты работы представлены в материалах Съезда генетиков и селекционеров, посвященного 200-летию со дня рождения Чарльза Дарвина и V Съезда Вавиловского общества генетиков и селекционеров (21-27 июня 2009 года, Москва); XLVIII Международной научной студенческой конференции «Студент и научно-технический прогресс» (10-14 апреля 2010 года, Новосибирск); международной конференции Annual Main Meeting of Society for experimental Biology (1-4 июля 2011 года, Глазго, Великобритания); международной конференции 7th European Course and 11th Euroconference of ISAC-ICCS-ICyS-ESCCA Joint Meeting (13-17 сентября 2011 года, Дублин, Ирландия); международной конференции A Current Opinion in Structural Biology conference (16-18 октября 2011 года, Амстердам, Нидерланды); 50-й юбилейной международной студенческой научной конференции «Студент и научно-технический прогресс» (13-19 апреля 2012 года, Новосибирск).
Публикации.
По теме диссертации опубликовано 4 работы, из которых 3 работы – в рецензируемом отечественном журнале и 1 работа – в рецензируемом зарубежном журнале.
Вклад автора.
Основные результаты были получены автором самостоятельно. Эксперименты, связанные с использованием лабораторных животных, проводились совместно с к.м.н. В.П. Николиным и к.б.н. Н.А. Поповой. Патологоанатомический анализ тканей и органов больных животных проводился совместно с к.б.н. О.С. Тарановым. Анализ мазков крови и костного мозга экспериментальных животных проводился при экспертной поддержке Т.Д. Дубатоловой.
Структура и объем работы.
Диссертация состоит из введения, четырех глав (Обзор литературы, Материалы и методы, Результаты, Обсуждение), выводов, списка литературы и двух приложений. Работа изложена на 191-й странице, содержит 86 рисунков, 4 таблицы.
МАТЕРИАЛЫ И МЕТОДЫ
Разведение экспериментальных животных
В экспериментах использовали 2-3 месячных мышей линии CBA/Lac разведения вивария №2 Института цитологии и генетики СО РАН (стандартное содержание), а также SPF-мышей этой же линии разведения SPF-вивария Института цитологии и генетики СО РАН. Животных содержали в пластиковых клетках по 5-10 особей в каждой со свободным доступом к пище и воде. Мыши получали гранулированный корм ПК120-1 (Лабораторснаб, Москва).
Препарат ДНК человека
Препарат человеческой ДНК получали из плацент здоровых рожениц, результаты анализа крови которых отрицательны на наличие ВИЧ, сифилиса, гепатитов В и С. Для выделения ДНК использовали безфенольный метод (раздел промышленного регламента производства препарата «Панаген»). Фрагментацию ДНК осуществляли ультразвуковым дезинтегратором при частоте 22 КГц, в результате чего получали набор фрагментов ДНК, размером от 200 до 6 000 п.н. Препарат ДНК хранили при –20оC. Данный препарат является фармакопейным препаратом (патентованное название «Панаген», регистрационное свидетельство ЛСР №004429/08 от 09.06.2008) и в качестве объекта промышленной собственности принадлежит ООО «Панаген».
Введение мышам ЦФ и ДНК человека
ЦФ вводили мышам внутрибрюшинно (в/б) из расчета 200 мг/кг веса. Затем через определенные интервалы времени мышам в/б вводили по 0,5-1 мг препарата фрагментированной человеческой ДНК.
Приготовление препаратов из ККМ мышей и иммунофлуоресцентный анализ фокусов репарации ДЦР
Из трубчатых костей мышей фосфатно-солевым буфером (PBS) вымывали красный костный мозг. Клетки осаждали центрифугированием и ресуспендировали в PBS. Каплю полученной взвеси клеток наносили на предметное стекло, иммуннофлуоресцентный анализ был сделан по методике, описанной в работе Niedernhofer et al, 2004.
Инкубирование экстракорпорально сгенерированных ККМ с препаратом ДНК
Из трубчатых костей мышей вымывали ККМ средой MEM-Glasgow (GibcoBRL, Великобритания), содержащей раствор незаменимых аминокислот, глутамин, 0,1 мМ -меркаптоэтанол, 1000 ед/мл LIF. Клетки инкубировали с 32P мечеными фрагментами ДНК. По окончании инкубации клетки промывали два раза этой же средой, заливали в блоки легкоплавкой агарозы, высушивали гель и проводили засветку на Molecular Imager FX Pro+.
Выделение ДНК из ядер ККМ экспериментальных мышей
ККМ мышей вымывали из трубчатых костей физиологическим раствором, ресуспендировали в 0,5 мл лизирующего буфера (Roberts, 1986), содержащего 0,5% Тритон X-100 и инкубировали 10 мин на льду. Смесь наслаивали на 1 мл раствора 10% сахарозы в лизирующем буфере и центрифугировали при 600 g, 4°С в течение 15 мин. Осадок ядер промывали буфером, повторно центрифугировали и ресуспендировали в небольшом объеме воды. Суспензию ядер лизировали 0,5% SDS и обрабатывали протеиназой К. Депротеинизацию проводили экстракцией фенол / хлороформ в соотношении 1:1. ДНК переосаждали 0,6 объемами изопропанола из 0,3 M NaAc pH 5,2, промывали 70% этиловым спиртом и растворяли в воде.
Анализ количества зрелых предшественников (CD34+) и предшественников лимфоидного ряда в костном мозге мышей
ККМ мышей осаждали центрифугированием и ресуспендировали в PBS с 0,1% NaN3, 1% FBS. К 1 млн. клеток добавляли 5 мкг антител (FITC Rat anti-Mouse CD34, BD Pharmingen) и, соответственно, 5 мкг изотип контроля (FITC Rat IgG2a, к Isotype Control, BD Pharmingen) и инкубировали в течение 40 мин при 4°С. Процент клеток CD34+ и предшественников лимфоидного и эритроидного ряда определяли при помощи проточного цитофотометра BD FACSAria.
Патологоанатомический анализ тканей и органов погибших мышей
Кусочки органов фиксировали в 4% параформальдегиде, обезвоживали в спиртах возрастающей концентрации, просветляли ксилолом, заливали в парафин. Парафиновые срезы толщиной до 5 мкм окрашивали гематоксилином и эозином (Волкова, Елецкий, 1971). Просмотр препаратов и микрофотосъемка проводились на световом микроскопе AxioImager ZI (Zeiss, Германия).
РЕЗУЛЬТАТЫ
Временные параметры проявления эффекта «отсроченной смерти» мышей
Неожиданно при исследовании лейкостимулирующей активности инъекций препаратов экзогенной ДНК в группе экспериментальных животных была отмечена массовая гибель, достигавшая 80% (Likhacheva et al., 2007). Эффект был обнаружен как следствие трехкратного введения мышам 0,5 мг экзогенной ДНК на фоне действия цитостатика ЦФ. Используя подход многократного введения препарата экзогенной ДНК после инъекции ЦФ и варьирование 6 и 12 часовыми промежутками времени, у разных групп был определен период времени, когда гибель мышей достигала 60-90%, и который мы обозначили как «окно смерти» (Рис. 1).
«Окно смерти» представляет собой два 6 часовых промежутка времени после введения ЦФ. Первый отрезок 18-24 часа, второй обязательный 6 часовой промежуток времени или следует непосредственно за первым (24-30 часов, группы 8, 9, 10, 14, 15), либо отнесен к концу вторых суток (42-48 часов, группы 4, 13). Двенадцатикратное введение ДНК человека, инъекция ЦФ (200 мг/кг) в виде монопрепарата, а также введение ЦФ в сочетании с ДНК человека в другие временные промежутки (группы 7, 11, 12) не оказывало негативного эффекта на выживаемость животных.

Рис. 1. Прямые отрезки обозначают различные группы мышей, числа рядом – номера групп. Точками на отрезках указана каждая индивидуальная инъекция экзогенной ДНК. Нулевая точка – момент введения ЦФ. Проекция на ось Y показывает процент смертности мышей в каждой группе. Группа 11 представляет собой совокупность 6 групп, которые каждый час получали инъекции ДНК человека в периоды времени 1-6, 7-12, 13-18, 19-24, 25-30 и 31-36 ч после введения ЦФ. Прерывистая кривая показывает процент ККМ, которые достоверно находятся под воздействием цитостатика ЦФ. Промежуток времени, представляющий собой «окно смерти», выделен серым цветом.
Следует отметить, что при использовании в экспериментах SPF-мышей заметного токсического эффекта обнаружено не было. В дальнейшем во всех экспериментах использовали линию мышей CBA стандартного содержания, кроме случаев, когда отдельно указано, что эксперимент проводили с использованием SPF-животных.
Исходя из экспериментальных данных, следует, что наблюдаемый феномен не связан с токсичностью ЦФ, не связан с присутствием в организме экзогенной ДНК, проявляется только в результате совместного действия ЦФ и экзогенной ДНК и во многом зависит от времени введения ДНК после инъекции ЦФ, а также определенной кратности введений препарата ДНК.
Препараты цитостатической группы губительно воздействуют на ККМ, в частности на СКК, вызывая тяжелую эритро- и лейкопению (Salem et al., 2010). Одновременно с этим имеются данные о том, что ККМ, включая СКК, могут являться одной из основных мишеней воздействия экзогенной ДНК при ее введении в организм экспериментального животного (Likhacheva et al., 2007). Именно эти два свойства ККМ были основанием при выборе данной клеточной системы в качестве модели для выяснения молекулярных причин губительного эффекта синергичного воздействия цитостатика ЦФ и экзогенной ДНК.
Анализ динамики возникновения и репарации ДЦР
Для того чтобы привязать установленные промежутки времени, когда наблюдается видимый эффект воздействия экзогенной ДНК на мышиный организм, к молекулярным процессам, происходящим в ККМ, при помощи антител к фосфорилированному гистону H2AX были проведены эксперименты по анализу количества ДЦР в ядрах указанных клеток (Niedernhofer et al., 2004) (Рис. 1, прерывистая кривая).
Из сопоставления графиков гибели мышей и динамики количества ДЦР (Рис. 1) можно сделать заключение, что мыши заболевают и гибнут только в том случае, если введение ДНК происходит во время репарации ДЦР основного количества ККМ (промежуток времени 18-24 часа после инъекции ЦФ). Если же введение экзогенной ДНК происходит в любой другой промежуток времени, то мыши выживают.
Дополнительно было проведено сравнение репарации ДЦР в ККМ мышей после воздействия одного ЦФ и в сочетании с ДНК человека (Рис. 2). Показано, что при появлении в организме экзогенной ДНК в ККМ в течение 10 мин исчезают фокусы репарации, выявляемые антителами к гистону H2AX. В группе мышей, обработанных ЦФ, основная масса ДЦР репарируется к 28 часам после инъекции цитостатика (Рис. 2).

Рис. 2. Процент клеток ККМ, находящихся под воздействием ЦФ у мышей после введения только цитостатика и в комбинации с экзогенной ДНК человека.
Интернализация экзогенной ДНК в ККМ экспериментальных мышей
Для подтверждения того факта, что экзогенная ДНК при в/б инъекциях доставляется в ядра ККМ мышей в виде фрагментов определенного размера, был проведен ПЦР анализ материала ДНК ядер ККМ мышей с праймерами на уникальный ген каспазы 3 человека (Рис. 3). Обнаружено присутствие фрагментов человеческой ДНК в ядерной фракции ККМ мышей, при этом размер интродуцированных в ядро фрагментов составляет не менее 260 п.н.

Рис. 3. Электрофореграмма (слева) и рентгенограмма (справа) продуктов ПЦР с праймерами на уникальный ген каспазы 3 человека с использованием в качестве матрицы ДНК человека, ДНК ККМ мышей CBA и ДНК ядерной фракции ККМ мышей, выделенных через 8 часов после введения ЦФ и ДНК (№1). В качестве зонда для гибридизации использовали 32P меченую ДНК гена каспазы 3 человека. Стрелка обозначает гибридизующийся фрагмент, соответствующий продукту ПЦР с праймерами на ген каспазы 3 человека.
Для решения вопроса о количестве доставляемых в ККМ фрагментов ДНК была разработана процедура экстракорпоральной генерации ККМ, их совместной инкубации с индивидуальными радиоактивно мечеными фрагментами ДНК и анализа материала этих клеток после заливки в блоки легкоплавкой агарозы.
Были выполнены серии экспериментов с фрагментом ДНК, меченым по липкому концу (гидролизованная рестриктазой HindIII плазмида pEGFP-N1). Оказалось, что фрагменты в не деградированном состоянии доставляются как в нативные, так и в находящиеся под действием ЦФ ККМ. Меченая плазмида начинает лигироваться в кольцо к 7 ч инкубации в ККМ, выделенных из мышей обеих групп (Рис. 4-А). Наблюдается быстрое конечное насыщение меченым материалом клеток, находящихся под воздействием ЦФ, и непрерывное увеличение количества меченого материала в клетках, выделенных из необработанных ЦФ мышей (Рис. 4-Б). Результаты экспериментов показали, что в ККМ может находиться до 1800 т.п.н. экзогенной ДНК в форме фрагментов.

Рис. 4. A – Результаты инкубации ККМ с плазмидой pEGFP-N1, гидролизованной рестриктазой HindIII и меченой по липкому концу, в течение различного времени – 1, 2, 4 и 7 ч. Электрофореграмма (слева) и рентгенограмма (справа) после заливки в блоки легкоплавкой агарозы и электрофореза ядер ККМ мыши, выделенных через 18 ч после воздействия ЦФ, и интактной мыши. М – маркер молекулярного веса /HindIII. Стрелками показаны линейная (нижняя) и кольцевая (верхняя) формы плазмиды.
Б – Количественная оценка меченой ДНК плазмиды pEGFP-N1, содержащейся в ядрах ККМ. Оценка проведена с использованием фосфоимеджера Molecular Imager FX Pro+ и программы Quantity One.
Характеристика изменения количества умеренных повторов B1 и B2 в геноме ККМ экспериментальных мышей
Первоначально в работе было отмечено изменение количества гомологичных Alu повтору повторяющихся последовательностей ДНК в геномной фракции, выделенной из ККМ мышей, обработанных ЦФ. Предполагалось изменение количества умеренных повторов в геноме мыши.
Для проверки этого предположения в качестве анализируемых повторов были выбраны B1 и B2 умеренные повторы генома мыши, которые в условиях жесткой гибридизации, используемых в настоящей работе, не имеют перекрестной гомологии ни между собой, ни с человеческим геномом. Благодаря этому можно было оценить изменение количества указанных повторов как в группе мышей, обработанных ЦФ, так и в группе экспериментальных животных, получавших инъекции ЦФ и ДНК человека, вне зависимости от присутствия в геномной фракции ККМ ДНК экзогенного происхождения (Vassetzky et al., 2003).
Для анализа происходящих в геноме событий были выбраны точки 11, 15, 18, 24, 28 часов для группы ЦФ и 18, 24, 28 часов для группы ЦФ+ДНК. Оказалось, что в условиях использования ЦФ как монопрепарата происходят колебания в количестве последовательностей генома, гомологичных обоим повторам. При этом в образцах геномной ДНК, выделенной из ККМ мышей группы ЦФ+ДНК, количество повторов остается неизменным на протяжении контролируемого временного отрезка (Рис. 5).

Рис. 5. Относительное количество В1 (А) и В2 (Б) повторов в геноме ККМ экспериментальных мышей после инъекции ЦФ (200 мг/кг) в виде монопрепарата (сплошные кривые) и после инъекции ЦФ с последующим введением экзогенной ДНК человека в промежуток времени 18-30 часов после инъекции цитостатика (пунктирные кривые). Отдельные точки – ДНК из ядер ККМ интактных мышей.
Характеристика динамики апоптоза в ККМ экспериментальных мышей
В рамках исследований по анализу состояния ККМ была проведена серия экспериментов по оценке степени и продолжительности апоптотической деградации ККМ в двух группах животных, получавших ЦФ как монопрепарат и ЦФ в сочетании с экзогенной ДНК. Оказалось, что если вводить экзогенную ДНК, начиная с 18 и до 30 часов с момента инъекции ЦФ («окно смерти»), то индуцированный к 16 часам апоптоз не прекращается и продолжается вплоть до последней инъекции ДНК. Для контрольной группы (ЦФ) возбуждение нормализуется к 24 часам после введения ЦФ (Рис. 6).
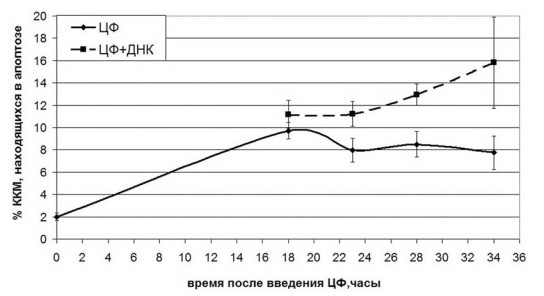
Рис. 6. Процент находящихся в апоптозе ККМ, выделенных из мышей после инъекции ЦФ в виде монопрепарата (сплошная кривая) и в сочетании с инъекциями ДНК в «окно смерти» (пунктирная кривая).
Оценка влияния ЦФ и экзогенной ДНК на субпопуляционный состав ККМ
Полученные данные предполагали, что присутствие в ядре костномозговых клеток фрагментов экзогенной ДНК должно было нарушать корректный ход репарации и приводить к аберрантному митозу и гибели клеток вследствие нарушения целостности хромосом. При анализе метафазных пластинок, выделенных из ККМ мышей, установлено, что в группе, получавшей инъекции ЦФ и ДНК человека, не менее 65% метафаз демонстрируют эффект пульверизации хромом. В группе, получавшей один ЦФ, количество метафаз в таком состоянии оценено как 42% (Рис. 7-В). Дополнительно был проведен анализ состава CD34+ прогениторных клеток и общий анализ изменения состава популяции ККМ в ходе развития болезни (Рис. 7-А, Б).

Рис. 7. Графики абсолютного количества клеток предшественников лимфоидного ряда (А) и зрелых CD34+ предшественников (Б) в костном мозге интактных мышей (контроль), мышей после инъекции ЦФ и ЦФ в сочетании с ДНК человека в периоды снижения и восстановления клеточности костного мозга на фоне инъекции ЦФ.
B – Метафазные пластинки ККМ интактных и экспериментальных мышей.
Общее количество ККМ в обеих группах (ЦФ, ЦФ+ДНК) снижается до минимального значения к 3-м суткам после введения цитостатика и составляет около 20 млн. клеток. К 15-м суткам происходит полное восстановление количества ККМ до исходного уровня 35 млн. клеток. При этом CD34+ СКК как популяция клеток восстанавливается и сохраняется у больных мышей, получавших инъекции ЦФ и экзогенной ДНК, в такой же динамике, как и в группе мышей, получавших только ЦФ (Рис. 7-Б). Тем не менее, обнаружено, что основной характеристикой ККМ болеющих мышей является практически полное исчезновение субпопуляции клеток размером 12-20 нм (Рис. 7-А). Проведенный анализ форменных элементов в отпечатках костного мозга, полученных из грудины болеющих животных, свидетельствует, что в популяции ККМ отсутствуют молодые формы коммитированных клеток-предшественников лимфоиммунопоэза.
Для анализа возможных причин гибели мышей стандартного содержания были проведены аналогичные исследования на SPF-животных, свободных от оппортунистической инфекции. Показано, что у SPF-животных не формируется симптомокомплекс, характерный для мышей стандартного содержания. Также не было отмечено гибели мышей как в контрольных, так и экспериментальных группах. В связи с отсутствием визуальных критериев заболевания анализ функционального состояния костного мозга осуществляли в выбранные контрольные точки: на 9, 15, 21 и 29-е сутки. 9-е сутки характеризуются резким уменьшением количества предшественников лимфоцитарного ростка крови у мышей, обработанных как ЦФ, так и ЦФ+ДНК. Также небольшое снижение обнаруживается в группе животных, получавших инъекции ДНК в виде монопрепарата. На 15 и 21-е сутки у мышей, обработанных ЦФ, анализируемая популяция ККМ начинает восстанавливаться, в то время как в группе ЦФ+ДНК процент клеток данной популяции остается на критически низком уровне. К 29-м суткам состав ККМ у мышей всех групп полностью восстанавливается (Рис. 8).

Рис. 8. Динамика изменения количества костномозговых предшественников лимфоидного ряда у SPF-мышей. Темная сплошная линия отражает количество (%) предшественников лимфоцитов в группе мышей, обработанных препаратом ДНК, светлая сплошная линия – обработанных ЦФ, прерывистая линия – обработанных сочетанием ЦФ и препарата ДНК. Нулевая точка соответствует проценту костномозговых предшественников лимфоидного ряда у интактных SPF-мышей.
Патологоморфологический анализ тканей и органов погибших мышей
Основными симптомами заболевания экспериментальных животных были следующие: общее угнетение двигательной активности, обильное потение, лихорадка, отек морды, выпадение волос на затылке и мордочке, неоткрывание глаза, судороги, параличи. Иногда мыши погибали сразу без видимых симптомов болезни. Иногда мыши выздоравливали после характерных симптомов заболевания.
В органах мышей, получавших совместные инъекции препаратов ЦФ и экзогенной ДНК в «окно смерти», в период от 2-х до 6-и суток не обнаружено визуально заметных морфологических отклонений от контрольных животных, обработанных ЦФ. Начиная с 9-х суток и далее, определяются достаточно яркие признаки нарушения структуры со стороны легких, печени, иммунокомпетентных органов и головного мозга.
В легких наблюдается интенсивная воспалительная реакция, проявляющаяся отеком межальвеолярных перегородок, кровоизлияниями, массивной воспалительно-клеточной инфильтрацией перибронхиальных и периваскулярных пространств с переходом на респираторный отдел легкого. В печени на первый план выступают многочисленные мелкоочаговые лимфоидно-клеточные инфильтраты внутри долек, а также по ходу желчных протоков и сосудов портальной системы. Местами внутридольковые инфильтраты сопровождаются деструкцией отдельных гепатоцитов. У одной из мышей описанные поражения легких и печени сопровождаются крупноочаговым некрозом поджелудочной железы.
Практически все мыши данной группы демонстрируют признаки ответной реакции со стороны органов иммунной системы. Так, со стороны тимуса (Рис. 9-А) отмечается снижение плотности коркового вещества, что находит отражение в визуальном стирании его границы с областью мозгового слоя. Селезенка многих животных характеризуется заметным сокращением как числа фолликулов в целом, так и уменьшением их размеров до масштаба периартериальной зоны (Рис. 9-Б). Лимфатические узлы в унисон с изменением морфологии тимуса и селезенки также показывают сокращение количества фолликулов в пределах корковой зоны.
Во многих случаях отмечается заметный отек ретикулярной ткани мозгового вещества. В головном мозге у обеих групп мышей, получавших инъекции ЦФ в виде монопрепарата и ЦФ в сочетании с ДНК человека, наблюдаются очаговые лимфоидноклеточные инфильтраты в коре полушарий либо изолированно, либо в сочетании с аналогичными клеточными скоплениями в перивентрикулярных и других отделах мозга. Со стороны других органов патологических изменений структуры не выявлено.
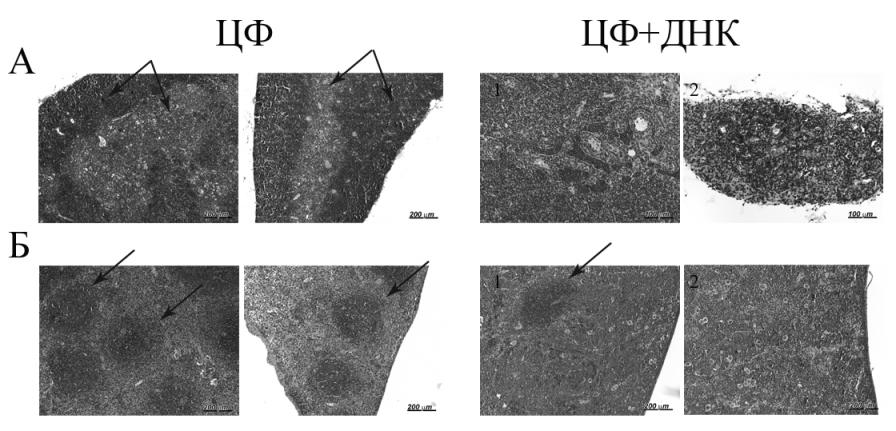
Рис. 9. ЦФ: контрольные мыши, получившие инъекцию ЦФ 200 мг/кг.
A – обзорная микрофотография паренхимы тимуса, демонстрирующая топографическое взаимоотношение коркового и мозгового слоя паренхимы (указаны стрелками); Б – паренхима селезенки отчетливо дифференцирована на красную и белую пульпу, крупные лимфоидные фолликулы белой пульпы селезенки указаны стрелками.
ЦФ+ДНК: мыши, которые находились на конечных стадиях заболевания, получившие совместные инъекции ЦФ и ДНК человека в «окно смерти».
A – снижение плотности заселения лимфоцитами корковой зоны тимуса на фоне обилия их в синусоидах мозгового слоя (1), резкое стирание границы между корковым и мозговым отделами паренхим тимуса (2); Б – умеренно (1) и резко выраженная (2) редукция фолликулов белой пульпы селезенки.
ОБСУЖДЕНИЕ
Общая картина начала и развития патологического процесса складывается из анализа результатов деструктивных процессов, произошедших в костном мозге, и на уровне гистологического анализа срезов органов, затронутых патологическими изменениями.
Фрагменты экзогенной ДНК достигают ядерного пространства ККМ. В присутствии ДЦР, фрагменты экзогенной ДНК нарушают корректный ход репаративного процесса, идущего по механизму деликатной гомологичной рекомбинации. Такой вывод подтверждается следующими найденными фактами. После инъекции экзогенной ДНК мышам наблюдается резкое 2-кратное снижение количества ККМ с ДЦР, т.е. происходит практически мгновенная репарация ДЦР. Также в пользу концепции нарушения корректного течения репарации свидетельствуют результаты анализа структуры метафазных пластинок и данные по изменению количества умеренных повторов в геноме ККМ.
В ККМ мышей группы, обработанной ЦФ, образуются межцепочечные сшивки (МЦС), которые распознаются клеткой при вхождении в S фазу клеточного цикла, когда репликативная(ые) вилка(и) наталкивается на повреждение (Akkari et al., 2000). В этот момент в месте МЦС образуется ДЦР, что запускает каскадный путь активации остановки клеточного цикла (Warmerdam, Kanaar, 2010). Наряду с этим происходит активация систем репарации ДЦР. При этом возобновление продвижения по клеточному циклу не наступит до тех пор, пока все повреждения не будут удалены из внутриядерного пространства клетки (Shibata et al., 2010). В описанной ситуации, когда произошла остановка репликации, но какое-то количество ДНК уже успело закончить репликацию, удвоение генома прошло неравномерно. При этом в суммарной фракции геномной ДНК меняется относительное количество определенных последовательностей: становится больше участков ДНК, которые успели удвоиться и, соответственно, уменьшается количество тех последовательностей, которые реплицируются в последнюю очередь. Показано, что только 86% SINE последовательностей реплицируются в ранней фазе репликации, тогда как 14% приходятся на позднюю S фазу (Holmquist et al., 1986). В наших экспериментах количество B1 и B2 повторов в геноме мыши в указанных экспериментальных условиях уменьшается ориентировочно на 20%, что хорошо согласуется с выводами, полученными в указанной работе.
Сохранение относительного количества умеренных повторов на одном уровне при инъекциях экзогенной ДНК может определяться немедленным лигированием ДЦР в стохастическом порядке. Предполагается, что фрагменты экзогенной ДНК активируют специфическую систему аварийного лигирования, что приводит к несанкционированному объединению двуцепочечных концов (Lee et al., 2005; Wang et al., 2005; Kotnis et al., 2009) и экстренному завершению репликации ДНК. В результате аварийного восстановления целостности генома синтез ДНК возобновляется, и уменьшение относительного количества повторов, связанного с остановкой репликации, не происходит.
Нарушения в структуре хромосом ККМ приводят к массовому апоптозу. При сравнении цитометрических облаков различных популяций ККМ с использованием бокового светорассеивания (SSC) было обнаружено, что в процессе развития патологического процесса из костного мозга исчезает популяция клеток, представляющая собой молодые формы предшественников лимфоидного ряда.
Характер выявленных патологических изменений морфологии легких, печени, поджелудочной железы, центральных и периферических органов иммунной системы и головного мозга указывает на преобладание воспалительных реакций. Подтверждением этому служат структурные эквиваленты функционального истощения лимфоидных органов. Можно полагать, что причиной гибели мышей является полиорганная недостаточность, вызванная системным воспалением и акцидентальной инволюцией лимфоидных органов.
По-видимому, воспаление развивается по нескольким направлениям. Повышение количества ДНК в форме нуклеосом, вызванное масштабным апоптозом активно делящихся клеток, согласно последним исследованиям, приводит к некрозу популяции периферических лимфоцитов (Decker et al., 2003). Индуцированные некротические процессы ведут к развитию очагов воспаления в организме больных мышей. Воспаление также индуцирует экзогенная ДНК сама по себе, запуская механизмы сверхпродукции интерферона и активацию синтеза ФНО (Martin, Elkon, 2006; Coban et al., 2008). Одновременно с указанным действием большое количество экзогенной ДНК, интродуцированное в организм мыши, может привести к активации аутоиммунных процессов, которые также заканчиваются воспалением (McMahon et al., 1998). Развитие системного воспаления приводит к истощению иммунокомпетентных органов. При этом происходит долговременная потеря CD34+ стволовыми клетками возможности дифференцироваться в клетки лимфоидного ростка. Следствием таких изменений в организме больных мышей является возникновение острого иммунодефицита, приводящего к активации оппортунистической инфекции (Shirota et al., 2006; Coban et al., 2008). Совокупность указанных процессов индуцирует акселеративную петлю воспаления, в результате чего развивается системный сепсис, приводящий к полиорганной недостаточности и растянутой во времени гибели экспериментальных животных.
ВЫВОДЫ
- Экзогенная ДНК при совместном культивировании ex vivo достигает и депонируется в клетках костного мозга мышей. Одновременно во внутриклеточном пространстве клеток может находиться до 1800 т.п.н. экзогенной ДНК в виде фрагментов.
- Инъекции мышам стандартного содержания экзогенной ДНК в сочетании с кросслинкирующим цитостатиком циклофосфаном индуцируют в стволовых клетках крови нарушения функциональной активности, характеризующиеся дегенеративными изменениями лимфоидного ряда кроветворения.
- На фоне дегенеративных изменений лимфоидного ряда кроветворения и связанной с этим естественной активацией оппортунистической инфекции у мышей стандартного содержания развивается невосполнимое истощение лимфоидных органов. Возникает полиорганная недостаточность, приводящая к растянутой во времени гибели экспериментальных животных.
- У SPF-животных, характеризующихся практически полным отсутствием оппортунистических микроорганизмов, при аналогичных режимах обработки происходит развитие сходных патологических процессов на уровне функционирования гемапоэтических предшественников, которые, однако, не сопровождаются развитием характерного симптомокомплекса и последующей гибелью экспериментальных мышей.
СПИСОК ОСНОВНЫХ РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Е.В. Долгова, А.С. Лихачева, К.Е. Орищенко, Е.А. Алямкина, С.С. Богачев, М.А. Шурдов. Репарация межцепочечных сшивок молекулы ДНК // Информационный вестник ВОГиС. 2010. Т. 14, № 2, С. 332-356.
- Е.В. Долгова, А.С. Проскурина, В.П. Николин, Н.А. Попова, Е.А. Алямкина, К.Е. Орищенко, А.Г. Шилов, Я.Р. Ефремов, Е.Р. Черных, А.А. Останин, С.С. Богачев, А.В. Прокопенко, Е.М. Малкова, О.С. Таранов, Т.С. Гвоздева, В.А. Рогачев, С.Н. Загребельный, М.А. Шурдов. Характеристика временных параметров проявления эффекта токсического действия инъекций экзогенной ДНК на фоне предобработки цитостатиком циклофосфаном // Вавиловский журнал генетики и селекции. 2011. Т. 15, № 4, С. 674-689.
- Dolgova E.V., Proskurina A.S., Nikolin V.P., Popova N.A., Alyamkina E.A., Orishchenko K.E., Rogachev V.A., Efremov Y.R., Dubatolova T.D., Prokopenko A.V., Chernykh E.R., Ostanin A.A., Taranov O.S., Omigov V.V., Zagrebelniy S.N., Bogachev S.S., Shurdov M.A. “Delayed death” phenomenon: a synergistic action of cyclophosphamide and exogenous DNA // Gene. 2012. V. 495. P. 134-145.
- Е.В. Долгова, В.П. Николин, Н.А. Попова, А.С. Проскурина, К.Е. Орищенко, Е.А. Алямкина, Я.Р. Ефремов, Е.Р. Черных, А.А. Останин, Е.М. Малкова, О.С. Таранов, В.А. Рогачев, С.В. Сидоров, С.С. Богачев, М.А. Шурдов. Интернализация экзогенной ДНК во внутренние компартменты клеток костного мозга мышей // Вавиловский журнал генетики и селекции. 2012. Т. 16, №2, С. 397-414.

