Поиск генетических пол и морфизмов, ассоциированных с биологической устойчивостью организма к радиационному воздействию
На правах рукописи
Уткин Константин Васильевич
Поиск генетических полиморфизмов, ассоциированных с биологической устойчивостью организма к радиационному воздействию
03.03.03 - иммунология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата медицинских наук
Москва, 2012
Работа выполнена в ФГБУ «ГНЦ Институт иммунологии» ФМБА России и ЗАО «НПФ ДНК-Технология».
| Научные руководители: | доктор медицинских наук, профессор, |
| член-корреспондент РАМН, | |
| Алексеев Леонид Петрович; | |
| кандидат биологических наук | |
| Кофиади Илья Андреевич. | |
| Официальные оппоненты: | Ярилин Александр Александрович, |
| доктор медицинских наук, профессор, | |
| заведующий отделом | |
| «ГНЦ Институт иммунологии» | |
| ФМБА России | |
| Кадагидзе Заира Григорьевна | |
| доктор медицинских наук, профессор, | |
| руководитель Централизованного клинико- | |
| лабораторного отдела РОНЦ им. Н.Н. Блохина РАМН | |
| Ведущая организация: | Российский национальный исследовательский |
| медицинский университет им. Н.И. Пирогова | |
| Минздравсоцразвития России |
Защита диссертации состоится 23 мая 2012 г. в 14 часов на заседании Cовета по защите докторских и кандидатских диссертаций - Д 208.017.01 в ФГБУ «ГНЦ Институт иммунологии» ФМБА России по адресу: 115478, Москва, Каширское шоссе, д. 24, корп. 2.
С диссертацией можно ознакомиться в библиотеке ФГБУ «ГНЦ Институт иммунологии» ФМБА России.
Автореферат разослан «____» апреля 2012 г.
| Ученый секретарь | |
| Совета по защите докторских и | |
| кандидатских диссертаций, | |
| доктор медицинских наук | Сеславина Л.С. |
ВВЕДЕНИЕ
Актуальность проблемы
В XX веке человечество вступило в период широкомасштабного использования ядерных технологий. Хотя новые физические явления, в первую очередь, нашли применение в военной области, на их основе были созданы источники электрической и тепловой энергии в виде АЭС и АТЭЦ. Стремительно развилась новая отрасль индустрии — ядерная энергетика – с широким спектром производств по добыче и обогащению руды, проектированию и строительству реакторов, выработке энергии и утилизации отработанного ядерного топлива.
Развитие атомной промышленности обеспечивает растущие потребности человечества в доступных источниках энергии, а также способствует реализации новых перспектив в достижении экономического и социального прогресса. Вместе с тем следует помнить, что этот путь отмечен многими человеческими жертвами, число которых, к сожалению, продолжает расти и в настоящее время.
За последние 50 лет потенциальная опасность излучения изучена более полно, чем любой другой техногенный фактор вредности. Детально изучены патогенез, патологическая морфология и клиника заболеваний, обусловленных поражающим действием облучения, риски их возникновения и зависимость от дозы радиации. При этом одной из важнейших, нерешенных до настоящего времени проблем, остается поиск биологических маркеров, позволяющих выявлять лиц с повышенным или пониженным уровнем устойчивости к радиационному воздействию.
Реакция тканей и организма в целом на радиационное воздействие обусловлена взаимодействием целого ряда клеточных и молекулярных факторов. Установлено, что при хроническом радиационном воздействии невысокой мощности реакция тканей на одинаковые дозы радиации, а также тяжесть негативных последствий облучения варьируют на индивидуальном уровне [Crompton N.E. et al., 2001]. В связи с этим, востребована разработка новых методов к снижению неблагоприятных воздействий радиоактивного облучения на организм человека и реабилитации хронически облучённых людей с использованием индивидуальных подходов к диагностике, оценке радиационных рисков и коррекции выявляемых нарушений.
Перспективным направлением в данной области является радиационная генетика. Генетическая составляющая играет важную роль в развитии всех мультифакторных заболеваний. Так, например, возникновение злокачественных новообразований (ЗНО), в среднем, на 30% обусловлено влиянием наследуемых факторов [Lichtenstein P. et al., 2000], а в случае с аутоиммунными нарушениями этот показатель достигает 50-60% [Redondo M.J. et al., 2001]. Это позволяет предположить влияние генотипа на риск возникновения негативных эффектов облучения, прежде всего, онкопатологий.
Проведение такого рода медико-биологических исследований стало возможным благодаря развитию молекулярно-генетических исследований, в первую очередь, выполненных в рамках международной программы «Геном человека». Одним из следствий этого, в частности, стала возможность оценки генетического разнообразия человека на новом уровне – установления полиморфизма одиночных нуклеотидных замен (Single Nucleotide Polymorphism, SNP). Этот уровень исследований позволяет идентифицировать варианты генов, продукты которых обладают специфическими свойствами, в частности, определяющими реакцию организма на факторы окружающей среды.
На сегодняшний день в геноме человека наиболее выраженным среди изученных генетических систем является полиморфизм генов иммунной системы, насчитывающей тысячи аллельных вариантов, определяющих особенности иммунного ответа (в первую очередь генов цитокинов и главного комплекса гистосовместимости). Данная система генов, вместе с системой генов, ответственных за поддержание целостности генома и регуляцию клеточного цикла (в том числе гены репарации ДНК и апоптоза – ATM, XRCC1, TGFB, OGG1, IL17, IL15RA и др.), является перспективной в контексте изучения механизмов генетического контроля восстановления организма после облучения и поиска генетических полиморфизмов, ассоциированных с повышенной или пониженной устойчивостью организма к радиационному воздействию. Решение этой задачи позволит повысить эффективность профессионального подбора, снизить смертность и раннюю инвалидизацию в контингентах, задействованных в атомной промышленности. В то же время, поиск путей оценки риска развития осложнений радиационного воздействия является важнейшим звеном в выборе и назначении эффективной и безопасной радиотерапии больных онкологическими заболеваниями.
Цель исследования
Установить молекулярно-генетические маркеры, ассоциированные с повышенной или пониженной устойчивостью организма человека к радиационному воздействию.
Задачи исследования
- Разработать научно-методическую платформу для установления генов, перспективных для поиска маркеров наследуемой устойчивости или чувствительности к радиационному воздействию.
- Разработать комплекс ПЦР-тест-систем для идентификации аллельных вариантов, ассоциированных с функциональными свойствами продуктов, кодируемых генами ATM, XRCC1, TGFB, OGG1, IL17, IL15RA, (изменением уровня экспрессии, альтернативным сплайсингом, изменением структуры и конформации).
- С помощью разработанных тест-систем установить частоты аллелей генов ATM, XRCC1, TGFB, OGG1 и др.) в группах радиорезистентных, радиочувствительных индивидуумов и в группе популяционного контроля.
- Установить частоты аллелей локуса 8q24, ассоциированных с наследственной предрасположенностью к развитию онкологических заболеваний в группах радиорезистентных, радиочувствительных индивидуумов и в группе популяционного контроля.
- Установить частоты аллелей генов DQA1, DRB1, DQB1 системы HLA класса II в группах радиорезистентных, радиочувствительных индивидуумов и в группе популяционного контроля.
- Охарактеризовать распределение выявленных аллелей в исследованных группах сравнения, оценить достоверность отличий в частотах аллелей, дать популяционно-генетическую характеристику обнаруженных отличий.
- Оценить применимость исследованных маркеров для прогнозирования мутагенного/канцерогенного эффекта радиации на индивидуальном уровне.
Научная новизна исследования
Впервые продемонстрирована ассоциация иммуногенетических маркеров системы HLA с развитием естественной устойчивости к радиационному воздействию. Полученные данные позволяют по-новому оценить роль молекул главного комплекса гистосовместимости класса II в реализации защитных функций организма человека в ответ на цитотоксическое и мутагенное воздействие радиации. Проведен подробный анализ последовательности иммунных реакций и оценена возможная роль полиморфизма генов в развитии негативных последствий облучения.
В работе проведен углубленный анализ иммунологических основ формирования индивидуальной реакции человека на радиационное воздействие. Отобраны кандидатные молекулярно-генетические маркеры, ассоциированные с изменением структурно-функциональных свойств ключевых компонентов систем репарации ДНК, регуляции клеточного цикла и восстановления защитных функций организма после облучения. Изучены образцы нуклеиновых кислот от радиорезистентных и радиочувствительных индивидуумов, охарактеризованных по радиобиологическим и иммунологическим параметрам. На основе полученных данных предложены возможные механизмы развития отдаленных последствий облучения, проанализированы механизмы канцерогенного воздействия радиации на молекулярном уровне.
Впервые получены данные о распределении выявленных молекулярно-гентических маркеров в русской популяции. Проведен анализ данных, позволяющий определить уровень межэтнической гетерогенности в распределении исследованных маркеров. Обсуждена значимость полученных данных с точки зрения радиационной эпидемиологии. Характеристика геномного полиморфизма в исследованных выборках имеет общенаучное значение и служит вкладом в развитие фундаментальной иммунологии, медицины и популяционной генетики.
Полученные данные могут служить теоретической основой при оценке особенностей индивидуальной реакции на радиационное воздействие. Они также важны при прогнозировании риска развития отдаленных эффектов облучения. Данные о частотах распределения клинически значимых генетических маркеров применимы при проведении клинико-статистических исследований и определении атрибутивных популяционных рисков.
Научно-практическая значимость
Разработанная методика перспективна для формирования комплексного подхода к определению риска развития отдаленных последствий радиационного воздействия. При определении таких рисков должны учитываться частоты аллелей, ассоциированных с устойчивостью к облучению либо с достоверным повышением радиочувствительности у облученных лиц. Эти параметры могут использоваться для планирования мер радиационной защиты.
Разработаны и внедрены в лабораторное производство генотипирующие ПЦР тест-системы для выявления аллелей генов ATM (rs1801516, rs664677), TGFB1 (rs1800469), XRCC1 (rs1799782), OGG1 (rs1052133), IL-7 (rs2717536), IL15-RA (rs2296135). Комплекс дополнен тест-системами для идентификации аллелей локуса 8q24 (rs9642880, rs6983267, rs1447295, rs13281615), а также аллелей HLA-DRB1, DQA1 и DQB1. Адаптированы технологии лабораторного производства разработанных тест-систем, основанных на методе ПЦР в реальном времени. Данный метод может быть использован в клинической практике в качестве диагностического инструмента для индивидуальной оценки диапазона безопасных терапевтических доз радиации и профилактики негативных эффектов радиационного воздействия.
Полученные данные могут быть использованы при проведении популяционно-генетических и радиационно-эпидемиологических исследований. Возможно включение результатов исследования в научно-методические программы для студентов медицинских ВУЗов, а также в образовательные программы учреждений высшего профессионального и последипломного образования.
Апробация работы
Результаты диссертационной работы были доложены и обсуждены на Семинаре по регулированию радиационной безопасности и медицинскому аварийному реагированию в случае аварий при транспортировании радиоактивных веществ (г. Сочи, 2011 г.), а также на XVI Международной конференции Европейской федерации иммуногенетиков и Британского общества гистосовместимости и иммуногенетики (г. Ливерпуль, 2012 г.)
Материалы диссертации изложены в 6 публикациях, в том числе 5 – в периодических научных изданиях, рекомендованных ВАК РФ для публикации результатов докторских и кандидатских диссертаций, 1 публикация в научной печати.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Биологические образцы, использованные в работе
Были исследованы образцы геномной ДНК, выделенной из крови 220 человек, забранной в рамках плановых медицинских осмотров на базе региональных МСЧ. В первую группу (группа RR) вошли 70 образцов геномной ДНК из коллекции Уральского научно-практического центра радиационной медицины, полученных от неродственных пациентов - жителей прибрежных сёл р. Теча, подвергшихся длительному комбинированному облучению: внешнему -облучению и внутреннему, обусловленному инкорпорацией 90Sr в костную ткань. Медиана накопленной дозы на красный костный мозг составляла 1,23 Зв. Выборка включает представителей русской популяции, а также объединенной группы татарской и башкирской популяций тюркской ветви алтайской языковой семьи (25 и 45 человек, соответственно) 1933-1949 года рождения. Обследованные лица не имели серьёзной соматической патологии и прожили более 60 лет от начала облучения, что в комплексе с данными гематологического анализа дало нам основания рассматривать их, как группу радиорезистентных индивидуумов (RR).
Во вторую группу (группа RS) вошли 50 образцов ДНК, полученные от индивидуумов с клиническими признаками соматической патологии, подвергшихся профессионально-ассоциированному облучению в рамках предельно допустимых концентраций. Образцы собраны в ходе проспективного обследования контингентов, задействованных на предприятиях атомной промышленности, проводимого ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Наличие соматической патологии, развившейся в условиях радиационной нагрузки послужило основанием для определения образцов в группу повышенной радиочувствительности (RS).
В третью группу (группа сравнения P – популяционный контроль) вошли образцы ДНК, полученные от 100 здоровых представителей русской популяции – доноров первичной кроводачи из коллекции ФГБУ «ГНЦ Институт иммунологии» ФМБА России, собранной на базе ФГБУ Российский научный центр хирургии им. акад. Б.В. Петровского РАМН. Группу составили индивидуумы, проживающие на территории Центрального, Южного, Волжского, Уральского и Северного-западного федеральных округов РФ.
В качестве дополнительного межпопуляционного контроля использовали информацию о частотах исследованных аллелей в референтных выборках из популяций европейского (CEU – 60 неродственных представителей) и азиатского (CHB – 45 неродственных представителей) происхождения из базы данных HapMap (http://hapmap.ncbi.nlm.nih.gov).
Очистка ДНК и генотипирование
Очистку ДНК проводили методом высаливания по стандартной процедуре [Miller S.A. et al., 1988].
Генотипирование образцов проводили методом полимеразной цепной реакции (ПЦР) с оценкой температуры плавления гомо- и гетеродуплексов синтетических аллель-специфичных проб и ДНК-мишени в режиме реального времени (точность использованных систем была подтверждена повторным генотипированием выборки образцов методом секвенирования по Сэнгеру [Sanger F. et al., 1975]). Оценку динамики плавления ДНК-дуплексов проводили с использованием линейных «примыкающих» проб на сертифицированном оборудовании. ПЦР проводили в детектирующем амплификаторе ДТ-96 (ЗАО «НПФ ДНК-Технология», Россия) по следующей программе: 94С – 10 с, 64С – 20 с, 72С – 10 с в течение 40 циклов, с дополнительным раундом плавления в диапазоне температур 25 – 75С.
Статистическая обработка данных
Частоту аллелей вычисляли по формуле:
f = n/2N,
где n – встречаемость аллеля [Hamilton M., 2011].
Все оборудование и реактивы, использованные в работе, были предоставлены ЗАО «НПФ ДНК-технология» (Россия). Оборудование и реактивы сертифицированы на территории РФ. Дизайн праймеров и молекулярных проб осуществляли с помощью программы Oligo 6.0, а также базы данных dbSNP и алгоритма Blast Национального Центра Биотехнологической Информации США (www.ncbi.nlm.nih.gov)
Статистическую оценку результатов проводили с помощью критерия 2 с уровнем достоверности p<0,05 [Petrie A., Sabin C., 2009].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Разработка лабораторного варианта тест-систем для выявления аллелей генов ATM (rs1801516, rs664677), TGFB1 (rs1800469), XRCC1 (rs1799782), OGG1 (rs1052133), IL-7 (rs2717536), IL15-RA (rs2296135) в режиме реального времени
В ходе работы созданы тест-системы для выявления аллелей генов ATM (rs1801516, rs664677), TGFB1 (rs1800469), XRCC1 (rs1799782), OGG1 (rs1052133), IL-7 (rs2717536), IL15-RA (rs2296135) в геноме человека методом ПЦР «в реальном времени». Тест-системы представляет собой комплект синтетических реагентов (биомолекул), буферных растворов, а также сертифицированных технических средств визуализации и анализа. Оригинальные модификации (ноу-хау), используемые при конструировании биомолекул, позволяют повысить аналитическую чувствительность технологии по сравнению с существующими технологиями. Преимущества предлагаемой модификации метода в области оптики (абсорбция/люминисценция) и биотехнологии (биосенсоры, биоинформатика) определяют ее превосходство над аналогичными разработками.
Использованная в работе модификация метода позволяет проводить одновременную детекцию обоих аллелей ДНК. Из существующего разнообразия флуоресцентных методик нами был выбран наиболее эффективный, на наш взгляд, подход к определению полимофизмов с помощью аллель-специфичных проб и анализа кривых плавления ДНК-дуплексов. Для идентификации аллелей проводили ПЦР с праймерами, фланкирующими полиморфный участок генома. Для определения генотипа использовали пробы, несущие молекулы донора и акцептора флуоресценции. Вариабельный нуклеотид располагали в центральной части аллель-специфичной пробы. Условия реакции подбирали так, чтобы максимизировать разницу в эффективности гибридизации/денатурации полностью комплементарной и частично некомплементарной пробы. Таким образом, если анализируемый образец содержит только один вариант последовательности (то есть гомозиготен по данному полиморфизму), температура денатурации полностью комплементарной пробы будет выше температуры денатурации частично некомплементарной пробы (рис. 1А). Если же анализируют гетерозиготный образец, обе пробы будут денатурировать на примерно одинаковых температурах (рис. 1Б). Регистрацию сигнала осуществляли при помощи молекул флуорофора (по одному на каждый из тестируемых аллелей) и «гасителя флуоресценции». В данной модификации метода использовали отдельную «акцепторную» пробу примыкающую к аллель-специфичной «репортерной» пробе. Такой подход позволил существенно упростить условия проведения реакции
Использованный нами подход продемонстрировал высокую точность и пропускную способность анализа.
А Б

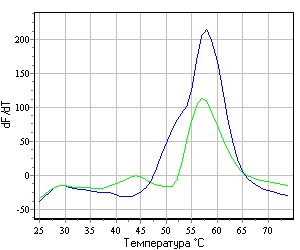
Рис. 1. Графики плавления ДНК-дуплексов, полученные с помощью детектирующего амплификатора ДТ-96 (ЗАО «НПФ ДНК-Технология»).
A - результат исследования гомозиготного образца. Светлая кривая отражает динамику денатурации частично некомплементарного праймера; Б - результат исследования гетерозиготного образца.
2. Генотипирование образцов
С помощью разработанных тест-систем были определены генотипы 220 образцов из исследуемых групп сравнения по 7 полиморфизмам: ATM (rs1801516, rs664677), TGFB1 (rs1800469), XRCC1 (rs1799782), OGG1 (rs1052133), IL-7 (rs2717536), IL15-RA (rs2296135). Для оценки возможной ассоциации генетических маркеров с риском развития онкопатологий в группах сравнения использовали тест-системы, изготовленные в рамках научно-исследовательской разработки, проводимой отделом иммуногенетики ФГБУ «ГНЦ Институт иммунологии» совместно с РОНЦ им. Н.Н.Блохина РАМН. Результаты генотипирования приведены в таблице 1.
Табл. 1. Результаты генотипирования биообразцов по 11 исследованным SNP-маркерам.
| Маркер | Ген | Частота минорного аллеля в группе RR (±SE) | Частота минорного аллеля в группе RS (±SE) | Частота минорного аллеля в группе P (±SE) |
| rs1801516 | ATM | 0,08 (±0,02) | 0,17 (±0,04) | 0,16 (±0,02) |
| rs664677 | ATM | 0,58* (±0,04) | 0,4 (±0,05) | 0,41 (±0,03) |
| rs1800469 | TGFB1 | 0,3 (±0,04) | 0,34 (±0,05) | 0,34 (±0,03) |
| rs1799782 | XRCC1 | 0,08 (±0,02) | 0,03 (±0,02) | 0,09 (±0,02) |
| rs1052133 | OGG1 | 0,07 (±0,04) | 0,18 (±0,04) | 0,17 (±0,03) |
| rs2717536 | IL7 | 0,07 (±0,02) | 0,08 (±0,02) | 0,07 (±0,02) |
| rs2296135 | IL15RA | 0,48 (±0,04) | 0,49 (±0,05) | 0,49 (±0,03) |
| rs9642880 | 8q24 | 0,52* (±0,04) | 0,47 (±0,05) | 0,49 (±0,04) |
| rs6983267 | 8q24 | 0,47 (±0,04) | 0,47 (±0,05) | 0,48 (±0,03) |
| rs1447295 | 8q24 | 0,07 (±0,02) | 0,13 (±0,03) | 0,12 (±0,02) |
| rs13281615 | 8q24 | 0,45 (±0,04) | 0,45 (±0,05) | 0,46 (±0,03) |
* Частота минорного аллеля для популяции в исследованной группе выше 50%.
Генотипирование по 34 аллелям генов HLA-DRB1, DQA1 и DQB1 проводили с помощью тест-систем, предоставленных ЗАО «НПФ ДНК-Технология». Тест-системы позволяют в режиме реального времени определять аллели генов HLA с уровнем разрешения до второго знака. Результаты генотипирования приведены в таблице 2.
3. Проверка соотношения Харди-Вайнберга для исследованных аллелей
Селективный отбор в отношении индивидуумов, несущих исследуемый генотип, может влиять на представленность аллелей в популяции. Для проверки этой гипотезы сравнивали полученные результаты с равновесным распределением Харди-Вайнберга. Для сравнения использовали критерий 2.
Эмпирически установленные частоты генотипов аллелей соответствовали распределению Харди-Вайнберга.
Табл. 2. Результаты генотипирования биообразцов по 34 исследованным аллелям HLA.
| Ген | Аллель | Частота аллеля в группе RR (±SE) | Частота аллеля в группе RS (±SE) | Частота аллеля в группе P (±SE) |
| DRB1 | *1 | 0,11 (±0,02) | 0,1 (±0,03) | 0,1 (±0,02) |
| DRB1 | *3 | 0,1 (±0,02) | 0,07 (±0,02) | 0,07 (±0,02) |
| DRB1 | *4 | 0,13 (±0,02) | 0,1 (±0,03) | 0,11 (±0,02) |
| DRB1 | *7 | 0,15 (±0,03) | 0,18 (±0,03) | 0,15 (±0,03) |
| DRB1 | *8 | 0,05 (±0,01) | 0,04 (±0,01) | 0,02 (±0,01) |
| DRB1 | *9 | 0,01(±0,01) | 0 | 0,01 (±0,01) |
| DRB1 | *10 | 0,03 (±0,01) | 0 | 0,01 (±0,01) |
| DRB1 | *11 | 0,04 (±0,01) | 0,13 (±0,03) | 0,14 (±0,02) |
| DRB1 | *12 | 0,08 (±0,02) | 0,02 (±0,01) | 0,03 (±0,01) |
| DRB1 | *13 | 0,11 (±0,02) | 0,13 (±0,03) | 0,14 (±0,02) |
| DRB1 | *14 | 0,01 (±0,01) | 0,01 (±0,01) | 0,02 (±0,01) |
| DRB1 | *15 | 0,16 (±0,03) | 0,16 (±0,03) | 0,13 (±0,02) |
| DRB1 | *16 | 0,03 (±0,01) | 0,07 (±0,03) | 0,06 (±0,01) |
| DQA1 | *101 | 0,1 (±0,02) | 0,1 (±0,03) | 0,13 (±0,02) |
| DQA1 | *102 | 0,2 (±0,03) | 0,23 (±0,04) | 0,19 (±0,03) |
| DQA1 | *103 | 0,1 (±0,02) | 0,09 (±0,03) | 0,1 (±0,02) |
| DQA1 | *201 | 0,15 (±0,03) | 0,17 (±0,03) | 0,15 (±0,03) |
| DQA1 | *301 | 0,12 (±0,02) | 0,1 (±0,03) | 0,12 (±0,02) |
| DQA1 | *302 | 0 | 0 | 0 |
| DQA1 | *401 | 0,02 (±0,01) | 0,03 (±0,01) | 0,02 (±0,01) |
| DQA1 | *501 | 0,3 (±0,03) | 0,25 (±0,04) | 0,29 (±0,03) |
| DQB1 | *201 | 0,2 (±0,03) | 0,22 (±0,04) | 0,19 (±0,03) |
| DQB1 | *203 | 0 | 0 | 0 |
| DQB1 | *301 | 0,25 (±0,03) | 0,19 (±0,03) | 0,24 (±0,03) |
| DQB1 | *302 | 0,08 (±0,02) | 0,08 (±0,02) | 0,08 (±0,02) |
| DQB1 | *303 | 0,04 (±0,01) | 0,04 (±0,02) | 0,03 (±0,01) |
| DQB1 | *304 | 0 | 0 | 0 |
| DQB1 | *305 | 0 | 0 | 0 |
| DQB1 | *401 | 0,02 (±0,01) | 0,03 (±0,01) | 0,02 (±0,01) |
| DQB1 | *501 | 0,1 (±0,02) | 0,09 (±0,02) | 0,11 (±0,02) |
| DQB1 | *502 | 0,08 (±0,02) | 0,08 (±0,03) | 0,07 (±0,02) |
| DQB1 | *503 | 0,02 (±0,01) | 0,01 (±0,01) | 0,02 (±0,01) |
| DQB1 | *601 | 0,03 (±0,01) | 0,02 (±0,01) | 0,03 (±0,01) |
| DQB1 | *602-8 | 0,02 (±0,01) | 0,22 (±0,04) | 0,2 (±0,03) |
4. Характеристика частотного распределения исследованных аллелей в исследованных группах
4.1. Распределение аллелей в европейской и азиатской популяции относительно исследованных групп
Группа облучённых людей, проживающих в селах на побережье р. Теча, неоднородна по этническому составу. Большая часть группы (64%) представлена лицами тюркской этнической принадлежности (татары, башкиры). Чтобы исключить возможность отклонений, вызванных отличиями в распределении маркеров в различных популяциях, нами был проведен сравнительный анализ частот аллелей исследованных SNP в референтных популяциях азиатского (CHB) и европейского (CEU) происхождения, представленных в базе данных HapMap относительно выборки P из русской популяции. По результатам анализа большинство SNP-маркеров за исключением rs1052133 (ген OGG1), rs1801516 (ген ATM) и rs1799782 (ген XRCC1) попали в группу, характеризующуюся сходным распределением во всех трех группах сравнения. Таким образом, можно исключить влияние фактора геномного разнообразия отдельных популяций, этносов, этнотерриториальных сообществ (популяционной стратификации) при исследовании распределения маркеров в выбранных группах. Отличия в частоте аллелей генов OGG1, ATM и XRCC1 установлены только для групп P и CHB. В то же время в группе P и CEU указанные маркеры распределены одинаково (без статистически достоверных отличий) (Рис 2).
Частота аллеля G в гене OGG1 варьирует от 0,22 среди европейцев до 0,55 в популяциях Китая и Японии. Другой маркер, rs1801516, расположенный в гене ATM (аллель A), практически не встречается в популяциях азиатского происхождения и, напротив, широко распространен в европейской этнической группе (0,19). Частоты аллелей SNP-маркеров по-разному представленных в популяциях европейского и азиатского региона могут отличаться и в пределах популяционной системы населения России. Это может приводить к искажению результатов исследования. Однако, по данным о распределении SNP-маркеров в евроазиатском регионе, генофонд популяций, проживающих на территории центральной части и Волго-Уральского региона России, в большей степени испытывает на себе влияние «притока генов» со стороны Европы [Кофиади И.А. и соавт., 2011]. Кроме того, по результатам исследования полиморфизма генов системы HLA, русские, татары и башкиры принадлежат одному этническому кластеру, что позволяет предположить сходное распределение эволюционно-стабильных независимых SNP-маркеров, в этих популяциях [Болдырева М.Н. и соавт., 2006]. Это дает основания к рассмотрению исследованных групп в составе общей по этнической принадлежности выборки и позволяет исключить влияние фактора популяционной стратификации на результат исследования.
4.2 Распределение аллелей кандидатных SNP-маркеров в исследуемых группах
Из 11 исследованных SNP-маркеров, для четырех (rs1801516, rs664677, rs1052133, rs1799782) в сравниваемых группах обнаружены различия в распределении (рис 3). Минорный аллель T варианта Asp1853Asn гена ATM (rs1801516) встречается в группе RR реже, чем в группе популяционного контроля (P). В то же время частота минорного аллеля T варианта IVS22-77 (rs664677) того же гена в группе RR выше, чем в группе популяционного контроля. Поскольку группу RR составили радиорезистентные индивидуумы, можно предположить разнонаправленное влияние данных полиморфизмов на признак радиорезистентности.

Рис. 2. Сравнительный анализ распределения аллелей исследованных SNP-маркеров в европейской (CEU) и азиатской (CHB) популяции относительно группы популяционного контроля (P).
Еще одно отличие обнаружено для минорного аллеля G варианта Ser326Cys, расположенного в 326 кодоне гена OGG1 (rs1052133). Наличие протективного эффекта для этого маркера описывалось ранее [Агеева А.М. и соавт., 2007]. В группе RS установлено единственное отличие в распределении аллеля А гена XRCC1 (rs1799782). Частота аллеля А в данной группе достоверно ниже, чем в двух других исследованных группах. В данном случае полученные нами результаты подтверждают установленную ранее [Vishnoi M at al., 2008 ] ассоциацию маркера rs1799782 с онкозаболеваниями. В настоящее время представления о роли конкретных аллелей гена XRCC1 в формировании предрасположенности к онкозаболеваниям противоречивы. Разными научными коллективами получены данные как о прямой, так и об обратной связи аллеля A с риском развития ЗНО. Результаты, полученные в настоящей работе, служат вкладом в дальнейшее развитие представлений о роли гена XRCC1 в механизме канцерогенеза. В таблице 3 представлены суммарные результаты по подтвержденным и выявленным впервые в рамках данного исследования ассоциациям.
В настоящем исследовании не удалось подтвердить описанную ранее ассоциацию варианта TGFB1 (rs1800469) с повышенным риском развития онкологических заболеваний.
Табл. 3. Суммарные результаты по подтвержденным и установленным впервые в рамках данного исследования ассоциациям.
| Маркер | аллель | RR | RS | P | признак | тип ассоциации | p |
| ATM(rs1801516) | Т | 0,08 | 0,17 | 0,16 | радиорезистентность | Обратная (выявлена впервые) | 0,007 |
| ATM(rs664677) | Т | 0,58 | 0,4 | 0,41 | радиорезистентность | Прямая (выявлена впервые) | 1E-04 |
| OGG1(rs1052133) | G | 0,7 | 0,18 | 0,17 | радиорезистентность | Обратная (подтверждена) | 0,005 |
| XRCC1(rs1799782) | A | 0,08 | 0,03 | 0,09 | радиочувствительность | Обратная (подтверждена) | 9E-04 |
| DRB1 | *11 | 0,04 | 0,13 | 0,14 | радиорезистентность | Обратная (выявлена впервые) | 0,001 |
4.3 Распределение аллелей генов HLA-DRB1, DQA1 и DQB1 в исследуемых группах
Лимфоциты являются одними из наиболее уязвимых к токсическому действию радиации клеток. В условиях лимфопении, вызванной внешним или эндогенным воздействием, существует два пути восстановления популяции лимфоцитов: (1) путем активации пролиферации лимфоцитов в тимусе и (2) за счет гомеостатической пролиферации в периферических органах иммунной системы [Jameson S.C. et al., 2002]. Как правило, у взрослых людей функциональная активность тимуса подавлена и восстановление популяций лимфоцитов происходит за счет гомеостатических механизмов. Сдвиг баланса в сторону экспансии олигоклональных клеток памяти приводит к уменьшению разнообразия представленных субпопуляций лимфоцитов и может стать причиной развития ауто- и аллоиммунных реакций, а также онкологических заболеваний [Yawalkar N. et al., 2003, Cox A.L. 2005].
Одним из важных направлений в исследовании онкогенеза является изучение процессов, способствующих «уходу» опухоли от действия иммунной системы. Наиболее перспективными с этой точки зрения представляются иммуногенетические исследования процесса представления опухолевых антигенов. Двумя ключевыми участниками этого процесса являются молекулы главного комплекса гистосовместимости, несущие антиген, и рецепторы лимфоцитов. Их взаимодействие запускает или подавляет иммунную реакцию. В свою очередь нарушения в системе распознавания приводят к развитию аутоиммунных или онкологических заболеваний.
Сложность изучения этих молекул в первую очередь вызвана полиморфизмом кодирующих их генов. Биологический смысл генетического полиморфизма заключен в способности распознавания этими молекулами всего разнообразия антигенов. Истощение репертуара антиген-распознающих молекул, вызванное старением организма, токсическим воздействием или иными факторами приводит к нарушению иммунологического баланса и развитию патологии.
Из 34 исследованных аллелей HLA класса II единственная достоверная ассоциация с признаком устойчивости к радиационному воздействию установлена для группы аллелей HLA-DRB1*11 (таблица 3). Помимо этого, нами обнаружены группы аллелей в генах HLA-DRB1 и HLA-DQB1, перспективные для дальнейшего исследования в более широких группах. О перспективности исследования данных маркеров позволяют судить установленные тенденции к равномерному повышению или понижению представленности аллелей в ряду исследованных групп RR/P/RS. Данные по распределению аллелей HLA класса II в группах индивидуумов с повышенной или пониженной устойчивостью к радиации получены впервые. Результаты настоящей работы открывают новые представления о роли молекул главного комплекса гистосовместимости в радиационной генетике.
4.4. Возможность использования полученных данных для прогнозирования патогенного эффекта радиации на индивидуальном уровне
Полученные результаты позволяют говорить о вкладе генетического фактора в формирование индивидуальной радиорезистентности. Исследованные SNP-маркеры (rs1801516, rs664677, rs1052133, rs1799782) являются перспективными для оценки индивидуальной радиорезистентности или радиочувствительности в группах риска отдалённой соматической патологии. Объем выборки и отсутствие ряда групп сравнения, которые могли бы дополнить выявленную картину распределения аллелей, не позволяют на данном этапе исследования делать выводы об отсутствии ассоциации остальных маркеров с чувствительностью тканей к радиационному воздействию. Тем не менее, установление отличий даже на уровне десятков образцов определяет целесообразность дальнейших исследований. Создание репрезентативной панели маркеров для оценки индивидуальной генетически обусловленной радиочувствительности требует комплексного подхода. Вероятность установления ложных ассоциаций достаточно велика из-за недостаточно полных на сегодняшний день представлений о степени межпопуляционной и внутрипопуляционной генетической вариабельности и об особенностях структурно-функциональной организации генома [Price A.L. et al., 2008]. Поэтому принципиальным является вопрос формирования широких групп сравнения, валидации ассоциаций и разработки эффективной модели дальнейших исследований.
ВЫВОДЫ
1. Разработаны лабораторные варианты тест-систем, позволяющих определять аллели 7 SNP-маркеров в генах ATM (rs1801516, rs664677), TGFB1 (rs1800469), XRCC1 (rs1799782), OGG1 (rs1052133), IL-7 (rs2717536), IL15-RA (rs2296135) методом ПЦР в реальном времени. Данный подход точен, прост в применении и может быть рекомендован для использования в клинико-диагностической практике.
2. Для трех SNP-маркеров (rs1801516, rs664677, rs1052133) обнаружены отличия в распределении в группе RR относительно двух других исследованных групп. Минорный аллель T варианта гена ATM (rs1801516), а также минорный аллель G гена OGG1 (rs1052133) встречаются в группе RR достоверно реже. В то же время частота минорного аллеля T гена ATM (rs664677) в группе радиорезистентнвх индивидуумов достоверно выше.
3. Для одного SNP-маркера (rs1799782) обнаружены отличия в распределении в группе RS относительно двух других исследованных групп. Частота минорного аллеля A гена XRCC1 (rs1799782) в группе радиочувствительных индивидуумов достоверно ниже.
4. Установлена ассоциация аллеля HLA-DRB1*11 с формированием фенотипа, характеризующегося повышенной устойчивостью к радиации. В локусах HLA-DRB1 и HLA-DQB1 обнаружены кандидатные маркеры, перспективные для дальнейшего изучения.
5. Достоверных различий в распределении маркера rs1800469 гена TGFB1, для которого ранее была установлена ассоциация с формированием фенотипа, характеризующегося повышенной чувствительностью к радиации, в исследованных группах не обнаружено.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Уткин К.В., Кофиади И.А., Алексеев Л.П., Абрамов Д.Д., Батенева Е.И., Хаитов P.M., Веремеева Г.А., Площанская О.Г., Аклеев А.В. Киселев М.Ф. Однонуклеотидные полиморфизмы, как маркеры индивидуальной реакции на хроническое радиационное воздействие. Ядерная и радиационная безопасность, 2011, т. 62, №. 4, с. 44-50.
2. Абрамов Д.Д., Кофиади И.А., Уткин К.В., Трофимов Д.Ю., Хаитов Р.М., Алексеев Л.П. Полиморфизм одиночных нуклеотидов в генах цитокинов и их рецепторов: биологический эффект и методы идентификации. Иммунология, 2011, № 5, с. 275-280.
3. Уткин К.В., Абрамов Д.Д., Болдырева М.Н., Алексеев Л.П. Генетика иммунозависимых заболеваний, роль однонуклеотидных полиморфизмов в формировании иммунного статуса человека. Физиология и патология иммунной системы. Иммунофармакогеномика. 2011, т. 15, № 6, с. 13-18.
4. Уткин К.В., Кофиади И.А., Гудима Г.О., Веремеева Г.А., Площанская О.Г., Аклеев А.В., Абрамов Д.Д., Васильев Е.В., Алексеев Л.П. Оценка ассоциации вариантов генов иммунного ответа с формированием фенотипа, характеризующегося повышенной устойчивостью к радиационному воздействию. Российский аллергологический журнал, 2012, № 1, с. 317-318.
5. Хаитов Р.М., Хаманева Н.Ю., Алексеев Л.П., Рагимов А.А., Уткин К.В., Болдырева М.Н., Алексеева П.Л. Трансплантация кроветворных стволовых клеток в России. Причины отставания. Медико-биологические, административно-правовые и организационные аспекты. Вестник службы крови России, 2012, № 2. с. 3-8.
6. Utkin K.V., Kofiadi I.A., Goudima G.O., Bateneva E.I., Kadochnikova V.V., Boldyreva M.N., Kiselev M.F., Akleev A.V., Veremeeva G.A., Alexeev L.P. Assessing Immunogenetic basis of inherited resistance to radiation: focus on HLA>Tissue antigens, 2012, v. 79, № 6, P360.

