Морфологическое и биохимическое исследование секреторной деятельности щитовидной железы при экспериментальном синдроме нетиреоидных заболеваний
На правах рукописи
ЯГЛОВА Наталья Валентиновна
МОРФОЛОГИЧЕСКОЕ И БИОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ СЕКРЕТОРНОЙ ДЕЯТЕЛЬНОСТИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ СИНДРОМЕ НЕТИРЕОИДНЫХ ЗАБОЛЕВАНИЙ
03.03.04 – клеточная биология, цитология, гистология
03.01.04 – биохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени доктора медицинских наук
Москва – 2011
Работа выполнена в Учреждении Российской академии медицинских наук Научно-исследовательском институте морфологии человека РАМН
Научные консультанты: доктор медицинских наук, профессор
Макарова Ольга Васильевна
Заслуженный деятель науки РФ,
академик РАМН,
доктор медицинских наук, профессор
Березов Темирболат Темболатович
Официальные оппоненты: доктор медицинских наук, профессор
Яцковский Александр Никодимович
доктор медицинских наук, профессор
Ноздрин Владимир Иванович
член-корреспондент РАМН,
доктор медицинских наук, профессор
Кушлинский Николай Евгеньевич
Ведущая организация: ГОУ ВПО Российский государственный медицинский университет Росздрава
Защита состоится «______» _________________ 2011г. в ____ часов на заседании дисертационного совета Д 001.004.01 при НИИ морфологии человека РАМН по адресу: 117418, г. Москва, ул. Цюрупы, д.3.
С диссертацией можно ознакомиться в научной библиотеке НИИ морфологии человека РАМН по адресу: 117418, г. Москва, ул. Цюрупы, д.3.
Автореферат разослан «______» ________________2011г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук Л.П. Михайлова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Синдром нетиреоидных заболеваний развивается при различных соматических заболеваниях у лиц, ранее не страдавших заболеваниями щитовидной железы, и проявляется снижением уровня трийодтиронина и тироксина в сыворотке крови (De Groot L., 2003). Первые сообщения о синдроме нетиреоидных заболеваний в научной литературе появились около 30 лет назад (Wartofsky L. et al., 1982). На сегодняшний день синдром нетиреоидных заболеваний описан при тяжелых формах инфекционных и воспалительных заболеваний, сепсисе, инфаркте миокарда, тяжелых травмах, трансплантации внутренних органов и ряде других заболеваний (Phillips R. et al., 1984; Vexiau P. et al., 1993, Eber B. et.al, 1995; Joosten K. et al., 2000). По данным клинических исследований (Maldonado S.et al., 1992; Kaptein E, 1997; Peeters R. et al., 2005) выраженность синдрома нетиреоидных заболеваний определяет уровень смертности пациентов реанимационных отделений, что обусловливает актуальность этой проблемы. Анализ литературных данных не позволяет сформировать целостное представление о патогенетических механизмах развития и регресса синдрома нетиреоидных заболеваний. Существует точка зрения, что синдром нетиреоидных заболеваний развивается вследствие снижения секреции тиролиберина гипоталамусом и тиреотропного гормона гипофизом, приводящим к снижению продукции тиреоидных гормонов, а также нарушения периферического превращения тироксина в трийодтиронин (Fliers E.et al., 1997; De Groot L., 2003; den Brinker M., 2005). Однако имеются данные клинических и экспериментальных исследований, противоречащие этим гипотезам, в частности, выявление синдрома нетиреоидных заболеваний при нормальном и повышенном уровне тиреотропного гормона в сыворотке крови, и высокая активность дейодиназ, превращающих тироксин в трийодтиронин при различных заболеваниях (Docter R. et al., 1993; Adler S. et al., 2007; Galton V. et al., 2009).
Наименее изученным аспектом проблемы являются изменения секреторной деятельности клеток щитовидной железы при синдроме нетиреоидных заболеваний. В современной литературе отсутствуют данные о сопоставлении биохимических данных, характеризующих деятельность щитовидной железы, и морфологических проявлениях секреторной деятельности клеток щитовидной железы при синдроме нетиреоидных заболеваний. В последние десятилетия в научной литературе было опубликовано большое количество экспериментальных работ по изучению влияния воздействия различных физических и химических факторов на деятельность щитовидной железы (Dumont J. et al., 1991; Thomson S. et al., 1998; Derwahl M. et al., 1999; Vella V. et al., 2002). Обнаружение на мембранах фолликулярных клеток щитовидной железы функционально активных толл-подобных рецепторов 4 и 3 (Yamazaki K. et al., 2007; Nicola J. et al., 2009) указывает на возможность непосредственного регулирования их секреторной активности патоген-ассоциированными молекулярными паттернами. Работы в этой области послужат основой для изучения внегипофизарных путей регуляции деятельности щитовидной железы в норме и патологии. Связь щитовидной железы с органами иммунной системы, ее роль в реакциях врожденного и адаптивного иммунитета представляют значительный интерес для исследователей, так как открывают новые пути изучения молекулярных основ общепатологических процессов. Следствием недостаточной изученности механизмов синдрома нетиреоидных заболеваний при различных патологиях является отсутствие патогенетически обоснованных подходов к его коррекции.
Таким образом, изучение морфологических и биохимических основ синдрома нетироеоидных заболеваний, его проявлений на разных структурно-функциональных уровнях, влияния на деятельность других органов и систем, позволило бы оптимизировать методы лечения тяжелых соматических заболеваний, а также стать основой нового направления исследования роли патоген-ассоциированных молекулярных паттернов, в том числе и конститутивных, в регуляции секреторной деятельности щитовидной железы и других эндокринных желез в норме и патологии, что и обусловило цель нашего исследования.
Цель исследования: изучение морфологических и биохимических изменений секреторной деятельности щитовидной железы при синдроме нетиреоидных заболеваний и обоснование методов его коррекции.
Задачи исследования:
- Изучить морфологические проявления секреторной деятельности фолликулярных клеток щитовидной железы при развитии синдрома нетиреоидных заболеваний, обусловленного острым грамотрицательным бактериальным эндотоксикозом, вызванным введением липополисахарида E. coli.
- Провести биохимический анализ изменений тиреоидного статуса в разные сроки после введения липополисахарида и изучить зависимость между изменениями концентраций гормонов и эндотоксина в сыворотке крови.
- Оценить изменения концентрации основных провоспалительных и иммунорегуляторных цитокинов в сыворотке крови и культуральной среде клеток селезенки в разные сроки после введения липополисахарида во взаимосвязи с изменениями концентрации тиреоидных и тиреотропного гормонов.
- Изучить морфологические проявления секреторной деятельности фолликулярных клеток щитовидной железы при регрессе синдрома нетиреоидных заболеваний и их особенности в зависимости от выраженности реакций иммунной системы.
- На основании полученных данных об изменениях секреторной деятельности щитовидной железы при остром грамотрицательном эндотоксикозе обосновать методологические подходы к коррекции синдрома нетиреоидных заболеваний.
- Исследовать морфологические проявления секреторной деятельности щитовидной железы при коррекции синдрома нетиреоидных заболеваний.
- Изучить цитофизиологические характеристики тучных клеток щитовидной железы и способы выделения ими секреторного материала в разные сроки развития экспериментального синдрома нетиреоидных заболеваний и при его коррекции.
- Изучить биохимические показатели тиреоидного статуса при коррекции экспериментального синдрома нетиреоидных заболеваний.
- Изучить изменения концентрации эндотоксина, провоспалительных и иммунорегуляторных цитокинов и активности индикаторных, экскреторных и секреторных ферментов печени в сыворотке крови и морфологические изменения печени при коррекции экспериментального синдрома нетиреоидных заболеваний.
Научная новизна:
Впервые установлено, что наряду с центральным существует периферический механизм развития синдрома нетиреоидных заболеваний при остром грамотрицательном бактериальном эндотоксикозе. Периферический механизм заключается в разобщающем действии липополисахарида на фазы секреторного цикла фолликулярных тироцитов и проявляется усилением синтеза тиреоглобулина и его депонирования в полости фолликулов, и снижением его резорбции и расщепления лизосомами.
Впервые охарактеризованы структурные изменения фолликулярных тироцитов крыс при развитии и регрессе синдрома нетиреоидных заболеваний, обусловленного острым грамотрицательным бактериальным эндотоксикозом. Ранние сроки развития синдрома нетиреоидных заболеваний характеризуются усилением синтетических процессов в фолликулярных клетках, слабой выраженностью резорбции и расщепления тиреоглобулина в периферической зоне долей и признаками неэффективной резорбции в центральной зоне долей щитовидной железы. На более поздних сроках появляются деструкция митохондрий с последующим усилением лизосомальной реакции, признаки макропиноцитоза коллоида. Регресс синдрома нетиреоидных заболеваний морфологически характеризуется усилением и синхронизацией процессов синтеза, резорбции и расщепления тиреоглобулина лизосомами фолликулярных тироцитов.
Впервые выявлены индивидуальные особенности морфологических проявлений секреторных процессов в щитовидной железе в зависимости от выраженности реакций иммунной системы и характеризующиеся различными размерами фолликулов и скоростью процессов резорбции тиреоглобулина фолликулярными тироцитами.
Установлен и охарактеризован молекулярный способ выделения секреторного материала тучными клетками щитовидной железы при воздействии липополисахарида.
Впервые обнаружена обратная зависимость между содержанием эндотоксина и тиреоидных гормонов в сыворотке крови при остром грамотрицательном бактериальном эндотоксикозе, что указывает на важную роль эндотоксина грамотрицательных бактерий в регуляции функций щитовидной железы. Доказано, что патогномоничным симпотомом синдрома нетиреоидных заболеваний при остром грамотрицательном эндотоксикозе является снижение концентрации тироксина в сыворотке крови, а не трийодтиронина, как считалось ранее.
Разработан и патогенетически обоснован эффективный подход к коррекции синдрома нетиреоидных заболеваний при остром грамотрицательном бактериальном эндотоксикозе, основанный на введении супрафизиологической дозы тиреотропного гормона Установлено, что ТТГ оказывает иммуномодулирующее и гепатотропное действие.
Практическая значимость:
Полученные в эксперименте данные о морфологических и функциональных изменениях щитовидной железы, печени, цитокинового профиля, при развитии синдрома нетиреоидных заболеваний и его коррекции тиреотропным гормоном могут быть рекомендованы для разработки новых и совершенствования существующих методов лечения тяжелых форм инфекционно-воспалительных заболеваний, вызванных грамотрицательными бактериями, включая эндотоксиновый бактериальный шок.
Полученные новые данные о наличии периферического внегипофизарного механизма регуляции секреторных процессов в клетках щитовидной железы, о роли эндотоксина в регуляции активности фолликулярных тироцитов и о взаимосвязи выраженности иммунного ответа организма и активности щитовидной железы открывают новые направления в разработке подходов к оценке тяжести состояния больных с инфекционно-воспалительными заболеваниями, сопровождающимися эндотоксинемией.
При морфологической оценке функциональной активности щитовидной железы необходимо учитывать, что известные морфологические критерии повышенной функциональной активности (увеличение высоты фолликулярных тироцитов, размеров их ядер, появление ШИК-положительных включений в цитоплазме фолликулярных тироцитов) могут наблюдаться и при пониженной продукции тиреоидных гормонов.
Внедрение результатов исследования. Результаты диссертационной работы внедрены в учебный процесс на кафедре гистологии, цитологии, эмбриологии ГОУ ВПО Российский университет дружбы народов и кафедре биологической химии лечебного факультета ГОУ ВПО Российский медицинский государственный университет Росздрава.
Положения, выносимые на защиту:
- В развитии синдрома нетиреоидных заболеваний при остром грамотрицательном бактериальном эндотоксикозе принимают участие периферический и центральный механизмы, заключающиеся, соответственно, в нарушении секреторной деятельности фолликулярных тироцитов под воздействием липополисахарида и снижении секреции тиреотропного гормона гипофизом.
- Липополисахарид оказывает на щитовидную железу амбивалентное действие, являясь с одной стороны активатором фазы синтеза, а с другой, ингибитором фазы резорбции и расщепления тироглобулина в фолликулярных тироцитах, и играет ведущую роль в развитии синдрома нетиреоидных заболеваний при остром грамотрицательном эндотоксикозе. Сочетание воздействия липополисахарида с дефицитом тиреотропного гормона характеризуется возникновением разнонаправленных морфодинамических процессов в периферической и центральной зонах долей щитовидной железы и большей сбалансированностью процессов синтеза, выделения и резорбции тиреоглобулина в центральной зоне по сравнению с периферической зоной долей щитовидной железы. Регресс синдрома нетиреоидных заболеваний характеризуется уменьшением размеров фолликулов и восстановлением баланса между фазами секреторного цикла фолликулярных тироцитов.
- Выраженность поляризации иммунного ответа по Th1 типу влияет на темпы присоединения центрального механизма развития синдрома нетиреоидных заболеваний к периферическому, что объясняет наличие различных вариантов синдрома нетиреоидных заболеваний с повышенным и пониженным уровнем тиреотропного гормона в сыворотке крови.
- Тучные клетки щитовидной железы при воздействии липополисахарида усиливают выделение секреторного материала преимущественно молекулярным способом. Развитие системного воспалительного ответа приводит к усилению выделения секреторного материала тучными клетками как молекулярным способом, так и путем экзоцитоза содержимого секреторных гранул.
- Введение тиреотропного гормона в супрафизиологических дозах обеспечивает восстановление процессов резорбции и расщепления тиреоглобулина в фолликулярных тироцитах, повышает содержание связанных, а затем и свободных фракций тиреоидных гормонов в сыворотке крови, оказывает иммуномодулирующее и гепатотропное действие.
Апробация работы: Материалы диссертации доложены и обсуждены на научно-практической конференции «Актуальные вопросы клинической и экспериментальной медицины» (Санкт-Петербург, 2008г.), III cъезде Российского общества патологоанатомов (Самара, 2009г.), международной научной конференции молодых ученых «Молодежь в науке-2009» (Минск, Беларусь, 2009г.), конференции «Актуальные вопросы морфогенеза в норме и патологии» (Москва, 2010г.), XVII Российском национальном конгрессе «Человек и лекарство» (Москва, 2010г.), XVIII международной конференции «Новые информационные технологии в медицине, биологии, фармакологии и экологии» (Ялта, Украина, 2010г.), VIII Всероссийской конференции «Патология клетки» (Москва, 2010г.), межлабораторной конференции НИИ морфологии человека РАМН (ноябрь 2010г.)
Публикации: По теме диссертации опубликовано 20 работ, из них 12 статей в журналах, рекомендованных ВАК РФ.
Структура и объем диссертации. Диссертационная работа изложена на 398 страницах машинописного текста и состоит из введения, обзора литературы, описания материалов и методов, результатов собственных исследований, обсуждения полученных результатов, заключения и выводов. Работа иллюстрирована 267 рисунками и 63 таблицами. Список литературы включает 246 источников, из них 26 отечественных и 220 зарубежных.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на 176 самцах крыс Вистар массой тела 200-220гг. Крысы содержались в стандартных условиях вивария, получали стандартный рацион питания и воду ad libitum.
Острый грамотрицательный бактериальный эндотоксикоз вызывали однократным внутрибрюшинным введением 74 крысам ЛПС E.coli штамм 026:В6 (“Sigma”, США) в дозе 10 мг/кг массы тела. Крысам контрольной группы (n=43) вводили физиологический раствор. После введения ЛПС крыс разделили на две подгруппы: для изучения проявлений СНТЗ – группа ЛПС (n=43) и для коррекции СНТЗ – группа ЛПС+ТТГ (n=31). Животных подгруппы ЛПС выводили из эксперимента через 1, 3, 6, 12, 24, 27, 30, 36, 48 и 72ч после введения ЛПС одновременно с животными контрольной группы. Животным подгруппы ЛПС+ТТГ через сутки после введения ЛПС однократно вводили внутрибрюшинно ТТГ (“Sigma”, США) в дозе 0,01 МЕ/кг массы тела. Крыс подгруппы ЛПС+ТТГ выводили из эксперимента через 1, 3, 6, 12, 24 и 48ч после введения ТТГ, что соответствует 25, 27, 30, 36, 48 и 72ч после введения ЛПС. Для сравнения использовали группу крыс, получавших только ТТГ в аналогичной дозе (n=29).
Для изучения индивидуальных различий в развитии и регрессе СНТЗ при остром эндотоксикозе 30 крысам вводили ЛПС E.coli внутрибрюшинно в сублетальной дозе 20мг/кг массы тела. Животных выводили из эксперимента через 1 и 7сут после введения ЛПС. Умерщвление животных проводили передозировкой золетила (“Virbac Sante Animale”, Франция), вводимого внутримышечно в дозе 50мг/кг. Эксперимент проведен в соответствии с правилами проведения работ с использованием экспериментальных животных, утвержденными приказом Минздрава СССР № 577 от 12.08.1977г. На проведение эксперимента получено разрешение этического комитета НИИ морфологии человека РАМН (протокол №5 от 12.02.2007г.).
Печень и одну долю ЩЖ фиксировали в жидкости Буэна, заливали в парафин и изготавливали гистологические срезы, которые окрашивали гематоксилином и эозином (“Biovitrum”, Россия). Гистологические срезы ЩЖ также окрашивали 1% раствором толуидинового синего рН 2,0 (“Sigma”, США), проводили ШИК-реакцию. Срезы печени окрашивали по С.П. Шуенинову для элективного выявления фибрина.
Для определения размеров структур использовали двумерные и одномерные исследования гистологических препаратов ЩЖ с помощью морфометрических программ “Image Scope M” (“Leica mycrosystems CMS Gmbh”, Австрия) и “Image ProPlus” (“Carl Zeiss”, Германия). Выбор изучаемых параметров проводили на основе анализа отечественных и зарубежных литературных данных (Хмельницкий О.К., 2002; Hartoft-Nielsen M., 2006). Исследование проводили с учетом региональных различий строения ЩЖ по отдельности в периферической (верхняя и нижняя трети долей) и центральной (средняя треть долей) зонах долей ЩЖ. В препаратах ЩЖ определяли размеры фолликулов, долю эпителия в фолликулах, площадь коллоида в срезах фолликулов, долю коллоида в полости фолликулов, индекс Брауна (индекс накопления коллоида), высоту фолликулярных тироцитов и площадь срезов их ядер.
Вторую долю ЩЖ фиксировали в 2,5% растворе глутаральдегида (“Fluka”, Швейцария) с постфиксацией в 1% растворе OsO4 (“Fluka”, Швейцария). Контрастирование проводили 2,5% спиртовым раствором (70 этиловый спирт) уранила ацетата (“Fluka”, Швейцария). Подготовленные кусочки заливали в смесь смол Эпона и Аралдита М (“Fluka”, Швейцария). Полутонкие срезы окрашивали азуром II и эозином. Ультратонкие срезы дополнительно контрастировали солями свинца по Рейнольдсу (Уикли Б., 1975г.). Изучение препаратов проводили на трансмиссионном электронном микроскопе “Libra 120” с автоматическим сканированием изображений (“Carl Zeiss”, Германия).
Анализ популяции тучных клеток ЩЖ проводили в гистологических препаратах, окрашенных толуидиновым синим. По методике Д.П. Линднер с соавт. (1980) определяли количество ТК в мм2 площади среза, цитограмму, ИД и соотношение степеней дегрануляции. Для определения насыщенности ТК секреторным материалом использовали вычисление СГК.
Для оценки цитокинового профиля выделяли клетки селезенки с помощью стеклянного гомогенизатора Поттера. Для индукции синтеза и секреции цитокинов суспензию клеток селезёнки в количестве 106/мл культивировали 24ч в 1 мл полной растворной среды с добавлением конканавалина А (“Sigma”, США) в конечной концентрации 5 мкг/мл при 37°С в атмосфере 5% СО2. По окончании инкубации отбирали супернатант.
Определение концентрации Т4, Т3, сТ4, сТ3, ТТГ, кортикостерона, ФНО-, ИЛ-2, ИЛ-4, ИЛ-12, ИНФ-, неоптерина в сыворотке крови крыс и ФНО-, ИЛ-2, ИЛ-4, ИЛ-10, ИЛ-12 и ИНФ- в культуральной среде клеток селезенки проводили методом твердофазного иммуноферментного анализа на основе моноклональных антител с помощью коммерческих наборов (“Monodind”, “Biosource”, Invitrogen Corp.,. “Assay Design”,США, “Bender MedSystems”, Австрия, США, “IBL”, Германия). Определение оптической плотности исследуемых образцов, стандартов и контролей проводили с помощью микропланшетного ридера “Anthos 2010” (“ANTHOS Labtec Instruments”, Gmbh, Австрия).
С целью оценки тяжести поражения печени в сыворотке крови определяли активность индикаторных ферментов АлАТ (КФ 2.6.1.2) и АсАТ (КФ 2.6.1.1), экскреторного фермента ГГТ (КФ 2.3.2.2), секреторного фермента холинэстеразы (КФ 3.1.1.8). Использовали наборы реактивов “DiaSys” (“Diagnostic Systems Gmbh, Германия).
Для определения активности АсАТ и АлАТ в сыворотке крови использовали оптимизированный ультрафиолетовый тест, ГГТ - кинетический фотометрический тест в соответствии с методикой Зейца/Персиджина (Persijin J., 1976), холинэстеразы бутирилхолиновым методом - кинетический фотометрический тест в соответствии с рекомендациями Международной федерации клинической химии и лабораторной медицины (Schumann G., 2002г.). Определение активности ферментов в сыворотке крови проводили с помощью биохимического анализатора “RAL Clima MC-15” (Испания).
Количественное определение эндотоксина в сыворотке крови проводили по конечной точке в реакции ферментативного расщепления п-нитроанилина при 405нм с помощью коммерческого набора LAL (Limulus Amebocyte Lysate)–test (“Hycult Biotech”, США).
Статистическую обработку проводили с помощью пакета прикладных программ STATISTICA (“Statsoft Inc.”, США). Центральные тенденции и рассеяния количественных признаков описывали средним значением М и стандартной ошибкой среднего значения m, а также с помощью медианы Ме и интерквартильного размаха в зависимости от вида распределения. Сравнение независимых групп по количественному признаку проводили с помощью t-критериев Стьюдента и Манна-Уитни. Для анализа корреляции признаков использовали критерий Спирмена. Кластерный анализ проводили по 23 признакам с использованием Ward’s method. В связи с множественностью проводимых сравнений был принят более жесткий уровень статистической значимости-0,01.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Введение ЛПС в дозе 10мг/кг приводило к развитию острого грамотрицательного эндотоксикоза, сопровождающегося поляризацией иммунного ответа по Th1 типу. В сыворотке крови повышалась концентрация ФНО-, ИЛ-12, вызывающего дифференцировку Th0 лимфоцитов в Th1, а затем основных Th1 цитокинов ИЛ-2 и ИНФ-, а также неоптерина, являющегося интегральным показателем иммунного ответа по Th1 типу. Развитие системного воспалительного ответа приводило к поражению внутренних органов, в первую очередь печени. Динамическое исследование в сыворотке крови активности АлАТ, АсАТ, ГГТ и холинэстеразы и гистологическое исследование печени выявило через 24ч после введения ЛПС развитие дистрофических изменений, признаки внутрипеченочного холестаза, снижение секреторной активности гепатоцитов, увеличение количества нейтрофилов, лимфоцитов в печени, признаки ДВС-синдрома.
Изменения концентрации тиреоидных гормонов и ТТГ в зависимости от уровня эндотоксинемии
Изменения уровня эндотоксина в сыворотке крови носили двухфазный характер (рис.1). Первый пик, наблюдаемый через 1ч после введения ЛПС, был связан с поступлением его в кровеносное русло, а второй, через 24ч после введения ЛПС, с развитием системного воспалительного ответа.
Изучение изменений концентрации тиреоидных гормонов и ТТГ в разные сроки после введения ЛПС показало обратную зависимость между уровнем эндотоксинемии и концентрациями Т4 и Т3, нарастающую с развитием системного воспалительного ответа (R=-0,52 и R=-0,57, р<0,01, соответственно). Через 1ч после введения ЛПС наблюдалось снижение концентрации Т4 в сыворотке крови и повышение концентрации ТТГ по принципу обратной связи (рис.1). Развитие системного воспалительного ответа приводило к повторному снижению концентрации Т4, а также сТ4, сопровождавшемуся уменьшением содержания ТТГ в сыворотке крови.
Таким образом, в развитии СНТЗ прослеживалось два последовательно включающихся механизма. Периферический механизм был обусловлен непосредственным воздействием ЛПС на фолликулярные тироциты, приводящим к снижению продукции Т4. Центральный механизм был обусловлен снижением продукции ТТГ гипофизом на фоне системного воспалительного ответа. Увеличение концентрации ТТГ при повышенном уровне эндотоксина в сыворотке крови не приводило к восстановлению функциональной активности щитовидной железы и повышению концентрации тиреоидных гормонов в сыворотки крови. Регресс СНТЗ происходил только после снижения уровня эндотоксина в крови, что указывает на ключевую роль действия ЛПС на фолликулярные тироциты. Полученные данные позволяют опровергнуть имеющуюся точку зрения ряда авторов (De Groot L., 2003; Boelen A. et al., 2004; De Groot L., 2006) о том, что СНТЗ является исключительно следствием снижения функциональной активности центрального звена гипоталамо-гипофизарно-тиреоидной оси и неспецифической реакцией, не зависящей от причины основного заболевания.

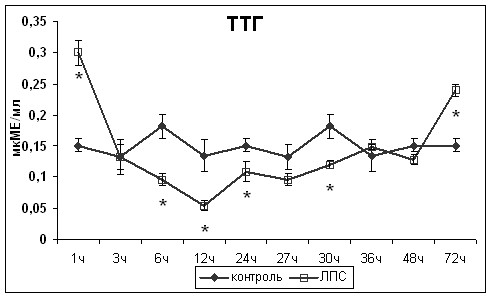



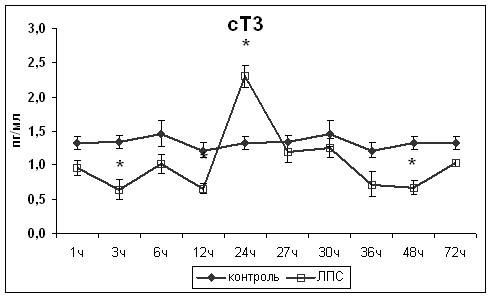
Рис.1. Изменения уровня эндотоксинемии и концентрации Т4, сТ4, Т3, сТ3 и ТТГ. * - статистически значимые отличия от значений контрольной группы
Морфофункциональные изменения щитовидной железы в разные сроки после введения ЛПС
Ранняя стадия развития СНТЗ (через 1 час после введения ЛПС) развивалась по периферическому механизму и морфологически проявлялась увеличением размеров фолликулов щитовидной железы и высоты фолликулярных тироцитов и размеров их ядер (рис.2,3), уменьшением десквамации фолликулярного эпителия, более выраженными в периферической зоне долей, и усилением синтетических процессов в фолликулярных тироцитах, проявляющихся расширением канальцев ЭПС, цистерн комплекса Гольджи, увеличением количества секреторных гранул, а также отсутствием признаков резорбции и расщепления тиреоглобулина в виде коллоидных капель в цитоплазме и их контакта с лизосомами, значительным уменьшением количества лизосом в периферической зоне долей ЩЖ по сравнению с контрольной группой. Изменения в центральной зоне долей ЩЖ свидетельствовали также о разобщении процессов резорбции и расщепления тиреоглобулина, что позволило выделить такое нарушение секреторной деятельности фолликулярных тироцитов как неэффективная резорбция – накопление множественных коллоидных капель в цитоплазме фолликулярных тироцитов, их слияние, образование крупных коллоидных капель и отсутствие их контакта с лизосомами.
Таким образом, ЛПС оказывает на ЩЖ амбивалентное действие, являясь активатором фазы синтеза и ингибитором фазы резорбции и расщепления тиреоглобулина в фолликулярных тироцитах, то есть вызывает десинхронизацию фаз секреторного цикла фолликулярных тироцитов, приводящую к уменьшению продукции ими основного гормона ЩЖ – Т4.
Через 3ч после введения ЛПС уровень эндотоксинемии снизился. Морфологические изменения ЩЖ свидетельствовали об усиленной синтетической деятельности фолликулярных тироцитов, но менее выраженной по сравнению с предыдущим сроком исследования. Растяжение фолликулов уменьшилось, о чем свидетельствует и уменьшение размеров фолликулов и снижение индекса Брауна. Уменьшилось количество коллоидных капель в цитоплазме фолликулярных тироцитов центральной зоны долей, что свидетельствует об утилизации резорбированного тиреоглобулина. Таким образом, через 3ч после введения ЛПС наблюдалась относительная нормализация секреторных процессов в фолликулярных тироцитах.
Через 6ч после введения ЛПС появились первые признаки усиления синхронизации процессов синтеза и резорбции тиреоглобулина (наличие мелких коллоидных капель в цитоплазме). Тем не менее, синтетические процессы преобладали над резорбционными.



Рис.2. Изменение морфометрических показателей периферической зоны долей щитовидной железы в разные сроки после введения ЛПС. * - статистически значимые отличия от значений контрольной группы.
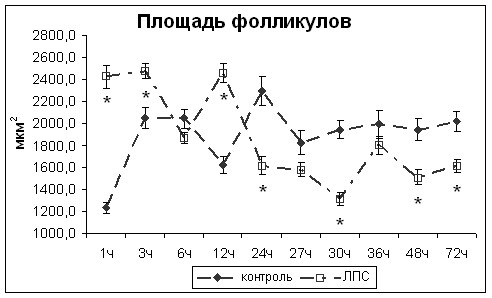


Рис.3. Изменение морфометрических показателей центральной зоны долей щитовидной железы в разные сроки после введения ЛПС. * - статистически значимые отличия от значений контрольной группы
Присоединение через 24ч после введения ЛПС центрального механизма развития СНТЗ к периферическому морфологически проявлялось разнонаправленностью морфодинамических процессов в периферической и центральной зонах долей ЩЖ. В периферической зоне сохранялись крупные размеры фолликулов, наблюдалось снижение высоты фолликулярных тироцитов (рис.2). В центральной же зоне отмечалось уменьшение размеров фолликулов и высоты фолликулярных тироцитов (рис.3). Наблюдались нарушения микроциркуляции в виде сладжей и стазов форменных элементов. Наблюдалось набухание и гибель митохондрий, усиление лизосомальной реакции. Процессы синтеза протекали активно. Несмотря на усиление лизосомальной реакции, наблюдалось скопление резорбированного коллоида в клетках центральной зоны долей.
Через 27ч после введения ЛПС произошло уменьшение размеров фолликулов как в центральной, так и периферической зонах (рис.2,3). Активировались процессы резорбции тиреоглобулина. В цитоплазме фолликулярных тироцитов резко увеличилось количество коллоидных капель, хорошо выявляемых даже на светооптическом уровне при проведении ШИК-реакции. Увеличение количества и объёма коллоидных капель является следствием их слияния друг с другом, обусловленного уменьшением количества лизосом и резким снижением протеолиза их содержимого лизосомами.
Через 36ч после введения ЛПС по многим морфометрическим показателям ЩЖ крыс опытной группы не отличалась от ЩЖ крыс контрольной группы (рис.2,3). Процессы оформления и выведения секреторных гранул преобладали над синтетическими процессами, особенно в центральной зоне долей. В периферической зоне резко усилились резорбционные процессы. Наблюдался макропиноцитоз коллоида — явление, описанное у крыс при стимуляции ЩЖ большими дозами ТТГ (Алешин Б.В. с соавт., 1983). В данном случае макропиноцитоз коллоида происходил при концентрации ТТГ в сыворотке крови, соответствующей значениям контрольной группы. Количество лизосом оставалось чрезвычайно низким. Наблюдалось выведение резорбированного коллоида через базолатеральную мембрану в межклеточную щель.
Через 48ч после введения ЛПС отмечалось усиление синтетической активности фолликулярных тироцитов, особенно выраженное в периферической зоне. Наряду с синтезом тиреоглобулина увеличилось количество незрелых лизосом. В фолликулярных тироцитах появились небольшие по размеру митохондрии без признаков функциональных изменений, что свидетельствует об уменьшении гипоксии и нормализации процессов клеточного дыхания.
Морфологическими проявлениями регресса СНТЗ, наблюдавшиеся через 72ч после введения ЛПС, были уменьшение размеров фолликулов ЩЖ (рис.2,3), усиление синтетической и резорбционной активности ее тироцитов как в центральной, так и периферической зонах, восстановление баланса между синтезом тиреоглобулина, его выделением в полость фолликулов и резорбцией с последующим внутриклеточным расщеплением лизосомами.
Анализ структурных изменений ЩЖ и ультраструктуры фолликулярных тироцитов не позволяет согласиться с мнением, что морфологическим проявлением СНТЗ является уменьшение размеров фолликулов и доли коллоида в полости фолликулов (De Jongh F. et al., 2001), а также с выделением и трактовкой некоторых морфологических критериев функциональной активности ЩЖ (Хмельницкий О.К., 2002). Такие признаки повышения функциональной активности ЩЖ как увеличение высоты фолликулярных тироцитов, размеров их ядер, наличие крупных коллоидных капель в цитоплазме наблюдаются и при снижении продукции гормонов щитовидной железой, так как отражают превалирование отдельных фаз секреторного цикла фолликулярных тироцитов. Как показали данные настоящего исследования, нарушения функциональной деятельности фолликулярных тироцитов могут происходить не только в связи с усилением или снижением секреторной активности клеток, но и за счет десинхронизации отдельных фаз секреторного цикла. Для установления повышенной функциональной активности ЩЖ необходимо выявление синхронизированного усиления всех фаз секреторного цикла, что не всегда возможно, если исследование проводится только методами световой микроскопии.
Особенности изменения концентрации тиреоидных гормонов при СНТЗ, обусловленном острым эндотоксикозом
Изучение изменений концентраций Т4 и Т3 в сыворотке крови показали, что ведущим признаком СНТЗ при остром грамотрицательном эндотоксикозе является снижение концентрации не Т3, как считалось ранее (Chopra I. et al., 1985; Docter R. et al., 1993; Joosten K. et al., 2000) а Т4. Эти данные позволяют опровергнуть сложившееся представление об универсальности изменений тиреоидного статуса при СНТЗ, обусловленных различными заболеваниями (Adler S. et al., 2007; Warner M. et al., 2010). При динамическом изучении тиреоидного статуса, установлено, что снижение продукции Т4 при системном воспалительном ответе, вызванном липополисахаридом, сопровождается сначала увеличением конвертации Т4 вТ3, а затем, по мере снижения продукции Т3 – усилением резорбции тиреоглобулина тироцитами путем макропиноцитоза, что является компенсаторными механизмами, направленными на нормализацию тиреоидного статуса.
Индивидуальные особенности реакций иммунной системы, морфофункциональных изменений ЩЖ и тиреоидного статуса при воздействиии ЛПС
Для исследования индивидуальных особенностей крысам вводили сублетальную дозу ЛПС. Исследование развития и регресса СНТЗ проводили через 1 и 7сут после введения ЛПС. По результатам кластерного анализа было выявлено два кластера, отличающихся по содержанию эндотоксина, концентрации провоспалительных и Th1 цитокинов в сыворотке крови крыс и культуральной среде клеток селезенки (рис.4), тиреоидных гормонов и ТТГ в сыворотке крови (рис.5), ряду морфометрических показателей.
Изучение взаимосвязей между выраженностью проявлений СНТЗ и реакций иммунной системы позволило объяснить формирование двух описанных ранее в научной литературе форм СНТЗ с пониженным и повышенным уровнем ТТГ в сыворотке крови (Adler S. et al., 2007; Warner M. et al., 2010). Исследование показало, что при более выраженной поляризации иммунного ответа по Тh1 типу, проявляющейся более высокими концентрациями провоспалительных и Th1 цитокинов центральные механизмы развития СНТЗ включаются в более поздние сроки, о чем свидетельствует повышенный уровень ТТГ в крови в сочетании со сниженным содержанием тиреоидных гормонов. При менее выраженной поляризации иммунного ответа по Тh1 типу центральные механизмы развития СНТЗ включаются в более ранние сроки и характеризуются снижением ТТГ на фоне пониженных значений тиреоидных гормонов в крови.


Рис.4. Индивидуальные различия концентрации провоспалительных и Th1 цитокинов в сыворотке крови (слева) и культуральной среде клеток селезенки (справа) через 1сут после введения ЛПС. Значения контрольной группы приняты за единицу. *- статистически значимые различия между кластерами
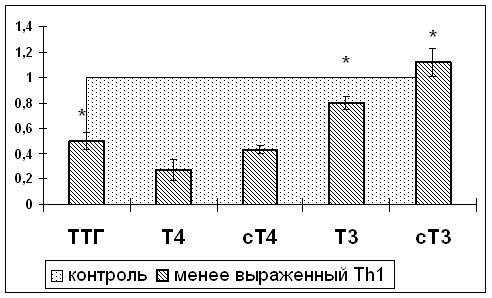

Рис.5. Различия показателей тиреоидного статуса через 1сут после введения ЛПС в зависимости от выраженности поляризации иммунного ответа по Th1 типу. Значения контрольной группы приняты за единицу. *- статистически значимые различия между кластерами
У крыс с более выраженной поляризацией иммунного ответа по Тh1 типу размеры фолликулов были меньше, отмечалось преобладание процессов синтеза тиреоглобулина над его резорбцией (расширение канальцев, увеличение цистерн комплекса Гольджи, формирование и накопление секреторных гранул, отсутствие коллоидных капель в цитоплазме). У крыс с менее выраженной поляризацией иммунного ответа по Тh1типу наблюдаются увеличение размеров фолликулов как в центральной, так и периферической зонах долей ЩЖ, а также выраженные проявления неэффективной резорбции тиреоглобулина (скопление большого числа коллоидных капель в цитоплазме фолликулярных тироцитов, не контактирующих с единичными лизосомами).
Степень выраженности иммунного ответа по Th1 типу определяла морфологические и функциональные особенности регресса СНТЗ. У крыс с менее выраженной поляризацией иммунного ответа по Тh1 типу концентрация ТТГ, Т3 и сТ3 в сыворотке крови была ниже, чем у крыс с более выраженной поляризацией иммунного ответа по Th1 типу, восстановление сбалансированности между процессами синтеза, резорбции и расщеплением тиреоглобулина развивалось преимущественно в центральной зоне щитовидной железы, а у крыс с более выраженной поляризацией по Тh1 – также и в периферической зоне, что объясняло различия в сроках восстановления тиреоидного статуса организма. Также у крыс с менее выраженной поляризацией иммунного ответа по Th1 типу медленнее восстанавливалась структура митохондрий.
Выявленные закономерности и особенности развития и регресса СНТЗ при остром грамотрицательном эндотоксикозе позволяют не согласиться с теорией о ведущей роли провоспалительных и Th1 цитокинов в снижении продукции ТТГ и развитии СНТЗ (Boelen A. et al., 1993, 1995, 2004, Rasmussen А., 2000). Резкое увеличение концентрации провоспалительных и Th1 цитокинов после введения ЛПС не приводило к снижению концентрации ТТГ в сыворотке крови. Кластерный анализ показал, что снижение секреции ТТГ гипофизом наиболее быстро происходило у крыс с низким уровнем Th1 цитокинов и более высоким уровнем эндотоксинемии.
Изучение механизмов развития СНТЗ и разобщающего действия ЛПС на фазы секреторного цикла фолликулярных тироцитов показывают, что коррекция синдрома с помощью препаратов тироксина и трийодтиронина, предлагаемая рядом авторов (Siegel N. et al., 1984; Brent G. et al., 1986; Chapital A. et al., 2001), является нецелесообразной и будет лишь способствовать усилению действия центрального механизма развития СНТЗ. Патогенетически обоснованным является введение вещества, синхронизирующего фазы секреторного цикла и в первую очередь усиливающего процессы резорбции и расщепления тиреоглобулина. Таковым является ТТГ. Но как показали данные исследования тиреоидного статуса восстановление уровня ТТГ в сыворотке крови до значений контрольной группы не приводило к усилению продукции гормонов, так как продолжал действовать периферический механизм. Следовательно, доза ТТГ должна быть супрафизиологической.
Морфофункциональные изменения щитовидной железы при остром грамотрицательном эндотоксикозе в разные сроки после введения тиреотропного гормона
Через 1ч после введения ТТГ крысам с острым эндотоксикозом морфологические изменения свидетельствовали об усилении процессов резорбции коллоида, в том числе и путем макропиноцитоза, и снижении лизосомальной реакции по сравнению с крысами, не получавшими ТТГ. Процессы синтеза и резорбции тиреоглобулина были сбалансированы и более выражены, а деструктивные изменения митохондрий менее выражены, чем у здоровых крыс после введения им аналогичной дозы ТТГ. В цитоплазме фолликулярных тироцитов наблюдались коллоидные капли, контактирующие с лизосомами. Усилилась десквамация фолликулярных тироцитов.
Через 3ч после введения ТТГ отмечалось улучшение микроциркуляции в органе. Процессы синтеза и резорбции были больше выражены в тироцитах периферической зоны долей. В периферической зоне происходила перестройка паренхимы, образование небольших фолликулов из более крупных. Наблюдались признаки усиления резорбции как микро-, так и макропиноцитозом, а также протеолиза тиреоглобулина. В клетках появились митохондрии без деструктивных изменений. Отмечалась активация клеток интерфолликулярного эпителия в виде усиление синтетических процессов.
Через 6ч после введения ТТГ в центральной зоне ЩЖ резко усилились процессы синтеза. Изучение ультраструктуры показало, что большинство фолликулярных тироцитов центральной зоны находилось в ранней стадии синтеза секрета, то есть до формирования секреторных гранул. Резорбированный коллоид расщеплялся лизосомами в основном в тироцитах периферической зоны долей. Выраженность синтетических процессов была выше, чем у крыс с эндотоксикозом, не получавшим ТТГ. Несмотря на то, что процессы резорбции тиреоглобулина были снижены по отношению к процессам его синтеза, тем не менее, они протекали боле активно, чем в группе сравнения.
Через 12ч после введения ТТГ в центральной зоне долей ЩЖ размеры фолликулов уменьшились. В фолликулярных тироцитах периферической зоны долей усилились процессы резорбции тиреоглобулина. Скорость процессов резорбции тиреоглобулина была ниже скорости его протеолиза, что приводило к накоплению коллоида в цитоплазме.
Через 24ч после введения ТТГ наблюдалась синхронизация деятельности фолликулярных тироцитов центральной и периферической зон долей. В периферической и центральной зонах долей ЩЖ синтетические процессы преобладали над резорбционными, что приводило к увеличению размеров фолликулов и накоплению в них коллоида. Выраженность синтетических процессов была выше, чем у крыс с эндотоксикозом, не получавших ТТГ.
Через 48ч после введения ТТГ отмечалась асинхронность функционирования фолликулярных тироцитов центральной и периферической зон долей ЩЖ. В периферической зоне во многих клетках отмечалось снижение интенсивности процессов синтеза и оформления секреторных гранул, а также протеолиза резорбированного тиреоглобулина. В центральной зоне процессы синтеза и резорбции протекали более активно. Однако фолликулярные тироциты центральной зоны функционировали асинхронно, то есть в одних клетках была выражена фаза синтеза секрета, а в других — как резорбции тиреоглобулина, так и его протеолиза. Процессы резорбции протекали как с помощью микропиноцитоза, так и макропиноцитоза. Наблюдались интенсивные процессы трансэндотелиального транспорта веществ. В структуре стенок фолликулов появились малодифференцированные клетки, что можно рассматривать как признак усиления процессов восстановления и обновления популяции фолликулярных тироцитов. Центральная зона была представлена более крупными фолликулами, выстланными тироцитами меньшей высоты с более базофильной цитоплазмой и меньшими по размеру ядрами, чем у крыс с острым эндотоксикозом, не получавших ТТГ. Доля коллоида в полости фолликулов была выше. В периферической зоне размеры фолликулов, высота тироцитов и размеры ядер были меньше, по сравнению со значениями группы с эндотоксикозом, не получавшей ТТГ. Содержание коллоида в фолликулах было более высоким. Малодифференцированные клетки в стенке фолликулов также не выявлялись. Процессы синтеза у крыс с острым эндотоксикозом были выражены сильнее, а процессы резорбции и протеолиза тиреоглобулина протекали боле активно у крыс, получавших ТТГ.
Таким образом, однократное введение супрафизиологической дозы ТТГ привело к синхронизации фаз секреторного цикла фолликулярных тироцитов, усиливало резорбцию как путем микро-, так и макропиноцитоза, и последующее расщепление тиреоглобулина лизосомами, а также синтетические процессы. Морфологические признаки наблюдаемых изменений были более выражены, чем у здоровых крыс после введения аналогичной дозы ТТГ.
Известно, что ТК играют важную роль в регуляции секреторной деятельности ЩЖ (Balboni G. et al., 1980; Kalisnik M. et al., 1988). Для изучения способов секреции тучных клеток ЩЖ при воздействии ЛПС было проведено их сравнительное исследование методами световой и электронной микроскопии у крыс контрольной группы, под воздействием ТТГ и при коррекции развившегося СНТЗ с помощью ТТГ.
Цитофизиологическая характеристика тучных клеток щитовидной железы при воздействии ЛПС
При изучении цитофизиологических характеристик ТК периферической и центральной зоны долей ЩЖ крыс контрольной группы не выявлено различий показателей численности ТК, их СГК и ИД. Суточные колебания численности ТК отсутствовали. Отмечалось снижение насыщенности ТК секреторным материалом в ночные часы. Дегрануляция ТК усиливалась в утренние и уменьшалась в ночные часы. Ультраструктура ТК в утренние часы характеризовалась высоким содержание секреторных гранул высокой и средней электронной плотности. В более поздние сроки появились везикулы по периферии гранул, затем участки оводнения гиалоплазмы вокруг гранул, диспергирование и растворение содержимого гранул.
Через 1ч после введения ЛПС количество выявляемых ТК в ЩЖ крыс статистически значимо не изменялось (рис. 6). Через 6ч после введения ЛПС количество ТК в ЩЖ резко увеличилось, достигнув максимальных значений, превышающих значения контрольной группы в 1,65 раза. При этом ТК часто располагались по периметру фолликулов. В дальнейшем наблюдалось уменьшение количества выявляемых ТК в единице площади среза. Отмечались выраженные изменения показателей цитограммы. Повысилось содержание очень светлых, светлых и темных ТК за счет резкого снижения процентного содержания очень темных ТК. Это указывает на то, что очень темные клетки вступали в фазу выделения секрета. Соответственно, значение СГК статистически значимо уменьшился в 1,4 раза (рис. 6). Под воздействием ЛПС произошли существенные изменения процессов дегрануляции ТК (рис. 6). Через 1ч после введения ЛПС выявлено снижение ИД приблизительно в 2,5 раза в периферической и в 3 раза в центральной зоне. В дальнейшем наблюдалось увеличение количества тучных клеток, накопление в них секреторного материала.
Изучение ультраструктуры ТК в разные сроки после введения ЛПС показало, что воздействие ЛПС усиливает выделение секреторного материала молекулярным способом, что проявлялось появлением, а затем усилением оводнения гиалоплазмы вокруг секреторных гранул, растворением содержимого секреторных гранул вплоть до образования гидропических вакуолей и выделением содержимого гранул в цитоплазму.



Рис.6. Изменения цитофизиологических характеристик тучных клеток щитовидной железы в разные сроки после введения ЛПС. * - статистически значимые отличия от значений контрольной группы
Цитофизиологическая характеристика тучных клеток щитовидной железы при воздействии тиреотропного гормона
Введение ТТГ крысам приводило к увеличению количества выявляемых ТК в ЩЖ в течение 48ч. Через 1ч после введения ТТГ ТК находились в стадии депонирования секреторного материала. Затем наблюдалось уменьшение насыщенности ТК секреторным материалом. Введение ТТГ резко изменило ритм выделения тучными клетками секреторного материала путем экзоцитоза содержимого гранул. Таким образом, после введения ТТГ наблюдалось уменьшение, а затем усиление выделения секреторного материала молекулярным способом, подтвержденное данными ультраструктурного исследования. Выделение секреторного материала характеризовалось появлением просветлений вокруг секреторных гранул в виде пузырьков, затем оводнением гиалоплазмы вокруг секреторных гранул, растворением их содержимого, вплоть до образования гидропических вакуолей. Через 48-72чч после введения ТТГ усиливались процессы синтеза и депонирования секрета.
Введение ТТГ через 24ч после ЛПС привело значительному увеличению количества выявляемых ТК в ЩЖ. Количество выявляемых ТК в единице площади среза было максимальным по отношению к другим опытным и контрольной группам. Наблюдались выраженные изменения в цитограмме, связанные с увеличением количества светлых ТК. Насыщенность ТК секреторным материалом была ниже, чем в других исследуемых группах, в течение всего срока исследования. Количество ТК, выделяющих секреторный материал путем дегрануляции, также было снижено. Изменения содержания СГК и ИД носили тот же характер, что и после введения ЛПС.
Последовательная стимуляция ТК сначала липополисахаридом, а затем ТТГ вызвала усиление выделения ими секреторного материала молекулярным способом. Наблюдался костимулирующий эффект действия ЛПС и ТТГ на процессы выделения секрета в течение 6ч. Также отмечалось снижение дегрануляции ТК. Характер динамики ИД совпадал с таковым под воздействием ЛПС, а его численные показатели – под воздействием ТТГ.
Таким образом, можно сделать вывод, что молекулярный способ является основным способом выделения секреторного материала из ТК как в норме, так и при системном воспалительном ответе.
Изменения концентрации гормонов щитовидной железы при коррекции экспериментального СНТЗ тиреотропным гормоном
Изменения тиреоидного статуса при остром грамотрицательном бактериальном эндотоксикозе после введения ТТГ характеризовались последовательным повышением концентрации в сыворотке крови сначала менее активного гормона – Т4, а затем более активного – Т3, а также созданием в крови депо гормонов в виде их связи с транспортными белками (рис. 7), что является наиболее благоприятной формой коррекции СНТЗ, так как это не приводит к резкому увеличению наиболее активных свободных форм гормонов.
Изменения концентрации гормонов ЩЖ после введения ТТГ при остром грамотрицательном эндотоксикозе качественно отличались от изменений, наблюдаемых после введения ТТГ в той же дозе здоровым крысам. Введение ТТГ здоровым животным приводило к повышению концентрации Т3, а не Т4. Увеличение концентрации Т4 у крыс с острым эндотоксикозом объясняется расщеплением депонированного в полости фолликулов большего количества тиреоглобулина, синтезированного под воздействием ТТГ.
Наблюдающееся после введения ТТГ увеличение концентрации преимущественно связанных с транспортными белками, а не свободных форм тиреоидных гормонов, свидетельствует об их нормальной связывающей способности и является косвенным подтверждением того, что снижение концентрации Т4 в сыворотке крови при развитии СНТЗ было обусловлено в первую очередь снижением его продукции щитовидной железой, а не снижением связывающей способности транспортных белков крови.

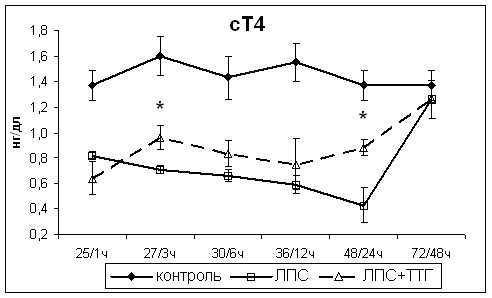



Рис.7. Изменения концентрации Т4, сТ4, Т3, сТ3 и ТТГ в сыворотке крови крыс с острым грамотрицательным эндотоксикозом после введения супрафизиологической дозы ТТГ. * - статистически значимые отличия от показателей крыс с острым эндотоксикозом, не получавших ТТГ
Полученные данные морфологического исследования ЩЖ и биохимических показателей ее активности позволяют опровергнуть точку зрения, высказываемую рядом исследователей (Mendel C. et al., 1991; Kaptein E., 1996; Janssen O. et al., 2002; Den Brinker M. et al., 2005) о ведущей роли нарушения связывающей способности транспортных белков крови в патогенезе СНТЗ.
Для оценки эффективности разработанного метода коррекции СНТЗ необходимо было провести изучение влияния супрафизиологической дозы ТТГ на уровень эндотоксинемии, изучить реакцию иммунной системы путем оценки изменения концентрации провоспалительных и иммунорегуляторных цитокинов в сыворотке крови, а также изучить влияние на основной орган-мишень эндотоксина – печень, путем определения активности в сыворотке крови индикаторных, экскреторных и секреторных ферментов и гистологического исследования печени.
Изменения уровня эндотоксинемии и концентрации цитокинов в сыворотке крови крыс при коррекции СНТЗ тиреотропным гормоном
После введения ТТГ отмечалось снижение уровня эндотоксинемии по сравнению со значениями крыс с острым эндотоксикозом, не получавших ТТГ (рис. 8). Введение ТТГ здоровым крысам также вызывало снижение содержания эндотоксина в сыворотке крови.
Введение ТТГ приводило к значительному снижению через 1и 3 чч в сыворотке крови провоспалительного цитокина ФНО-, Th1 цитокинов ИЛ-2 и ИНФ- как по отношению к значениям показателей крыс с острым эндотоксикозом, так и контрольной группы. В последующие часы наблюдалось увеличение концентраций вышеуказанных цитокинов, но их значения не превышали показатели контрольной группы, за исключением ИЛ-2, концентрация которого резко повысилась через 48ч после введения ТТГ (рис. 8). Концентрация неоптерина, являющегося интегральным показателем выраженности поляризации иммунного ответа по Th1 типу, не изменялась (рис. 8). Концентрация Th2 цитокина ИЛ-4 после введения ТТГ была чрезвычайно низкой, такой же как у крыс с острым эндотоксикозом, не получавших ТТГ. После введения ТТГ отмечалось повышение концентрации противовоспалительного иммунорегуляторного цитокина ТФР-, значения которого соответствовали значениям контрольной группы (рис. 8).
Таким образом, введение супрафизиологической дозы ТТГ оказывало иммуномодулирующее действие, снижая продукцию провоспалительных и Th1 цитокинов и повышая продукцию противовоспалительных цитокинов без уменьшения выраженности поляризации иммунного ответа по Th1 типу.
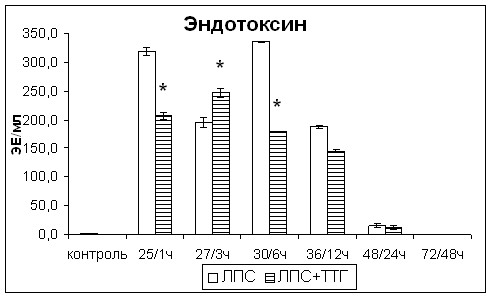


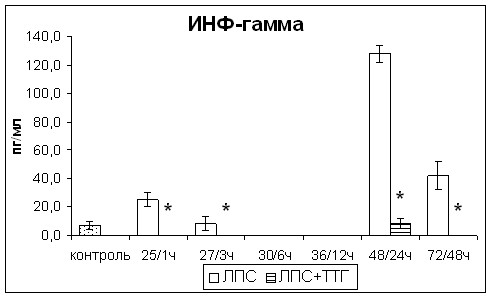
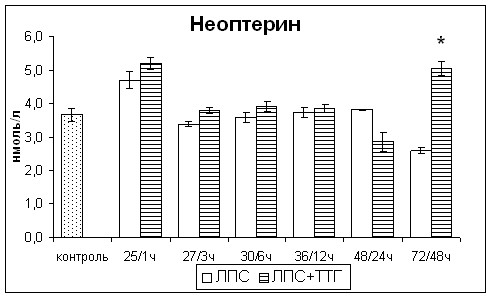

Рис. 8. Изменения уровня эндотоксинемии, концентрации провоспалительных и Th1 цитокинов, ТФР- в сыворотке крови крыс с острым эндотоксикозом после введения супрафизиологической дозы ТТГ. * - статистически значимые отличия от показателей крыс с острым эндотоксикозом, не получавших ТТГ.
Изменения активности индикаторных, экскреторных и секреторных ферментов в сыворотке крови крыс с острым эндотоксикозом в разные сроки после введения тиреотропного гормона
Введение ТТГ крысам через сутки после введения ЛПС приводило к снижению активности АлАТ в сыворотке крови (рис.9). Через 12ч после введения ТТГ наблюдалось однократное повышение активности АлАТ. Через 72ч после введения ЛПС активность АлАТ в сыворотке крови не отличалась от значений контрольной группы, в отличие от крыс с острым эндотоксикозом, не получавших ТТГ. Введение ТТГ также вызвало снижение активности АсАТ в сыворотке крови крыс, но через 48ч после введения ТТГ активность фермента повысилась по отношению к контрольным значениям и не отличалась от значений крыс с острым эндотоксикозом, не получавших ТТГ (рис.9).
После введения ТТГ крысам с острым эндотоксикозом активность ГГТ в сыворотке крови уменьшалась и значимо не отличалась от значений контрольной группы в течение всего исследуемого периода (рис.9).
После введения ТТГ крысам активность холинэстеразы в сыворотке крови повысилась по сравнению со значениями крыс с острым эндотоксикозом, не получавшим ТТГ, и не отличалась от значений контрольной группы (рис.9).

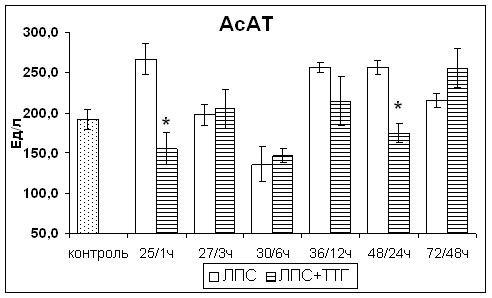
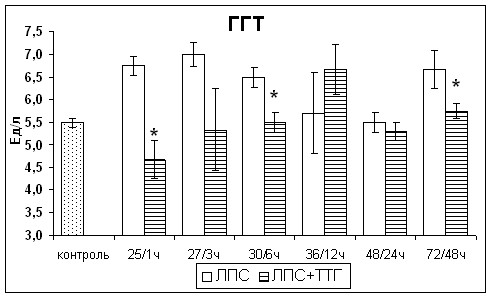

Рис. 9. Изменения активности индикаторных, экскреторных и секреторных ферментов печени крыс с острым эндотоксикозом после введения супрафизиологической дозы ТТГ. * - статистически значимые отличия от показателей крыс с острым эндотоксикозом, не получавших ТТГ
Морфологические изменения печени свидетельствовали об уменьшении выраженности дистрофических процессов в гепатоцитах и повышении их пролиферативной активности.
Таким образом, введение ТТГ оказывало гепатотропное действие, приводило к снижению выраженности дистрофических изменений и улучшению секреторной и экскреторной функции гепатоцитов.
ЗАКЛЮЧЕНИЕ
Проведенное экспериментальное исследование СНТЗ при остром грамотрицательном эндотоксикозе установило, что СНТЗ является не только универсальной реакцией ЩЖ на патологические процессы, протекающие в организме, но и может иметь характерные особенности, связанные с непосредственным воздействием на секреторные процессы в фолликулярных тироцитах. Повышение уровня эндотоксина в системном кровотоке приводит к выраженным изменениям секреторного цикла фолликулярных тироцитов, заключающимся в усилении синтеза и выделения тиреоглобулина в полость фолликулов и снижении скорости процессов резорбции и расщепления тиреоглобулина, то есть существует периферический механизм изменения функциональной активности ЩЖ, отличный от центрального, проявляющегося снижением скорости секреторных процессов в фолликулярных тироцитах (рис.10). Периферический механизм является ведущим в развитии СНТЗ. Присоединение центрального механизма определяется выраженностью поляризации иммунитета по Th1 типу. Наиболее быстро центральный механизм присоединяется к периферическому при менее выраженной поляризации иммунного ответа по Th1 типу. Этим объясняется наличие двух типов СНТЗ при тяжелых инфекционно-воспалительных заболеваниях с пониженным и повышенным уровнем ТТГ в сыворотке крови, описанных в научной литературе. Динамическое исследование изменений ЩЖ позволило выявить морфологические признаки СНТЗ на ранних и поздних стадиях его развития, свидетельствующие как о нарушениях секреторных процессов, так и компенсаторных изменениях, направленных на повышение продукции гормонов. Полученные данные позволили опровергнуть имеющуюся точку зрения, что СНТЗ начинается с нарушения превращения Т4 в Т3, и лишь по мере развития основного заболевания к снижению концентрации Т3 в сыворотке крови присоединяется снижение Т4.
Рис. 10. Схема развития и регресса СНТЗ при остром грамотрицательном эндотоксикозе и точки приложения коррегирующего воздействия ТТГ. Условные обозначения: Х – блокирование звеньев патогенеза СНТЗ тиреотропным гормоном
Выявленные нарушения секреторной активности фолликулярных тироцитов позволили разработать патогенетически обоснованный способ коррекции, заключающийся в усилении и синхронизации процессов синтеза, резорбции и расщепления тиреоглобулина с помощью супрафизиологической дозы ТТГ. Введение ТТГ привело к повышению концентрации связанного с сывороточными белками Т4 и Т3, опровергнув ранее существовавшую гипотезу о нарушении связывающей способности транспортных белков крови как одного из механизмов СНТЗ.
Выявлен иммуномодулирующий эффект ТТГ, связанный со снижением продукции провоспалительных и Th1 цитокинов, а также положительный эффект на морфофункциональные показатели печени (рис.10), что открывает новые потенциальные возможности для применения ТТГ при лечении воспалительных заболеваний, вызванных грамотрицательными микроорганизмами.
Исследование морфофункциональных изменений в различных зонах долей ЩЖ в норме, при воздействии ЛПС и ТТГ позволило получить новые данные о гетерофункциональности различных участков паренхимы ЩЖ. С учетом новых данных периферическую зону следует рассматривать как зону ритмичного функционирования, обеспечивающую базальную продукцию тиреоидных гормонов, а центральную — как зону экстренного реагирования, обеспечивающего функциональную секрецию гормонов. Исследование тучных клеток ЩЖ показало, что основным способом выделения ими секреторного материала при действии указанных факторов является молекулярный способ, в основе которого лежит растворение содержимого секреторных гранул и выведения его в цитоплазму.
Полученные данные расширяют представления о функционировании ЩЖ и роли гормонов гипофиза в обеспечении защитных реакций организма и их органотропном действии и дают новое направление исследованиям о роли различных биологически активных веществ, бактериальных антигенов в регуляции секреторной деятельности эндокринных желез, а также поиску новых эффективных методов коррекции дисфункций ЩЖ при различных соматических заболеваниях.
ВЫВОДЫ
- При остром грамотрицательном эндотоксикозе у крыс Вистар развивается синдром нетиреоидных заболеваний, характеризующийся нарушением секреторной деятельности фолликулярных клеток щитовидной железы и снижением концентрации тиреоидных гормонов в сыворотке крови. Выявленные закономерности изменений морфологических и биохимических показателей функционирования щитовидной железы вызваны периферическим и центральным механизмами, лежащими в основе нарушения секреторной деятельности фолликулярных тироцитов. Периферический механизм обусловлен непосредственным влиянием липополисахарида на секреторную деятельность фолликулярных тироцитов, а центральный – уменьшением на фоне системного воспалительного ответа продукции гипофизом тиреотропного гормона.
- Ранняя стадия развития синдрома нетиреоидных заболеваний обусловлена действием периферического механизма и морфологически проявляется усилением признаков синтетических процессов в фолликулярных тироцитах на фоне снижения или отсутствия признаков резорбции и расщепления лизосомами тиреоглобулина в периферической зоне долей, или неэффективной его резорбции фолликулярными тироцитами (накопление множественных коллоидных капель в цитоплазме фолликулярных тироцитов и отсутствие их контакта с лизосомами) в центральной зоне долей щитовидной железы, а также уменьшением десквамации фолликулярного эпителия.
- Присоединение к периферическому центрального механизма развития синдрома нетиреоидных заболеваний проявляется разнонаправленностью морфодинамических процессов в периферической и центральной зонах долей щитовидной железы. В периферической зоне наблюдается преобладание процессов синтеза тиреоглобулина над процессами его резорбции. В центральной же зоне отмечается относительная сбалансированность процессов синтеза и резорбции тиреоглобулина в фолликулярных тироцитах. Набухание и гибель митохондрий и усиление лизосомальной реакции в фолликулярных тироцитах наблюдается в обеих зонах щитовидной железы.
- Изменения концентрации тироксина и трийодтиронина имеют обратную зависимость от содержания эндотоксина в сыворотке крови. Снижение концентрации связанного с транспортными белками тироксина, а не трийодтиронина, является основным признаком синдрома нетиреоидных заболеваний при остром грамотрицательном эндотоксикозе. Низкий уровень тироксина обусловлен уменьшением его продукции щитовидной железой, а не снижением связывающей активности транспортных белков сыворотки крови. Уменьшение продукции тироксина щитовидной железой сопровождается увеличением образования трийодтиронина, а на поздних стадиях также и усилением резорбции тиреоглобулина тироцитами путем макропиноцитоза, что является компенсаторными механизмами, направленным на нормализацию тиреоидного статуса организма.
- Увеличение секреции ТТГ при повышенном уровне эндотоксина в сыворотке крови не приводит к восстановлению функциональной активности щитовидной железы и повышению концентрации тиреоидных гормонов в сыворотке крови. Регресс синдрома нетиреоидных заболеваний происходит только после снижения уровня эндотоксина в крови, что указывает на ключевую роль действия липополисахарида на продукцию гормонов фолликулярными тироцитами.
- Введение липополисахарида крысам приводит к изменению ряда биохимических показателей: повышению концентрации неоптерина в сыворотке крови и ФНО-, ИЛ-2, ИЛ-12 и интерферона- в культуральной среде клеток селезенки и сыворотке крови, что свидетельствует о поляризации иммунного ответа по Тh1 типу. При более выраженной продукции провоспалительных и Th1 цитокинов снижение секреции тиреотропного гормона (центральный механизм развития синдрома нетиреоидных заболеваний) происходит в более поздние сроки, о чем свидетельствует повышенный уровень ТТГ в крови в сочетании со сниженным содержанием тиреоидных гормонов. При менее выраженной продукции провоспалительных и Th1 цитокинов центральный механизм развития синдрома нетиреоидных заболеваний включается в более ранние сроки и характеризуются снижением ТТГ на фоне пониженных значений тиреоидных гормонов и более высокого уровня эндотоксина в сыворотке крови.
- Выявлены особенности морфологических изменений щитовидной железы при синдроме нетиреоидных заболеваний в зависимости от выраженности реакций иммунной системы. При более выраженной продукции Тh1 цитокинов наблюдаются меньшие размеры фолликулов и преобладание признаков синтеза тиреоглобулина над его резорбцией. При менее выраженной продукции Тh1 цитокинов наблюдаются более крупные размеры фолликулов, а также выраженные проявления неэффективной резорбции тиреоглобулина в центральной зоне долей щитовидной железы.
- Морфологическими проявлениями регресса синдрома нетиреоидных заболеваний является усиление синтетической и резорбционной активности фолликулярных тироцитов как в центральной, так и периферической зонах, восстановление баланса между синтезом тиреоглобулина, его выделением в полость фолликулов и резорбцией с последующим внутриклеточным расщеплением лизосомальными ферментами. У крыс с менее выраженной продукцией Тh1 цитокинов указанные процессы развиваются преимущественно в центральной зоне щитовидной железы, а у крыс с более выраженной продукцией Тh1 цитокинов – в центральной и периферической зоне, что определяет различия в сроках восстановления тиреоидного статуса организма.
- По морфометрическим данным изменения секреторной активности фолликулярных тироцитов периферической зоны долей щитовидной железы крыс как в условиях действия липополисахарида, так и у контрольных животных, более ритмичные и упорядоченные, по сравнению с центральной зоной. Это свидетельствует об участии периферической зоны долей щитовидной железы в обеспечении базальной секреции тиреоидных гормонов, а центральной – в адаптивной, в ответ на действие стрессорных факторов.
- При воздействии липополисахарида тучные клетки щитовидной железы крыс усиливают выделение секреторных продуктов молекулярным способом, что проявляется оводнением гиалоплазмы вокруг секреторных гранул, растворением их содержимого и последующим его выделением в цитоплазму. Развитие системного воспалительного ответа усиливает накопление секреторного материала в тучных клетках, а затем его выделение как дегрануляцией, так и молекулярным способом.
- Применение ТТГ в супрафизиологической дозе является патогенетически обоснованным и эффективным методом коррекции синдрома нетиреоидных заболеваний при остром бактериальном эндотоксикозе. Однократное введение ТТГ синхронизирует фазы секреторного цикла, усиливает резорбцию и расщепление тиреоглобулина, синтетические процессы в фолликулярных тироцитах, а также способствует обновлению их популяции.
- Введение ТТГ при остром грамотрицательном бактериальном эндотоксикозе приводит к последовательному повышению концентрации в сыворотке крови сначала менее активного гормона – тироксина, а затем более активного – трийодтиронина, а также к созданию в системном кровотоке депо гормонов в виде их связи с транспортными белками, что является наиболее благоприятной формой коррекции синдрома нетиреоидных заболеваний, так как не приводит к резкому увеличению наиболее активных свободных форм гормонов.
- Введение ТТГ при остром грамотрицательном бактериальном эндотоксикозе оказывает иммуномодулирующее действие, снижая синтез провоспалительных и Th1 цитокинов и повышая синтез иммунорегуляторного противовоспалительного трансформирующего фактора роста- в сыворотке крови. Тиретропный гормон также оказывает гепатотропное действие, проявляющееся снижением активности в сыворотке крови индикаторных и экскреторных и повышением активности секреторных ферментов и уменьшением выраженности дистрофических изменений гепатоцитов.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Cтатьи в журналах, рекомендованных ВАК РФ
- Яглова Н.В. Цитофизиологические особенности популяции тучных клеток щитовидной железы при воздействии липополисахарида. // Морфологические ведомости. – 2008. – №3-4. – С.94-98.
- Яглова Н.В., Яглов В.В., Березов Т.Т. Проблемы экспериментального моделирования гипо- и гипертиреоидных состояний. // Вестник РАМН. – 2009. – №3. – С.30-35.
- Яглова Н.В. Тучные клетки и врожденный иммунитет. // Иммунология. – 2009. – Т.30. – №2. – С.139-143.
- Яглова Н.В. Взаимосвязь функциональной активности щитовидной железы и уровня провоспалительных и иммунорегуляторных цитокинов при остром экспериментальном эндотоксикозе. // Бюллетень экспериментальной биологии и медицины. – 2009. – Т.49. – №6. – С.635-638.
- Яглова Н.В., Березов Т.Т. Роль поляризации иммунного ответа в развитии синдрома нетиреоидных заболеваний. // Вопросы биологической, медицинской и фармацевтической химии. – 2009. – №4. – С.17-20.
- Макарова О.В., Яблонская А.М., Михайлова Л.П., Яглова Н.В., Солдатов Д.И. Индивидуальные различия реакции органов-мишеней и иммунной системы при экспериментальном эндотоксикозе. // Архив патологии. – 2009. – №4. – С.37-43.
- Яглова Н.В. Морфофункциональный анализ развития синдрома нетиреоидных заболеваний при экспериментальном эндотоксикозе. // Бюллетень экспериментальной биологии и медицины. – 2009. – Т.148. – №11. – с.584-588.
- Яглова Н.В. Регуляторная роль липополисахарида в функциональной деятельности щитовидной железы и гипофиза. // Биомедицинская химия. – 2010. – Т.56. – №2. – С.179-186.
- Яглова Н.В., Березов Т.Т. Роль тиреотропного гормона в изменении гомонального и цитокинового профиля при экспериментальном синдроме нетиреоидных заболеваний. // Иммунология. – 2010. – Т.31. – №3. – С.146-151.
- Яглова Н.В. Роль эндотоксина грамотрицательных бактерий в механизмах регуляции тиреоидного статуса организма. // Вопросы питания. – 2010. – №3. – С.18-24.
- Яглова Н.В. Морфофункциональные изменения щитовидной железы крыс при остром экспериментальном эндотоксикозе. // Архив патологии. – 2010. – №3. – С.24-27.
- Яглова Н.В., Березов Т.Т. Синдром нетиреоидных заболеваний: современное состояние проблемы и перспективы ее изучения. // Владикавказский медико-биологический вестник. – 2010. – Т.10. – С.118-126.
Другие публикации
- Яглова Н.В. Гистофизиологическая характеристика тучных клеток щитовидной железы крыс при системном воспалительном ответе, вызванном липополисахаридом. // Актуальные вопросы клинической и экспериментальной медицины: Сборник тезисов научно- практической конференции молодых ученых. – Санкт-Петербург, 2008. – С.33-34.
- Яглова Н.В., Макарова О.В., Яглов В.В. Морфология щитовидной железы при экспериментальном остром эндотоксикозе. // III cъезд Российского общества патологоанатомов: Материалы съезда. – Самара, 2009. – Т.2. – С.594-596.
- Яглова Н.В. Экспериментальное исследование синдрома нетиреоидных заболеваний при остром эндотоксикозе. // Молодежь в науке-2009: Весцi Нацыянальнай акадэмii навук Беларусi. Материалы международной научной конференции молодых ученых. – Минск, 2009. – Часть 4. – С. 440-445.
- Яглова Н.В., Черников В.П. Индивидуальные морфофункциональные различия изменений щитовидной железы и цитокинового профиля при экспериментальнос синдроме нетиреоидных заболеваний. // Актуальные вопросы морфогенеза в норме и патологии: Сборник научных трудов конференции. – Москва, 2010. – С.208-212.
- Яглова Н.В., Яглов В.В. Регуляция секреторных процессов в фолликулярных тироцитах щитовидной железы при экспериментальном синдроме нетиреоидных заболеваний, обусловленном острым эндотоксикозом. // Актуальные вопросы морфогенеза в норме и патологии: Сборник научных трудов конференции. – Москва, 2010. – С.212-216.
- Яглова Н.В., Березов Т.Т., Макарова О.В. Влияние тиреотропного гормона на функциональное состояние печени при экспериментальном остром эндотоксикозе. // Человек и лекарство: Сборник материалов XVII Российского национального конгресса. – Москва, 2010. – С.751-752.
- Яглова Н.В. Синдром нетиреоидных заболеваний при остром эндотоксикозе: морфофункциональные аспекты развития и патогенетически обусловленная коррекция. // Новые информационные технологии в медицине, биологии, фармакологии и экологии: Труды XVIII международной конференции и дискуссионного научного клуба. – Украина, Ялта, 2010. – Т.2. – С.25-26.
- Яглова Н.В. Морфологическая характеристика секреторного цикла фолликулярных тироцитов при воздействии липополисахарида // Патология клетки: Сборник научных трудов VIII Всероссийской конференции. – Москва, 2010. – С.305-307.
СПИСОК СОКРАЩЕНИЙ
АлАТ - аланинаминотрансфераза
АсАТ - аспартатаминотрансфераза
ГГТ – -глутамилтранспептидаза
ИД – индекс дегрануляции
ИЛ - интерлейкин
СГК – средний гистохимический коэффициент
СНТЗ – синдром нетиреоидных заболеваний
сТ4 – свободный тироксин
сТ3 – свободный трийодтиронин
Т4 - тироксин
Т3 - трийодтиронин
ТК – тучные клетки
ТТГ – тиреотропный гормон
ТФР- – трансформирующий фактор роста-
ФНО- – фактор некроза опухоли-
ЩЖ – щитовидная железа
Соискатель Н.В. Яглова

