Репарация и васкуляризация инфарктной зоны миокарда у крыс после трансплантации мононуклеаров красного костного мозга
На правах рукописи
Байкова Юлия Павловна
Репарация и васкуляризация инфарктной зоны миокарда у крыс после трансплантации мононуклеаров красного костного мозга
03.03.04 – клеточная биология, цитология, гистология
А в т о р е ф е р а т
диссертации на соискание ученой степени
кандидата биологических наук
Москва 2011
Работа выполнена в Учреждении Российской академии медицинских наук Научно-исследовательском институте морфологии человека РАМН
Научный руководитель: доктор биологических наук
Большакова Галина Борисовна
Официальные доктор биологических наук
Егорова Ирина Федоровна
оппоненты:
доктор биологических наук, профессор
Болтовская Марина Николаевна
Ведущая организация:
Российский университет дружбы народов
Защита состоится 15 декабря 2011 года в 12 часов на заседании диссертационного совета Д 001.004.01 НИИ морфологии человека РАМН по адресу: 1117418, Москва, ул. Цюрупы, д. 3
С диссертацией можно ознакомиться в библиотеке НИИ морфологии человека РАМН по адресу: 1117418, Москва, ул. Цюрупы, д. 3
Автореферат разослан « » 2011 г.
Ученый секретарь
диссертационного совета
доктор медицинских наук Михайлова Лилия Петровна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Клеточная терапия – метод лечения заболеваний с помощью стволовых клеток – активно развивается в последние 10 лет. Трансплантация стволовых прогениторных клеток как одно из направлений клеточной терапии является одним из перспективных, так как позволяет стимулировать репаративные процессы поврежденной ткани (Anversa P. et al., 2004; Gersh B.J., Simari D.R., 2006).
На сегодняшний день существует несколько способов лечения таких распространенных заболеваний, сопровождающихся сердечной недостаточностью, как ишемическая болезнь сердца и инфаркт миокарда. Среди них выделяют хирургическое и медикаментозное лечение (Болл С. Дж. и др., 1995., Куртова А.В. и др., 2006), и трансплантацию прогениторных клеток костного мозга (Шахов В.П., Попов С.В., 2004; Li J. et al., 2010). Современная медикаментозная терапия и хирургическое лечение часто оказываются недостаточно эффективными, поэтому для лечения сердечно-сосудистых заболеваний все большее внимание уделяют клеточной трансплантации (Yacoub М. et al., 2006).
За последнее десятилетие было накоплено большое количество экспериментальных данных, свидетельствующих об эффективности и безопасности клеточных трансплантаций (Zhang C. et al., 2010). Было показано, что трансплантированные клетки могут выживать и участвовать в регенерации и реваскуляризации миокарда (Pangonyte D. et al., 2008). Однако до сих пор нет достоверных данных о том, что трансплантация клеток позволяет не просто восстановить функцию поврежденного миокарда, но в значительной мере устранить и само повреждение (Prockop D.J., 1997). Также остается неясным, какой именно клеточный трансплантат является наиболее безопасным и эффективным. Многие исследователи считают, что нефракционированные мононуклеары являются наиболее приемлемым клеточным трансплантатом (Zhang S. et al., 2010) по ряду причин. Во-первых, мононуклеары получают из красного костного мозга, который является наиболее доступным источником получения прогениторных клеток. Во-вторых, трансплантат мононуклеаров не требует культивирования и индукции дифференцировки, фенотипирования и отбора нужной фракции. Кроме того, в состав фракции мононуклеаров входят мультипотентные стромальные клетки, гемопоэтические стволовые клетки, эритроидные клетки - предшественники, мегакариоцитарные клетки – предшественники и клетки-предшественники миелоидного ряда, что позволяет воспроизвести и оценить комплексное влияние клеток красного костного мозга на репарацию тканей (Iwase T. et al., 2005).
Существуют три способа трансплантации прогениторных клеток: интравенозный, интракоронарный и интрамиокардиальный. Интрамиокардиальная трансплантация наиболее инвазивна, но наиболее эффективна, так как клеточный трансплантат вводят непосредственно в область повреждения (Henning R.J., et al., 2007). Интравенозная и интракоронарная трансплантации менее инвазивны и травматичны, но менее эффективны, так как прогениторные клетки мигрируют в зону повреждения под действием хемоаттрактантов (Grgaard H.K., et al., 2007). Именно поэтому на данный момент все еще стоит вопрос о выборе оптимальной техники введения клеток.
Среди возможных механизмов действия трансплантированных клеток на регенерацию миокарда выделяют заместительный (Orli D. et al., 2001; Bell A. et al., 2010), индукционный (Sieveking P.D. et al., 2009; Wollert K.C. et al., 2010; Yoon C.H. et al., 2010) и механизм клеточного слияния (Balsam L.B. et al., 2001; Tada M. et al., 2003). Заместительный эффект реализуется благодаря высокому пролиферативному потенциалу стволовых/прогениторных клеток и возможности слияния и/или дифференцировки их в кардиомиоциты (Johnston P.V., et al., 2009). Индукция регенерации происходит за счет синтеза и выделения трансплантированными клетками различных сигнальных молекул, которые регулируют пролиферацию, миграцию и дифференцировку клеток в зоне повреждения (Burchfield J.S., Dimmeler S., 2008). Слияние прогениторных клеток с кардиомиоцитами предполагает восстановление пролиферативной активности последних, что и приводит к восстановлению поврежденной ткани (Matsuura K., et al., 2004). Тем не менее, точный механизм действия трансплантированных стволовых клеток не установлен, и его определение является одной из основных задач исследователей.
Таким образом, на данный момент остаются неизвестными механизм действия трансплантированных клеток, наиболее эффективный клеточный фенотип для трансплантации и способ доставки клеток в зону повреждения.
Однако, несмотря на недостаток данных и ряд спорных вопросов, то, что трансплантация мононуклеаров приводит к положительным результатам, свидетельствует о перспективности данного клеточного трансплантата и возможности его использования в клинической практике. Для этого необходима разработка эффективной методики трансплантации и точное знание механизмов действия трансплантированных мононуклеаров, обеспечивающих их терапевтический эффект.
Цель и задачи исследования. Изучить в эксперименте особенности репаративных процессов в инфарктной зоне миокарда после трансплантации аутологичных мононуклеаров красного костного мозга.
Для достижения указанной цели были поставлены следующие задачи:
- Разработать метод интракоронарной трансплантации мононуклеаров костного мозга мелким лабораторным животным.
- Исследовать топографию трансплантированных мононуклеаров в сердце и других органах через 14 и 30 сут после трансплантации с помощью витальной мембранной метки PkH26.
- Определить фенотип клеток миокарда, образующихся из трансплантированных мононуклеаров через 14 и 30 суток после трансплантации с помощью морфологического анализа с применением иммуногистохимии.
- Провести морфометрическое исследование особенностей васкуляризации постинфарктного рубца после трансплантации мононуклеаров.
- Изучить влияние трансплантации мононуклеаров на постинфарктное ремоделирование левого желудочка с помощью морфометрического анализа серийных поперечных срезов сердца.
- Оценить глобальную сократимость левого желудочка сердца после трансплантации мононуклеаров по показателям максимального давления и скорости повышения давления в левом желудочке.
- Оценить уровень экспрессии генов ангиогенеза, ростовых факторов, цитокинов и хемоаттрактантов во фракции мононуклеаров красного костного мозга методом полимеразной цепной реакции в реальном времени.
Научная новизна. Разработана модель интракоронарной трансвентрикулярной трансплантации мононуклеаров мелким лабораторным животным. Особенность разработанной модели состоит в том, что при пережатии аорты большая часть трансплантированных клеток попадает из полости левого желудочка в коронарные артерии при сердечном выбросе. По эффективности доставки клеток в зону повреждения разработанный метод сравним с интрамиокардиальным (50,04% клеток через 14 сут в зоне повреждения после трансплантации, 40,07% клеток через 30 сут), но является менее инвазивным. Интракоронарная трансплантация мононуклеаров безопасна: она не вызывает развития воспалительной реакции.
Исследована локализация и выживаемость мононуклеарных клеток после трансплантации в условиях экспериментального инфаркта миокарда. Трансплантированные аутологичные мононуклеары выживали в течение месяца без изменения локализации. Большая часть клеток локализовалась в сердце и селезенке, единичные клетки были обнаружены в печени и легких.
В сердце клетки располагались только в рубцовой зоне, были окружены пучками коллагеновых волокон и имели фибробластоподобный фенотип через 14 и 30 сут после трансплантации. Часть трансплантированных клеток, помимо флуоресцентной метки трансплантированных мононуклеаров PkH26, экспрессировала маркеры фибробластов Fap и миофибробластов -SMA, что доказывает их дифференцировку в фибробласты и миофибробласты как через 14, так и через 30 сут после трансплантации.
Мононуклеары не дифференцируются в клетки стенок кровеносных сосудов. Трансплантация мононуклеаров приводит к стабилизации процессов васкуляризации, поддерживая количество и объемную плотность сосудов на постоянном уровне, по сравнению с контрольной группой, где было выявлено уменьшение как количества, так и объемной плотности сосудов через 30 сут после трансплантации.
Показана стимуляция пролиферации клеток стромы после трансплантации. Через 14 и 30 сут после трансплантации в рубце опытной группы количество делящихся клеток значительно выше (р0,001), чем в контрольной. При сопоставлении метки было выявлено, что некоторые меченые PkH26 клетки окрашивались мАТ к Ki67, что свидетельствует о пролиферации самих трансплантированных мононуклеаров на протяжении всего срока исследования.
Изучена экспрессия 84 генов во фракции мононуклеаров. Установлена сверхэкспрессия факторов ангиогенеза, факторов роста и дифференцировки, цитокинов и хемоаттрактантов.
Трансплантация мононуклеаров ускоряла процесс созревания коллагена, что повышало механическую прочность стенки левого желудочка в области рубца и препятствовало ее разрыву. Однако дифференцировка мононуклеаров в фибробласты и миофибробласты, синтезирующие коллаген, приводила к разрастанию рубцовой ткани. Трансплантация мононуклеаров не влияла на индекс гипертрофии левого желудочка.
Показано улучшение глобальной сократимости сердца после трансплантации мононуклеаров. Трансплантация мононуклеаров приводила к повышению максимального давления в стенке левого желудочка и увеличению скорости повышения максимального давления в левом желудочке.
Практическая значимость. Разработанная модель интракоронарной клеточной трансплантации мелким лабораторным животным после экспериментального инфаркта миокарда по эффективности сравнима с интрамиокардиальной, но менее инвазивна.
Полученные экспериментальные данные о безопасности и эффективности трансплантации мононуклеаров послужат основой для усовершенствования методики предклинических испытаний.
Полученные данные следует учитывать не только при проведении исследований по клеточной терапии сердечно-сосудистых заболеваний, но и в области клеточной ангиопластики и лечения ишемических заболеваний.
Степень личного вклада автора в результаты исследования. Автор принимал участие в хирургических операциях по моделированию инфаркта миокарда, взятии красного костного мозга и интракоронарной трансплантации. Все хирургические манипуляции проводили в Лаборатории биологических испытаний Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН в г. Пущино в соответствии с GLP-условиями.
Автор принимал участие в приготовлении клеточного трансплантата и витальном маркировании мононуклеаров. Автором было самостоятельно проведено гистологическое, иммуногистохимическое, морфометрическое исследование, полимеразная цепная реакция в реальном времени. Автор проводил статистический анализ полученных данных.
Апробация работы. Основные положения работы доложены на:
Итоговой конференции по результатам выполнения мероприятий в рамках приоритетного направления «Живые системы» ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007-2012 гг» (Москва, 2009, 2010, Институт молекулярной биологии им. В. А. Энгельгардта РАН); Всероссийской научной школе-конференции «Стволовые клетки и регенеративная медицина» (25 - 28 октября 2010 года, Москва, факультет фундаментальной медицины МГУ имени М.В.Ломоносова); Научной конференции «Актуальные опросы морфогенеза в норме и патологии» (Москва, 2010, УРАМН НИИ морфологии человека РАМН); Всероссийской конференции «Фундаментальные и клинические аспекты изучения ангиогенеза. Подходы регенеративной медицины» (Москва, 2011, Московский физико-технический институт); Всероссийской научной конференции «Регенеративная биология и медицина» (Москва, 2011, УРАМН НИИ морфологии человека РАМН); межлабораторной конференции НИИ морфологии человека РАМН (2011).
Внедрение полученных результатов. На основании полученных данных разрабатываются протоколы клеточных трансплантаций для клинических исследований и протоколы клеточной терапии для лечения пациентов с диагностированной хронической сердечной недостаточностью. Проведенное исследование может служить доклиническим исследованием оценки безопасности и эффективности трансплантации мононуклеаров красного костного мозга.
Результаты диссертационного исследования используются в лекционных и практических занятиях на кафедре гистологии и эмбриологии лечебного факультета Российского государственного медицинского университета.
Публикации. По материалам диссертации опубликовано 3 научные статьи в журналах, представленных в списках ВАК. Получен 1 патент.
Структура и объем диссертации. Диссертация изложена на 212 страницах машинописного текста и состоит из списка сокращений, введения, обзора литературы, описания материалов и методов исследования, изложения собственных результатов и их обсуждения, заключения, выводов и списка литературы. Литературный указатель включает 227 источников, из них 200 – иностранных, 27 – отечественных. Работа иллюстрирована 32 рисунками и 5 таблицами.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальное исследование. Экспериментальное исследование проводили на самцах аутбредного стока линии Спрейг-Доули (НПП «Питомник лабораторных животных ФИБХ РАН»). Всего использовали 56 животных в возрасте 8 недель массой тела 180-200 граммов. Животных содержали в соответствии с GLP-условиями. Работа с экспериментальными животными проводилась согласно приказу Минздрава СССР № 755 от 12.08.1977 г. На проведение исследования было получено разрешение биоэтической комиссии НИИ морфологии человека РАМН (протокол № 4 от 12.03.2008).
Острый инфаркт миокарда моделировали лигированием левой нисходящей коронарной артерии с последующей реперфузией через 20 мин. Наркотизацию крыс проводили внутримышечной инъекцией смеси кетамин/ксилазин (90-120 мг/кг + 10 мг/кг). Проводили трахеальную интубацию, подсоединяли к аппарату искусственной вентиляции легких (UGO BASILE, Rodent Ventilator). После интубации к животному подключали электроды для регистрации ЭКГ. Проводили торакотомию и накладывали лигатуру на левую коронарную артерию. Наличие инфаркта определяли по изменению комплекса PQRST. Визуально окклюзию устанавливали по появлению цианоза передней стенки левого желудочка. Через 20 мин после начала окклюзии лигатуру снимали, возвращали сердце в грудную клетку и зашивали рану. Животное находилось при включенном ИВЛ в течение 10 мин после окончания всех хирургических манипуляций. После операции всем животным однократно давали противовоспалительный препарат «Дексафорт» (100 мкл/500 г) и в течение 5 дней - антибиотик «Линкомицин» (2 раза в день в дозировке 0,6 мл/100 г веса).
Получение клеточного трансплантата. Клеточный трансплантат получали из красного костного мозга бедренных и большеберцовых костей обеих конечностей. Взятие костного мозга проводили перед моделированием острого инфаркта миокарда многократным пунктированием большеберцовых и бедренных костей через полость коленного сустава. Полученный пунктат помещали в среду с гепарином и DMEM/F12 с антибиотиком «Амикацин».
Выделение мононуклеаров. Для выделения мононуклеаров использовали метод разделения клеточных элементов при центрифугировании в градиенте плотности фиколла-урографина (плотность 1,089 г/мл). Фракцию мононуклеаров отбирали и центрифугировали повторно, получая мононуклеары в осадке.
Приготовление клеточного трансплантата. Полученную фракцию мононуклеаров разводили в 1 мл физиологического раствора, брали аликвоту и подсчитывали количество клеток в камере Горяева. Готовили клеточный трансплантат так, чтобы получить 5 млн. кл./мл физиологического раствора. Клеточный трансплантат 6 животных опытной группы маркировали витальной мембранной флуоресцентной меткой PKH26 (Sigma). Животным контрольной группы вводили 1 мл физиологического раствора.
Имплантация катетеров. Катетеризация левой сонной артерии была необходима для регистрации системного артериального давления. Катетеризация правой сонной артерии была необходима для регистрации давления в левом желудочке и введения клеточного трансплантата. Над артериями делали разрез и отсепарировали левую, а затем правую наружные сонные артерии по стандартной методике. Катетер подсоединяли к электроманометрическому датчику DTXTM Plus TNF-R (Becton Dickinson). После введения трансплантата оба катетера вынимали. Повторную катетеризацию проводили перед эвтаназией.
Интракоронарная трансвентрикулярная трансплантация. Животных делили случайным образом на 2 группы – опытную (n = 29) и контрольную (n = 27). Животным опытной группы вводили клеточный трансплантат, животным контрольной группы - физиологический раствор. Введение клеточного трансплантата осуществляли однократно через 30 сут после острого инфаркта миокарда. Клеточный трансплантат водили в полость левого желудочка через катетер, внедренный в правую наружную сонную артерию. Одновременно пережимали аорту ниже места ее отхождения от правой и левой коронарных артерий, что обеспечивало поступление прогениторных клеток в коронарные сосуды. Клеточный трансплантат вводили в полость левого желудочка сначала в объеме 0,2 мл. После восстановления нормального давления в левом желудочке процедуру повторяли для введения всего объема трансплантата.
Функциональный тест. В исследовании использовали тест «Плавание» для оценки физической динамической нагрузки. Уровень воды был подобран таким образом, чтобы крыса, плавая, не касалась дна кончиком хвоста. Регистрировали продолжительность плавания от момента погружения крысы в воду до того момента, как ее хвост касался дна.
Регистрация давления. Регистрировали артериальное давление и давление в левом желудочке сердца до операции трансплантации и перед выведением животных из эксперимента. Рассчитывали скорость повышения давления в левом желудочке (+dp/dt) как показатель инотропной функции сердца.
Гистологические методы исследования. Каждую группу животных делили на две подгруппы в зависимости от сроков выведения из эксперимента (14 и 30 сут после трансплантации клеток). Выведение животных из эксперимента проводили в СО2-камере. Для гистологического исследования брали сердце, печень, селезенку и легкие, которые фиксировали в 10% нейтральном забуференном формалине в течение 2-х дней. Органы животных, которым вводили клетки, меченные флуоресцентной меткой, после изъятия помещали в жидкий азот и в дальнейшем до приготовления криосрезов хранили при -70°С. Для дальнейшей обработки и приготовления парафиновых срезов использовали ксилол-спиртовую гистологическую проводку. Срезы селезенки, печени и легких делали на 3 разных уровнях, выбранных случайным образом. Срезы сердца делали на 10 разных уровнях на протяжении от верхушки сердца до предсердий. Из органов животных, которым вводили меченные PKH26 клетки, после криофиксации делали криосрезы с помощью криостата HM525 MICROM и проводили анализ миграции клеток в органах с помощью флуоресцентного микроскопа Axioplan 2 (Carl Zeiss, Германия), подсчитывая количество меченых клеток в 50 полях зрения.
Гистологические срезы сердца окрашивали пикросириусом красным для выявления зоны рубца и оценки в поляризованном свете доли зрелого и незрелого коллагена. Срезы печени, легких и селезенки окрашивали гематоксилином и эозином. Для исследования васкуляризации и подсчета клеток в рубце серийные поперечные срезы окрашивали по Маллори.
Морфометрическое исследование. При морфометрическом исследовании серийных поперечных срезов сердца измеряли следующие показатели: толщину стенки левого желудочка в области рубца, толщину стенки левого желудочка в перифокальной области, площадь рубцовой зоны, площадь полости левого желудочка, площадь стенки левого желудочка, общую площадь левого желудочка.
На основании первичных данных измерений рассчитывали следующие индексы, выраженные в процентах:
- Объемная доля рубцовой ткани - отношение площади рубцовой ткани к площади стенки левого желудочка.
- Индекс дилатации левого желудочка - отношение площади полости левого желудочка к общей площади левого желудочка.
- Относительная толщина рубца – отношение толщины стенки левого желудочка в области рубца к толщине стенки левого желудочка в перифокальной области.
- Индекс гипертрофии левого желудочка – отношение толщины стенки левого желудочка в перифокальной области к толщине межжелудочковой перегородки.
При исследовании срезов сердца, окрашенных по Маллори, определяли общее количество сосудов на квадратный миллиметр и объемную плотность кровеносных сосудов в области рубца на 14-е и 30-е сут после трансплантации:
- Общее количество сосудов на мм2 определяли как отношение количества сосудов в поле зрения к площади поля зрения (в мм2), умноженное на 100.
- Объемную плотность кровеносных сосудов в области рубца определяли как отношение площади кровеносных сосудов в поле зрения к площади поля зрения, умноженное на 100.
Отдельно подсчитывали количество артериол, венул и капилляров, измеряли их площадь, обводя их контур по внешнему диаметру. Вычисляли процентные доли капилляров, артериол и венул, количество артериол, капилляров и венул на квадратный миллиметр. Кроме того, на окрашенных по Маллори срезах подсчитывали количество клеток в рубце.
Иммунногистохимическое исследование. Для проведения иммуногистохимического исследования использовали как парафиновые срезы, так и криосрезы. Парафиновые срезы перед иммуногистохимическим окрашиванием депарафинировали, криосрезы сразу помещали в фосфатно-солевой буфер. Для проведения исследования были выбраны следующие антитела фирмы Abcam: CD68 (мембранный маркер макрофагов), Ki67 (ядерный маркер пролиферации), Fap (мембранный маркер реактивных фибробластов), -SMA (-гладкомышечный актин). В качестве системы визуализации использовали биотин-стрептавидин-пероксидазный комплекс (Dako), в качестве блокатора пептидов – 10% раствор БСА.
Для определения дифференцировки трансплантированных мононуклеаров сопоставляли две метки: одновременное наличие флуоресцентной мембранной метки PkH26 и иммуногистохимического маркера свидетельствовало о том, что дифференцировалась именно трансплантированная клетка.
RT-PCR. Полимеразную цепную реакцию в реальном времени (RT-PCR) проводили согласно рекомендованной производителем реактивов (QIAGEN) схеме. РНК выделяли из образцов фракции мононуклеаров (стандартным фенольным способом и с использованием набора RNeasy Mini Kit). Проверяли чистоту выделенной РНК электрофоретически и с помощью спектрофотометра. На ее матрице синтезировали кДНК (с использованием набора RT2 First Strand Kit фирмы SABioscience) и ставили RT-PCR (с использованием набора The Rat Angiogenesis RT Profiler™ PCR Array). Все этапы проводили согласно протоколам фирм-производителей. Данный набор был выбран для комплексной количественной оценки рецепторов ангиогенеза и экспрессии генов факторов роста. Помимо этого, с помощью данного набора можно оценить экспрессию молекул адгезии и матричных белков, а также протеиназ и их ингибиторов, цитокинов и хемокинов, принимающих участие в процессе ангиогенеза (Табл.1).
Таблица 1. Обозначение генов ангиогенеза на плашке в исследовании RT-PCR.
| A | B | C | D | E | F | G | H | |||||||||
| 01 |
|
|
|
|
|
|
|
| ||||||||
02 | Akt1 | Tymp | Fgf2 | Ifnb1 | Lep | Pecam1 | Tgfb2 | Hprt1 | ||||||||
03 | Angpt1 | S1pr1 | Fgf6 | Ifng |
| Pgf | Tgfb3 | Rpl13a | ||||||||
04 | Anpep | Efna1 | Fgfr3 | Igf1 | Mdk | Plau | Tgfbr1 | Ldha | ||||||||
05 | Bai1 | Efna2 | Figf | Il1b | Mmp19 | Plg |
| Actb | ||||||||
06 | Ccl2 | Efna5 | Flt1 | Il6 | Mmp2 | Ptgs1 | Timp1 | RGDC | ||||||||
07 | Cdh5 | Egf | Fn1 | Itga5 | Mmp3 | Serpinb5 | Timp2 | RTC | ||||||||
08 |
| Eng | Fzd5 | Itgav |
| Serpinf1 | Timp3 | RTC | ||||||||
09 | Col4a3 | Epas1 | Hgf | Itgb3 | Npr1 |
| Tnf | RTC | ||||||||
10 | Ctgf | Ereg | Hif1a | Jag1 | Nrp1 | Tbx4 | Vegfa | PPC | ||||||||
11 | Cxcl1 | F2 | Id1 | Kdr | Nrp2 | Tek | Vegfb | PPC | ||||||||
12 | Cxcl2 | Fgf1 | Id3 | Lama5 | Pdgfa | Tgfa | Vegfc | PPC |
Сравнение уровня экспрессии вышеуказанных генов проводили с генами «домашнего хозяйства» («house-keeping» genes).
Статистический анализ. Для абсолютных и процентных показателей определяли средние значения, медианы и стандартные ошибки среднего. Абсолютные показатели при условии нормального распределения сравнивали с помощью критерия Стьюдента. При распределении, отличном от нормального, использовали 2-тест, z-тест и тест Манна-Уитни. Сравнения процентных показателей проводили с помощью рангового однофакторного дисперсионного анализа Краскала-Уоллиса. Статистический анализ проводили с помощью программы SigmaStat 3.5. Различия считали значимыми при достигнутом 95% уровне достоверности.
Статистический анализ данных ПЦР проводили с помощью RT Profiler PCR Array Data Analysis Template v3.3.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Разработка модели интракоронарной трансвентрикулярной трансплантации. Разработана модель интракоронарной трансвентрикулярной трансплантации клеток мелким лабораторным животным, особенность которой состоит в том, что вследствие пережатия аорты большая часть клеток попадает в зону повреждения. Ранее хирургические операции подобной сложности выполняли на крупных животных – кроликах и свиньях. Подобная модель позволяет осуществлять интракоронарные трансплантации мелким лабораторным животным без рентгенографического контроля локализации катетера, что позволяет проводить эксперименты с меньшими затратами на содержание животных и, таким образом, увеличивать выборки.
По эффективности разработанная модель сравнима с интрамиокардиальной и обеспечивает доставку большого количества трансплантированных клеток в зону повреждения (50,04% клеток через 14 сут, 40,07% клеток через 30 сут). По сравнению с интрамиокардиальной, разработанная модель менее инвазивна и не требует операции на открытом сердце. Тем не менее, из-за тяжести процедуры пережатия аорты, погибло 5 животных контрольной и 4 животных опытной группы (27,7% и 17,4% соответственно). Смерть наступала либо во время хирургических операций, либо в течение двух суток после операций, и не зависела от состава введенного трансплантата (мононуклеары или физиологический раствор).
Второе преимущество разработанной модели состоит в том, что в отличие от других способов трансплантации она позволяет использовать клеточные трансплантаты с разными потенциями к направленной миграции, так как при пережатии аорты клетки попадают в полость левого желудочка в область максимальной концентрации хемоаттрактантов, а не в сосуды большого круга кровообращения.
Выживаемость трансплантированных клеток. Было установлено, что трансплантированные клетки не элиминировались и сохраняли жизнеспособность в течение как минимум 30-и сут после трансплантации. На гистологических срезах клетки имели вид неповрежденных, по фенотипу не отличались от клеток стромы, вокруг них не было обнаружено выраженной лимфо-макрофагальной инфильтрации. Иммуногистохимический анализ c использованием мАТ к маркеру макрофагов CD68 показал присутствие макрофагов как в контрольной, так и в опытных группах, при этом их количество достоверно не различалось (p=1,000).
Окрашенные CD68 единичные трансплантированные клетки, несшие PkH26 метку, вероятно, элиминировались макрофагами, но при этом морфологические признаки острой воспалительной реакции отсутствовали. Не исключено, что единичные трансплантированные клетки дифференцировались в макрофаги, так как известно, что во фракции мононуклеаров присутствуют предшественники клеток миелоидного ряда (Ярилин А.А., 1999).
Топография трансплантированных мононуклеаров. Было показано, что при неселективном интракоронарном введении меченые мононуклеары локализуются в основном в сердце и селезенке (Рис.1).
Наличие меченых клеток в селезенке связано с тем, что данный орган является естественной нишей введенного клеточного трансплантата. В сердце клетки располагались только в рубцовой зоне сердца, что свидетельствует о направленной миграции трансплантированных мононуклеаров. Ни одной меченой клетки не было обнаружено в перифокальной области, в неповрежденном миокарде и стенках кровеносных сосудов. Отсутствие PkH26 метки в кардиомиоцитах, клетках эндотелия и гладкомышечных клетках кровеносных сосудов свидетельствует о том, что трансплантированные мононуклеары не дифференцируются в кардиомиоциты, клетки кровеносных сосудов и не сливаются с ними в синцитий. Подобная локализация была отмечена и другими исследователями, особенно при интракоронарных инъекциях (Mkel J. et al., 2009).

Рис. 1. Распределение трансплантированных мононуклеаров по органам
через 14 (А) и 30 сут (Б) после трансплантации.
Иммунофенотип трансплантированных клеток. Вопрос о дифференцировке мононуклеаров до сих пор остается открытым. Зачастую в экспериментах in vivo одного наличия маркеров недостаточно для заключений о дифференцировке клеток. О ней можно косвенно судить по морфологии и локализации клеток, а также по наличию различных типов контактов с окружающими клетками. Поэтому в данном исследовании, помимо реакции с мАТ, рассматривали и локализацию, и морфологию трансплантированных мононуклеаров.
Трансплантированные мононуклеары располагались в сердце только в области рубца в толще соединительной ткани как через 14, так и через 30 сут после трансплантации, были окружены коллагеновыми волокнами. Некоторые мононуклеары окрашивались мАТ к маркеру реактивных фибробластов Fap и мАТ к маркеру миофибробластов -ASMA. Таким образом, учитывая особенности локализации, фенотип и экспрессию Fap и -ASMA, можно сделать вывод, что, по крайней мере, часть трансплантированных мононуклеаров дифференцируется в фибробласты и миофибробласты (Табл.2).
Таблица 2. Клеточный состав рубцовой зоны через 14 и 30 сут после трансплантации мононуклеаров.
| Показатель | Контрольная группа | Опытная группа | ||||
| 14 сут | 30 сут | 14 сут | 30 сут | |||
| Количество клеточных элементов в рубце | 51, 3±1,4 | 49, 0±1 | 80,8±2,5 * | 76,7±1 * | ||
| Количество пролиферирующих клеток в рубце | 17,3±0,6 | 16,8±0,7 | 27,4±0,7 * | 24,2±0,9 * | ||
| Количество фибробластов в рубце | 12,8±0,6 | 14,6±0,5 | 16,3±0,5 * | 16,6±0,3 * | ||
| Количество миофибробластов в рубце | 2,6±0,2 | 3,4±0,2 | 6,4±0,6 * | 8,8±0,6 * | ||
| Примечание: * - p<0,05 при сравнении с контрольной группой | ||||||
Не было обнаружено ни одного мононуклеара, дифференцировавшегося в кардиомиоцитарном направлении. Даже если бы единичные клетки дифференцировались в кардиомиоциты, установка щелевых контактов с функционально активными неповрежденными кардиомиоцитами была бы невозможна из-за особенности их локализации, так как клетки были окружены пучками коллагеновых волокон. Следовательно, говорить о существовании функционально активных кардиомиоцитов, возникших вследствие дифференцировки мононуклеаров, невозможно. В проведенных экспериментах не подтвердились данные о том, что трансплантированные мононуклеары способны дифференцироваться в гладкомышечные и эндотелиальные клетки стенки сосудов, приводимые рядом исследователей (Prockop D.J., 1997; Wang T. et al., 2009; Li C.J. et al., 2010; Hosoda T. et al., 2010). В опытной группе не было обнаружено ни одной PkН26-меченной клетки, входящей в состав внутренней и средней стенки сосудов.
Полученные данные совпадают с данными Orli D. и его коллег (2001), а также Yang S.E. (2004), которые свидетельствуют о возможности дифференцировки мононуклеаров в фибробласты и миофибробласты под воздействием факторов роста и дифференцировки.
Данные результаты противоречат утверждениям некоторых исследователей (Bell A. et al., 2010) о том, что мононуклеары способны дифференцироваться в гладкую и поперечно-полосатую мышечную ткань, кардиомиоциты и клетки эндотелия сосудов. Авторами показана подобная дифференцировка in vitro, но данных о возможности дифференцировки мононуклеаров в кардиомиоциты in vivo недостаточно (Gnecchi M. et al., 2008; Brunner S. et al., 2008).
Васкуляризация миокарда после трансплантации мононуклеаров. Трансплантированные мононуклеары не дифференцировались в клетки стенок кровеносных сосудов, но, несмотря на это, трансплантация приводила к стимуляции ангиогенеза. Через 14 сут после трансплантации количество кровеносных сосудов на мм2 в опытной группе было меньше, чем в контрольной, но объемная плотность кровеносных сосудов у животных опытной группы была достоверно больше (p0,001), что свидетельствует о большем калибре новообразованных сосудов при трансплантации мононуклеарных клеток. На 30-е сут уже и количество (p0,001), и объемная плотность (p = 0,004) сосудов в опытной группе была больше, чем в контрольной (Рис.2). При этом следует отметить, что по сравнению с контрольной группой, где наблюдалось уменьшение количества сосудов, в опытной группе показатели количества и объемной плотности сосудов были стабильными.

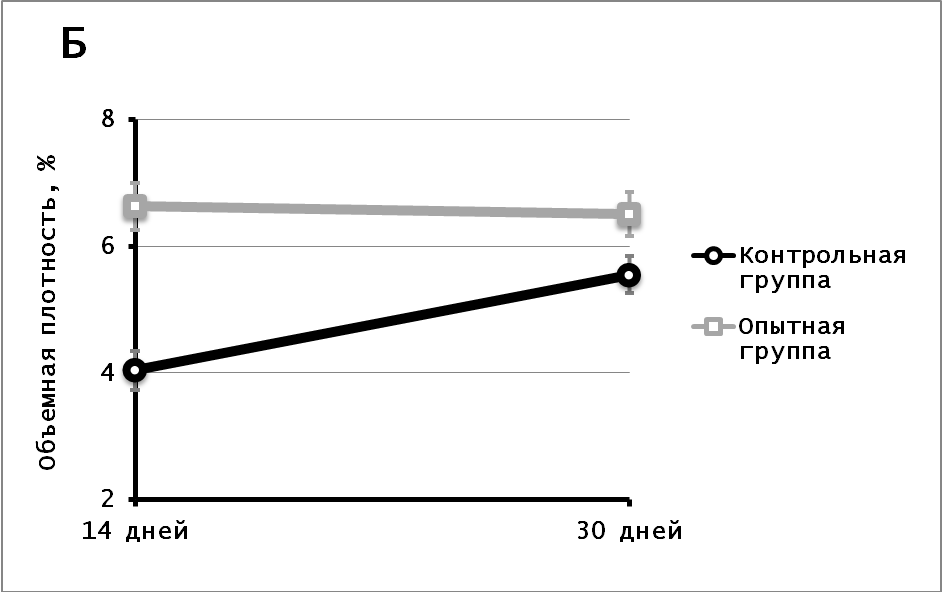
Рис. 2. Количество сосудов (А) на квадратный мм2 и объемная плотность сосудов (Б) через 14 и 30 сут после трансплантации.
Подобная динамика наблюдалась и при подсчете количества капилляров на мм2 среза рубцовой ткани. На 14-е и 30-е сут количество капилляров в опытной группе было достоверно меньше, чем в контрольной (p0,001) (Рис.3). Но к 30-м сут количество капилляров в рубце животных контрольной группы достоверно снижалось, тогда как у животных опытной группы наблюдалась стабильность данного показателя (р = 0,267). Количество артериол на мм2 в обеих группах было стабильно (Рис.3). Однако в рубце опытной группы количество артериол было меньше, чем в контрольной (р = 0,901). Доля венул в рубце контрольной группы к 30-м сут увеличивалась (р 0,001), когда как в рубце опытной группы на 14 и 30 сутки количество венул оставалось стабильным и на обоих сроках превышало контрольные значения (Рис. 3).
Таким образом, согласно полученным данным, трансплантация мононуклеаров стабилизировала и стимулировала ангиогенез, что соотносится с уже известными данными о процессах ангиогенеза в поврежденном миокарде (Dishart K.L. et al., 2003; Fukuda S., 2004). По данным литературы, при трансплантации стволовых клеток увеличивалось количество и капилляров, и венул, и артериол за счет дифференцировки трансплантированных клеток в гладкомышечные и эндотелиальные (Shintani S. et al., 2001; Taguchi A. et al.,2004). Возможно, снижение активности артериогенеза после трансплантации мононуклеаров в проделанном исследовании связано с тем, что трансплантированные клетки не дифференцировались в гладкомышечные стенки сосудов, а деление гладкомышечных клеток предсуществующих артериол и миграция гладкомышечных клеток не обеспечивали образования новых артериол.
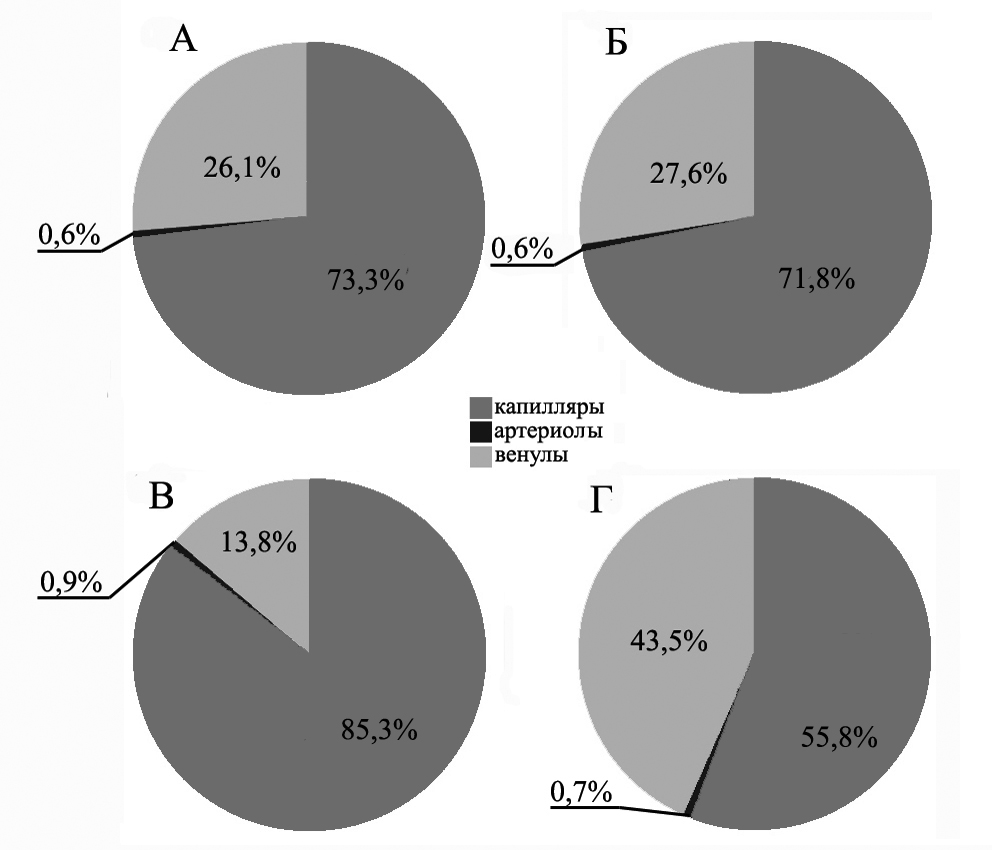
Рис. 3. Доля капилляров, артериол и венул через 14 и 30 сут после трансплантации. А – опытная группа, 14 сут, Б – опытная группа, 30 сут, В – контрольная группа, 14 сут, Г – контрольная группа, 30 сут.
Экспрессия генов во фракции мононуклеаров. Во всех образцах фракций мононуклеаров была установлена сверхэкспрессия таких факторов, как Vegf, генов семейства Tnf и Angpt, а также генов семейства Tgf. Вероятно, сверхэкспрессия Vegf после трансплантации приводила к стабилизации ангиогенеза, а сверхэкспрессия Tgf – к увеличению количества капилляров за счет пролиферации клеток эндотелия. Так как дифференцировавшиеся в фибробласты и миофибробласты мононуклеары не способны к секреции факторов роста и дифференцировки, то, вероятно, к секреции паракринных факторов после трансплантации способны не дифференцировавшиеся мононуклеары, сохранившиеся в зоне рубца.
Повышенный уровень экспрессии Pecam1, гена молекул адгезии эндотелиальных клеток, вероятнее всего, связан с тем, что во фракцию мононуклеаров входят эндотелиальные клетки-предшественники, способные паракринным способом регулировать рост эндотелия сосудов (Yoon C.H. et al., 2005). Повышенный уровень экспрессии гена Pecam1 в мононуклеарах после трансплантации, вероятно, приводит к стимуляции формирования капилляров.
Резюмируя полученные данные, можно заключить, что во фракции мононуклеаров экспрессия генов ангиогенеза, факторов роста и дифференцировки повышена. Терапевтический эффект после трансплантации мононуклеаров, по-видимому, и реализуется за счет сверхэкспрессии данных генов, а не за счет их дифференцировки в кардиомиоцитарном направлении, как считают некоторые исследователи (Johnston P.V. et al., 2009; Bell A. et al., 2010; Zakharova L. et al., 2010).
Морфология рубцовой ткани постинфарктного сердца. К моменту выведения животных из эксперимента (44-е и 60-е сут после инфаркта миокарда) у животных обеих групп в миокарде были выявлены очаги рубцовой ткани. Рубец представлял собой плотно-волокнистую соединительную ткань, богатую коллагеновыми волокнами, среди которых были как толстые пучки коллагена I типа, так и тонкие пучки коллагена III типа. Между коллагеновыми волокнами располагались клетки полигональной и/или веретеновидной формы, количество которых снижалось по мере приближения к перифокальной зоне. В рубцовой ткани опытной группы была выявлена достоверно большая (p0,001) плотность клеточных элементов как на 14-е, так и на 30-е сут после трансплантации, чем в контрольной (Табл.2). На 14-е сут большая часть клеток была представлена мечеными трансплантированными клетками, а на 30-е сут доля меченых клеток уменьшалась.
В рубце у крыс опытной группы было выявлено достоверно большее количество как фибробластов, так и миофибробластов (р0,001) по сравнению с контролем, количество которых незначительно увеличивалось в обеих группах к 8 неделе после острого инфаркта миокарда (Табл.2). Так как Fap окрашивает только реактивные фибробласты, можно заключить, что фибробласты рубцовой зоны активно синтезировали коллаген, укрепляя тем самым стенку левого желудочка.
Окрашивание с мАТ к маркеру пролиферации Ki67 выявило три зоны пролиферации – эпикард, стенки кровеносных сосудов и постинфарктный рубец. При этом пролиферация клеток рубца активно шла в обеих группах (Табл.2). Ни в опытной, ни в контрольной группе не было обнаружено ни одного Ki67+ кардиомиоцита. Пролиферировали только клетки стромы, эндотелиальные клетки сосудов и клетки эпикарда. Единичные пролиферирующие клетки были обнаружены в адвентиции сосудов перифокальной зоны. Количество пролиферирующих клеток в зоне рубца на всех сроках наблюдения было выше в опытной группе по сравнению с контролем. Пролиферация, по-видимому, была индуцирована паракринными факторами роста, синтезируемыми трансплантированными мононуклеарами.
Трансплантация клеток приводила к утолщению стенки сердца в области рубца (Табл.3).
Таблица 3. Морфометрические показатели левого желудочка через 14 и 30 сут после трансплантации мононуклеаров
| Показатель | Контрольная группа | Опытная группа | ||
| 14 сут | 30 сут | 14 сут | 30 сут | |
| Толщина стенки в области рубца | 33, 1±1,0 | 33,1±1,4 | 40,3±1,8 * | 43,1±1,3 * |
| Размер рубца | 7,6±1,3 | 7,4±0,7 | 5,1±0,8 * | 10,0±1,0 *# |
| Объемная доля коллагена I типа в рубце | 77,9±3,3 | 87,2±1,7 # | 92,0±0,9 * | 87,5±1,9 # |
| Индекс дилатации левого желудочка | 24,2±1,4 | 27,6±1,0 | 19,7±1,1 | 32,6±1,7 # |
| Индекс гипертрофии перифокальной области левого желудочка | 73,1±2,5 | 67,5±2,1 | 72,2±2,6 | 69,8±1,6 |
| Примечание: # - p<0,05 при сравнении с исходным значением * - p<0,05 при сравнении с контрольной группой | ||||
Утолщение стенки связано с выработкой коллагена фибробластами сердца и мононуклеарами, дифференцировавшимися в фибробласты и миофибробласты. Было выявлено, что после трансплантации происходит ускорение созревания рубцовой ткани, состоящее в перестройке коллагена III типа в коллаген I типа. Доля зрелого коллагена была достоверно выше в опытной группе по сравнению с контрольной уже на 14-е сут после трансплантации (Табл.3). Вероятно, ускорение созревания коллагена связано с повышенной экспрессией генов семейства Mmp. Согласно данным RT-PCR, во фракции мононуклеаров повышен уровень экспрессии Mmp9. Так как не все трансплантированные мононуклеары дифференцировались в фибробласты, то, возможно, экспрессия Mmp9 не дифференцировавшимися мононуклеарами привела к ускорению созревания коллагена. Полученные данные не согласуются с утверждениями некоторых ученых о том, что для мононуклеаров характерна пониженная экспрессия генов семейства Mmp (Hirohata S. et al., 1997; Vu T.H. et al., 2000).
Хотя существуют данные о том, что трансплантация мононуклеаров приводит к уменьшению рубца (Orli D. et al., 2001; Henning R.J. et al., 2007) за счет дифференцировки трансплантированных клеток в кардиомиоциты, в данном исследовании активный синтез коллагена клетками, дифференцированными из трансплантированных мононуклеаров, и собственными фибробластами сердца привел к увеличению размера рубца через 30 сут после трансплантации (Табл.3).
Функциональные показатели работы сердца. Важными показателями функциональной активности сердца являются систолическое давление и скорость повышения давления в левом желудочке. Данные показатели отражают изменение систолической функции и глобальной сократимости левого желудочка.
Согласно полученным результатам, систолическое давление в левом желудочке через 30 сут после трансплантации было выше в опытной группе по сравнению с контролем (136±7 мм.рт.ст. по сравнению с 116±3 мм.рт.ст., p0,01).
Подобную картину наблюдали и при сравнении показателя скорости повышения давления в левом желудочке, которая увеличивалась через 30 сут после трансплантации в опытной группе (9320±655 мм.рт.ст./с по сравнению с 7781±364 мм.рт.ст./с в контрольной группе, p0,01).
Ремоделирование левого желудочка. Установлено, что после трансплантации мононуклеаров индекс гипертрофии достоверно не различался между опытом и контролем, а индекс дилатации левого желудочка возрастал к 30-м суткам после трансплантации (Табл.3). Таким образом, улучшение функциональных показателей, скорее всего, обусловлено не структурной перестройкой миокарда, а увеличением механической прочности рубцовой ткани вследствие более активной пролиферации фибробластов.
Таким образом, можно заключить, что интракоронарная трансплантация мононуклеаров безопасна и эффективна. Мононуклеары как клеточный трансплантат оказывают стабилизирующее и стимулирующее влияние на ангиогенез в области постинфарктного рубца в миокарде, вероятно, за счет паракринных механизмов. Трансплантированные мононуклеары дифференцируются не в кардиомиоциты и клетки стенки кровеносных сосудов, а в фибробласты и миофибробласты, за счет чего происходит укрепление стенки левого желудочка в области рубца. Мононуклеары стимулируют увеличение площади рубца, но не влияют на процессы постинфарктного ремоделирования. Трансплантация нефракционированных мононуклеаров может быть использована в качестве вспомогательного метода при медикаментозном и хирургическом лечении больных инфарктом миокарда. По-видимому, в дальнейших исследованиях следует использовать отдельные фракции мононуклеаров, такие, как мультипотентные стромальные клетки, или проводить их преддифференцировку с целью повышения эффективности трансплантации.
Выводы
- Разработана эффективная методика интракоронарного трансвентрикулярного введения аутологичных мононуклеаров мелким лабораторным животным после индуцированного инфаркта миокарда с реперфузией.
- При интракоронарном введении меченые клетки выживают как минимум в течение месяца после трансплантации. Трансплантированные клетки локализуются преимущественно в сердце, причем только в рубцовой зоне, и селезенке Через 14 сут после трансплантации количество меченых клеток в сердце составило 1996,6±65,8 клеток на мм2, через 30 сут - 1336,7±29,7 клеток.
- Трансплантированные мононуклеары дифференцируются в фибробласты и миофибробласты рубцовой ткани, обладающие характерной морфологией и специфическими маркерами -SMA и Fap. Трансплантированные мононуклеары не сливаются с кардиомиоцитами, не дифференцируются в кардиомиоциты и клетки кровеносных сосудов.
- Трансплантация клеток стабилизирует ангиогенез, поддерживая количество артериол и капилляров на постоянном уровне, и способствует увеличению количества венул. Это может быть обусловлено сверхэкспрессией ангиогенных факторов (генов семейства Vegf), факторов роста (генов семейства Tgf), хемоаттрактантов и молекул адгезии (Pecam1) во фракции мононуклеаров.
- Трансплантация мононуклеаров стимулирует пролиферативную активность клеток стромы. Пролиферация клеток соединительной ткани и самих трансплантированных мононуклеаров увеличивает количество клеточных элементов в рубце.
- Трансплантация мононуклеаров не увеличивает степень гипертрофии левого желудочка.
- Трансплантация ускоряет процесс созревания коллагена в рубце, изменяя активность генов семейства Мmp и Akt, влияющих на процессы синтеза, созревания и деградации коллагена. Синтез коллагена фибробластами сердца и мононуклеарами, дифференцировавшимися в миофибробласты и фибробласты, приводит к утолщению стенки левого желудочка в области рубца, препятствуя ее разрыву и увеличивая размер рубца у животных опытной группы по сравнению контрольной.
- Трансплантация мононуклеаров улучшает функциональное состояние левого желудочка. После трансплантации мононуклеаров увеличивается максимальное давление в левом желудочке и скорость его повышения. Это способствует увеличению глобальной сократимости сердца и систолической функции левого желудочка.
Список работ, опубликованных по теме диссертации
- Байкова Ю.П., Фатхудинов Т.Х., Большакова Г.Б., Бухарова Т.Б., Слащёва Г.А., Хохлова О.В., Мурашев А.Н., Гольдштейн Д.В. Репарация миокарда при трансплантации мононуклеарных клеток костного мозга // Клеточные технологии в биологии и медицине. – 2010. - №4. – С. 203 – 211.
- Фатхудинов Т.Х., Байкова Ю.П., Большакова Г.Б., Бухарова Т.Б., Дубовая Т.К., Кактурский Л.В., Гольдштейн Д.В.
Влияние трансплантации мононуклеаров красного костного мозга на ангиогенез у крыс // Клеточные технологии в биологии и медицине. – 2011. - №. 3– С. 132 – 136. - Байкова Ю.П., Фатхудинов Т.Х., Большакова Г.Б., Бухарова Т.Б., Дубовая Т.К., Кактурский Л.В., Гольдштейн Д.В. Пути дифференцировки мононуклеарных клеток костного мозга при трансплантации в постинфарктное сердце// Клеточные технологии в биологии и медицине. – 2011. - №. 3– С. 140 – 146.

