Морфофункциональные изменения в клетках иммунной системы при нарушении светового режима и иммунопатологии
На правах рукописи
ЛИТВИНЕНКО ГАЛИНА ИВАНОВНА
МОРФОФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ В КЛЕТКАХ ИММУННОЙ СИСТЕМЫ ПРИ НАРУШЕНИИ СВЕТОВОГО
РЕЖИМА И ИММУНОПАТОЛОГИИ
03.03.04 – клеточная биология, цитология, гистология
14.03.09 – клиническая иммунология, аллергология
Автореферат
диссертации на соискание учёной степени
доктора медицинских наук
Новосибирск – 2011
Работа выполнена в Учреждении Российской академии медицинских наук Научно-исследовательском институте клинической и экспериментальной лимфологии Сибирского отделения РАМН (г. Новосибирск)
Научные консультанты
доктор медицинских наук, академик РАМН Труфакин Валерий Алексеевич
доктор медицинских наук, профессор Шурлыгина Анна Вениаминовна
Официальные оппоненты:
доктор медицинских наук, доцент Залавина Светлана Васильевна
доктор медицинских наук, профессор Логвинов Сергей Валентинович
доктор медицинских наук Колесникова Ольга Петровна
Ведущая организация: Государственное образовательное учреждение высшего профессионального образования «Алтайский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» (г. Барнаул)
Защита диссертации состоится «___»___________2011 г. в ___ часов на заседании диссертационного совета Д 208.062.05 при Новосибирском государственном медицинском университете (630091, г. Новосибирск, Красный проспект, 52; (383) 229-10-83)
С диссертацией можно ознакомиться в библиотеке Новосибирского государственного медицинского университета (630091, г. Новосибирск, Красный проспект, 52)
Автореферат разослан « » 2011 г.
Учёный секретарь диссертационного совета
доктор медицинских наук, профессор А. В. Волков
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Особенностью биологии иммунокомпетентных клеток является чрезвычайная динамичность за счет постоянно идущих процессов пролиферации, дифференцировки, миграции, кооперации, апоптоза [Труфакин В. А., 1980; Бородин Ю. И. с соавт., 1992; Труфакин В. А. с соавт., 1996], что обуславливает необходимость ее рассмотрения в пространственно-временном аспекте. Этот «внутренний временной порядок», по-видимому, обуславливает оптимальный уровень функционирования системы в каждый данный момент времени [Бородин Ю. И. с соавт., 1992; Труфакин В. А. с соавт, 1996].
Различным заболеваниям, которые сопровождаются иммунными нарушениями, сопутствует или предшествует рассогласование суточных ритмов функционирования клеток иммунной системы [Лозовой В. П. с соавт., 1979; Махонова Л. А. с соавт., 1979; Труфакин В. А., 1980; Туаев В. С. с соавт., 1981; Martini E. et al., 1988; Fei G. H. et al., 2004]. Нарушается также и синтез гормона эпифиза мелатонина, который обеспечивает сохранность биологических ритмов всего организма, в том числе и иммунной системы, на протяжении суток [Анисимов В. Н. с соавт., 1990; Кветная Т. В. с соавт., 2004; Schwarz W. et al., 1988; West S. K. et al., 1992].
В литературе очень мало сведений о суточных колебаниях морфофункционального состояния иммунокомпетентных клеток при иммунопатологии и о попытках восстановления нормального циркадианного биологического ритма функционирования иммунной системы при искусственно вызванном десинхронозе и при заболеваниях иммунопатологического генеза – при бронхиальной астме и атопическом дерматите. Поэтому актуальным является изучение циркадианных ритмов функционирования клеток иммунной системы при нарушениях светового режима и при заболеваниях, в патогенезе которых ведущую роль играют иммунологические дисфункции – при бронхиальной астме, атопическом дерматите, хроническом воспалении. Важной задачей является и исследование возможности их медикаментозной коррекции препаратами мелатонина (мелаксен, мелатонин) и индукторами его синтеза, так как основная роль этого гормона – хронотропная [Арушанян Э. Б. с соавт., 2003].
В тесной связи с целями хронопатологических исследований находятся задачи хронокоррекции нарушенных функций иммунокомпетентных клеток. Наличие выраженной цикличности чувствительности иммунной системы к внешним воздействиям открывает перспективы для хронотерапии в иммунопатологии [Труфакин В. А. с соавт., 1991; Шурлыгина А. В., Труфакин В. А., 1993; Halberg F., 1988; Fernandes G., 1989]. Показано, что существуют суточные вариации чувствительности лимфоцитов к некоторым иммуномодуляторам, цитокинам [Шурлыгина А. В. с соавт., 1998; 1999; 2000; Труфакин В. А. с соавт., 2002]. Однако в литературе существуют лишь немногочисленные сведения о хронобиологических режимах применения лекарств, оказывающих влияние на клетки иммунной системы [Шурлыгина А. В. с соавт.,1993; 2000; Труфакин В. А., с соат., 2001; Kemeny M. M. et al., 1992; Masera R. G. et al., 1994; Perpoint B. et al., 1995]. Поскольку в клинике иммунопатологии всё большее внимание уделяется цитокинотерапии, представляется актуальным изучение хронобиологических эффектов индуктора синтеза интерферона ридостина при вторичных иммунодефицитных состояниях (воспалительные гинекологические заболевания).
Цель исследования. Исследовать морфофункциональное состояние клеток иммунной системы в разное время суток при нормальном и нарушенном световых режимах и при развитии иммунопатологии. Разработать оптимизированные методы хроноиммунокоррекции.
Задачи исследования
1. Изучить колебания на протяжении суток количества и субпопуляционного состава, энергетического метаболизма лимфоцитов периферической крови и лимфоидных органов у интактных крыс Wistar и мышей линии CBA.
2. Определить динамику в течение суток количества и субпопуляционного состава, энергетического метаболизма лимфоцитов периферической крови и лимфоидных органов у крыс Wistar и мышей линии CBA при экспериментальном десинхронозе.
3. Исследовать влияние фармакологической стимуляции функции эпифиза амитриптилином и мелатонином на динамику в течение суток количества и субпопуляционного состава, энергетического метаболизма лимфоцитов периферической крови и лимфоидных органов у крыс Wistar и мышей линии CBA с экспериментальным десинхронозом.
4. Определить динамику в течение суток морфофункциональных параметров иммунокомпетентных клеток периферической крови и уровня мелатонина в слюне и в сыворотке крови у здоровых людей.
5. Выявить изменения на протяжении суток морфофункциональных параметров иммунокомпетентных клеток периферической крови и уровня мелатонина в сыворотке крови у людей с нарушениями иммунного статуса: при бронхиальной астме, при атопическом дерматите.
6. Изучить влияние синтетического аналога мелатонина (мелаксена) на динамику в течение суток морфофункциональных параметров иммунокомпетентных клеток периферической крови при заболеваниях, сопровождающихся нарушением иммунного статуса у людей (бронхиальная астма, атопический дерматит).
7. Исследовать хроноэффективность применения индуктора синтеза интерферона ридостина на клетки иммунной системы у людей с иммунодефицитным состоянием (неспецифические воспалительные гинекологические заболевания).
Научная новизна. Впервые показано, что при постоянном освещении нарушается суточная динамика морфоцитохимических параметров клеток иммунной системы: общее количество клеточных элементов, соотношение их субпопуляций, активность дегидрогеназ в лимфоцитах периферической крови и органах иммунной системы. Впервые выявлено синхронизирующее влияние гормона эпифиза мелатонина и индуктора его синтеза амитриптилина на клетки иммунной системы животных с экспериментальным десинхронозом, вызванным постоянным освещением.
Впервые выявлено, что у здоровых людей взаимоотношения между иммунологическими показателями и уровнем мелатонина неодинаковы в различное время суток.
Впервые обнаружены нарушения суточной динамики субпопуляционного состава лимфоцитов периферической крови, уровня мелатонина и цитокинов в крови у больных бронхиальной астмой и атопическим дерматитом и определена воможность использования в их лечении корректора циркадианных ритмов синтетического аналога мелатонина мелаксена.
Впервые охарактеризованы суточные вариации чувствительности дегидрогеназ лимфоцитов периферической крови к индуктору продукции интерферонов ридостину.
Научно-практическая значимость работы. Результаты работы расширяют знания о гистофизиологии лимфоидной ткани в условиях нормального светового режима, при десинхронозе, иммунопатологии, о механизмах регуляции функций иммунокомпетентных клеток с позиций структурно-временной организации иммунной системы. Показан хронокоррегирующий и иммуномодулирующий эффект амитриптилина и мелатонина при экспериментальном десинхронозе у животных. В этом отношении исследование вносит значительный вклад в развитие нового направления – изучение хронобиологических закономерностей функционирования иммунокомпетентных клеток.
К практическим результатам относятся также данные о хронокорригирующем и иммуномодулирующем эффекте синтетического аналога мелатонина мелаксена при бронхиальной астме и атопическом дерматите.
Результаты исследования показывают эффективность применения биоритмологического подхода для использования иммуномодулирующих препаратов в лечении вторичных иммунодефицитных состояний. Разработаны хронотерапевтические схемы применения ридостина при неспецифических воспалительных гинекологических заболеваниях.
Основные положения, выносимые на защиту
1. Под влиянием постоянного освещения изменяется динамика в течение суток субпопуляционного состава лимфоцитов лимфоидных органов и активности ферментов окислительно-восстановительного метаболизма лимфоцитов животных.
2. Мелатонин и амитриптилин частично восстанавливают суточную динамику субпопуляционного состава лимфоцитов лимфоидных органов и активности ферментов окислительно-восстановительного метаболизма лимфоцитов животных, после их содержания в условиях круглосуточного освещения.
3. У здоровых людей выраженность и характер взаимоотношений между морфофункциональными параметрами иммунокомпетентных клеток и мелатонином индивидуальны и зависят от фазы суточного цикла.
4. У людей при заболеваниях, сопровождающихся нарушениями иммунного статуса (при бронхиальной астме, при атопическом дерматите), изменены суточные колебания субпопуляционного состава лимфоцитов периферической крови, активности их окислительно-восстановительных ферментов, снижен уровень мелатонина в плазме крови. Применение мелаксена в комплексном лечении заболеваний (бронхиальная астма, атопический дерматит) оказывает иммуномодулирующий эффект, вызывает перестройку суточной динамики субпопуляционного состава и окислительно-восстановительного метаболизма лимфоцитов периферической крови, повышает клиническую эффективность лечения.
5. Хронотерапевтический принцип применения индуктора синтеза интерферона ридостина при хронических неспецифических воспалительных гинекологических заболеваниях повышает клиническую эффективность лечения и приводит к более полному восстановлению морфофункциональных характеристик клеток иммунной системы.
Апробация работы. Материалы диссертации доложены и обсуждены на I Сибирском съезде лимфологов с международным участием (Новосибирск, 2006), на VII отчётной конференции ГУ НИИКИ СО РАМН «Иммунопатогенез и иммунотерапия основных заболеваний человека: от эксперимента к клинике» (Новосибирск, 2006), на Международной конференции «Фундаментальные проблемы лимфологии и клеточной биологии» (Новосибирск, 2008), на X Конгрессе Международной ассоциации морфологов (Ярославль, 2010), на Межрегиональном форуме «Актуальные вопросы аллергологии и иммунологии – междисциплинарные проблемы» (Санкт-Петербург, 2010), на заседании проблемной комиссии «Морфология» Научного совета № 56 по медицинским проблемам Сибири, Дальнего Востока и Крайнего Севера Новосибирского отделения Всероссийского общества анатомов, гистологов и эмбриологов (Новосибирск, 2011г.).
Внедрение. Результаты диссертационной работы используются в лечении пациентов, больных бронхиальной астмой, атопическим дерматитом в отделении аллергологии клиники иммунопатологии Государственного учреждения РАМН Научно-исследовательского института клинической иммунологии СО РАМН. Результаты диссертационной работы внедрены в учебный процесс кафедры внутренних болезней 5 курса Медицинского факультета НГУ в лекционный курс по дисциплине «Хрономедицина» с сентября 2010 г. Результаты диссертационной работы использованы в хронобиологическом подходе к планированию экспериментов и трактовке научных результатов в лабораториях Учреждения РАМН Научно-исследовательского института клинической и экспериментальной лимфологии СО РАМН.
Публикации. По теме диссертации опубликована 30 работа, из них – 11 статей в ведущих рецензируемых научных журналах, рекомендуемых ВАК Минобрнауки России для публикаций основных результатов исследования.
Объём и структура работы. Диссертация написана в традиционном стиле и состоит из введения, обзора литературы, описания материалов и методов исследования, главы результатов собственных исследований, обсуждения полученных результатов, выводов, иллюстрирована 35 таблицами и 30 рисунками. Список литературы включает 470 источников (267 отечественных и 203 зарубежных авторов). Диссертация изложена на 320 страницах машинописного текста.
Личный вклад автора. Эксперименты, обработка и анализ их результатов выполнены лично автором. Во всех совместных исследованиях автор принимала непосредственное участие. Совместные работы проводились с сотрудниками Научно-исследовательского института клинической иммунологии СО РАМН (г. Новосибирск). Диагностика заболеваний, обследование и клиническое наблюдение за больными проводились ведущим научным сотрудником Научно-исследовательского института клинической и экспериментальной лимфологии СО РАМН д.м.н., проф. Т. И. Дергачевой в городской клинической больнице № 2 и в медико-социальном центре «Наедине», врачами отделения аллергологии клиники иммунопатологии Научно-исследовательского института клинической иммунологии СО РАМН (директор – д. м. н., проф., акад. РАМН В. А. Козлов).
Автор искренне признателен за квалифицированную помощь научным консультантам – д.м.н., профессору, академику РАМН В. А. Труфакину, д.м.н., профессору А. В. Шурлыгиной, а также д.м.н., профессору В. С. Ширинскому, д.м.н., профессору В. С. Кожевникову, д.м.н., профессору Т. И. Дергачёвой, д.м.н. И. В. Ширинскому, В. М. Непомнящих, инженеру по электронной технике И. Б. Белану, всем сотрудникам лаборатории иммуноморфологии.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование одобрено этическим комитетом Научно-исследовательского института клинической и экспериментальной лимфологии Сибирского отделения РАМН, протокол № 76 от 29.04.2011 (г. Новосибирск). Перед включением в исследование все пациенты подписали форму добровольного информированного согласия.
Характеристика экспериментальных групп животных, отобранных для проведения исследования. 60 крыс Wistar и 60 мышей линии CBA в возрасте 4-х месяцев, самцы (для того, чтобы гормональный фон их был одинаковым на протяжении всего исследования).
Животные забивались в 10.00 ч, 15.00 ч, и 20.00 ч по 5 особей на точку из каждой группы (рис. 1).
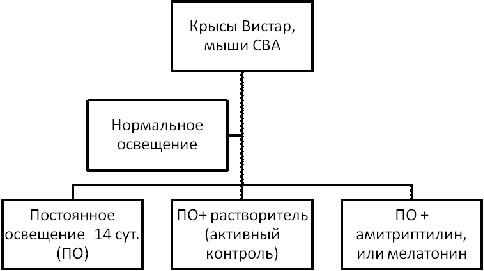

Рис. 1. Эксперимент по исследованию влияния амитриптилина и мелатонина на иммунную систему
Характеристика группы доноров. Для группы пациенток, страдающих хроническими неспецифическими воспалительными гинекологическими заболеваниями, группой сравнения являлись 23 здоровые женщины в возрасте 22 – 30 лет. У всех доноров этой группы регистрировалась вторая фаза менструально-овариального цикла. Для групп пациентов, страдающих бронхиальной астмой или атопическим дерматитом, группой сравнения являлись 36 здоровых доноров (53 % мужчин и 47 % женщин) в возрасте 22 – 30 лет.
Общая характеристика больных. Под наблюдением в 2004 – 2005 гг. находилось 68 женщин в возрасте от 18 до 35 лет, страдающих хроническими неспецифическими воспалениями матки и придатков. Больные были разделены на две группы по 34 человека. Женщинам первой группы ридостин вводили без определения чувствительности к нему лимфоцитов крови; второй группе – назначали препарат во время наибольшей чувствительности к нему лимфоцитов крови. Всем женщинам была проведена лимфотропная антибактериальная терапия [Дергачева Т. И., Анастасьева Н. В. с соавт., 2000], по показаниям физиолечение, витаминотерапия. Ридостин назначали 1 раз в сутки через день до 5 инъекций.
В работе анализировались результаты клинико-иммунологического обследования 248 пациентов с диагнозом бронхиальная астма, из них 161 со смешанным вариантом и 87 с атопическим вариантом, средний возраст обследованных – 32,6 ± 2,51 года, мужчины – 44 %, женщины – 56 %.
Пациентов с атопической и смешанной формами бронхиальной астмы набирали в одну группу, так как литературные данные в большинстве случаев свидетельствуют об отсутствии различий в иммунном статусе этих пациентов в фазу обострения заболевания [Смирнова С. В. с соавт., 2006], при атопической и смешанной формах бронхиальной астмы с тяжёлым течением в фазу обострения заболевания отсутствуют достоверные различия как в уровне цитокинов IL-4 и IFN-, так и IgE в сыворотке периферической крови, также при данных формах заболевания отсутствуют различия по данным корреляционного анализа IgE, IL-4, IFN- [Турдибеков Х. И. с соавт., 2008]. Диагноз и степень тяжести бронхиальной астмы верифицировались согласно международным критериям Консенсуса по бронхиальной астме [«Бронхиальная астма. Глобальная стратегия», 1996].
С целью купирования обострения бронхиальной астмы использовалась стандартная терапия (ингаляционные глюкокортикостероиды, бронхолитики). Группе пациентов с бронхиальной астмой, состоящей из 20 человек (8 мужчин, 12 женщин) назначался препарат мелатонина (Мелаксен, Unifarm, США) в дозе 0,003 г ежедневно в 21.00 ч в течение трёх недель в сочетании со стандартной терапией.
В работе анализировались результаты клинико-иммунологического обследования 146 пациентов с атопическим дерматитом (АД) с распространёнными проявлениями заболевания, средний возраст обследованных – 33,6 ± 2,17 года (мужчины – 42 %, женщины – 58 %), индекс SCORAD – 31,7 – 77,7 баллов (в среднем 44,64 баллов), что соответствует средней и тяжёлой степени течения заболевания у всех обследованных пациентов, без клинических и лабораторных проявлений паразитарной инфекции.
Диагноз атопического дерматита выставлялся на основании международных диагностических критериев, предложенных Hanifin и Rajka [Hanifin J. M., Rajka G., 1980] в модификации Leung и др. [Leung D. Y. et al., 1993], Согласительного документа Ассоциации детских аллергологов и иммунологов России (2004 г.) Уровень IgE в сыворотке периферической крови у 36 пациентов (у 25 %) был в пределах нормативных значений, а у 110 человек (у 75 %) повышен.
При статистическом сравнении данных иммунологических обследований пациентов с нормальным и с повышенным уровнем IgE достоверных различий не выявлено. Поэтому все пациенты с атопическим дерматитом до лечения были объединены в одну группу.
Группе пациентов из 28 человек (11 мужчин, 17 женщин) назначался препарат мелатонина (Мелаксен, Unifarm, США) в дозе 0,003 г ежедневно в 21.00 ч в течение трёх недель в сочетании со стандартной терапией. Под достижением клинической ремиссии у пациентов с атопическим дерматитом понимали снижение индекса SCORAD до 15 и меньше, разрешение клинических признаков и субъективных ощущений, характерных для атопического дерматита в стадии обострения.
Определение количества клеток в лимфоидных органах и периферической крови животных. В органах иммунной системы экспериментальных животных (тимусе, селезёнке, паховых лимфатических узлах) определялось абсолютное количество ядросодержащих клеток, в периферической крови подсчитывали количество лейкоцитов в 1,0 мл крови (Бородин Ю. И. с соавт., 1987).
Методы количественной и функциональной оценки субпопуляций лимфоидных клеток и моноцитов периферической крови. Оценка иммунного статуса включала определение субпопуляционного состава Т- и -
В-лимфоцитов, иммуноглобулинов, цитокинов, фагоцитарной активности моноцитов и нейтрофилов периферической крови (МнНПК). Идентификацию популяций лимфоцитов осуществляли с использованием моноклональных антител (CD3+, CD4+, CD8+, CD16+, CD20+), количественный учёт проводился на иммуноцитометре FACS Calibur (Becton Diskinson, USA) в программе CellQuest (Becton Diskinson, USA). Стимуляцию продукции перекиси водорода выражали как показатель активации нейтрофилов (ПАН) в пробах с лейкоцитами и показатель активации моноцитов в пробах с мононуклеарами с помощью ИФА-ридера Multiscan MS (Labsystems, Финляндия). Функция МнНПК также оценивалась по фагоцитозу Fc-комплексов. Активность ГЗТ-эффекторных клеток в условиях стимуляции миграции клеток субоптимальной дозой митогена учитывали как индекс миграции (ИМ), ингибицию миграции оптимальной дозой митогена учитывали как индекс ингибиции миграции (ИИМ), интегральную активность ГЗТ-эффекторов учитывали как показатель эффекторных функций (ПЭФ) [Лозовой В. П., 1990]. Концентрацию сывороточных иммуноглобулинов IgA, IgM, IgG определяли методом скоростной нефелометрии на иммуноцитохимическом анализаторе (ICS II, Beckman, США). Концентрацию общего IgE в сыворотке крови определяли методом двухсайтового ИФА с использованием наборов реагентов ООО «Хема-Медика». Концентрацию в сыворотке крови IL-4 и IFN-Y определяли методом ИФА с помощью набора реагентов Вектор-БЕСТ (Россия) на ИФА-ридере Multiscan (Labsystems, Финляндия).
Определение субпопуляций лимфоцитов лимфоидных органов животных. Проводили обработку клеток моноклональными антителами (МАТ), меченными флюоресцеином-5-изотиоцинатом (ФИТЦ) к поверхностным лимфоцитарным антигенам CD3, CD4, CD8, и МАТ, мечеными фикоэритрином (ФЭ) к молекуле CD25 (Becton Dickinson). Анализ образцов проводили на проточном цитофлюориметре FACS Calibur (Becton Dickinson, USA).
Определение уровня мелатонина в слюне и сыворотке крови людей. Уровень эндогенного мелатонина определялся в сыворотке крови, взятой в 09.00 ч и в 21.00 ч иммуноферментным методом с применением набора Melatonin – Elisa – Kit (ICN – Biomedicals, Inc.). Уровень мелатонина определяли в слюне, взятой в 09.00 ч и в 21.00 ч, иммуноферментным методом с применение набора Saliva Melatonin- Elisa- Kit (Buhlmann Laboratories AG).
Цитохимическое определение активности ферментов в лимфоцитах крови. Цитохимическое исследование активности дегидрогеназ лимфоцитов венозной крови проводили по методике Р. П. Нарциссова [Нарциссов Р. П., 1969; Меркурьева А. В. с соавт., 1982]. В лимфоцитах периферической крови определяли ферменты окислительно-восстановительного метаболизма – сукцинатдегидрогеназу (СДГ), лактатдегидрогеназу (ЛДГ) и никотинамидинуклеотидфосфат-диафоразу (НАДФ-Д).
Определение хроночувствительности дегирогеназ лимфоцитов периферической крови к ридостину. Для определения оптимального времени введения ридостина пациенткам, страдающим воспалительными неспецифическими заболеваниями придатков матки, исследовалась хроночувствительность сукцинатдегидрогеназы (СДГ) лимфоцитов периферической крови к данному препарату. Чувствительность лимфоцитов крови к ридостину определяли по изменению активности СДГ после инкубации крови с препаратом in vitro в разведении 1 : 100 в течение 15 мин при 37оС.
Статистическая обработка результатов. Для статистической обработки результатов использовался пакет прикладных программ для ПК «Statistica 5». Достоверность различий между группами оценивали по непараметрическому критерию Манна-Уитни, Крускалла-Уоллеса (ANOVA) и с применением многомерного дисперсионного анализа (MANOVA) при 95 % уровня значимости [Гублер Е. В., 1978, Урбах В. Ю., 1963]. Проводился также корреляционный анализ с вычислением коэффициента корреляции Спирмена и анализ по методу 2. Параметры суточного ритма физиологических функций (период, амплитуда, акрофаза, мезор) вычислялись по методу регрессионно-периодического анализа с элементами Косинор-анализа по программе SMD, разработанной д.м.н., проф. А. Ю. Летягиным и ведущим инженером лаборатории иммуноморфологии ГУ НИИКиЭЛ И. Б. Беланом [Бородин Ю. И. с соавт., 1992].
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Количество клеток и их морфоцитохимические показатели в периферической крови и в лимфоидных органах крыс Wistar в зависимости от времени суток, режимов освещения и введения индуктора синтеза мелатонина амитриптилина. Постоянное освещение привело к сглаживанию суточных колебаний всех исследованных показателей. Восстановление циркадианных вариаций клеточного состава после стимуляции синтеза мелатонина в ночное время (введение амитриптилина) наблюдалось только в тимусе и лимфатических узлах. В селезёнке эффект амитриптилина не отличался от эффекта инъекционного стресса – и то, и другое воздействие приводили к усилению циркадианных колебаний количества клеток в органе (рис. 2, 3, 4).
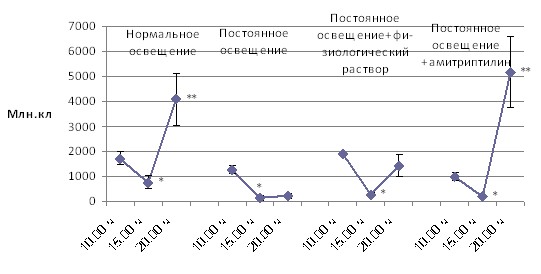
Примечание: * – p < 0,05 от 10.00 ч; ** – p < 0,05 от 15.00 ч.
Рис. 2. Динамика в течение суток общего количества клеток в тимусе
при различных режимах освещения и медикаментозного воздействия
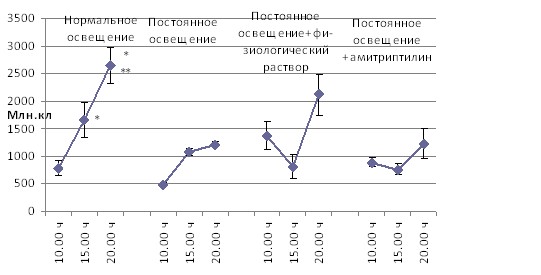
Примечания: * – p < 0,05 от 10.00 ч; ** – p < 0,05 от 15.00 ч.
Рис. 3. Динамика в течение суток общего количества клеток в селезёнке при различных режимах освещения и медикаментозного воздействия
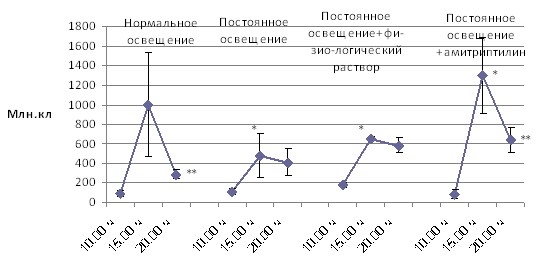
Примечания: * – p < 0,05 от 10.00 ч; ** – p < 0,05 от 15.00 ч.
Рис. 4. Динамика в течение суток общего количества клеток в лимфатических узлах у крыс при различных режимах освещения и
медикаментозного воздействия
Восстановление циркадианных вариаций клеточного состава тимуса и лимфатических узлов под влиянием амитриптилина, являющегося индуктором синтеза мелатонина объясняется тем, что суточные биоритмы клеток тимуса, лимфатических узлов в большей степени находятся под влиянием мелатонина [Арушанян Э. Б. c соавт., 2006; A. Martin-Cacao et al., 1992; Maestroni G. J. M. et al., 1986].
Амитриптилин оказывает синхронизирующее влияние на окислительно-восстановительный метаболизм лимфоцитов (рис. 5), под его влиянием нормализуется утренняя активность ЛДГ, восстанавливается характер суточных вариаций НАДФ-диафоразы.
ЛДГ
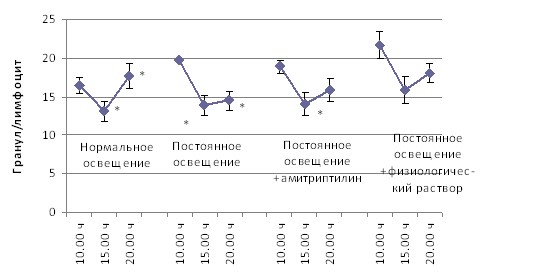
НАДФ-Д
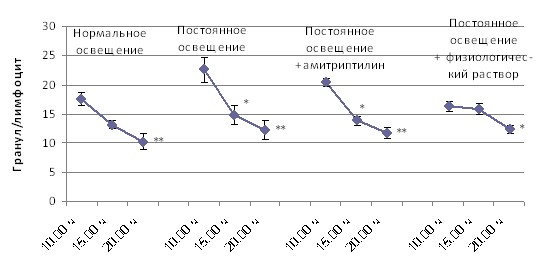
Примечания: * – p < 0,05 от 10.00 ч; ** – p < 0,05 от 15.00 ч.
Рис. 5. Динамика в течение суток активности дегидрогеназ лимфоцитов при при различных режимах освещения и медикаментозного воздействия
Субпопуляционный состав иммунокомпетентных клеток в лимфоидных органах мышей линии CBA в различное время суток в зависимости от режима освещения и введения мелатонина. Влияние постоянного освещения на тимус мышей линии CBA заключается в повышении процента незрелых тимоцитов с фенотипом CD4+8+ в 10.00 часов и абсолютного количества CD4+ в 10.00 ч и в 15.00 часов, с 15.00 ч до 20.00 часов исчезает динамика процентного содержания CD4+ и абсолютного содержания CD8+ клеток, что может свидетельствовать о сглаживании суточного ритма клеточного состава органа (рис. 6).
После введения мелатонина появляются достоверные различия процентного содержания CD4+ и CD4+8+ лимфоцитов в зависимости от времени суток, форма суточной кривой для процентного содержания CD4+8+ приближается к таковой интактных животных, а форма суточной кривой для процентного содержания CD8+ клеток нормализуется (рис. 6).
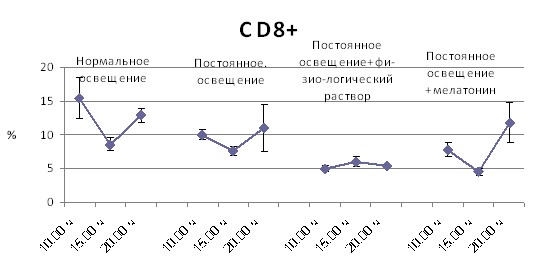
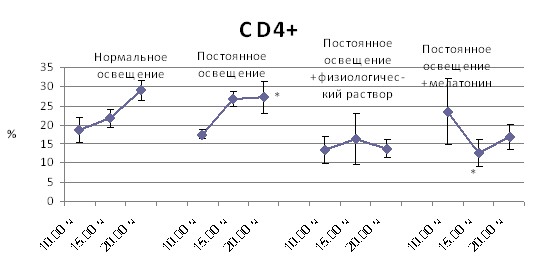

Примечание: * – p < 0,05 от 10.00 ч; ** – p < 0,05 от 15.00 ч
Рис. 6. Динамика в течение суток клеточного состава тимуса в зависимости от режима освещения, введения физиологического раствора или мелатонина
Постоянное освещение вызывает повышение в лимфатических узлах вечернего уровня абсолютного содержания CD4+ лимфоцитов, введение мелатонина нормализует суточную динамику этих клеток (рис. 7).
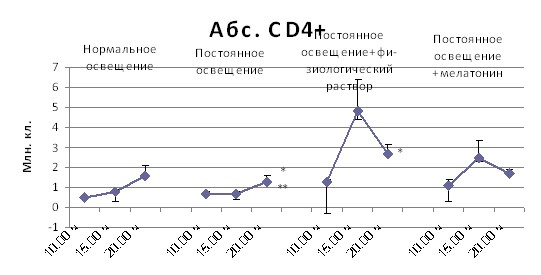
Примечание: * – p < 0,05 от 10.00 ч; ** – p < 0,05 от 15.00 ч
Рис. 7. Динамика в течение суток абсолютного содержания CD4+ лимфоцитов в лимфатических узлах в зависимости от режима освещения, инъекционного стресса и введения мелатонина
Таким образом, под влиянием мелатонина перестраивается характер вариаций в течение суток клеточного состава тимуса и лимфатических узлов мышей, находящихся в условиях нарушенного светового режима, причём по некоторым параметрам они приближаются к интактным животным.
Содержание мелатонина в слюне и иммунокомпетентных клеток в периферической крови у здоровых людей в различное время суток. Характер суточных вариаций концентрации мелатонина в слюне имел индивидуальные особенности. У половины обследованных (у 50 %) максимальная концентрация мелатонина в слюне отмечалась вечером (1 тип суточной динамики). У части доноров (31 %) не выявлено различий между утренним и вечерним уровнем гормона (2 тип суточной динамики), а у части – утренние значения данного показателя превышали вечерние (у 19 %) (3 тип суточной динамики). По уровню утреннего и вечернего мелатонина оказалось возможным разделить всех обследованных на группы: 1В – с высоким (80 мкг/мл), 2В – со средним (13-21 мкг/мл), 3В – с низким уровнем вечернего мелатонина (0-5 мкг/мл); 1У – со средним (10-20 мкг/мл), 2У – с низким уровнем утреннего мелатонина (0-5,5 мкг/мл). В утреннее время ни у одного донора не было обнаружено высокого уровня мелатонина. В группе 1В по сравнению с группами 2В и 3В оказались сниженными среднесуточные значения фагоцитарной активности гранулоцитов, процент HLA-DR+ моноцитов и процент СD16+, но было повышено соотношение CD4+/CD8+ (табл. 1). В группе 1У по сравнению с группой 2У были повышены среднесуточный процент HLA-DR+ моноцитов, процент СD16+ и соотношение CD4+/CD8+, но снижены среднесуточные проценты CD3+, CD8+, CD20+ клеток (табл. 1). В группе со средним утренним уровнем мелатонина отмечается снижение активности ЛДГ в лимфоцитах крови (p < 0,05) (табл. 1).
Таблица 1
Среднесуточные показатели клеток иммунной системы и активность
дегидрогеназ лимфоцитов крови у людей с различными вечерним и
утренним уровнями мелатонина в слюне (M ± SE)
| Показатель | Уровень мелатонина слюны, пкг/мл | ||||
| Вечерний | Утренний | ||||
| 0 – 5 (3 В) | 13 – 21 (2В) | 80 (1 В) | 0 - 5,5 (2У) | 14 - 20 (1У) | |
| % CD3+ | 65,9 ± 2,4 | 64,25 ± 1,6 | 68,75 ± 2,5 | 67,46 ± 4,8 | 58,83 ± 3,6** |
| % CD4+ | 35,65 ± 0,76 | 36,88 ± 2,9 | 38,25 ± 2,4 | 36,85 ± 3,5 | 58,83 ± 4,1 |
| Соотношение CD4+/CD8+ | 1,43 ± 0,01 | 1,73 ± 0,6 | 1,75 ± 0,5 * | 1,47 ± 0,4 | 1,88 ± 0,06** |
| % CD16+ | 12,7 ± 0,59 | 12,0 ± 3,0 | 5,75 ± 0,9 * | 9,65 ± 2,1 | 20,33 ± 2,9** |
| % CD20+ | 13,6 ± 1,3 | 12,0 ± 1,6 | 12,25 ± 1,3 | 13,12 ± 1,4 | 12,67 ± 1,7** |
| % HLA-DR+ моноцитов | 86,13 ± 2,1 | 85,13 ± 6,1 | 73,75 ± 2,5 * | 81,45 ± 5,4 | 93,67 ± 7,5** |
| % фагоцитирующих гранулоцитов | 78,05 ± 5,8 | 75,75 ± 6,2 | 71,25 ± 4,3 * | 76,69 ± 5,9 | 76,33 ± 5,9 |
| ЛДГ (гранул/лимфоцит) | 14,9 ± 0,5 | 12,4 ± 2,4 | 16,8 ± 0,05 | 15,5 ± 2,4 | 10,9 ±4,6 ** |
Примечания: * – p < 0,05 по сравнению с группами с минимальным и средним вечерним уровнем мелатонина; ** – p < 0,05 – по сравнению с группой с минимальным утренним уровнем мелатонина, M-средняя арифметическая, SE-ошибка средней арифметической.
Корреляционные связи мелатонина с иммунологическими показателями наблюдаются только при суточных вариациях гормона 1-го типа: вечерняя концентрация мелатонина находится в отрицательной корреляционной связи с утренним процентным содержанием CD16+ клеток и в положительной – с процентным содержанием активированных моноцитов (HLA-DR+моноциты). Утренняя концентрация мелатонина находится в положительной корреляционной связи с утренним уровнем HLA-DR+ экспрессии на моноцитах и вечерним процентным содержанием CD20+ лимфоцитов.
Таким образом, установлено, что взаимоотношения эндогенного мелатонина с показателями иммунной системы у здоровых людей неодинаковы в разное время суток. Его суточные вариации отражаются на характеристиках иммунокомпетентных клеток и являются индивидуальными, что необходимо учитывать в клинической практике при хроноиммунокоррекции.
Морфофункциональные показатели клеток иммунной системы и содержание мелатонина в сыворотке крови у пациентов с атопическим дерматитом в различное время суток до и после лечения по общепринятой схеме и после добавления к лечению мелаксена. У пациентов с атопическим дерматитом до лечения утренние и вечерние показатели морфофункционального состояния клеток иммунной системы не отличаются друг от друга (табл. 2). У здоровых же утренне-вечерние различия характерны для общего количества лимфоцитов, абсолютного содержания CD3+ и CD4+ клеток, их количество более высокого уровня достигает в утреннее время. У больных до лечения по сравнению со здоровыми в утреннее время статистически значимо увеличение общего IgE, 5-кратное увеличение уровня IL-4 в сыворотке крови, которое характерно для патогенеза данного заболевания [Скрипкина Л. А. с соавт., 2008; Nakazawa M., 1999]. В вечернее время у больных в отличие от здоровых повышено общее количество лимфоцитов, процентное содержание CD20+ клеток, что характеризует гиперактивацию гуморального звена иммунитета [Бережная Н. М., 1997] (табл. 2), абсолютные уровни CD8+ и CD20+, а проценты CD3+ и CD4+ лимфоцитов и иммунорегуляторный индекс снижены. И в 09.00, и в 21.00 ч отмечено также снижение активности всех исследованных дегидрогеназ лимфоцитов, что свидетельствует о снижении энергетических и синтетических процессов в клетках [Прохоренков В. И., 2000], большей напряжённости обменных процессов [Быков О. С. с соавт, 1992], снижении функциональной активности лимфоцитов [Зарецкая Ю. М., 1983].
Таблица 2
Различия в морфоцитохимических показателях иммунокомпетентных клеток, в уровне мелатонина у здоровых и больных с атопическим дерматитом до лечения (M ± SE)
| Показатель | Время суток | |
| 09.00 ч | ||
| Здоровые | Больные | |
| Количество лимфоцитов/мм3 | 2146,2 ± 655,5 | 2082,0 ± 1011,1 |
| IL-4 (пкг/мл) | 20,7 ± 7,6 | 109,0 ± 21,0 # |
| IgE (ЕД/л) | 313,1 ± 41,1 | 516,88 ± 39446 # |
| СДГ (гранул/лимфоцит) | 14,4 ± 1,52 | 11,9 ± 1,58 # |
| ЛДГ (гранул/лимфоцит) | 16,0 ± 2,0 | 11,4 ± 1,49 # |
| НАДФ-Д (гранул/лимфоцит) | 14,4 ± 2,40 | 11,6 ± 1,39 # |
| Мелатонин (пкг/мл) | 66,57 ± 41,0 | 28,66 ± 6,41 |
| Показатель | Время суток | |
| 21.00 ч | ||
| Количество лимфоцитов/мм3 | 1614,5 ± 306,0* | 3395,0 ± 2390,6 # |
| % CD20+ | 13,59 ± 4,79 | 33,0 ± 5,90 # |
| % CD3+ | 65,85 ± 7,24 | 38,04 ± 22,28 # |
| % CD4+ | 36,85 ± 5,59 | 24,78 ± 14,41 # |
| ИРИ (соотношение CD4+/CD8+) | 1,48 ± 0,31 | 0,94 ± 0,23 # |
| СДГ (гранул/лимфоцит) | 15,3 ± 2,69 | 11,24 ± 1,58 # |
| ЛДГ (гранул/лимфоцит) | 14,3 ± 2,52 | 10,9 ± 1,60 # |
| НАДФ-Д (гранул/лимфоцит) | 14,4 ± 2,68 | 12,0 ± 1,68 # |
| Мелатонин (пкг/мл) | 115,3 ± 21,7 * | 25,68 ± 4,73 # |
Примечания: # – p < 0,05 часов от здоровых в соответствующее время суток; * – p < 0,05 в 21.00 ч от 09.00 ч
В отличие от здоровых вечерний уровень мелатонина в сыворотке крови снижен и отсутствуют его суточные вариации, что говорит о состоянии десинхроноза (табл. 2), сопровождающего любое заболевание и проявляющегося в рассогласовании эндогенных биологических ритмов в организме [Лозовой В. П. с соавт., 1979; Туаев В. С. с соавт., 1981; Рахимова О. Ю., 2009; Martini E. et al., 1988; Fei G. H. et al., 2004].
Корреляционный анализ показал, что наличие связей между характеристиками иммунокомпетентных клеток и уровнем цитокинов в крови может свидетельствовать о важной роли -IFN и IL-4 в иммунопатогенезе атопического дерматита.
После стандартного лечения увеличилось процентное содержание Т- и -В-клеток, количество фагоцитирующих гранулоцитов, соотношение CD4+/CD+8, свидетельствующее о нарушении взаимодействия субпопуляций Т-лимфоцитов [Баранова Н. И., Костина Е. М., 2009], повысился уровень циркулирующих иммунных комплексов (ЦИК), персистенция ЦИК ведёт к сенсебилизации организма и дисфункции Т-хелперов [Трофимов И. Б. с соавт, 2001]. И в утреннее и в вечернее время у больных остаётся сниженной активность дегидрогеназ лимфоцитов. Утренне-вечерние различия характерны только для процента фагоцитирующих моноцитов (табл. 3). После лечения, так же как и до лечения, у больных сохраняется сниженным, по сравнению со здоровыми, вечерний уровень мелатонина, и отсутствуют утренне-вечерние различия в его содержании (табл. 3).
После лечения по обычной схеме исчезают корреляционные связи между показателями иммунокомпетентных клеток и концентрацией цитокинов в крови, то есть можно предполагать, что в процессе лечения идут изменения либо цитокинпродуцирующей функции иммунокомпетентных клеток, либо ответа клеток на цитокиновые стимулы.
Можно сделать заключение, что после общепринятой терапии у пациентов с атопическим дерматитом сохраняются негативные изменения в характеристиках клеток иммунной системы, что стимулирует поиск более эффективных методов иммунокоррекции. Отсутствие положительной динамики концентрации мелатонина в сыворотке крови обосновывает целесообразность введения в схему лечения препарата мелаксен, который является синтетическим аналогом мелатонина.
Таблица 3
Характеристика иммунокомпетентных клеток и уровня мелатонина в сыворотке крови у больных с атопическим дерматитом (M ± SE)
| Показатель | До лечения 09.00 ч | После лечения 09.00 ч |
| % CD20+ | 15,21 ± 6,04 | 16,71 ± 1,02 * |
| % фагоцитирующих гранулоцитов | 54,52 ± 11,49 | 65,50 ± 3,76 * |
| ЦИК, усл.ед. | 18,5 ± 3,53 | 23,15 ± 5,89 * |
| Показатель | До лечения 21.00 ч | После лечения 21.00 ч |
| % CD3+ | 38,04 ± 9,32 | 66,0 ± 4,93 * |
| % CD4+ | 24,78 ± 14,41 | 37,66 ± 4,92 * |
| Соотношение CD4+\CD8+ | 0,94 ± 0,23 | 1,61 ± 0,54 * |
| % фагоцитирующих гранулоцитов | 70,61 ± 16,85 | 79,0 ± 10,6 * |
| Показатель | Здоровые 09.00 ч | После лечения 09.00 ч |
| СДГ (гранул\лимфоцит) | 14,4 ± 1,52 | 10,4 ± 1,13 # |
| ЛДГ (гранул\лимфоцит) | 16,0 ± 2,00 | 11,6 ± 2,89 **# |
| НАДФ-Д (гранул\лимфоцит) | 14,4 ± 2,4 | 11,2 ± 2,31 # |
| % фагоцитирующих гранулоцитов | 74,33 ± 14,23 | 65,05 ± 8,14 # |
| % HLA-DR+ моноцитов | 87,36 ± 8,53 | 92,43 ± 3,07 # |
| Мелатонин (пкг\мл) | 66,57 ± 41,0 | 25,75 ± 9,02 |
| Показатель | Здоровые 21.00 ч | После лечения 21.00 ч |
| % CD4+ | 36,85 ± 5,59 | 37,66 ± 4,92# |
| Соотношение CD4+\CD8+ | 1,48 ± 0,31 | 1,61 ± 0,54 # |
| % фагоцитирующих гранулоцитов | 66,76 ± 17,85 | 79,0 ± 10,6 # |
| СДГ (гранул\лимфоцит) | 14,3 ± 2,52 | 11,3 ± 1,27 # |
| ЛДГ (гранул\лимфоцит) | 15,3 ± 2,69 | 11,6 ± 1,54 # |
| НАДФ-Д (гранул\лимфоцит) | 14,4 ± 2,68 | 9,9 ± 1,62 # |
| Мелатонин (пкг\мл) | 115,3 ± 21,7 ** | 28,32 ± 10,87 # |
Примечания: # – p < 0,05 от здоровых; * – p < 0,05 от до лечения; ** – p < 0,05 в 21.00 ч от 09.00 ч.
После лечения с мелаксеном в утреннее время на фоне увеличения количества всех лимфоцитов повысилось относительное содержание CD8+ лимфоцитов, IgМ, процентное содержание фагоцитирующих моноцитов и гранулоцитов. При этом снизился показатель эффекторных функций (ПЭФ) и абсолютное содержание CD20+. Уровни IgE, IL-4 в сыворотке крови также уменьшились, а содержание -IFN не претерпело изменений, однако, отмечается отчётливая тенденция к повышению его уровня в вечернее время суток. Вечером же снизился процент CD4+ лимфоцитов (табл. 4).
Таблица 4
Различия в морфоцитохимических показателях иммунокомпетентных клеток у больных с атопическим дерматитом до и после лечения с мелаксеном (M ± SE)
| Показатель | Время суток (ч) | До лечения | После лечения с мелаксеном |
| Количество лимфоцитов/мм3 | 09.00 | 2082,0±1011,1 | 2700,5±131,4 * |
| % СD8+ | 09.00 | 25,16±5,89 | 38,71±1,45 * |
| % фагоцитирующих гранулоцитов | 09.00 | 61,77±1249 | 77,51±1,82 * |
| % фагоцитирующих моноцитов | 09.00 | 54,52±11,49 | 67,21±7,21 * |
| IgM (г\л) | 09.00 | 1,17±0,84 | 2,73±0,23 * |
| СДГ (гранул/лимфоцит) | 09.00 | 11,4±1,49 | 12,4±1,80 * |
| ПЭФ | 09.00 | 5,14±0,11 | 2,94±0,93 * |
| IL-4 (пг/мл) | 09.00 | 109,0±21,0 | 41,3±17,9 * |
| IgE (Ku/l) | 09.00 | 516,88±394,46 | 466,94±430,3 * |
| % CD4+ | 21.00 | 24,78±14,41 | 20,81±2,03 * |
| IFN- (пг\мл) | 21.00 | 14,5±1,3 | 19,8±4,3 |
| ЛДГ (гранул\лимфоцит) | 21.00 | 11,24±1,58 | 12,4±1,01 * |
Примечание: * – p < 0,05 в сравнении с показателем до лечения.
Следует отметить, что у пациентов, пролеченных с мелаксеном, после завершения лечения изменения в иммунном статусе более выраженные. Так как при аллергической форме атопического дерматита доминируют цитокины, продуцируемые Th-2 клетками, в частности Il-4, вызывающий повышение синтеза IgE В-лимфоцитами [Akdis M. et al., 1997]. Поэтому снижение уровня Il-4 обуславливает и снижение содержания IgE. ПЭФ – является маркёром персистенции аллергического воспаления, снижение ПЭФ это благоприятный признак для прогноза наступупления ремиссии заболевания [Курамшина Д. В., 2003]. Только после лечения с мелаксеном наблюдалось увеличение активности СДГ и ЛДГ, свидетельствующее о повышении энергообеспеченности лимфоцитов и их функциональной активности [Куртасова Л. М. с соавт., 2001] (табл. 4).
Таким образом, обычное лечение и лечение с добавлением мелаксена оказало различное влияние на иммунный статус больных с атопическим дерматитом. После лечения с мелаксеном для некоторых показателей иммунного статуса обнаружены достоверные суточные вариации. Процентное содержание Т-лимфоцитов (CD3+), Т-лимфоцитов хелперов (CD4+), Т-лимфоцитов-эффекторов (CD8+), фагоцитирующих моноцитов, активность СДГ в лимфоцитах оказались достоверно выше в утреннее время, а общее количество лимфоцитов, процентное содержание CD20+, CD16+, активность ЛДГ в лимфоцитах, содержание -IFN в сыворотке крови более высокого уровня достигают в вечернее время.
По результатам корреляционного анализа концентрация -IFN в крови начинает коррелировать с процентным содержанием CD3+, CD4+ лимфоцитов, что может свидетельствовать об активации цитокинпродуцирующей функции Th1. Появляются корреляции уровня -IFN с функциональными показателями иммунокомпетентных клеток (ИИМ, IgA). Концентрация IL-4 коррелирует только с уровнем IgA. Возросшее количество корреляционных взаимосвязей может свидетельствовать об усилении синхронизации между параметрами клеток иммунной системы.
В обеих группах после завершения лечения зарегистрирован положительный клинический эффект. Однако в группе с мелаксеном он был статистически значимо выше – интенсивность и распространенность кожных проявлений по шкале SCORAD уменьшилась на 84 %, тогда как в группе пациентов, пролеченных без мелаксена, – на 60 %. Положительный эффект лечения в группе пациентов без мелаксена зарегистрирован у 70 % больных, а у получавших мелаксен – у 88 %. В группе пациентов, получавших мелаксен, на 7 – 8 дней быстрее претерпели положительную динамику такие клинические составляющие индекса SCORAD, как нарушение сна и кожный зуд. Следовательно, положительные изменения в иммунном статусе сочетаются с более выраженным клиническим эффектом от лечения с добавлением мелаксена. Немаловажную роль в повышении эффективности лечения, по-видимому, играет синхронизирующее действие препарата на суточную ритмику морфофункционального состояния клеток иммунной системы.
Морфофункциональные показатели клеток иммунной системы и содержание мелатонина в сыворотке крови у пациентов с бронхиальной астмой в различное время суток до и после лечения по общепринятой схеме и после добавления к лечению мелаксена. В 09.00 часов у больных по сравнению со здоровыми снижены процент Т-лимфоцитов (CD3+), процент фагоцитирующих гранулоцитов и моноцитов, а процент NK-клеток (CD16+), В-лимфоцитов (СD20+), активированных моноцитов (HLA-DR+) повышены (у здоровых – 87,36 ± 8,53; у больных – 90,49 ± 6,23). В 21.00 час процент Т-лимфоцитов (CD3+), Т-лимфоцитов хелперов (CD4+), соотношение CD4+/CD8+, процент фагоцитирующих гранулоцитов и моноцитов ниже аналогичных показателей здоровых людей (табл. 5). Таким образом, у больных с бронхиальной астмой отмечается угнетение Т-клеточного и фагоцитарного звеньев иммунной системы и в утреннее и вечернее время суток, что является патогномоничным для данного заболевания [Рябова Л. В. с соавт., 2004; Шамова Д. В. с соавт., 2003]. А повышенный уровень В-лимфоцитов в утреннее время свидетельствует об активации гуморальных иммунных реакций, что также характерно для атопии [Порядин Г. В. с соавт., 2002].
У больных имеются утренне-вечерние различия в показателях клеток иммунной системы. В вечернее время отмечается повышение общего количества лимфоцитов, а процентное содержание лимфоцитов с фенотипами CD3+, CD4+, а также иммунорегуляторный индекс и процент активированных Т-лимфоцитов хелперов (HLA-DR+ CD4+) снижается (табл. 5). У здоровых же в утренне-вечерние различия характерны для общего количества лимфоцитов, для абсолютного содержания CD3+ и CD4+, их количество выше в 09.00 ч (табл. 5).
После стандартного лечения в утреннее время наблюдается снижение процента фагоцитирующих гранулоцитов и повышение уровня CD4+ клеток, количество активированных Т-хелперов (HLA-DR+CD4+) снизилось, а так как HLA-DR является маркёром поздней активации лимфоцитов, то это свидетельствует о снижении потенциальных возможностей Т-лимфоцитов [Цибулькин А. П. с соавт., 2004]. Увеличилось также соотношение CD4+/CD8+, а в вечернее время более высоких цифр достигает общее количество лимфоцитов. После лечения значительно меньшее количество показателей иммунограммы стало иметь утренне-вечерние различия (они наблюдаются только у CD16+ клеток). До лечения и после стандартного лечения содержание мелатонина в сыворотке крови также не имеет утренне-вечерних различий. И его уровень в вечернее время остаётся сниженным по сравнению со здоровыми (табл. 5).
После лечения с мелаксеном перестало отличаться от нормальных величин доноров соотношение CD4+/CD8+ (табл. 5),что свидетельствует о нормализации взаимодействия субпопуляций Т-лимфоцитов [Баранова Н. И. с соавт., 2009].
После лечения с мелаксеном нормолизовались процентное содержание CD3+, CD4+, CD20+, CD16+ клеток, фагоцитирующих моноцитов, общее количество лимфоцитов, абсолютное количество CD20+. Процентное содержание CD8+ лимфоцитов стало выше, чем после стандартной терапии, то есть лечение с мелаксеном оказало влияние на процесс регуляции антителообразования, так как сниженный уровень этих клеток патогенетически связан с нарушением синтеза антител [Потекаев Н. С. c соавт., 1991; Калюжная Л. Д. с соавт.,1994]. Утренне-вечерние различия стали характерны только для процента фагоцитирующих гранулоцитов (табл. 5).
Таблица5
Различия в содержании клеток иммунной системы у здоровых и у больных с бронхиальной астмой
до и после лечения (M ± SE)
| Показатель | Время суток | |||||||||||
| 09.00 час | 21.00 час | |||||||||||
| Здоровые | До лечения | После лечения | После лечения с мелаксеном | Здоровые | До лечения | После лечения | После лечения с мелаксеном | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||||
| Количество лимфоцитов / мм3 | 2146,2 ± 655,5 | 2280,6 ± 1096,0 | 2306,9 ± 1342,2 | 1771,9 ± 693,6 | 1614,5 ±306,0 *** | 2402,3 ± 335,7 #, *** | 4114,7 ± 2449,8 #, *** | 3725,0 ± 2278,4 | ||||
| % CD3+ | 66,51 ± 6,94 | 60,25 ± 10,71 # | 65,88 ± 8,31 ** | 62,66 ± 13,70 | 65,85 ± 7,24 | 51,86 ± 12,76 #, *** | 69,25 ± 8,17 ** | 56,5 ± 5,31 #, *** | ||||
| % CD4+ | 36,41 ± 5,49 | 36,7 ± 9,86 | 40,05 ± 8,25 **, # | 34,83 ± 9,77 | 36,85 ± 5,59 | 32,12 ± 9,63 #, *** | 40,62 ± 6,6 ** | 34,83 ± 8,68 | ||||
| % CD16+ | 11,0 ± 5,78 | 15,70 ± 10,1# | 12,17 ± 6,92 ** | 14,18 ± 6,43 | 13,25 ± 7,4 | 15,08 ± 7,89 | 15,12 ± 8,8 | 11,5 ± 7,86 | ||||
| % CD20+ | 12,65 ± 5,4 | 16,85 ± 6,99 # | 12,94 ± 7,83 ** | 12,5 ± 5,33 ** | 13,59 ± 4,7 | 16,23 ± 6,88 | 10,87 ± 4,1 ** | 12,83 ± 7,44 | ||||
| Продолжение Таблицы 5 | ||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||||
| % CD8+ | 26,03 ± 5,67 | 24,0 ± 6,73 | 24,07 ± 6,26 | 28,58 ± 4,52 **, **** | 25,77 ± 4,67 | 28,5 ± 14,40 | 28,25 ± 5,54 | 28,33 ± 11,11 | ||||
| ИРИ (соотношение CD4+/CD8+) | 1,48 ± 0,38 | 1,68 ± 0,81 | 1,75 ± 0,52 * | 1,27 ± 0,57 **** | 1,48 ± 0,31 | 1,41 ± 1,37 ***, # | 1,49 ± 0,39 | 1,46 ± 0,76 | ||||
| % HLA-DR СD4+ | _ | _ | 2,32 ± 1,19 | 1,24 ± 0,19 *** | 1,07 ± 0,36 ** | – | – | – | ||||
| % фагоцитрующих гранулоцитов | 74,37 ± 14,23 | 57,04 ± 13,75 # | 64,90 ± 13,07 **, # | 63,75 ± 8,86 # | 66,76 ± 17,85 | 63,33 ± 10,35 # | 68,28 ± 5,87 | 77,66 ± 11,23 *** | ||||
| % фагоцитрующих моноцитов | 56,53 ± 16,55 | 52,29 ± 13,20# | 57,03 ± 12,06 | 57,33 ± 10,05 | 61,44 ± 9,00 | 55,41 ± 8,0# | 55,28 ± 8,55 | 65,0 ± 12,76 | ||||
| Мелатонин (пкг\мл) | 66,57 ± 41,0 | 20,88 ± 5,72 | 44,61 ± 21,9 | _ | 115,33 ± 21,7 *** | 41,93 ± 20,5 # | 33,2 ± 16,2# | _ | ||||
Примечания: # – p < 0,05 от здоровых;** – p < 0,05 от до лечения; *** – p < 0,05 от 09.00 ч; **** – p < 0.05 лечение с мелаксеном от стандартного лечения, M-средняя арифметическая, SE-ошибка средней арифметической.
При корреляционном анализе выявлено, что связи между цитокинами становятся более сильными (IFN- и IL-4) и появляются их корреляции с активированными моноцитами.
Показателем эффективности лечения могут служить данные спирографического исследования функции внешнего дыхания. После стандартного лечения достоверно увеличился процент имеющейся жизненной ёмкости лёгких от должностной (до лечения – 91,50 ± 6,74; после лечения - 104,10 ± 11,56). После лечения с добавлением мелаксена увеличился объём форсированного выдоха за 1-ю секунду (до лечения – 1,96 ± 0,02; после лечения – 2,38 ± 0,46), этот показатель наиболее полно отражает состояние дыхательной системы при бронхиальной астме [Айсанов З. Р., с соавт., 2007]. Отмечается тенденция к увеличению фактической жизненной ёмкости лёгких. После лечения с мелаксеном у значительно большего процента пациентов улучшилась функция внешнего дыхания – увеличилась ЖЕЛ, ОФВ1. Можно заключить, что влияние лечения с мелаксеном на вентиляционную функцию лёгких эффективнее стандартной терапии.
Таким образом, после лечения с мелаксеном отмечается нормализация значительно большего числа показателей иммунокомпетентных клеток. Это ассоциируется с более выраженным клиническим эффектом. Однако произошло уменьшение корреляционных связей между исследованными показателями и нивелирование утренне-вечерних различий между ними. Объяснением этому может быть разрушение патологических ритмов, которое должно предшествовать формированию нормальной временной организации [Арушанян Э. Б., 1999].
Хронотерапевтический режим применения ридостина у пациенток с хроническими неспецифическими воспалительными гинекологическими заболеваниями. У пациенток до лечения обнаружено повышение количества натуральных киллерных клеток – CD16+-лимфоцитов, снижена активация моноцитарно-макрофагального звена иммунной системы – HLA-DR+-моноцитов, снижена среднесуточная активность СДГ и ЛДГ (табл. 8).
Таблица 8
Характеристика клеток иммунной системы здоровых и больных с ХНВГЗ до и после различных видов лечения ридостином (M ± SE)
| Показатель | Время суток | Здоровые | До лечения | После лечения | |
| Без учета чувствительности к ридостину | С учетом чувствительности к ридостину | ||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| % CD3+ | 09.00 | 65,5 ± 1,26 | 64,4 ± 2,8 | 71,1 ± 2,2 # | 70,4 ± 1,7 # |
| % CD4+ | 09.00 | 36,7 ± 0,81 | 32,3 ± 3,0 | 41,4 ± 1,5 # | 38,6 ± 1,6 |
| % CD8+ | 09.00 | 26,2 ± 1,78 | 30,2 ± 2,0 | 34,8 ± 1,9 # | 25,5 ± 0,9 |
| % CD16+ | 09.00 | 9,3 ± 1,59 | 14,9 ± 2,0# | 6,6 ± 1,1 # ** | 8,1 ± 1,1 ** |
| % CD20+ | 09.00 | 11,4 ± 0,62 | 8,9 ± 1,7 | 7,2 ± 0,7 # | 8,4 ± 0,6 # |
| СДГ | Среднесут. | 14,5 ± 2,4 | 11,6 ± 1,5 # | 10,7 ± 1,8 # | 22,1 ± 3,2 |
| СДГ | 09.00 | 16,7 ± 2,1 | 11,2 ± 0,9 * | 10,3 ± 1,1 # | 23,4 ± 3,9 |
| СДГ | 21.00 | 18,3 ± 2,5 | 10,4 ± 1,2 # | 14,1 ± 1,7 # | 24,0 ± 4,9 |
| ЛДГ | Среднесут. | 15,7 ± 1,7 | 11,5 ± 0,9 # | 10,9 ± 1,2 # | 15,8 ± 2,4 |
| ЛДГ | 09.00 | 14,2 ± 2,4 | 10,7 ± 1,8 # | 12,3 ± 3,2 # | 14,8 ± 2,7 |
| ЛДГ | 21.00 | 16,1 ± 2,8 | 12,3 ± 1,7 # | 11,5 ± 1,4 # | 16,5 ± 2,4 |
Примечания: *# – p < 0,05 от группы «здоровы; ** – p < 0,05 от группы «до лечения; *** – p < 0,05 от группы «после лечения без учета чувствительности».
Эти изменения в иммунном статусе свидетельствует о дефектах фагоцитарного звена иммунной системы при частых и длительных бактериальных инфекциях. [Трунова Л. А. с соавт., 2001]. После стандартного лечения отмечено повышение относительного количества CD3+, CD4+, CD8+ клеток, снижение процентного содержания CD20+ и CD16+ и активированных моноцитов (табл. 8).
После хронотерапии ридостином увеличилось относительное количество CD3+, процентное содержание натуральных киллеров (CD16+) снизилось до контрольных показателей, а процент активированных моноцитов, хоть и остался сниженным по сравнению с его уровнем у здоровых, стал выше, чем после обычной схемы назначения препарата, повысилась активность и СДГ и ЛДГ.
У пациенток до лечения и после обычного лечения значительно реже встречались достоверные суточные вариации активности дегидрогеназ, что свидетельствует о наличии состояния десинхроноза. После хронотерапии ридостином процент пациенток с достоверными различиями между утренней и вечерней активностью дегидрогеназ становится значительно выше.
Процент пациенток с хорошим эффектом после хронотерапии (50 %) выше, чем пролеченных ридостином по обычной схеме (16,7 %). Частичный эффект от лечения отмечался в обеих группах у 50 % пациенток. У 33,3 % пациенток эффект от лечения отсутствовал, и это наблюдалось только в группе, которой ридостин вводили без учёта времени чувствительности к нему СДГ лимфоцитов.
ВЫВОДЫ
1. У крыс Wistar и у мышей линии CBA после содержания животных при постоянном освещении сглаживаются имеющиеся при нормальном режиме освещения суточные колебания количества лейкоцитов и лимфоцитов периферической крови, обшего количества клеток тимуса, селезёнки и паховых лимфатических узлов, субпопуляционного состава лимфоцитов тимуса и паховых лимфатических узлов. Повышается утренняя активность НАДФ-диафоразы и ЛДГ в лимфоцитах крови, её максимальная активность смещается с вечернего на утреннее время.
2. Мелатонин восстанавливает изменённые суточные вариации клеточного и субпопуляционного состава тимуса. Амитриптилин восстанавливает нарушенные суточные вариации клеточного состава тимуса и паховых лимфатических узлов. Препараты оказывают синхронизирующее влияние на окислительно-восстановительный метаболизм лимфоцитов животных в условиях постоянного освещения.
3. У здоровых людей суточные вариации концентрации мелатонина в слюне индивидуальны и отражают его взаимоотношения с иммунокомпетентными клетками (при высоком вечернем уровне мелатонина снижены среднесуточный процент фагоцитарующих гранулоцитов, процент HLA-DR+ моноцитов и CD16+ лимфоцитов, а соотношение CD4+/CD8+ повышено. При средним утреннем уровне мелатонина повышено среднесуточное содержание в крови HLA-DR+ моноцитов, CD16+ лимфоцитов и соотношение CD4+/CD8+, но снижены среднесуточные уровни процента CD3+ и CD8+ лимфоцитов).
4. У больных с атопическим дерматитом и с бронхиальной астмой, в отличие от здоровых, отсутствуют суточные вариации уровня мелатонина в крови, снижена вечерняя концентрация гормона. У больных с атопическим дерматитом отсутствуют корреляционные связи концентрации мелатонина в крови с показателями иммунокомпетентных клеток.
5. При лечении больных с атопическим дерматитом с введением мелаксена происходят изменения иммунного статуса, имеющего положительное прогностическое значение (появляются суточные колебания субпопуляционного состава иммунокомпетентных клеток, снижается процент Т-хелперов (CD4+), увеличивается относительное содержание Т-эффекторов (CD8+), повышается процент фагоцитирующих моноцитов и гранулоцитов, снижается показатель эффекторных функций, снижается содержание в сыворотке крови IgE и IL-4, повышается активность окислительно-восстановительных ферментов в лимфоцитах крови). Это сочетается с большей клинической эффективностью данного метода лечения по сравнению с общепринятой терапией (более низкий балл по шкале SCORAD).
6. Лечение больных c бронхиальной астмой с добавлением мелаксена более эффективно по сравнению со стандартным курсом, о чём свидетельствует увеличение: фактической жизненной ёмкости лёгких, процента жизненной ёмкости лёгких к должностной, объёма форсированного выдоха за 1-ю секунду, процента объёма форсированного выдоха за 1-ю секунду к должностному. Наблюдается нормализация процентного содержания CD3+, CD4+, CD8+, CD20+, CD16+ лимфоцитов, соотношения CD4+/CD8+. Изменяются параметры суточных ритмов физиологических показателей: снижается мезор частоты дыхания, смещаются на более раннее время суток акрофазы частоты дыхания, длительности индивидуальной минуты и тревожности.
7. Лечение пациенток с хроническими неспецифическими воспалительными заболеваними с назначением ридостина по хронотерапевтической схеме увеличивает в 3 раза количество пациенток с хорошим эффектом от лечения. Количество пациенток с частичным эффектом от лечения не изменяется.
8. Хронотерапевтическое назначение ридостина нормализует количество естественных киллерных клеток и активированных моноцитов крови, повышает активности СДГ и ЛДГ лимфоцитов. Лечение ридостином без учета чувствительности к нему лимфоцитов крови приводит к дальнейшему нарушению показателей клеток иммунной системы: еще больше снижается процент HLA-DR+ моноцитов, содержание В-лимфоцитов, натуральных киллерных клеток (CD16+), повышается процент лимфоцитов с фенотипом Т-хелперов (CD4+) и Т-супрессоров/киллеров (CD8+).
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Труфакин В. А., Шурлыгина А. В., Дергачева Т. И., Литвиненко Г. И., Вербицкая Л. В. Хронобиология иммунной системы // Вестник Российской академии медицинских наук. – 1999. – № 4.- С. 40 – 43, автора – 0,08 п.л.
2. Литвиненко Г. И., Вербицкая Л. В., Тараданова Л. В., Мельникова Е. В., Тендитник М. В., Шурлыгина А. В., Труфакин В. А. Влияние амитриптилина на суточные колебания клеточного состава органов иммунной системы крыс при экспериментальном десинхронозе // Бюллетень экспериментальной биологии и медицины. – 2000. – №11. – С. 589 – 592, автора – 0,05 п.л.
3. Литвиненко Г. И., Шурлыгина А. В., Труфакин В. А. Влияние амитриптилина на колебания активности ферментов окислительно-восстановительного метаболизма лимфоцитов крыс в течении суток при экспериментальном десинхронозе // Бюллетень экспериментальной биологии и медицины. – 2001. – № 5. – С. 577 – 579, автора – 0,08 п.л.
4. Литвиненко Г. И., Нимаев В. В., Хабаров Д. В., Шурлыгина А. В., Труфакин В. А. Суточные вариации чувствительности дегидрогеназ лимфоцитов крови больных лимфедемой к перфузату ксеноселезёнки in vitro // Бюллетень Сибирского отделения Российской академии медицинских наук. – 2001. – № 4. – С. 108 – 109, автора – 0,05 п.л.
5. Литвиненко Г. И., Шурлыгина А. В., Малышева О. А., Кудаева О. Т., Ширинский В. С., Козлов В. А., Труфакин В. А. Изучение суточных вариаций содержания мелатонина в слюне и иммунокомпетентных клеток в крови у здоровых людей // Бюллетень экспериментальной биологии и медицины. – 2002. – № 5. – С. 578 – 581, автора – 0,05 п.л.
6. Литвиненко Г. И., Шурлыгина А. В., Дергачева Т. И., Мельникова Е. В., Вербицкая Л. В., Кречетова Е. В., Труфакин В. А. Хронотерапевтический режим применения ридостина в целях коррекции нарушений иммунного статуса у пациенток с хроническими неспецифическими воспалительными гинекологическими заболеваниями // Российский вестник акушера-гинеколога. – 2004. – Т.4, №6 – С. 12 – 15, автора – 0,07 п.л.
7. Литвиненко Г. И., Шурлыгина А. В., Вербицкая Л. В., Пантелеева Н. Г., Мельникова Е. В., Труфакин В. А. Суточная динамика клеточного состава тимуса и лимфоузлов мышей в норме, при постоянном освещении и при введении мелатонина // Бюллетень экспериментальной биологии и медицины. – 2005. – Т. 140, № 8. – С. 181 – 185, автора – 0,10 п.л.
8. Литвиненко Г. И., Шурлыгина А. В., Ширинский В. С., Непомнящих В. М., Леонова М. И., Круглеева О. Л., Григорьева А. Е., Козлов В. А., Труфакин В. А. Суточные вариации иммунного статуса и содержания мелатонина в сыворотке крови у пациентов с бронхиальной астмой // Бюллетень экспериментальной биологии и медицины. – 2006. – Т. 142, № 11. – С. 553 – 556, автора – 0,05 п.л.
9. Ширинский В. С., Непомнящих В. М., Леонова М. И., Круглеева О. Л., Кожевников В. С., Соловьёва Н. Ю., Шурлыгина А. В., Литвиненко Г. И., Ширинский И. В., Малышева О. А. Эффективность и безопасность применения мелатонина у больных атопическим дерматитом // Медицинская иммунология. – 2006. – Т.8, № 5-6. – С. 707 – 714, автора – 0,10 п.л.
10. Шурлыгина А. В., Литвиненко Г. И., Дергачёва Т. И., Ковшик И. Г., Абдалова А. М., Пантелеева Н. Г., Мельникова Е. В., Труфакин В. А. Хроноэффективность экзогенных цитокинов // Российский иммунологический журнал. – 2008. – Т. 2 (11), № 2-3. – С. 138, автора – 0,03
11. Литвиненко Г. И. Хронофармакологические свойства мелатонина // Бюллетень Сибирского отделения Российской академии медицинских наук. – 2010. – Том 30, № 6. – С. 82 – 88, автора – 0,8 п.л.
12. Литвиненко Г. И., Вербицкая Л. В., Шурлыгина А. В. Возможности коррекции экспериментального десинхроноза в лимфоидной системе путем фармакологического воздействия на синтез мелатонина в эпифизе // Проблемы экспериментальной, клинической и профилактической лимфологии : труды НИИКиЭЛ СО РАМН. – Новосибирск, 2000. – С. 173 – 174, автора – 0,08п.л.
13. Литвиненко Г. И., Шурлыгина А. В., Труфакин В. А. Влияние амитриптилина на суточные колебания морфоцитохимических показателей органов иммунной системы крыс при экспериментальном десинхронозе // Современные проблемы аллергологии, иммунологии и иммунофармакологии : тезисы докладов 4-го Конгресса РААКИ. – Москва, 2001. – Т.2. – С. 285, автора – 0,04 п.л.
14. Литвиненко Г. И., Шурлыгина А. В., Ширинский В. С., Труфакин В. А. Взаимоотношения суточных вариаций эндогенного мелатонина с показателями иммунного статуса у здоровых людей // Материалы 4 съезда физиологов Сибири. – Новосибирск, 2002. – С. 156 – 157, автора – 0,06 п.л.
15. Труфакин В. А., Шурлыгина А. В., Дергачёва Т. И., Литвиненко Г. И. Биоритмы цитокиновой иммунорегуляции // Материалы 4 съезда физиологов Сибири, 2002. – С. 279, автора – 0,03п.л.
16. Литвиненко Г. И., Шурлыгина А. В., Дергачёва Т. И., Мельникова Е. В. Хронотерапевтический режим применения ридостина в целях коррекции нарушений иммунного статуса у пациенток с хроническими неспецифическими воспалительными гинекологическими заболеваниями // Проблемы экспериментальной, клинической и профилактической лимфологии : материалы научной конференции с международным участием. – Новосибирск, 2002. – С. 230 – 232, автора – 0,09 п.л.
17. Труфакин В. А., Шурлыгина А. В., Ширинский В. С., Литвиненко Г. И., Кудаева О. Т., Козлов В. А. Суточный ритм эндогенного мелатонина как фактор, влияющий на показатели иммунного статуса у здоровых людей // Аллергология и иммунология : матер. 5-го Съезда иммунологов и аллергологов СНГ. – 2003. – Т. 4, №2. – С.70, автора – 0,02 п.л.
18. Дергачева Т. И., Литвиненко Г. И., Мельникова Е. В., Вербицкая Л. В., Кречетова Е. В., Шурлыгина А. В., Труфакин В. А. Иммунокорригирующая хронотерапия пациенток с хроническими неспецифическими воспалительными гинекологическими заболеваниями // Проблемы лимфологии и интерстициального массопереноса : материалы научной конференции с международным участием.– Новосибирск, 2004. – Т.10 (1). – С.245-248, автора – 0,07 п.л.
19. Дергачева Т. И., Кречетова Е. В., Шурлыгина А. В., Литвиненко Г. И., Мельникова Е. В., Вербицкая Л. В. Коррекция нарушений иммунного статуса у пациенток с воспалительными заболеваниями матки и придатков // Актуальные вопросы современной медицины : материалы XYI научно-практической конференции. – Новосибирск. 2004. – С. 4-5, автора – 0,04 п.л.
20. Литвиненко Г. И., Шурлыгина А. В., Мельникова Е. В., Труфакин В. А. Суточные вариации клеточного состава тимуса и лимфоузлов мышей в норме, при постоянном освещении и при введении мелатонина // Проблемы лимфологии и интерстициального массопереноса : материалы научной конференции с международным участием. – Новосибирск, 2004. – Т.10(1). – С. 245 – 248, автора – 0,13 п.л.
21. Шурлыгина А. В., Литвиненко Г. И.,Мельникова Е. В., Труфакин В. А. Суточные вариации эндогенного мелатонина и морфофункциональные показатели лейкоцитов крови у здоровых людей // Проблемы лимфологии и интерстициального массопереноса : материалы научной конференции с международным участием. – Новосибирск, 2004. – Т.10(1). – С. 209 – 212, автора – 0,16 п.л.
22. Литвиненко Г. И., Шурлыгина А. В., Труфакин В. А., Кудаева О. Т., Ширинский В. С., Козлов В. А. Взаимоотношения мелатонина и иммунного статуса в течении суток у здоровых людей // Физиология иммунной системы, перспективные подходы к диагностике и терапии иммунопатологий и аллергических заболеваний : материалы V симпозиума. – Москва, 2006. – С. 43– 44, автора – 0,04 п.л.
23. Литвиненко Г. И., Шурлыгина А. В., Ширинский В. С., Непомнящих В. М., Труфакин В. А., Козлов В. А. Сравнительная динамика иммунного статуса на протяжении суток у пациентов с атопическим дерматитом до и после лечения без мелаксена и с мелаксеном // 1-й Сибирский съезд лимфологов с международным участием. – Новосибирск, 2006. – С. 185 – 187, автора – 0, 08 п.л.
24. Ширинский В. С., Непомнящих В. М., Круглеева О. Л., Ширинский И. В., Шурлыгина А. В., Шурлыгина А. В., Козлов В. А. Применение мелатонина у больных атопическим дерматитом // V Всемирный конгресс по иммунопатологии и аллерглогии : материалы конгресса – Москва, 2007. – 27, автора – 0,02 п.л.
25. Ширинский В. С., Непомнящих В. М., Леонова М. И., Круглеева О. Л., Шурлыгина А. В., Литвиненко Г. И., Кожевников В. С., Ширинский И. В., Малышева О. А. Эффективность и безопасность применения мелатонина у больных атопическим дерматитом // Иммунопатогенез и иммунотерапия основных заболеваний человека: от эксперимента к клинике : материалы 7-й отчётной конференции ГУ НИИКИ СО РАМН. – Новосибирск. – 2006. – С. 285 – 286, автора – 0,03 п.л.
26. Ширинский В. С., Непомнящих В. М., Леонова М. И., Шурлыгина А. В., Литвиненко Г. И., Кожевников В. С., Ширинский И. В., Малышева О. А. Изучение суточных вариаций иммунокомпетентных клеток крови при Th-1 и Th-2 опосредованных заболеваниях // Иммунопатогенез и иммунотерапия основных заболеваний человека: от эксперимента к клинике : материалы 7-й отчётной конференции ГУ НИИКИ СО РАМН. – Новосибирск, 2006. – С. 244 – 247, автора – 0,06 п.л.
27. Литвиненко Г. И., Шурлыгина А. В., Труфакин В. А., Вербицкая Л. В., Мельникова Е. В., Пантелеева Н. Г., Тендитник М. В., Тараданова Л. В. Коррекция амитриптилином десинхронизирующего влияния постоянного освещения на клеточный состав органов иммунной системы крыс // Морфология и хирургия : сборник научных трудов. Выпуск 6. / Под ред. проф. В. А.Головнева и проф. А. В.Волкова. – Новосибирск: Сибмедиздат НГМУ, 2007. – С.86-90, автора – 0,06п.л.
28. Ширинский В. С., Непомнящих В. М., Леонова М. И., Круглеева О. Л., Кожевников В. С., Соловьёва Н. Ю., Шурлыгина А. В., Литвиненко Г. И., Ширинский И. В., Малышева О. А. Иммунофармакодинамика и эффективность гормона мелатонина у больных атопическим дерматитом // Тезисы форума. Российский иммунологический журнал. – 2008. – Т. 2 (11), № 2 – 3. – С. 221, автора – 0,01 п.л.
29. Шурлыгина А. В., Мичурина С. В., Вербицкая Л. В., Литвиненко Г. И., Ковшик И. Г., Пантелеева Н. Г., Мельникова Е. В., Труфакин В. А. Нарушение циркадных ритмов как фактор, вызывающий дестабилизацию функций иммунной системы // Фундаментальные проблемы лимфологии и клеточной биологии : материалы Международной научной конференции. – Новосибирск, 2008. – С. 219–220, автора – 0,03 п.л.
30. Бородин Ю. И., Литвиненко Г. И., Шурлыгина А. В. Зависимость субпопуляционного состава клеток тимуса от времени суток, режима освещения и введения мелатонина // Морфология. X Конгресс Международной Ассоциации лимфологов. – 2010. – Т.137, №4.– С.39, автора – 0,04 п.л.

