Клетки дермальной папиллы из нервного гребня в морфогенезе волосяного фолликула
На правах рукописи
Гнедева Ксения Юрьевна
Клетки дермальной папиллы из нервного гребня в морфогенезе волосяного фолликула
Специальности 03.03.04. – клеточная биология, цитология, гистология;
03.03.05. – биология развития, эмбриология
АВТОРЕФЕРАТ
Диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2012
Работа выполнена в лаборатории проблем клеточной пролиферации Учреждения Российской академии наук Института биологии развития им. Н.К. Кольцова РАН и в лаборатории нейрогенеза Sanford-Burnham Medical Research Institute (La Jolla, Калифорния, США).
Научные руководители: кандидат биологических наук
Воротеляк Екатерина Андреевна (ИБР РАН)
кандидат биологических наук
Терских Алексей Васильевич (Sanford-Burnham)
Официальные оппоненты: доктор биологических наук
Александрова Мария Анатольевна (ИБР РАН)
доктор биологических наук, профессор,
Гривенников Игорь Анатольевич (ИМГ РАН)
Ведущая организация: Московский государственный университет
имени М.В. Ломоносова, биологический факультет, кафедра эмбриологии.
Защита диссертации состоится «18» января 2012 г. в 14:00 часов на заседании
диссертационного совета Д 002.238.01 в Учреждении Российской академии наук Института биологии развития им. Н.К. Кольцова РАН по адресу:
119334, Москва, ул. Вавилова, д. 26.
С диссертацией и авторефератом можно ознакомиться в библиотеке и на сайте Учреждения Российской академии наук Института биологии развития им. Н.К. Кольцова РАН. Сайт: http://idbras.comcor.ru/; e-mail: [email protected]
Автореферат разослан « 14 » декабря 2011 года.
Ученый секретарь диссертационного совета,
кандидат биологических наук Абрамова Е.Б.

ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Волосяной фолликул является уникальной структурой и играет важную роль в процессе роста волос и поддержании гомеостаза эпидермиса. В морфогенезе волосяные фолликулы формируются из клеток эпидермиса и подлежащей мезенхимы. Популяцией мезенхимных клеток, расположенных в основании волосяного фолликула, являются клетки дермальной папиллы (ДП). Эти клетки играют важную роль в регуляции цикла роста волос и участвуют в регенерации кожи при травмах. Также клетки ДП способны дифференцироваться в адипо-, остео- и хондрогенном направлениях in vitro, что делает их изучение важной и актуальной задачей. Наряду с широким спектром мезенхимных дифференцировок клетки ДП способны дифференцироваться в нейроны и глию периферической нервной системы. Подобные данные существуют для ДП мыши и человека, но исследований потенциала к нейральной дифференцировке у клеток ДП крысы проведено не было. Между тем, это могло бы показать универсальность феномена нейральной дифференцировки клеток ДП для млекопитающих.
Способность к нейральной дифференцировке может быть объяснена происхождением клеток ДП. Генетическое маркирование показало, что ДП вибрисс мыши происходят от клеток нервного гребня, однако, детально роль клеток нервного гребня на ранних этапах морфогенеза вибрисс мыши не была исследована. Неизвестно, принимают ли клетки нервного гребня участие в формировании дермальных конденсатов или мигрируют в дермальную папиллу вибрисс на более поздних этапах.
Изучение происхождения дермы и ДП волосяного покрова головы у человека – еще одна актуальная задача. Подходом к её решению является культура эмбриональных стволовых клеток (ЭСК) человека. На данный момент возможно получение клеток нервного гребня из ЭСК. Исследование потенциала этих клеток к дифференцировке в клетки дермы и ДП могло бы стать альтернативным подходом к изучению процессов фолликулогенеза у человека. Более того, клетки ДП способны индуцировать формирование волосяных фолликулов при подкожных трансплантациях. Использование этих клеток является перспективным направлением в биомедицине. Применение клеток ДП может со временем решить проблемы восстановления волосяного покрова головы у людей с заболеваниями волосяного фолликула или потерей его функции.
Цель и задачи исследования. Целью работы стало изучение роли клеток дермальной папиллы из нервного гребня в морфогенезе волосяного фолликула. В работе предстояло решить следующие задачи:
- Проследить судьбу клеток, производных нервного гребня, в морфогенезе вибрисс мыши.
- Изучить потенциал к нейральной дифференцировке клеток ДП крысы.
- Охарактеризовать дифференцировку ЭСК клеток человека в клетки нервного гребня и ДП.
- Изучить способность клеток ДП, полученных из ЭСК, индуцировать рост волосяных фолликулов при подкожных пересадках in vivo.
- Изучить роль сигнального пути BMP в формировании клеток ДП человека.
- Изучить роль факторов роста в начальных этапах формирования волосяных фолликулов на модели морфогенеза кератиноцитов человека in vitro.
Научная новизна и практическая значимость работы. Впервые было показано, что на стадии 12-и суток эмбрионального развития в дерме головы мыши могут быть найдены производные клеток нервного гребня, которые дают начало дермальным конденсатам, предшественникам ДП волосяных фолликулов вибрисс.
У клеток ДП вибрисс крысы впервые выявлен потенциал к нейральной дифференцировке. Нейроны и глия периферической нервной системы, полученные из клеток ДП, являются альтернативным источником нейральных клеток для лечения нейродегенеративных заболеваний.
Впервые разработан метод получения клеток ДП человека из эмбриональных стволовых клеток (ЭСК-ДП). С помощью разработанного метода показано, что формирование клеток нервного гребня является необходимым промежуточным этапом дифференцировки ЭСК в клетки дермальной папиллы. ЭСК-ДП способны индуцировать волосяные фолликулы при подкожных пересадках бестимусным мышам и могут быть получены в неограниченных количествах, в отличие от культивируемых клеток ДП человека. Использование ЭСК-ДП может стать первым шагом в решении проблем потери волос и дисфункции волосяного фолликула у человека.
Впервые показано, что сигнальный путь BMP играет важную роль в формировании клеток ДП человека и поддержании их морфогенетического потенциала. Использование ЭСК позволяет изучать сигнальные пути дифференцировки клеток нервного гребня в клетки ДП. Такая возможность уникальна, поскольку доступ к эмбриональным тканям человека ограничен.
На модели морфогенеза кератиноцитов впервые выявлены ростовые факторы, которые стимулируют начальные этапы фолликулогенеза у человека. Моделирование процессов эпителиального морфогенеза в культуре является актуальным направлением современной клеточной биологии, которое пока слабо развито.
Вклад автора. Автором были спланированы и выполнены все эксперименты, описанные в диссертационной работе, за исключением проточной флуориметрии, которая была выполнена Giulio C. (сотрудником лаборатории нейрогенеза Sanford-Burnham Medical Research Institute). Автором также был проведен анализ всех полученных данных, включая данные проточной флуориметрии.
Апробация работы. Результаты диссертационной работы были представленны на конференциях: Международный симпозиум «Клеточные, молекулярные и эволюционные аспекты морфогенеза» (Москва, 2007); 2009 Cold Spring Harbor Laboratory Meeting on Stem Cell Biology (Cold Spring Harbor, 2009); VI международная конференция «Молекулярная медицина и биобезопасность» (Москва, 2009); в двух различных докладах на 4th Annual Stem Cell Meeting on the Mesa (La Jolla, 2009); 5th Annual Stem Cell Meeting on the Mesa (La Jolla, 2010); Конференция молодых ученых Института биологии развития им. Н.К. Кольцова (Москва, 2008, 2009 гг.); Stem Cells in Development, Tissue Homeostasis, and Disease (Santa Fe, 2011); 2nd Annual Development and Aging Program Retreat (La Jolla, 2011) (Премия за лучший доклад); III конференция «Биология стволовых клеток: фундаментальные аспекты», памяти Н.Г. Хрущова (Москва, 2011).
Публикации. По материалам работы опубликовано 14 печатных работ, из них статей в журналах, соответствующих перечню ВАК – 2, статей в иностранных рецензируемых журналах – 2, тезисов докладов и материалов конференций – 10.
Структура и объем работы. Диссертационная работа изложена на 134 страницах, содержит 45 рисунков, 2 таблицы и состоит из следующих разделов: введение, обзор литературы, материалы и методы, результаты и обсуждение, выводы и список литературы, включающий 145 цитируемых источника.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Генномодифицированные мыши. Для получения генотипа Wnt1Cre/ZEG скрещивали мышей двух линий. У первых под промотором Wnt1 экспрессируется фермент - Cre-рекомбиназа, способный узнавать и вырезать из генома участки ДНК, фланкированные LoxP сайтами. У вторых, линии ZEG мышей, имеется двойной репортерный ген под CMV--actin промотором, и экспрессия GFP блокирована фланкированным LoxP сайтами участком ДНК. При скрещивании этих линий в потомстве мы получали животных, у которых только в клетках нервного гребня (под Wnt1 промотором) экспрессируется Cre-рекомбиназа, а, следовательно, и GFP.
Получение первичных кератиноцитов и фибробластов из кожи мыши и человека. Фрагменты кожи промывали в растворе Хэнкса, содержащем 80мкг/мл гентамицина, и помещали в 0,2%-ный раствор диспазы (Sigma) в среде DMEM на 14-16 ч при +4°С. После этого эпидермис пинцетом отделяли от дермы по линии базальной мембраны и помещали в смесь растворов PBS + 0,25% трипсин (1:1) при 37°С на 7-10 мин. Действие трипсина ингибировали добавлением 5% сыворотки крупного рогатого скота. Пипетированием получали суспензию кератиноцитов, которую осаждали центрифугированием при 1000 об/мин (200g) в течение 5 мин. Дерму гомогенизировали с помощью глазных ножниц и помещали в 0.1% р-р трипсина при 37°С на 30-40 мин., затем культивировали в смеси сред DMEM:F12 (1:1) с добавлением 10% сыворотки плода коровы (Биолот), 4мM L-глутамина (Sigma).
Индукция нейральной дифференцировки клеток ДП крысы. ДП крысы 2-3 пассажа культивировали на покрытой матригелем пластиковой посуде в концентрации 100 тыс клеток/см2 в нейрализующей среде следующего состава: среды DMEM, F12 и Glutamax-neurobasal (Gibco) в соотношении 1:1:2, 10% BIT 9500 (StemCell Technologies), 1 мM глутамин (Gibco), 100 нг/ил bFGF and 100нг/мл BDNF (оба Sigma). Дифференцировку проводили в течение 12-14 дней.
Получение клеток нервного гребня из эмбриональных стволовых клеток. Колонии ЭСК человека механически разделяли на 200-500 клеточные кластеры и культивировали 5 дней в чашках Петри низкой адгезии (Ted Pella, Redding, CA) в нейрализующей среде следующего состава: среды DMEM, F12 и Glutamax-neurobasal (Gibco) в соотношении 1:1:2, 10% BIT 9500 (StemCell Technologies), 1 мM глутамин (Gibco), 20нг/мл EGF (Chemicon), 20нг/мл bFGF, 5 мкг/мл инсулин (Sigma) и 5 мM никотинамид (Sigma). На 6-ой день нейросферы переносили в пластиковую посуду, покрытую матригелем (BD Biosciences).
Иммуногистохимическое исследование. Клетки фиксировали 4% параформальдегидом 10 мин при 20°С или 12-14 часов при 4°С для кусочков ткани и эмбрионов мыши. Криосрезы промывали фосфатно-солевым буфером (PBS) и инкубировали 1 час при 20°С в блоковом р-ре (PBS, 0-0,3% Triton X-100 (Sigma), 5% бычий сывороточный альбумин (БСА). Первичные антитела наносили в рекомендованной производителем концентрации при 4°С на 12-16 часов. После промывки в PBS наносили разведенные 1:500 вторые антитела, конъюгированные с флуорохромом (FITC, Alexa), на 1 час при 20°С. Для окрашивания ядер использовали DAPI.
Количественный ПЦР в реальном времени. Клеточную РНК изолировали с помощью Quantitect набора (Qiagen). Для синтеза ДНК использовали 1 мкг РНК для каждой реакции. ДНК синтезировали с помощью набора для ретротранскрипции (Qiagen). Количественный ПЦР в реальном времени проводили с использованием SyberGreen (Invitrogen).
Трансплантация клеток иммунодефицитным мышам. Трансплантацию проводили методом «patch». Клетки мезенхимного происхождения (5млн /50мкл среды DMEM с добавлением 10% сыворотки плодов коровы) смешивали с суспензией первичных кератиноцитов мыши (5млн/50мкл) и инъецировали подкожно иммунодефицитным мышам линии NUDE. Анализ трансплантатов проводили через 2 - 4 недели после инъекций.
Культивирование кератиноцитов в коллагеновом геле. Первичные кератиноциты помещали в подготовленные в коллагеновом геле «колодцы» объёмом 100 мкл. После прикрепления клеток (через 20-30 мин) добавляли среду DMEM:F12 (1:1) с добавлением 10% сыворотки плода коровы (Биолот), 4мM L-глутамина (Sigma), 5мкг/мл инсулина (Sigma), 10-6 М изопротеренола (Sigma) и 10нг/мл EGF (Sigma).
Статистическая обработка результатов. Статистическую обработку результатов, полученных на основе данных иммуногистохимии и трансплантаций, проводили в программе Excel (Microsoft). При обработке результатов оценивали значения средней величины и стандартного отклонения. При оценке достоверности различий показателей использовали t-критерий Стьюдента. Различие считали статистически достоверным, если уровень значимости был p<0,05, что является мерой достаточной надежности результатов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Происхождение дермальной папиллы в морфогенезе вибрисс мыши. На мышах линии Wnt1Cre/ZEG проследили судьбу клеток нервного гребня в формировании ДП вибрисс. У линии этих мышей производные клеток нервного гребня экспрессируют зеленый флуоресцентный белок (GFP). Анализ начинали на стадии 12.5 суток развития, когда у эмбрионов мыши появляются первые дермальные конденсаты – будущие ДП вибрисс. Экспрессию GFP наблюдали в клетках дермы и дермальных конденсатах. На стадии 13.5 суток развития дермальные конденсаты формировали ДП, клетки которых экспрессировали GFP (Рис. 1). На стадиях 16-18 суток развития и у взрослых животных 30-ого постнатального дня развития изучали расположение производных нервного гребня клеток, в вибриссах на криосрезах. ДП и дермальная капсула волосяных фолликулов вибрисс состояли из GFP-положительных клеток. Таким образом, полученные нами
данные показали, что клетки нервного гребня дают начало дерме головы, дермальным конденсатам, дермальной капсуле и ДП вибрисс мыши. Ранее было показано, что производные клеток нервного гребня входят в состав ДП вибрисс мыши (Nagoshi et al., 2008), однако детальное исследования роли клеток нервного гребня на ранних этапах морфогенеза вибрисс мыши нами было проведено впервые.
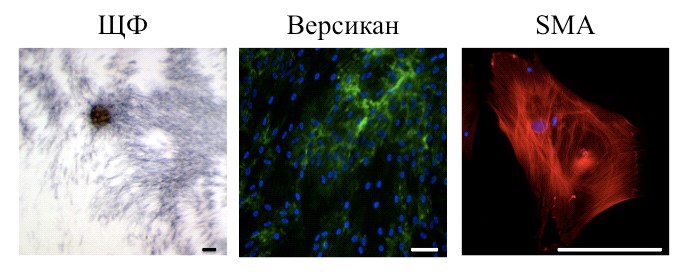
Потенциал к нейральной дифференцировке у клеток ДП вибрисс крысы. Происхождение клеток ДП из нервного гребня подтверждали, демонстрируя потенциал к нейральной дифференцировке. Для этого использовали ДП вибрисс крысы. Крупный размер вибрисс этого животного позволяет микрохирургически выделять ДП, что исключает возможность присутствия клеток другого происхождения и дает возможность судить об истинности трансдифференцировки. Гомогенность культуры клеток ДП подтверждали с помощью иммуногистохимического окрашивания антителами против версикана, актина гладкомышечной мускулатуры (SMA) и окраски на щелочную фосфатазу (Рис. 2).
Индукцию нейральной дифференцировки проводили на культуре клеток ДП крысы 2-3 пассажа. Через 12-14 суток в культуре наблюдали появление клеток с морфологией глии (паукообразные клетки с ветвящимися отростками) и нейронов (небольшое тело и длинные биполярные отростки) (Рис. 3). Нейрализацию подтверждали с помощью иммуногистохимического окрашивания антителами против специфичных маркеров глии (GFAP – кислый глиальный фибриллярный белок) и нейронов (МAP 2 – ассоциированный с микротрубочками белок 2). Известно, что потенциал к нейральной дифференцировке является свойством клеток ДП мыши и человека, однако нейральная дифференцировка клеток ДП вибрисс крысы была получена нами впервые.
Дифференцировка клеток нервного гребня человека в клетки ДП. На модели получения клеток нервного гребня из ЭСК (Curchoe, Maurer et al. 2010), исследовали происхождение клеток ДП человека. Для получения клеток ДП из нервного гребня разработали оригинальный протокол.
Культуры клеток нервного гребня первого пассажа дифференцировали в течение двух недель в среде следующего состава: среды DMEM/F12 в соотношении 1/1, 10% фетальной телячьей сыворотки, 2мM L-глютамин, 1X антибиотики/антимикотики. После 3-х дней дифференцировки, клетки
пассировали на непокрытую матригелем пластиковую посуду и удаляли клетки, неспособные адгезировать к пластику в течение 8 часов. Около 20% клеток оставались в культуре и пролиферировали, давая начало ДП-подобным клеткам (ЭСК-ДП).





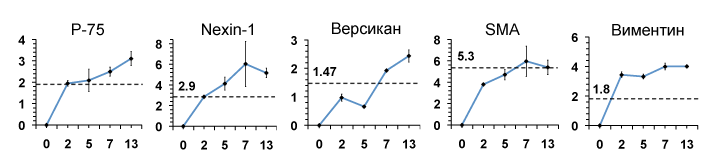
Гистохимический анализ экспрессии ДП маркеров в культурах ЭСК-ДП. Для подтверждения дифференцировки клеток нервного гребня в клетки ДП проводили иммунногистохимическое окрашивание клеток нервного гребня, полученных из ЭСК (ЭСК-НГ); дифференцированных в ДП клеток нервного гребня (ЭСК-ДП) и культивируемых клеток ДП человека (для подтверждения специфичности маркеров). ЭСК-ДП, как и культивируемые ДП человека, экспрессировали маркеры клеток нервного гребня: p-75 и Nestin; маркеры клеток ДП: версикан, актин гладкомышечной мускулатуры (SMA) и проявляли активность щелочной фосфатазы (свойство ДП клеток) (Рис. 4). В культурах клеток ЭСК-НГ выявляли окрашивание только на маркеры клеток нервного гребня. Для подтверждения данных иммуногистохимии применяли количественный ПЦР в реальном времени. Для этого ежедневно выделяли РНК из дифференцирующихся в ДП клеток ЭСК-НГ, начиная с 1-ого дня, и заканчивая двумя неделями дифференцировки. Уровни матричной РНК тестированных генов – маркеров ДП человека (p-75, nexin-1, версикана, SMA, и виментина), прогрессивно росли в культурах ЭСК-НГ при их дифференцировке в ДП-подобные клетки (Рис. 5).
Данные иммуногистохимического исследования и количественного ПЦР в реальном времени доказывают дифференцировки полученных из ЭСК клеток нервного гребня в клетки ДП. Клетки ДП человека были впервые получены из ЭСК.
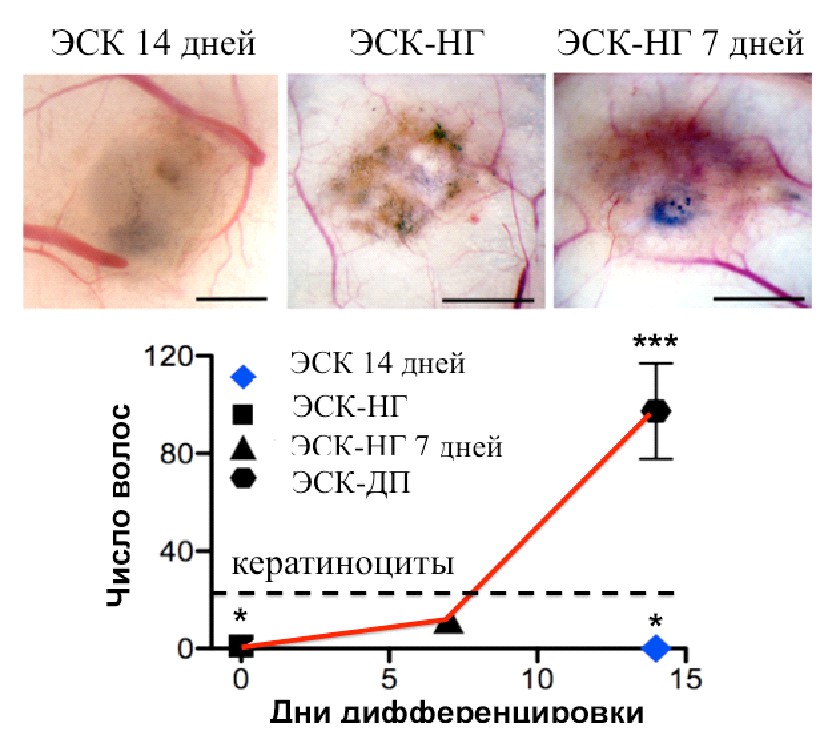
Потенциал ЭСК-ДП клеток к индукции волосяных фолликулов. Способность ЭСК-ДП индуцировать волосяные фолликулы изучали, используя «patch» метод трансплантации. Для этого полученные из эпидермиса новорожденных мышей кератиноциты, трансплантировали вместе с мезенхимными клетками. Использовали следующие типы мезенхимных клеток: ЭСК-ДП, мышиные неонатальные дермальные клетки (МДК) и изолированные из кожи человека клетки ДП. Также трансплантировали кератиноциты мыши без мезенхимных клеток (отрицательный контроль). Через 14 дней животных усыпляли, и проводили анализ подкожных трансплантатов под бинокуляром. Способность мезенхимных клеток к индукции оценивали по числу волосяных фолликулов, сформированных в трансплантатах. В случае трансплантации кератиноцитов мыши наблюдали образование незначительного количества волосяных фолликулов (Рис. 6). При трансплантации МДК, наблюдали статистически значимое (P=0.0282) увеличение числа волос. При пересадке ДП человека, статически значимого увеличения числа фолликулов в трансплантатах (по сравнению с отрицательным контролем) не наблюдали. При пересадке ЭСК-ДП, наблюдали формирование большого количества волосяных фолликулов в трансплантатах. Их число было статистически (P=0.0002) больше числа волосяных фолликулов, полученных при пересадке всех тестируемых типов клеток. Индукция формирования волосяных фолликулов – одна из главных характеристик клеток ДП. Однако к настоящему моменту не существует данных о способности культивируемых клеток ДП человека к индукции большого количества волосяных фолликулов при трансплантациях бестимусным мышам (Yang and Cotsarelis 2010). Впервые полученные из ЭСК человека клетки ДП обладают этой способностью.
Роль клеток нервного гребня, как стадии дифференцировки ЭСК в клетки ДП. Для выявления важности индукции клеток нервного гребня, трансплантировали ЭСК, дифференцированные в клетки ДП, без ЭСК-НГ, как промежуточного этапа дифференцировки. Также трансплантировали ЭСК-НГ и ЭСК-НГ, частично дифференцированные в ДП (7 дней дифференцировки). Трансплантаты изолировали и анализировали 14 дней после пересадки. Появление индуцирующих свойств оценивали по числу волос, сформированных в трансплантатах. При пересадке ЭСК-НГ и ЭСК, дифференцированных в ДП, без промежуточной индукции клеток нервного гребня, не наблюдали появления волосяных фолликулов в трансплантатах (Рис. 7). При трансплантации частично дифференцированных в ДП клеток нервного гребня, наблюдали появление небольшого количества волосяных фолликулов в трансплантатах. Полученные данные показывают, что полученные из ЭСК клетки нервного гребня, приобретают способность индуцировать волосяные фолликулы при их дифференцировке в ДП и, что индукция клеток нервного гребня является необходимым этапом дифференцировки ЭСК в клетки ДП.
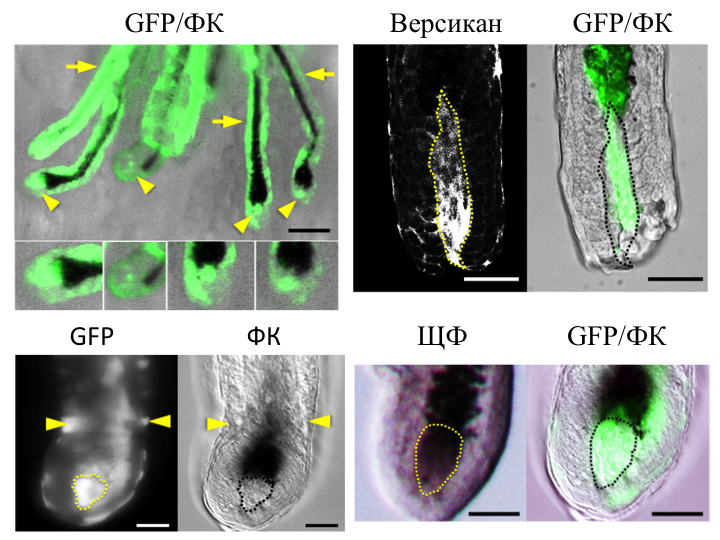
Локализация ЭСК-ДП в волосяных фолликулах из трансплантатов. Клетки ЭСК-ДП маркировали зелёным флуоресцентным белком (GFP), что позволяло определить их локализацию in situ. Через две недели после пересадки клеток методом «patch», проводили анализ трансплантатов под бинокуляром в флуоресцентном освещении. ДП и дермальные капсулы волосяных фолликулов в трансплантатах содержали GFP-положительные клетки (Рис. 8). Целые препараты волос иммуногистохимически окрашивали на версикан и проводили реакцию по выявлению активности щелочной фосфатазы. При изучении под конфокальныи микроскопом, выявляли положительное окрашивание на оба маркера в GFP-положительных ДП волосяных фолликулов. Полученные данные доказывают участие клеток ЭСК-ДП в формировании ДП волосяных фолликулов, формирующихся в трансплантатах.
Роль сигнального пути BMP в дифференцировке клеток ЭСК-НГ в ДП. Ингибитор BMP-4 – дорсоморфин добавляли в среду для дифференцировки на этапе ЭСК-НГ. Культивированные с дорсоморфином клетки полностью теряли способность индуцировать волосяные фолликулы при подкожных трансплантациях бестимусным мышам (Рис. 9). Результаты количественного ПЦР в реальном времени показали, что уровни экспрессии генов-маркеров (версикана, corin, nexin-1 и виментина) в культивируемых с дорсоморфином клетках, значительно снизились по сравнению с ЭСК-ДП. Уровень экспрессии гена-маркера клеток нервного гребня - p-75 - остался неизменным, а уровень экспрессии актина гладкомышечной ткани SMA вырос. Сигнальный путь BMP играет одну из ведущих ролей в поддержании индукционных свойств клеток ДП кожи спины мыши в культуре, продлевая их способность индуцировать волосяные фолликулы при подкожных пересадках (Rendl et al. 2008). Полученные нами данные показывают, что сигнальный путь BMP играет важную роль в формировании клеток ДП человека и поддержании их морфогенетических потенций.
Влияние факторов роста на индукцию волосяных фолликулов на модели тубулогенеза кератиноцитов in vitro. Конгломераты кератиноцитов культивировали в коллагеновом геле на бессывороточных средах с добавлением факторов роста: инсулиноподобного фактора роста (IGF) (50 нг/мл), фактора роста фибробластов (FGF) (40 нг/мл), фактора роста гепатоцитов (HGF) (50 нг/мл), эпидермального фактора роста (EGF) (20 нг/мл), фактора роста кератиноцитов (KGF) (50 нг/мл). В контрольной среде, не содержащей ни одного фактора, рост тубулярных структур не был отмечен. При добавлении в среду EGF и KGF, отмечали активный рост эпидермальных выростов. IGF и FGF индуцировали незначительное число вырастов. При добавлении HGF в среду культивирования наблюдали самые протяженные и ветвящиеся выросты. Известно, что HGF индуцирует инвазию кератиноцитов в дерму и участвует в морфогенезе и регуляции роста волосяного фолликула в органотипической культуре клеток мыши (Lindner et al., 2000), однако индукция морфогенеза кератиноцитов человека с помощью HGF была показана впервые.
ВЫВОДЫ
- Клетки дермы головы, дермальные конденсаты и ДП вибрисс мыши происходят из клеток нервного гребня.
- Культивированные клетки ДП крысы могут быть дифференцированы в производные клеток нервного гребня: периферические нейроны и глию.
- Клетки нервного гребня, полученные из ЭСК человека, могут быть дифференцированы в клетки ДП in vitro. ЭСК-ДП экспрессируют характерные для ДП и клеток нервного гребня маркеры.
- ЭСК-ДП индуцируют фолликулогенез при подкожных пересадках бестимусным мышам и встраиваются в ДП волосяных фолликулов, образованных в трансплантатах.
- Сигнальный путь BMP играет важную роль в дифференцировке полученных из ЭСК клеток нервного гребня в клетки ДП.
- Факторы роста HGF, EGF, KGF стимулируют начальные этапы формирования волосяных фолликулов на модели морфогенеза кератиноцитов человека in vitro.
Статьи в журналах, соответствующих Перечню ВАК и рецензируемых иностранных изданиях:
- Гнедева К.Ю., Чермных Э.С., Воротеляк Е., Васильев А.В., Терских В.В. Эффект факторов роста на морфогенез кератиноцитов человека in vitro // Известия РАН. Серия Биологическая. 2009. Т. 36(3). С. 307–310.
- Chermnykh E.S., Vorotelyak E.A., Gnedeva K.Y., Moldaver M.V., Yegorov Y.E., Vasiliev A.V., Terskikh V.V. Dermal papilla cells induce keratinocyte tubulogenesis in culture // Histochemistry and Cell Biology. 2010. V. 133(5). Р. 567–576.
- Cimadamore F., Fishwick K., Giusto E., Gnedeva K., Catarossi G., Miller A., Pluchino S., Brill L.M., Bronner-Fraser M., Terskikh A.V. Human ESC-derived neural crest model reveals a key role for SOX2 in sensory neurogenesis // Cell Stem Cell. 2011. V. 8(5). Р. 538-551.
- Гнедева К.Ю., Воротеляк Е.А., Терских А.В., Васильев А.В., Терских В.В. Дифференцировочный и морфогенетический потенциал клеток дермальной папиллы крысы // Известия РАН. Серия Биологическая. 2011. Т. 6. С. 1–6
Тезисы конференций:
- Воротеляк Е.А., Чермных Э.С., Гнедева К.Ю., Васильев А.В., Терских В.В. Морфогенетический потенциал кератиноцитов человека в культуре // Конференция «Клеточные, молекулярные и эволюционные аспекты морфогенеза». 2007. С. 27.
- Cimadamore F., Giusto E., Cattarossi G., Gnedeva K., Miller A., Terskikh, A.V. Dual role of Sox2 in neural crest and peripheral neurogenesis // Poster session presented at: 2009 Cold Spring Harbor Laboratory Meeting on Stem Cell Biology. 2009. Р. 48.
- Гнедева К.Ю., Чермных Э.С., Воротеляк Е., Васильев А.В., Терских А.В. Терских В.В. Роль клеток нервного гребня в формировании волосяного покрова головы // Конференция молодых ученых Института Биологии Развития им. Н.К.Кольцова РАН. 2008. C. 17.
- Gnedeva K., Elliott J., Vorotelyak E., Terskikh V.V., Terskikh A.V. Role of neural crest in hair follicle formation and function // Poster session presented at: 4th Annual Stem Cell Meeting on the Mesa. 2009. Р. 32.
- Cimadamore F., Giusto E., Cattarossi G., Gnedeva K., Miller A., Terskikh, A.V. Dual role of Sox2 in neural crest and peripheral neurogenesis // Poster session presented at: 4th Annual Stem Cell Meeting on the Mesa. 2009. Р. 54.
- Гнедева К.Ю., Чермных Э.С., Воротеляк Е., Васильев А.В., Терских А.В. и Терских В.В. Роль клеток нервного гребня в формировании волосяного покрова головы // Конференция молодых ученых Института Биологии Развития им. Н.К.Кольцова РАН. 2009. С. 17
- Воротеляк Е.А., Чермных Э.С., Гнедева К.Ю., Васильев А.В., Терских В.В. Стволовые клетки волосяного фолликула // VI международная конференция «Молекулярная медицина и биобезопасность». 2009. С.
- Gnedeva K., Vorotelyak E., Terskikh V.V., Terskikh A.V. Growing hair from human embryonic stem cells // Poster session presented at: 5th Annual Stem Cell Meeting on the Mesa. 2010. Р. 18.
- Gnedeva K., Elliott J., Vorotelyak E., Terskikh V.V., Terskikh, A.V. Role of primary cilia in vibrissae formation // Poster session presented at: Stem Cells in Development, Tissue Homeostasis, and Disease. 2011. Р. 34.
- Воротеляк Е.А., Гнедева К.Ю. Стволовые клетки волосяного фолликула // III конференция «Биология стволовых клеток: фундаментальные аспекты», памяти Н.Г. Хрущова. 2011. С. 43

