Локальная и дистантная регуляция сократительной активности гладких мышц воздухоносных путей
На правах рукописи
Дьякова Елена Юрьевна
ЛОКАЛЬНАЯ И ДИСТАНТНАЯ РЕГУЛЯЦИЯ СОКРАТИТЕЛЬНОЙ АКТИВНОСТИ ГЛАДКИХ МЫШЦ ВОЗДУХОНОСНЫХ ПУТЕЙ
03.03.01 – физиология
14.03.03 – патологическая физиология
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Томск – 2011
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Сибирский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации
Научный консультант:
доктор медицинских наук,
профессор Капилевич Леонид Владимирович
Официальные оппоненты:
доктор медицинских наук,
профессор Барбараш Нина Алексеевна
доктор медицинских наук,
профессор,
член-корреспондент РАМН Киселев Валерий Иванович
доктор медицинских наук Наследникова Ирина Олеговна
Ведущая организация:
НИИ физиологии СО РАМН, г. Новосибирск
Защита состоится: « 28 » октября 2011 г. в 10.00 на заседании диссертационного совета Д 208.096.01 при Сибирском государственном медицинском университете (634050 г. Томск, Московский тракт, 2)
С диссертацией можно ознакомиться в научно-медицинской библиотеке Сибирского государственного медицинского университета
Автореферат разослан «___» ______________201_ г.
Ученый секретарь
диссертационного совета Петрова И.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования
В настоящее время не теряют своей актуальности исследования, направленные на выяснение внутриклеточных механизмов регуляции функций гладких мышц, входящих в состав практически всех полых органов. Детальное изучение этого вопроса лежит в основе формирования целостного представления о функционировании гладких мышц и, следовательно, двигательной функции внутренних органов.
В разное время при открытии очередного звена цепи механизмов регуляции функционирования клетки следовало большое количество работ, сосредоточенных на раскрытии роли данного фактора в реализации конкретного пути. В первой половине 70-х годов прошлого столетия большое внимание было уделено изучению циклического аденозинмонофосфата [В.Ю. Васильев, Н.Н. Гуляев, Е.С. Северин, 1975; K. Unsicker, J.H. Chamley, 1976; Y. Hashimoto, H. Sasaki, K. Iwatsuki, 1976], во второй половине 70-х годов, начале 80-х активно изучалась кальцийзависимая сигнальная система [В.Д. Романенко, 1975; R. Casteels, C. Van Breemen, 1975; K.R. Hightower, V.N. Reddy, 1981; J.L. Ram, U.A. Shukla, R. Parti, R.L. Goines, 1984]. На 90-е, 2000-е годы пришлось исследование роли сигнальной молекулы оксида азота и связанного с ним цГМФ-зависимого сигнального пути [S. Moncada et al., 1987; 1989; 1990; 1992; R.E. Cataln, A.M. Martnez, L. Gargiulo, A. Liras, 1995; N. Maulik, D.T. Engelman, M. Watanabe, 1995; K. Witte, B. Lemmer, 1996; O.Z. Chi, X. Liu, H.R. Weiss, 1999; H. Yawo, 1999; L. Bosgraaf, P.J. Van Haastert, 2002; A.A. Steiner, L.G. Branco, 2003].
Одним из современных направлений является изучение участия молекул газов (NO, CO, H2S) в регуляции внутриклеточных процессов [М.Б. Баскаков, 2010; G. Yang, L. Wu, B. Jiang et al., 2008; A. Li, Q. Xi, E.S. Umstot et al., 2008]. Интересы исследователей также распространяются на изучение влияния цитокинов на работу сигнальных путей [M.E. Martino, J.C. Olsen, N.B. Fulcher et al., 2009; E. Gkoumassi, B.G. Dekkers, M.J. Drge et al., 2007], реализующими свои эффекты через цитоскелет [Б. Албертс и др., 1994].
Постоянное внимание исследователей к данным проблемам обусловлено тем, что именно на субклеточном уровне берут начало все патологические процессы, проявляющиеся на организменном уровне в виде симптомов и синдромов различных заболеваний. Фундаментальные исследования, направленные на вскрытие механизмов функционирования клетки в физиологических условиях и изучение их изменений при различных нефизиологических состояниях, позволяют находить точки приложения корректного патогенетически обусловленного терапевтического воздействия. Особое значение подобное направление научных изысканий имеет для системы дыхания. Значительная часть заболеваний респираторной системы связана с нарушением регуляторных механизмов гладкомышечных клеток стенки воздухоносных путей [В.Н. Абросимов, 1990, Y. Sato, T. Kishi, T. Umemura, 1998, А.Г. Чучалин, 2008].
Благодаря существенному прогрессу в исследовании данной проблемы на сегодняшний момент накоплено огромное количество результатов, однако единого мнения о механизмах локальной и дистантной регуляции сократительной активности гладкомышечных клеток не сформировано. В представлении о регуляции гладких мышц воздухоносных путей сохраняются некоторые противоречия и пробелы.
Например, в одних работах говорится, что лейкотриены вызывают сокращение гладкой мускулатуры, простагландины потенцируют ее расслабление [P.E. Moore, T. Lahiri, J.D. Laporte et al., 2001; R.S. Lan, D.A. Knight, G.A. Stewart, 2001], в других – что и простагландины и лейкотриены вызывают сокращение гладких мышц [D. Schaafsma, R. Gosens, I.S. Bos et al., 2005; V. Schlemper, R. Medeiros, J. Ferreira et al., 2005]. Также широко известен сократительный эффект гистамина на гладкие мышцы, реализующийся через рецептор-управляемый вход Са2+ в гладкомышечные клетки, освобождение Са2+ из внутриклеточных депо и активацию фосфолипазы C. Однако наряду с этим существуют отдельные данные о том, что гистамин опосредует расслабление гладкомышечных клеток воздухоносных путей морских свинок. Среди возможных механизмов расслабления называют ингибирование холинергической нейротрансмиссии. Не исключается также роль эпителия в этом процессе [M. Ichinose, C.D. Stretton, J.C. Schwartz et al., 1989].
Остаются невыясненными вопросы о влиянии эпителия на сократительную активность гладких мышц бронхиального дерева при формировании состояния гиперреактивности и участии цитоскелета в реализации сократительной функции гладких мышц бронхов.
Остается открытым вопрос о значении оксида азота в регуляции сократительной активности гладких мышц при бронхиальной астме, так как он считается главным претендентом на роль расслабляющего фактора. При этом уровень его метаболитов в конденсате выдыхаемого воздуха больных бронхиальной астмой значительно возрастает в период обострения параллельно тяжести приступа [В.А. Невзорова и др. 2003; G. Rolla, A. Malinovschi, I. Badiu et al., 2011].
В последнее время, кроме известных путей регуляции сократительной активности гладких мышц, все больше внимания уделяется ранее неисследованным соединениям экзогенного происхождения, влияющим на состояние дыхательной системы, изучение влияния которых на живые объекты еще только начинается. К таким веществам относятся получившие в настоящее время широкое распространение в производственной сфере наноструктурные материалы. Изучение их влияния на организм не только имеет серьезную теоретическую ценность, но и важный прикладной аспект, так как глубокое исследование подобного воздействия может создать технологии контроля оценки токсического повреждения организма наноматериалами.
Все изложенное обуславливает выбор цели и задач настоящего исследования.
Цель исследования:
Изучить роль локальных и дистантных звеньев в регуляции гладких мышц воздухоносных путей при формировании гиперреактивности.
Задачи исследования:
1. Исследовать влияние эпителия на сократительную активность гладких мышц воздухоносных путей в физиологических условиях и в условиях формирования гиперреактивности.
2. Изучить влияние нитросоединений на регуляцию сократительной активности воздухоносных путей в физиологических условиях и в условиях формирования гиперреактивности.
3. Исследовать влияние ингибиторов ферментов метаболизма арахидоновой кислоты на сократительную активность воздухоносных путей в физиологических условиях и в условиях формирования гиперреактивности.
4. Определить роль интерлейкина 5 и интерлейкина 4 в регуляции тонуса воздухоносных путей в физиологических условиях и в условиях формирования гиперреактивности.
5. Выяснить роль компонентов цитоскелета в реализации локальных механизмов регуляции гладких мышц воздухоносных путей морских свинок в физиологических условиях и при формировании гиперреактивности.
6. Исследовать влияние аэрозолей нанодисперсных структур CoFe2O4 на сократительные реакции гладких мышц воздухоносных путей морских свинок.
Положения, выносимые на защиту:
1. Эпителий воздухоносных путей модулирует сократительные реакции гладких мышц, характер этого воздействия зависит как от факторов, запускающих сократительные ответы, так и от исходного состояния гладкомышечных клеток. В условиях формирования гиперреактивности модулирующее влияние эпителия на сократительную активность гладких мышц утрачивается. Этот эффект связан с изменением чувствительности гладкомышечных клеток к релаксирующим факторам (нитроксидергические реакции гладких мышц от сенсибилизированных животных зависят от вида NO-донора: снижаются при действии нитрозоглутатиона и увеличиваются при действии нитропруссида натрия).
2. Метаболиты арахидоновой кислоты, а так же интерлейкины 4 и 5 в физиологических условиях потенцируют сократительные реакции гладкомышечных клеток и угнетают их ответы на дилатационные воздействия. Эти эффекты сохраняются, а в ряде случаев даже усиливаются в условиях формирования гиперреактивности. Рекомбинантный рецептор интерлейкина 5 устраняет эффект экзогенного интерлейкина 5.
3. Величина гиперкалиевого сокращения гладких мышц зависит от характера дезинтеграции элементов цитоскелета: разрушение микротрубочек потенцирует сократительные ответы, а разрушение микрофиламентов – угнетает. В условиях формирования гиперреактивности эффект дезинтеграции цитоскелета на сократительные рецептор-зависимые реакции гладкомышечных сегментов снижается.
4. Влияние нанодисперсных структур на сократительные реакции гладких мышц воздухоносных путей как при ингаляционном введении, так и при воздействии на изолированные сегменты сходно с эффектом дезинтегратора всех компонентов цитоскелета колхицина – модулирующее влияние определяется предсокращающим фактором и исходным состоянием гладкомышечных клеток.
Научная новизна
Впервые установлено, что в случае предсокращения сегментов воздухоносных путей гистамином адренергические дилатационные реакции в присутствии эпителия усиливаются, в случае предсокращения гиперкалиевым раствором – ослабляются.
Показано, что при сенсибилизации эпителий теряет способность модулировать сократительные реакции подлежащих гладких мышц воздухоносных путей.
Выявлено, что нитроксидергические дилатационные реакции гладких мышц воздухоносных путей при сенсибилизации зависят от вида NO-донора: уменьшаются реакции, вызванные нитрозоглутатионом, и усиливаются реакции при воздействии нитропруссида натрия.
Впервые показано, что в условиях формирования гиперреактивности лейкотриены усиливают гистаминергические и серотонинергические сократительные реакции, а простагландины и тромбоксаны усиливают серотонинергические реакции и ослабляют гистаминергические реакции.
Установлено, что инкубация гладкомышечных сегментов воздухоносных путей с интерлейкином 4 и интерлейкином 5 приводит к усилению гистаминергических и снижению адренергических реакций, как животных контрольной группы, так и сенсибилизированных.
Показано, что растворимая субъединица рекомбинантного рецептора интерлейкина-5 дозозависимо снижает эффект экзогенного интерлейкина 5, а инкубация с рецептором сегментов воздухоносных путей сенсибилизированных (но не контрольной группы) животных подавляет гистаминергические сократительные реакции.
Впервые выявлено, что величина гиперкалиевого сокращения зависит от степени дезинтеграции элементов цитоскелета: разрушение микротрубочек приводит к увеличению гиперкалиевой контрактуры, а разрушение микрофиламентов – к уменьшению. Показано, что дезинтеграция цитоскелета снижает гистаминергические сократительные реакции гладких мышц воздухоносных путей животных как контрольной группы, так и сенсибилизированных.
Впервые показано, что действие нанодисперсных структур на гиперкалиевую контрактуру сходно с эффектом дезинтегратора цитоскелета колхицина. При воздействии наночастицами CoFe2O4 на гладкие мышцы воздухоносных путей усиливаются и гистаминергические и адренергические реакции.
Научно-практическая значимость
Результаты исследования являются вкладом в развитие фундаментальных знаний об изменении регуляторных механизмов сократительной активности гладких мышц воздухоносных путей при формировании гиперреактивности. Полученные данные дополняют представления о патогенезе бронхиальной гиперреактивности при заболеваниях бронхолегочной системы. Установлено, что ведущим механизмом в формировании гиперреактивности гладких мышц воздухоносных путей является потеря эпителием модулирующего влияния на гладкие мышцы. Результаты проведенных исследований расширяют научную базу для создания новых патогенетически обоснованных средств коррекции бронхоспастических состояний.
Основные положения работы используются в курсах лекций и практических занятиях, проводимых на кафедрах биофизики и функциональной диагностики, нормальной физиологии Сибирского государственного медицинского университета, на кафедре физиологии человека и животных Томского государственного университета.
Методические приемы и полученные данные используются в научных исследованиях, проводимых на кафедрах биофизики и функциональной диагностики, нормальной физиологии, Центральной научно-исследовательской лаборатории Сибирского государственного медицинского университета. Областями применения полученных научных данных являются физиология, патофизиология, пульмонология, биофизика, фармакология.
Апробация и реализация работы
Основные результаты диссертации обсуждены на всероссийских и международных конгрессах: Международной конференции «Biological motility» (Пущино, 2004), Международном «3-rd Congress of European Region International Union against Tuberculosis and Lung Diseases (IUATLD)» (Москва, 2004), Международном V конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2004), Международном V Сибирском физиологическом съезде (Томск, 2005), Международном VI конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2005), Международном VIII конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2007), научной конференции с международным участием, посвященной 100-летию со дня рождения профессора Е.Ф. Ларина «Нейрогуморальные механизмы регуляции органов пищеварительной системы в норме и при патологии» (Томск, 2007), Международном IX конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2008), Международном VI Сибирском физиологическом съезде (Барнаул, 2008), 4-ой Всероссийской с международным участием школе-конференции по физиологии кровообращения (Москва, 2008), Международном X конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2009), научной конференции с международным участием, посвященной 120-летию кафедры нормальной физиологии СибГМУ (ТМИ) и кафедры физиологии ТГУ «Нейрогуморальные механизмы регуляции висцеральных органов и систем в норме и при патологии» (Томск, 2009), Международной научно-практической конференции «Здоровье и образование в XXI веке» (Москва, 2009).
Исследования поддержаны грантами РФФИ – «Исследование механизмов регуляции цитоскелетом сократительной активности гладких мышц» (№ 07-04-01184), «Разработка технологии контроля оценки повреждающего действия различных наноматериалов при ингаляционном поступлении» (№09-04-99124-р_офи); ФЦП – «Разработка научно-технологической основы применения лазерных технологий в биомедицинских исследованиях, эффективных методов экспресс-диагностики основных социально-значимых заболеваний респираторной системы человека с использованием методов лазерной спектроскопии» (№02.740.11.0083), «Разработка технологии селективного управления внутриклеточной газовой сигнализацией» (№ 02.740.11.5031), «Разработка технологических основ управления функциональным состоянием клеток на основе идентификации ключевых звеньев трансляции сигналов с участием активных форм кислорода и элементов цитоскелета» (№ П455). Работа выполнена при частичной финансовой поддержке Федерального агентства по науке и инновациям (№ 02.438.11.7018).
Публикации. По теме диссертации опубликовано 69 печатных работ, из них 24 полнотекстовые статьи, опубликованные в журналах, рекомендованных ВАК и одна монография.
Объем и структура диссертации. Диссертация изложена на 252 страницах машинописного текста и состоит из введения, глав: «Обзор литературы», «Материал и методы исследования», «Результаты исследования», «Обсуждение результатов исследования» и заключения. Библиография включает 333 ссылок, в том числе 99 – работ отечественных авторов и 234 – зарубежных. Работа иллюстрирована 101 рисунком и 1 таблицей.
Личное участие автора в получении результатов, изложенных в диссертации. Автором самостоятельно на основании обзора большого количества литературных данных сформулированы цель и задачи, разработан дизайн исследования.
Автором самостоятельно выполнены эксперименты по изучению сократительной активности сегментов воздухоносных путей морских свинок и исследование состава выдыхаемого воздуха экспериментальных животных.
Автором самостоятельно проведена статистическая обработка результатов, их научный анализ и обсуждение, сформулированы выводы и положения, выносимые на защиту.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования служили изолированные кольцевые гладкомышечные сегменты главных бронхов половозрелых морских свинок - самцов весом 200-400 г. Всего было использовано 172 особи, на 71 из которых моделировалась гиперреактивность воздухоносных путей (было приготовлено 308 сегментов), 91 особь служила контролем (415 сегментов), 10 подвергались ингаляционному воздействию аэрозоля нанодисперсных частиц (21 сегмент). Были сформированы две экспериментальные группы животных и две контрольные. Животные первой экспериментальной группы сенсибилизировались трехкратными подкожными инъекциями 0,1 мл на 100 г. массы тела животного 0,25% раствора овальбумина в физиологическом растворе (промежуток между инъекциями 3-4 дня). На 21 день животные подвергались ингаляционному воздействию аэрозоля того же раствора. Животные первой контрольной группы подвергались воздействию физиологического раствора по аналогичной схеме. Животные второй экспериментальной группы подвергались ингаляциям нанопорошка CoFe2O4 (феррит кобальта) в концентрации 0,05 мг/мл, которые проводились ежедневно в течение 30 минут (курс 4 дня). Животные второй контрольной группы подвергались воздействию дистиллированной воды по аналогичной схеме. Содержание, питание, уход за животными и выведение их из эксперимента осуществлялось в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных».
Методика исследования механического напряжения. Механическое напряжение (МН) кольцевых гладкомышечных сегментов бронхов регистрировали изометрическим датчиком силы FT10G в условиях, близких к изометрическим, при температуре 37 0С в аэрируемом растворе Кребса. Исследования проводились на сегментах с сохраненным эпителием (интактных) и на деэпителизированных сегментах, при этом эпителий удалялся механически вращением деревянного шпателя в просвете сегмента в течение 1 минуты.
Перед началом исследования сегменты тестировались воздействием гиперкалиевого раствора Кребса (40 мМ), амплитуда ответа на который принималась за 100 %. Величины сократительных ответов на воздействие исследуемых соединений оценивались в % от амплитуды этого контрольного сокращения.
Для изучения влияния биологически активных веществ (БАВ) они добавлялись непосредственно в камеру, в которой находились сегменты.
При исследовании влияния ингибитора 5-липоксигеназы АА 861 на сократительную активность воздухоносных путей (ВП), данный ингибитор в концентрации 1 мкМ добавлялся в камеру, в которой находились исследуемые сегменты ВП [E. Titos, J. Clria, A. Planagum et al., 2003]. Сегменты находились в данном растворе в течение 30 минут, после чего подвергались воздействию БАВ.
Ингибитор циклооксигеназы индометацин в концентрации 10 мкМ добавлялся в камеру по аналогичной схеме [A.K. Larsson, M. Bck, J. Hjoberg et al., 2005], обработка сегментов происходила в течение 15 минут.
Для изучения влияния интерлейкина (ИЛ) 5, интерлейкина 4 и рецептора интерлейкина 5 деэпителизированные сегменты инкубировались в течение 18 часов в термостате при температуре 250С в среде RPMI-1640 с добавлением интерлейкина 5 в концентрации 0,1 мкг/мл и/или -субъединицы рецептора интерлейкина 5 в концентрациях 0,1; 0,5 и 1 мкг/мл, интерлейкина 4 в концентрации 0,1 мкг/мл.
Для исследовании влияния дезинтеграторов цитоскелета препараты также добавлялись в камеру: колхицин в концентрации 10 мкМ, обработка сегментов продолжалась 90 минут; цитохалазин Д – 1 мкМ и 45 минут [K.B. Adler, J. Krill, T.V. Alberghini et al., 1983; S.S. An, R.E. Laudadio, J. Lai et al., 2002]; нокодазол – 10 мкМ и 60 минут [C.A. Brum, I.D. Duarte, R.C. Webb et al., 2005].
Для изучения влияния взвеси нанодисперсных частиц в камеру, в которой находились сегменты, добавляли CoFe2O4 в концентрации 0,3 мг/мл.
Методика исследования аэрозольных сред. Эксперименты по измерению пропускания воздушно-аэрозольными смесями лазерного излучения проводились на базе Института оптики атмосферы Сибирского отделения Российской Академии наук и выполнялись по стандартной спектрофотометрической схеме.
Методика исследования состава выдыхаемого воздуха. Исследования выдыхаемого воздуха проводились на внутрирезонаторном лазерном оптико-акустическом сенсоре ILPA-1.
Методика исследования количества нитрит-анионов. Содержание оксида азота в гомогенате бронхов морской свинки определяли косвенным методом, по концентрации нитрит-анионов в реакции с реактивом Грисса.
Методика определения циклического гуанозинмонофосфата. Количество циклического гуанозинмонофосфата (цГМФ) в гомогенате бронхов морской свинки определяли иммуноферментным методом с использованием наборов фирмы Biomol international, L.P.
Используемые растворы. Раствор Кребса следующего состава (в мМ): NaCl – 120,4; KCl – 5,9; CaCl2 – 2,5; MgCl2 – 1,2; глюкозы – 11,5; трис(оксиметил)-аминометана – 15,5; рН = 7,36±0,01. Аэрация осуществлялась воздухом с помощью компрессионного насоса.
Модифицированные растворы Кребса: гиперкалиевые растворы с концентрацией KCl 40, 60, 80, 100 и 120 мМ.
Тестирующие растворы готовились на основе раствора Кребса и его модификаций с добавлением соответствующих реактивов.
Используемые реактивы: гистамин (производство Россия); сальбутамол (производство Россия); серотонин (ICN Biomedicals, Inc., США); нитропруссид натрия (ICN Biomedicals, Inc., США); нитрозоглутатион (ICN Biomedicals, Inc., США); АА861 (производство Россия); индометацин (производство Россия); рекомбинантный человеческий интерлейкин 4 (Biosource International, Inc., США); рекомбинантный человеческий интерлейкин 5 (Biosource International, Inc., США); рецептор интерлейкина 5 (R&D Systems Inc., США); овальбумин (egg white) (ICN Biomedicals, Inc., США); колхицин (Sigma, Франция); цитохалазин Д (ICN Biomedicals, Inc., США); нокодазол (ICN Biomedicals, Inc., США); нанопорошок CoFe2O4 (произведен методом механохимического синтеза из солевых систем на базе отдела структурной макрокинетики ТНЦ СО РАН).
Статистическая обработка результатов. Анализ данных проводился при помощи программы Statistica 6.0 for Windows фирмы Statsoft. Фактические данные представлены в виде «среднее ± ошибка среднего» (X±m). Для определения характера распределения полученных данных использовали критерий Колмогорова-Смирнова. Гипотезу о принадлежности сравниваемых независимых выборок к одной и той же генеральной совокупности или к совокупностям с одинаковыми параметрами проверяли с помощью рангового U - критерия Манна-Уитни. Когда члены сравниваемых выборок были связаны попарно (зависимые выборки), различия между ними оценивали с помощью рангового Т-критерия Вилкоксона. Для оценки взаимосвязи полученных результатов использовали критерий Спирмена. Связь между признаками считается статистически значимой, если значения коэффициента ранговой корреляции Спирмена больше 0,5.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
1 Особенности эпителиально-гладкомышечных взаимодействий в воздухоносных путях
Известно, что эпителий обладает способностью секретировать различные контрактильные и релаксирующие факторы и тем самым модулировать сократительную активность подлежащих гладких мышц (ГМ) ВП. Больше всего обсуждается роль релаксирующего фактора NO, выделяемого эпителием, меньше внимания уделено контрактильным агентам. Исследования, направленные на изменение модулирующего действия эпителия при формировании гиперреактивности, в перспективе могут дать основу для понимания процессов, развивающихся при патологии.
Влияние эпителия на сократительную активность подлежащих ГМ ВП оценивали методом сравнения контрактильных реакций деэпителизированных сегментов и сегментов с сохраненным эпителием (интактных).
Для исследования контрактильных реакций сегментов ВП животных контрольной группы использовался гистамин в концентрациях 0,1 нМ – 100 мкМ. Интактные (n=15) и деэпителизированные (n=9) сегменты отвечали на воздействие гистамина в концентрациях 0,01 мкМ – 100 мкМ дозозависимым сокращением (рис. 1). При этом максимальная амплитуда сокращения деэпителизированных сегментов (53,65±1,82 % относительно контрольного сокращения) на концентрацию гистамина 100 мкМ была достоверно выше амплитуды сокращения интактных сегментов (40,96±2,44 %, p<0,05).
Похожие результаты были получены при изучении влияния серотонина в концентрациях 10 нМ – 10 мкМ на сократительную активность сегментов ВП животных контрольной группы. У сегментов с сохраненным эпителием серотонин в концентрациях 0,001 мкМ – 10 мкМ не вызывал достоверного дозозависимого увеличения механического напряжения (n=9). При изучении воздействия серотонина на деэпителизированные сегменты было выявлено дозозависимое сокращение всех сегментов на концентрации 0,1 мкМ – 10 мкМ (n=9). Амплитуда сократительных реакций деэпителизированных сегментов (максимальная амплитуда составила 13±1,5 % на концентрацию серотонина 10 мкМ) была достоверно выше амплитуды сократительных реакций интактных сегментов (p<0,05).
 | Рисунок 1 – Зависимость механического напряжения (МН) гладкомышечных сегментов бронхов морских свинок контрольной группы от концентрации гистамина Сплошная линия – сегменты с сохраненным эпителием. Пунктирная линия – сегменты без эпителия. По оси ординат – механическое напряжение в процентах от амплитуды контрольного сокращения на гиперкалиевый раствор Кребса (МН, %). По оси абсцисс - десятичный логарифм концентрации гистамина (Lg C). * - достоверность различий в амплитудах сократительных реакций сегментов с сохраненным эпителием и без эпителия. |
В норме тонус гладких мышц бронхов в основном определяется динамическим балансом образующегося в эпителии оксида азота и секретируемых тучными клетками гистамина и серотонина, то есть при действии данных медиаторов эпителий может вырабатывать релаксирующие факторы, такие как оксид азота, и тем самым уменьшать амплитуду контрактильных реакций [L.A. Cohn, K.B. Adler, 1992].
Для исследования дилатационных реакций сегментов ВП животных контрольно группы был использован сальбутамол в концентрациях 0,01 нМ – 10 мкМ. Предварительно интактные сегменты предсокращались гиперкалиевым раствором (40 мМ), на фоне которого проводилось воздействие сальбутамола. Интактные (n=14) и деэпителизированные (n=11) сегменты отвечали дозозависимым расслаблением на воздействие сальбутамола в концентрациях 0,01 нМ – 10 мкМ. При этом степень расслабления на воздействие сальбутамола была достоверно больше у деэпителизированных сегментов: максимальное расслабление на концентрацию сальбутамола 10 мкМ составила 59,59±3,05 % от амплитуды предсокращения (100 %) по сравнению с максимальным расслаблением интактных сегментов – 81,42±2,66 % (p<0,05). Таким образом, удаление эпителия приводило к усилению дилатационных реакций сегментов ВП морских свинок контрольной группы.
В следующей серии экспериментов исследовалось влияние сальбутамола на механическое напряжение сегментов, предсокращенных гистамином в концентрации 100 мкМ. Интактные (n=10) и деэпителизированные (n=12) сегменты отвечали дозозависимым расслаблением на воздействие сальбутамола в концентрациях 0,01 нМ – 10 мкМ. Реакция адренергического расслабления была более выражена у интактных сегментов по сравнению с деэпителизированными (p<0,05): максимальная амплитуда расслабления интактных сегментов составила -18,06±1,02 % (от амплитуды предсокращения на гистамин), деэпителизированных – 10,94±0,46 %.
Таким образом, вклад эпителия в реализацию адренергических реакций гладких мышц ВП зависит от вида предсокращающего фактора. В случае, когда предобработка гладких мышц осуществляется с помощью гистамина, амплитуда дилатационного ответа в присутствии эпителия увеличивается. Релаксирующий эффект складывается из ц-АМФ-зависимой релаксации собственно гладких мышц и дополнительного воздействия на гладкие мышцы эпителиального релаксирующего фактора [Анфиногенова Я.Д., 1997]. В случае предсокращения сегментов гиперкалиевым раствором Кребса дилатационные реакции в присутствии эпителия снижаются, что может быть обусловлено антагонизмом кальциевой сигнальной системы и ц-АМФ-зависимого пути регуляции сократительной активности.
Объяснение данных результатов может также лежать в области физиологической роли предсокращающих факторов: гистамин как главный медиатор при воспалительных реакциях вызывает выделение эпителием релаксирующих факторов, гиперкалиевый раствор не является физиологичным, поэтому может вызывать противоположную реакцию эпителия, сопровождающуюся выделением констрикторов.
Возможно, что дисбаланс дилатационных и констрикторных факторов эпителия приводит к формированию такого состояния, как гиперреактивность ВП.
Воздействие гистамина в концентрациях 0,1 мкМ – 100 мкМ вызывало дозозависимое сокращение интактных (n=13) и деэпителизированных (n=18) сегментов ВП животных экспериментальной группы (рисунок 1). Максимальная амплитуда сокращения на концентрацию гистамина 100 мкМ составила 73,36±5,32 % у интактных сегментов и 89,74±6,49 % у деэпителизированных сегментов, достоверных различий между данными группами обнаружено не было.
Серотонин также вызывал дозозависимое сокращение интактных (n=8) и деэпителизированных (n=10) сегментов ВП сенсибилизированных животных в концентрациях 0,01 мкМ – 10 мкМ. Максимальная амплитуда сокращения регистрировалась на воздействие серотонина в концентрации 10 мкМ и составляла 15,4±1,1 % для интактных сегментов и 18,5±1,2 % для деэпителизированных сегментов. Достоверных различий между интактными и деэпителизированными сегментами также обнаружено не было.
Сальбутамол в концентрациях 0,01 нМ – 10 мкМ вызывал дилатацию всех исследуемых сегментов ВП сенсибилизированных животных. В случае предсокращения гиперкалиевым раствором Кребса механическое напряжение интактных сегментов снижалось до 70,42±2,06 % от амплитуды предсокращения (n=8), механическое напряжение деэпителизированных сегментов – до 77,99±3,41 % от амплитуды предсокращения(n=14). Достоверных различий обнаружено не было. В случае предсокращения гистамином механическое напряжение интактных сегментов снижалось до 3,86±0,22 % (n=8) от амплитуды предсокращения на 100 мкМ гистамина, деэпителизированных сегментов – до 5,59±0,48 % (n=12), достоверные различия также были не выявлены.
Таким образом, модулирующая роль эпителия на сократительные реакции ГМ ВП в условиях формирования гиперреактивности нивелируется. Вероятно, это связано с тем, что при сенсибилизации морских свинок овальбумином происходит нарушение целостности эпителиального пласта, возникают необратимые органические изменения стенки ВП: на гистологических препаратах обнаруживаются преобладание эпителиоцитов с признаками дистрофии, скопление отечной жидкости под базальной мембраной и периваскулярно, гипертрофия мышечных волокон [Е.А. Геренг и др., 2004], что похоже на картину, наблюдающуюся у пациентов с бронхиальной астмой [S. Al-Muhsen, J.R. Johnson, Q. Hamid, 2011]. Такие изменения могут вести к дефициту секретирующей функции эпителия, либо к дисбалансу выделяющихся контрактильных и релаксирующих факторов.
2 Изменение механизмов нитроксидергической бронхорелаксации в условиях формирования гиперреактивности
Большинство исследователей считает, что эпителий так же, как эндотелий, выделяет эпителиальный релаксирующий фактор, однако при сенсибилизации возникает дефицит его образования, что приводит к снижению NO-зависимой бронхорелаксации [Р.И. Сепиашвили, М.Г. Шубич, В.Б. Карпюк, 2003]. Тем не менее, количество NO в выдыхаемом воздухе у людей больных бронхиальной астмой при обострении заболевания увеличивается [В.А. Невзорова, 1997].
Для оценки NO-продуцирующей функции дыхательных путей морских свинок были проведены исследования концентрации нитрит-анионов в бронхах морских свинок. Оказалось, что их концентрация у сенсибилизированных животных была увеличена в 2,43 раз по сравнению с животными контрольной группы (р<0,05). На фоне увеличения концентрации нитрит-анионов также было выявлено, что содержание цГМФ в респираторным тракте у сенсибилизированных морских свинок было достоверно выше в 1,47 раз, чем у животных контрольной группы (р<0,05). Следует отметить, что была выявлена статистически достоверная положительная корреляция (r=0,5; p<0,01) между параметрами, характеризующими NO-продуцирующую функцию дыхательных путей и уровнем цГМФ.
Кроме того, исследования выдыхаемого воздуха также подтвердили, что продукция NO в ВП при сенсибилизации увеличивается. В группе животных после сенсибилизации было обнаружено достоверное увеличение коэффициентов поглощения, соответствующие длинам волн 10,44 мкм, 10,14 мкм. Эти длины волн соответствуют линиям поглощения метаболитов оксида азота N2O и NO2 (коэффициенты поглощения для группы контроля составили: 0,1581 и 0,0803 соответственно, для экспериментальной группы: 0,2291 и 0,1171).
В связи с этим были проведены эксперименты по исследованию влияния окиси азота на сократительные реакции деэпителизированных сегментов ВП животных в норме и в условиях сенсибилизации. В качестве донаторов окиси азота были выбраны нитрозоглутатион и нитропруссид натрия. Влияние донаторов оксида азота оценивали на фоне предсокращения сегментов гиперкалиевым раствором Кребса.
Было показано, что нитропруссид натрия в концентрациях от 10 нМ до 100 мкМ вызывал дозозависмое расслабление всех сегментов, полученных от животных контрольной группы. Максимальная амплитуда расслабления на воздействие нитропруссида натрия (100 мкМ) составила 85,3±5,1 % (n=8) от амплитуды предсокращения. При этом максимальная амплитуда дилатационных реакций сегменты бронхов сенсибилизированных животных была достоверно больше (p<0,05) и составила 65,3±4,5 % (n=21) от амплитуды предсокращения.
Механизм действия нитропруссида натрия связывают с молекулой NO, высвобождающейся из этого комплекса. При этом считается, что и NO и оставшаяся часть нитропруссида натрия проникают через цитоплазматическую мембрану. Под влиянием NO происходит увеличение уровня цГМФ, что ведет к удалению ионов Са2+ из клетки [В.В. Рекалов, В.В. Тараненко, М.Ф.Шуба, 1985], активации калиевой проводимости [М.Б. Баскаков и др., 1996] и как следствие – развитию релаксации.
Эксперименты с нитрозоглутатионом показали, что он вызывает дозозависимое расслабление сегментов ВП животных контрольной (рис. 2) и экспериментальной групп во всем диапазоне концентраций (1 нМ – 100 мкМ).
Максимальная амплитуда расслабления ГМК сегментов ВП животных контрольной группы составила 58,2±3,5 % (n=6) от амплитуды предсокращения. При этом максимальная амплитуда расслабления сегментов ВП животных экспериментальной группы (n=10) была достоверно ниже (p<0,05) и составила 83,5±4,2 % от амплитуды предсокращения.
Дозозависимое расслабление ГМ ВП, наблюдающееся при воздействии нитрозоглутатиона, можно объяснить также с эффектом воздействия молекулы NO, высвобождающейся из данного соединения. Сам глутатион проникать через мембрану не может. Сенсибилизация сопровождается возникновением окислительного стресса и усилением активности ферментов антиоксидантной защиты. В клетке таким соединением является глутатион. Соответственно, количество свободного глутатиона в ГМК при формировании гиперреактивности уменьшается [А.В. Носарев, 2006; J. Kloek, E. Mortaz, I. Van Ark et al., 2010], следовательно, формируется нехватка глутатиона для связи с пришедшим извне NO (экзогенный нитрозоглутатион).
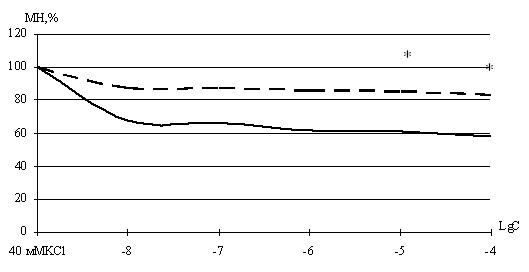 | Рисунок 2 – Зависимость механического напряжения гладкомышечных сегментов бронхов морских свинок, предсокращенных гиперкалиевым раствором Кребса, от концентрации нитрозоглутатиона Пунктирная линия - сегменты ВП морских свинок в состоянии гиперреактивности бронхов. Сплошная линия – сегменты бронхов морских свинок контрольной группы. По оси ординат – механическое напряжение в процентах от амплитуды контрольного сокращения на гиперкалиевый раствор Кребса (МН %). По оси абсцисс десятичный логарифм концентрации нитрозоглутатиона (Lg C). * - достоверность различий между амплитудами расслабления сегментов животных контрольной группы и в условиях формирования гиперреактивности (p<0,05). |
Кроме того, существуют данные о том, что при формировании бронхиальной астмы у людей метаболизм NO смещается в сторону образования пероксинитрита, так как уменьшается активность глутатион-S-трансферазы [Л.М. Огородова, 2009]. Пероксинитрит сам способен вызывать контрактильные реакции гладких мышц. Все это приводит к уменьшению дилатационных реакций на воздействие экзогенного нитрозоглутатиона при формировании гиперреактивности.
3 Влияние эйкозаноидов на сократительные реакции гладких мышц воздухоносных путей в условиях формирования гиперреактивности
Результаты, полученные при исследовании влияния эпителия на адренергическое расслабление ГМ ВП и имеющие зависимость от вида предсокращающего фактора, могут быть связаны с тем, что биологически активные вещества реализуют свое действие с вовлечением фосфоинозитидного пути регуляции сократительной активности ГМ.
Используя ингибиторы циклооксигеназы, можно считать, что работает только липоксигеназный путь и реализуются эффекты лейкотриенов и липоксинов. И наоборот, блокируя липоксигеназу, можно увидеть действие простагландинов, простациклинов и тромбоксанов.
В первой серии экспериментов исследовали влияние гистамина в концентрациях 10 нМ – 10 мкМ на сократительную активность гладких мышц сегментов ВП морских свинок контрольной группы после предобработки ингибитором липоксигеназы АА 861 в концентрации 1 мкМ. Гладкомышечные сегменты отвечали дозозависимым сокращением на всем диапазоне концентраций, при этом максимальная амплитуда сокращения на 10 мкМ гистамина составила 69,4±4,4 % (n=10), что было достоверно больше (на 31,9 %) величины амплитуды сокращения гладких мышц при воздействии гистамином на базальный тонус ГМК сегментов ВП (p<0,05).
Похожие результаты были получены при исследовании влияния серотонина в концентрациях 10 нМ – 10 мкМ на сегменты ВП животных контрольной группы, предобработанные ингибитором липоксигеназы АА 861 в концентрации 1 мкМ. Было обнаружено, что сегменты отвечают дозозависимым сокращением. Максимальная амплитуда реакции гладких мышц на концентрацию 10 мкМ составила 51,9±5,4 % (n=10). При этом на концентрацию серотонина 10 мкМ амплитуда сократительных реакций гладких мышц, предобработанных АА 861, была достоверно выше на 38,9 % (p<0,05) амплитуды сокращения гладких мышц при воздействии серотонином на базальный тонус (рис. 3).
Таким образом, при воздействии на гладкие мышцы таких констрикторов, как гистамин и серотонин, после предобработки ингибитором липоксигеназы происходит увеличение сократительного ответа сегментов ВП животных контрольной группы.
Однако, при воздействии гистамина на гладкомышечные сегменты ВП морских свинок, обработанные ингибитором липоксигеназы АА 861, в условиях формирования гиперреактивности амплитуда сокращения на 10 мкМ гистамина составила 35,7±2,3 % (n=10), что на 14,8 % меньше амплитуды сокращения при воздействии гистамином на базальный тонус ГМК сегментов ВП (p<0,05).
При воздействии серотонина амплитуда сократительного ответа сегментов ВП экспериментальной группы, обработанных ингибитором липоксигеназы АА 861, составила 33,3±3,2 % (n=10), что на 14,7 % больше амплитуды сокращения гладких мышц при воздействии серотонином на базальный тонус ГМК (p<0,05).
 | Рисунок 3 – Зависимость механического напряжения гладкомышечных сегментов бронхов морских свинок контрольной группы от концентрации серотонина Сплошная линия – сегменты ВП морских свинок без предобработки ингибитором липоксигеназы (АА 861). Пунктирная линия – сегменты ВП морских свинок после предобработки АА861. По оси ординат – механическое напряжение в процентах от амплитуды контрольного сокращения на гиперкалиевый раствор Кребса (МН, %). По оси абсцисс - десятичный логарифм концентрации серотонина (Lg C). * - достоверность различий в амплитудах сократительных реакций сегментов морских свинок (p<0,05). |
Таким образом, при сенсибилизации эффекты неоднозначны: гистаминергическиий сократительный ответ снижается, серотонинергический – повышается. Такой результат может быть объяснен исходным состоянием ВП. Хотя экзогенные простагландины обычно подавляют аллергические реакции, роль простагландинов как природных эндогенных регуляторов иммунного ответа и воспаления неясна. Имеются данные о том, что простагландины вызывают релаксацию [V. Schlemper et al., 2005; R.S. Lan et al., 2001] и сокращение ВП [L. Pang, E. Holland, A.J. Knox, 1998; D. Schaafsma et al., 2005], что зависит от типа простагландинов: ПГ-B2, ПГ-F2, ПГ-D2 сокращают гладкие мышцы бронхов, тогда как ПГ-Е2 расслабляет их [K. Decker, 1994; L.J. Janssen et al., 2000; A. Shiraki, H. Kume, T. Oguma et al., 2009].
Это может быть связано с тем, что гистамин в отличие от серотонина является основным медиатором, регулирующим тонус ГМ ВП в состоянии гиперреактивности. У животных контрольной группы система метаболизма арахидоновой кислоты не активна, поэтому ее стимуляция гистамином приводит к увеличенному по сравнению с экспериментальной группой эффекту. У сенсибилизированных животных простагландины, возможно, действуют через цАМФ, снижая констрикторный эффект. При стимуляции серотонином простагландины в условиях гиперспастического состояния вовлекаются в сократительный ответ. Возможно, что стимуляция гистамином приводит к большей наработке ПГ-Е2, а серотонином – ПГ-B2, ПГ-D2 или ПГ-F2.
В следующей серии экспериментов исследовали особенности влияния ингибитора циклооксигеназы индометацина на сократительную активность ГМ ВП морских свинок.
После предобработки индометацином сегменты ВП животных контрольной группы на воздействие гистамина отвечали дозозависимым сокращением. Максимальная амплитуда на концентрацию гистамина 10 мкМ была равной 74,5±5,5 % (n=10), что на 24,1 % превышала амплитуду сокращения ГМ ВП при действии гистамином на базальный тонус ГМК (p<0,05).
Подобное увеличение максимальной амплитуды сокращения наблюдалось также у сегментов ВП животных контрольной группы, предобработанных индометацином, при воздействии на них серотонина в концентрациях 0,1 мкМ – 10 мкМ. Максимальная амплитуда сократительных реакций предобработанных индометацином сегментов на максимальную концентрацию серотонина (10 мкМ) составила 51,5±4,4 %, что на 35,5 % было выше амплитуды сокращения сегментов при действии серотонина без предобработки индометацином (p<0,05).
После предобработки гладких мышц ингибитором циклооксигеназы индометацином происходит увеличение сократительного ответа ГМ ВП и на гистаминергическое воздействие, и на серотонинергическое. Возможно, полученные результаты связаны с тем, что при ингибировании циклооксигеназы происходит активация липоксигеназного пути метаболизма арахидоновой кислоты, что приводит к наработке лейкотриенов, которые являются мощными констрикторами.
Гладкомышечные сегменты в условиях гиперреактивности после предобработки индометацином (10 мкМ), на воздействие гистамином также отвечали дозозависимым сокращением. Максимальная амплитуда сокращения гладких мышц на концентрацию гистамина 10 мкМ составила 125,8±6,5 % (n=18). Полученное сокращение на 75,3 % (p<0,05) было достоверно больше амплитуды сокращения гладких мышц при воздействии гистамином на базальный тонус ГМК сегментов ВП (p<0,05).
При воздействии серотонина сегменты ВП животных экспериментальной группы, обработанные индометацином, отвечали дозозависимым сокращением, максимальная амплитуда при этом была достоверно больше на 21,9 % (p<0,05) амплитуды сокращения сегментов без обработки индометацином и составила 40,4±3,8 % (n=8).
При формировании гиперреактивности сократительные реакции ГМ на воздействие гистамина и серотонина увеличиваются. Известно, что при сенсибилизации метаболизм арахидоновой кислоты смещается в сторону наработки лейкотриенов, что способствует формированию гиперспастического состояния [Л.С. Булкина, А.Г. Чучалин, 1998; Z. Diamant et al., 1999]. Если в этих условиях заблокировать конкурентный путь наработки простагландинов, то констрикторный эффект медиаторов усиливается, дополненный действием лейкотриенов.
При изучении адренергических реакций сегментов ВП в условиях блокирования путей метаболизма арахидоновой кислоты были получены следующие результаты.
Сегменты ВП морских свинок предобрабатывались ингибитором липоксигеназы АА 861 в концентрации 1 мкМ, после чего предсокращались гистамином (100 мкМ), на фоне которого происходило воздействие сальбутамола.
Сальбутамол в концентрациях 0,01 нМ – 10 мкМ вызывал дозозависимое расслабление всех исследуемых сегментов ВП животных контрольной группы (n=12). Максимальная амплитуда расслабления на концентрацию сальбутамола 10 мкМ составила 13,81±0,4% от предсокращения. При этом наблюдалось достоверное снижение дилатационных реакций (p<0,05) при предобработке сегментов АА 861.
Такой же эффект был получен при исследовании адренергических реакций сегментов ВП животных экспериментальной группы. Сальбутамол в концентрациях 0,01 нМ – 10 мкМ вызывал дозозависимое расслабление исследуемых сегментов, максимальная амплитуда расслабления на концентрацию сальбутамола 10 мкМ составила -2,81±0,08 % от амплитуды предсокращения (n=14). Предобработка АА 861 достоверно снижала дилатационный эффект сальбутамола (p<0,05).
Для исследования влияния индометацина на адренергические реакции сегменты предобрабатывали индометацином, затем предсокращали гистамином (100 мкМ), на фоне которого проводили воздействие сальбутамолом.
Сальбутамол в концентрациях 0,01 нМ – 10 мкМ вызывал дозозависимое расслабление сегментов ВП морских свинок контрольной группы, максимальная амплитуда расслабления на концентрацию сальбутамола 10 мкМ составила -2,81±0,08 % от амплитуды предсокращения (n=14). Предобработка индометацином достоверно снижала дилатационный эффект сальбутамола (p<0,05).
Таким образом, при влиянии как ингибитора липоксигеназы, так и ингибитора циклооксигеназы расслабление на релаксанты снижается. Видимо, простагландины и лейкотриены препятствуют реализации цАМФ-зависимого пути, запускаемого -адреномиметиками.
Подводя итог, можно сделать вывод, что основной медиатор воспаления гистамин, оказывающий наибольшее влияние на тонус ГМ ВП, может играть важную роль в формировании состояния гиперреактивности, вовлекая в сократительный ответ и простагландины и лейкотриены, которые к тому же снижают выраженность дилатационных реакций. Возможно, что снижение дилатационных реакций на адренергические воздействия при сенсибилизации объясняется не только снижением количества рецепторов, как предполагалось ранее, но также усиленной наработкой простагландинов, лейкотриенов и тромбоксанов.
4 Роль цитокинов в регуляции тонуса воздухоносных путей в условиях формирования гиперреактивности
Кроме эйкозаноидов, оказывающих влияние на механическое напряжение гладких мышц, существует группа соединений, активирующихся при патологических процессах и способных влиять на тонус гладких мышц – цитокины. При сенсибилизации активируется Th-2-путь, и клетки выделяют ИЛ-3, -4, -5, -6, -9 и -13. Способностью изменять тонус бронхиальных мышц обладает ИЛ-4, однако в последние годы все больше внимания уделяется ИЛ-5, отвечающему за рост и развитие эозинофилов.
В первой серии экспериментов было изучено непосредственное влияние ИЛ-5 на тонус сегментов ВП животных обеих групп. Для этого ИЛ-5 добавляли в кювету с сегментами в концентрациях 1 пг/мл, 0,01нг/мл, 0,1нг/мл, 1 нг/мл и 0,01мкг/мл. Было установлено, что ИЛ-5 в указанных концентрациях не оказывал влияния на механическое напряжение сегментов.
Это подтверждается исследованием влияния ИЛ-5 на реактивность ВП при его ингаляции [H.-Z. Shi et al., 1998]. При ингалировании ИЛ-5 людям с легкой степенью астмы показатели спирометрии оставались прежними, как до ингаляции.
Для проведения второй серии экспериментов изолированные деэпителизированные сегменты предварительно в течение 18 часов инкубировали в термостате при температуре 250С в среде RPMI-1640 с добавлением ИЛ-5 (концентрация 0,1 мкг/мл). После этого сегменты тестировались воздействием гистамина и сальбутамола, аналогично тому, как это было описано выше.
Инкубация с ИЛ-5 приводила к существенному увеличению амплитуды сократительных реакций гладких мышц бронхов на воздействие гистамина как у сенсибилизированных животных, так и у животных контрольной группы. Было выявлено повышение амплитуды сокращения на воздействие гистамина в концентрациях 10 и 100 мкМ как в контрольной (p<0,05, n=13), так и в экспериментальной группах (p<0,05, n=9). Максимальная амплитуда сокращения сегментов ВП, полученных от животных контрольной группы, составила 53,65±1,82 %, (n=8), после инкубации с ИЛ-5 – 98,37±6,45 % (n=13). Максимальная амплитуда сокращения сегментов гладких мышц бронхов, полученных от животных экспериментальной группы, составила 89,74±6,49 %, (n=18), а сегментов, инкубированных с ИЛ-5 – 115,19±6,23 % (n=9).
В следующей серии экспериментов было изучено влияние ИЛ-5 на дилатационные реакции ГМ бронхов при действии на них сальбутамола.
При воздействии сальбутамола на инкубированные с ИЛ-5 сегменты, предсокращенные гиперкалиевым раствором Кребса, наблюдалось уменьшение степени расслабления как в контрольной, так и в экспериментальной группе.
В контрольной группе степень расслабления достоверно уменьшалась при инкубации с ИЛ-5 на концентрации сальбутамола 1 мкМ (p<0,05, n=6) и 10 мкМ (p<0,05, n=6). У сегментов ВП сенсибилизированных животных, инкубированных с ИЛ-5, амплитуда расслабления сегментов была меньше на концентрации сальбутамола 0,1 мкМ (p<0,05, n=6), 1 мкМ/мл (p<0,05, n=6) и 10 мкМ (p<0,05, n=6).
Таким образом, инкубация сегментов с ИЛ-5 приводит к значительному повышению их реактивности на гистамин и, вместе с тем, к уменьшению амплитуды релаксирующих ответов на воздействие сальбутамола, причем как сегментов ВП животных контрольной группы, так и сенсибилизированных. Можно предположить, что ИЛ-5 оказывает непосредственное влияние на функциональное состояние гладких мышц бронхиальной стенки. Действие этого цитокина может опосредоваться через рецепторный комплекс. Рецепторы к ИЛ-5 найдены в ГМ ВП [Y. Bi, Z. Yang, C. Wang, 1999]. Значит, взаимодействуя со своими рецепторами ГМ, ИЛ-5 посредством неизвестных на данный момент механизмов может изменять реактивность ГМ на воздействие гистамина. Это может объяснять феномен ИЛ-5-опосредованной бронхиальной гиперреактивности при отсутствии эозинофильного повреждения тканей [A. Koarai, M. Ichinose, S. Ishigaki-Suzuki, 2003; A.D. Kraneveld, F.P. Nijkamp, A.J. Van Oosterhout, 1997]. Более того, ранее было показано, что для развития бронхиальной гиперчувствительности критическими являются ИЛ-5 и ИЛ-4, но не эозинофилы или IgE, то есть ИЛ-5 лиганд-рецепторное взаимодействие на гладких мышцах дыхательных путей может вызывать гиперчувствительность независимо от эозинофил-индуцированного повреждения тканей.
Таким образом, ИЛ-5 является заманчивой терапевтической мишенью. Однако в исследованиях на морских свинках с экспериментальной бронхиальной астмой было замечено, что для блокирования гиперреактивности дыхательных путей необходимы более высокие дозы препаратов моноклональных антител к ИЛ-5, чем для блокирования эозинофильного воспаления [C.L. Elbon, D.B. Jacoby, A.D. Fryer, 1995; Y. Hitoshi, 1991]. Поэтому остается еще один путь для предотвращения возникновения токсических и провоспалительных эффектов, возникающих в результате дегрануляции эозинофилов – необходимо блокировать действие ИЛ-5 на эти клетки, то есть блокировать взаимодействие между ИЛ-5 и рецептором к нему.
Известно, что астма характеризуется повышенной экспрессией рецептора ИЛ-5, образование мРНК мИЛ-5Р повышено у всех больных в периферической крови и мокроте. При тяжелой форме заболевания наблюдается сдвиг в сторону преимущественного образования мРНК мембранносвязанной изоформы [Л.М. Огородова и др., 2006]. Связывание ИЛ-5 можно осуществить, используя растворимую изоформу –рецептора к ИЛ-5. Для проверки данного предположения проводили инкубацию сегментов в среде с добавлением ИЛ-5 в концентрации 0,1 мкг/мл и -субъединицей рецептора ИЛ-5 в концентрациях 0,1 мкг/мл, 0,5 мкг/мл и 1 мкг/мл.
И в контрольной, и в экспериментальной группах совместное добавление в среду ИЛ-5 и его рецептора приводило к достоверному снижению амплитуды сократительных реакций на воздействие гистамина по сравнению с амплитудами сокращения при инкубации только с ИЛ-5.
У сегментов ВП морских свинок контрольной группы снижение максимальной амплитуды сокращения при концентрации рецептора 1 мкг/мл составило 63,87 % (p<0,01, n=6), при концентрации рецептора 5 мкг/мл – 60,68 % (p<0,01, n=6) (рис. 69). У сегментов ВП животных экспериментальной группы максимальная амплитуда уменьшилась при концентрации рецептора 1 мкг/мл на 63,6 % (p<0,01, n=6), при концентрации 5 мк/мл – на 54,63 % (p<0,01, n=6), при концентрации 1 мкг/мл – 43,32 % (p<0,01, n=6) (рис. 70). При этом максимальная амплитуда сокращения сегментов ВП сенсибилизированных животных оставалась выше амплитуды сокращения сегментов ВП животных контрольной группы (p<0,05, n=6).
Таким образом, добавление в среду инкубации рекомбинантного рецептора ИЛ-5 частично блокировало эффекты данного цитокина на гиперреактивность бронхов. Связывая экзогенный ИЛ-5, рецептор тем самым уменьшает сократительные реакции сегментов бронхов животных обеих групп (контрольной и экспериментальной) на гистаминергические воздействия. Но амплитуда сократительных реакций сегментов ВП сенсибилизированных животных остается выше по сравнению с контрольной группой. Эти различия между группами свидетельствуют о важном значении исходного состояния сегментов: возможно, что при сенсибилизации количество эндогенного ИЛ-5 повышено настолько, что необходимы более высокие дозы рецептора ИЛ-5 для полного его связывания. Это подтверждается некоторыми данными из литературы, показывающими, что цитокины и их рецепторы могут синтезироваться в гладкомышечных клетках кроликов и людей.
Для подтверждения того, что в сегментах ВП сенсибилизированных животных находится эндогенный ИЛ-5, который влияет на реактивность ВП, были проведены эксперименты с инкубацией сегментов только с -субъединицей рецептора ИЛ-5.
Инкубацию гладкомышечных сегментов проводили в течение 18 часов при температуре 250С в среде RPMI-1640 с добавлением -субъединицы рецептора ИЛ-5 в концентрациях 0,1 мкг/мл, 0,5 мкг/мл и 1 мкг/мл.
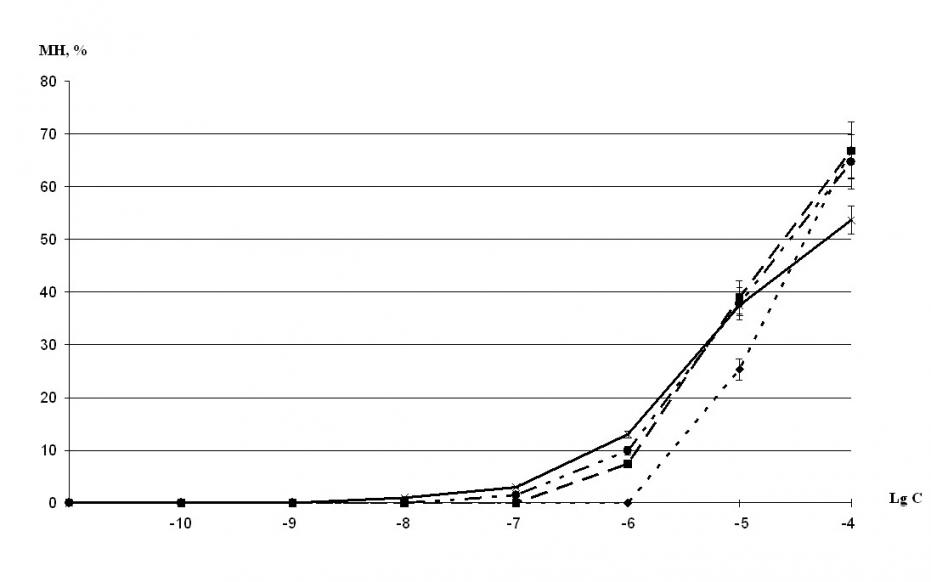
На инкубированные сегменты воздействовали гистамином в концентрациях 0,1 нМ - 100 мкМ. При инкубации достоверной разницы между амплитудами сокращения сегментов ВП животных контрольной группы обнаружено не было (рисунок 4). У сегментов ВП сенсибилизированных животных достоверное снижение сократительных реакций наблюдалось при инкубации сегментов с рецептором в концентрации 1 мкг/мл (рис. 4).
Полученные результаты свидетельствуют о том, что растворимая -субъединица рецептора ИЛ-5 способна связывать растворенный в окружающей среде ИЛ-5, а также эндогенный ИЛ-5 и тем самым устранять его действие, направленное на повышение гиперреактивности гладких мышц дыхательных путей. Эти данные позволяют обсудить перспективу использования растворимой формы -субъединицы рецептора ИЛ-5 для блокирования действия ИЛ-5 на клетки, устраняя ИЛ-5-опосредованные эффекты. Такой подход может лечь в основу принципиально нового, патогенетически обоснованного способа коррекции бронхоспастических состояний.
Однако традиционно главным констрикторным цитокином считается не ИЛ-5, а ИЛ-4. Чтобы оценить вклад ИЛ-5 в повышение сократительных реакций, было проведено сравнение его эффекта с воздействием ИЛ-4.
Для проведения экспериментов, изолированные деэпителизированные сегменты предварительно в течение 18 часов инкубировали в термостате при температуре 250С в среде RPMI-1640 с добавлением ИЛ-4 (концентрация 0,1 мкг/мл). После этого сегменты тестировались воздействием гистамина в концентрациях 1 нМ – 10 мкМ.
 А А |  Б Б |
Рисунок 4 – Зависимость механического напряжения (МН) гладкомышечных сегментов бронхов морских свинок контрольной группы (А) и экспериментальной группы (Б) от концентрации гистамина (эпителий удален)

