Структурные изменения миометрия мышей при его инволюции после многократных родов и прерванной беременности
На правах рукописи
ОБЕДИНСКАЯ
КРИСТИНА СЕРГЕЕВНА
СТРУКТУРНЫЕ ИЗМЕНЕНИЯ МИОМЕТРИЯ МЫШЕЙ ПРИ ЕГО ИНВОЛЮЦИИ ПОСЛЕ МНОГОКРАТНЫХ РОДОВ И ПРЕРВАННОЙ БЕРЕМЕННОСТИ
03.03.04 - клеточная биология, цитология, гистология
14.03.02. - патологическая анатомия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Новосибирск - 2010
Работа выполнена в Учреждении Российской академии медицинских наук Научный центр клинической и экспериментальной медицины Сибирского отделения РАМН и Государственном образовательном учреждении высшего профессионального образования Новосибирский государственный медицинский университет Росздрава
Научные руководители:
Заслуженный деятель науки РФ,
академик РАМН,
доктор медицинских наук, профессор Шкурупий Вячеслав Алексеевич
Доктор медицинских наук,
профессор Надеев Александр Петрович
Официальные оппоненты:
Доктор медицинских наук, профессор Обухова Лидия Александровна
Доктор медицинских наук, профессор Ларионов Петр Михайлович
Ведущая организация: НИИ региональной патологии и патоморфологии СО РАМН
Защита состоится « »_____________2010 года в_______часов на заседании диссертационного совета Д001.048.01 в Научном центре клинической и экспериментальной медицины Сибирского отделения Российской академии медицинских наук по адресу: 630117, г. Новосибирск, ул. Тимакова, 2. Тел. / факс 8(383) 333 64 56
С диссертацией можно ознакомиться в библиотеке НЦ КЭМ СО РАМН.
Автореферат разослан « »____________2010 года
Ученый секретарь диссертационного совета
доктор биологических наук ![]() Пальчикова Н.А.
Пальчикова Н.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Послеродовый период – заключительная стадия гестационного процесса, характеризующаяся «обратным развитием» изменений, связанных с беременностью и родами, становлением лактационной функции молочных желез и восстановлением деятельности гипоталамо-гипофизарно-яичниковой системы (Чернуха Е.А., 2006, Милованов А.П. и др., 2007). Особенностью матки в перинатальный период является то, что во время беременности ее масса значительно возрастает, а после родов очень быстро возвращается к исходному (до беременности) уровню, что обусловлено инволютивными процессами, происходящими преимущественно в миометрии.
Механизмы, реализующие программу послеродовых структурных изменений миометрия, не достаточно изучены. В научной литературе рассматривают четыре механизма, обеспечивающих постгестационную трансформацию структур матки: апоптоз (Chatzaki E., et al., 2003; Caron P.-L. et al., 2009), клазмацитоз (Шкурупий В.А., и др., 2008; Inoue S. et al., 1983), аутофагоцитоз и некроз (Henell F. et al., 1983; Jeffrey J.J., 1991). Однако какой из приведенных механизмов элиминации структур является наиболее эффективным и «физиологичным» не ясно. Так, аутофагоцитоз, в связи с малым его масштабом, не может быть таковым. Физиологически наиболее «предпочтительным» представляется клазмацитоз, т.к. с ним не сопряжены уменьшение численности миоцитов и последующее воспаление, поскольку происходит лишь уменьшение размеров миоцитов, которые могут быть восстановлены в процессе регенерационной гипертрофии при повторной беременности и, видимо, без ущерба для силы мышечных сокращений. Однако наиболее широко распространено представление о том, что ведущим механизмом послеродовой инволюции структур маки является апоптоз (Shimonnvitz S. et al., 1994; Leppert P.C.,1998; Pampfer S. et al., 2003; Chatzaki E. et al., 2003; Dery М.С. et al., 2003; Yin Y. et al., 2008; Caron P.-L. et al., 2009).
Известно, что увеличение количества беременностей, а также многократные беременности, наряду с эпизодами их искусственного прерывания, являются факторами риска развития ряда осложнений при родах, среди которых угрожающие плоду и матери – атония матки и слабость родовых сил. Одним из ведущих признаков клинического неблагополучия в течение послеродового периода является субинволюция матки, которая достаточно часто встречается после родов у женщин с отягощенным акушерско-гинекологическим анамнезом. В связи с этим не ясно, какая существует зависимость между инволютивными процессами, происходящими в миометрии после родов и слабостью родовых сил при многочисленных беременностях, а также при наличии эпизодов прерывания беременности в анамнезе.
Таким образом, для решения вопросов профилактики и разработки наиболее эффективных способов коррекции послеродовых осложнений в условиях многократных родов, и родов, осложненных прерыванием предшествующей беременности, необходимо белее углубленное изучение механизмов инволюции миометрия в экспериментах, моделирующих процессы, потенциально сопряженные с возможностью развития осложнений в родах и послеродовом периоде при многократных беременностях и их искусственном прерывании, в частности.
Цель исследования. Изучить особенности структурных преобразований в миометрии мышей линии C57/Bl6g во время беременности, в ранний и поздний послеродовые периоды при однократной, многократных берменностях и многократных беременносях с эпизодом прерывания предыдущей (второй) беременности.
Задачи исследования:
1. Изучить структурную организацию миометрия у небеременных мышей линии C57BL/6g и при физиологической беременности.
2. Изучить особенности структурных преобразований паренхимы и стромы миометрия мышей линии C57BL/6g в процессе третьей физиологической беременности и его инволюции после нее.
3. Изучить структурные преобразования в миометрии мышей в процессе третьей физиологической беременности и после нее у мышей линии C57BL/6g с эпизодом прерывания предыдущей (второй) беременности.
4. Изучить структурные проявления механизмов, обеспечивающих послеродовую инволюцию матки у мышей линии C57BL/6g после однократных, многократных и многократных с прерыванием второй беременности родов.
5. Изучить влияние многократных физиологических беременностей и родов, а так же родов с эпизодом прерывания предыдущей (второй) беременности на вероятное изменение количества плодов в помете у мышей.
Научная новизна результатов исследования. Впервые рассмотрены механизмы структурных преобразований миометрия мышей линии C57BL/6g при беременности и в процессе послеродовой инволюции. Показано, что послеродовая инволюция миометрия у мышей линии C57BL/6g завершается к 10-м суткам после родов, проявляясь «возвратом» структурной организации миометрия к структурным параметрам матки у небеременных животных. Показано, что процесс инволюции после третьих физиологических беременностей и родов, и физиологических родов, которым предшествовало искусственное прерывание беременности, не завершался к 10-м суткам послеродового периода. Удлинение процесса инволюции сопряжено с неэффективностью механизмов элиминации (клазмацитоз, апоптоз, некроз) структур миометрия. Впервые показано, что инициация процессов инволюции миометрия имеет обратную корреляционную связь с ухудшением васкуляризации миометрия, особенно после многократных родов с эпизодом прерывания предшествующей беременности, а ухудшение трофики миометрия инициирует процессы клазмацитоза, апоптоза и некроза миоцитов в нем.
Впервые установлено, что к 10-м суткам послеродового периода в интерстиции миометрия у мышей, перенесших три беременности, каждая из которых закончилась физиологическими родами, а также у мышей с наличием эпизода прерывания беременности в «анамнезе», происходило многократное уменьшение количества коллагена. Впервые показано, что за «пределами родов» в тех же экспериментальных условиях в миометрии продолжались процессы пролиферации миоцитов, а уровень структурных механизмов инволюции у самок в связи с многократными родами и эпизодом прерывания беременности – недостаточен для завершения процесса инволюции миометрия к 10-м суткам послеродового периода.
Научно-практическая значимость работы. Показано, что основными механизмами послеродовой инволюции являются: клазмацитоз, апоптоз, некроз при адекватном количестве макрофагов в миометрии, «обеспечивающих» элиминацию погибших миоцитов и цитоплазматических конгломератов (продуктов клазмацитоза) из интерстиция. Показано, что многократная беременность и многократная беременность с эпизодом ее прерывания сопряжены с избыточной элиминацией коллагена, удлинением периода послеродовой инволюции миометрия в связи с задержкой процесса элиминации структур миометрия и уменьшением количества плодов в помете у мышей.
Положения, выносимые на защиту.
1. Ведущими механизмами, обеспечивающими послеродовую инволюцию миометрия у мышей, являются: клазмацитоз, апоптоз, некроз миоцитов с последующим фагоцитозом их «продуктов» макрофагами. Эффективность механизмов послеродовой инволюции миометрия снижена после многократных физиологических родов и многократных физиологических родов с эпизодом прерывания предыдущей (второй) беременности.
2. Многократные физиологические беременности и роды, и многократные беременности и роды с эпизодом искусственного прерывания предыдущей (второй) беременности, сопряжены с: продолжением пролиферативных процессов в миометрии после родов, удлинением периода инволюции миометрия за пределы 10-х суток в связи с меньшей эффективностью механизмов ее обеспечивающих по сравнению с таковыми у мышей после однократных физиологических беременностей и родов; существенным уменьшением количества коллагена в миометрии и количества плодов в помете.
3. Установлены сильные обратные корреляционные связи структурных проявлений механизмов, обеспечивающих инволюцию миометрия и коэффициента его васкуляризации, а также прямые сильные корреляции изменений численной плотности макрофагов в миометрии с концентрацией его структур, подлежащих элиминации в послеродовом периоде. Это свидетельствует о том, что ухудшение васкуляризации миометрия в конце беременности и в послеродовом периоде является фактором, инициирующим процесс инволюции миометрия механизмами клазмацитоза, апоптоза и некроза, и, как следствие, приводит к адекватному увеличению численности макрофагов без проявлений процесса воспаления в миометрии.
Апробация материалов диссертации. Основные положения диссертации были доложены и обсуждены на съезде Российского общества патологоанатомов (Самара, 2009 г.), четвертой Всероссийской научно-практической конференции «Фундаментальные аспекты компенсаторно-приспособительных процессов» с международным участием (Новосибирск, 2009).
Публикации. По материалам диссертации опубликовано 6 научных работ, из которых 2 в журналах, включенных в список периодических научных изданий, рекомендованных ВАК РФ для опубликования материалов кандидатских диссертаций.
Структура и объем диссертации. Работа изложена на 142 страницах машинописного текста, содержит обзор литературы, описание материала и методов исследования, результаты исследования и их обсуждение, заключение, выводы и список цитируемой литературы, который включает 98 русскоязычных и 116 иностранных источников. Работа иллюстрирована 13 микрофотографиями, 22 графиками, 16 таблицами.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на 95 мышах-самках двухмесячного возраста массой 20–22 гр. линии С57Bl/6g. Животные получены из питомника НИИ цитологии и генетики СО РАН (г. Новосибирск).
Животных содержали в стандартных условиях, на стандартной лабораторной диете, они имели свободный доступ к пище и воде. Продолжительность периода адаптации мышей к условиям содержания перед проведением эксперимента составила две недели. Для получения материала по методике, описанной М. Monk (1987), группу самок (по 5 животных) помещали в клетку с самцом. Срок беременности у самок определяли со дня обнаружения во влагалище копулятивной пробки. Животных выводили из эксперимента под эфирным наркозом методом дислокации шейных позвонков. Регистрировали количество плодов в каждой группе мышей. Все воздействия на животных в ходе эксперимента, взятие экспериментального материала осуществляли в утренние часы (с 900 до 1000).
Животные были разделены на четыре группы по пять мышей на каждом этапе исследования:
Первая группа – интактная (небеременные) мыши-самки линии С57Bl/6g.
Вторая группа – однократно рожавшие мыши-самки линии С57Bl/6, перенесшие одну беременность.
Третья группа – многократно рожавшие мыши-самки линии С57Bl/6g, перенесшие две беременности. Образцы матки получали в течение третьей физиологической беременности и после третьих физиологических родов.
Четвертая группа – многократно рожавшие с эпизодом прерывания беременности. Преждевременные роды были индуцированы препаратом «Энзапрост-Ф» (Хиноин, Венгрия) с концентрацией действующего вещества 5 мг/мл, на 15-е сутки второй беременности. Введение препарата осуществляли интраперитонеально в дозе 0,3 мл. на мышь. Образцы материала получали в течение третьей физиологической беременности и после третьих физиологических родов.
Объектом исследования служил миометрий мышей линии С57Bl/6g, образцы которого забирали на 10-е и 20-е сутки беременности и на 1-е, 3-е, 5-е, 10-е сутки после родов.
Для гистологического исследования образцы миометрия получали из межплацентарных зон матки, фиксировали в 10%-ном водном растворе нейтрального формалина, обезвоживали в серии спиртов возрастающей концентрации и заключали в парафин. Срезы толщиной 5-6 мкм. изготавливали на микротоме ротационного типа НМ 355S (Mikrom) (Carl Zeiss), окрашивали гематоксилином Майера и эозином и по ван Гизон (Пирс Э., 1962; Лили Р., 1969). Для идентификации апоптотических изменений в миоцитах проводили иммунногистохимическое окрашивание срезов с использованием моноклональных антител caspasae 3 (Novocastra Ltd, Великобритания) (Саркисов Д.С., Перов Ю.Л., 1996). Гистологические срезы исследовали в световом микроскопе AxioStar plus (Carl Zaiss).
Морфометрию структур миометрия осуществляли с помощью закрытой тестовой системы, состоящей из 25 регулярно расположенных квадратов с тестовой площадью 1600 мкм при конечном увеличении в 400 раз. Подсчитывали объемную (Vv) и численную (Nai) плотности миоцитов миометрия и их структур (ядро, цитоплазма); сосудов миометрия. Для оценки эффективности кровоснабжения миометрия вычисляли коэффициент васкуляризации (отношение объемной плотности сосудов в миометрии к суммарной объемной плотности миоцитов). Величину данного показателя выражали в долях единицы. Определяли средний объем ядра миоцита (отношение объемной плотности (Vv) ядер миоцитов к численной плотности (Nai) ядер миоцтов) и средний объем самого миоцита (отношение общей объемной плотности (Vv) миоцитов к численной плотности (Nai) цитоплазмы миоцитов). Оценивали объемные плотности (Vv) коллагеновых волокон стромы миометрия, апоптотически измененных миоцитов, идентифицированных по визуальным цитологическим признакам (кариопикноз, кариорексис, апоптотическое тельце) и с использованием иммуногистохимической метки для выявления экспрессии caspasae 3, цитоплазматических конгломератов в интерстиции (продукты клазмацитоза цитоплазмы миоцитов) и некротически измененных миоцитов. На основании полученных данных, в каждом из периодов наблюдений путем сложения определяли суммарную объемную плотность миоцитов, погибших механизмами апоптоза, клазмацитоза (цитоплазматические конгломераты в интерстиции) и некроза. Кроме того, определяли объемную (Vv) и численную (Nai) плотности миоцитов в состоянии вакуольной и баллонной дистрофий. Исследовали численную плотность (Nai) макрофагов в интерстиции миометрия. Проводили корреляционный анализ величин (результатов морфометрии) – устанавливали характер взаимосвязи объемных долей сосудов миометрия с объемными долями некротически и апоптотически измененных миоцитов; концентрацией макрофагов (Nai) с объемными плотностями апоптотически, некротически измененных миоцитов и продуктами их клазмацитоза.
Статистическую обработку полученных данных выполняли в соответствии с принципами вариационной статистики (Автандилов Г. Г., 1996; Гланц С.В., 1999) и с использованием пакета прикладных программ «Statistica 7,0» (StatSoft Inc., USA). Результаты представлены как среднее арифметическое и ошибка среднего (М±m). Оценку межгрупповых различий проводили с учетом нормального распределения величин исследованных параметров и использованием t-критерия Стьюдента. Проводили корреляционный анализ с расчетом коэффициента ранговой корреляции Пирсона. Выявленные различия считали статистически значимыми при величине р<0,05.
Полученные результаты представлены в виде графиков, диаграмм и таблиц, созданных с помощью программ Microsoft Word и Microsoft Excel 2007.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
1. Структурная организация небеременных мышей-самок линии C57Bl/6g
Морфологическое исследование миоцитов миометрия мышей интактной группы показало, что данная популяция клеток разнородна. В соответствии с морфофункциональной классификацией групп миоцитов миометрия, предложенной В.А. Шкурупием, Е.В. Дубининым (2005), было выявлено, что большая часть миоцитов относится к клеткам 1-го (активно функционирующие) и 2-го (покоящиеся) типов. Содержание 3-го, 4-го, 5-го типов миоцитов (миоциты в состоянии вакуольной, баллонной дистрофий и апоптотически измененных миоцитов, соответственно) было незначительным (табл. 1). Кроме того, на долю миоцитов приходилось более двух третей и менее трети - на долю коллагеновых волокон стромы миометрия (табл. 2).
Таблица 1
Результаты морфометрического исследования структур миометрия мышей линии C57Bl/6g при однократной беременности и в процессе его послеродовой инволюции (M±m)
| Усло-вия экспе-римен-та, объект | Мио-циты в состо-янии вакуоль-ной дистро-фии (Vv) | Мио-циты в состо-янии баллон-ной дистро-фии (Vv) | Цито-плазма-тические конгло-мераты в интерстиции (Vv) | Апопто-тически изме-ненные мио-циты (Vv) | Некроти-чески изменен-ные миоциты (Vv) | Общий объем мио-цитов, подле-жщих элими-нации (Vv) | Макро-фаги (Nai) |
| Интакт-ные мыши-самки | 1,36±0,29 | 1,28±0,35 | 0,80±0,27 | 1,68±0,34 | 0,48±0,14 | 2,90±0,2 | 0,73±0,11 |
| 10 | 6,88±0,85 а | 2,64±0,35 а | 3,12±0,57 a | 1,84±0,38 | 0,44±0,13 | 5,40±0,36 a | 0,91±0,14 |
| 20 | 11,92±0,78 a | 3,28±0,54 a | 5,04±1,02 a | 2,80±0,40 a | 2,48±0,51 a | 10,32±0,64 a | 1,25±0,13 a |
| 1 | 9,44±0,70 ab | 6,56±0,80 ab | 16,08±1,01 b | 3,44±0,49 a | 2,92±0,47 a | 22,44±0,65 ab | 1,84±0,25 a |
| 3 | 7,28±0,81 ab | 5,04±0,56 ab | 8,00±1,07 b | 5,04±0,51 ab | 1,44±0,25 ab | 14,49±0,75 ab | 1,17±0,12 a |
| 5 | 5,28±0,71 ab | 7,76±0,77 ab | 3,76±0,88 b | 2,32±0,41 a | 0,96±0,76 b | 7,04±0,68 ab | 0,87±0,12 b |
| 10 | 3,28±0,39 аb | 2,88±0,49 а | 0,00 ab | 2,16±0,32 | 0,44±0,12 b | 2,62±0,33 b | 0,77±0,10 b |
Примечание: отличия статистически значимы - a – от величин параметров миометрия интактных самок, b – от параметров миометрия на 20-е сутки беременности.
10, 20 – продолжительность беременности (сутки).
1, 3, 5, 10 – продолжительность послеродового инволютивного периода (сутки).
2. Структурные изменения миометрия впервые беременных мышей-самок линии C57Bl/6g и в процессе его послеродовой инволюции
Во время первой беременности наблюдали увеличение объема матки. При морфометрическом исследовании миометрия на 10-е и 20-е сутки беременности было определено, что гипертрофия матки обусловлена процессами пролиферации миоцитов, т.к. средние объемы миоцитов и их ядер уменьшились в 2 раза, а численная плотность ядер увеличилась в 3 раза (см. табл. 2). Наряду с анаболическими процессами, происходящими в паренхиме миометрия, наблюдали процессы деструкции миоцитов – увеличение доли дистрофически измененных миоцитов к концу беременности (см. табл. 1). В период беременности доля коллагеновых волокон стромы уменьшалась (см. табл. 2).
Таблица 2
Результаты морфометрического исследования паренхимы, коллагена и структур миоцитов миометрия мышей линии C57Bl/6g при однократной беременности и в процессе послеродовой инволюции (M±m)
| Условия экспери-мента, объект | Общий объем миоцитов миометрия ( Vv) | Объем миоцита (v) | Цитоплаз-мы миоцитов (Nai) | Объем ядра (v) | Ядра миоцитов (Nai) | Коллагеновые волокна стромы миометрия (Vv) |
| Интакт-ные мыши-самки | 62,74±1,25 | 1,88±0,02 | 33,46±1,08 | 0,73±0,02 | 28,05±1,05 | 27,30±1,19 |
| 10 | 68,65±0,96 а | 1,53±0,02 a | 44,89±1,79 a | 0,63±0,01 a | 38,12±1,74 a | 25,56±1,06 |
| 20 | 75,54±1,12 a | 0,89±0,01 a | 84,00±1,01 a | 0,32±0,02 a | 78,79±1,06 a | 15,38±1,19 a |
| 1 | 71,28±0,99 ab | 1,67±0,01 ab | 42,62±1,61 ab | 0,65±0,02 ab | 32,48±1,54 ab | 18,01±1,06 ab |
| 3 | 68,20±1,21 ab | 1,70±0,02 ab | 40,08±1,34 ab | 0,65±0,01 ab | 31,88±0,63 b | 21,25±1,18 ab |
| 5 | 65,45±0,98 b | 1,83±0,01 ab | 35,86±1,21 b | 0,64±0,02 ab | 30,05±1,36 b | 22,86±1,06 ab |
| 10 | 63,08±1,12 b | 1,80±0,01 ab | 34,95±1,32 b | 0,68±0,01 ab | 28,04±0,80 b | 27,98±0,96 b |
Примечание: отличия статистически значимы - a – от величин параметров миометрия интактных самок, b – от параметров миометрия на 20-е сутки беременности.
10, 20 – продолжительность беременности (сутки).
1, 3, 5, 10 – продолжительность послеродового инволютивного периода (сутки).
Объемная и численная плотности сосудов к середине беременности не изменялись и соответствовали аналогичным величинам в небеременной матке. В конце беременности величина объемной плотности сосудов увеличивалась на 48%, а величина численной - изменялась незначительно (табл. 3). При гистологическом исследовании нередко наблюдали полнокровие сосудов. Все это указывает на застойные явления в миометрии в данный период беременности, что может быть причиной нарушения гемодинамики в микроциркуляторном русле и развития тканевой гипоксии. Недостаточная трофика миоцитов с последующим развитием окислительного стресса в миоцитах может объяснить масштабную трансформацию миоцитов в состояние вакуольной дистрофии, а также явления апоптоза и, возможно, клазмацитоза.
Так, общий объем элиминированных миоцитов к исходу беременности в 3,5 раза превышал величину аналогичного показателя у животных интактной группы (см. табл. 1). Преимущественным механизмом элиминации миоцитов в рассматриваемом периоде был клазмацитоз, продукты которого на светооптическом уровне были представлены скоплениями многочисленных вакуолей в интерстиции – цитоплазматические конгломераты из участков цитолеммы миоцитов (Шкурупий В.А., Дубинин Е.В. и др., 2008). Объемная плотность данных структур в середине беременности была выше, чем у небеременных животных и продолжала увеличиваться к моменту родов. Элиминацию структур миометрия механизмами некроза и апоптоза наблюдали в конце беременности, и их объемы были примерно равными (см. табл. 1).
Элиминация миоцитов, находящихся на завершающих стадиях гибели (апоптотически и некротически измененные миоциты), и фрагментов их цитолеммы (продукты клазмацитоза) является «прерогативой» макрофагов (Hunt J.S.1990; De M., Wood G.W., 1990; Grossman C.J. et al., 1994; Druckmann R., 2001). Для адекватной реализации данной функции возникает «необходимость» увеличения численного состава макрофагального звена. Согласно данным, представленным в таблице 1, на 20-е сутки беременности численная плотность макрофагов увеличилась почти в 2 раза по сравнению с величиной данного показателя у мышей интактной группы. Была выявлена прямая положительная корреляционная зависимость между изменениями объемных плотностей каждой из структур, подлежащих элиминации, и численной плотностью макрофагов (табл. 4). Необходимо отметить, что, несмотря на наличие деструктивных изменений в миоцитах, выраженных морфологических признаков развития типичной воспалительной реакции (нейтрофилы, лимфоидно-гистиоцитарная инфильтрация миометрия) не было обнаружено.
Таблица 3
Результаты морфометрического исследования сосудов миометрия мышей линии C57Bl/6g при однократной беременности и в процессе послеродовой инволюции (M±m)
| Условия эксперимента, объект | Исследованные параметры | ||
| Сосуды миометрия (Vv) | Сосуды миометрия (Nai) | Коэффициент васкуляризации* | |
| Интактные мыши-самки | 9,58±1,24 | 1,47±0,16 | 0,15±0,02 |
| 10 | 9,88±1,01 | 1,42±0,17 | 0,15±0,01 |
| 20 | 14,67±1,45 a | 1,59±0,16 | 0,19±0,01 a |
| 1 | 12,40±1,44 b | 1,42±0,13 | 0,17±0,02 b |
| 3 | 10,89±1,07 b | 1,49±0,16 | 0,16±0,01 b |
| 5 | 10,60±1,03 b | 1,57±0,13 | 0,16±0,01 b |
| 10 | 9,98±0,95 b | 1,51±0,36 | 0,15±0,01 b |
Примечание: отличия статистически значимы - a – от величин параметров миометрия интактных самок, b – от параметров миометрия на 20-е сутки беременности.
10, 20 – продолжительность беременности (сутки).
1, 3, 5, 10 – продолжительность послеродового инволютивного периода (сутки).
* - коэффициент васкуляризации – Vv сосудов
Vv миоцитов.
В период ранней (1-е, 3-и сутки) послеродовой инволюции при исследовании гистологических срезов миометрия наблюдали гипертрофированные, неупорядоченно ориентированные друг относительно друга миоциты, которые отличались значительным полиморфизмом. На 5-е сутки после родов наблюдали значительное уменьшение размеров миоцитов и их более компактное расположение, а к концу послеродового периода (10-е сутки) гистологическое строение миометрия было сходным с таковым у небеременных мышей.
С помощью морфометрического исследования было обнаружено, что сразу после родов определялась тенденция к уменьшению объемной плотности миоцитов относительно
величины аналогичного показателя данной группы перед родами (20-е сутки), а на 10-е сутки наблюдали ее соответствие величине того же показателя у интактных животных. Аналогичную закономерность наблюдали при изучении концентрации ядер миоцитов в миометрии (см. табл. 2). Вместе с тем происходило уменьшение доли коллагеновых волокон в интерстиции мышечного слоя матки (см. табл. 2). К 10-м суткам послеродового периода доля коллагеновых волокон соответствовала величине аналогичного показателя у небеременных самок. Динамика величин объемной плотности данных параметров (за исключением коллагена) приведена на рис. 1.

Рис. 1. Объемные плотности (Vv) элиминируемых структур (цитоплазматические конгломераты в интерстиции, апоптотически измененные миоциты, некротически измененные миоциты) во время первой беременности (Б) и в послеродовый период (ПП).
10, 20 – продолжительность беременности (сутки).
1, 3, 5, 10 – продолжительность послеродового периода (сутки).
Условия васкуляризации миометрия в раннем послеродовом периоде несколько ухудшались, т.к., судя по коэффициенту васкуляризации, на единицу объема кровоснабжаемого миометрия приходилось большее количество мышечной ткани. Уменьшение объема сосудистого русла может быть обусловлено спазмом сосудов во время родов и мощной ретракцией миометрия после родов. Однако к 10-м суткам инволютивного периода коэффициент васкуляризации соответствовал таковому у небеременных животных (см. табл. 3).
Вероятнее всего общим механизмом, индуцирующим процессы инволюции структур, являются развившиеся условия недостаточной трофики. Об этом свидетельствуют результаты, проведенного нами, корреляционного анализа. Именно снижение объемной плотности сосудов в миометрии обусловливало увеличение доли апоптотически измененных миоцитов (табл. 4). Во все исследованные сроки периода послеродовой инволюции, основная доля структур, подлежащих элиминации, приходилась на продукты клазмацитоза (цитоплазматические конгломераты в интерстиции), и примерно равные доли – на апоптотически (с некоторым преобладанием) и некротически измененные миоциты (см. рис. 1).
Таблица 4
Результаты корреляционного анализа структур миометрия мышей линии C57Bl/6g при однократной беременности и в процессе послеродовой инволюции
| Условия экспе-римента, объект | Сосуды миометрия и некроти-чески изменен-ные миоциты (Vv) | Сосуды миометрия и апоптоти-чески изменен-ные миоциты (Vv) | Макрофаги и апоптотически измененные миоциты (Nai) | Макрофаги (Nai) и цитоплазма-тические конгломераты в интерстиции (Vv) | Макрофаги (Nai) и некротически измененные миоциты (Vv) |
| Интакт-ные мыши-самки | -0,33 | -0,38 | +0,55 | +0,59 | +0,54 |
| 10 | -0,25 | -0,45 | +0,65 | +0,60 | +0,57 |
| 20 | -0,42 | +0,05 | +0,49 | +0,76 | +0,64 |
| 1 | -0,14 | -0,60 | +0,50 | +0,67 | +0,58 |
| 3 | -0,22 | -0,59 | +0,19 | +0,83 | +0,57 |
| 5 | -0,31 | -0,48 | +0,37 | +0,62 | +0,76 |
| 10 | -0,06 | -0,79 | +0,31 | +0,00 | +0,57 |
В отношении апоптотически измененных миоцитов необходимо отметить, что результаты определения их концентрации (объемной и численной плотностей) в миометрии при использовании визуальных цитологических критериев достоверно не отличались от данных, полученных при применении метода иммуноцитологической визуализации экспрессии caspasae 3 (рис. 2).

Рис. 2. Объемная плотность (Vv) апоптотически измененных миоцитов в миометрии мышей линии C57Bl/6g при однократной беременности (Б) и в послеродовом периоде (ПП).
10, 20 – продолжительность беременности (сутки).
1, 3, 5, 10 – продолжительность послеродового периода (сутки).
В дальнейшем концентрация клеток, подлежащих элиминации, снижалась, очевидно, в связи с их некробиозом и элиминацией макрофагами, и на 10 сутки исследованного периода была близка к величине аналогичного показателя у интактных животных (см. табл. 1).
Во все периоды после родов концентрация макрофагов в миометрии изменялась пропорционально содержанию всех структур, подлежащих элиминации. При анализе общей численной плотности макрофагов и долей каждой из структур, подлежащих элиминации, была установлена определенная взаимосвязь (см. табл. 1). На 10-е сутки после родов продукты клазмацитоза с помощью метода светооптической визуализации уже не определялись, а доли остальных структур, подлежащих элиминации, не имели статистически значимых отличий от величин аналогичных показателей в миометрии интактных животных.
Таким образом, полученные данные свидетельствуют об успешном завершении процесса инволюции миометрия в матке мышей линии C57BL/6g после однократных физиологических родов.
3. Результаты морфологического исследования миометрия мышей-самок линии C57Bl/6g в процессе многократной физиологической беременности и послеродовой инволюции
В процессе третьей беременности наблюдали увеличение доли миоцитов миометрия. Гестационные изменения (гипертрофия, гиперплазия) миоцитов были несколько менее выражены, чем в миометрии мышей 1-ой группы (табл. 5). При этом динамика относительных величин объемных плотностей стромально-паренхиматозного компонентов в условиях однократной и многократной беременностей имела общую тенденцию. Однако соотношения паренхимы и коллагена в интерстиции значительно отличались: 3:1 – в конце третьей беременности и 5:1 – в конце первой.
Таблица 5
Результаты морфометрического исследования паренхимы, коллагена и структур миоцитов миометрия мышей линии C57Bl/6g при многократной беременности и в процессе послеродовой инволюции (M±m)
| Условия экспери-мента, объект | Общий объем миоцитов миометрия ( Vv) | Объем миоцита (v) | Цитоплазма миоцитов (Nai) | Объем ядра (v) | Ядра миоцитов (Nai) | Коллагеновые волокна стромы миометрия (Vv) |
| Интактные мыши-самки | 62,74±1,25 | 1,87±0,02 | 33,46±1,08 | 0,73±0,01 | 28,05±1,05 | 27,30±1,19 |
| 10 | 64,81±0,80 | 0,85±0,01 a | 75,99±1,05 а | 0,43±0,01 a | 46,06±1,27 а | 32,83±1,01 a |
| 20 | 70,05±1,35 a | 1,26±0,02 a | 55,30±1,07 a | 0,36±0,02 | 69,53±1,53 а | 28,56±1,15 |
| 1 | 72,45±0,78 a | 0,85±0,02 ab | 85,17±0,99 аb | 0,45±0,01 а | 66,49±1,07 аb | 24,06±0,86 ab |
| 3 | 80,36±1,15 ab | 0,78±0,02 ab | 102,26±1,83 аb | 0,37±0,01 а | 94,51±1,08 аb | 16,32±1,22 ab |
| 5 | 86,36±1,23 ab | 0,67±0,02 ab | 131,48±1,57 аb | 0,37±0,02 а | 119,03±1,55аb | 10,32±1,16 ab |
| 10 | 88,21±0,93 ab | 0,63±0,02 ab | 139,15±1,40 аb | 0,37±0,01 а | 127,18±1,40 аb | 4,56±1,28 ab |
Примечание: отличия статистически значимы - a – от величин параметров миометрия интактных самок, b – от параметров миометрия на 20-е сутки беременности.
10, 20 – продолжительность беременности (сутки).
1, 3, 5, 10 – продолжительность послеродового инволютивного периода (сутки).
В середине 3-й беременности (10-е сутки) условия кровоснабжения миометрия были значительно хуже, чем в тот же период при однократной беременности (табл. 6). Перед родами (20-е сутки) ситуация несколько улучшалась - определилась тенденция к увеличению коэффициента васкуляризации (см. табл. 6), однако кровоснабжение миометрия все равно оставалось недостаточным. Следовательно, миометрий находился в состоянии ишемии и гипоксии, что, вероятно, являлось пусковым фактором развития некробиотических, апоптотических и, возможно, клазматозных изменений миоцитов.
Таблица 6
Результаты морфометрического исследования сосудов миометрия мышей линии C57Bl/6g при многократной беременности и в процессе послеродовой инволюции (M±m)
| Условия эксперимента, объект | Исследованные параметры | ||
| Сосуды миометрия (Vv) | Сосуды миометрия (Nai) | Коэффициент васкуляризации* | |
| Интактные мыши-самки | 9,58±1,24 | 1,47±0,16 | 0,15±0,02 |
| 10 | 2,06±0,34 a | 0,77±0,12 a | 0,03±0,01 a |
| 20 | 3,27±0,59 a | 0,84±0,15a | 0,05±0,01 a |
| 1 | 3,92±0,63 a | 1,15±0,13 b | 0,05±0,01 a |
| 3 | 4,96±0,82 a | 1,21±0,16 b | 0,06±0,01a |
| 5 | 5,16±0,78 ab | 1,25±0,15 b | 0,05±0,01 a |
| 10 | 8,16±0,86 b | 1,59±0,20 | 0,09±0,01 ab |
Примечание: отличия статистически значимы - a – от величин параметров миометрия интактных самок, b – от параметров миометрия на 20-е сутки беременности.
10, 20 – продолжительность беременности (сутки).
1, 3, 5, 10 – продолжительность послеродового инволютивного периода (сутки).
* - коэффициент васкуляризации – Vv сосудов
Vv миоцитов.
По мере развития третьей беременности суммарный объем (Vv) структур, элиминированных всеми исследованными механизмами, за сутки перед родами увеличивалась в 4,6 раза по сравнению с величиной того же параметра у интактных самок, и в 1,3 раза – по сравнению с величиной аналогичного показателя у впервые беременных самок (табл. 7).
Гистологическими особенностями строения миометрия после третьих физиологических родов в раннем периоде инволюции (1-е и 3-е сутки) были: клеточный полиморфизм (максимально выраженный на 3-и сутки), большое количество вакуолизированых миоцитов, гипертрофированные миоциты, узкие прослойки соединительной ткани и немногочисленными сосуды. Морфологически миометрий на 5-е, 10-е сутки после родов отличался от такового на 1-е, 3-и сутки инволютивного периода большей однородностью клеточного состава, отсутствием пузыревидных образований в интерстиции, более компактным расположением миоцитов.
Результаты морфометрического анализа миометрия мышей после многократных родов свидетельствуют об интенсивных процессах пролиферации, происходящих в паренхиме миометрия. Так, объемная плотность миоцитов миометрия и численная плотность ядер миоцитов в течение всего исследованного послеродового периода увеличивались, вместе с тем, объем самих клеток значительно уменьшался (см. табл. 5). Нарастание суммарной объемной доли миоцитов может быть связано с многократным увеличением миоцитов в состоянии вакуольной и баллонной дистрофий, что сопряжено с увеличением объема клеток (см. табл. 7).
Таблица 7
Результаты морфометрического исследования структурных проявлений механизмов послеродовой инволюции миометрия мышей линии C57Bl/6g после многократной беременности (M±m)
| Условия экспери-мента, объект | Миоциты в состоянии вакуольной дистрофии (Vv) | Миоциты в состоянии баллонной дистрофии (Vv) | Цитоплазматические конгломераты в интер-стиции (Vv) | Апопто-тически измененные миоциты (Vv) | Некротически изменен-ные миоциты (Vv) | Общий объем миоцитов, подлежщих элиминации (Vv) | Макрофаги (Nai) |
| Интактные мыши-самки | 1,36±0,29 | 1,28±0,35 | 0,80±0,27 | 1,68±0,34 | 0,48±0,14 | 2,90±0,2 | 0,73±0,11 |
| 10 | 4,04±0,61 a | 3,13±0,52 a | 2,24±0,96 a | 2,00±0,36 | 0,80±0,18 | 5,04±0,50 a | 2,01±0,24 а |
| 20 | 10,27±0,86 a | 4,71±0,62 a | 8,08±1,32 a | 2,72±0,46 | 2,72±0,39 | 13,52±0,72 a | 3,04±0,28 a |
| 1 | 16,8±0,91 ab | 6,00±0,80 ab | 15,84±1,31 ab | 4,64±0,44 ab | 5,24±0,59 ab | 25,72±0,78 ab | 4,63±0,13 a |
| 3 | 28,32±1,21 ab | 9,92±0,84 ab | 11,6±1,06 ab | 7,04±0,57 ab | 4,80±0,7 ab | 23,44±1,33 ab | 4,71±0,39 a |
| 5 | 25,76±1,10 ab | 4,00±0,49 a | 2,08±0,43 ab | 3,04±0,42 a | 3,80±0,53 a | 8,92±0,46 ab | 4,21±0,26 a |
| 10 | 20,96±1,19 ab | 6,53±0,47 ab | 0,00 ab | 2,56±0,43 | 2,72±0,37 а | 5,28±0,40 аb | 2,85±0,28 а |
Примечание: отличия статистически значимы - a – от величин параметров миометрия интактных самок, b – от параметров миометрия на 20-е сутки беременности.
10, 20 – продолжительность беременности (сутки).
1, 3, 5, 10 – продолжительность послеродового инволютивного периода (сутки).
Наряду с увеличением доли миоцитов регистрировали и значительное (в 6 раз) уменьшение доли коллагена в интерстиции миометрия. Таким образом, паренхиматозно-стромальное отношение на 10-е сутки после родов определялось как 19:1, тогда как в миометрии интактных животных и после однократной беременности – 2:1.
Формирующаяся после родов тенденция улучшения васкуляризации миометрия сохранялась и в более отдаленные сроки инволютивного периода. К 10-м суткам регистрировали увеличение коэффициента васкуляризации в 2 раза в сравнении с величиной аналогичного показателя на 20-е сутки беременности (см. табл. 6). Однако, несмотря на увеличение объемной и численной плотностей сосудов, кровоснабжение миометрия оставалось все еще недостаточным. Величины коэффициентов васкуляризации были существенно снижены по сравнению с таковыми у интактных мышей и самок после первых родов в аналогичные периоды (см. табл. 3, 6).
Возможно, с вышеописанными особенностями кровоснабжения миометрия после родов связано резкое увеличение доли подлежащих элиминации структур (см. табл. 7). Как в ситуации до родов, так и после них, в условиях однократной и многократной беременностей преобладал физиологически наиболее «выгодный» (ввиду отсутствия гибели клетки) механизм инволюции миометрия – клазмацитоз, продукты которого были полностью элиминированы на 10-е сутки после родов. Доля некротически измененных миоцитов на 1-е сутки после родов у многократно беременных мышей возросла почти в 2 раза, и во столько же относительно величины аналогичного показателя того же периода наблюдения после первых родов (см. табл. 1, 7).
Несколько менее выражены были масштабы апоптотических изменений в миоцитах. Величины объемной и численной плотностей апоптотически измененных миоцитов, определенные иммунногистохимическим методом («каспазная» метка) и с использованием метода цитологической визуализации апоптотически измененных миоцитов достоверно мало отличались по величинам, и не отличались по динамике (рис. 3).

Рис. 3. Объемная (Vv) плотность апоптотически измененных миоцитов в миометрии мышей линии C57Bl/6g при многократной беременности (Б) и в послеродовом периоде (ПП).
10, 20 – продолжительность беременности (сутки).
1, 3, 5, 10 – продолжительность периода послеродовой инволюции (сутки).
На 3-и сутки после родов доля апоптотически измененных миоцитов увеличилась в 1,5 раза, а некротически измененных – уменьшилась в 1,1 раз (см. табл. 7). Видимо, мощными хемоаттрактантными свойствами для макрофагов обладали некротически измененные миоциты (табл. 8), что продиктовано «необходимостью» скорейшей элиминации потенциальных индукторов воспаления.
Таблица 8
Результаты корреляционного анализа структур миометрия мышей линии C57Bl/6g при многократной беременности и в процессе послеродовой инволюции
| Условия эксперимента, объект | Сосуды миометрия и некротически измененные миоциты (Vv) | Сосуды миометрия и апоптотически измененные миоциты (Vv) | Макрофаги и апоптотически измененные миоциты (Nai) | Макрофаги (Nai) и цитоплазмати-ческие конгломе-раты в интерстиции (Vv) | Макрофаги (Nai) и некротически измененные миоциты (Vv) |
| Интактные мыши-самки | -0,33 | -0,38 | +0,55 | +0,59 | +0,54 |
| 10 | -0,53 | -0,68 | +0,31 | +0,68 | +0,56 |
| 20 | - 0,74 | -0,65 | +0,69 | +0,79 | +0,61 |
| 1 | -0,52 | -0,39 | -0,13 | +0,71 | +0,53 |
| 3 | -0,48 | -0,31 | +0,36 | +0,76 | +0,57 |
| 5 | -0,53 | -0,45 | -0,08 | +0,65 | +0,47 |
| 10 | -0,59 | -0,71 | +0,46 | 0,00 | +0,70 |
В целом, в конце периода послеродовой инволюции суммарная объемная плотность подлежащих элиминации структур была в 2 раза большей, чем у однократно беременных мышей и у животных интактной группы (см. табл. 1,7). Однако, рассмотренные механизмы, видимо, были недостаточными для полноценной инволюции миометрия к 10-м суткам после родов, т.к. миоциты, погибшие механизмами некроза и апоптоза не были элиминированы из миометрия на 10-е сутки послеродового периода.
Динамика элиминации структур рассмотренными механизмами послеродовой инволюции миометрия отражена на рис. 4.
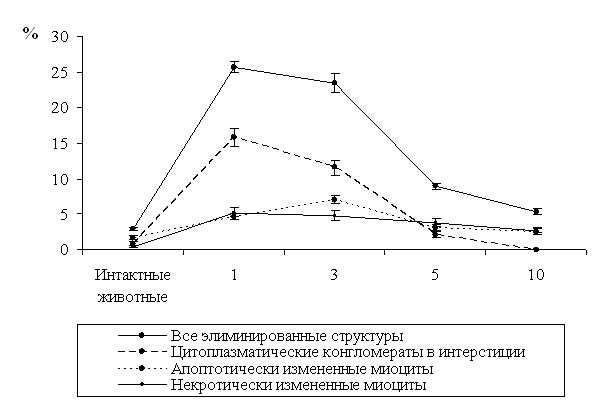
Рис. 4. Объемная плотность (Vv) элиминированных различными механизмами структур (цитоплазматические конгломераты в интерстиции, апоптотически измененные миоциты, некротически измененные миоциты) и общего объема элиминированных гладкомышечных клеток в миометрии мышей линии С57Bl/6g при многократных родах.
1, 3, 5, 10 – продолжительность послеродового периода (сутки).
После третьих родов концентрация макрофагов в миометрии изменялась пропорционально изменению содержания всех подлежащих элиминации структур (см. табл. 7). Но к 10-м суткам инволютивного периода общий объем подлежащих элиминации структур был в 2 раза большим, чем у интактных самок, тогда как количество макрофагов – в 4 раза (см. табл. 7). Причины данного феномена не ясны. Возможно, это связано с сохранением достаточно высокой доли апоптотически измененных миоцитов в составе подлежащих элиминации структур, перевариваемых более медленно, чем иные структуры, что стимулировало процессы компенсации функциональной недостаточности макрофагов увеличением их численности.
Таким образом, полученные данные свидетельствуют о сохранении пролиферативной активности миоцитов и незавершенности процессов инволюции миометрия на 10-е сутки после родов у многорожавших мышей по сравнению с мышами, рожавшими один раз.
4. Результаты морфологического исследования миометрия матки самок-мышей
линии C57Bl/6g в процессе послеродовой инволюции после многократных родов
и предшествующей (второй) прерванной беременности
В процессе следующей - после прерывания предшествующей (второй) - беременности наблюдали увеличение суммарной объемной доли миоцитов, которое связано с гиперплазией миоцитов (увеличение численной плотности ядер клеток и уменьшение их объема) (табл. 9). Аналогичные закономерности проявлений рассмотренных механизмов наблюдали в эксперименте во время однократной и многократной беременностей (см. табл. 2, 5).
Таблица 9
Результаты морфометрического исследования паренхимы, коллагена и структур миоцитов миометрия мышей линии C57Bl/6g во время третьей беременности, следующей после искусственного прерывания предыдущей (второй) беременности, и в процессе послеродовой инволюции (M±m)
| Условия экспери-мента, объект | Общий объем миоцитов миометрия ( Vv) | Объем миоцита (v) | Цитоплазма миоцитов (Nai) | Объем ядра (v) | Ядра миоцитов (Nai) | Коллагеновые волокна стромы миометрия (Vv) |
| Интактные мыши-самки | 62,74±1,25 | 1,87±0,02 | 33,46±1,08 | 0,73±0,01 | 28,05±1,05 | 27,30±1,19 |
| 10 | 65,96±1,29 | 0,79±0,02 а | 83,43±1,49 а | 0,35±0,01 а | 81,58±1,52 а | 16,64±0,83 а |
| 20 | 69,43±0,80 а | 1,05±0,01 а | 65,84±0,92 а | 0,29±0,01 а | 88,13±0,80 а | 20,46±1,01 а |
| 1 | 71,06±1,24 а | 1,51±0,01 аb | 46,76±1,41 аb | 0,53±0,02 аb | 40,72±1,49 аb | 17,52±0,96 аb |
| 3 | 80,04±1,10 аb | 0,86±0,01 b | 92,37±1,58 аb | 0,37±0,01 аb | 90,77±1,58 аb | 16,16±0,70 b |
| 5 | 79,64±0,82 аb | 0,63±0,01 аb | 126,53±1,44 аb | 0,33±0,02 аb | 123,19±1,54 аb | 13,16±0,56 аb |
| 10 | 81,80±0,97 аb | 0,62±0,01 аb | 131,42±0,57 аb | 0,34±0,01 аb | 130,64±1,65 аb | 11,56±0,58 аb |
Примечание: отличия статистически значимы - a – от величин параметров миометрия интактных самок, b – от параметров миометрия на 20-е сутки беременности.
10, 20 – продолжительность беременности (сутки).
1, 3, 5, 10 – продолжительность послеродового инволютивного периода (сутки).
Доля коллагеновых волокон в интерстиции миометрия к концу беременности изменялась обратно пропорционально относительно общей объемной плотности миоцитов (см. табл. 9). При этом величина данного показателя (объемная плотность коллагеновых волокон стромы) у многократно беременных мышей была большей почти на 40%, а у однократно беременных – на 33% меньшей, чем в миометрии многократно беременных мышей с прерванной беременностью в «анамнезе» (см. табл. 2, 5, 9).
В течение всего периода беременности, наступившей после прерывания предыдущей, васкуляризация миометрия была существенно хуже, чем во время первой беременности. Необходимо отметить, что объемная доля сосудов при многократной беременности без эпизода ее прерывания, была в 2 раза меньшей, чем с наличием последнего в «анамнезе», а численная плотность сосудов в процессе беременности не изменялась. В целом, судя по коэффициенту васкуляризации, перед родами у мышей 2-й и 3-й групп кровоснабжение миометрия было существенно хуже, чем у интактных и первородящих мышей (см. табл. 3, 6, 10).
Таблица 10
Результаты морфометрического исследования сосудов миометрия мышей линии C57Bl/6g во время третьей беременности, следующей после искусственного прерывания предыдущей (второй) беременности, и в процессе послеродовой инволюции (M±m)
| Условия эксперимента, объект | Исследованные параметры | ||
| Сосуды миометрия (Vv) | Сосуды миометрия (Nai) | Коэффициент васкуляризации* | |
| Интактные мыши-самки | 9,58±1,24 | 1,47±0,16 | 0,15±0,02 |
| 10 | 6,20±0,82 а | 1,25±0,13 | 0,09±0,01 а |
| 20 | 7,04±0,61 а | 1,11±0,42 | 0,10±0,02 а |
| 1 | 4,84±0,61 аb | 0,93±0,13 а | 0,06±0,02 аb |
| 3 | 4,72±0,54 а | 1,19±0,12 | 0,05±0,01 аb |
| 5 | 4,13±0,43 а | 1,08±0,11 | 0,05±0,02 аb |
| 10 | 3,48±0,52 а | 0,90±0,13 а | 0,04±0,02 аb |
Примечание: отличия статистически значимы - a – от величин параметров миометрия интактных самок, b – от параметров миометрия на 20-е сутки беременности.
10, 20 – продолжительность беременности (сутки).
1, 3, 5, 10 – продолжительность послеродового инволютивного периода (сутки).
* - коэффициент васкуляризации – Vv сосудов
Vv миоцитов.
Рассмотренные выше условия кровоснабжения миометрия после многократных родов с эпизодом прерывания предыдущей (второй) беременности позволили предположить, что миоциты находились в состоянии циркуляторной, а затем, в родах, и тканевой гипоксии. Можно полагать, что при ишемии и гипоксии в миоцитах миометрия развиваются метаболические нарушения, результатом которых является повышенная продукция активированных метаболитов кислорода. Последние, особенно перекись водорода, способны оказывать повреждающее воздействие (Зенков Н. К. и др., 2001, Курашвили Л. В. и др., 2003; Smrcka M. et al., 2003) на миоциты, индуцируя развитие вакуольной дистрофии и некроза. О взаимосвязи изменений объемной плотности сосудов и деструктивных изменений в клетках паренхимы миометрия свидетельствует наличие между величинами данных показателей сильной обратной корреляционной зависимости (табл. 11).
Таблица 11
Результаты корреляционного анализа структур миометрия мышей линии C57Bl/6g при многократной беременности и прерывания предыдущей (второй) беременности и в процессе послеродовой инволюции
| Условия эксперимента, объект | Сосуды миометрия и некротически измененные миоциты (Vv) | Сосуды миометрия и апоптотичес-ки изменен-ные миоциты (Vv) | Макрофаги и апоптотически измененные миоциты (Nai) | Макрофаги (Nai) и цитоплазмати-ческие конгломераты в интерстиции (Vv) | Макрофаги (Nai) и некротически измененные миоциты (Vv) |
| Интактные мыши-самки | -0,33 | -0,38 | +0,55 | +0,59 | +0,54 |
| 10 | -0,52 | -0,64 | +0,61 | +0,49 | +0,32 |
| 20 | -0,53 | -0,49 | +0,12 | +0,52 | +0,24 |
| 1 | -0,19 | -0,49 | +0,57 | +0,48 | +0,29 |
| 3 | -0,42 | -0,52 | +0,15 | +0,58 | +0,25 |
| 5 | -0,43 | -0,37 | +0,36 | +0,50 | +0,42 |
| 10 | -0,66 | -0,74 | +0,77 | +0,60 | +0,16 |
После физиологического родоразрешения в паренхиме миометрия многократно беременных животных с эпизодом искусственного прерывания беременности в «анамнезе», наблюдали увеличение общей объемной плотности миоцитов вплоть до 10-х суток включительно (см. табл. 9). Аналогичную закономерность изменений выявляли у многократно беременных животных. Однако в 3-й группе увеличение составило 40,71 %, а в 4-й - 30,53% относительно величины этого параметра у интактных мышей (см. табл. 5, 9), что, видимо, было обусловлено и сохраняющейся гипертрофией, и усиливающейся гиперплазией миоцитов миометрия. Так, наряду с постепенным увеличением (с 1-х по 10-е сутки после родов) общей объемной плотности миоцитов, наблюдали увеличение и численной плотности миоцитов, сопровождавшееся уменьшением объема клеток (см. табл. 9). Причиной данных изменений, возможно, является недостаточность механизмов послеродовой инволюции.
Элиминация коллагена в период послеродовой инволюции была, очевидно, избыточной. Однако наиболее существенно (более чем в 6 раз) концентрация коллагена в миометрии уменьшалась у мышей 3-й группы после третьих физиологических родов, и к завершению периода послеродовой инволюции была почти в 3 раза меньшей, чем у мышей 4-й группы после третьих физиологических родов, которым предшествовало прерывание второй беременности (см. табл. 2, 5, 9)
Вопрос о механизмах избыточности резорбции коллагена после родов остается открытым, но представляет большой интерес в связи с проблемой фибротических осложнений при целом ряде острых и хронических патологических состояниях и рассмотрения возможностей их профилактики и лечения.
Соотношение паренхимы и коллагеновых волокон стромы миометрия на 10-е сутки после родов у многократно беременных мышей с эпизодом прерывания предыдущей беременности составляло 7:1. Сравнительный анализ величин рассмотренных параметров между экспериментальными группами приведен на рис. 5.
Рис. 5. Объемные плотности (Vv) миоцитов и коллагеновых волокон стромы миометрия мышей линии C57Bl/6g на 10-е сутки после однократных, многократных родов и многократных родов с прерыванием второй беременности в «анамнезе».
Васкуляризация миометрия после родов у мышей 4-й группы была существенно хуже, чем у интактных мышей, и не нормализовалась к 10-м суткам (см. табл. 6, 10). При этом величина коэффициента васкуляризации была примерно в 2 раза меньшей, чем у многократно беременных мышей. Сравнительная динамика коэффициентов васкуляризации перед родами и на завершающем этапе периода послеродовой инволюции в экспериментальных группах представлена на рис. 6.
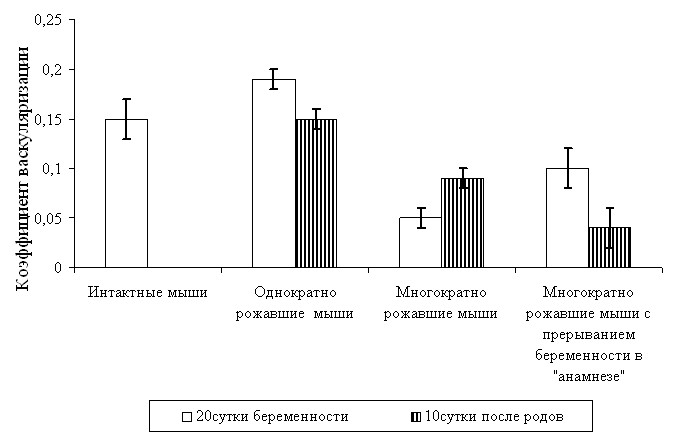
Рис. 6. Коэффициент васкуляризации миометрия мышей линии C57Bl/6g перед родами (20-е сутки беременности) и в периоде поздней послеродовой инволюции (10-е сутки после родов) после однократных, многократных родов и многократных родах с прерыванием второй беременности в «анамнезе».
Недостаточная васкуляризация миометрия, вероятно, является пусковым фактором в развитии механизмов элиминации целой клетки (апоптоз, некроз) или ее частей (клазмацитоз), что подтверждается результатами корреляционного анализа (см. табл. 4, 8, 11).
При морфометрическом исследовании продуктов клазмацитоза цитоплазмы миоцитов у многократно беременных мышей с эпизодом прерывания предыдущей беременности наблюдали, что данный процесс несколько активизировался сразу после родов и сохранялся на одном уровне в течение первых трех суток, а на 10-е сутки цитоплазматические конгломераты в интерстиции были единичными. Необходимо отметить, что наиболее активным данный процесс был у многократно рожавших мышей. При этом в миометрии мышей после однократных и многократных родов на 10-е сутки наблюдали полную элиминацию продуктов клазмацитоза (рис. 7).

Рис. 7. Объемные плотности (Vv) цитоплазматических конгломератов в интерстиции миометрия мышей линии C57Bl/6g перед родами (20-е сутки беременности) и в периоде поздней послеродовой инволюции (10-е сутки после родов) после однократных, многократных родов и многократных родов с прерыванием второй беременности в «анамнезе».
Объемная доля апоптотически измененных миоцитов у мышей 4-й группы на всех исследованных сроках послеродового периода была примерно на одном уровне и статистически значимо не отличалась от величины аналогичного показателя на 20-е сутки беременности. Однако относительно величин данного показателя в миометрии мышей после однократных и многократных родов активность данного процесса была значительно снижена и к 10-м суткам полностью не завершалась.
Изменения доли апоптотически измененных миоцитов перед родами и в конце периода послеродовой инволюции в различных экспериментальных ситуациях показаны на рис. 8.
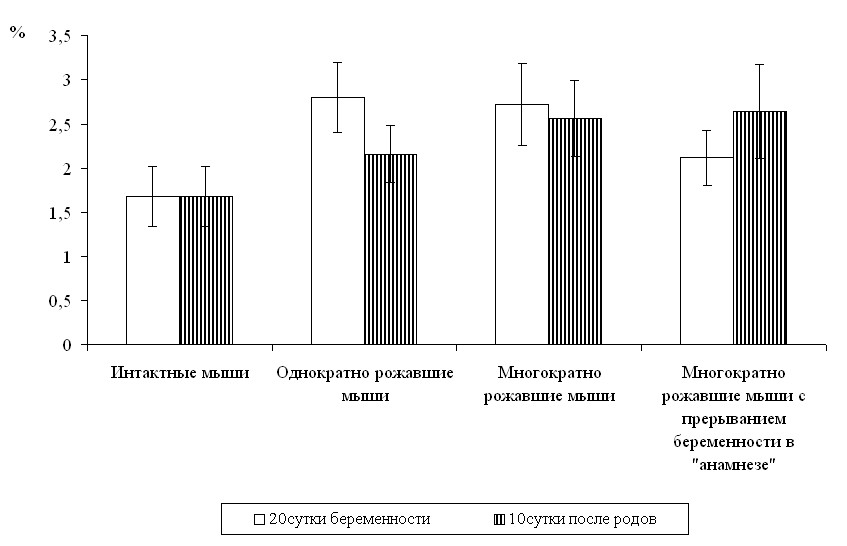
Рис. 8. Объемные плотности (Vv) апоптотически измененных миоцитов в миометрии мышей линии C57 Bl/6g перед родами (20-е сутки беременности) и в периоде поздней послеродовой инволюции (10-е сутки после родов) после однократных, многократных родов и многократных родов с прерыванием второй беременности в «анамнезе».
В миометрии мышей 4-й группы объемная плотность некротических изменений была максимально выражена на 3-и сутки после родов, которая в дальнейшем постепенно уменьшалась, и к 10-м суткам достигала величины аналогичного показателя у интактных и однократно беременных мышей. Динамика изменений величин показателей некротически измененных миоцитов перед родами и в конце периода послеродовой инволюции отражена на рис. 9.

Рис. 9. Объемные плотности (Vv) некротически измененных миоцитов в миометрии мышей линии C57Bl/6g перед родами (20-е сутки беременности) и в периоде поздней послеродовой инволюции (10-е сутки после родов) после однократных, многократных родов и многократных родов с прерыванием второй беременности в «анамнезе».
В целом, суммарный объем структур, подлежащих элиминации, механизмами упомянутыми выше, свидетельствует о несостоятельности последних у мышей данной группы, т.к. на 10-е сутки после родов процессы инволюции в миометрии не были завершены (рис. 10).
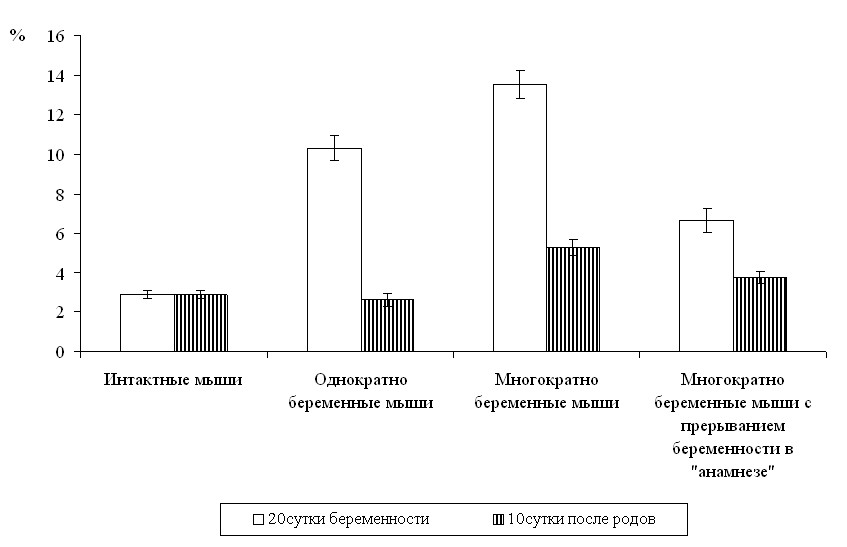
Рис. 10. Суммарные объемные плотности (Vv) структур, подлежащих элиминации в миометрии мышей линии C57Bl/6g перед родами (20-е сутки беременности) и в периоде поздней послеродовой инволюции (10-е сутки после родов) после однократных, многократных родов и многократных родов с прерыванием второй беременности в «анамнезе».
Изменения величин численных плотностей макрофагов и объемных плотностей цитоплазматических конгломератов в интерстиции миометрия у мышей 4-й группы характеризовались сильной прямой корреляционной связью (см. табл. 11). Однако более высокие величины коэффициентов корреляции были получены в миометрии у однократно и многократно беременных мышей (см. табл. 4, 8, 11).
Эпизод искусственного прерывания 2-й беременности в «анамнезе» у мышей 4-й группы сопряжен с уменьшением количества плодов в помете на 44 % после третьей беременности по сравнению с самками 3-й группы и на 56 % по сравнению с количеством плодов у мышей той же линии после однократной физиологической беременности (рис. 11).

Рис. 11. Количество плодов в помете мышей линии C57Bl/6g после однократных, многократных родов и многократных родов с эпизодом прерывания предыдущей (второй) беременности.
Таким образом, после третьих родов, которым предшествовало прерывание беременности, наблюдали задержку инволюции паренхимы миометрия в связи с продолжающимся процессом его гипертрофии, что указывает на недостаточность механизмов ее обеспечивающих и, вероятно, на нарушения регуляции пролиферации миоцитов.
ВЫВОДЫ
1. В процессе физиологической беременности в миометрии наблюдали морфологические проявления клазмацитоза, апоптоза, некроза гладкомышечных клеток вне зависимости от количества беременностей и эпизодов прерывания одной из них.
2. В процессе послеродовой инволюции в миометрии мышей наблюдали процессы клазмацитоза, апоптоза, некроза максимально выраженные в ранний послеродовый период, что позволило рассматривать их в качестве основных механизмов послеродовой инволюции миометрия.
3. После однократной физиологической беременности процессы инволюции миометрия у мышей линии C57Bl/6g завершались на 10-е сутки после первых родов
4. Инволютивные послеродовые преобразования миометрия после третьих физиологических беременностей родов у мышей линии C57Bl/6g к 10-м суткам не завершались в связи с недостаточностью механизмов инволюции:
а. У многократно рожавших мышей – апоптоза и некроза.
б. У многократно рожавших мышей с эпизодом прерывания предыдущей (второй) беременности – клазмацитоза, апоптоза, некроза.
5. Васкуляризация миометрия у многократно беременевших и рожавших мышей была недостаточной в конце беременности и ухудшалась после родов вплоть до 10 суток.
6. Выявленные обратные сильные корреляционные связи структурных проявлений механизмов, обеспечивающих послеродовую инволюцию миометрия, и коэффициента его васкуляризации дают основание полагать, что ухудшающиеся условия трофики, гипоксия миометрия являются факторами, инициирующими механизмы инволюции: клазмацитоз, апоптоз, некроз.
7. Процессы пролиферации гладкомышечных клеток в миометрии мышей после третьих физиологических беременностей и родов, которым предшествовало прерывание беременности, были интенсивнее процессов элиминации миоцитов и продолжались в послеродовом периоде, а элиминация коллагена, напротив, была резко усилена.
8. Увеличение количества физиологических беременностей и родов, медикаментозное прерывание беременности в сочетании с многократными физиологическими беременностями и родами сопряжено с прогрессирующим уменьшением количества плодов в помете.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Обединская К.С. Морфологическая структура миометрия мышей в послеродовом периоде при многократной беременности / К.С. Обединская, А.П. Надеев, В.А. Шкурупий // Современные проблемы общей и частной патологической анатомии: Мат. всеросс. научной конф., посвященной 150-летию кафедры патологической анатомии Военно-медицинской академии им. С.М. Кирова 24 апреля 2009 года. - СПб.: Б.и., 2009. - С. 89-91.
2. Структурная организация миометрия при патологии беременности / К.С. Обединская, В.А. Жукова, А.П. Надеев, В.А. Шкурупий // Актуальные вопросы патологической анатомии Мат. съезда Росс. общества патологоанатомов 26-30 мая 2009 года. - Самара, 2009. – Т. 2. - С. 376-378.
3. Обединская К.С. Структурные изменения миометрия мышей в послеродовом периоде при преждевременно прерванной беременности / К.С. Обединская, А.П. Надеев, В.А. Шкурупий // Фундаментальные аспекты компенсаторно-приспособительных процессов: Четвертая Всероссийская научно-практическая конференция с международным участием 27-29 октября 2009 года. – Новосибирск, 2009. – С.168-169.
4. Структурная организация плацентарной площадки матки при патологии беременности / К.С. Обединская, В.А. Жукова, А.П. Надеев, В.А. Шкурупий // 100-летие Российского общества патологоанатомов – научные чтения памяти О.К.Хмельницкого. - СПб, 2009. – С. 239-240.
5. Шкурупий В.А. Исследование структурных изменений в миометрии при многократных беременностях и в процессе инволюции матки у мышей / В.А. Шкурупий, К.С. Обединская, А.П. Надеев // Бюлл. эксперим. биол. мед. – 2010. – Т. 149, №5. – С. 487-491. – в списке журналов, рекомендованных ВАК.
6. Шкурупий В.А. Морфологическое исследование основных механизмов инволюции миометрия после многократных беременностей у мышей / В.А. Шкурупий, К.С. Обединская, А.П. Надеев // Бюлл. эксперим. биол. мед. – 2010. – Т. 150, №9. – С. 347-351. – в списке журналов, рекомендованных ВАК.
Соискатель Обединская К.С.


