Морфологические изменения нейронов и макроглиоцитов основных отделов мезокортиколимбической дофаминергической системы при воздействии этанола
На правах рукописи
ДРОБЛЕНКОВ АНДРЕЙ ВСЕВОЛОДОВИЧ
МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ НЕЙРОНОВ
И МАКРОГЛИОЦИТОВ ОСНОВНЫХ ОТДЕЛОВ МЕЗОКОРТИКОЛИМБИЧЕСКОЙ ДОФАМИНЕРГИЧЕСКОЙ СИСТЕМЫ ПРИ ВОЗДЕЙСТВИИ ЭТАНОЛА
14.03.01 – анатомия человека
03.03.04 – клеточная биология, цитология, гистология
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
доктора медицинских наук
Санкт-Петербург
2010
Работа выполнена на кафедре анатомии человека Государственного образовательного учреждения высшего профессионального «Санкт-Петербургская государственная педиатрическая медицинская академия Федерального агентства по здравоохранению и социальному развитию».
Научные консультанты: доктор медицинских наук,
профессор Н.Р. Карелина
доктор медицинских наук,
профессор П.Д. Шабанов
Официальные оппоненты:
доктор медицинских наук,
профессор И.В. Гайворонский
доктор медицинских наук,
профессор Ф.Н. Макаров
доктор медицинских наук,
профессор С.В. Костюкевич
Ведущая организация:
Государственное образовательное учреждение высшего профессионального образования «Санкт-Петербургский государственный медицинский университет им. акад. И.П.Павлова Федерального агентства по здравоохранению и социальному развитию»
Защита состоится «____» «______________» 2010 года
в ___ часов на заседании совета по защите докторских и кандидатских диссертаций Д 208.087.01 при Государственном образовательном учреждении высшего профессионального образования «Санкт-Петербургская государственная педиатрическая медицинская академия Федерального агентства по здравоохранению и социальному развитию». (194100, Санкт-Петербург, ул. Литовская, 2).
С диссертацией можно ознакомиться в научной библиотеке ГОУ ВПО СПбГПМА по адресу: 194100, Санкт-Петербург, Кантемировская ул., д. 16.
Автореферат разослан «____» «______________» 2010 года
Ученый секретарь диссертационного совета
Доктор медицинских наук Н.Р.Карелина
ВВЕДЕНИЕ
Актуальность темы. Проблема алкогольной зависимости является одной из важнейших в современной наркологии и психиатрии. Широкая распространенность, высокий уровень хронической инвализизации и большая социально-экономическая значимость ставит это болезненное состояние в ряд наиболее важных проблем здравоохранения.
Несмотря на значительный успех нейронаук на пути познания биологических основ зависимости, многие звенья ее патогенеза остаются невыясненными. Отсюда вытекает наиболее актуальный вопрос алкогольной зависимости – необходимость расшифровки основных механизмов, обусловливающих генез этого состояния, приводящего к алкогольной болезни.
Большинство исследователей считает, что основной причиной алкогольной зависимости является измененное содержание дофамина (преимущественно) и норадреналина в отделах мезокортиколимбической дофаминергической системы (МДС), на которые проецируются дофаминергические ядра среднего мозга. Различают алкогольную зависимость при длительном алкогольном стаже, алкогольную абстинентную и врожденную зависимость. Алкогольную зависимость между периодами абстиненции связывают с увеличением синтеза дофамина, его содержания в синапсах и активацией рецепторов к дофамину в проекционных отделах МДС (Анохина И.П., Коган Б.М., Христолюбова Н.А., 1979; Анохина И.П. 2001; Шабанов П.В. и соавт., 2002, 2010; Bergstorm H.C. at al., 2008). Причиной алкогольной абстинентной и врожденной зависимости является сниженное содержание дофамина (преимущественно) и норадреналина в отделах МДС (McBride W.J. et al., 1990; Rossetti Z. L., Hmaidan Y., Gessa G. L., 1992; George S. R. et al., 1995).
Уровень дофамина, высвобождаемого в синапсах и взаимодействующего с рецепторами постсинаптической мембраны нейронов в проекционных отделах МДС зависит от их морфофункционального состояния и трофико-пластического влияния, которое оказывают на нейроны макроглиоциты (Певзнер Л.З., 1972; Hyden H., 1967; Dai X. at al., 2003). Однако современное представление морфологии нейронов и нейроно-глиального взаимоотношения в МДС, являющееся ключевым для выяснения механизма и морфологических признаков перечисленных видов алкогольной аддикции, затруднено тем, что не решен ряд задач. Во-первых, не определены центры МДС и их подотделы, которые могли бы демонстрировать состояние нейронов и изменения дофаминовой медиации в наибольшей степени, поскольку в разных частях этих отделов объем центров, плотность расположения нейронов и области проекций дофаминергических волокон вариабельны (Bjorklund A., Lindvall O., 1984; Oads R.S., Halliday G.M., 1987). В связи с этим параметры нейронов МДС, например, в передней цингулярной коре (ПЦК), вычислены без учета области распределения дофаминергических окончаний (Должанский О.В., 2001). Во-вторых, отсутствует единое представление вида патологических изменений нейронов МДС (и других отделов головного мозга) при остром и хроническом воздействии этанола, функционального перенапряжения дофаминергических ядер и избыточной катехоламиновой медиации. Одни авторы, например, считают признаком острого алкогольного повреждения нейронов острое набухание нейронов, наиболее выраженное в коре лобной доли головного мозга (Галеева Л.Ш., 1973; Борисова Н.Ф., Желамбеков И.В., 1998; Pentschew A., 1958), другие – ишемическое сморщивание нейронов (Пиголкин Ю.И. и соавт., 2006). В-третьих, отсутствуют данные о количестве измененных форм нейронов в МДС у крыс и здоровых людей, известные при патологии (Жаботинский Ю.М., 1965). В-четвертых, отсутствуют исчерпывающие данные о количестве нейронов, их основных особенностях строения и количестве разновидностей макроглиоцитов в МДС как при различных видах аддикции, так и при условии нормы. В-пятых, информативность многих критериев оценки напряженности нейроноглиального взаимоотношения в МДС у здоровых организмов и при различных видах воздействий недостаточна и зачастую противоречива. Имеется в виду отношение числа нейронов к числу глиоцитов (Александрова М.А., 1999), среднее расстояние макроглиоцита от тел нейронов в пределах площади R2, где R=20 мкм – глиальное расстояние (Богомолов Д.В. и соавт., 2001), среднее количество перинейрональных сателлитов на один неизмененный нейрон – глиоцито-нейрональный индекс, абсолютное количество олигодендроцитов в 0,001мм3 (Востриков В.М., 2008) и др. Они связаны с выбором различной площади исследований, либо с произвольным выбором территории для подсчета, ограниченной целым ядром или слоем поля 24б без учета различной плотности расположения нейронов и макроглдиоцитов в пределах подотдела исследуемого нервного центра. В-шестых, скудно представлены данные об устойчивости морфологических признаков зависимости, особенно алкогольной. Известно, например, что через 1 мес после отмены хронического воздействия опиатов значимо уменьшены размеры тел вентральной области покрышки (ВОП), длина и толщина их дендритов (Nestler E.J., 2005). В-седьмых, фрагментарно и недостаточно полно освещены дифференциальные признаки воздействия на нейроны МДС этанола и опиатов. Например, данные об увеличении тяжести поражения нейронов в некоторых отделах МДС при отравлении алкоголем, опиатами и экспериментальной морфиновой абстиненции (Должанский О.В., 2001) не могут облегчить эту диагностику, поскольку в показатель включены все виды дистрофических и некробиотических изменений, включая алкогольную и наркотическую энцефалопатию. В-восьмых, нет данных о фазах гибели нейронов МДС развивающегося мозга и его скорости, степени повреждения нейронов МДС при хроническом воздействии этанола на материнский организм, а также о роли нейроно-глиального взаимоотношения в регуляции программированной гибели – апоптоза. И, наконец, не определена полушарная доминанта МДС (Михеев В.В., Шабанов П.Д., 2007).
Исходя из этого, очевидно, что выделение из МДС отделов и подотделов, в которых изменения нейронов в норме и при интоксикациях были бы наиболее информативны, детальное количественное изучение состояния нейронов на уровне их субпопуляций и изучение нейроно-глиального взаимоотношения, способные отразить влияние альтерирующих факторов на эту систему у организмов разного возраста, являются актуальной задачей в выяснении механизмов алкогольной зависимости.
Цель исследования – выявление закономерностей морфологических изменений нейронов и нейроно-глиальных взаимоотношений в мезокортиколимбической дофаминергической системе при воздействии этанола для уточнения механизмов внеабстинентной, абстинентной и врожденной алкогольной зависимости.
Задачи исследования.
1. Произвести объемную реконструкцию основных левосторонних центров МДС крысы, при помощи которой изучить их топографию и уточнить границы их сопредельной локализации.
2. Установить на основе полученной объемной реконструкции, количественного и морфометрического анализа нейронов и макроглицоитов, а также данных литературы подотделы МДС, демонстрирующие морфологические изменения нейронов в наибольшей степени. Определить количество неизмененных и патологически измененных форм нейронов, объем нейронов, количество олигодендроцитов, астроцитов и уровень нейроно-глиального взаимоотношения, представляющие собой эталон нормы для установленных подотделов МДС у интактных крыс и человека.
3. Определить фазы и сроки гибели нейронов МДС развивающегося мозга, сроки программированной клеточной гибели, а также степень повреждения нейронов исследованной системы при хроническом воздействии этанола на материнский организм у крыс, важные для понимания механизма врожденной алкогольной аддикции. Установить роль нейроно-глиального взаимоотношения в регуляции дифференцировки нейронов.
4. Выявить реактивные изменения нейронов и оценить степень напряженности нейроно-глиального взаимоотношения, характерные для внеабстинентной алкогольной зависимости у человека и крыс.
5. Определить дифференциальные морфологические признаки длительного влияния этанола, опиатов, гормонов стресса и антистресса на МДС.
6. Сопоставить полученные морфологические критерии врожденной и внеабстинентной алкогольной зависимости, а также отсроченные морфологические изменения МДС при раннем постнатальном воздействии гормонов стресса и антистресса с результатами функциональных тестов.
Научная новизна исследования.
Получены оригинальные данные объемной реконструкции, количественного и морфометрического анализа нейронов и макроглиоцитов основных отделов и подотделов МДС, связанных между собой проекционными волокнами и являющихся наиболее информативными для морфологических и физиолого-фармакологических исследований различных видов зависимости и возможности воздействия на эту систему. В МДС у человека и крыс ими являются: передние медиальные части паранигрального ядра вентральной области покрышки и компактной части черного вещества, середина вентромедиальной части прилежащего ядра и дофаминоцептивные слои передней лимбической коры. Их удобно рассматривать в подсистеме МДС – мезоаккумбоцингулярной дофаминергической системе (МАЦДС).
Выявлено, что у практически здоровых людей и интактных крыс небольшая часть нейронов патологически изменена. У человека количество патологически измененных форм нейронов больше в дофаминергических ядрах, чем в дофаминоцептивных слоях лимбической доли и, особенно, в коре теменной доли (не относящейся к МДС). Локальные изменения нейронов МАЦДС человека и высокая напряженность нейроно-глиального взаимоотношения в дофаминергических ядрах означает стертость границы нормы и патологии, а также меньшую прочность данной системы в сравнении с корковыми полями, удаленными от источника катехоламинергических волокон.
Впервые с помощью широко доступного метода световой микроскопии получены данные, позволяющие выделить морфологические признаки врожденной, внеабстинентной и абстинентной алкогольной зависимости.
Доказано, что длительное воздействие этанола на материнский организм вызывает усиление программированной гибели и уменьшение объема тел нейронов МАЦДС, сопряженные с усилением нейроно-глиального взаимоотношения. Эти дегенеративные изменения нейронов могут быть причиной сниженного уровня дофаминовой медиации в МДС и определять состояние врожденной алкогольной зависимости.
Впервые выявлено, что при развитии экспериментальной внеабстинентной алкогольной зависимости у взрослых крыс наблюдаются устойчивые компенсаторные пластические изменения нейронов, выражающиеся увеличением объема их тел и плотности расположения гранул хроматофильной субстанции, выраженные, главным образом, в дофаминергических ядрах. Эти изменения нейронов, наряду со значительным напряжением нейроно-глиального взаимодействия, объясняют увеличение уровня дофаминовой стимуляции формаций лимбической доли, считающееся одной из причин алкогольной межабстинентной аддикции.
Разработаны морфологические критерии оценки дифференциальной диагностики острого отравления этанолом, хронической алкогольной интоксикации и алкогольной абстинентной аддикции у человека. Показано, что этот вид зависимости, связанный с падением уровня дофамина в МДС, определяет высокая степень острого и хронического повреждения нейронов этой системы.
Выдвинута и доказательно обоснована гипотеза о том, что степень острого и хронического алкогольного повреждения нейронов МДС обусловлена комбинацией альтерирующих факторов – воздействия этанола, избыточной концентрации катехоламинов в синапсах дофаминоцептивных нейронов и функционального перенапряжения дофаминергических ядер.
Показано, что механизм восстановления нейронов МДС после отравления этанолом в периоде абстиненции связан с активацией нейроно-глиального взаимоотношения и его уровень обусловлен степенью острого повреждения нейронов.
Получены оригинальные данные, что воздействие мозгового гормона стресса (кортиколиберина) в раннем онтогенезе у крыс вызывает отсроченные компенсаторные пластическое изменения нейронов и усиление нейроно-глиального взаимоотношения в дофаминергических ядрах, аналогичные изменениям в этих ядрах при длительной алкогольной интоксикации, а также дегенеративные изменения дофаминоцептивных нейронов передней цингулярной коры. Наблюдаемое при этом усиление эмоционального реагирования (при функциональном тестировании) может являться следствием устойчивой активации МДС. Воздействие факторов антистресса (белки теплового шока 70 кДа) вызывает повреждение части нейронов дофаминергических ядер и снижение эмоционального реагирования, что может быть следствием угнетения дофаминовой медиации.
Получены новые результаты научно-практического характера, свидетельствующие о значимой компенсаторно-приспособительной роли макроглиоцитов в механизмах постнатального развития, пластических и дистрофических изменений нейронов МДС. Последние могут являться следствием функционального напряжения при синтезе избыточного количества дофамина, воздействием на дофаминоцептивные нейроны этанола и избыточного количества катехоламинов.
Теоретическая и практическая значимость исследования. Полученные оригинальные данные объемной реконструкции и топографии основных отделов и подотделов МДС у крыс могут быть использованы в качестве модели для различных морфологических и прицельных функциональных исследований данной системы (электростимуляция, фармакологическое воздействие). Описанные количественные и морфометрические параметры нейронов и макроглиоцитов МДС у человека и крыс следует рассматривать как эталон нормы.
Установленные морфологические закономерности острого и хронического алкогольного повреждения нейронов МДС, а также восстановления нейронов в сочетании с усилением нейроно-глиального взаимоотношения при алкогольной абстиненции могут служить в качестве диагностических критериев перечисленных болезненных состояний.
Описаны принципы дифференциальной диагностики морфологических изменений клеток МДС при опиатной и алкогольной интоксикации, связанные с распространенностью дегенерации (хроматофильного сморщивания) нейронов МДС, количественной реакцией макроглиоцитов, значительным ростом фагоцитарной активности всех разновидностей нейроглиоцитов, угнетением защитно-приспособительной реакции перинейрональных сателлитов.
Определена реактивность структур МДС в раннем онтогенезе для возможности развития поведенческих (эмоциональных) девиаций у половозрелых животных (крыс).
Полученные сведения о морфологических и количественных изменениях нейронов и макроглиоцитов, а также степени нейроно-глиального взаимоотношения при различных способах воздействия этанола и видах алкогольной зависимости могут служить основой для дальнейшего выяснения сложных механизмов алкогольной болезни и аддикции, а также возможностей разработки новых подходов к их профилактике и лечению.
Примененный способ определения количества нейронов, астроцитов и олигодендроцитов в МДС у крыс, сравнение информативности основных параметров нейроно-глиального взаимоотношения в формациях развивающегося мозга и у взрослых могут быть использованы при изучении пластичности нервной ткани в экспериментальных и клинико-анатомических исследованиях мозга.
По исследованиям получен патент на изобретение «Способ коррекции процессов регенерации» № 2350340 от 27.03.2009 г.
Основные положения, выносимые на защиту.
1. Длительное воздействие этанола на материнский организм у крыс характеризуется уменьшением объема тел нейронов мезоаккумбоцингуляр-ной дофаминергический системы (МАЦДС), а также и увеличением числа их теневидных и гипохромных дегенеративных форм типа апоптотически измененных при рождении. К началу пубертатного периода (61 сутки) численность нейронов в проекционных отделах МАЦДС сокращена. Эти морфологические изменения отражают угнетение дофаминовой медиации и могут определять врожденную алкогольную зависимость.
2. Длительное воздействие этанола на головной мозг взрослых крыс характеризуется повреждением значительной части нейронов МАЦДС, особенно паранигрального ядра ВОП и прилежащего ядра (ПЯ), а также устойчивыми компенсаторными пластическими изменениями тел малоповрежденных нейронов дофаминергических ядер по типу гипертрофических. Эти изменения отражают усиление дофаминовой медиации и могут определять устойчивое состояние повышенной мотивации к этанолу.
3. Алкогольная абстиненция у человека выражается высокой степенью повреждения нейронов МАЦДС при хронической алкоголизации и частичным восстановлением дистрофических изменений нейронов при остром отравлении, низким количеством малоповрежденных нейронов в отделах этой системы, особенно в прилежащем ядре. Эти изменения отражают преходящее угнетение дофаминовой медиации и могут определять состояние алкогольной абстинентной зависимости.
4. Систематическое избыточное высвобождение катехоламинов (в частности, дофамина) в проекционных отделах МАЦДС при отравлении этанолом, длительном воздействии этанола и воздействии кортиколиберина (КЛ) в раннем онтогенезе у крыс индуцирует повреждение нейронов, степень которого убывает по мере увеличения расстояния от ядер ретикулярной формации.
5. Воздействие КЛ в раннем онтогенезе у крыс индуцирует развитие морфологических признаков активации дофаминовой медиации в виде компенсаторного увеличения объема нейронов дофаминергических ядер и плотности расположения хроматофильных гранул в их цитоплазме. Эти изменения сочетаются с усилением эмоционального реагирования и могут являться ее причиной у половозрелых крыс-самок. Воздействие белков теплового шока 70 кДа (БТШ) вызывает угнетение морфо-функционального состояния МДС.
6. Усиление нейроноглиального взаимоотношения, оцененное по уменьшению глиального расстояния и увеличению глиоцито-нейронального индекса, представляет собой универсальную защитно-приспособительную реакцию МДС при ее развитии и различных способах воздействия этанола (кроме смертельного отравления) и раннего постнатального воздействия КЛ на головной мозг. Оно потенцирует дифференцировку нейронов в постнатальном онтогенезе МАЦДС в норме и при воздействии этанола, способствует формированию устойчивых компенсаторных изменений нейронов типа гипертрофических при длительном воздействии этанола и определяет регрессию признаков дистрофии нейронов при отмене этого воздействия.
Публикации. По теме диссертационной работы опубликованы 31 научная работа, в том числе 15 статей в журналах, включенных в перечень рецензируемых научных журналов ВАК, разделы в 3 коллективных монографиях, 2 методических рекомендации.
Апробация диссертационной работы. Основные положения диссертации были доложены и обсуждены на отечественных и международных конференциях: на XV Всероссийской конференции с международным участием «Актуальные вопросы прикладной анатомии и хирургии» (СПбГМУ, 2007), на 4 международной конференции «Cancer therapeutics» (Канада, 2007), на 11 многодисциплинарной международной конференции по нейронауке и биологической психологии «стресс и поведение» (CПб, 2008), на 621 и 638 пленарных заседаниях Санкт-Петербургского научного общества судебных медиков (2008 и 2010), на межрегиональной научно-практической конференции «Судебно-медицинская диагностика алкоголь-ассоциированной смерти» (СПб, 2009).
Структура и объем диссертации. Диссертация изложена на 323 страницах и содержит следующие разделы: введение, обзор литературы, материал и методы исследования, результаты, обсуждение полученных результатов, заключение, выводы, список литературы, содержащего 243 источника (57 отечественных и 186 иностранных). Диссертация иллюстрирована 103 рисунками и 76 таблицами. 2 таблицы составляют приложения к диссертации.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материал исследования. Для решения поставленных задач было проведено морфологическое изучение основных левосторонних отделов МДС – паранигрального ядра вентральнй области покрышки среднего мозга, компактной части черного вещества, прилежащего ядра и передней цингулярной коры человека и крыс – самок линии Вистар. Для сравнения количества измененных нейронов и нейроноглиального взаимоотношения в МДС у здорового человека, при отравлении этанолом и алкогольной абстиненции с этими же параметрами в формациях мозга, не относящихся к данной системе были исследованы слои III и V средней части постцентральной извилины (поле 1 – контроль). Экспериментальная часть работы проведена на базе вивария физиологического отдела НИИ экспериментальной медицины РАН. Головной мозг человека был исследован на базе ГУЗ «Бюро судебно-медицинской экспертизы» Санкт-Петербурга.
Всего было выполнено: 20 морфологических исследований головного мозга людей обоего пола в возрасте 24 – 45 лет, 98 морфологических исследований головного мозга крыс в возрасте от 0 суток до 17 мес. жизни, 82 половозрелые крысы подвергнуты функциональному тестированию.
Методы исследования.
Серия экспериментальных морфологических исследований основных отделов МДС.
1). Выполняли объемную реконструкцию основных левосторонних отделов МАЦДС (с использованием программы Reconstruct, Fiala G.С., 2005), а также изучали в этих отделах количественные и морфологические особенности нейронов, количество астроцитов и олигодендроцитов у интактных половозрелых крыс.
Головной мозг 6 крыс-самок в возрасте 7 мес. (180г) через 3 минуты после декапитации фиксировали в 9% растворе нейтрального формалина, проводили через спирты и заливали в парафин по стандартной методике приготовления гистологических препаратов (Меркулов Г.А., 1956). Производили ленточные серийные срезы головного мозга во фронтальной плоскости от лобного полюса левого полушария до рострального отдела моста. Шаг лезвия бритвы составлял 8 мкм, для последующей съемки на цифровой фотоаппарат Leica DFC290, Германия через микроскоп Leica DM2500, Германия – 3 мкм. Расстояние среза от лобного полюса полушария определялось по количеству серийных срезов. При подсчете учитывались дефектные срезы, не вошедшие в микропрепараты. Вычислялись средние арифметическое и квадратическое отклонение.
Объемная реконструкция основных отделов МАЦДС была составлена при микроскопии 87 фронтальных срезов головного мозга (выполнены через одинаковые промежутки), окрашенных гематоксилином и эозином. Отделы исследуемой системы были определены по цито-, миелоархитектоническим и топографическим особенностям в соотвествии с топографиеской картой головного мозга крысы (Paxinos G., 1986).
Количественные и морфометрические параметры клеток были определены в среднем и переднем отделах медиальной части паранигрального ядра ВОП и медиального края компактной части черного вещества (ЧВ) (13,3 и 12,2 мм от лобного полюса), в середине ПЯ (5,1 мм от лобного полюса) на территории обоих его частей (ядерной и скорлуповой) между передней мозговой спайкой и комплексом обонятельных ядер нижне-медиального края полушария (область проекции медиальных отделов паранигрального ядра и компактной части ЧВ), в слое VI 3 цингулярного поля (2,4 мм от лобного полюса) и слое III 2 цингулярного поля (на уровне измерений ПЯ). Срезы были окрашены крезиловым фиолетовым по методу Ниссля. Подсчет нейронов был произведен после их идентификации по классификации Жаботинского Ю.М. (1965) на неизмененные, гипохромные, сморщенные гиперхромные (пикноморфные) и теневидные. Подсчет нейронов и макроглиоцитов был произведен на площади 0,01 мм2 со стороной квадрата 100 мкм в 5 срезах серии толщиной 3 мкм, состоящей из каждого пятого последовательного среза (групповое n=30). Подсчет клеток в ПЯ произведен на площади 5 квадратов, начиная от передней спайки мозга в одном срезе у каждого животного (групповое n=30). Учитывали клетки с различимыми ядрами. Были вычислены количество тел нейронов в 0,01 мм2 (полотность) и объем неизмененных нейронов (по формуле объема эллипсоида).
GFAP в астроцитах был выявлен при помощи мышиных антител (клон GA5, разведение 1:250), набора “VECTASTAIN ABC”, CША (со вторичными биотинилированными антителами) и хромогена DAB. В срезах с окрашиванием GFAP и докрашенных гематоксилином Караци была определена плотность расположения астроцитов и олигодендроцитов (количество клеток в 0,01 мм2). Количество олигодендроцитов после подсчета суммарного количества макроглиоцитов в срезах, окрашенных по методу Ниссля, было определено как их разность с количеством астроцитов, выявленных на этой же площади в следующем срезе, окрашенном на GFAP. Среднее глиальное расстояние макроглиоцитв от тел нейронов (глиальное расстояние) было определено для всех учтенных нейронов на площади R2, где R=20 мкм, снаружи клеточной границы согласно (Богомолов Д.В., Пиголкин Ю.И. и Должанский О.В., 2001). Ошибка среднего арифметического количества нейронов, макроглиоцитов, объема нейронов, глиального расстояния (Х±Sx) была определена по методике Лакина Г.Ф. (1980) для малых выборок. Значимость различий средних определяли по критерию Стьюдента при р<0,05.
2). Изучали количество и морфологические изменения нейронов, количество макроглиоцитов мезоаккумбоцингулярной дофаминергической системы в раннем постнатальном онтогенезе у крыс. Задачей данного раздела исследования являлось также определение фаз программированной гибели нейронов МАЦДС развивающегося мозга и их сроки, а также роли нейроно-глиального взаимоотношения в регуляции этого процесса, представляющие собой эталон нормы, необходимый для сравнения с ним результатов различных воздействии на эту систему.
Количество и морфологические особенности нейронов и макроглиоцитов МАЦДС у 20 крысят-самок, рожденных интактными самками: новорожденных, на 5, 10 и 61 сутки развития (групповое n=25) были исследованы в тех же отделах системы и таким же образом, что и у интактных крыс в возрасте 7 мес. Дополнительно в этой части исследования и у взрослых интактных крыс был определен глиоцито-нейрональный индекс (как отношение количества перинейрональных сателлитов к количеству неизмененных нейронов). Перинейрональным сателлитом считался макроглиоцит, ядро которого находилось на расстоянии от тела неизмененного нейрона не более 2,5 мкм. Это расстояние было выбрано в силу того, что средний диаметр ядра олигодендроцита (наиболее частый вид сателлита) составляет 5 мкм, цитоплазма его очень узкая, слабо видима при окраске по методу Ниссля, и поэтому ядро практически прилежит к телу нейрона.
3). Изучали изменения количества и морфологических особенностей нейронов, количества макроглиоцитов МАЦДС в раннем постнатальном онтогенезе у крыс, рожденных самками, содержавшимися в условии хронической алкогольной интоксикации. Задачей данного раздела исследования являлось выявление степени повреждения нейронов и изменения нейроно-глиального взаимоотношения, важные для понимания врожденной алкогольной аддикции.
Были исследованы 20 крысят-самок, рожденные самками, содержащимися в условиях длительной алкогольной интоксикации. Последние в течение 5 мес., в период спаривания и беременности находились на сухом корме, в качестве единственного источника жидкости получали 15%-ный раствор этанола. Сроки, подотделы МАЦДС, методы исследования и приемы статистической обработки полученных результатов были аналогичны таковым в группе интактных крысят. Глиальное расстояние в данном разделе исследования не определялось.
4). Изучали количественные и морфологические изменения нейронов, количества макроглиоцитов МАЦДС при длительном воздействии 15%-го раствора этанола и после длительного перерыва. Задачей данного раздела исследования являлось выявление реактивных изменений нейронов и выраженности нейроно-глиального взаимоотношения, характерные для внеабстинентной алкогольной аддикции у крыс и их устойчивость.
Для определения микроморфологических параметров МАЦДС использовали 26 крыс-самок, которые были разделены на 3 группы. 1-ая группа состояла из 6 особей в возрасте 7 мес. (интактные). Крысам 2-ой группы (16 особей), находящимся на сухом корме, в качестве единственного источника жидкости предлагали 15%-ный раствор этанола. Длительность их алкоголизации составила 7 сут., 1, 3 и 5 мес. (по 4 особи в каждый срок), по истечении которых животных 7 сут. содержали на воде. Исключение периода абстиненции, во время которой содержание дофамина в структурах МДС падает (Rossetti Z. L., Hmaidan Y. аnd Gessa G. L., 1992) делало возможным получение параметров в условиях роста дофаминовой нагрузки на отделы данной системы, индуцированной длительным потреблением этанола (Анохина И.П., 2001; Николаев С.В., 2001; Шабанов П.Д., Лебедев А.А. и Мещеров Ш.К., 2002). Головной мозг крыс 3 группы (4 особи) исследовали после алкоголизации в течение 5 мес. и перерыва в 5 мес. (когда животных переводили на воду) с целью определения устойчивости измененных параметров.
Исследование МАЦДС крыс и оценка достоверности полученных результатов были осуществлены аналогичным способом, как и в группе интактных половозрелых крыс.
5). Изучали количественные и морфологические изменения нейронов МАЦДС при первичном быстро и медленно развивающимся отравлении этанолом. Задачей данного раздела исследования являлось получение дифференциальных признаков изменений нейронов при данных вариантах острого воздействия этанола, способствующих разрешению противоречий во мнениях о морфологических признаках острого алкогольного отравления.
Были исследованы 2 группы половозрелых крыс (7 мес.). Крысам 1 группы (4 особи) принудительно через зонд внутрь желудка вводили 15% раствор этанола по 3 мл каждый час, визуально оценивая поведение, позу, дыхание, сердцебиение, изменение цвета кожи до регистрации смерти через 9 часов. Крысам 2 группы (4 особи) однократно через зонд внутрь желудка вводили 25 мл 30% раствора этанола и регистрировали наступление смерти через 0,5 – 1 час.
Исследовали морфологические изменения нейронов в переднем медиальном отделе ВОП. В качестве контроля был использован слой V 1 теменного поля (Par 1, bregma –0,8), определенное по атласу Рaxinos G. (1986). Он не относится к МДС, поскольку не содержит дофаминергических окончаний. Норадренергические окончания в нем малочисленны (Bjorklund A., Lindvall O., 1984).
Данные отделы мозга были получены, зафиксированы, проведены через спирты, залиты в парафин аналогичным способом, как и в группе интактных половозрелых крыс. Таким же образом были получены и окрашены гистологические срезы ВОП и Par 1 (групповое n = 20). В срезах были визуально оценены морфологические изменения нейронов, а также морфометрические изменения среднего диаметра их клеточных тел (косого, продольного и поперечного). Для сопоставления изменения этого параметра с нормой, средний диаметр был определен в аналогичных структурах взрослых интактных крыс (6 особей, групповое n = 30). Достоверность полученных результатов была оценена тем же способом, что и у взрослых крыс.
6). Определяли количественные и морфологические изменения нейронов, изменения количества глиоцитов МАЦДС при перинатальном воздействии морфина у крыс. Задача данного раздела работы состояла в определении дифференциальных морфологических признаков длительного влияния на МДС этанола и опиатов. Пластические способности нейронов при длительном воздействии на МАЦДС морфина были изучены на модели позднего пренатального и раннего однократного введения морфина в организм плодов и новорожденных, тормозящего постнатальное развитие МДС (Hu Z., Cooper M., Crockett D.P. et al., 2004; Deng D.R., Djalai S., Holtje M. еt al., 2007).
Под эфирным наркозом крысам-самкам (n = 4) линии Wistar на 17 сутки после оплодотворения внутрь амниона плодов, а также крысятам на 4 сутки после рождения (n = 4) внутрибрюшинно вводили 10 мкл 1% раствора морфина гидрохлорида. Контрольным животным (n = 8) аналогичным образом в том же объеме вводили асептический 0,9% раствор хлорида натрия. Через 3 мес. от начала опыта экспериментальных и контрольных крыс декапитировали. Нейроны и макроглиоциты (групповое n в эксперименте = 20, в контроле = 40) были исследованы способом, аналогичным для интактных половозрелых крыс. Дополнительно было сосчитано количество микроглиоцитов и количество фагоцитируемых нейронов (в 0,01 мм2).
7). Определяли отсроченные количественные и морфологические изменения нейронов, изменения количества глиоцитов основных отделов МДС при раннем постнатальном воздействии гормонов стресса и атистресса у крыс. В задачу также входило определение пластической способности и особенностей повреждения нейронов МДС при длительном экспериментальном стрессе в период синаптогенеза системы.
Крысятам в возрасте 4 суток жизни внутрибрюшинно однократно вводили 0,5 мкг/крысу КЛ (Sigma, США) или 5 мкг/крысу БТШ-70 кДа (Институт Цитологии РАН, Санкт-Петербург).
Морфологическая оценка нейронов и макроглиоцитов была осуществлена способом, аналогичным для интактных половозрелых крыс. Для проверки предполагаемой роли избыточной катехоламиновой медиации в повреждении нейронов МДС, был аналогичным способом исследован дофаминоцептивный III слой заднего (гранулярного) цингулярного поля позади валика мозолистого тела (CgG – контроль). Раздельного подсчета олигодендроцитов и астроцитов не велось. Результаты воздействия были сопоставлены с данными у интактных половозрелых крыс.
Серия функциональных экспериментов.
1). Определяли уровень врожденной алкогольной зависимости, зависимости при хронической алкогольной интоксикации и после ее отмены у крыс. Задачей данного раздела работы являлось выявление фактической связи выявленных морфологических признаков внеабстинентной и врожденной алкогольной зависимости и ее степень в функциональном тесте.
Степень алкогольной зависимости определяли в двухпоилочном тесте (в одной поилке была вода, в другой – 15% раствор этанола), используемом для определения уровня аддикции в физиологическом отделе СПб НИИ экспериментальной медицины РАН (Николаев С.В., 2001). О степени зависимости судили по индексу предпочтения этанола. Он был вычислен как отношение объема употребленного этанола к объему употребленной воды в течение 3 суток.
Для определения исходного уровня алкогольной зависимости (серия 1) индекс предпочтения этанола был вычислен у крыс-самок в возрасте 7 мес., исследованных в условии нормы (10 особей).
Для определения алкогольной зависимости между периодами абстиненции (серия 2) этот индекс был определен у 24 самок. Животных подвергали алкоголизации длительностью 7 сут., 1, 3 и 5 мес. (по схеме морфологического эксперимента №№ 3 и 4), затем 7 сут. содержались на воде, после чего в течение 3 суток измеряли объемы вывитой ими воды и раствора этанола (по 6 в каждый срок). Интервал отмены этанола длительностью 7 суток (во время которого животных переводили на воду) исключал активации дофаминовой системы и предполагаемый рост зависимости в периоде абстиненции.
Для определения устойчивости алкогольной зависимости (серия 3) индекс определяли в течение 3 суток после 5 месячной алкоголизации и 5 месяцев перерыва (6 особей).
Для определения врожденной алкогольной зависимости (серия 4) индекс предпочтения этанола был вычислен у 6 крыс в возрасте 2 мес., рожденных от самок, длительно потреблявших 15% раствор этанола (по схеме морфологического эксперимента №№ 3 и 4) и у 10 крыс, рожденных от интактных самок.
2). Определяли эмоциональное поведение при воздействии гормонов стресса и антистресса в раннем онтогенезе у крыс. Задачей данного раздела работы являлось выявление фактической связи выявленных пластических и дегенеративных изменений нейронов развивающихся основных отделов МДС с изменениями эмоционального поведения.
Опыты выполнены на 40 крысах-самках в возрасте 4 мес., выращенных в группе по 5 особей в стандартных пластмассовых клетках в условиях вивария. Все животные были разделены на 3 группы. Крысятам 1 группы в возрасте 4 сут. жизни внутрибрюшинно однократно вводили 0,5 мкг/крысу КЛ (Sigma, США). Крысятам 2 группы на 4 сут. жизни вводили 5 мкг/крысу БТШ-70кДа (Институт Цитологии РАН, Санкт-Петербург). Крысята 3 группы были интактными.
Уровень свободной двигательной активности и тревожности определяли в тесте «открытое поле» и приподнятом крестообразном лабиринте (методика, использованная Шабановым П.Д., Лебедевым А.А. и Мещеровым Ш.К., 2002).
«Открытое поле» представляет собой круглую площадку диаметром 80 см и с 16 отверстиями (норками) диаметром 3 см каждая. Продолжительность опута составляла 3 мин. Регистировали число горизонтальных и вертикальных движений, заглядываний в норки.
Крестообразный лабиринт состоял из двух открытых рукавов 50х10 см и двух закрятых рукавов 50х10 см с открытым верхом, расположенных перпендикулярно друг относительно друга. Высота над полом – 1м. Животное помещали в центр лабиринта. Путем нажатия соответствующей клавиши этографа, связанного с компьютером, фиксировали время пребывания в закрытых и открытых рукавах, число свешиваний с платформы лабиринта.
В группах тестируемых животных среднее арифметическое и стандартная ошибка среднего (Х±Sx) были определены по методике Лакина Г.Ф. (1980) для малых выборок. Значимость различий средних определяли по критерию Стьюдента при Р<0,05.
Морфологическое исследование МАЦДС взрослых людей.
1). Выявляли количественные и морфологические изменения нейронов, изменения количества макроглиоцитов в слое III поля 1, содержащем небольшое количество дофаминергических окончаний (низкодофаминоцептивном) и слое V поля 1, лишенном этих окончаний (недофаминоцептивном) при отравлении этанолом, алкогольной абстиненции и хронической алкогольной интоксикации у человека. Задача этого раздела работы состояла в выяснении механизма морфологических изменений нейронов, а также степени участия в нем нейроноглиального взаимоотношения в данном отделе головного мозга, который не относится к МДС, но чаще всего используется как стандарт в судебно-медицинской диагностике отравлений (Исаков В.Д. и соавт., 2005).
Гистологически были исследованы средняя часть слоя III и слой V постцентральной извилины (поля 1 Бродмана) из области середины расстояния между верхним краем и латеральной бороздой полушария у 4-х групп людей обоего пола (n=20) в возрасте 24 – 45 лет.
Условную норму (n=5) составили умершие вследствие сочетанной травмы и кататравмы при дорожно-транспортном происшествии. Макро- и микроскопические признаки повреждения костей черепа, кровоизлияния в головной мозг, а также признаки алкогольной, опиатной интоксикаций, иные патологические изменения внутренних органов отсутствовали. Вторую группу (n=5) объединил судебно-медицинский диагноз «отравление этанолом» и признаки алкогольной болезни (стеатоз печени, алкогольная кардиомиопатия и энцефалопатия), подтвержденные судебно-гистологическим исследованием. Исследование головного мозга с признаками глубокой алкогольной патологии внутренних органов (алкогольный гепатит, цирроз печени, печеночная энцефалопатия) не проводилось. Третью группу (n=5) объединил судебно-медицинский диагноз «алкогольная кардиомиопатия» и аналогичные признаки алкогольной болезни. В эту группу вошли только те судебно-медицинские объекты, в моче которых определено остаточное количество этанола, то есть предполагалась алкогольная абстиненция. Четвертую группу (n=5) объединила смерть от последствий травм и отравлений в стационаре более, чем через 7 суток после поступления и аналогичные признаки алкогольной болезни. Поскольку 7 суток перерыва в употреблении алкоголя на ранних этапах алкогольной болезни составляет максимальную продолжительность алкогольного абстинентного синдрома (Афанасьев В.В., Рубитель Л.Т. и Афанасьев А.В., 2002), изменения нейронов и макроглиоцитов в коре головного мозга этой группы объектов характеризуют состояние хронической алкогольной интоксикации «в чистом виде».
Участки головного мозга, вырезанные при аутопсии не позже, чем через 12 часов с момента наступления смерти. Изготовление срезов, подсчет нейронов (неизмененных, гипохромных, пикноморфных и теневидных) и макроглиоцитов на площади 0,25 мм2 – в 4 последовательных квадратах со стороной 250 мкм (групповое n = 5) и статистическая обработка данных были произведены способом, аналогичным для интактных крыс.
2). Определяли количество и морфологические особенности нейронов, количество макроглиоцитов во взаимосвязанных отделах МАЦДС человека в условии нормы. Задача данного раздела работы состояла в определении количественной характеристики нейронов и макроглиоцитов, структурных особенностей нейронов и выявлении степени нейроно-глиального взаимоотношения в основных подотделах МАЦДС человека, аналогичных установленным подотделам у крыс, представляющие собой эталон нормы. В задачу данного раздела входило также сравнение количественных особенностей нейронов, макроглиоцитов и нейроно-глиального взаимоотношения в слоях III и V поля 1, лишенных дофминергических окончаний и с их низким количеством. Результаты исследования подотделов МАЦДС человека и крысы были сопоставлены между собой.
3). Изучали реактивные изменения нейронов, степень выраженности нейроно-глиальных взаимоотношений, выясняли механизмы алкогольной абстинентной зависимости у человека.
При этом были исследованы левосторонние взаимосвязанные подотделы МАЦДС человека у групп людей, умерших от отравления этанолом и в состоянии алкогольной абстиненции, выделенных в исследовании 1. Способ исследования и методика статистической обработки были также аналогичными. Для выяснения наиболее вероятной доли участия нейронотоксических факторов в генезе алкогольного повреждения нейронов МДС (выброс катехоламинов, функциональное напряжение ядер, этанол) и степени их восстановления при алкогольной абстиненции были исследованы слои III и V поля 1, лишенные дофминергических окончаний и с их низким количеством.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
1. Установление подотделов МДС, представляющих собой (по количественным и морфологическим особенностям нейронов, количеству макроглиоцитов и напряженности нейроно-глиальных взаимоотношений) эталон нормы для интактных крыс и человека.
Иммуноцитохимическими и авторадиографическими методами у крыс были выявлены проекционные связи аксонов медиального отдела паранигрального ядра ВОП с медиальной частью ПЯ и слоем VI передней цингулярной коры – Сg3, а также медиального отдела компактной части ЧВ с медиальной частью ПЯ и слоем III супрагенуальной цингулярной коры –Cg2 (Bjorklund A., Lindvall O., 1984; Oads R.S., Halliday G.M., 1987). У человека слоя III поля 24б (дофаминоцептивного) и медиальной части ПЯ достигают все аксоны нейронов медиальной части паранигрального ядра и около 25% нейронов переднего медиального отдела компактной части ЧВ (Porrino L.J., Goldman-Rakic P.C., 1982; Oads R.S., Halliday G.M., 1987).
В настоящем исследовании установлено, что в переднем и среднем отделах медиальной части паранигрального ядра у крысы численная плотность нейронов, их объем и количество астроцитов значительно не различались (р>0,05). Меньшее количество олигодендроцитов в его переднем отделе (р<0,05) может обусловить более низкую устойчивость нейронов этой части ВОП к повреждению, поскольку известна способность данного вида глиоцитов передавать нейронам РНК, аминокислоты и трофические факторы (Певзнер Л.З., 1972; Hyden H., 1967; Dai X. et al., 2003; Wilkins A. et al., 2003).
Через передний отдел паранигрального ядра проходит медиальный пучок переднего мозга – МПП (Paxinos G., 1986). В срезах этой части ядра мы наблюдали цепочки клеток, вытянутые тела нейронов и основания их отростков, ориентированные параллельно этому пучку. Известно, что аксоны норадренергических нейронов глубоватого места образуют синапсы на нейронах этой части ВОП (Steward O., 2000). Избыточное количество норадреналина и дофамина обладает нейронотоксическим действием. О повреждении нейронов при накоплении в отделах головного мозга катехоламинов известно из работ Аничкова С.В. (1984), Анохиной И.П. и соавт. (2001). Увеличение количества светлых нейронов с небольшим количеством поврежденных органелл и пикноморфных клеток обнаружено при повышении концентрации норадреналина в палеоамигдале на стадии проэструс (Ахмадеев А.В., 2009). Можно предположить, что избыточное высвобождение катехоламинов, выявленное методом высокоэффективной жидкостной хроматографии, в проекционных отделах МДС при стрессе и интоксикациях (Нуманд Л.Б., Оттер М.Я., 1083; Афанасьев В.В. и соавт., 2002; Wise R.A., Rompre P.P., 1989; McBride W.J. et al., 1990; Koob G.F., 1992), происходит и в синапсах передней медиальной части паранигрального ядра ВОП, где оно способно вызывать наиболее выраженные морфологические изменения, чем в остальных отделах этого ядра и других ядрах комплекса ВОП. Переднемедиальный отдел паранигрального ядра имеет наибольшую диагностическую ценность при морфологической оценке различных воздействий еще и потому, что его латеральная часть содержит наибольшее количество светлых нейронов (недофаминергических по Oads R.S., Halliday G.M., 1987), а тела нейронов остальных ядерных групп ВОП имеют малые размеры.
Передний отдел компактной части ЧВ характеризует свойства МАЦДС в наибольшей степени, поскольку он имеет наибольшие объем (рис. 1) и численную плотность нейронов (р<0,05) при близких значениях их объема и количества олигодендроцитов спереди и посередине. Практически полное отсутствие в нем астроцитов может характеризовать недостаточность гематоэнцефалического барьера и. следовательно, большую устойчивость этого отдела ЧВ к повреждению. Переднемедиальные подотделы паранигрального ядра ВОП и компактной части ЧВ могут быть изучены в одинаковых фронтальных плоскостях на уровне 12,2±0,1мм от лобного полюса.
Медиальная часть ПЯ наибольший объем (и, следовательно, количество нейронов) имеет в центральной части ядра (5,1±0,1мм от лобного полюса) на уровне передней части супрагенуального цингулярного поля (Cg2). Слой VI прегенуального цингулярного поля (Сg3) наиболее близок к МПП. На уровне основания передних щипцов (2,4±0,1мм от лобного полюса) численная плотность его нейронов и астроцитов превосходит их удельное количество в остальных отделах МДС, что может означать максимальную концентрацию рецепторов к дофамину.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


Рис. 1. Объемная реконструкция основных левосторонних отделов мезоаккумбо-цингулярной дофаминергической системы крыс, иллюстрирующая две проекционные подсистемы среднего мозга: вентральная область покрышки (RTV) – прилежащее ядро (NAc) – прегенуальная цингулярная кора (слой VI и нижняя часть слоя V Cg3, прегенуальной части Cg1) и компактная часть черного вещества (SNC) – прилежащее ядро – супрагенуальная поясная кора (слой III Сg2, супрагенуальной части Cg1). 1, 2, 3 и 4 – уровни фронтальных срезов, в которых была исследована система: 1 – RTV и SNC – уровень 13,28 ± 0,08 мм от лобного полюса; 2 – RTV и SNC – уровень 12,18 ± 0,07 мм, 3 – NAc и Cg 2 – уровень 5,10 ± 0,06 мм, 4 – Cg3 уровень 2,42 ± 0,09 мм. Caud – R и sup – inf – направления осей
У интактных крыс в установленных подотделах МАЦДС гипохромные, пикноморфные и теневидные нейроны были единичными (табл. 1). Их происхождение не вполне понятно. Напряженность нейроно-глиального взаимоотношения в дофаминергических ядрах оказалась больше, чем в дофаминоцептивных слоях лимбической коры: глиоцито-нейрональный индекс в ядрах был меньше, а глиальное расстояние – больше, чем в коре (р<0,05).
В подотделах МАЦДС человека, аналогичных установленным у крысы, количество патологически измененных нейронов было значительно большим (см. табл. 1). Доля теневидных нейронов и доля их фагоцитоза уменьшаются с увеличением расстояния от паранигрального ядра ВОП.
Доля гипохромных нейронов в проекционных отделах МДС убывает с увеличением расстояния от ПЯ. Доля пикноморфных нейронов в паранигральном ядре ВОП больше, чем в ПЯ, слоях поля 1 и в ЧВ. Степень выраженности нейроно-глиального взаимоотношения в дофаминергических ядрах у человека, как и у интактных крыс значительно больше, чем в проекционных отделах МДС и не относящихся к системе слоях поля 1.
Таблица 1
Долевое соотношение нейронов в установленных отделах МДС и в соматосенсорной коре у здоровых людей на площади 0,25 мм2 (Х±Sx; n=5) и интактных крыс на площади 0,01 мм2 (Х±Sx; n=30).
| Отделы дофаминергической системы и слои соматосенсорной коры | Объект исследо-вания | Доля нейронов в популяции (%) | ||||
| неизмененных | гипохромных | пикноморфных | теневидных | фагоцитируемых теневидных (% от теневидных) | ||
| Паранигральное ядро вентральной области покрышки | Человек | 59,9±5,1* | 8,0±2,9 | 6,8±1,3 | 25,3±5,5* | 63,3±10,9 |
| Крысы | 83,9±5,2 | 5,4±3,3 | 8,7±3,7 | 2,0±2,0 | - | |
| Компактная часть черного вещества | Человек | 81,3±5,2* | 10,1±1,7 | 2,2±0,7*** | 6,4±1,9* | 41,2±16,2 |
| Крысы | 89,8±6,1 | 6,2±4,4 | 3,0±2,2 | 1,0±0,5 | - | |
| Прилежащее ядро | Человек | 69,7±4,7* | 16,0±4,2* | 0,4±0,4*** | 13,9±3,2* | 36,4±6,8** |
| Крысы | 91,4±1,5 | 0,7±0,7 | 5,6±1,6 | 2,3±1,5 | - | |
| III (дофаминоцептив-ный) слой поля 24б | Человек | 75,3±5,2* | 8,2±1,4* | 5,0±1,1 | 11,5±2,2* | 25,0±7,8** |
| VI (дофаминоцептив-ный) слой поля Сg3 | Крысы | 93,0±1,4 | 1,8±0,7 | 2,7±1,3 | 3,1±0,6 | - |
| III (дофаминоцептив-ный) слой поля 1 | Человек | 81,4±5,6 | 8,6±2,0 | 1,0±0,4 | 9,0±2,1 | ** 18,8±6,8 |
| V (недофаминоцеп-тивный) слой поля 1 | Человек | 89,1±6,5 | **** 4,3±1,4 | *** 0,5±0,2 | ***** 6,1±1,1 | ** 22,2±15,3 |
* – различие при сравнении с показателем у крыс значимы (р<0,05); ** – различие при сравнении с показателем в паранигральном ядре ВОП значимы (р<0,05); *** – различие при сравнении с показателем в паранигральном ядре ВОП значимы (р<0,05); **** – различие при сравнении с показателем в ЧВ, ПЯ и поле 24б значимы (р<0,05); ***** – различие при сравнении с показателем в паранигральном ядре ВОП, ПЯ и поле 24б значимы (р<0,05)
2. Определение фаз и сроков программированной гибели нейронов МАЦДС, сроков появления GFAP+ астроцитов и роли нейроно-глиальных взаимоотношений в регуляции дифференцировки нейронов.
Известные сведения о ранней пренатальной дифференцировке нейронов дофаминергических ядер у крыс (Van Kampen J.M. and Robertson H.A., 2005), опережающей дифференцировку неокортекса и, особенно дофаминоцептивных слоев прегенуальной цингулярной коры (Замбржицкий И.А., 1972) подтверждаются нашими количественными и морфометрическими данными, которые дополняют представления этих авторов. Вполне возможно, что ускоренная дифференцировка дофаминергических нейронов необходима для последующего развития и синаптогенеза нейронов проекционных отделов МДС, поскольку при снижении концентрации моноаминов в лимбической коре выявлена индукция апоптоза и повреждение синаптического аппарата пирамидных нейронов (Отеллин В.А., 2003).
При рождении клеточные тела нейронов дофаминергических ядер и слоя III Cg2 имели наиболее зрелый вид. Нейроны слоев глубоких слоев Сg3 и прилежащего ядра были расположены в виде гнезд и цепочек; их цитоплазма имела вид узкого перинуклеарного ободка. В постнатальном развитии нейронов системы, судя по изменению их объема, можно различить два периода дифференцировки. В раннем постнатальном периоде (до 5 сут.) наблюдается высокий темп дифференцировки нейронов дофаминергических ядер и увеличение скорости дифференцировки прилежащего ядра (5 – 10 сут). В позднем постнатальном периоде (10 – 61 сут.) дифференцируются нейроны всех исследованных отделов системы. Дифференцировка нейронов завершается к концу 2 мес. жизни.
При сопоставлении величин объема нейронов и глиоцито-нейронального индекса в каждом исследованном периоде жизни в отделах МДС (ВОП, ЧВ, ПЯ, Cg3, Cg2) был выявлен высокий коэффициент линейной корреляции: 0,98 – 0,94 – 0,89 – 0,80 – 0,89 отн. ед. Следовательно, объем нейронов и степень нейроно-глиального взаимоотношения являются информативными морфометрическими критериями процесса дифференцировки нейронов. Глиальное расстояние является информативным критерием нейроно-глиального взаимоотношения только у взрослых особей. Вследствие компактного расположения клеток развивающегося мозга один и тот же глиоцит находился на разном расстоянии от ближайших нейронов. Поэтому стандартная ошибка среднего глиального расстояния имела значительный размах (0,9 – 2,8 мкм).
Для оценки параметров нормы наряду с установлением численности нейронов нужно учитывать и характерные особенности их гибели. Несмотря на то, что в настоящее время признаки апоптоза хорошо изучены с помощью различных современных иммуноцитохимических методик (с использованием маркеров) до сих пор количественные показатели оценки гибели нейронов в различных отделах мозга человека и животных, включая и МДС, остаются не выясненными. Попытки его оценить по убыли числа нейронов мозжечка в пери- и постнатальные периоды показали, что массовая гибель нейронов наблюдается в раннем постнатальном периоде и заканчивается при половом созревании (Ахмедова Р.Л., Ахмедова Л.М., 2008).
К определению сроков программированной гибели нейронов и ее длительности мы подошли, подсчитывая долю неизмененных, гипохромных (погибающих) и теневидных (погибших) нейронов. Гипохромные нейроны (рис. 2) имели вид просветленных, лишенных хроматофильной субстанции, выглядели сморщенными, реже слегка набухшими, имели участки стертости клеточной и ядерной поверхности. У многих из них определялись характерные для апоптоза участки конденсации хроматина на внутренней поверхности ядра. Цитоплазма и контур клеточного тела у теневидных нейронов были неразличимы. Нуклеоплазма большей части теневидных нейронов была также неразличима: ядра выглядели как полые кольца.
































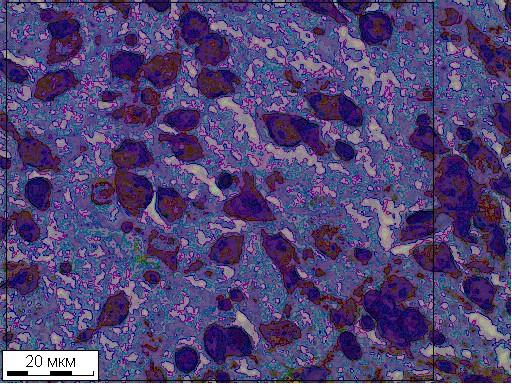
Рис. 2. Нейроны и макроглиоциты паранигрального ядра на 0 сутки постнатального развития. Окраска крезиловым фиолетовым по методу Ниссля. Н – неизмененный нейрон, Д и Дс – дистрофически измененные (гипохрмные и гиперхромные сморщенные), Т – теневидные нейроны; стрелки – макроглиоциты. Рамкой ограничены 0,01 мм2 площади.
В процессе гибели нейронов мы различили начальную и заключительную фазы. О начале программируемой гибели свидетельствовало увеличение доли гипохромных нейронов, а о ее завершенности – увеличение доли теневидных клеток. При рождении в дофаминергических ядрах доля гипохромных и, особенно, теневидных нейронов больше, чем в проекционных отделах. Значительная убыль доли этих нейронов в ядрах происходит между 10 и 61 сутками жизни.
В проекционных отделах системы на 5 сутки жизни наблюдается резкое увеличение доли гипохромных нейронов и последующий их спад, более плавный между 10 и 61 сутками жизни. В этот поздний постнатальный период программированная гибель нейронов ПЯ, Cg3 и Cg2 вступает в завершающую фазу, поскольку нарастает доля теневидных нейронов, а доля гипохромных клеток значительно снижается.
В 0 сутки жизни единичные GFAP+ астроциты содержали дофаминоцептивные слои Cg3 и Cg2, что согласуется с данными о начале экспрессии GFAP радиальными глиоцитами неокортекса перед рождением (Valentino K.L., Jones E.G., 1982). Количество GFAP+ астроцитов МАЦДС достигает уровня у взрослых животных на 5 сутки жизни (в ПЯ – на 10 сут). Количество олигодендроцитов находится на уровне взрослых уже при рождении, как и в остальных формациях мозга (Uylings H.B., 1990).
3. Повреждение нейронов МАЦДС развивающегося мозга, изменение сроков их программированной гибели, сроков появления GFAP+ астроцитов и напряженности нейроно-глиальных взаимоотношений при хроническом воздействии этанола на материнский организм у крыс.
Уже при рождении в дофаминергических ядрах доля гипохромных и теневидных нейронов увеличилась в 1,52 – 1,98 раза. Суммарное количество нейронов значительно не изменилось, а их объем уменьшился (табл. 2). В ПЯ, дофаминоцептивных слоях Cg3 и Cg2 доля теневидных нейронов увеличилась в 6,2 – 17,5 раз; гипохромных – всего в 1,89 – 5,5 раза. Возросла доля пикноморфных нейронов; объем нейронов уменьшился более значительно, чем в дофаминергических ядрах. Рост суммарного количества нейронов в проекционных отделах МАЦДС, отражающий компактное расположение незрелых, поврежденных нейронов (и волокон) на 61 сутки жизни сменился сокращением их числа и доли поврежденных нейронов (теневидных и гипохромных).
Эти данные подтверждают и развивают представление об индукции апоптоза нейронов лимбической коры при падении концентрации моноаминов (Отеллин В.А., 2003). Они убеждают в том, что угнетение дифференцировки нейронов дофаминергических ядер за счет снижения синтеза в них ДНК и белка под воздействием этанола в пренатальном периоде (Тимошенко и соавт., 1987) индуцирует массовую гибель, уменьшение объема и отсроченную разреженность нейронов проекционных отделов МАЦДС. Эти изменения в группе крыс на 61 сутки жизни могли
Таблица 2
Долевое соотношение популяций нейронов МАЦДС, их суммарное количество и объем на 0 сутки постнатального развития у потомства самок, содержавшихся в условии хронической алкогольной интоксикации (ХАИ) по сравнению с этими параметрами у интактных крыс в 0,01 мм2 площади (Х ± Sх)
| Исследованные отделы | Воздействие на организм самок | Доля нейронов в популяции | Суммарное количество нейронов | Объем нейронов, мкм3 | |||
| неповреж-денных | гипохром-ных | пикно-морфных | тене-видных | ||||
| Вентральная область покрышки (паранигральное ядро) | ХАИ | * 35,3±1,0 | * 27,1±1,1 | * 5,5±1,0 | * 33,7±2,2 | 50,4±3,6 | * 130,6±8,3 |
| – | 60,9±1,9 | 13,7±1,7 | 3,3±1,1 | 22,1±3,1 | 49,8±4,1 | 167,4±14,5 | |
| Черное вещество (компактная часть) | ХАИ | * 47,7±1,2 | * 18,5±0,9 | 5,4±1,1 | * 29,3±1,9 | 102,4±5,5 | * 130,7±9,4 |
| – | 71,8±1,8 | 10,6±0,7 | 6,8±0,7 | 10,8±0,6 | 97,0±7,7 | 182,1±17,3 | |
| Прилежащее ядро | ХАИ | * 64,4±2,7 | * 7,0±0,8 | * 5,7±0,6 | * 24,5±1,1 | * 169,8±5,1 | * 65,1±8,3 |
| – | 94,1±1,2 | 3,7±0,5 | 0,8±0,7 | 1,4±0,5 | 113,0±3,2 | 103,3±13,8 | |
| 3 цингулярное поле (Сg3) | ХАИ | * 51,9±1,6 | * 11,0±0,7 | 0,8±0,4 | * 36,4±1,6 | * 103,2±5,6 | * 85,6±12,2 |
| – | 93,3±2,2 | 2,0±0,6 | 0,7±0,5 | 2,6±1,1 | 56,4±4,7 | 178,0±21,2 | |
| 2 цингулярное поле (Cg2) | ХАИ | * 63,8±1,4 | * 14,6±0,9 | * 3,1±0,6 | * 18,5±2,0 | * 84,2±4,6 | * 151,2±9,9 |
| – | 90,7±2,0 | 5,6±1,8 | 0,7±0,5 | 3,0±1,0 | 54,0±1,8 | 236,8±21,2 | |
* – различие при сравнении с показателем у интактных крыс значимы (р<0,05).
обусловить рост индекса предпочтения этанола (интактные животные этого возраста не потребляли этанол), поскольку считается, что снижение уровня дофамина в МДС заложено в природе врожденной алкогольной аддикции (McBride W.J. et al., 1990; George S. R., 1995).
Первые GFAP+ астроциты в МАЦДС появлялись только на 5 – 10 сутки жизни. Выявленное торможение экспрессии GFAP пренатальным воздействием этанола подтверждает данные, полученные на культуре радиальной глии (Valles S. at al., 2008). Количество олигодендроцитов, перинейрональных сателлитов и глиоцито-нейрональный индекс при развитии исследованных подотделов системы под воздействием этанола было увеличено (р<0,05). Эти наши данные подтверждают и дополняют сведения о компенсаторной роли олигодендроглиоцитов, вырабатывающих нейронотрофические факторы – BDNF, GDNF (Dai X. et al., 2003; Wilkins J., 2003), выработка которых прекращается с наступлением половой зрелости.
4. Установление вероятных причин острого повреждения нейронов головного мозга при воздействии этанола.
До сих пор отсутствуют систематизированные подтверждения ряду гипотетических объяснений других причин повреждений нейронов, нежели воздействие этанола на клеточные мембраны, таких как функциональное перенапряжение при выработке избыточного количества катехоламинов (Оттер Л.Б., Нуманд М.Я., 1983; Анохина И.П. и соавт., 2001) и повреждение избыточным количеством катехоламинов, воздействующих на постсинаптическую мембрану (Аничков С.В., 1984; Koob, 1092). Между тем известно, что избыточный синтез дофамина и норадреналина обусловлен воздействием на организм этанола, опиатов и стресса (Афанасьев В.В. и соавт., 2002; Wise R.A., Rompre P.P., 1989; Le Moal M., Simon H., 1991; Chrousos G.P., Gold P.W., 1992; Koob G.F., 1992). При инъекции катехоламинов внутрь желудочков мозга был выявлен отек цитоплазмы и повреждение органелл вблизи постсинаптических пространств тела нейронов (Федосихина Л.А., 1986; Hedreen J.C., Chalmars J.P., 1972). Просветление, разреженность матрикса цитоплазмы и повреждение органелл нейронов палеоамигдалы выявлено при избыточном выделении норадреналина в фазе проэструс (Ахмадеев А.В., 2009).
Предположив, что при отравлении этанолом ишемическое сморщивание нейронов (Пиголкин Ю.И. и соавт., 2006) и их острое набухание (Галеева Л.Ш., 1973; Борисова Н.Ф., Желамбеков И.В., 1998; Pentschew A., 1958) могут зависеть от длительности переживания, в нашем исследовании был выполнен соответствующий эксперимент.
При первичном быстроразвивающимся отравлении этанолом нейроны паранигрального ядра ВОП и слоя V теменного поля 1 (в нем дофаминергические окончания отсутствуют, а норадренергические имеют низкую численность) подвергались острому набуханию. У нейронов ВОП средний диаметр был увеличен значительно больше (р<0,05), чем в слое V поля Par 1; их хроматофильная субстанция была оттеснена к периферии клеточного тела или распылена, тогда как в цитоплазме нейронов Par 1 был выявлен всего лишь узкий перинуклеарный ободок просветления. Это различие не исключает сочетанного влияния этанола, фактора перенапряжения при выработке дофамина и какого-либо токсического либо гиперполяризующего воздействия норадреналина, высвобождающегося через многочисленные синапсы на телах нейронов ВОП (Steward O., 2000). На нейроны же Par 1 преимущественно воздействует лишь этанол. Более выраженные признаки острого набухания нейронов в коре лобной доли, чем в остальных отделах неокортекса наблюдал Pentschew A. (1958), который не смог дать этому объяснения.
При остром отравлении этанолом, развивающимся в течение 11 часов, нейроны обеих исследованных формаций мозга были ишемически изменены и обладали признаками оксифильной дегенерации по типу ишемического некроза, чему предшествовало продолжительное ослабление дыхания и цианоз кожи и слизистых оболочек животных.
5. Формирование устойчивых морфологических изменений нейронов и макроглиоцитов МАЦДС, заложенных в основе алкогольной аддикции у взрослых крыс.
При алкогольной интоксикации длительностью 1 мес. и более (исключая период абстиненции) в мезоаккумбоцингулярной системе было определено сокращение численности малоповрежденных нейронов. Было установлено, что это изменение происходит за счет значительного увеличения количества нейронов с признаками острого набухания и вакуолизацией клеточных тел (дистрофически измененных) и теневидных (некротизированных) нейронов. Устойчивые (на протяжении 5 мес. после отмены этанола) компенсаторные увеличение объема малоповрежденных нейронов МАЦДС и визуальной плотности расположения гранул хроматофильной субстанции особенно выраженные в дофаминергических ядрах, так же как и усиление степени нейроно-глиального взаимоотношения, были установлены через 1 мес. и нарастали к 5 мес. алкогольной интоксикации (рис. 3). Было снижено глиальное расстояние и увеличено количество обоих видов макроглиоцитов (р<0,05). Поскольку появление этих признаков (через 1 – 3 мес. эксперимента) и их сохранение через 5 мес. перерыва длительного потребления этанола сочеталось с предпочтением этанола в двухпоилочном тесте (рис. 4.) их возможно трактовать как морфологические признаки алкогольной (внеабстинентной) аддикции.
При алкогольной интоксикации установлены локальные компенсаторные пластические увеличения объема осевых дендритов пирамидных нейронов ПЦК (Cornish J.L., Kalvias P.W., 2000; Chandler L.J., Mulholland J., 2007). На шипиковых нейронах ПЯ, пирамидных нейронах ПЦК и медиальной префронтальной коры (обе структуры имеют дофаминовые входы) при длительном воздействии кокаина, амфетамина и
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


Рис. 3. Нейроны и макроглиоциты переднемедиального подотдела компактной части черного вещества при воздействии алкоголя длительностью 5 месяцев и после 7 суточной отмены (Б) по сравнении с нормой (А). Окраска методом Ниссля. Ок. 10, об. 40. Обозначения: Н – неизмененные, Д – гипохромные и пикноморфные, Т – теневидные нейроны, стрелки – макроглиоциты. Рамкой ограничены 0,01 мм2 площади. Пунктир – площадь R2, где R=20 мкм
![]()
![]()
![]()
![]()

Длительность алкоголизации 0 7 сут 1 мес 3 мес 5 мес 5 мес
Длительность перерыва 0 7 сут 7 сут 7 сут 7 сут 5 мес
Рис. 4. Изменение суточного индекса предпочтения этанола в процессе алкоголизации (без учета периода абстиненции) и после длительного перерыва. * - изменение величины индекса в сравнении с исходным уровнем статистически значимо (Р < 0,05)
шизофрении увеличены число разветвлений дендритов, шипиков и их размеры (Boundreau A., Wolf M., 2005; Backstrom P., Hyitia P., 2007; Bergstrom H. et al., 2008).
Перечисленные данные литературы, а также результаты компенсаторных пластических изменений нейронов и усиление степени нейроно-глиального взаимоотношения в дофаминергических ядрах (особенно) и проекционных отделах МАЦДС свидетельствуют об активации дофаминовой медиации, закреплению ощущения эйфории (Nestler E.J., 2001, Nestler E.J., 2005) вследствие усиления возбуждения нейронов ПЯ и передней лимбической коры.
6. Отсроченные морфологические изменения МАЦДС и изменения эмоционального поведения при воздействии кортиколиберина и белков теплового шока 70 кДа в раннем онтогенезе у крыс.
Изменения в эмоциональном и двигательном поведении крыс, подвергнутых воздействию кортиколиберина (КЛ) и белков теплового шока (БТШ 70 кДа) в раннем постнатальном периоде, убедительно демонстрируют, что по направленности отсроченные эффекты КЛ и БТШ различаются. Эмоциональность самок при воздействии КЛ на 4 сутки жизни, т.е. в период синаптогенеза МДС (Угрюмов М.В., 1998) взрастает, а при воздействии БТШ – снижается. Об этом свидетельствуют полученные нами результаты оценки эмоциональности в тесте «открытое поле» по показателям двигательной активности, дефекации и уринации и по уровню тревожности в тесте «приподнятый крестообразный лабиринт» (табл. 3 и 4).
Таблица 3
Влияние КЛ или БТШ, вводимых в ранний постнатальный период, на поведение половозрелых крыс-самок в «открытом поле»
| Показатель | Контроль | Кортиколиберин | Белки теплового шока 70 кДа |
| Число стоек | 5,9±1,2 | 9,5±1,3* | 2,5±1,5* |
| Болюсы дефекаций | 0,0±0,0 | 2,1±1,8* | 0,0±0,0 |
Таблица 4
Влияние КЛ или БТШ, вводимых в ранний постнатальный период, на поведение половозрелых крыс-самок в приподнятом крестообразном лабиринте
| Показатель | Контроль | Кортиколиберин | Белки теплового шока 70 кДа |
| Время в открытых рукавах | 36,5±2,5 | 12,2±4,4* | 57,3±14,1* |
Примечание: *р<0,05 — достоверность отличий но сравнению с контролем.
Отсроченные морфологические изменения нейронов дофаминергических ядер при воздействии гормона стресса в период синаптогенеза МДС выражались пластическими увеличением объема нейронов (р<0,05), их ядрышек и компактности расположения хроматофильной субстанции (визуально), что может свидетельствовать об устойчивой активации выработки дофамина (рис. 5). Умеренно выраженные увеличение глиальной плотности в ВОП и ЧВ при воздействии КЛ и уменьшение расстояния между телами нейронов и макроглиоцитами является защитно-приспособительной реакцией макроглиоцитов. Вполне вероятно, что путем восполнения рибосомальной РНК и аминокислот у нейронов глиоцитами (по Певзнеру Л.З., 1972) обусловлены пластические компенсаторные изменения
нейронов и отсутствие их выраженных дистрофических изменений. Полученные признаки усиления нейроно-глиального взаимоотношения и пластические изменения нейронов паранигрального ядра и компактной части ЧВ объясняют повышение концентрации дофамина в структурах головного мозга, отмеченное Wolkowitz O.M. et al. (1986) при воздействии клюкокортикоидных гормонов и могут свидетельствовать об активации МДС.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


Рис. 5. Отсроченные изменения нейронов и макроглиоцитов компактной части ЧВ крыс при раннем постнатальном воздействии кортиколиберина (А) и белка теплового шока (Б). Окраска по Нисслю (А) и гематоксилином-эозином (Б). Ок. 10, об. 63. Обозначения: Т – теневидные нейроны; В – вакуольная дистрофия нейронов, стрелки – макроглиоциты, ср – ножка мозга
Установленные пластические компенсаторные изменения нейронов дофаминергических ядер косвенно свидетельствуют об усилении выработки дофамина (возможно, и норадреналина). Избыток последних оказывает повреждающее действие на нейроны (см. выше). Переднюю цингулярную кору достигает около 1/3 волокон медиального пучка переднего мозга (Bjorklund A. and Lindvall O.,1984), их количество убывает в каудальном направлении. Степень повреждения нейронов дофаминоцептивных слоев прегенуального и супрагенуального цингулярных полей, основную долю в которых составили теневидные и кономорфные нейроны, и напряженность в них нейроно-глиального взаимоотношения, судя по уменьшению глиального расстояния) при неонатальном воздействии КЛ были значительно больше, чем в ретроспленальном цингулярном поле (р<0,05). Следовательно, дегенеративные изменение нейронов и компенсаторное увеличение нейроно-глиального взаимодействия в проекционных отделах МДС при неонатальном воздействии КЛ могут быть обусловлены их избыточной катехоламиновой стимуляцией и связаны с количеством катехоламин-ергических волокон этого пучка.
В противоположность неонатальному воздействию КЛ, в дофаминергических ядрах при воздействии БТШ выражены дегенеративные изменения нейронов (см. рис. 5). В проекционных отделах МАЦДС при воздействии БТШ данные изменения выражены гораздо слабее, чем при воздействии КЛ. Это может быть связано с нарушениями синтеза, высвобождения дофамина и ишемией нейронов вследствие нарушения гемоциркуляции.
Устойчивые морфологические признаки снижения активности МДС при неонатальном воздействии БТШ 70 кДа сочетаются с устойчивым снижением эмоционального поведения и могут являться ее причиной у крыс-самок.
7. Отсроченные морфологические изменения МАЦДС при перинатальном воздействии морфина у крыс.
При перинатальном воздействии морфина малоповрежденные нейроны, численность которых была значительно сокращена, обладали уменьшенным объемом (р<0,05), многие из них были повышенно гиперхромны. Было увеличено число пикноморфных, гипохромных, в том числе по типу апоптотически измененных нейронов. Повреждение нейронов оказалось связанным с их фагоцитозом макро- и микроглиоцитами, особенно в пренатальном периоде (табл. 5). Активации нейроно-глиального взаимоотношения и увеличения количества макроглиоцитов в большинстве отделов МАЦДС не наблюдалось.
Таблица 5
Количество фагоцитируемых нейронов МАЦДС у крыс на площади 0,01 мм2 при перинатальном воздействии морфина (X ± Sx).
| Воздействие | Вентральная область покрышки | Черное вещес-тво (компакт-ная часть) | Прилежащее ядро | 3-e цингуляр-ноe полe (пре-генуальное), VI слой |
| Нет (норма) | 0,9±0,3 | 1,2±0,5 | 0,7±0,3 | 0,6±0,3 |
| Пренатальное | 3,8±0,4* | 3,8±0,5* | 2,6±0,5* | 3,44±0,4* |
| Постнатальное | 2,9±0,8* | 2,8±0,4* | 2,9±0,4* | 2,1±0,3* |
* – различия параметров клеток между нормой и в результате воздействия достоверны (р<0,05).
Выявленные в настоящей работе повреждения нейронов компактной части ЧВ и прегенуальном цингулярном поле (Cg3) во многом были подобны изменениям, развивающимся в этих отделах дофаминергической системы мозга у крысят в периоде созревания и половой зрелости после пренатального стресса метеринского организма (Хожай Л.И., 2008). В отличие от результата неонатального влияния гормона стресса (КЛ), воздействие морфина было более мягким: оно не вызывало утраты из нейропиля части нейронов, тяжелых изменений нейронов в виде вакуолизации их цитоплазмы и изменения количества макроглиоцитов.
В развитии дофаминергической системы принимает участие большое количество активных факторов (факторы роста, нейротропины, глиальные нейротрофические факторы, стероидные гормоны и т.д.), которые включаются в регуляцию развития и дифференцировки этой системы. Механизмы, лежащие в основе этих процессов сложны, комплексны и включают взаимодействия с другими факторами, стимулирующие эти процессы, а также требуют активации астроцитов. Одной из мишеней глиального нейротрофического фактора (GDNF) являются дофаминергические нейроны. Способностью вырабатывать нейронотрофические факторы обладают, преимущественно, олигодендроциты (Dai X., Lercher L.D. and Clinton P.M., 2003; Wilkins A, Majed H and Layfield R., 2003). Не исключено, что обнаруженное в настоящем исследовании отсутствие активации нейроноглиального взаимодействия в большинстве отделов системы (в сравнении с интактными организмами) может быть причастной к обозначенным повреждениям нейронов дофаминергической системы.
Танскрипционные факторы недавно выделенных генов (HNF3-alfa, synaptotagmin 1 и EBF3), экспрессия которых обнаружена в ВОП и ЧВ, являются необходимыми для постмитотической дифференцировки и выживания дофаминергических нейронов (Thuret S., Bhatt L., O`Leary D.D. et al., 2004). Вполне допустимо, что влияние морфина на опиатные рецепторы и рецепторы к дофамину, расположенные на нейронах МДС, может нарушить экспрессию этих генов, оказав, тем самым непрямое влияние на дифференцировку дофаминергических нейронов и их выживание. Обнаруженное в настоящем исследовании уменьшение объема нейронов, дистрофические изменения и их отсроченная гибель вполне могут быть результатом нарушения процесса дифференцировки нейронов.
Отсутствие компенсаторной реакции нейроглиоцитов в виде усиления нейроноглиального взаимоотношения, обнаруженное в ходе настоящего исследования, согласуется с данными о подавлении опиатами роста и дифференцировки олигодендроцитов (Knapp P.E., Hauser K.F., 1996). Все виды нейроглиоцитов при перинатальном воздействии морфина усиленно осуществляли фагоцитоз поврежденных нейронов.
У половозрелых крыс при абстиненции после длительной интоксикации морфином в компактной части ЧВ, слоях III и V передней цингулярной коры и переднем ядре таламуса, напротив, был выявлен рост морфо-функциональной активности макроглиоцитов: увеличено количество олигодендроцитов и перинейрональных сателлитов, уменьшено глиальное расстояние (Должанский О.В., 2001). Причина этого разногласия, вероятно в том, что наблюдаемый рост морфо-функциональной активности соответствует наркотической абстиненции – преходящему состоянию опиатной, дофаминергической систем и некоторых других отделов мозга. Несмотря на обнаружение у микроглиоцитов опиоидных рецепторов (Dobrenis K., Makman M., Stefano G., 1995), активация морфином этих клеток, все же не вполне ясна в свете данных о разрушении их псевдоподий и утрате подвижности (Sonetti D., Ottaviani E. et al., 1997).
8. Установление реактивных изменений нейронов и степени напряженности нейроно-глиального взаимоотношения, важные для выяснения алкогольной абстинентной аддикции у человека.
Известно, что алкогольная абстинентная аддикция (тяга к спиртному в периоде алкогольной абстиненции) обусловлена сниженным количеством дофамина (преимущественно) и норадреналина в проекционных отделах МДС при алкогольной абстиненции (Rossetti Z. L. еt al., 1992). В результате дефицита этих нейромедиаторов устанавливается алкогольная мотивация, направленная на возобновление возбуждения МДС (Шабанов П.Д. и соавт., 2002).
При отравлении этанолом доля нейронов с выраженными признаками острого набухания и элементами острого тяжелого повреждения была наибольшей в исследованных подотделах МАЦДС. В слое III и, особенно, в слое V соматосенсорной коры (поле 1) доля набухших гипохромных нейронов была наименьшей (р<0,05), а признаки вакуольной дистрофии нейронов отсутствовали. Это может свидетельствовать о комбинации повреждающих факторов. V слой поля 1 лишен дофаминергических окончаний, норадренергические окончания нейронов ретикулярной формации в нем имеют низкую плотность (Bjorklund A., Lindvall O., 1984; Steward O., 2000). Этот слой имеет более густую сеть капилляров и расположен ближе к основному руслу средней мозговой артерии (Mai J.K. et al., 1998), чем III. Поэтому нейроны V слоя поля 1, главным образом, испытывают повреждающее действие этанола. Степень острого повреждения его нейронов невелика. Нейроны слоя III поля 1 имеют дофаминергические окончания. Уровень дофаминовой медиации в этом слое ниже, чем в префронтальной и цингулярной коре (Bjorklund A., Lindvall O., 1984). На нейронах этого слоя заканчивается небольшое количество норадренергических волокон (Steward O., 2000). Поэтому нейроны III слоя поля 1 испытывают повреждающее действие этанола и избыточной дофаминовой медиации. Степень острого повреждения его нейронов промежуточная. Через паранигральное ядро ВОП, медиальную часть ПЯ и прегенуальную часть слоя III поля 24б проходят катехоламинергические волокна МПП, аксоны которых образуют синапсы на нейронах этих подотделов МАЦДС (Bjorklund A., Lindvall O., 1984; Oads R.S., Halliday G.M., 1987; Steward O., 2000). Поэтому нейроны этих отделов МДС при отравлении этанолом испытывают повреждающее действие этанола и максимальное повреждающее действие избыточной катехоламинергической медиации. Нейроны дофаминергических ядер, к тому же, находятся в функциональном напряжении вследствие усиленной выработки дофамина (Оттер Л.Б., Нуманд М.Я., 1983; Анохина И.П. и соавт., 2001). Степень острого повреждения нейронов этих отделов МДС максимальная. Меньшая степень повреждения нейронов ЧВ, в сравнении с нейронами ВОП, может быть объяснена следующим. В ЧВ численная плотность норадренергических окончаний (Steward O., 2000) и астроцитов (наши экспериментальные данные) значительно ниже, чем в ВОП. Кроме того, у гигантских нейронов ЧВ наиболее развит белоксинтетический и энергетический аппарат (Hassler R., 1937; Oads R.S., Halliday G.M., 1987). Это может означать большую устойчивость нейронов ЧВ к интоксикациям и стрессу, чем нейронов ВОП. Уровень нейроно-глиального взаимоотношения, судя по количеству перинейрональных сателлитов и глиоцито-нейрональному индексу, при отравлении этанолом значительно не изменялся (р>0,05).
При алкогольной абстиненции в исследованных формациях мозга установлена значительная регрессия доли набухших гипохромных нейронов (в сравнении с их долей при отравлении; р<0.05). Степень восстановления нейронов – отношение доли набухших гипохромных нейронов при отравлении этанолом к их доле при алкогольной абстиненции – убывала в ряду: паранигральное ядро ВОП и ПЯ – поле 24, слой III поля 1 и ЧВ – слой V поля 1 (рис. 6). Распределение степени восстановления нейронов в подотделах МАЦДС при алкогольной абстиненции была близки к степени нейроно-глиального взаимоотношения (рис. 7). Коэффициент линейной корреляции между ними составил 0,96. Следовательно, уровень нейроноглиального взаимодействия определяет степень восстановления нейронов при алкогольной абстиненции. Ее уменьшение в обозначенном ряду обусловлено исходным уровнем острого повреждения исследованных формаций мозга.
Степень хронического алкогольного повреждения, оцененная по доли теневидных и пикноморфных нейронов, доли фагоцитируемых теневидных нейронов, при отравлении этанолом и алкогольной абстиненции, в сравнении с нормой (у здоровых людей) увеличена (р<0,05). Ее убыль в ряду: паранигральное ядро ВОП и ПЯ – поле 24б и слой III поля 1, как и при отравлении этанолом, может быть связана с количеством катехоламинергических волокон МПП.
Степень общего (острого и хронического) алкогольного повреждения нейронов при отравлении этанолом и алкогольной абстиненции, оцененная по доле малоповрежденных нейронов, была наибольшей в МАЦДС, особенно в ПЯ, и наименьшей – в слоях соматосенсорной коры (рис. 8).
Высокая степень сочетанного (острого и хронического) алкогольного повреждения нейронов паранигрального ядра вентральной области покрышки, прилежащего ядра и поля 24б при отравлении этанолом, а также не полное восстановление при алкогольной абстиненции их нейронов выражается низким количеством малоповрежденных нейронов в отделах системы, особенно в прилежащем ядре. Эти изменения могут выражать
![]()
![]()
![]()
![]()
![]()
![]()
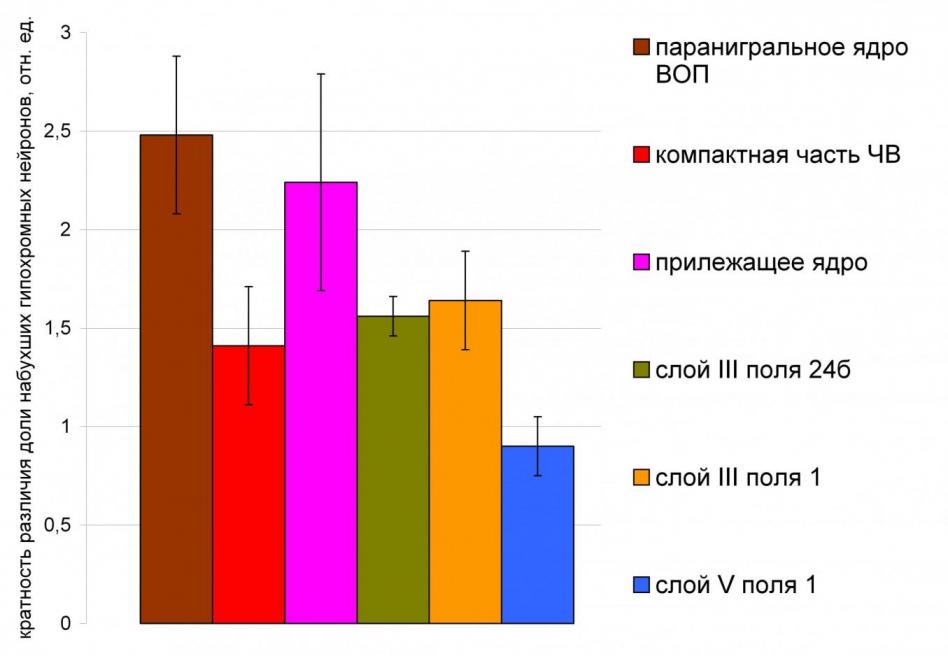
Рис. 6. Степень восстановления нейронов при алкогольной абстиненции в МАЦДС и соматосенсорной коре. Вертикальными отрезками обозначена ошибка среднего. * – различие признака с параметром в ВОП достоверно (р<0,05); ** – различие с параметрами в слое III полей 24б и 1 достоверно (р<0,05).











Норма Отравление Абстиненция
Рис. 7. Глиоцито-нейрональный индекс в МАЦДС и соматосенсорной коре при отравлении этанолом и алкогольной абстиненции. Вертикальными отрезками обозначена ошибка среднего. * – различие с параметром при условной норме достоверно (р<0,05); ** – различие параметров при отравлении и абстиненции достоверно (р<0,05)
существенное угнетение выработки дофамина и его высвобождения в проекционных отделах МДС, что, как известно, определяет алкогольную абстинентную аддикцию.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
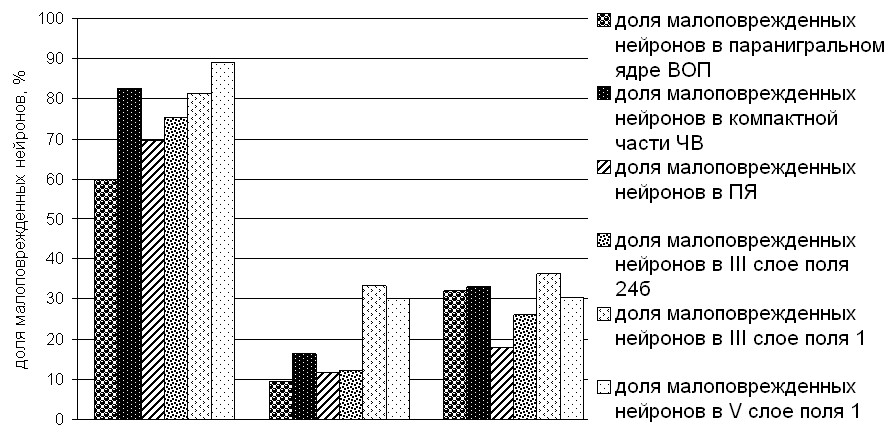
Норма Отравление Абстиненция
Рис. 8. Доля малоповрежденных нейронов МАЦДС и соматосенсорной коры при отравлении этанолом и алкогольной абстиненции на фоне хронической алкогольной интоксикации. Вертикальными отрезками обозначена ошибка среднего. * – различие в сравнении с параметрами в соматосенсорной коре при отравлении достоверны (р<0,05); ** – различие параметров при абстиненции с отравлении достоверны (р<0,05).
ВЫВОДЫ
1. Эталоном нормы для морфологической оценки воздействия на МДС повреждающих факторов могут являться ее левосторонние взаимосвязанные подотделы: переднемедиальные части паранигрального ядра вентральной области покрышки и компактной части черного вещества, середина вентромедиальной части прилежащего ядра и дофаминоцептивные слои передней лимбической коры: прегенуального поля на уровне основания передних щипцов (Сg3), супрагенуального поля (Сg2) на уровне среза прилежащего ядра у крыс и прегенуальная часть поля 24б человека. Их удобно рассматривать в подсистеме МДС – мезоаккумбоцингулярной дофаминергической системе (МАЦДС).
Полученные различия между установленными количественными и морфологическими параметрами нейронов, количеством макроглицоитов, параметрами нейроно-глиальных взаимоотношений при различных способах воздействия этанола, морфина, стресса и нормой являются информативными критериями оценки альтеративных и компенсаторно-приспособительных изменений системы.
2. Локальные изменения нейронов МАЦДС человека и высокая напряженность нейроно-глиального воаимоотношения в дофаминергических ядрах означает стертость границы между нормой и патологией, та также меньшую прочность данной системы по сравнению с корковыми полями, удаленными от источника катехоламинергических волокон.
3. Дифференцировка и программированная гибель нейронов дофаминергических ядер крыс ускорены при рождении и завершаются к началу периода половой зрелости. В проекционных отделах МАЦДС ускорение дифференцировки и гибели нейронов наблюдается через 5 сут. после рождения; дифференцировка нейронов заканчивается к началу периода половой зрелости. Программированная гибель единичных нейронов продолжается у взрослых крыс.
4. Длительное воздействие этанола на материнский организм у крыс вызывает усиление программированной гибели и уменьшение объема тел нейронов МАЦДС. Эти изменения могут определять формирование врожденной алкогольной зависимости.
5. Повреждающее воздействие алкоголя на нейроны головного мозга обусловлено комбинацией альтерирующих факторов: этанола, функционального перенапряжения нейронов дофаминергических ядер, избыточного количества катехоламинов, воздействующих на постсинаптическую мембрану.
6. Длительное воздействие этанола на головной мозг взрослых крыс определяет устойчивые компенсаторные пластические изменения тел малоповрежденных нейронов типа гипертрофических и усиление нейроно-глиального взаимоотношения в отделах МАЦДС, которые сочетаются с устойчивой алкогольной аддикцией.
7. Воздействие кортиколиберина в раннем онтогенезе у крыс индуцирует развитие морфологических признаков активации дофаминовой медиации и усиление эмоционального реагирования половозрелых крыс-самок, а воздействие белков теплового шока 70 кДа – угнетение морфо-функционального состояния МАЦДС.
8. Морфологическими признаками алкогольной абстинеции являются частичное восстановление дистрофических изменений нейронов при остром отравлении этанолом и высокая степень их повреждения при хронической алкоголизации, выражающееся низким количеством малоповрежденных нейронов в отделах МАЦДС, особенно в прилежащем ядре. Эти изменения могут определять состояние алкогольной абстинентной зависимости.
9. Усиление степени выраженности нейроно-глиального взаимоотношения представляет собой универсальную защитно-приспособительную реакцию МДС при ее развитии и различных способах воздействия этанола (кроме смертельного отравления) и раннего постнатального воздействия гормона стресса на головной мозг. Оно потенцирует дифференцировку нейронов при развитии МАЦДС в норме и при воздействии этанола, способствует формированию устойчивых измененных форм нейронов при длительном воздействии этанола и определяет регрессию признаков дистрофии нейронов при отмене этого воздействия.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Полученные оригинальные данные объемной реконструкции и топографии основных отделов и подотделов МДС у крыс могут быть использованы в качестве модели для различных морфологических и прицельных функциональных исследований данной системы (электростимуляция, фармакологическое воздействие). Наиболее информативными для морфологических и физиолого-фармакологических исследований различных видов зависимости и возможности воздействия на эту систему в МДС у человека и крыс являются: передние медиальные части паранигрального ядра вентральной области покрышки и компактной части черного вещества, середина вентромедиальной части прилежащего ядра и дофаминоцептивные слои передней лимбической коры. Их удобно рассматривать в подсистеме МДС – мезоаккумбоцингулярной дофаминергической системе (МАЦДС). Полученные количественные и морфометрические параметры нейронов и макроглиоцитов МДС у человека и крыс следует рассматривать как эталон нормы.
2. Для дифференциальной диагностики отравления этанолом, алкогольной абстиненции и хронической алкогольной интоксикации по морфологическим изменениям нейронов МАЦДС и соматосенсорной коры удобно сгруппировать признаки на:
– острые (преходящие), регрессирующие в течение 7 суток,
– постоянные (признаки хронической алкогольной интоксикации) и
– сочетанные.
Преходящие признаки, характерные для отравления этанолом:
– острое набухание, вакуольная дистрофия нейронов (наиболее выражены в ВОП, ПЯ, ПКЦ и слое III поля 1);
– отсутствие или слабая выраженность перинейронального сателлитоза;
– глиальная реакция в виде перинейронального сателлитоза, присущая
периоду алкогольной абстиненции (выражена в МАЦДС и слое III поля 1).
Постоянные:
– сморщивание пирамидных нейронов, преобладание теневидных, в том числе фагоцитируемых, и пикноморфных нейронов над популяцией малоповрежденных и гипохромных нейронов;
– высокое суммарное количество макроглиоцитов и количество
периваскулярных макроглиоцитов (особенно в слое V поля 1);
– отсутствие или регрессия перинейронального сателлитоза.
Длительность регрессии острого набухания нейронов МДС увеличивается с удлинением времени непрерывного потребления этанола.
3. Дифференциальные морфологические изменения нейронов и нейроглиоцитов МДС при хронической алкогольной и опиатной интоксикациях принципиально различаются распространенностью дегенерации (хроматофильного сморщивания) нейронов, отсутствием выраженной количественной реакции макроглиоцитов, значительным ростом фагоцитарной активности всех разновидностей нейроглиоцитов, угнетением защитно-приспособительной реакции перинейрональных сателлитов. Перечисленные явления характерны для отсроченных изменений при воздействии морфина в периоде раннего постнатального синаптогенеза МДС.
Изменения клеток МДС при экспериментальной длительной алкогольной интоксикации («в чистом виде», то есть после окончания периода абстиненции) выражаются:
– сокращением численности нейронов и вакуольной дистрофией нейронов, выраженные в паранигральном ядре ВОП (преимущественно),
– устойчивыми компенсаторными пластическими изменениями тел части нейронов дофаминергических ядер (особенно) типа гипертрофических,
– увеличением количества астроцитов и олигодендроцитов,
– уменьшение глиального расстояния и увеличение глиоцито-нейронального индекса, свидетельствующие об активации нейроно-глиальных взаимоотношений.
В соматосенсорной коре у человека при хронической алкогольной интоксикации сморщивание пирамидных нейронов и увеличение количества периваскулярных глиоцитов выражены сильнее в слое V, чем в слое III.
4. Ценностью для диагностики длительного воздействия этанола на материнский организм обладают такие признаки, выявляемые уже при рождении, как усиление программированной гибели и уменьшение объема тел нейронов МАЦДС. При наступлении половой зрелости выявлено уменьшение количества нейронов этой системы. Перечисленные изменения могут определять формирование врожденной алкогольной зависимости.
5. Для определения степени напряженности нейроно-глиальных взаимоотношений в формациях головного мозга взрослых организмов информативными критериями являются как глиальное расстояние, так и глиоцито-нейрональный индекс. При выяснении этой характеристики у новорожденных и в раннем постнатальном периоде информативным параметром является глиоцито-нейрональный индекс.
Список научных работ по теме диссертации
Статьи в рекомендованных ВАК рецензируемых журналах
1. Дробленков А.В. Особенности структуры нейроглиальных комплексов в центрах мезокортикальной дофаминергической системы крыс при воздействии белка теплового шока // Морфология. –2007. –Т. 131, вып. 3. – 67с.
2. Shabanov P.D., Lebedev A.A., Droblenkov A., Lubimov A.V. Delayed behavioral and morphological subsequences of activation of the stress-antistress system in early ontogeny in rats. // Internatiomnal Journal of Neuropsychopharmacology. –2008. –V.11. –Suppl. 1. –p. 208.
3. Дробленков А.В. Некоторые аспекты процесса генерации, осуществляемой посредством мультипотентных стволовых клеток / Печерский А.В. Печерский В.И., Асеев М.В., Дробленков А.В., Семиглазов В.Ф. // Цитология. – 2008. – Т. 50, №6. – С. 511 – 521.
4. Дробленков А.В., Карелина Н.Р., Лебедев А.А. Мезоаккумбопоясная дофаминергическая система крыс и эмоциональные функции мозга // Морфология. –2008. –Т. 134, вып. 6. –С. 84 – 89.
5. Дробленков А.В. Моделирование девиантных форм поведения введением кортиколиберина и белка теплового шока 70 кДа в раннем онтогенезе у крыс / Шабанов П.Д., Лебедев А.А., Дробленков А.В. // Наркология. –2008, №4. –С. 22 – 32.
6. Дробленков А.В. Изменение нейроглиальных комплексов мезокортиколимбической дофаминергической системы мозга при длительной алкоголизации и после ее отмены у крыс / Лебедев А.А., Дробленков А.В. // Наркология. –2008, №8. –С. 25 – 30.
7. Дробленков А.В. Структурные изменения в мезлимбической дофамин-ергической системе мозга при длительной алкоголизации крыс / Лебедев А.А., Дробленков А.В., Шабанов П.Д. // Бюллетень экспери-ментальной биологии и медицины. –2008. –Т. 146, №12. –С. 698 – 701.
8. Droblenkov A. Structural changes in Meso-corticolimbic dopaminergic system of the brain during long alcoholization in rats / Lebedev A.A., Droblenkov A., Shabanov P.D. // Bulletin of Experimental Biology and Medicine. –2008. –V.146, №6. –P. 816 – 819.
9. Дробленков А.В., Карелина Н.Р. Структурные особенности нейронов и макроглиоцитов взаимосвязанных отделов мезоаккумбоцингулярной дофаминергической системы крыс // Морфология. –2009. –Т.136, вып. 5. –С. 11 – 17.
10. Дробленков А.В., Карелина Н.Р., Шабанов П.Д. Диагностика алкогольной интоксикации по микроморфологическим изменениям нейронов и нейроглии мезоаккумбицингулярной дофаминергической системы в эксперименте // Судебно-медицинская экспертиза. –2009. –Т. 52, №6. –С. 25 – 28.
11. Дробленков А.В., Карелина Н.Р., Шабанов П.Д Изменения нейронов и глиоцитов мезоаккумбо-цингулярной системы при перинатальном воздействии морфина у крыс // Морфология. –2009. –Т. 136, вып. 6. –С. 35 – 37.
12. Дробленков А.В. Отсроченные поведенческие и морфологические последствия активации системы стресса-антистресса в раннем онтогенезе у крыс / Шабанов П.Д., Лебедев А.А., Дробленков А.В., Любимов А.А. // Экспериментальная и клиническая фармакология. –2009. –Т. 72, №6. –С. 7 – 14.
13. Дробленков А.В., Воейков И.М., Лебедев А.А., Шабанов П.Д. Структура нейронов и нейроглиоцитов взаимосвя-занных отделов мезоаккумбоцингулярной дофаминергической системы крыс // Медицинский академический журнал. –2010. –Т. 10, №1. –С. 45 – 51.
14. Дробленков А.В. Патологические изменения нейронов мезокортиколимби-ческой дофаминергической системы у здоровых людей и крыс // Морфология. –2010. –Т.136, вып. 3. –С. 11 – 17.
15. Дробленков А.В. Дифференциальная диагностика отравления этанолом, алкогольной абстиненции и хронической алкогольной интоксикации по измененииям нейронов и макроглиоцитов коры головного мозга // Судебно-медицинская экспертиза. –2010. –Т. 53, №4. –С. 28 – 32.
Другие работы, опубликованные по теме диссертации
1. Дробленков А.В. Краткий микроскопический атлас ядерных и корковых центров мезокортиколимбической и некоторых других дофаминергических систем головного мозга крысы / Под ред. проф. Н.Р.Карелиной. –СПб., СПбГПМА. –2006. –37с.
2. Дробленков А.В., Григорьева Е., Копытенко Н. Морфологические особенности поясных центров крыс и их влияние на поведенческие реакции // Материалы Всероссийской науч. конф. с междун. участ. «Актуальные вопросы прикладной анатомии и хирургии» по вопросам прикладной анатомии и хирургии». –СПб., 24 апреля 2007 г. –С. 33 – 35.
3. Droblenkov A. Some aspects of the regeneration and carcinogenesis / Pechersky A., Pechersky V., Aseev M., Droblenkov A., Semiglazov V. // Russian academy of natural sciences. International Academy of Authors of Scientific Discoveries and Inventions. –Moskow, Russia. –2007. –103p.
4. Droblenkov A. The influence of breach down of regeneration among people of older age groups on development of carcinogenesis / Pechersky A., Pechersky V., Aseev M., Droblenkov A., Semiglazov V. // The joint meeting of the 4-th ISC International Conference on Cancer Theraputics and The 7-th Princess Margaret Hospital Conference: New Developments in Cancer Ma-nagement. –Toronto, Ontario, Canada. –2007. –p. 25.
5. Дробленков А.В. Последствия модуляции систем стресса-антистресса введением кортиколиберина и белков теплового шока 70 кДа в раннем онтогенезе, оцененные по поведению и состоянию нейронов в лимбических структурах мозга половозрелых крыс / Шабанов П.Д., Лебедев А.А., Дробленков А.В. // Психофармакология и биологическая наркология. – 2007. –Т. 7, №3-4. –С. 2158 – 2178.
6. Droblenkov A. Early ontology stress with CRF involvement modulates behavioral responses in adult rats / Lebedev A.A., Droblenkov A., Lubimov A.V., Shabanov P.D. // Multidisciplinary International Neuroscience and Biological Psychiatry Conference “Stress and Behavior”. –St-Petersburg. – 2008. –р. 55. 7. Дробленков А.В. Последствия введения кортиколиберина и белков теплового шока 70 кДа в раннем онтогенезе у крыс / Лебедев А.А., Дробленков А.В., Любимов А.В., Шабанов П.Д. // Психофармакология и биологическая наркология. –2008. –Т.8, №1-2. –С. 2368 – 2369.
8. Дробленков А.В., Лебедев А.А., Шабанов П.Д. Структурные изменения в мезокортиколимбической дофаминергической системе мозга при длительной алкоголизации крыс // Психофармакология и биологическая наркология. – 2008. –Т.8, №1-2. –С. 2362 – 2363.
9. Дробленков А.В., Лебедев А.А., Шабанов П.Д. Реакция клеток мезокортиколимбической дофаминергической системы мозга на длительную алкоголизацию у крыс // Психофармакология и биологическая наркология. –2008. –Т.8, №4. –С. 2453 – 2456.
10. Droblenkov A. The role of breach down of regeneration among men of older age groups in development of androgen deficiency / Pechersky A., Pechersky V., Aseev M., Droblenkov A., Semiglazov V. // 1-st World Congress on Controversies on Urology. –Barselona, Spain. –2008. –46р.
11. Дробленков А.В., Карелина Н.Р., Шабанов П.Д. Формирование алкогольной зависимости и изменения нейроглиальных комплексов мезоаккумбопоясной дфаминергической системы // Вопр. морфологии ХХI века. Вып.1.–СПб, изд-во ДЕАН. –2008. –С. 124 – 129.
12. Дробленков А.В., Абрамова Т.Г. Алгоритм судебно-гистоло-гической диагностики сос-тояний печени при хронических алкогольной и наркотической интоксикациях // Труды Всероссийской науч.-пр. конф., посв. 90-летию ГУЗ «БСМЭ СПб». –СПб. –2008. –С. 414 – 418.
13. Дробленков А.В. Поведенческие эффекты пептидных препаратов кортексина и ноопепта при модуляции систем стресса-антистресса в раннем онтогенезе / Шабанов П.Д., Лебедев А.А., Дробленков А.В. // Пептидные нейропротекторы / Ред. М.М.Дьяконов и А.А.Каменский. –СПб., Наука. –2009. –С. 217 – 237.
14. Дробленков А.В. Отдаленные последствия модуляции центральных систем стресса-антистресса в раннем онтогенезе у крыс / Лебедев А.А., Шабанов П.Д., Дробленков А.В. // Психонейроэндокринология. Ред. проф. П.Д. Шабанов и проф. Н.С. Сапронов. –СПб., Информ-Навигатор. –2010. –С. 133 – 162
15. Дробленков А.В. Дифференциальная диагностика отравления этанолом и хронической алкогольной интоксикации по изменениям внутренних органов // Материалы Всероссийской науч.-пр. конф. «Актуальные вопросы судебно-медицинской экспертизы». –Москва, РЦСМЭ. –2010. –С. 55 – 57.
СПИСОК СОКРАЩЕНИЙ
БТШ – белки теплового шока 70 кДа.
ВОП – вентральная область покрышки.
КЛ – кортиколиберин.
МАЦДС – мезоаккумбоцингулярная дофаминергическая система (подсистема МДС).
МДС – мезокортиколимбическая дофаминергическая система.
МПП – медиальный пучок переднего мозга.
ПАВ – психоактивные вещества.
ПФК – префронтальная кора (поля 9,10,46 Бродмана у человека, Cg1,2,3 у крыс).
ПЦК – передняя цингулярная кора (поле 24б у челвека, Cg1,2,3 у крыс).
ПЯ – прилежащее ядро.
ЧВ – черное вещество.
Сg2 – супрагенуальное цингулярное поле у крыс.
Cg3 – прегенуальное цингулярное поле у крыс.
GFAP – глиальный фибриллярный кислый белок астроцитов.

