Патогенетические механизмы хронической алкогольной миопатии
На правах рукописи
Казанцева
Юлия Владимировна
ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ХРОНИЧЕСКОЙ АЛКОГОЛЬНОЙ МИОПАТИИ
14.01.11 – Нервные болезни
03.03.01 - Физиология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва
2011
Работа выполнена в ГОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова.
Научные руководители:
доктор медицинских наук Зиновьева Ольга Евгеньевна
доктор биологических наук, профессор Шенкман Борис Стивович
Официальные оппоненты:
доктор медицинских наук, профессор Меркулова Дина Мироновна
доктор медицинских наук Умрюхин Павел Евгеньевич
Ведущая организация:
Учреждение Российской академии медицинских наук Научный центр неврологии РАМН.
Защита диссертации состоится «_____»__________________ 2011 г. в «_____» часов на заседании Диссертационного Совета Д.208.040.07 при ГОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова (119991, Москва, ул. Трубецкая д.8, стр. 2).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова (117998, Москва, Нахимовский проспект, д. 49).
Автореферат разослан «_____»____________________2011 г.
Ученый секретарь
Диссертационного Совета
доктор медицинских наук,
профессор Дамулин Игорь Владимирович
Общая характеристика работы
Актуальность темы
Хроническая алкогольная миопатия (ХАМ) является одним из частых проявлений алкогольной болезни, и, по данным ряда авторов, встречается у пациентов с хронической этаноловой интоксикацией в 40-60% случаев [Preedy V.R. et al, 2001, 2003]. Клинические симптомы в виде нижнего проксимального парапареза в сочетании с гипотрофией мышц нижних конечностей приводят к нарушению ходьбы и последующей инвалидизации пациентов, что делает изучение данной проблемы актуальным как с медицинской, так и социальной точки зрения.
В настоящее время патогенез ХАМ остается до конца неизученным. В качестве причин возникновения данного состояния рассматриваются глубокие многоуровневые нарушения ростовых и синтетических процессов в мышцах [Wassif W.S. et al, 1993; Reilly M.E. et al, 1998; Ronis M.J. et al, 2007]. Определяющим механизмом их развития, вероятно, является снижение синтеза белка в мышечных волокнах, обусловленное, в первую очередь, снижением интенсивности трансляционных процессов на рибосомах. Скорость трансляции снижается как после острой алкогольной интоксикации, так и на фоне хронического потребления алкоголя [Lang C.H. et al, 2004; Vargas R. et al, 2008]. Развитие ХАМ не зависит от наличия алкогольной полиневропатии, алкогольного поражения печени, полидефицитарных состояний, гормональных нарушений и напрямую не связано с процессами апоптоза [Mills K.R. et al, 1986; Fernandez-Sola J. et al, 1998]. В то же время ХАМ может сочетаться с другими проявлениями алкогольной болезни [Martin F. et al, 1985; Peng M.C. et al, 1991].
В настоящее время не разработан алгоритм диагностики и методы патогенетически обоснованной терапии данного состояния. Показано, что при длительной алкогольной интоксикации поражение скелетных мышц имеет прогредиентный характер. В случаях ХАМ даже через 5 лет после отмены алкоголя не происходит регресса клинических и морфологических признаков заболевания [Estruch R. et al, 1998]. Полученные данные указывают на необходимость ранней, по возможности субклинической диагностики ХАМ. Актуальным является изучение роли различных патогенетических механизмов в развитии ХАМ с целью разработки алгоритма диагностики и коррекции выявленных нарушений.
Цель исследования
Изучить системные и клеточные параметры, определяющие патогенетические механизмы развития хронической алкогольной миопатии.
Задачи исследования
- проанализировать клинические проявления миопатического синдрома у пациентов с хронической алкогольной интоксикацией;
- изучить состояние ростовых гуморальных факторов роста (инсулиноподобный фактор роста I) при алкогольной миопатии;
- оценить состояние регенераторного потенциала волокон скелетной мышцы при хронической алкогольной миопатии;
- разработать новые подходы к диагностике повреждения мышц при хронической алкогольной интоксикации.
Научная новизна
Впервые проведена комплексная диагностика ХАМ, включающая клиническое, биохимическое, электромиографическое, морфологическое и иммуногистохимическое обследование пациентов с длительной алкогольной интоксикацией.
Изучена инициирующая роль процессов нарушения синтеза белка в патогенезе ХАМ. В качестве маркера системного нарушения белкового синтеза выявлена значимость инсулиноподобного фактора роста I (IGF-I). Впервые отмечено уменьшение числа миоядер и сателлитных клеток у пациентов с морфологически подтвержденной атрофией мышечных волокон. Впервые выявлено снижение уровня экспрессии и содержания активной формы (по уровню фосфорилирования) основных внутриклеточных маркеров белкового синтеза на стадии предшествующей морфологическим изменениям.
Впервые на биологической модели алкогольной миопатии показано влияние лейцин-содержащей аминокислотной смеси на темп увеличения ППС быстрых мышечных волокон в восстановительном периоде после отмены алкоголя.
Практическая значимость работы
В работе изучена распространенность ХАМ у лиц, злоупотребляющих спиртными напитками. Показана необходимость использования в диагностике ХАМ комплекса биохимических, морфологических и иммуногистохимических методов в виду малой информативности рутинного клинического и электромиографического обследования. В качестве скринингового метода диагностики ХАМ предложено определение концентрации в плазме крови инсулиноподобного фактора роста I в плазме крови больных, являющегося маркером нарушения белкового синтеза. На экспериментальной модели животных показана роль лейцин-содержащей аминокислотной смеси в процессе восстановления атрофированных мышечных волокон.
Положения, выносимые на защиту
- Хроническая алкогольная миопатия является частым проявлением алкогольной болезни, протекающим независимо от алкогольной полиневропатии.
- Морфологическую основу ХАМ составляет прогредиентно текущий атрофический процесс в скелетных мышцах, развивающийся вследствие нарушения синтеза белка.
- С целью диагностики ХАМ необходимо проведение морфологических, иммуногистохимических и биохимических исследований скелетных мышц.
- Использование аминокислотных смесей ускоряет процессы восстановления скелетных мышц у предварительно алкоголизированных лабораторных животных.
Апробация работы
Диссертационная работа была апробирована и рекомендована к защите на совместном заседании кафедры нервных болезней лечебного факультета Первого МГМУ им. И.М. Сеченова и лаборатории миологии ГНЦ РФ Института медико-биологических проблем РАН 21.09.2010 г.
Основные положения и результаты исследования докладывались и обсуждались на VIII Конференции молодых ученых, специалистов и студентов, посвященной Дню космонавтики (Москва, 2009); 13-й Конгрессе Европейской федерации неврологических обществ (Флоренция, 2009); XXXIX Европейской мышечной конференции (Падуя, 2010).
Публикации
По теме диссертации опубликовано 11 научных работ, из них 4 статьи в журналах, рекомендованных ВАК РФ.
Объем и структура работы
Диссертация изложена на 104 страницах машинописного текста; состоит из введения, обзора литературы, 6 глав, выводов и списка литературы, содержащего 15 отечественных и 107 зарубежных источников. Диссертация иллюстрирована 9 таблицами и 13 рисунками.
Содержание работы
Общая характеристика больных
Обследовано 42 пациента с длительной алкогольной интоксикацией: 30 мужчин и 12 женщин, в возрасте от 29 до 69 лет, проходивших стационарное лечение в Клинике нервных болезней им. А.Я Кожевникова (база кафедры) в период с 2008 по 2010гг. Средний возраст составил 45,9±1,5 лет. Средняя толерантность к алкоголю составила 184,5±12,2 мл этанола, минимальная – 50 мл, максимальная - 400 мл. Длительность приема алкоголя варьировала от 4 до 38 лет, средняя длительность составила - 16,6±1,5 лет.
Основными жалобами пациентов были слабость в проксимальных отделах ног и чувство онемения в стопах и голенях. 18 (42,9%) обследованных предъявляли жалобы на слабость в ногах (преимущественно в мышцах бедер и тазового пояса) и связанные с ней затруднения при ходьбе по лестнице, вставании с низкого стула, с пола. Большинство из них - 11, отмечали трудности при пользовании общественным транспортом (необходимость помогать себе руками при подъеме на ступеньку), ходьбе на длительные расстояния; 7 были вынуждены пользоваться средствами дополнительной опоры. У 30 (71,4%) больных отмечалось чувство онемения в дистальных отделах ног, сопровождавшееся ощущениями “ползания мурашек”, покалываниями различной степени интенсивности, усиливающимися в ночное время. У 13 из них эта симптоматика наблюдалась и в руках. При клиническом осмотре мышечная слабость в виде нижнего вялого проксимального парапареза разной степени выраженности определялась у 20 (47,6%) пациентов, у 8 из них он сочетался с дистальным парезом. У 5 (11,9%) обследованных был выявлен проксимальный тетрапарез со снижением мышечной силы в руках до 3,5-4 баллов. У 33 (78,6%) больных выявлялся полиневропатический тип расстройств чувствительности. У 24 (57,1%) обследованных отмечались клинические проявления сенситивной атаксии, симптомы мозжечковой атаксии - у 16 (38,1%), в 31% случаев определялось их сочетание. Практически у всех больных выявлялись вегетативные реакции в виде дистального гипергидроза и изменения окраски кожных покровов.
Всем больным была проведена открытая биопсия мышцы бедра (m.quadriceps femoris (vastus lateralis) с последующим морфологическим и иммуногистохимическим исследованием биоптатов. На основании полученных при морфометрии данных все пациенты были разделены на две группы. В первую группу (основная группа) вошли пациенты с морфологически подтвержденной атрофией мышечных волокон. Вторую группу (группа сравнения) составили пациенты без морфологически подтвержденной атрофии мышечных волокон. С целью анализа выраженности атрофического процесса в группе пациентов с атрофией мышечных волокон были выделены две подгруппы: с атрофией только волокон II типа (1А) и с атрофией волокон как I, так и II типов (1Б).
Методы исследования
Клинико-неврологическое обследование проводилось по общепринятой схеме: выявление жалоб, анамнеза, с оценкой стадии алкоголизма, и исследование неврологического статуса.
Лабораторные исследования включали общий анализ крови и мочи, биохимический анализ крови (билирубин, общий белок, холестерин, АСТ, АЛТ, Г-ГТ, ЩФ, КФК, глюкоза), исследование содержания в крови инсулиноподобного фактора роста I методом иммуноферментного анализа.
Методом игольчатой миографии исследовались латеральная головка четырехглавой мышцы бедра (m.quadriceps femoris (vastus lateralis) и передняя большеберцовая мышца (m.tibialis anterior) с определением параметров ПДДЕ и оценкой спонтанной активности. В каждой мышце регистрировалось не менее 20 ПДЕ. Определялись средняя длительность и амплитуда ПДЕ, количество полифазных и псевдополифазных ПДЕ (%). Результаты игольчатой ЭМГ оценивались на основе сравнения с возрастной нормой для исследованных мышц.
Иммуногистохимические и биохимические исследования биоптатов скелетных мышц проводились в лаборатории миологии ГНЦ РФ Института медико-биологических проблем РАН - заведующий лабораторией д.б.н., профессор, Шенкман Борис Стивович.
Образцы мышечной ткани были получены из латеральной головки четырехглавой мышцы бедра (m.quadriceps femoris (vastus lateralis) путем открытой биопсии под местной анестезией 1% раствором новокаина, сразу заморожены в жидком азоте и хранились при температуре -80С до обработки.
С помощью морфометрии измерялись площади поперечного сечения волокон I (медленные с аэробным типом метаболизма) и II типов (быстрые гликолитические и окислительно-гликолитические волокна). Полученные результаты оценивались в сравнении со средними значениями морфометрических показателей здоровых лиц [Staron R.S. et al, 2000]. Уменьшение площади поперечного сечения мышечных волокон II типа менее 4000 мкм2 у мужчин и менее 3500 мкм2 у женщин считалось критерием включения пациентов в группу с морфологически подтвержденной атрофией скелетной мышцы. Наличие в биоптате мышечного волокна зон некроза и/или воспалительной инфильтрации служило критерием исключения пациента из исследования.
Проводилась оценка количества мышечных ядер. Для этого подсчитывалось количество МВ и число миоядер в них, а затем рассчитывалось миоядерное число - количество ядер на один поперечный срез МВ. Для идентификации собственных ядер МВ (миоядер) волокна контурировали антителами к субсарколеммальному белку дистрофину. Все ядра, находящиеся в пределах области, ограниченной продуктами иммуногистохимической реакции, считали миоядрами. Анализировали не менее 100 мышечных волокон (МВ).
Для выявления сателлитных клеток (клетки-предшественники миоядер) проводилось окрашивание на М-кадгерин. Считали число меченных М-кадгерином ядер (ядер сателлитных клеток) на одно мышечное волокно. Анализировали все волокна на срезе.
Методом электрофореза и вестерн-блоттинга оценивались уровень экспрессии и уровень фософорилирования основных сигнальных молекул белкового синтеза - рибосомальных киназ P70 S6K и P90 RSK.
Для контроля результатов морфологического, иммуногистохимического и биохимического исследований была набрана группа, состоящая из 5 здоровых добровольцев - мужчин в возрасте от 32 до 49 лет, средний возраст составил 39±2,4 года. Всем добровольцам проводилось обследование, включавшее клинический осмотр, общий анализ и биохимический анализ крови, определение IGF-I в плазме крови, инцизионная биопсия m.quadriceps femoris (vastus lateralis) с последующим морфологическим, иммуногистохимическим и биохимическим исследованием.
Обработка полученных данных проводилась с использованием методов медицинской статистики на персональном компьютере с помощью программы SPSS 17.0. Все статистические сравнения проводились на уровне значимости 95% (р<0,05).
Результаты исследования
Сравнительный анализ пациентов группы с атрофией мышечных волокон(1 группа) и без атрофии мышечных волокон (2 группа)
При сравнении обеих групп установлено, что пациенты второй группы были моложе и имели меньшую длительность алкогольного анамнеза (Таблица 1).
Таблица 1.
Общая характеристика пациентов исследуемых групп
| Группа с атрофией (1), n=36 | Группа без атрофии (2), n=6 | |
| Средний возраст (лет), М±m | 46,7±1,6 | 41,2±1,8* |
| Половой состав (мужчины / женщины), (%) | 67 / 33 | 100 / 0 |
| Толерантность к алкоголю, мл этанола, М±m | 181,9 ±11,1 | 200±57,7 |
| Длительность приема алкоголя (лет), М±m | 17,5±1,7 | 9,6±1,6* |
*- р0,05 при сравнении 1-2
Достоверных отличий по объему потребляемого алкоголя между первой и второй группами получено не было. Оценка жалоб пациентов показала, что 50% пациентов из группы с морфологически подтвержденной атрофией предъявляла жалобы на слабость в проксимальных отделах ног, в отличие от группы без атрофии, в которой таких жалоб не предъявлял никто. Анализ клинических проявлений показал, что в группе пациентов с морфологически подтвержденной атрофией мышечных волокон часто встречались основные проявления ХАМ, такие как слабость в мышцах тазового и/или плечевого пояса (55,6%), гипотрофии мышц конечностей (27,8%). Полиневропатический синдром в виде хронической дистальной преимущественно сенсорной полиневропатии выявлялся у подавляющего большинства пациентов как в основной группе (80,6%), так и в группе сравнения (66,7%).
Сравнительный анализ пациентов подгрупп с атрофией только волокон II типа и с атрофией волокон как I, так и II типов
Сравнительный анализ показал, что подгруппы были сопоставимы по возрасту и объему потребляемого этанола в сутки (Таблица 2).
Таблица 2.
Общая характеристика пациентов с атрофией только волокон II типа (1А) и атрофией волокон как I, так и II типов (1Б)
| 1А (1), n=20 | 1Б (2), n=16 | |
| Средний возраст (лет), М±m | 44,1±2,3 | 49,9±2,1 |
| Половой состав (мужчины / женщины), (%) | 60 / 40 | 75 / 25 |
| Толерантность к алкоголю, мл этанола, М±m | 188,5±15,9 | 173,8±15,6 |
| Длительность приема алкоголя (лет), М±m | 14,6±2 | 21,3±2,6* |
*- р0,05 при сравнении 1-2
Достоверным было отличие по длительности алкогольного анамнеза - большим он был у пациентов с морфологически подтвержденной атрофией волокон как I, так и II типов. Статистически значимых отличий между подгруппами при анализе жалоб и основных клинических проявлений получено не было.
При анализе морфологических данных выявлена зависимость выраженности атрофического процесса от длительности алкогольного анамнеза (R=0,398, р<0,05), то есть наиболее длительному периоду приема алкоголя соответствовали наиболее выраженные атрофические изменения скелетных мышц (Рисунок 1). Так, в группе больных без морфологически подтвержденной атрофии мышечных волокон длительность алкогольного анамнеза составила 9,6±1,6 лет; в подгруппе с атрофией только волокон II типа – 14,6±2 года; в подгруппе с атрофией волокон как I, так и II типов – 21,3±2,6 лет.
Рисунок 1.
Длительность алкогольного анамнеза в подгруппах c атрофией только волокон II типа и атрофией волокон как I, так и II типов
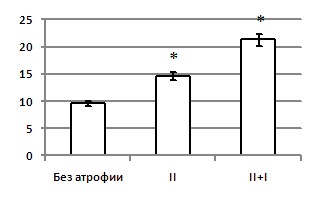
*- р0,05
Анализ группы с атрофией мышечных волокон с учетом гендерного фактора
Стоит отметить, что все женщины, участвовавшие в исследовании, вошли в данную группу (с морфологически подтвержденной атрофией мышечных волокон).
Сравнительный анализ показал, что мужчины и женщины с хронической алкогольной интоксикацией были сопоставимы по возрасту и объему потребляемого этанола в сутки (Таблица 3). Группы достоверно отличались по длительности алкогольного анамнеза - меньшим он был у лиц женского пола.
Таблица 3.
Общая характеристика пациентов группы с морфологически подтвержденной атрофией мышечных волокон с учетом пола
| Мужчины (1), n=24 | Женщины (2), n=12 | |
| Средний возраст (лет), М±m | 47,7±2 | 44,8±2,8 |
| Толерантность к алкоголю, мл этанола, М±m | 179,2±11,7 | 187,5±24,7 |
| Длительность приема алкоголя (лет), М±m | 19,8±2,1 | 12,9±2,5* |
*- р0,05 при сравнении 1-2
Жалобы на слабость в проксимальных отделах ног с одинаковой частотой отмечались в обеих группах - в 50% случаев в одной и другой группе. У женщин чаще отмечались жалобы на онемение в стопах и голенях: 100%, против 62,5% у мужчин, - характерные для дистальной полиневропатии. Анализ клинических проявлений показал, что нижний проксимальный парапарез встречается у мужчин и женщин одинаково часто - 58,3% и 50% соответственно. Однако у женщин чаще наблюдается более распространенный двигательный дефект в виде проксимального тетрапареза - 25%, у мужчин - 8,3%. Также у них более часто выявляются чувствительные нарушения, характерные для дистальной полиневропатии - 100%, против 70,8% у мужчин.
Результаты электромиографического исследования
При проведении игольчатой ЭМГ во всех исследованных мышцах выявлено уменьшение средней длительности потенциалов двигательных единиц (ПДДЕ) в сочетании с увеличением их средней и максимальной амплитуд, а также числа полифазных и псевдополифазных ПДДЕ. Полученные изменения показателей игольчатой ЭМГ могут указывать на сочетанный невральный (аксональный) и мышечный уровни поражения. Классический миопатический паттерн не выявлен. При сравнительной оценке показателей ЭМГ в группах пациентов с морфологически подтвержденной атрофией мышечных волокон и без не выявлено достоверных отличий ни по одному из показателей.
Результаты биохимического анализа крови (КФК, АСТ, АЛТ, Г-ГТ) и исследования концентрации IGF-I в плазме крови
При оценке показателей биохимического анализа крови у всех обследованных пациентов в целом выявлено незначительное повышение уровня печеночных трансаминаз и увеличение уровня Г-ГТ в 3 раза по сравнению с нормой, что, вероятно, свидетельствует о длительном токсическом воздействии этанола и его метаболитов на функцию печени. Уровень КФК находился в пределах нормы у всех больных, что согласуется с данными других исследований, посвященных механизмам развития ХАМ [Preedy V.R. et al, 1990, 1994].
Оценка концентрации IGF-I в плазме крови выявила ее уменьшение в группе с морфологически подтвержденной атрофией мышечных волокон по сравнению с группой без атрофии. Также было выявлено достоверное снижение при сравнении пациентов с хронической алкогольной интоксикацией с контрольной группой. При сравнительной оценке этого показателя в подгруппах пациентов с атрофией только волокон II типа (1А) и с атрофией волокон как I, так и II типов (1Б) не выявлено достоверных отличий (Таблица 4).
Таблица 4.
Показатели IGF-I в плазме крови обследованных пациентов
| IGF-I, нг/мл (N 81-225) | |
| Первая группа (1), n=36 | 100,4±5,7 |
| 1А подгруппа (2), n=20 | 94,8±7 |
| 1Б подгруппа (3), n=16 | 106,3±9,2 |
| Вторая группа (4), n=6 | 143,3±15,7* |
| Контроль (5), n=5 | 216±63,6** |
*- р0,05 при сравнении 1-4
**- р0,01 при сравнении 1,2,3,4-5
Анализ миоядер и клеток-миосателлитов
Анализ данных о количестве миоядер, приходящихся на один поперечный срез МВ показал, что в группе пациентов с морфологически подтвержденной атрофией мышечных волокон этот показатель достоверно меньше, чем в группе пациентов без атрофии: 1,5±0,1 и 2,6±0,2 соответственно. Различий между подгруппами пациентов с атрофией только волокон II типа и с атрофией волокон как I, так и II типов получено не было: 1,4±0,1 и 1,2±0,1 соответственно.
Количество сателлитных клеток, приходящихся на поперечный срез мышечного волокна, в группе пациентов с морфологически подтвержденной атрофией мышечных волокон составило 0,187±0,03, что достоверно меньше чем в группе без морфологически подтвержденной атрофии (0,261±0,01). Различий между подгруппами пациентов с атрофией только волокон II типа и с атрофией волокон как I, так и II типов получено не было: 0,189±0,01 и 1,185±0,02 соответственно.
Результаты определения общего количества рибосомальных киназ P70 S6K и P90 RSK
Оценивалось общее содержание рибосомальных киназ P70 S6K и P90 RSK по уровню экспрессии и содержанию активной формы (уровню фосфорилирования) в следующих группах и подгруппах пациентов: контроль, без морфологически подтвержденной атрофии мышечных волокон, с атрофией только волокон II типа и с атрофией волокон как I, так и II типов. Выявлено достоверное снижение относительно контроля, как уровня экспрессии, так и фосфорилирования киназ P70 S6K и P90 RSK. Определение общего количества рибосомальных киназ P70 S6K и P90 RSK, как наиболее значимых внутриклеточных звеньев белкового синтеза, впервые в клиническом исследовании выявило снижение их экспрессии и фосфорилирования по сравнению с группой контроля. Особого внимания заслуживает тот факт, что снижение этих показателей отмечалось и в группе пациентов без атрофических изменений скелетных мышц.
Эксперимент с алкоголизацией лабораторных животных
Эксперимент проводился на базе лаборатории миологии ГНЦ РФ Института медико-биологических проблем РАН - заведующий лабораторией д.б.н., профессор, Шенкман Борис Стивович.
В эксперименте использовались самцы крыс линии Wistar. Животные содержались в стандартных виварных условиях по 5 особей в клетке, никаких ограничений в корме и воде не было. Первые 16 недель все группы кроме контроля получали алкоголь с пищей (Рисунок 2).
Рисунок 2.
Схема эксперимента
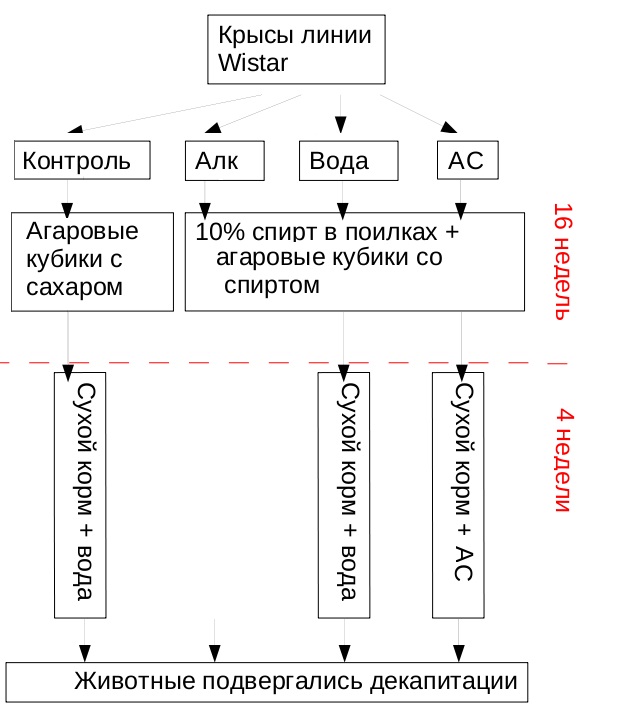
Контроль - группа животных, не получавших спирт
Алк - группа животных, получавшая спирт в течение 16 недель
Вода - группа животных, получавшая спирт в течение 16 недель, а затем, в течение 4-х недель сухой корм и воду
АС - группа животных, получавшая спирт в течение 16 недель, а затем, в течение 4-х недель сухой корм и аминокислотные смеси, содержащии L-лейцин – 1000 мг, L-глутамин – 1000 мг, L-изолейцин – 600 мг, L-валин – 600 мг, 5-метил-7-метоксиизофлавон – 200 мг, витамин С – 200 мг, витамин В6 – 10 мг
Кроме того, что спирт содержался в поилках, животные получали агаровые кубики, также содержавшие спирт. Контрольная группа получала агаровые кубики с эквивалентным (по калориям) содержанием сахара. Через 16 недель все группы перестали получать спирт, а контрольная группа — сахар. Животные группы «Алк» были забиты с помощью декапитации, у них была взята m. gastrocnemius. После 16 недель алкоголизации, кроме стандартного рациона для грызунов, группа «АС» получала аминокислотные смеси, обогащенные лейцином. Через 4 недели все животные были декапитированы, у них была выделена m. gastrocnemius.
Результаты
После 16 недель приема алкоголя проведенное морфометрическое исследование выявило достоверное уменьшение ППС быстрых волокон на 32%. Атрофии медленных волокон вследствие приема алкоголя у крыс не наблюдалось. В группе лабораторных животных, которые в течение 4 недель после отмены алкоголя получали только сухой корм и воду, не отмечалось достоверного увеличения размеров мышечных волокон. В то же время применение лейцин-содержащих аминокислотных коктейлей у крыс в период восстановления приводило к достоверному увеличению размеров быстрых волокон. За 4 недели восстановления с применением АС ППС быстрых волокон увеличивалась в 1,7 раза, имелась также тенденция к увеличению размеров медленных волокон.
Обсуждение
Целью настоящего исследования было изучение системных и клеточных параметров, определяющих патогенетические механизмы развития хронической алкогольной миопатии. В соответствии с поставленными задачами выполнено комплексное (клиническое, биохимическое, нейрофизиологическое, морфологическое и иммуногистохимическое) обследование 42 больных, длительное время злоупотребляющих алкогольными напитками. Контрольную группу составили пять здоровых добровольцев, сопоставимых по возрасту.
При анализе клинических проявлений выявлена частая встречаемость нервно-мышечных нарушений в виде полиневропатического синдрома и ХАМ во всех группах пациентов. ХАМ находится на втором месте по распространенности, что согласуется с данными литературы [Sacanella E. et al, 1995].
Характерными клиническими проявлениями ХАМ у обследованных пациентов являлись проксимальная мышечная слабость и похудание мышц. В 79% случаев ХАМ сопутствовали симптомы алкогольной полиневропатии. Эти проявления алкогольной болезни развиваются независимо друг от друга, но могут и сочетаться [Mills K.R. et al, 1986].
С учетом результатов морфометрии все пациенты были разделены на две группы: с морфологически подтвержденной атрофией мышечных волокон (основная группа - 36 пациентов) и без морфологически подтвержденной атрофии мышечных волокон (группа сравнения – 6 пациентов). В основной группе у 20 (56%) пациентов при морфометрическом исследовании была выявлена атрофия только волокон II типа, а у 16 (44%) - атрофия волокон как I, так и II типов. У обследованных пациентов гипотрофия обоих типов мышечных волокон встречается чаще, чем по данным литературы, что, вероятно, связано с тяжелым стационарным контингентом обследованных больных и длительным алкогольным анамнезом.
Выявлена зависимость выраженности атрофического процесса в мышцах от длительности злоупотребления алкоголем. Сочетанная атрофия мышечных волокон I и II типа определялась у пациентов с самым длительным периодом алкоголизации. Так, в группе больных без морфологически подтвержденной атрофии мышечных волокон (группа сравнения) длительность алкогольного анамнеза составила 9,6±1,6 лет; в подгруппе с атрофией только волокон II типа – 14,6±2 года; в подгруппе с атрофией волокон как I, так и II типов – 21,3±2,6 лет. Полученные результаты подтверждают литературные данные, указывающие на прогредиентный характер течения ХАМ [Estruch R., 1998].
Клинико-морфологический анализ показал, что у пациентов с морфологически подтвержденной атрофией мышечных волокон отмечались клинические проявления ХАМ в виде слабости и гипотрофии мышц тазового пояса и бедер. Так в основной группе у 20 (55,6%) пациентов выявлялась проксимальная слабость в ногах разной степени выраженности, в то время, как в группе без атрофии ни у одного из больных не отмечалось снижения мышечной силы в мышцах бедер и тазового пояса. В подгруппах с изолированной атрофией волокон II типа и с атрофией волокон обоих типов выявлена тенденция к прогрессированию проксимального пареза, однако различия между подгруппами были недостоверными. В 1А подгруппе нижний проксимальный парапарез выявлялся у 50% больных, в 1Б подгруппе - у 62,5%. Обращает внимание, что более грубый и распространенный двигательный дефект отмечался у пациентов с атрофией волокон обоих типов. В целом, клинические проявления поражения скелетных мышц у пациентов с ХАМ соответствовали выраженности атрофического процесса в них.
Проведен анализ группы пациентов с морфологически подтвержденной атрофией скелетных мышц с учетом гендерного фактора. Установлено, что атрофический процесс в мышцах у женщин развивается достоверно чаще и при меньшей длительности алкогольной интоксикации, что указывает на большую чувствительность лиц женского пола к действию этанола и его метаболитов. К тому же, по мнению ряда авторов, патогенетические механизмы развития ХАМ у женщин отличаются от таковых у мужчин [Lang C.H. et al, 2007]. Предполагают большую значимость у них процессов протеолиза, что, возможно, вносит свой вклад в более раннее развитие атрофии мышечных волокон. Оценка клинических проявлений с учетом пола пациентов показала, что частота встречаемости основных симптомов ХАМ практически не отличается у мужчин и женщин. Однако у последних отмечалась большая выраженность неврологического дефицита в виде более глубокой степени пареза и более частого вовлечения в патологический процесс мышц плечевого пояса.
Оценка основных звеньев регуляции синтеза белка в скелетной мышце выявила нарушение на всех уровнях регуляции. В группе пациентов с морфологически подтвержденной атрофией мышечных волокон определялось статистически достоверное уменьшение содержания IGF-I в плазме крови и числа ядер в мышечных волокнах по сравнению с группой без атрофии. Следовательно, развитие атрофического процесса в скелетных мышцах происходит на фоне снижения, как ядерных структур (ДНК-матриц), так и внеклеточного регулятора белкового синтеза - IGF-I. Не исключено, что потеря мышечных ядер обусловлена развитием некомпенсированных апоптотических процессов, признаки которых были ранее обнаружены у пациентов с ХАМ [Fernandez-Sola J. et al, 2003]. Увеличение числа миоядер возможно только на фоне пролиферации клеток-миосателлитов и их последующего слияния с материнским волокном. Следовало ожидать влияния хронического потребления алкоголя и на эти процессы. Впервые получено уменьшение количества клеток, меченых m-кадгерином у больных с признаками атрофии мышечных волокон, что говорит об истощении их регенераторного потенциала.
Определение общего количества рибосомальных киназ P70 S6K и P90 RSK, как наиболее значимых внутриклеточных звеньев регуляции белкового синтеза, впервые в клиническом исследовании выявило снижение их экспрессии и фосфорилирования по сравнению с группой контроля. Особого внимания заслуживает тот факт, что снижение этих показателей отмечалось и в группе пациентов без атрофических изменений скелетных мышц. Таким образом, нарушение регуляции белкового синтеза опережает развитие морфологических проявлений атрофического процесса в скелетной мышце при хронической алкогольной интоксикации.
Снижение синтеза белка является ранним признаком поражения скелетных мышц у пациентов с хронической алкогольной интоксикацией, опережающим морфологические проявления ХАМ. В дальнейшем возможно использование определения уровня IGF-I в плазме крови для ранней скриннинговой диагностики ХАМ.
Не смотря на наличие большого количества экспериментальных работ, посвященных механизмам возникновения ХАМ, в настоящее время не существует общепринятых схем терапии данного состояния. Предполагавшийся ранее дефицит аминокислот, как субстрата для синтеза белка, впоследствии не нашел своего подтверждения [Nicolas J.M. et al, 2007]. Также не показали своей эффективности попытки использовать у животных -токоферол в качестве корректора антиоксидантных систем, недостаточность которых, как предполагали, может приводить к нарушению синтеза белка в мышце [Ward R.J. et al, 1992; Fernandez-Sola J.et al, 2002; Fujita T. et al, 2002].
В эксперименте с лабораторными животными показана роль лейцин-содержащей аминокислотной смеси в качестве возможного корректора нарушения синтеза белка. Применение указанной смеси в период восстановления у предварительно алкоголизированных крыс позволило ускорить процессы регенерации быстрых мышечных волокон, которые в первую очередь страдают при хронической интоксикации. Так, в группе животных, получавших лейцин-содержащую аминокислотную смесь, увеличение ППС быстрых мышечных волокон было в 1,7 раза больше, чем в группе грызунов, получавших только корм и воду.
В дальнейшем, возможно изучение эффекта лейцина на процессы восстановления атрофированных мышечных волокон у пациентов с ХАМ. При положительном результате это позволит включать лейцин-содержащие аминокислотные смеси в схему лечения ХАМ.
Выводы
- Хроническая алкогольная миопатия имеет прогредиентное течение, выраженность атрофического процесса зависит от длительности злоупотребления этанолом и не зависит от количества потребляемых напитков. Ее морфологическую основу в 56% случаев составляет гипотрофия мышечных волокон II типа, а в 44% случаев – мышечных волокон I и II типов;
- У пациентов с морфологически подтвержденной атрофией мышечных волокон в 56% случаев отмечались клинические проявления ХАМ в виде слабости мышц тазового пояса и бедер, гипотрофии мышц конечностей. В группе пациентов без атрофии мышечных волокон клинические симптомы ХАМ отсутствовали. Выраженность клинических проявлений соответствовала степени выраженности атрофического процесса;
- Выявленное снижение IGF-I в плазме крови, вероятно, указывает на нарушение системных механизмов регуляции белкового синтеза при длительной алкогольной интоксикации. На этом фоне впервые обнаружено уменьшение общего содержания основных рибосомальных киназ р70 и р90, а также снижение уровня их фосфорилирования, что является ранним биохимическим маркером атрофического процесса в скелетных мышцах;
- Наличие морфологических признаков атрофического процесса у больных ХАМ сопровождается уменьшением общего количества миоядер в мышечных волокнах и количества клеток-миосателлитов, что свидетельствует о снижении регенераторного потенциала скелетной мышцы;
- У предварительно алкоголизированных лабораторных животных применение лейцин-содержащей аминокислотной смеси приводило к ускорению процессов восстановления размеров быстрых мышечных волокон
Практические рекомендации
Выявление симптомов хронической алкогольной миопатии, как одного из наиболее частых неврологических проявлений алкогольной болезни, должно носить активный характер у лиц, длительно злоупотребляющих алкогольными напитками. Пациентам с длительным алкогольным анамнезом с целью ранней диагностики ХАМ показано проведение биопсии проксимальной скелетной мышцы с последующим иммуногистохимическим и морфометрическим исследованием. Морфологическое исследование скелетной мышцы является единственным методом диагностики ХАМ в отсутствии клинических проявлений.
Список работ, опубликованных по теме диссертации
- Зиновьева О.Е., Маслова Г.А., Стогова Ю.В. Сочетанное поражение периферических нервов и мышц на фоне длительной алкогольной интоксикации // Врач.-2008 - №11 - С.62-64.
- Шенкман Б.С., Зиновьева О.Е., Маслова Г.А., Стогова Ю.В. Клинико-морфологические особенности алкогольной миопатии // Фундаментальные науки – медицине. Тезисы докладов на конференциях и семинарах по научным направлениям Программы в 2008 году. М.: Фирма «Слово», 2008 - С.80-81.
- Зиновьева О.Е., Ангельчева О.И., Маслова Г.А., Стогова Ю.В. Поражение периферической нервной системы при хронической алкогольной интоксикации // VII Московская ассамблея «Здоровье столицы» Тезисы докладов 2008 - с.69-70.
- Зиновьева О.Е., Шенкман Б.С., Маслова Г.А, Стогова Ю.В. Поражение скелетных мышц при алкогольной интоксикации // Украинский неврологический журнал.-2009 - №2(11) - С.11-16.
- Шенкман Б.С., Маслова Г.А., Стогова Ю.В., Зиновьева О.Е., Яхно Н.Н. Атрофия медленных и быстрых волокон локомоторной мышцы у больных хроническим алкоголизмом. Клинико-физиологический анализ // Технологии живых систем.-2009 - №8 - С.3-10.
- Маслова Г.А., Стогова Ю.В. Клинические и электрофизиологические особенности алкогольной миопатии // VIII «Конференция молодых ученых, специалистов и студентов», посвященная Дню космонавтики. Материалы конференции. –М.: Государственный научный центр РФ – Институт медико-биологических проблем РАН, 2009 - С.33.
- Maslova G, Stogova J, Lysenko E, Zinovyeva O., Shenkman B, Yakhno N. Morphological alterations and serum IGF-1 changes in chronic alcoholic myopathy // European Journal of neurology. - 2009 - Vol.16 - P.228.
- Казанцева Ю.В., Маслова Г.А., Лысенко Е.А., Зиновьева О.Е., Шенкман Б.С., Яхно Н.Н. Механизмы развития атрофии скелетных мышц при хронической алкогольной интоксикации // Анналы клинической и экспериментальной неврологии.-2010 - №4 - Т.4 - С.15-19.
- Лысенко Е.А., Казанцева Ю.В., Зиновьева О.Е., Яхно Н.Н., Шенкман Б.С. Клеточные сигнальные механизмы в развитии атрофии скелетных мышц человека при хронической алкогольной миопатии // Технологии живых систем.-2010 - №8 - С.38-44.
- B. Shenkman, E. Lysenko, O. Zinovyeva, G. Maslova, Y.Kazantseva, N. Yakhno. Phosphorylation of ribosomal s6 kinases in atrophied and non-atrophied muscles of alcoholic patients is profoundly declined // Abstracts of the XII International Congress on Neuromuscular Disorders, Naples, Italy. - 2010 - P. 242.
- E. Lysenko, E. Kachaeva, Yu. Kazantseva, G. Maslova, O. Zinovyeva, B. Shenkman. Some parameters of the protein synthesis regulation during chronic alcohol intoxication in human // Abstracts of the XXXIX European Muscle Conference, Padua, Italy. - 2010 - P. 123.
Список сокращений
АЛТ - аланинаминотрансфераза
АС – аминокислотная смесь
АСТ - аспартатаминотрансфераза
Г-ГТ - гамма-глутамилтрансфераза
КФК - креатинфосфокиназа
МВ - мышечное волокно
ППС - площадь поперечного сечения
ХАМ - хроническая алкогольная миопатия
ЭМГ – электромиография
ПДДЕ – потенциал действия двигательной единицы
IGF-I - инсулиноподобный фактор роста I

