Экстрасинаптическая секреция нейротрансмиттеров: исследование с помощью изолированного нейрона как биологического сенсора
На правах рукописи
Чистопольский
Илья Александрович
ЭКСТРАСИНАПТИЧЕСКАЯ СЕКРЕЦИЯ НЕЙРОТРАНСМИТТЕРОВ: ИССЛЕДОВАНИЕ С ПОМОЩЬЮ ИЗОЛИРОВАННОГО НЕЙРОНА КАК БИОЛОГИЧЕСКОГО СЕНСОРА
03.03.01. - физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва 2012
Работа выполнена в лаборатории сравнительной физиологии Учреждения Российской академии наук Института биологии развития им. Н.К. Кольцова РАН
Научный руководитель: доктор биологических наук
Сахаров Дмитрий Антонович, ИБР РАН
Официальные оппоненты: доктор биологических наук, профессор
Гомазков Олег Александрович,
РАМН НИИ биомедицинской
химии им. В.Н. Ореховича РАМН
кандидат медицинских наук
Шевелкин Алексей Валерьевич,
РАМН НИИ нормальной физиологии
им. П.К.Анохина РАМН
Ведущая организация: Московский государственный университет им.
М.В. Ломоносова, Биологический факультет, кафедра высшей нервной деятельности.
Защита диссертации состоится « 01 » 02 2012 г. в 15 часов на заседании диссертационного совета Д 002.238.01 в Учреждении Российской академии наук Институте биологии развития им. Н.К. Кольцова РАН по адресу:
119334, Москва, ул. Вавилова, д. 26.
Сайт: http://idbras.comcor.ru/; e-mail: [email protected].
С диссертацией и авторефератом можно ознакомиться в библиотеке и на сайте Учреждения Российской академии наук Института биологии развития им. Н.К. Кольцова РАН.
Автореферат разослан «___»______________20__ года.
Ученый секретарь диссертационного совета,
кандидат биологических наук Абрамова Е.Б.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Согласно логике классической синаптической парадигмы, для работы нервной системы не требуется нескольких, даже двух медиаторов. В реальной же нервной системе множество медиаторов работают совместно. В попытке логически разрешить «противоречие» между разнообразием эргичности нейронов и представлением о достаточности одного химического посредника для работы нервной системы, были высказаны соображения о том, каким образом это разнообразие участвует в работе нервной сети (Сахаров, 1985, 1990). Кодирование передающих сигналов в такой сети предполагается не посредством синаптических связей нейронов между собой, а наличием рецепторного поля к тому или иному химическому агенту, выделяемому нейроном-передатчиком. Такая передача не требует обязательной локализации всего процесса внутри синапса, т.к. адресация в ней производится не локализацией места передачи, а типом рецепторов к медиатору, расположенных на мембранах нейронов как вблизи, так и в удалении от зоны медиаторного выброса. Известные на сегодня описания элементов такой «несинаптической» передачи в нейрональных сетях конкретных животных пытаются объединить в одной группе феноменов. С другой стороны, синаптической доктрине противоречат феномены, которые относят к экстрасинаптической секреции («объемной передаче», volume transmission, VT) (Zoli,1999; Agnati,2010; Sykova, 2008). Вместе с тем, функции и механизмы экстрасинаптической секреции остаются в целом неясными, методы ее исследования разработаны недостаточно и требуют новых подходов. Необходимо изучение того, как экстрасинаптическая секреция проявляет себя в работе нервных систем реальных животных.
Цель и задачи исследования. Цель работы – выявление механизмов химических несинаптических взаимодействий в работе простой центральной нервной системы (ЦНС). В работе предстояло решить следующие задачи:
- Разработать методику с использованием биосенсора для регистрации нейроактивных веществ, выделяемых нейронами в нейропиль ганглиев ЦНС моллюска.
- Выявить участие нейроактивных веществ, действующих по механизму безадресного межнейронального взаимодействия, в работе простой ЦНС моллюска Lymnaea stagnalis.
- Оценить функциональную значимость и эффективность таких нейроактивных веществ в работе нейронов ЦНС, участвующих в реализации локомоторного поведения моллюска.
- Выяснить, проявляют ли себя феномены экстрасинаптического межнейронального взаимодействия при генерации нейронами ЦНС моллюска программы фиктивного пищевого поведения.
Научная новизна и практическая значимость работы. Впервые системно и в разных модификациях зарегистрированы в режиме реального времени экстраклеточные химические процессы, которые относят к несинаптическим взаимодействиям. С этой целью была применена собственная методическая разработка – биосенсор на основе изолированного нейрона.
Применение нового метода впервые дало возможность визуализировать регистрацию и позволило исследовать несинаптические взаимодействия в интактной, фиктивно работающей нервной системе. Метод позволяет тестировать химическую обстановку вблизи поверхности ганглиев моллюска и отслеживать ее изменения, наблюдать в режиме реального времени работу нейроактивных факторов, выделяемых в объем ганглия.
Разработанные методические приёмы, продлевающие на многие часы рабочее состояние изолированного нейрона, впервые позволили регистрировать химические изменения межнейронального пространства простой нервной системы, связанные со спонтанным переключением ее функциональных состояний. Результаты экспериментов говорят о важности феномена экстрасинаптической секреции в работе нервной системы исследованного объекта, моллюска Lymnaea stagnalis. Они позволяют выявить специфику объемной межнейрональной передачи, а также очертить круг функций, с которыми может быть связан феномен экстрасинаптической секреции.
Личное участие автора. Вся работа выполнена непосредственно автором. Поставленные задачи были решены с применением современных методов электрофизиологии. Кроме того, была отработана не применявшаяся ранее методика для многочасовой детекции нейроактивных веществ истекающих из нейропиля ЦНС. Выводы сформулированы четко и соответствуют заявленным целям и использованным методам. Написание и оформление диссертации осуществлено в соответствии с предъявляемыми требованиями. Научные положения и выводы, изложенные в работе, обоснованы и опираются на квалифицированный анализ собственных исследований и данных литературы.
Апробация работы. Основные результаты диссертационной работы были представлены на конференциях: Simpler nervous systems. VI East European conference of the ISIN, September 22-24, Moscow-Pushchino, 2000.; VIII Всероссийская конференция, посвященная 100-летию со дня рождения Х.С. Коштоянца, октябрь 25-27, 2000.; Simpler nervous systems. VII East European conference of the ISIN, September 12-16, Kaliningrad-Svetlogorsk-Otradnoe, 2003.; Конференция «Нейрохимия: фундаментальные и прикладные аспекты», 14-16 марта, Москва, 2005.; 35th annual meeting of the Society for Neuroscience, 13-16 November, Washington, USA, 2005.; Simpler nervous systems. VIII East European conference of the ISIN, September 13-17, Kazan, Russia, 2006.; 11th Symposium on invertebrate neurobiology, August 25-29, Tihany, Hungary, 2007.; Конференция «Механизмы нервных и эндокринных регуляций, ноябрь 24-26, Москва, 2008.; Simpler nervous systems. IX East European conference of the ISIN, September 9-13, S-Peterburg, Russia, 2009.; 9th International congress of neuroethology, August 2-7, Salamanka, Spain, 2010.; 40th annual meeting of the Society for Neuroscience, 13-17 November, San Diego, California, USA, 2010.; 9th Gagra Talks. International conference on fundamental questions of neuroscience, October 13-16, Tbilisi, Georgia, 2010.
Публикации. По результатам диссертации опубликовано 24 печатных работы, из них статей в журналах, соответствующих Перечню ВАК – 6, в других журналах и научных сборниках – 3, тезисов докладов и материалов конференций – 15.
Структура и объем работы. Диссертационная работа изложена на 75 страницах, содержит 18 рисунков, 2 таблицы и состоит из следующих разделов: введение, обзор литературы, материалы и методы, результаты исследования, обсуждение результатов, заключение, выводы, список литературы, включающий 82 цитируемых источника.
МЕТОДЫ И МАТЕРИАЛЫ ИССЛЕДОВАНИЯ
Объектом исследования были выбраны выращенные в аквариальной культуре взрослые особи большого прудовика Lymnaea stagnalis (Mollusca Gastropoda Pulmonata). Все эксперименты проводили с использованием препарата изолированной ЦНС улитки (рис. 1). Регистрацию электрической активности нейронов, а также их стимуляцию, осуществляли стандартными методами клеточной электрофизиологии. Отводились микроэлектродами как от нейронов, лежащих внутри ЦНС, так и от изолированных нейронов.
Биосенсор. С помощью изолированного нейрона-биосенсора тестировалось присутствие нейроактивных веществ в выбранной точке пространства рабочей камеры. Такой биосенсор, имея необходимую рецепцию, реагировал на окружающие его химические вещества изменением мембранного потенциала. Биосенсоры изолировали из педальных, церебральных, буккальных и плевральных ганглиев. Для изоляции биосенсора нервную систему прудовика обрабатывали проназой Е (Sigma), 4 мг/мл, 5-7 минут, с последующей отмывкой физиологическим раствором. Изоляцию осуществляли с помощью микроэлектрода (Т.Л. Дьяконова, 1985). В сому клетки вводили стеклянный микроэлектрод, который медленно сдвигали в сторону до полного отрыва ветвей нейрита от нейропиля. Этот же микроэлектрод использовали как для дальнейших перемещений биосенсора, так и для регистрации его электрической активности. В опытах с тестированием экстранейрональной среды биосенсор попеременно сближали с поверхностями одного или нескольких ганглиев. Его перемещали в течение 20-60 секунд из отдалённой точки, находящейся на расстоянии около 0,5 мм от тестируемых ганглиев, к выбранному участку поверхности. Через 60-120 секунд биосенсор возвращали в исходную отдалённую точку. При непрерывном мониторинге среды у поверхности ганглия использовали несколько биосенсоров.
«Полуизолированные» нейроны. В некоторых опытах использовали не до конца изолированные нейроны. Получены они были сходно с тем, как описано для биосенсора, т.е. микроэлектрод вводили в сому и затем микроманипулятором отодвигали ее от ганглия, стараясь вытащить проксимальный и медиальный сегменты отростка из нейропиля.
Тестируемые ганглии нервной системы улитки. Тестируемые ганглии обрабатывали проназой Е (Sigma), 4 мг/мл, 2-6 минут, с последующей отмывкой физиологическим раствором.

Рис. 1. Схема ЦНС моллюска Lymnaea stagnalis (предоставлена В.Цыгановым). Дорсальная сторона ЦНС. Перерезана церебральная комиссура, церебральные ганглии развернуты вентральной стороной. Отмечены идентифицированные нейроны, используемые в экспериментах.
ЛБГ и ПБГ– левый и правый буккальные ганглии; ЛЦГ и ПЦГ– левый и правый церебральные ганглии; ЛПлГ и ППлГ– левый и правый плевральные ганглии;
ЛПарГ и ППарГ– левый и правый париетальные ганглии; ЛПедГ и ПедГ– левый и правый педальные ганглии; ВГ – висцеральный ганглий; В4 – идентифицированные нейроны буккальных ганглиев; В4-кл – район кластера, состоящего из В4Сl нейронов; А-кл – район А-кластера; ПCGC и ЛCGC - гигантские нейроны правого и левого церебральных ганглиев.
Условия экспериментов. Основной физиологический раствор имел состав:(в мМ): NaCl – 50; KCl – 1,6; CaCl2 – 4; MgCl2 – 4; Tris – 10 (pH 7,5); с добавлением D-глюкозы 0,05%. Эмпирически подобранный состав раствора, оптимальный для регистрации биосенсорами ритмов в буккальных ганглиях, был изменен, концентрация MgCl2 составляла в нем 1 мМ. Препарат ЦНС помещали в проточную камеру объёмом 1,5 мл. В ней поддерживали проток скоростью 0,5-1 мл/мин на всём протяжении эксперимента. Используемые экзогенные химические вещества вносили в проток рабочей камеры или апплицировали в камеру микропипеткой. Использовали вещества: хинин (Calbiochem), серотонин (5-гидрокси-L-триптамин, 5-НТ, Sigma), предшественник серотонина (5-гидрокси-L-триптофан, 5-НТР, Sigma). Для ингибирования триптофандекарбоксилазы, фермента, превращающего 5-НТР в 5-НТ, применяли м-гидроксибензилгидразин (мГБ, Sigma).
В части опытов нейрон подводили также к кончику капилляра с диаметром кончика несколько микрометров, который содержал 10-3 М 5-НТ. Мембранные потенциалы отводили от нейронов с помощью стеклянных микроэлектродов (KCl, 3М, R= 20 – 50 МОм), на усилители постоянного тока фирмы Микромед. Далее сигналы подавали на аналого-цифровой преобразователь (АЦП, интервал между двумя последовательными опросами по одному каналу составлял 0,2 миллисекунды), встроенный в персональный компьютер IBM PC. После дополнительной обработки данных и расчета средних значений параметров, достоверность полученных результатов оценивали по непараметрическому критерию Уилкоксона и критерию знака, в части случаев пользовались F-критерием.
РЕЗУЛЬТАТЫ
1.Медиаторная обстановка вблизи серотонинергических нейронов А-кластера педальных ганглиев.
1.1. Предварительное исследование механизма действия 5-НТР на нейроны А-кластера педальных ганглиев. Зная, что у моллюска можно активизировать локомоторное поведение при помощи 5-НТР, данного экзогенно в его гемолимфу, на изолированной центральной нервной системе (ЦНС) моллюска было изучено, сводится ли действие 5-НТР к повышению синтеза 5-НТ в серотонинэргических нейронах. В них был заблокирован синтез 5-НТ из 5-НТР с помощью мГБ (см. методы) в концентрации 25 мкМ. В этих опытах электрическую активность отводили от «полуизолированного» нейрона А-кластера педальных ганглиев (см. методы). После начала поступления раствора с мГБ в рабочую камеру, регистрировали фоновую активность нейрона в течение 30 минут (пять или шесть записей, каждая длительностью 1 минута). Затем в проток мГБ на 6 минут добавляли 5-HTP в концентрации 100 мкМ и регистрировали сходным образом активность нейрона в интервале с 4-ой до 14-ой минуты от начала поступления 5-HTP в рабочую камеру. Разность двух средних частот по модулю, до и после воздействия 5-НТР, выражала его влияние на клетку. Результаты опытов с мГБ (n=7) даны в Таблице 1. Результаты контрольных экспериментов (n=12) с действием 5-НТР без мГБ, даны в Таблице 2.
Таблица 1.
| номер нейрона | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| исходная частота (спайк/мин) | 14,5 | 16,0 | 16,0 | 11,5 | 24,5 | 21,5 | 51,2 |
| частота после мГБ (спайк/мин) | 14,6 | 14,0 | 18,5 | 9,3 | 28,3 | 17,6 | 53,4 |
| частота после мГБ + 5-HTP (спайк/мин) | 13,3 | 14,1 | 15,0 | 10,5 | 27,1 | 16,5 | 53,3 |
Таблица 2.
| номер нейрона | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| исходная частота (спайк/мин) | 10,8 | 5,8 | 9,3 | 33,2 | 9,2 | 8,6 | 8,4 | 6,8 | 4,4 | 9,4 | 10,2 | 17,0 |
| частота после 5-HTP (спайк/мин) | 20,3 | 15,8 | 27,0 | 36,6 | 15,3 | 14,5 | 15,4 | 13,9 | 9,1 | 13,2 | 11,1 | 19,1 |
Опыты показали, что мГБ достоверно снимает эффект 5-НТР (уровень значимости 0.01, критерий Уилкоксона), и что его возбуждающее действие становится возможным лишь после его превращения в 5-HT. Т.к. все это наблюдалось в условиях «полуизоляции», можно было предполагать, что действие 5-НТР осуществляется на уровне одного нейрона. В дальнейшем это подтвердилось опытами на полностью изолированных нейронах. Т.е. после дачи предшественника вновь синтезированный 5-НТ нейрона действует на этот же нейрон, возбуждая его, и, тем самым, осуществляет положительную обратную связь на уровне одной клетки.
1.2. 5-НТ в межклеточном пространстве педальных ганглиев. В предположении, что 5-НТ действует в районе А-кластера при усилении локомоции моллюска по механизму экстрасинаптической секреции, была исследована химическая обстановка с помощью биосенсора, в качестве которого выступал нейрон А-кластера. В подавляющем большинстве случаев (36 из 42 клеток на 31 препарате ЦНС) частота спайков изолированного нейрона, придвинутого сомой к поверхности ганглия в зоне А-кластера, возрастала и составляла 112-1000% (в среднем 280%). Однако были исключения, когда частота значимо не менялась (3 случая) или даже уменьшалась (3 случая). Если биосенсор сближали с кончиком 5-НТ капилляра (см. методы), частота спайков возрастала. Исследование биосенсором всей поверхности педальных ганглиев позволило получить более детальную информацию о химической обстановке внутри них (см. рис. 2). То, что наиболее сильное возбуждающее действие достигается в области А-кластера, уже более определенно указывает на эти нейроны, как на источник сильного медиаторного влияния.

Рис. 2. Изменения активности биосенсора в зависимости от его позиции относительно педального ганглия.
ЛПД – левый педальный ганглий; ППД – правый педальный ганглий; А – педальный А-кластер. На ЛПД дана карта активности биосенсора у разных участков дорзальной поверхности (среднее из 7 экспериментов, в процентах от измеренной частоты спайков у латерального края ганглия). На ППД показаны результаты эксперимента, в котором биосенсор перемещали вдоль протока. Для каждой точки указано число спайков за 2 мин регистрации. Стрелкой указано направление протока физиологического раствора.
Далее была проведена серия опытов с подведениями биосенсора к педальным ганглиям на фоне экзогенного 5-НТ. Периодическое сближение биосенсора с педальными ганглиями на фоне постепенно увеличивающейся концентрации 5-НТ в протоке (2 случая) показало, что после достижения экзогенным 5-НТ некоторого порогового значения частота спайков нейрона переставала увеличиваться и могла даже уменьшаться при подведениях к педальным ганглиям. Экзогенный 5-НТ, действуя сонаправленно с фактором, выделяющимся из ганглия, при 10-7М полностью маскировал действие этого эндогенного фактора на биосенсор. При 5*10-5М 5-НТ подведение биосенсора к А-кластеру во всех случаях не вызывало усиления электрической активности. Напротив, в этих условиях отмечалось уменьшение частоты спайков (в 6 случаях из 10). Все это указывало на 5-НТ, как на один наиболее значимых химических факторов, который выделяется в исследуемой области ганглиев и влияет на биосенсор.
В следующей схеме эксперимента использовали усиливающее действие 5-НТР. При поступлении с протоком в концентрации 1-2*10-4М (или при аппликации его в камеру) (рис. 3) (n=6), 5-НТР вызывал как усиление активности самого биосенсора, так и увеличение прироста частоты, вызванного его сближением с педальными ганглиями. Абсолютный прирост частоты, вызываемый сближением с педальными ганглиями, продолжал увеличиваться, в то время как фоновая частота спайков самого биосенсора уже прошла максимум увеличения, вызванного 5-НТР. Т.е. возбуждающее влияние педальных ганглиев на биосенсор усиливается в присутствии 5-НТР, который, не обладая прямым действием на нейроны А-кластера, действует на них только после превращения в 5-НТ.

Рис. 3. Реакция биосенсора на подведение к А-кластеру усиливается на фоне 2*10-4М 5-НТР в протоке. Биосенсор подводили через каждые 5 минут, начиная с 0 минуты, время перемещения нейрона при подведении (отведении) - 0,5 минуты, время у поверхности ганглия после подведения до начала отведения – 1,5 минуты. Черный прямоугольник на горизонтальной оси – начало поступления в камеру 5-НТР. Светлый прямоугольник – начало отмывки.
1.3. Медиаторный «бульон» педальных ганглиев. Помимо ожидаемого 5-НТ, в системе педальных ганглиев предполагались и другие факторы, которые, подобно 5-НТ, действовали на биосенсор. На это указывали единичные случаи гиперполяризации биосенсоров в отсутствие внешних химических воздействий на педальные ганглии.
Применение хинина в концентрации 10 мкМ выявило отличный от 5-НТ деполяризующий фактор. На фоне хинина спайк биосенсора, подведенного к педальным ганглиям, сужается под влиянием деполяризующего фактора, который не является 5-НТ, т.к. последний всегда действует на биосенсоры (изолированные из А-кластера), расширяя их спайк (пример см. рис. 4).
Для обнаружения тормозящего фактора препарат подвергали действию 0,5 мкМ 5-НТ, что вызывало возбуждение нейронов А-кластера, в том числе биосенсора. Если на первых минутах действия 5-НТ сблизить биосенсор с А-кластером педальных ганглиев ЦНС, то в первые секунды сближения частота спайков уменьшается (рис. 5) (n=6).
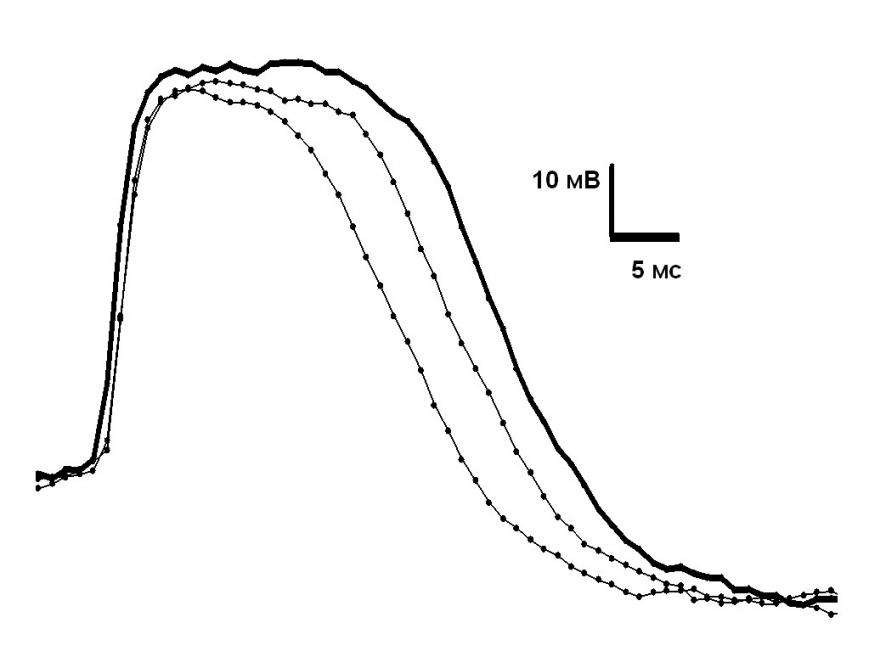
Рис. 4. Изменения длительности спайков биосенсора на фоне 10 мкМ хинина в ходе тестирования эталонного источника медиатора, 5-НТ капилляра, и ганглиев ЦНС.
тонкая сплошная линия – в отсутствие воздействий; толстая сплошная линия – при сближении с 5-НТ капилляром; тонкая пунктирная линия – при сближении с А -кластером. Действие кончика 5-НТ капилляра было равносильно действию 10-8-10-7М 5-НТ.

Рис. 5. Изменение средней частоты спайков биосенсора при сближении его с
А-кластером педальных ганглиев в отсутствие и на фоне 0,5 мкМ 5-НТ. Момент появления 5-НТ в растворе обозначен стрелкой. Толстые А-линии – нейрон находится вблизи А-кластера. Каждая точка графика – средняя частота спайков на интервале 30 секунд.
2. Медиаторная обстановка вблизи буккальных ганглиев.
Опыты показали, что медиаторный фон имеется у многих ганглиев моллюска (у педальных, церебральных, париетальных, буккальных и висцерального ганглиев). Мембранный потенциал биосенсора при подведении его к поверхности выбранного ганглия обратимо сдвигался до нескольких мВ. При повторных подведениях того же биосенсора к той же точке характер ответа не менялся. Знак ответа при тестировании примерно одной и той же области в разных опытах мог быть разным даже при использовании в качестве биосенсора одноименных нейронов. В большинстве экспериментов было видно, что у поверхности ЦНС присутствуют нейроактивные факторы в концентрации, способной оказать значимое влияние на мембранный потенциал изолированного нейрона. Для дальнейших исследований были выбраны буккальные ганглии, которые ответственны за формирование пищевого паттерна.
2.1. Работа генератора пищевого ритма. Основная задача нейронов этих ганглиев – задание ритмических движений мышц буккальной массы, организация циклических движений скребущего ротового аппарата. Стандартный моторный цикл, с периодом порядка 10 сек, состоящий из трех фаз, обеспечивается поочередной активностью нейронов центрального генератора. В ходе многочасовых экспериментов на препаратах изолированной ЦНС прудовика отслеживали изменения состава среды вблизи буккальных ганглиев, отражающие изменения в характере генерации фиктивного моторного ритма.
Использовали биосенсоры, представляющие собой изолированные буккальные нейроны В4 или B4Cl (это идентифицированные нейроны 4-го кластера буккальных ганглиев). Эти нейроны – моторные нейроны третьей фазы. В поведении моллюска эта фаза соответствует заглатыванию пищи.
Биосенсоры выделяли из ЦНС другого животного и располагали вблизи выбранного участка поверхности одного из буккальных ганглиев. Одновременно отслеживали работу буккального генератора, регистрируя in situ электрическую активность нейрона В4, входящего в состав тестируемого ганглия.
Примеры электрофизиологических данных, полученных в такой схеме, даны на рис. 6, 7, 8, 9. На рис. 6 видно, как запуск генерации внутри буккального ганглия, отслеживаемый по нейрону В4 in situ, приводит к изменению активности биосенсоров. В активности нейрона in situ, помимо собственно моторного ритма периодом около 7-10 сек, нами зарегистрированы медленные ритмы с периодами порядка 50 сек (см. рис. 7 и 9) и 500 сек (см. рис. 9). Эксперименты показали, что электрическая активность биосенсора коррелирует с активностью нейрона in situ на обоих медленных ритмах. Значимой корреляции с 10 секундным моторным ритмом обнаружить не удалось. Результаты, сходные с показанными на рис. 6, 7, 8,9 были получены на 13 биосенсорах в 8 опытах. Достоверность наблюдаемых корреляций оценивали после обработки максимальных частотных или амплитудных значений активности биосенсоров, сравнивая полученные данные с усредненной ритмической активностью нейронов в ганглии (см. методы). Наличие корреляции оценивали отдельно в каждом опыте, используя для анализа F-критерий.

