Участие медиального мозжечка в механизмах памяти и обучения при формировании различных видов оборонительного поведения
РОССИЙСКАЯ АКАДЕМИЯ МЕДИЦИНСКИХ НАУК
НИИ НОРМАЛЬНОЙ ФИЗИОЛОГИИ
им. П. К. АНОХИНА
На правах рукописи
СТОРОЖЕВА
Зинаида Ивановна
УЧАСТИЕ МЕДИАЛЬНОГО МОЗЖЕЧКА В МЕХАНИЗМАХ ПАМЯТИ И ОБУЧЕНИЯ ПРИ ФОРМИРОВАНИИ РАЗЛИЧНЫХ ВИДОВ ОБОРОНИТЕЛЬНОГО ПОВЕДЕНИЯ
03.03.01 – физиология
Автореферат диссертации на соискание ученой степени
доктора биологических наук
Москва – 2010
Работа выполнена в Учреждении Российской Академии медицинских наук НИИ нормальной физиологии им. П.К. Анохина
Научный консультант:
доктор медицинских наук, заслуженный деятель науки РФ, профессор
Владимир Вячеславович Шерстнев
Официальные оппоненты:
доктор биологических наук, профессор
Валерий Викторович Шульговский
кафедра высшей нервной деятельности
биологического факультета МГУ им.М.В.Ломоносова
доктор биологических наук,
Ольга Николаевна Серова
институт нормальной физиологии им.П.К.Анохина РАМН
доктор медицинских наук, заслуженный деятель науки РФ, профессор
Рита Ушеровна Островская
институт фармакологии им. В.В.Закусова РАМН
Ведущая организация:
Институт физиологии им. И.П. Павлова РАН
Защита состоится 17 июня в 11.00 на заседании Диссертационного Ученого Совета Д 001.008.01 при Учреждении Российской Академии медицинских наук НИИ нормальной физиологии им. П.К. Анохина РАМН.
Адрес: 125009, Москва, ул. Моховая, д.11, стр.4.
С диссертацией можно ознакомиться в Библиотеке НИИ НФ РАМН.
Автореферат разослан
Ученый секретарь Диссертационного Совета
Кандидат медицинских наук
В.А. Гуменюк
ОБЩАЯ ХАРАКТЕРИСТИКА ИССЛЕДОВАНИЯ
Актуальность проблемы.
Изучение функциональной роли и особенностей участия различных отделов мозга в интегративной деятельности ЦНС является одной из наиболее актуальных проблем нейробиологии. Наряду с важным теоретическим значением, разработка этой проблемы имеет неоспоримую ценность для выяснения механизмов патогенеза нервно-психических заболеваний, разработки методов их диагностики и терапии. В последнее время все возрастающее внимание в этом плане привлекает мозжечок. Накопленные в лабораторных и клинических исследованиях данные убедительно свидетельствуют, что наряду с регуляцией моторных функций этот отдел мозга вовлечен в обеспечение механизмов памяти и эмоциональных процессов (Schmahmann et al., 2007, Ito, 2005, Калашникова и др., 2000). Однако симптомы, наблюдаемые в клинике при поражениях мозжечка: нарушения абстрактного мышления, внимания, рабочей и зрительно-пространственной памяти, расторможенность и неадекватное поведение (Heath еt al., 1978, 1980, Malm, 1998, Зуева, 2003), достаточно полиморфны, а их систематизация находится на начальном этапе.
В экспериментальных исследованиях участие мозжечка в когнитивных процессах было показано в моделях оборонительного поведения, в то время как в экспериментах с использованием положительного подкрепления были получены отрицательные результаты. Наиболее подробно изучена роль данного отдела мозга в формировании, консолидации и хранении условного мигательного рефлекса (Krupa and Thompson, 1997, Medina et al., 2001). Обнаружено, что с функциями полушарий мозжечка связана инициация мигательной реакции на условный сигнал на стадии генерализации рефлекса, а также структурирование условного ответа во времени на этапе его специализации.
Значительно менее исследовано участие в когнитивных процессах медиального отдела мозжечка – червя, поражения которого наблюдаются при многих нервно-психических заболеваниях, манифестирующих в раннем возрасте (Калашникова и др., 2000, Lawyer G, et al., 2009). Имеются сведения, что с этим отделом мозжечка связано формирование долговременного угашения акустической стартл-реакции (АСР) (Leaton & Supple, 1986, Maschke. et al., 2000), а также консолидация условного обстановочного замирания (Saccetti et al., 2002, 2005) - генерализованных реакций организма, включающих оборонительную и ориентировочную составляющие, обеспечивающих формирование и выполнение более сложных и специфичных оборонительных форм поведения (Н.А. Бернштейн, 1966, Davis, 1984, Richardson and al., 1996).
Высказана гипотеза, что роль мозжечка в процессах обучения и памяти обусловлена существованием в этой структуре собственных внутренних моделей организма и окружающей среды, (Kawato M, Gomi H. 1992, Ito M., 2005). Показано, что механизмы формирования таких моделей связаны со специфичным изменением активности отдельных нейромедиаторных систем. Поступление информации через основные афферентные проекции в мозжечок - лиановидные и мшистые волокна, опосредуется возбуждающими аминокислотами. Кроме того, все большее количество данных указывает, что в формировании и функционировании внутренней модели важную роль играют т.н. «модуляторные», в частности, моноаминергические проекции (Schweighofer N., et al., 2001, 2004). С активностью ГАМК- и глицинэргических интернейронов связывают фильтрацию информации, поступающей по основным афферентным входам, а также изменение свойств внутренней модели под влиянием «модуляторных» проекций (Cavelier P. et al., 2005)
В ряде работ показано, что существенное значение в молекулярно-клеточных механизмах пластичности в мозжечке принадлежит факторам, регулирующим пролиферацию, дифференцировку и выживаемость клеток, (Stansberg C., 2007, Bao et al., 1998, Willson ML et al., 2008). Нейродегенеративные изменения в различных отделах мозжечка выявлены при многих нервно-психических расстройствах (Steinlin M., 2008).
Таким образом, изучение роли мозжечка в процессах обучения и памяти вызывает активный исследовательский интерес. Вместе с тем, механизмы его участия в когнитивных процессах нуждаются в дальнейших исследованиях, а имеющиеся данные зачастую противоречивы. В частности, некоторые авторы (Supple et al., 1988, Fanselow, Poulous, 2005) ставят под сомнение значение медиального мозжечка для консолидации условного замирания, а изменения его активности при формировании угашения АСР, зарегистрированные в различных работах, носят противоположную направленность (Frings M., et al., 2006, Pissiota et al. 2002). Зависимость характера участия мозжечка в формировании следа памяти от интенсивности отрицательного подкрепления и уровня оборонительной мотивации была показана в модели условного замирания (Sacchetti et al., 2007).
В связи с этим, необходимым представляется одновременное изучение динамики АСР и поведения замирания при воздействии на активность червя мозжечка. Такое исследование позволяет оценить участие медиального мозжечка в механизмах пластичности и динамической интеграции ориентировочно-исследовательской, активно-оборонительной и пассивно-оборонительной реакций, а также привыкания и сенситизации, соотношение которых в значительной степени определяет характер и динамику более сложных когнитивных процессов. Однако работы, направленные на анализ формирования нескольких видов поведения при воздействии на функции медиального мозжечка в одних и тех же экспериментальных условиях, единичны, а одновременное изучение поведения замирания и АСР ранее не проводилось. Следует также отметить, что исследование нейрохимических механизмов пластичности в мозжечке в большинстве своем были выполнены in vitro. Оценка роли отдельных нейромедиаторных систем этого отдела мозга в механизмах обучения in vivo осуществлена лишь в немногочисленных экспериментах с использованием модели мигательного рефлекса (Jimnez-Daz L et al., 2007, Paredes DA et al., 2008). Данные относительно влияния факторов, регулирующих пролиферацию, дифференцировку и выживаемость клеток мозжечка, на процессы обучения, в литературе отсутствуют.
Цель исследования
Целью работы явилось изучение нейрофизиологических и нейрохимических механизмов участия медиального мозжечка в регуляции процессов обучения
и памяти при формировании различных видов оборонительного поведения
Задачи исследования:
- Провести сравнительный анализ участия медиального мозжечка и гиппокампа в реализации безусловного (врожденного) поведения замирания, а также формировании кратковременного и долговременного привыкания АСР в условиях различного уровня обстановочного страха и тревоги.
- Изучить функциональную роль медиального мозжечка в механизмах сенситизации и десенситизации АСР.
- Исследовать временную динамику вовлечения медиального мозжечка в процессы консолидации долговременного угашения АСР и условного страха, вызванного воздействием обстановочных стимулов (обстановочного страха).
- Исследовать изменения уровня нейромедиаторных аминокислот и моноаминов в медиальном мозжечке при кратковременном и долговременном угашении АСР, а также формировании условного обстановочного страха.
- Изучить влияние экспериментально вызванных изменений активности отдельных нейромедиаторных систем червя мозжечка и модуляции процессов роста, развития и гибели клеток мозжечка на кратковременное и долговременное угашение АСР, а также формирование условного обстановочного страха.
- Исследовать специфичность вовлечения отдельных нейромедиаторных систем червя мозжечка в механизмы консолидации долговременного угашения АСР и условного страха.
Положения, выносимые на защиту:
- С активностью медиального отдела мозжечка (червя) связаны механизмы реализации врожденного поведения замирания при изменении обстановочной афферентации.
- На различных этапах формирования приспособительного поведения в условиях оборонительной мотивации медиальный мозжечок принимает участие в процессах кратковременной и долговременной памяти, обеспечивающих выбор адекватной стратегии поведения на основе интеграции генерализованных пассивно-оборонительных, активно-оборонительных и ориентировочных реакций.
- При отсутствии подкрепления медиальный мозжечок вовлечен в механизмы долговременной десенситизации, обеспечивающие достижение оптимального уровня активно-оборонительного поведения.
- Специфичное вовлечение червя мозжечка в обеспечение отдельных форм оборонительного поведения обусловлено избирательными и разновременными изменениями активности нейромедиаторных систем различной эргичности в этом отделе мозга:
- с активностью глутаматэргических синаптических процессов, опосредующих сенсорную информацию, приходящую по мшистым волокнам, связано формирование долговременного угашения ориентировочно-исследовательской составляющей АСР;
- серотонинергические проекции в кору медиального мозжечка и ГАМК-глицинергические тормозные интернейроны участвуют в формировании долговременного угашения оборонительной составляющей АСР, а также в формировании обстановочного пассивно-оборонительного поведения замирания;
- механизмы консолидации долговременного привыкания оборонительной составляющей стартл-реакции связаны со снижением активности серотонинергической системы;
- активность тауринэргической системы сопряжена с механизмами кратковременной сенситизации и кратковременного привыкания, а также долговременной десенситизации и долговременного растормаживания стартл-реакции.
5. Участие медиального мозжечка в системных механизмах приспособительного поведения в условиях оборонительной мотивации связано с обеспечением процессов предпусковой интеграции возбуждений на стадии афферентного синтеза, а также с формированием и функционированием акцептора результата действия.
Научная новизна работы: Впервые получены доказательства участия медиального мозжечка в реализации врожденного пассивно-оборонительного поведения замирания при изменении обстановочной афферентации, а также в обеспечении кратковременного привыкания и кратковременной сенситизации генерализованной активно-оборонительной реакции - АСР. Получены ранее неизвестные результаты об особенностях участия червя мозжечка в механизмах сенситизации АСР обстановочными стимулами. Установлено, что вовлечение медиального мозжечка в обеспечение сенситизации АСР реализуется при более низком уровне обстановочного страха и более высокой активно-оборонительной мотивации в сравнении с участием гиппокампа в этом процессе.
Продемонстрировано участие медиального мозжечка в обеспечении процессов долговременной памяти при десенситизации и растормаживании ориентировочной составляющей генерализованной активно-оборонительной реакции - АСР.
Показано, что с функциями медиального мозжечка связаны процессы консолидации долговременного привыкания АСР. Документирована специфичность и временная динамика вовлечения мозжечка в консолидацию привыкания ориентировочной и оборонительной составляющих АСР: через 5 минут после обучения мозжечок участвует в консолидации долговременного угашения оборонительной составляющей АСР, обусловленного процессами десенситизации; спустя 2 часа - в консолидации долговременного привыкания ориентировочно-исследовательской составляющей АСР и условного обстановочного замирания.
Характеризованы особенности участия червя мозжечка в регуляции периодических колебаний амплитуды АСР.
Впервые изучена динамика содержания нейромедиаторов в коре медиального мозжечка на различных стадиях формирования долговременного привыкания АСР и поведения замирания, а также влияние на эти процессы апплицируемых на червь мозжечка агонистов и антагонистов, отдельных нейромедиаторов. Выявлено избирательное вовлечение серотонин- и ГАМК-эргических систем червя мозжечка в формирование условного обстановочного замирания и долговременного привыкания оборонительной составляющей АСР, а также участие глутамат- и таурин-эргических систем в механизмах долговременного угашения ориентировочной составляющей АСР.
Обнаружено нейропротекторное влияние пептида HLDF6 в условиях клеточной гипоксии червя мозжечка.
На основании полученных результатов выдвинуто положение об интегративной роли медиального мозжечка в обеспечении оптимального соотношения ориентировочных, пассивно-оборонительных и активно-оборонительных реакций на различных стадиях формирования приспособительного поведения в условиях оборонительной мотивации. Обосновано представление о том, что с функциями медиального мозжечка связаны механизмы афферентного синтеза и акцептора результата действия. Специфичное вовлечение червя мозжечка в обеспечение отдельных форм оборонительного поведения обусловлено избирательными и разновременными изменениями активности его нейромедиаторных систем.
Теоретическая и практическая значимость работы. Полученные результаты расширяют и углубляют имеющиеся теоретические представления об участии мозжечка в процессах памяти и обучения. Сформулированные и обоснованные в работе положения о функциональном значении, нейрофизиологических и нейрохимических механизмах вовлечения медиального мозжечка в системную организацию различных видов оборонительного поведения вносят вклад в дальнейшее развитие исследований закономерностей участия этой структуры в интегративной деятельности ЦНС в норме и при развитии психопатологических состояний. Результаты, полученные при изучении динамики АСР и поведения замирания, уточняют современные взгляды на структуру и механизмы кратковременной и долговременной памяти при формировании оборонительного поведения
Оригинальный комплекс методических приемов, использованный в работе, может найти применение в лабораторных и клинических исследованиях, особенностей участия различных отделов мозга в обеспечении когнитивных функций, а также эмоциональных состояний в норме и патологии.
Полученные научные факты могут быть использованы в лекционных курсах по физиологии, нейробиологии и нейрохимии в вузах биологического, медицинского и психологического профиля.
Данные о нейропротекторных эффектах пептида HLDF6 в условиях клеточной гипоксии явились основой для разработки нового лекарственного препарата, обладающего комбинированным нейропротекторным и ноотропным действием, находящегося на данный момент в стадии доклинических испытаний.
Апробация диссертации.
Материалы диссертации были представлены на 1 Европейском форуме по нейронаукам (1st Forum of European Neurosciеnce) (Берлин, 1998 г.), Всероссийской научной конференции с международным участием, посвященной 150-летию со дня рождения И.П. Павлова, (Москва, 1999 г.), научных конференциях «Интеграция: НИИ – ВУЗ - клиника» ( Москва, 2000, 2001 гг.), Российском симпозиуме по химии и биологии пептидов. (Москва 2003 г.), 6-ом конгрессе IBRO (Прага, 2003 г.) Всероссийской конференции «Нейрохимия: фундаментальные и прикладные аспекты» ( Москва, 2005), Международном симпозиуме «Гиппокамп и память»
(Пущино, 2006), Всероссийском съезде физиологического общества им. И. П. Павлова (Москва, 2007), Конференции с международным участием «Нейрохимические механизмы формирования адаптивных и патологических состояний мозга» (С.-Петербург-Колтуши, 2008 г.) итоговых сессиях НИИ НФ им. П. К. Анохина (Москва, 2004, 2005, 2006). Диссертационная работа была апробирована на совместном заседании лаборатории функциональной нейрохимии и лаборатории мотивации НИИ НФ им. П.К. Анохина РАМН 03 июля 2009 г.
Публикации: по материалам диссертации опубликовано 40 печатных работ, из них 19 - статьи в рецензируемых журналах.
Структура и объем диссертации: Работа изложена на 263 страницах, включает разделы: введение, обзор литературы, характеристика методов исследования, результаты и их обсуждение, заключение, выводы и список цитируемой литературы. Работа иллюстрирована 42 рисунками и 27 таблицами. Список цитируемой литературы включает 540 источников, 521 из них на иностранных языках.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проведены на крысах-самцах Вистар весом 250-300 г., содержавшихся по три в клетке при температуре 24 о С и световом цикле 12/12 в условиях свободного доступа к корму и воде. Время проведения опытов с 11.00 до 15.00 часов
Изучение кратковременного и долговременного привыкания АСР с одновременной регистрацией поведения замирания проводили в камере из плексигласа размером 15х10х17 см., которую устанавливали на платформу, оснащенную тензодатчиком, соединенным с компьютером для фиксации амплитуды АСР. Подача звуковых стимулов осуществлялась усилителем мощности 100Y-101 (Россия) через динамик. Параметры звукового сигнала (широкополосный шум длительностью 500 мс и громкостью 110ДБ) контролировались персональным компьютером. Регистрацию времени замирания - полного отсутствия движения животного, включая движение вибрисс, - осуществляли визуально. За 24 часа до начала обучения крыс адаптировали к экспериментальной камере в течение 5 мин. В ходе сеанса обучения животных помещали в камеру и в течение 5 мин регистрировали реакцию замирания, затем предъявляли 10 звуковых стимулов с интервалом 20 с. Через 24 часа для оценки долговременного угашения АСР и условного замирания проводили сеанс тестирования по той же схеме. В некоторых экспериментах был использован протокол, не включавший процедуры предварительной адаптации животных к экспериментальной камере.
Блокатор натриевых каналов тетродотоксин (ТТХ) в дозе 3 нг вводили за 1 час, через 5 минут и 2 часа после обучения. Азид натрия - блокатор митохондриального комплекса IV, вызывающий клеточную гипоксию, инъецировали в дозе 2 мкг за 5 суток до обучения. Пептид HLDF6 в дозе 5 мкг вводили через 5 минут после введения азида натрия. Белок S100b в дозе 500 нг вводили за 4 часа до начала обучения. Ингибитор синтеза белка циклогексимид инъецировали в дозе 50 мкг через 5 минут, а также через 2 часа после обучения. Ингибитор синтеза РНК актиномицин D вводили в дозе 50 мкг через 5 минут после обучения. Антитела к белку A3G7 в дозе 5 мкг вводили через 2 часа после обучения. Антагонист NMDA рецепторов глутамата APV (2-амино-5-фосфовалериановую кислоту) вводили дозе 5 мкг за 1 час до обучения. Антагонист АМРА рецепторов глутамата CNQX (6-циано-7~нитрохиноксалин-2,3-дион) вводили в дозе 5 мкг за 1 час до обучения. Антагонист ГАМКA/ глициновых рецепторов бикукуллин вводили в дозе 0,5 мкг за 1 час до обучения. Антагонист ГАМКБ рецепторов факлофен вводили в дозе 5 мкг за 1 час до обучения. Антагонист 5НТ2 серотониновых рецепторов ритансерин инъецировали в дозе 5 мкг за 1 час обучения или за 1 час до тестирования. Все использованные в работе вещества, кроме пептида HLDF6, синтезированного в Институте биоорганической химии РАН, и антител к белку A3G7, полученных из Института медицинской и биологической кибернетики СО РАН, были приобретены в фирме «Sigma» США.
Вещества вводили через канюли, предварительно вживленные под нембуталовым наркозом по стереотаксическим координатам AP – 11,8; L 0; H -3,5, при помощи инъекционной иглы с ограничителем, соединенной виниловым шлангом с микрошприцем. Объем вводимого раствора составлял 3 мкл. Контрольным животным вводили физиологический раствор. Актиномицин D и CNQX в растворяли в 0.1% диметилсульфоксиде; контрольным крысам этих серий вводили 3 мкл 0,1% диметилсульфоксида в физиологическом растворе.
При изучении эффектов подавления активности мозжечка и гиппокампа использовали ТТХ в дозе 3 нг, который инъецировали в объеме 3мкл в дорзальный гиппокамп за 1 час до обучения через предварительно вживленные канюли (по стереотаксическим координатам АР-3,5 DL±2, H-3). Контрольным животным этих серий вводили 3 мкл физиологического раствора.
Определение внеклеточного содержания нейромедиаторных аминокислот проводили методом внутримозгового диализа на свободноподвижных крысах через микродиализный U-образный зонд (мембрана типа AN-69, проницаемость до 15000 Да, "Hospal", Италия), стереотаксически имплантированный в мозжечок по координатам AP – 11,8; DL 0; H -3,5.под нембуталовым наркозом за 6 часов до начала адаптации крыс к камере. Сбор образцов диализата проводили в течение 10 минут до, во время и после сеанса обучения, а также до, во время и после сеанса тестирования. После обучения собирали 3 пробы от каждого животного, а после тестирования – 1-2 пробы. Определение содержания нейромедиаторных аминокислот проводили методом высокоэффективной жидкостной хроматографии с флуоресцентной детекцией. Для деривации аминокислот к 25 мкл диализата добавляли 10 мкл о-фтальальдегид-сульфитного реактива в 0,1М боратном буфере (рН 9,5). ГАМК, аспартат, глутамат, глицин и таурин в концентрации 0,001 мг/мл в 0,1 Н НClО4 использовали в качестве стандартной смеси для калибровки прибора. Через 15 мин после инкубации при комнатной температуре 20 мкл раствора наносили на колонку Agilent (США) размером 4,6х250 мм с сорбентом Hypersil ODS 5 mkM (США). Регистрацию продуктов разделения проводили на флуоресцентном детекторе Agilent 1100 (США) при волне возбуждения 230 нм и волне эмиссии 392 нм/ Мобильная фаза состояла из 0,05 М фосфатного буфера (рН 5,6) с 0,025 мМ ЭДТА и 5% метанола.
При исследовании содержания биогенных аминов в гомогенате червя мозжечка животных декапитировали через 5 минут, а также через 2, 4 и 24 часа после обучения, и извлекали червь мозжечка. Определение моноаминов и их метаболитов проводили в надосадочной жидкости после центрифугирования гомогената ткани (1:20 в 0,1Н HClO4 добавлением 0,2 мМ метабисульфита натрия) при 10000g, в течение 10 мин методом высокоэффективной жидкостной хроматографии с электрохимической детекцией на хроматографе LC - 304T (BAS, WESТ LAFAYETTЕ, США), снабженным инжектором RНEODYNE-7125 (США) с петлей на 20 мкл для нанесения образцов. Изучаемые вещества разделяли на обращeннофазной колонке (3х150 мм) с сорбентом С18, 5 мкм, (МНПП «Элсико», Москва) и определяли электрохимически, используя амперометрический детектор LC-4B с ячейкой TL-5. Маточные стандарты готовили в 0,1Н HClO4 в концентрации 100 мкг/мл с добавлением 0,2 мМ метабисульфита натрия в качестве консерванта. Рабочие стандарты приготовляли из маточных растворов ежедневно. Подвижную фазу (рН=3,9) приготовляли следующим образом: на 1 л деионизированной воды - 5,76 лимонной кислоты, 4,72г КH2PO4, 100мг ЭДТА, 425мг ионопарного реагента октилсульфита натрия и 9% ацетонитрила.
Для определения количества клеток Пуркинье с признаками темноклеточной гипоксической дегенерации при воздействии азида натрия после окончания процедуры тестирования животных декапитировали под тиопенталовым наркозом (50 мг/кг). Мозжечок фиксировали в 4% параформальдегиде и заливали парафином. Срезы толщиной 6 микрон депарафинизировали, окрашивали гематоксилин-эозином и оценивали количество нормальных и гиперхромных клеток Пуркинье визуально под световым микроскопом. От каждого животного исследовали не менее 15 срезов. В каждом срезе анализировали 100 и более клеток Пуркинье.
Регистрацию частоты сердечных сокращений (ЧСС) при формировании долговременного угашения АСР и условного замирания осуществляли при помощи полиграфа П84-01 (Россия). Во время сеанса адаптации и 5-минутного периода перед подачей звукового стимула ЧСС регистрировали в течение 5 с через каждые 20 с, отмечая при этом состояние подвижности или замирания животного. На фоне звуковой стимуляции регистрацию проводили в течение 5 с до и в течение 5 с после подачи сигнала.
Статистическая обработка данных.
При анализе долговременного привыкания АСР оценивали индекс спонтанного восстановления реакции (Iсв) - разность амплитуд последнего ответа в день обучения и первого ответа в день тестирования (Petrinovich, 1984). Достоверное отрицательное значение индекса в группе указывает на нарушение долговременного привыкания. Для характеристики динамики АСР в течение сеансов угашения и тестирования для экспериментальных групп и индивидуальных животных проводили вычисление коэффициентов регрессии амплитуды реакции Аn от номера стимула N в уравнении Аn=A0-bxN при обучении (b1) и тестировании (b2). Кроме того, различия в динамике АСР между группами оценивали при помощи дисперсионного анализа с повторными измерениями (repeated measures ANOVA). Был использован также t-критерий Стьюдента, непараметрические критерии Вилкоксона и Манна-Уитни и непараметрический корреляционный анализ Спирмена.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние тетродотоксина на динамику АСР и поведение замирания при введении в червь мозжечка животных с различным уровнем оборонительной мотивации. Сравнение с эффектами введения ТТХ в гиппокамп.
Для выбора адекватной модели обучения оценивали динамику АСР и поведения замирания у животных, которых при обучении помещали в экспериментальную обстановку впервые (неадаптированные крысы), а также у крыс, которых за 24 часа до обучения адаптировали к экспериментальной камере в течение 5 минут (адаптированные крысы).
Согласно литературным данным, брадикардическая реакция отражает ориентировочно-исследовательскую составляющую АСР, а тахикардия является показателем оборонительной компоненты реакции (Taylor, Printz, 1996, Gautier, Cook, 1997, Richardson et al., 1996, Lang & Davis, 2006). Поэтому у животных указанных групп проводили измерение частоты сердечных сокращений (ЧСС) с целью определения соотношения ориентировочно-исследовательской и оборонительной составляющих поведения замирания и АСР.
Обнаружено, что в день обучения ЧСС на фоне замирания перед началом звуковой стимуляции у адаптированных крыс была на 12 % ниже, чем у неадаптированных и на 8% меньше соответствующего показателя во время сеанса адаптации (p<0,05). Таким образом, предварительная адаптация животного к экспериментальному контексту снижает уровень оборонительной мотивации, вызванной изменением обстановочной афферентации.
Таблица 1. Основные показатели динамики АСР и поведения замирания у адаптированных и неадаптированных к обстановке крыс.
| Группы животных | Амплитуда первой АСР | Индекс восстановления АСР (Iсв) | Коэффициент регрессии b1 исходно | Коэффициент регрессии b2 через 24 часа | Время замирания исходно (с) | Время замирания через 24 часа |
| Неадаптиро-ванные (суммарно) n=36 | 17,9±2,1 | -3,54±2,8 | 0,70±0,13 | 0,56±0,15 | 61,6±7,8 | 118,6±7,8* |
| Неадаптиро-ванные (b>0) n=13 | 18,2 ±3,4 | -7,9 ±2,9 | 1,15 ±0,30 | 0,63 ±0,19 | 66,0± 9,6 | 108,2± 9,6* |
| Неадаптиро- ванные (b=0) n=23 | 17,4 ±3,0 | 2,5± 2,64 | 0,37± 0,19 | 0,49± 0,19 | 57,6± 9,4 | 129,6±12,2 |
| Адаптиро-ванные (суммарно) n=35 | 13,1±1,2# | 0,028±0,10 | 0,19±0,12# | 0,20±0,08# | 53,8±10,4 | 96,8±8,2#* |
| Адаптиро-ванные (b>0) n=11 | 11,9±1,8# | -2,82±1,9 | 0,79±0,14 | 0,69±0,16 | 52,8±7,4 | 130,2±9,8* |
| Адаптиро-ванные b=0 n=11 | 12,1±2,7# | 0,83±0,49 | -0,05±0,21 | 0,06±0,19 | 31,8±10,4 | 73,2±13,6#* |
| Адаптиро-ванные (b1<0) n=13 | 14,0±2,4 | 1,60±0,9 | -0,51±0,18 | -0,06±0,09 | 42,6±7,8 | 70,2±10,8* |
* - p<0.05 по сравнению с исходным уровнем, # p<0.05 по сравнению с неадаптированными крысами.
Оценка средне-групповых значений коэффициентов регрессии b1 и b2 показала (табл.1), что неадаптированные крысы в сравнении с адаптированными демонстрируют более выраженное снижение величины АСР во время обучения и при тестировании. Дальнейший анализ обнаруженных различий с оценкой индивидуальных величин коэффициента b1 позволил выявить в группе адаптированных животных три подгруппы, представленные практически в равной пропорции: 1 – крысы с доминированием процесса угашения (b1>0), 2 - крысы без выраженной тенденции в динамике АСР (b1 не демонстрирует достоверных отличий от нуля, поэтому принимаем b1=0), 3 – крысы с доминированием сенситизации (b1<0). В группе неадаптированных животных подгруппа с доминированием сенситизации отсутствовала, при этом около 2/3 от общего числа (23 из 36) составляли животные с b1=0 (табл.1.). Таким образом, предварительная адаптация к обстановке приводит к возникновению у части животных кратковременной сенситизации АСР.
А Б 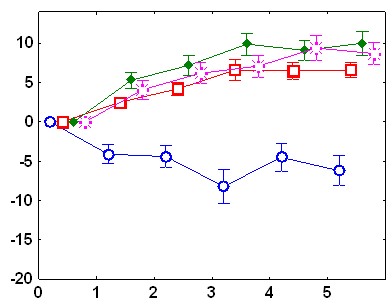
В Г
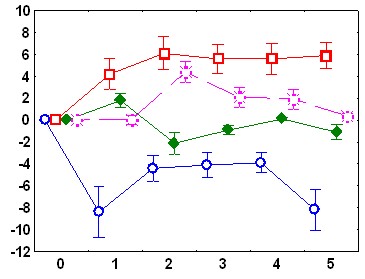
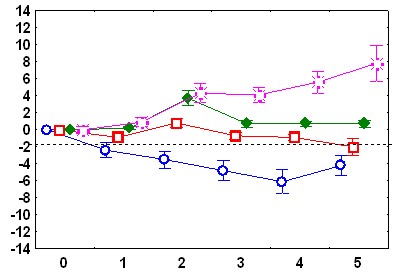
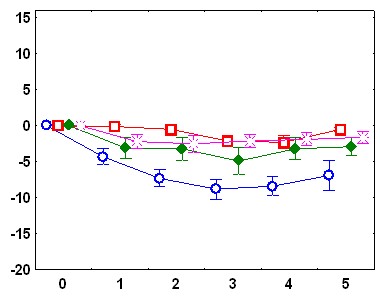
Рис.1. Изменения ЧСС после подачи звукового стимула: А - во время обучения у адаптированных крыс, Б – во время обучения у неадаптированных крыс, В – во время тестирования у адаптированных крыс, Г – во время тестирования у неадаптированных крыс. По оси абсцисс – время от начала стимула (с), По оси ординат – изменения ЧСС (1/с).
![]() 1-й стимул,
1-й стимул, ![]() 5-й стимул,
5-й стимул, ![]() 7-й стимул,
7-й стимул,  10-й стимул
10-й стимул
Существенные межгрупповые отличия обнаружены и в динамике реакций ЧСС на звуковые стимулы. У адаптированных крыс в день обучения в ответ на первый звуковой сигнал наблюдается снижение ЧСС.
Ко второму стимулу брадикардическая реакция угасает, а с 4 по 10 стимул имеет место возрастание ЧСС. В день тестирования снижение ЧСС происходит в ответ на 1-й стимул, на 4-6-й - наблюдается тахикардический ответ; который угасает при дальнейшей стимуляции (рис.1). У неадаптированных животных в день обучения снижение ЧСС наблюдается в ответ на 1-й и 2-й стимулы, затем брадикардическая реакция угасает, но в отличие от адаптированной группы, не сменяется тахикардической: уровень ЧСС после предъявления 3-10 звуковых стимулов не отличается от фоновых величин. В день тестирования у животных этой группы брадикардический ответ наблюдается только на 1-й стимул, а к 7-му стимулу развивается тахикардическая реакция (рис 1).
Таким образом, предварительная адаптация к экспериментальной обстановке повышает выраженность оборонительной составляющей в структуре АСР и вызывает у части животных (около 30%) кратковременную сенситизацию реакции.
Аппликация ТТХ на червь мозжечка неадаптированных крыс за 1 час до обучения вызывала достоверное возрастание времени замирания при первом помещении в экспериментальную камеру (109,0±15,8 с по сравнению с 66,6±6,8 с в контроле, р<0,05). Повышения данного показателя в день тестирования по сравнению с днем обучения в экспериментальной группе не наблюдалось (115,6 ±11,2 с) в то время как в контрольной группе его значение возрастало почти вдвое (до 114,2±8,6). Влияния ТТХ на исходный уровень и динамику АСР в этих условиях обнаружено не было.
Аппликация ТТХ на червь мозжечка адаптированных крыс не влияла на исходный уровень АСР и замирания (табл.2), однако приводила к достоверному уменьшению числа животных, демонстрирующих кратковременную сенситизацию АСР и возрастанию численности подгруппы животных без выраженной динамики реакции. При этом в подгруппе с b1=0 индекс спонтанного восстановления реакции был достоверно отрицательным, т.е. имела место долговременная сенситизация АСР. Во всех подгруппах экспериментальных крыс наблюдалось также нарушение формирования условного обстановочного замирания. При оценке долговременного привыкания АСР по величине коэффициента b2 достоверных различий между группами не обнаружено.
Таблица 2. Влияние тетродотоксина на угашение АСР и поведение замирания при аппликации на червь мозжечка адаптированных к обстановке крыс.
| Группы животных | Амплитуда первой АСР | Индекс восстановления АСР | Коэффициент регрессии b1 исходно | Коэффициент регрессии b2 через 24 часа | Время замирания исходно | Время замирания через 24 часа |
| Контроль (суммарно) n=32 | 12,3±1,1 | 0,031±0,9 | 0,17±0,13 | 0,29±0,09 | 54,4±5,3 | 88,6±11,8* |
| Контроль (b1>0) n=10 | 11,5±1,7 | -2,51±1,8 | 0,62±0,14 | 0,58±0,14 | 50,6±6,1 | 70,4±6,3* |
| Контроль (b1<0) n=12 | 13,5±2,1 | 1,51±0,9 | -0,57±0,12 | -0,04±0,08 | 37,0±8,6 | 65,4±12,2* |
| Контроль (b1=0) n=10 | 11,8±2,4 | 0,96±0,51 | -0,04±0,13 | 0,21±0,14 | 20,6±4,9 | 64,4±16,2* |
| ТТХ (суммарно) n=32 | 12,8± 1,6 | -2,9± 1,1^ | 0,38± 0,16# | 0,45± 0,12 | 58,8±10,0 | 77,2± 9,4 |
| ТТХ (b1>0) n=14 | 14,1±2,6 | -2,52±1,9 | 0,86±0,28 | 0,41±0,18 | 51,6±16,8 | 75,6±14,2 |
| ТТХ (b1<0) n=3 | 12,5±1,9 | 1,51±0,8 | -0,93±0,31 | 0,34±0,44 | 53,0±14,6 | 55,0±12,4 |
| ТТХ (b1=0) n=15 | 13,3±2,3 | -4,2±1,6^# | -0,05±0,24 | 0,52±0,24 | 53,4±13,8 | 79,2±18,8 |
* - p<0.05 по сравнению с исходным уровнем, # p<0.05 по сравнению с контролем,. ^ - p<0.05 – достоверное отличие от нулевого значения
У адаптированных крыс с введением ТТХ в червь мозжечка обнаружена отрицательная корреляционная зависимость между временем замирания в день обучения до начала звуковой стимуляции и амплитудой первой АСР (r=–0,59, р=0,0017 по сравнению с r=–0,12 р>0,1 в контроле) и положительная корреляционная зависимость (r=0,36, p<0,05) между индексом восстановления реакции и изменением времени замирания в день тестирования по сравнению с днем обучения, (в контрольной группе r=0,19, p>0,1).
Таблица 3. Влияние ТТХ на динамику АСР и поведение замирания при введении в гиппокамп неадаптированных к экспериментальной обстановке крыс.
| Группы животных | Амплитуда первой АСР | Индекс восстановле-ния АСР | Коэффициент регрессии b1 исходно | Коэффициент регрессии b2 через 24 часа | Время замирания исходно | Время замирания через 24 часа |
| Контроль (суммарно) n=24 | 19,5±2,3 | -5,4±2,1 | 0,67±0,16 | 0,70±0,13 | 66,8±6,8 | 114,2±8,6* |
| Контроль (b>0) n=8 | 23,7 ±2,7 | -8,2 ±3,8 | 1,11 ±0,10 | 0,94 ±0,37 | 74,2± 13,2 | 116,0± 16,2* |
| Контроль (b=0) n=16 | 17,4±2,3 | -3,6± 2,6 | 0,07± 0,10 | 0,43± 0,28 | 58,8±11,6 | 105,2 ±18,2* |
| ТТХ (суммарно) n=18 | 27,1± 2,5# | -13,2± 4,7# | 1,51± 0,34 | 0,15± 0,33# | 53,4 ±11,2 | 67,4± 16,2 |
| ТТХ (b>0 n=16 | 26,0± 2,62 | -16,5± 2,7# | 1,74± 0,13# | 0,06± 0,31# | 59,8± 22,8 | 70,4± 15,7 |
| ТТХ b=0 n=4 | 31,0± 4,89# | - 8,0±5,9 | 0,59±0,41 | 0,54±0,39 | 51,6± 7,8 | 48,0± 8,2 |
* - p<0.05 по сравнению с исходным уровнем, # p<0.05 по сравнению с контролем
У неадаптированных крыс введение ТТХ в гиппокамп приводило к возрастанию исходного уровня АСР, стимуляции кратковременного угашения и возникновению долговременной сенситизации реакции, (оцениваемой по показателю спонтанного восстановления и величине коэффициента b2), а также нарушало формирование условного замирания (табл.3).
При введении ТТХ в гиппокамп адаптированных крыс (табл.4) достоверно возрастала численность подгруппы без выраженной динамики АСР (р=0,037) за счет уменьшения количества крыс с кратковременным угашением реакции. В экспериментальной группе этой серии наблюдалось повышение исходного времени замирания в день обучения (табл.4), однако не было обнаружено дальнейшего возрастания времени замирания в день тестирования.
Таким образом, независимо от адаптации к обстановке, введение ТТХ как в гиппокамп, так и в мозжечок, нарушает формирование условной реакции замирания. Эффекты «инактивации» мозжечка и гиппокампа на другие показатели оборонительного поведения зависят от адаптации к экспериментальной обстановке и, в ряде случаев, имеют противоположную направленность: изменения, наблюдаемые при депрессии активности мозжечка у адаптированных животных,
сходны с эффектами, наблюдаемыми при депрессии гиппокампа у неадаптированных крыс, и наоборот (табл.5).
Таблица 4. Влияние ТТХ на динамику АСР и поведение замирания при введении в гиппокамп адаптированных к экспериментальной обстановке крыс
| Группы животных | Амплитуда первой АСР | Индекс восстановле-ния АСР | Коэффициент регрессии b1 исходно | Коэффициент регрессии b2 через 24 часа | Время замирания исходно | Время замирания через 24 часа |
| Контроль (суммарно) n=24 | 13,5±3,5 | 0,21±0,6 | 0,25±0,14 | 0,24±0,11 | 53,2±8,7 | 99,2±12,8* |
| Контроль (b>0) n=9 | 14,9±3,7 | 1,58±1,4 | 0,71±0,16 | 0,61±0,23 | 98,5±10,7 | 136,3±18,1* |
| Контроль (b=0) n=8 | 12,8±2,9 | 0,83±0,42 | -0,11±0,19 | -0,09±0,10 | 25,9±6,2 | 59,2±15,8* |
| Контроль (b<0) n=7 | 13,7±4,2 | - 1,47±0,5 | -0,43±0,14 | -0,10±0,08 | 38,2±7,2 | 70,9±8,4* |
| ТТХ (суммарно) n=24 | 10,1 ± 3,4 | 0,23± 0,7 | 0,18± 0,19 | 0,31± 0,09 | 112,6±22,8 | 88,0 ±18,4 |
| ТТХ (b>0) n=3 | 11,8± 4,9 | -1,64±1,1 | 0,94± 0,37 | 0,52± 0,18 | 40± 9,9 | 58,8± 12,2 |
| ТТХ b=0 n=15 | 9,9 ± 3,0 | 0,48± 0,29 | 0,07± 0,08 | 0,08± 0,09 | 158,2 ±8,4 | 88,0 ±22,4 |
| ТТХ (b<0) n=7 | 10,6± 2,7 | 1,02±0,85 | -0,81± 0,39 | -0,32± 0,19 | 82,0 ±26,2 | 107,5 ±39,9 |
*- p<0.05 по сравнению с исходным уровнем,
Учитывая данные о соотношении ориентировочно-исследовательской и оборонительной составляющих поведения замирания и АСР у адаптированных и
Таблица 5. Эффекты нарушений функций мозжечка и гиппокампа на поведение замирания и угашение АСР у адаптированных и неадаптированных животных.
| Структура, в которую вводили ТТХ/опыт адаптации к контексту | Кратковре-менное угашение АСР | Спонтанное Восстановле- ние АСР | Замирание исходно | Возрастание замирания в день тестирования |
| Мозжечок, неадаптированные | 0 | 0 | + | - |
| Гиппокамп, недаптированные | + | + | 0 | - |
| Мозжечок, адаптированные | + | + | 0 | - |
| Гиппокамп, адаптированные | - | 0 | + | - |
неадаптированных крыс, можно сделать вывод, что подавление активности мозжечка оказывает влияние на эти формы поведения в условиях более высокого уровня оборонительной составляющей, а при доминировании ориентировочной компоненты более выраженные эффекты наблюдаются при подавлении активности гиппокампа..
Исходя из полученных результатов, дальнейшие эксперименты проводили на адаптированных к обстановке животных
Эффекты вызванные азидом натрия. Исследование протекторного влияния пептида HLDF6. Введение NaN3 приводило к т.н. темноклеточной дегенерации
Таблица 6. Влияние азида натрия и пептида HLDF6 на динамику АСР и поведение замирания при аппликации на червь мозжечка за 5 дней до обучения.
| Группы животных | Амплитуда первой АСР | Индекс восстанов-ления АСР | Коэффициент регрессии b1 исходно | Коэффициент регрессии b2 через 24 часа | Время замирания исходно | Время замирания через 24 часа |
| Физ. р-р (суммарно) n=21 | 14,9± 2,5 | 0,5± 0,47 | 0,43± 0,25 | 0,35± 0,17# | 62,6± 15,6 | 100,8± 10,2* |
| Физ. р-р (b>0) n=7 | 17,0± 3,5 | -4,0 ±2,2 | 1,77± 0,46 | 0,44± 0,11 | 95,2± 8,4 | 123,5± 9,8* |
| Физ. р-р (b=0) n=7 | 14,3 ±5,9 | -0,7± 2,6 | 0,38± 0,16 | 0,39 ± 0,23 | 34,6 ±10,1 | 77,4± 11,0* |
| Физ. р-р (b<0) n=7 | 12,4± 3,4 | 5,0 ±2,8 | -1,6± 0,44 | -1,03± 0,48 | 54,0 ±10,4 | 85,6± 9,2 |
| NaN3 (суммарно) n=22 | 14,6± 2,2 | -5,3 ±2,3# ^ | 0,07 ±0,24 | 0,41± 0,21 | 49,0± 10,4 | 65,8± 11,6 |
| NaN3 (b>0) n=3 | 27,3± 2,3 | -5,3 ±3,7 | 2,4± 0,37 | 0,36± 0,34 | 86,2± 12,4 | 73,5± 19,6 |
| NaN3 (b=0) n=11 | 11,7± 1,8 | -9,7 ±3,9#^ | 0,36± 0,34 | 0,55 ±0,26 | 42,9± 8,6 | 64,2± 11,2 |
| NaN3 (b<0) n=8 | 11,2± 3,2 | 1,0 ±1,8 | -1,2± 0,23 | 0,28± 0,35 | 62,2± 9,9 | 64,0± 9,0 |
| NaN3+HLDF6 (суммарно) n=24 | 15,1± 3,7 | 3,05 ±3,22 | 0,13±0,34 | 0,6± 0,29 | 59,9± 8,0 | 92,0± 9,7 * |
| NaN3+НLDF6 (b>0) n=4 | 24,0 ±4,9 | 2,0 ±3,1 | 2,48± 1,0 | 1,25± 0,34 | 58,0 ±6,2 | 79,0± 7,2* |
| NaN3+HLDF6 (b=0) n=12 | 11,4± 3,6 | -1,5 ±3,3 | 0,45± 3,1 | 0,64± 0,37 | 72,6± 6,6 | 93,2± 8,2* |
| NaN3+HLDF6(b<0) n=8 | 11,0 ±2,5 | 6,8 ±1,5# | -2,36± 1,0 | 0,42± 0,25 | 62,5 ±6,1 | 94,0 ±10,2* |
*- p<0,05 - отличия от исходного уровня. ^ p<0,05 – отличия от контроля, # p<0,05 отличия от нулевого значения
клеток Пуркинье, характерной для гипоксических поражений. В контроле число таких клеток составило 21±6%, что соответствует литературным данным и, возможно, связано с глутаматной токсичностью (Pae EK, et al., 2005). После введения NaN3 количество поврежденных клеток Пуркинье возрастало до 63±3%, тогда как аппликация HLDF6 через 5 мин после азида натрия достоверно снижала его до 42±4% (p<0,05).
Обнаружено, что время замирания в сеансе адаптации в группе, получавшей NaN3, было достоверно выше, чем в контроле (98,4±10,2 с по сравнению с 65,2±8,1с p<0,05) и снижалось до 61,4±9,6 с при воздействии HLDF6. Введение NaN3 вызывало нарушение кратковременного угашения АСР (табл.6), ассоциированное с уменьшением количества крыс, демонстрирующих привыкание (b1>0) и увеличением числа животных без выраженной динамики реакции (b1=0),, а также подавление долговременного угашения АСР по показателю спонтанного восстановления (преимущественно в подгруппе с b1=0) и нарушение формирования условного замирания.
Введение пептида HLDF6 не влияло на показатели динамики АСР в день обучения, однако восстанавливало долговременное угашение АСР и формирование поведения замирания, нарушенные азидом натрия (табл.6).
Эффекты белка S100b в дозе, вызывающей апоптоз. Глиальный белок S100b, секретируемый астроцитами в межклеточное пространство, в зависимости от концентрации, оказывает протекторное или проапоптотическое действие на нервные клетки (Rothermundt al., 2003). Аппликация S100b на червь мозжечка крыс за 4 часа до начала обучения в дозе, которая, согласно литературным данным, вызывает апоптоз (500 нг/3мкл), приводила к подавлению кратковременного привыкания (табл.7). На индекс спонтанного восстановления существенного влияния введение S100b не оказывало, однако у всех крыс было нарушено долговременное привыкание, оцениваемое по коэффициенту b2, а также формирование условного обстановочного замирания.
Полученные результаты свидетельствуют, что с функциями мозжечка связан контроль безусловной реакции замирания при высоком уровне оборонительной мотивации, направленный на предотвращение избыточного проявления пассивно-оборонительного поведения, и обеспечивающий адекватный уровень ориентировочно-исследовательской активности. Так, аппликация ТТХ и NaN3 на червь мозжечка приводила к возрастанию времени замирания животных при первом помещении в экспериментальную камеру. Кроме того, обнаружено, что подавление активности червя мозжечка нарушает формирование условного обстановочного замирания. Документированные нами факты также указывают на участие червя мозжечка в обеспечении кратковременного привыкания и кратковременной сенситизации АСР.
Таблица 7. Влияние белка S100b в дозе 500 нг на динамику АСР и поведение замирания при аппликации на червь мозжечка крыс за 4 часа до обучения.
| Группы животных | Амплитуда первой АСР | Индекс восстановле- ния АСР | Коэффициент регрессии b1 исходно | Коэффициент регрессии b2 через 24 часа | Время замирания исходно | Время замирания через 24 часа |
| Контроль (суммарно) n=20 | 16,4 ± 2,9 | 2,1± 1,9 | 0,29± 0,17 | 0,56 ± 0,22 | 52,8± 4,4 | 78,4± 6,6* |
| Контроль (b>0) n=7 | 18,4± 2,9 | -2,0 ±2,3 | 1,03± 0,47 | 0,52± 0,23 | 77,0± 10,4 | 102,8± 9,2* |
| Контроль (b=0) n=8 | 16,0 ±3,6 | 3,38± 2,7 | 0,31± 0,51 | 0,57± 0,37 | 35,8± 8,2 | 64,8± 5,9* |
| Контроль (b<0) n=5 | 13,2 ±3,9 | 5,1 ± 3,2 | -1,58± 0,62 | -0,57± 0,29 | 43,6± 7,4 | 91,2 ±6,0* |
| S100b (суммарно) n=21 | 11,2 ±2,7 | 2,2 ± 1,4 | -0,39± 0,35^ | 0,23± 0,16^ | 64,0± 7,8 | 63,8± 5,6 |
| S100b (b>0) n=0 | - | - | - | - | - | - |
| S100b n=15 (b=0) | 10,1± 3,02 | 2,3 ±2,0 | -0,18 ± 0,49 | 0,2 ±0,34 | 69,4±9,6 | 64,2± 8,6 |
| S100b n=6 (b<0) | 12,0± 3,14 | 2,0 ±1,8 | -2,00± 0,44 | 0,26± 0,27 | 87,6± 5,5 | 72,2± 9,8 |
* p<0,05 - отличия от исходного уровня, ^ p<0,05 – отличия от контроля
# p<0,05 отличия от нулевого значения
При анализе данных о влиянии нарушения функций червя мозжечка на долговременное привыкание АСР, следует учитывать, что привыкание и сенситизация как формы неассоциативного обучения являются системным результатом согласованной работы различных отделов ЦНС, функционирующих в качестве интегрирующих и дифференцирующих элементов (Г.В.Гершуни, 1968, Thompson and Spenser, 1972, Poon and Young, 2006). На начальном этапе стимуляции в условиях постоянно изменяющейся активности ЦНС работа системы недостаточно скоординирована, вследствие чего возможна избыточность привыкания или сенситизации. В процессе обучения уровень взаимосодействия элементов системы повышается, что находит отражение в изменении параметров динамики реакции (в частности, значений коэффициентов линейной регрессии), а также в сохранении достигнутого при обучении уровня реакции, либо в ее спонтанном восстановлении, компенсирующем избыточную кратковременную сенситизацию или привыкание. Анализ динамики АСР у совокупной выборки адаптированных контрольных животных в описанных экспериментах (табл. 2, 4, 6-8) показывает, что у крыс с доминированием кратковременной сенситизации спонтанное восстановление проявляется как снижение амплитуды первой АСР в сеансе тестирования по сравнению с амплитудой последней АСР сеанса обучения, т.е. имеет место долговременная десенситизация. Напротив, у крыс с доминированием кратковременного угашения имеет место долговременное растормаживание, т.е. повышение амплитуды первой реакции (рис.2). При изменении активности медиального мозжечка может наблюдаться подавление как кратковременной сенситизации, так и кратковременного угашения с одновременным нарушением спонтанного восстановления амплитуды АСР в первой пробе сеанса тестирования. Нарушение спонтанного восстановления имеет место в подгруппах без выраженной динамики, т.е. именно тех, численность которых увеличивается при уменьшении количества крыс, демонстрирующих привыкание или сенситизацию.
Рис. 2. Динамика АСР у адаптированных к контексту контрольных крыс, принадлежащих к различным подгруппам в зависимости от индивидуального значения коэффициента b1. * - p<0,05 по сравнению с амплитудой первой реакции в день тестирования у крыс соответствующей подгруппы.
Учитывая, что в структуре первой АСР сеанса тестирования доминирует ориентировочно-исследовательская составляющая, можно заключить, что при формировании приспособительного поведения в условиях интенсивной акустической стимуляции с функциями медиального мозжечка связаны механизмы долговременного растормаживания и долговременной десенситизации АСР, обеспечивающие оптимальный уровень ориентировочно-исследовательской составляющей активно-оборонительного поведения при повторном помещении животного в экспериментальную обстановку. Кроме того, возникновение положительной корреляции между показателями условного страха и спонтанного восстановления АСР при подавлении активности червя мозжечка свидетельствует об участии этого отдела мозга в обеспечении интеграции пассивно- и активно-оборонительных реакций.
Участие червя мозжечка в консолидации долговременного привыкания АСР и условного обстановочного страха.
При изучении вовлечения медиального мозжечка в механизмы консолидации различных видов оборонительного поведения в качестве одного из инструментов исследования использовали ингибитор синтеза белка циклогексимид (ЦГ). Аппликация ЦГ на червь мозжечка через 5 минут после обучения не оказывала влияния на спонтанное восстановление АСР (рис.3), но вызывала достоверное снижение коэффициента регрессии b2 (0,07±0,23 по сравнению с 1,03±0,36 в контроле, р<0,05 ). Дисперсионный анализ выявил различия в динамике АСР между контрольной и экспериментальной группами во второй половине сеансе тестирования (с 6 по 10 стимулы, p=0,0038); но не в первой его половине (p=0,58), (рис. 3.). Сходные данные получены при аппликации на червь мозжечка ингибитора синтеза мРНК актиномицина D: достоверные различия с контролем наблюдались во второй половине тестирования (p=0,0014), а коэффициент b2 у экспериментальных животных составил 0,28±0,21 по сравнению с 1,1±0,29 в контроле р<0,05). Ни ЦГ, ни актиномицин D при аппликации на червь мозжечка через 5 минут после обучения не оказывали существенного влияния на поведение замирания в день тестирования (рис.3).
Согласно полученным нами данным (рис.1), во второй половине сеанса тестирования у контрольных животных происходит угашение оборонительной составляющей АСР. Таким образом, ингибиторы синтеза белка и РНК при ведении в червь мозжечка избирательно подавляют привыкание оборонительной компоненты стартл-реакции.
При аппликации ЦГ на червь мозжечка через 2 часа после сеанса угашения, наблюдалось достоверное спонтанное восстановление реакции (Iсв=-5,3 ±2,1), а значения коэффициента b2 не отличались от контрольного (рис.4). Время замирания в сеансе тестирования у экспериментальных крыс было достоверно ниже, чем у контрольных (62,6 ±15,5 по сравнению с 109,9±13,5, р<0,05), при этом наблюдалась отрицательная корреляционная зависимость между возрастанием времени замирания и индексом спонтанного восстановления реакции ( r=-0,53, p=0,024), которой не было выявлено у животных, получавших физиологический раствор.
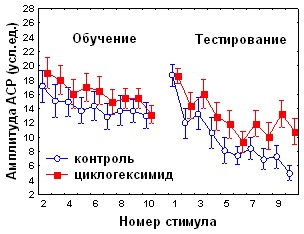
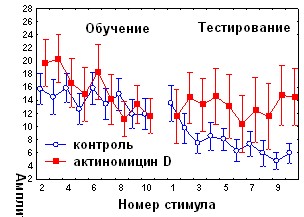
Рис. 3 Влияние циклогексимида и актиномицина D на динамику АСР при аппликации на червь мозжечка крыс через 5 минут после обучения
Аналогичное влияние оказывали моноклональные антитела к белку А3G7, обладающему нейроростовыми и нейротрофическими эффектами (Ельникова и др., 1992, 1995). У животных, которым через 2 часа после обучения апплицировали на червь мозжечка антитела к A3G7 в дозе 5 мкг (рис.4), наблюдалось достоверное спонтанное восстановление АСР (Iсв=-6,25± 2,4) и подавление консолидации/хранения поведения условного замирания (возрастание времени замирания в день тестирования по сравнению с днем обучения составило 21,2± 8,3 с, по сравнению с 54,2± 10,4 с в контроле). Сходные данные относительно избирательного влияния на угашение оборонительной составляющей АСР и на консолидацию обстановочного страха были получены нами ранее при введении в мозжечок антител к белку S100b и мозгоспецифичным лектинам через 2 часа после сеанса обучения (Sherstnev et al., 2000, 2003).

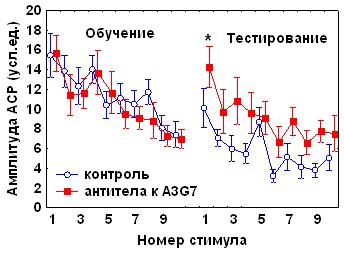
Рис. 4. Влияние циклогексимида и антител к белку A3G7 на динамику АСР при аппликации на червь мозжечка крыс через 2 часа после обучения * -p<0,05 по сравнению с амплитудой последней АСР в день тестирования
Таким образом, обнаружено, что через 5 минут после обучения с функциями червя мозжечка связаны механизмы консолидации долговременного привыкания оборонительной составляющей АСР, а через 2 часа – консолидация привыкания ориентировочно-исследовательской составляющей стартл-реакции и обстановочного условного замирания. Нарушение функций мозжечка на стадии консолидации приводит к разнонаправленным долговременным изменениям пассивно- и активно-оборонительных форм поведения (привыкания АСР и условного замирания), в то время как на этапе формирования эти изменения носят однонаправленный характер.
В немногочисленных исследованиях, посвященных данному вопросу, получены противоречивые сведения о временных параметрах участия мозжечка в процессах консолидации долговременной памяти при формировании различных видов поведения (Cooke еt al. 2004, Такehara et al., 2003). Высказываются мнения, что при формировании моторных навыков процессы консолидации кинематической внутренней модели, обеспечивающей быстрое движение к цели и основанной на сенсорной информации, и динамической внутренней модели, основанной на проприоцептивной информации (или копиях моторных команд) имеют разные временные параметры. (Krakauer et al., 1999, 2006). Полученные нами данные согласуются с этим предположением и указывают, что подобная разновременность характерна также для консолидации различных форм оборонительного поведения и, по крайней мере, отчасти связана с особенностями вовлечения мозжечка в эти процессы.
Участие нейромедиаторных систем мозжечка в процессах угашения АСР и формирования условного обстановочного страха.
На различных этапах формирования долговременного угашения АСР и условного обстановочного страха в черве мозжечка были выявлены изменения активности отдельных нейромедиаторных систем. Достоверных изменений содержания внеклеточного аспартата (базовый уровень в микродиализной пробе 6,3±0,58 fmol), во время обучения и тестирования обнаружено не было (рис.5). Достоверных изменений внеклеточного уровня глутамата (базовый уровень 35,3 ±7,0 fmol) в день обучения не выявлено. Через 24 часа после обучения содержание глутамата повышалось на 40% по сравнению с показателем, наблюдавшимся во время обучения, однако на фоне тестирования его значения не демонстрировали достоверных отличий от имевших место в день обучения (рис 5). Была обнаружена отрицательная корреляция между индивидуальными показателями динамики глутамата через 30 минут после обучения и амплитудой первой АСР в день обучения (r= -0,90, р<0,05 ), а также с амплитудами первых трех АСР день тестирования (r= -0,73, -0,92 и -0,87 р<0,05). Обнаружена положительная корреляция между абсолютными значениями уровня внеклеточного глутамата во время тестирования и индексом восстановления АСР (r= 0,88, p<0,01).
Исходное содержание глицина составляло 17,1± 7,9 fmol, и на фоне тенденции к его снижению во время обучения на 25 % по сравнению с базовым уровнем (р=0,083 по критерию Вилкоксона) наблюдалась положительная корреляция изменения содержания глицина в этой временной точке с возрастанием времени замирания в день тестирования по сравнению с днем обучения (r=0,92, р<0,01). Содержание глицина через 20 и 30 минут после обучения не отличалось от исходного уровня (рис.5). Перед началом тестирования содержание глицина достоверно повышалось по сравнению с сеансом обучения, однако во время тестирования, как это наблюдалось для глутамата, снижалось практически до исходного уровня и достоверных отличий от показателей, наблюдаемых в день обучения, обнаружено не было.
Рис. 5. Динамика изменений уровня аспаратата, глутамата и глицина в черве мозжечка на различных этапах формирования угашения АСР и условного замирания. * - p<0,05 по сравнению с исходным уровнем.
Внеклеточное содержание ГАМК (базовый уровень 2,1± 0,94 fmol в пробе) достоверно повышалось в течение 10-30 минут после обучения (p<0,05 по критерию Вилкоксона) (рис.6А). Отмечена высокая индивидуальная вариабельность исходного уровня и изменений ГАМК. Через 24 часа после обучения и во время тестирования содержание ГАМК не отличалось от исходного, однако его повышение наблюдалось сразу после сеанса тестирования
А Б
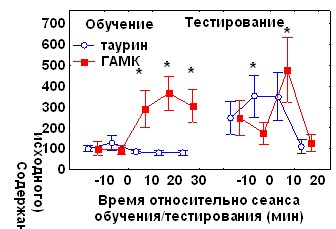
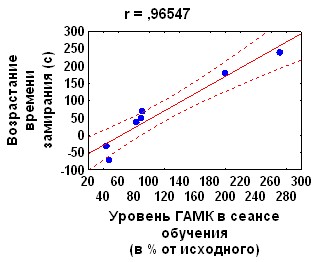
Рис. 6. А - динамика изменений уровня ГАМК и таурина в черве мозжечка на различных этапах формирования угашения АСР и условного замирания, Б -корреляционные зависимости между возрастанием времени замирания в сеансе тестирования по сравнению с сеансом обучения и изменением содержания ГАМК. * - p<0,05 по сравнению с исходным уровнем.
Как и для глицина, выявлена достоверная положительная корреляция между индивидуальными изменениями уровня ГАМК во время обучения и возрастанием времени замирания в день тестирования (рис.6Б).
Достоверное повышение содержания таурина (базовый уровень 1,9 fmol) было отмечено только во время тестирования. В остальных временных точках наблюдались чрезвычайно высокие индивидуальные различия в динамике содержания этого медиатора (рис.6А). Выявлена положительная корреляция абсолютных значений исходного уровня таурина с коэффициентами b1 (r=0,96, p<0,05) и b2(r=0,84, p<0,05), а также отрицательная корреляция между изменениями его содержания во время тестирования и индексом спонтанного восстановления АСР (r=0,88, p<0,05).
Аппликация на червь мозжечка антагониста NMDA глутаматных рецепторов APV, за 1 час до обучения не оказывая влияния на кратковременное угашение АСР, вызывала подавление долговременного привыкания ее ориентировочно-исследовательской составляющей (рис.7). Влияния APV на привыкание оборонительной компоненты АСР и поведение замирания не обнаружено.
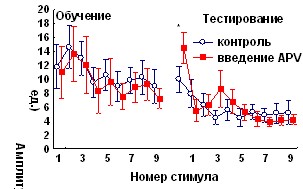

Рис. 7. Влияние антагонистов рецепторов глутамата на динамику АСР при введении за 1 час до начала обучения.
Антагонист АМРА-рецепторов глутамата CNQX вызывал кратковременную сенситизацию АСР F(1, 9,190)=4,44, p<0,01 с возрастанием числа животных, демонстрирующих сенситизацию (9 из 18) и снижением численности подгруппы с угашением (3 из 18). При этом CNQX стимулировал долговременное угашение ориентировочной составляющей АСР: индекс спонтанного восстановления в экспериментальной группе был достоверно выше, чем в контроле (p<0,05 по критерию Манна-Уитни), и повышение его происходило за счет подгруппы, которая в сеансе обучения демонстрировала сенситизацию. В день тестирования у экспериментальных животных наблюдалась стимуляция угашения АСР по показателю b2, за счет более быстрого снижения амплитуды 1-3 ответов, т.е. на стадии доминирования ориентировочно-исследовательской составляющей реакции (рис.7). Влияния CNQX на поведение замирания обнаружено не было.
Антагонист ГАМКА рецепторов бикукуллин при введении за 1 час до обучения вызывал повышение амплитуды АСР, не оказывая влияния на кратковременное угашение и спонтанное восстановление реакции, и нарушал привыкание АСР во второй половине сеанса, т.е., на стадии угашения оборонительной составляющей реакции (рис.8).
Факлофен, антагонист ГАМКБ рецепторов, в аналогичных условиях не оказывал влияния на исходную амплитуду АСР, но, как и бикукуллин, вызывал нарушение долговременного привыкания оборонительной составляющей реакции (рис.8).. 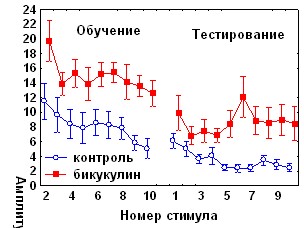
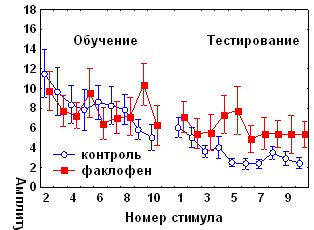
Рис. 8. Влияние антагониста ГАМКА рецепторов бикукуллина и антагониста ГАМКБ –рецепторов факлофена на динамику АСР при аппликации на червь мозжечка крыс за 1 час до начала обучения.
Введение таурина за 1 час до обучения приводило к нарушению кратковременного угашения (рис. 9) за счет уменьшения количества животных с b1>0 (1 из 19 по сравнению с 7 из 19 в контроле) и повышения количества крыс без выраженной тенденции в динамике АСР.
Рис. 9. Влияние таурина на динамику АСР при аппликации на червь мозжечка крыс за 1 час до начала обучения
В то же время, таурин стимулировал долговременное привыкание ориентировочной компоненты АСР и по амплитуде первого ответа в день тестирования различий между группами не наблюдалось. В сеансе тестирования у животных, получавших инъекции таурина, было нарушено привыкание оборонительной составляющей АСР. Полученные результаты согласуются с данными о положительной корреляции коэффициентов b1 и b2 с исходным уровнем таурина и отрицательной корреляции между уровнем таурина при тестировании и индексом спонтанного восстановления АСР. Влияния таурина на поведение замирания выявлено не было.
При изучении уровня биогенных аминов и их метаболитов в гомогенате червя мозжечка обнаружено возрастание уровня норадреналина через 4 часа после обучения и тенденция к его снижению через 24 часа, не достигающая уровня достоверности. Уровень серотонина повышался через 5 минут и 4 часа после обучения, а через 24 часа его содержание снижалось на 60% по сравнению с контролем (рис.10А). Уровень 5-ОИУК достоверно снижался через 4 и 24 часа после обучения. В условиях введения циклогексимида в червь мозжечка через 5 минут, но не через 2 часа после обучения снижения показателей активности серотонинергической системы не наблюдалось (рис. 10Б), таким образом, этот процесс зависит от синтеза белка в медиальном мозжечке.
А Б
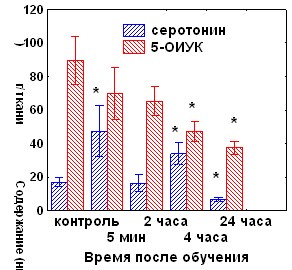
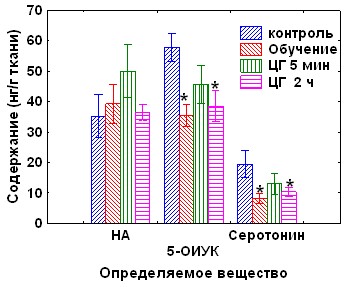 Рис. 10. А - показатели активности серотонинергической системы мозжечка в различные сроки после обучения. Б - влияние циклогексимида на содержание моноаминов через 24 часа после обучения. ЦГ 5 мин – введение циклогексимида через 5 минут после обучения, ЦГ 2 ч – введение циклогексимида через 2 часа после обучения.. * - р<0,05 по сравнению с контрольным уровнем
Рис. 10. А - показатели активности серотонинергической системы мозжечка в различные сроки после обучения. Б - влияние циклогексимида на содержание моноаминов через 24 часа после обучения. ЦГ 5 мин – введение циклогексимида через 5 минут после обучения, ЦГ 2 ч – введение циклогексимида через 2 часа после обучения.. * - р<0,05 по сравнению с контрольным уровнем
Ритансерин – антагонист 5-НТ2 серотониновых рецепторов при введении до обучения не оказывал влияния на кратковременное угашение и спонтанное восстановление АСР, однако вызывал нарушение угашения оборонительной составляющей реакции (рис11А).
А Б
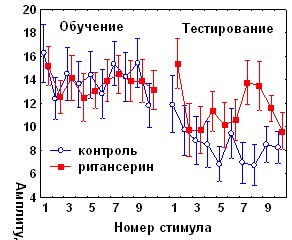
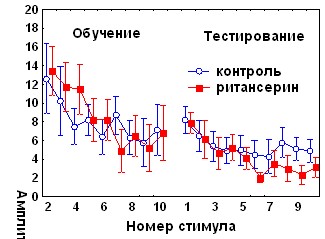
Рис. 11. Влияние ритансерина на динамику АСР. А - при аппликации на червь мозжечка крыс за 1 час до начала обучения, Б - за 1 час до начала тестирования.
У экспериментальных животных этой серии не наблюдалось также достоверного возрастания времени замирания в день тестирования по сравнению с днем обучения (показатель возрастания времени замирания составил 41,3±21,1с при контрольном уровне 77,4 ±9,6с, р<0,05). Введение ритансерина за 1 час до тестирования (рис.11Б) избирательно стимулировало угашение оборонительной компоненты АСР по данным дисперсионного анализа (для второй половины сеанса тестирования: F (1, 5, 175)=2,36, p<0,05) и по величине коэффициента b2 (0,63±0,15 по сравнению с 0,28±0,09, р<0,05). Влияния ритансерина на поведение замирания при введении перед тестированием обнаружено не было.
Таким образом, полученные данные свидетельствуют, что глутаматэргические синаптические процессы, опосредующие сенсорную информацию от мшистых волокон, избирательно вовлечены в обеспечение долговременного угашения ориентировочной составляющей АСР. В то же время, с изменениями активности серотонинергических афферентов и находящихся под их модуляторным воздействием тормозных ГАМК/глицинэргических интернейронов (Калиниченко, Мотавкин, 2005), связано формирование и реализация долговременного угашения оборонительной составляющей АСР, а также формирование обстановочного пассивно-оборонительного поведения замирания. Выявленные нами факты также указывают на участие тауринергических механизмов как в обеспечении кратковременного привыкания/сенситизации, так и долговременного растормаживания/десенситизации АСР.
Исследование механизмов участия медиального мозжечка в обеспечении сенситизации и десенситизации АСР.
Анализ динамики АСР (рис. 2-4, 7-9, 11) показывает, что изменения амплитуды реакции носят неравномерный характер. Поэтому, наряду с коэффициентами b1 и b2, для характеристики процессов привыкания/сенситизации при обучении и тестировании оценивали закономерности колебательных процессов методом последовательных разностей, т.е. вычитанием последующего значения из предыдущего с дальнейшим анализом полученной последовательности (Бокс, Дженкинс, 1974). Было обнаружено, что изменение амплитуды АСР на стимул n – SDn, у контрольных крыс демонстрирует положительную корреляцию с амплитудой предыдущей реакции An (рис.12). В результате такой зависимости, отрицательные (сенситизация) и положительные (угашение) значения SDn чередуются с периодом в 1-2 стимула. В значительной степени от соотношения значений изменений амплитуды в сторону сенситизации или угашения, частоты и чередования таких изменений зависит динамика реакции в целом. Обнаружено, что нарушение соотношения привыкания и сенситизации в день обучения или долговременного угашения оборонительной составляющей АСР при воздействиях на червь мозжечка сопровождаются изменениями параметров, характеризующих колебательные изменения амплитуды АСР.
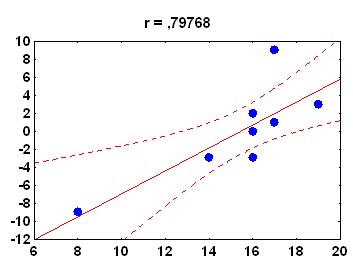
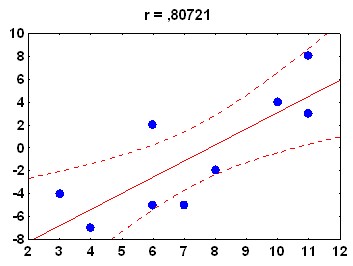
Рис. 12 Корреляционные зависимости между амплитудой АСР и ее последующим изменением, в сеансе обучения. Приведены данные по двум случайно выбранным контрольным животным. По оси абсцисс – амплитуда АСР (An), по оси ординат – последующее изменение амплитуды АСР (SDn)
Так, у адаптированных к контексту крыс аппликация ТТХ на червь мозжечка, наряду с нарушением кратковременной сенситизации, вызывает снижение коэффициента корреляции между SDn и An (0,61± 0,021 по сравнению с 0,72± 0,035 в контроле, p<0,01). Напротив, введение CNQX вызывает кратковременную сенситизацию АСР, а также повышение коэффициента корреляции между SDn и An (0,91±0,036 по сравнению с 0,76± 0,029, p<0,01). Таким образом, червь мозжечка вовлечен в процесс регуляции колебательных изменений АСР, осуществляемой на основе информации об амплитуде текущей реакции.
Обнаружено также, что у контрольных крыс во время обучения средняя амплитуда АСР, после которых наблюдаются SD c отрицательным значением
(А-), ниже, чем средняя амплитуда АСР, после которых следует SD c положительным значением (А+) (рис. 12). В сеансе тестирования у контрольных животных наблюдается снижение средней амплитуды АСР по сравнению с обучением, при этом средние значения А+ и А- также снижаются (табл.8). При аппликации циклогексимида или актиномицина D через 5 минут после обучения снижение значений А- в сеансе тестирования по сравнению с сеансом обучения не происходило, в то время как динамика значений А+ не отличалась от контрольной. Аналогичный эффект наблюдался при аппликации на червь мозжечка бикукуллина, факлофена и ритансерина до начала обучения, т.е., в тех случаях, когда имело место подавление угашения оборонительной составляющей АСР. Напротив, у животных, получавших ритансерин перед тестированием, наряду со стимуляцией долговременного привыкания оборонительной составляющей АСР, наблюдалось также снижение А- по сравнению с контролем (табл.8).
Таблица 8. Влияние ингибиторов синтеза белка и антагонистов нейромедиаторных рецепторов на показатели сенситизации/десенситизации и привыкания/растормаживания АСР
| Группа животных | А (% от уровня в день обучения) | А+ (% от уровня в день обучения) | А- (% от уровня в день обучения) |
| Контроль к введению циклогексимида (физ. раствор) | 61,3± 7,9* | 69,2± 7,7* | 58,7± 6,2* |
| Циклогексимид | 83,0 ±19,9 | 75,4 8,7* | 100,5 27,9 |
| Контроль к введению актиномицина D (физ. раствор) | 53,4± 4,2* | 57,4 ±6,2* | 42,1 ±10,3* |
| Актиномицин D | 72,2± 9,6 | 58,3± 8,2* | 81,3 ±22,7 |
| Контроль к ведению бикукуллина и факлофена (физ. раствор) | 45,1± 5,0* | 49,2 ±7,4* | 39,0± 8,4* |
| Бикукуллин | 72 ±14 | 69 8, ±7* | 96,0± 7,6 |
| Факлофен | 54 ±11* | 50,4± 7/1* | 70± 14,8 |
| Контроль к введению ритансерина до обучения (физ. раствор) | 50,0± 10,1* | 57,6 ±11,0* | 45,4 ±8,2* |
| Ритансерин до обучения | 86,2± 8,0 | 79,8± 4,4* | 89,8 ±7,8 |
| Контроль к введению ритансерина перед тестированием (физ. раствор) | 67,1± 13,1* | 59,2± 6,4* | 68± 15,4* |
| Ритансерин перед тестированием | 51,2 ±10,0* | 67,8 ±7,5* | 35,0 ±8,2*^ |
* - p<0,05 по сравнению с днем обучения (100%), ^ - p<0,05 по сравнению с контролем
Таким образом, можно предположить, что долговременное угашение оборонительной компоненты АСР отчасти обеспечивается процессами десенситизации, которые нарушаются при подавлении функций червя мозжечка.
Полученные данные свидетельствуют, что на ранних этапах консолидации долговременного угашения АСР пластические перестройки в коре медиального отдела мозжечка связаны с изменениями параметров работы механизмов, обеспечивающих соотношение сенситизации и привыкания при обработке информации поступающей от моторного аппарата. По сути дела, речь идет о том, что называют метапластичностью (Schweighofer N., Arbib M.A. 1998), - изменении алгоритма обработки информации, поступающей в систему. Нейрональными механизмами метапластичности могут являться дезингибиция и депотенциация (Калиниченко, Мотавкин, 2005), которые на поведенческом уровне проявляются в растормаживании и десенситизации. Результаты представленного исследования указывают, на вовлечение, серотонин- и ГАМК-глицинергической систем мозжечка в механизмы долговременной десенситизации, обеспечивающей привыкание оборонительной составляющей АСР.
ЗАКЛЮЧЕНИЕ
В выполненной нами работе при исследовании нескольких видов оборонительного поведения выявлены различные механизмы участия медиального мозжечка в процессах памяти и обучения. Эти результаты согласуются с данными о многообразии когнитивных и эмоциональных нарушений, наблюдаемых в клинике при поражениях мозжечка (Heath еt al., 1980, Калашникова и др.. 2000).
Гипотеза о существовании ментальных моделей, исходящая из концепции когнитивной дисметрии и теории моторного контроля Альбуса-Марра, также предполагает множественность механизмов вовлечения мозжечка в когнитивные процессы (Ito, 2005). Так, в гипотезе постулируется существование форвардной модели, обеспечивающей планирование действия, и инверсной модели, контролирующей его реализацию. Предполагается, что микромодули, кодирующие инверсную и форвардную модель, расположены в различных зонах полушарий мозжечка и имеют связи с разными отделами коры больших полушарий. Однако авторы гипотезы несколько механистически распространяют закономерности работы двигательного аппарата на когнитивные функции, не пытаясь на более высоком теоретическом уровне осмыслить общие принципы ментальных и моторных процессов, при этом, по их собственному признанию, из теоретических построений выпадают эмоции. Игнорируется роль сенсорных сигналов, и информации, поступающей в мозжечок по «модуляторным» (холин- и моноаминэргическим) входам (Molinari et al., 2005). Наконец, данная гипотеза базируется на сведениях о наличии избирательных связей различных областей полушарий мозжечка с отдельными областями коры больших полушарий мозга. Не представляется возможным рассматривать с ее позиций функции медиального мозжечка, имеющего диффузные связи практически со всеми областями коры, а также с лимбической системой.
Более плодотворным, на наш взгляд, является анализ полученных экспериментальных данных с позиций теории функциональных систем (П.К.Анохин, 1974, К.В.Судаков, 1984, 1997), согласно которой скоординированная динамическая активность различных отделов мозга определяется доминирующей мотивацией и обеспечивает достижение организмом полезного результата на основе саморегуляции. В нашей работе было изучено поведение животных на фоне интенсивной звуковой стимуляции, вызывающей безусловные оборонительные реакции, не сопровождающейся, однако, отрицательным подкреплением. Данная экспериментальная ситуация моделирует условия неопределенности, достаточно часто встречающиеся в повседневной действительности и создающие высокий уровень эмоционального напряжения, что может приводить к развитию невротических реакций (Willner, P, 1993). Активность формирующихся в ситуации неопределенности функциональных систем направлена на выработку адекватной стратегии поведения, которая обеспечивается достижением оптимального для индивидуума соотношения ориентировочно-исследовательских, активно- и пассивно-оборонительных реакций на основе реализации врожденных и формирования новых видов поведения (Толокнов А.В. и др., 1999).
Полученные в работе данные позволяют утверждать, что с функциями медиального отдела мозжечка связаны механизмы реализации врожденного пассивно-оборонительного поведения замирания в условиях изменения обстановочной афферентации. Обнаружено, что на фоне высокого уровня страха и тревоги, возникающего у неадаптированных животных при первом помещении в закрытую камеру небольших размеров, активность мозжечка направлена на предотвращение избыточного проявления пассивно-оборонительного поведения и обеспечение оптимального уровня исследовательской активности. В этих условиях у животных наблюдается высокий исходный уровень активно-оборонительной акустической стартл-реакции (АСР), а нарушение функций червя мозжечка не оказывает влияния на ее параметры.
При повторном помещении крыс в экспериментальную камеру (адаптированные животные), когда уровень страха и тревоги достоверно ниже, чем при первом ознакомлении с обстановкой, подавление активности мозжечка не оказывает влияния на длительность замирания, однако приводит к изменению соотношения времени замирания и амплитуды первой АСР. В условиях продолжающейся при обучении акустической стимуляции от функций червя мозжечка у адаптированных животных зависит соотношение кратковременного привыкания и кратковременной сенситизации АСР. Согласно литературным данным, изменения активности клеток Пуркинье в ответ на звуковую стимуляцию происходят слишком поздно для непосредственной инициации стартл-реакции (Mortimer, 1973, 1975, Welsh et al., 2002). В то же время, имеются многочисленные экспериментальные свидетельства модулирующего влияния обстановочных стимулов на амплитуду и динамику АСР (File a. Davis, 1994, Braff et al., 2006). Следовательно, выявленные при нарушениях функций мозжечка изменения параметров АСР отражают его роль в обеспечении влияния обстановочной афферентации и доминирующей мотивации на начальный уровень стартл-реакции и ее динамику в условиях продолжающейся стимуляции. С точки зрения теории функциональных систем, акустический сигнал в наших экспериментах является пусковым стимулом, реализующим ранее сформированную предпусковую интеграцию возбуждений в поведенческий акт. Таким образом, полученные результаты указывают, что вовлечение медиального отдела мозжечка в механизмы кратковременного привыкания/сенситизации АСР связано с его участием в процессах предпусковой интеграции возбуждений на стадии афферентного синтеза (П.К.Анохин, 1974, К.В.Судаков, 1997).
Вместе с тем, нами обнаружено, что динамика амплитуды АСР как при обучении, так и при тестировании включает периодическую компоненту, а разнонаправленные изменения величины реакции чередуются с периодом, в 1-2 стимула. Выявлена достоверная зависимость изменений амплитуды стартл-реакции от ее предыдущих значений. Обнаружено также, что нарушения активности медиального мозжечка приводят к существенным изменениям значений параметров, характеризующих зависимость динамики амплитуды АСР от ее предшествующих значений. Таким образом, червь мозжечка вовлечен в механизмы, опосредующие влияние поступающей в ЦНС информации о величине текущей стартл-реакции на ее последующие изменения. При этом информация об амплитуде АСР, поступающая в мозжечок, может быть представлена как проприоцептивными сигналами, так и копиями моторных команд (Ito, 2005). Согласно теории функциональных систем, взаимодействие коллатеральных возбуждений выходных нейронов, копирующих структуру выходного командного потока, с возбуждениями афферентной природы, отражающими содержание полученных результатов, составляют основу формирования акцептора результата действия как аппарата прогнозирования и оценки свойств приспособительного поведенческого результата. Таким образом, результаты анализа полученных нами экспериментальных фактов указывают, что медиальный мозжечок вовлечен не только в механизмы предпусковой интеграции, но также является элементом акцептора результата действия.
В представленном исследовании было показано, что при формировании различных видов оборонительного поведения медиальный мозжечок вовлечен в процессы долговременной памяти. Обнаружено, что с функциями червя мозжечка связаны процессы выработки и консолидации пассивно-оборонительной реакции условного замирания при воздействии обстановочных стимулов, ассоциированных с предъявлением интенсивных звуковых стимулов (обстановочное замирание). Кроме того, показано участие медиального мозжечка в обеспечении долговременного привыкания АСР. В условиях, когда стартл-стимулы предъявляются в отсутствие подкрепления, формирование приспособительного поведения направлено на достижение стабильной оптимальной для конкретного животного величины АСР, обеспечивающей адекватный ситуации уровень готовности к оборонительному поведению, однако без проявлений гиперреактивности. У адаптированных к обстановке крыс приближение к такому уровню наблюдается во второй половине сеанса тестирования, о чем, в частности, свидетельствует угашение тахикардической реакции, наблюдаемое в этот период. Достижение оптимальных значений АСР обеспечивается в результате кратковременного привыкания или сенситизации при обучении, а также формирования и консолидации долговременной памяти, которую можно оценить по двум параметрам: величине первой реакции в сеансе тестирования и изменению динамики реакции в сеансе тестирования по сравнению с обучением. Нами продемонстрировано, что в структуре первой АСР в сеансе тестирования доминирует ориентировочная составляющая. При этом регистрируемые изменения амплитуды первой реакции относительно уровня, достигнутого при обучении, свидетельствуют, что у животных, демонстрировавших кратковременную сенситизацию, наблюдается долговременная десенситизация, а у крыс, демонстрировавших кратковременное привыкание, имеет место долговременное растормаживание. Таким образом, достижение оптимального уровня ориентировочно-исследовательской составляющей АСР в начале сеанса тестирования обеспечивается механизмами спонтанного восстановления, компенсирующими недостаточную согласованность процессов кратковременной сенситизации и привыкания (Poon a.Young, 2006). В работе обнаружено, что червь мозжечка вовлечен в формирование и консолидацию долговременной памяти, обеспечивая долговременную десенситизацию и подавление долговременного растормаживания при достижении оптимального уровня ориентировочно-исследовательской составляющей АСР. Временной профиль вовлечения этого отдела мозга в формирование и консолидацию долговременного привыкания ориентировочной компоненты АСР совпадает с таковым для формирования и консолидации условного обстановочного пассивно-оборонительного поведения – реакции замирания. Согласно полученным данным, на стадии обучения активность мозжечка обеспечивает разнонаправленные долговременные изменения амплитуды АСР и времени замирания, тогда как на этапе консолидации влияние мозжечка на амплитуду АСР и поведение замирания носит однонаправленный характер. Эти результаты, по нашему мнению, свидетельствуют, что участие червя мозжечка как в привыкании ориентировочно-исследовательской составляющей АСР, так и в модуляции динамики реакции во время обучения, связано с процессами предпусковой интеграции, которые активируются под контролем акцептора результата действия при помещении животного в экспериментальную обстановку. Как указывают документированные нами факты, долговременное угашение ориентировочной составляющей АСР связано с активностью глутаматэргических проекций в кору червя мозжечка и тауринергическими механизмами, а формирование обстановочного условного замирания зависит от активности серотонинергического входа и ГАМК/глицинэргических интернейронов. Исходя из строения структурно-функциональной единицы коры мозжечка – микромодуля, включающего разветвленную сеть интернейронов, секретирующих «объемные» нейротрансмиттеры, в частности, оксид азота (Калиниченко, Мотавкин, 2003), а также из наличия множественных связей между отдельными микромодулями, можно полагать существование нейрофизиологических и молекулярных механизмов интеграции и взаимодействия нейромедиаторных процессов, обеспечивающих оптимальное соотношение пассивно- и активно-оборонительных форм поведения на разных этапах их формирования.
Выявлено, что с функциями мозжечка связано также изменение динамики АСР в сеансе тестирования по сравнению с сеансом обучения, характеризующее долговременное привыкание оборонительной составляющей АСР. При этом временной профиль консолидации и нейрохимические механизмы обеспечения угашения оборонительной составляющей реакции в мозжечке отличаются от таковых для привыкания ориентировочной компоненты АСР. Так, угашение оборонительной составляющей АСР обусловлено десенситизацией, которая связана с изменением параметров, характеризующих зависимость изменений амплитуды реакции от ее текущих значений. Обнаружено, что одним из нейромедиаторных механизмов десенситизации является снижение активности серотонинергических терминалей в коре мозжечка. Выявленное подавление серотонинергической нейротрансмиссии не является исключительно следствием снижения активности мозговых структур – источников соответствующих проекций в кору мозжечка. Нами показано, что снижение уровня серотонина и его метаболита при формировании угашения АСР зависит от синтеза белка в коре червя мозжечка и, следовательно, происходит в результате пластических перестроек в этом отделе мозга. Кроме того, обнаружено, что важную роль в угашении оборонительной составляющей АСР играет система ГАМК/глицин-эргических интернейронов червя мозжечка, получающих информацию от серотонинергических афферентов.
Таким образом, можно предположить, что участие медиального мозжечка в системных механизмах приспособительного поведения в условиях оборонительной мотивации связано с обеспечением предпусковой интеграции возбуждений, а также с формированием и функционированием акцептора результата действия. Полученные данные также свидетельствуют об избирательном и разновременном вовлечении в эти процессы отдельных нейромедиаторных систем червя мозжечка.
Обнаруженные закономерности можно выявить и при анализе литературных данных об участии мозжечка в формировании других видов поведения. Так, при выработке условного мигательного рефлекса, зависимая от функций мозжечка сенситизация на стадии афферентного синтеза приводит к возникновению мигательного акта в ответ на предъявление подпорогового для инициации этой реакции звукового условного сигнала. В дальнейшем наблюдается связанное с участием мозжечка в механизмах акцептора результата действия угашение генерализованной коротколатентной составляющей мигательной реакции и нарастание длиннолатентного адаптивного компонента мигательного акта, приуроченного по времени к моменту подачи подкрепления (Medina et al., 2001). При исследовании моторного обучения в ряде работ выявлено участие мозжечка как в формировании быстрых кинематических актов, так и обеспечении точности динамических движений, основанных на механизмах обратной связи (Krakauer, et al., 1999, 2006, Устинова К. и др., 2004).
Результаты клинических исследований, также свидетельствуют, что при поражениях мозжечка страдают процессы планирования и рабочая память, основанная на динамическом взаимодействии внутренней модели с информацией от сенсомоторного аппарата (Зуева, 2003). С нарушениями выбора стратегии поведения при поражениях мозжечка могут быть связаны симптомы, наблюдаемые при аутизме и синдроме де ля Туретта, а дефицит рабочей памяти может сказываться на речевой функции и приводить к развитию некоторых симптомов шизофрении (Ito, 2005).
Таким образом, гипотеза о вовлечении медиального мозжечка в механизмы афферентного синтеза, а также формирование и функционирование акцептора результата действия, высказанная на основании полученных в настоящем исследовании результатов, позволяет интерпретировать многообразные изменения когнитивных и эмоциональных процессов, наблюдаемые при нарушениях функций мозжечка в экспериментальных и клинических условиях
ВЫВОДЫ
- Исследованы механизмы участия медиального отдела мозжечка (червя) в процессах кратковременной и долговременной памяти, обеспечивающих формирование и реализацию различных видов оборонительного поведения.
- Подавление активности медиального отдела мозжечка стимулирует проявление врожденного пассивно-оборонительного поведения замирания, и угнетает кратковременную сенситизацию акустической стартл-реакции. В сравнении с гиппокампом, указанные эффекты инактивации червя мозжечка проявляются при более высоком уровне оборонительной мотивации.
- Нарушение активности медиального мозжечка подавляет формирование условного обстановочного страха, вызванного интенсивной звуковой стимуляцией, при этом наблюдаются однонаправленные долговременные изменения поведения замирания и угашения ориентировочно-исследовательской составляющей акустической стартл-реакции.
- При формировании долговременного привыкания акустической стартл-реакции в условиях нарушения активности червя мозжечка наблюдается изменение соотношения долговременной десенситизации и долговременного растормаживания - процессов, обеспечивающих оптимальный уровень ориентировочно-исследовательской составляющей генерализованного активно-оборонительного поведения.
- Нарушение функциональной активности червя мозжечка в условиях клеточной гипоксии, вызванной азидом натрия, и при действии белка S00b в дозе, вызывающей апоптоз, подавляет кратковременное и долговременное привыкание акустической стартл-реакции, а также формирование условного страха. Снижение уровня гипоксических поражений клеток Пуркинье под влиянием пептида HLDF6 уменьшает выраженность нарушений формирования условного замирания и долговременного привыкания ориентировочно-исследовательской составляющей акустической стартл-реакции.
- Обнаружено, что подавление синтеза белка в медиальном мозжечке в различные сроки после обучения оказывает избирательное влияние на формирование различных видов оборонительного поведения. Ингибиторы синтеза белка, апплицируемые на червь мозжечка непосредственно после обучения, подавляют консолидацию долговременной десенситизации оборонительной составляющей акустической стартл-реакции, тогда как их введение через 2 часа после обучения избирательно нарушает консолидацию долговременного угашения ориентировочно-исследовательской компоненты акустической стартл-реакции и консолидацию условного обстановочного страха; при этом наблюдаются разнонаправленные изменения поведения замирания и долговременного угашения стартл-реакции.
- Обнаружено, что участие медиального мозжечка в механизмах десенситизации оборонительной компоненты стартл-реакции обусловлено поступлением в эту структуру информации от моторного аппарата.
- На различных этапах формирования долговременного угашения акустической стартл-реакции и условного обстановочного страха в черве мозжечка наблюдаются избирательные изменения активности отдельных нейромедиаторных систем. Непосредственно после обучения повышается уровень гамма-аминомасляной кислоты и серотонина, в то время как через 24 часа возрастает содержание глутамата и глицина, а также снижается уровень серотонина и 5-оксииндолил-уксусной кислоты; при повторной звуковой стимуляции в сеансе тестирования наблюдается возрастание уровня таурина.
- Изменения уровня ГАМК и глицина, наблюдаемые в день обучения, демонстрируют положительную корреляцию с показателем формирования условного замирания, изменения уровня глутамата - положительную корреляцию с показателем долговременного привыкания ориентировочной составляющей акустической стартл-реакции, а показатели динамики таурина – положительно коррелируют с индексом кратковременного угашения стартл-реакции и отрицательно – с долговременным привыканием ее ориентировочной составляющей.
- Экспериментальные воздействия на активность определенных нейромедиаторных систем червя мозжечка до начала обучения оказывают избирательное влияние на формирование различных видов оборонительного поведения: таурин и антагонисты глутаматных рецепторов вызывают изменения кратковременного привыкания акустической стартл-реакции и формирования долговременного угашения ее ориентировочной составляющей; антагонисты рецепторов ГАМК бикукуллин и факлофен, а также антагонист 5-НТ2-рецепторов серотонина ритансерин нарушают долговременную десенситизацию оборонительной составляющей стартл-реакции и формирование условного замирания.
- Экспериментальные воздействия на активность червя мозжечка в различные временные периоды после обучения указывают на вовлечение серотонинергической системы медиального мозжечка в обеспечение консолидации и воспроизведения долговременной десенситизации оборонительной составляющей стартл-реакции. Обнаружено, что введение перед сеансом тестирования антагониста 5-НТ2-рецепторов серотонина стимулирует десенситизацию стартл-реакции; в то же время аппликация ингибитора синтеза белка на червь мозжечка через 5 минут после обучения подавляет долговременную десенситизацию и повышает активность серотонинергической системы, регистрируемую через 24 часа после обучения.
- Полученные результаты позволяют обосновать положение о том, что участие медиального мозжечка в механизмах приспособительного поведения в условиях оборонительной мотивации связано с обеспечением процессов предпусковой интеграции на стадии афферентного синтеза, а также с формированием и функционированием акцептора результата действия. Участие червя мозжечка в указанных процессах осуществляется на основе избирательного и разновременного изменения активности определенных нейромедиаторных систем в этом отделе мозга
Основные публикации, в которых отражено содержание диссертации:
- Storozeva ZI, Pletnicov MV. Habituation of acoustic startle in rats: a functional ablation study.// Neuroreport, 1994, v. 27, N 16, p. 2065-8.
- Pletnikov MV, Storozheva ZI Developvental analysis of habituation of the acoustic startle response in the preweanling and adult rat.// Behavioral processes, 1994, v.34, p.269-78.
- Pletnikov MV, Storozheva ZI, Sherstnev VV. Relationship between memory and fear: developmental and pharmacological studies.// Pharmacol Biochem Behav., 1996, v.54, N1, p.93-8.
- В.В. Шерстнев, М.В.Плетников, З.И.Сторожева, А.Т.Прошин Избирательное влияние моноклональных антител к нейроростовому белку А3G7 на центральные механизмы различных видов оборонительного поведения у взрослых крыс.// Жур. высш. нервн. деят., 1997, т. 47, № 6, с.965-71.
- Шерстнев В.В., М.В.Плетников, З.И.Сторожева, Г.Ельникова, Т.М.Панкова, М.В.Старостина, М.Б.Штарк. Моноклональные антитела к ассоциированному с ростом нервной ткани белку А3G7 нарушают процессы обучения и памяти у взрослых крыс // Бюлл. эксп. биол. и мед., 1998, № 8, с.23-30.
- Сторожева З. И., Афанасьев И. И., Кудрин В. С., Прошин А. Т. Динамика содержания и скорости метаболизма внеклеточного дофамина в стриатуме мозга крыс при формировании угашения акустической стартл-реакции // Нейрохимия, 1999, т. 16, № 1, с. 50-53.
- Cторожева З. И., Прошин А. Т. Махмутов Р.Я. Изучение латентного ситуационного торможения сердечного компонента реакции вздрагивания на звуковой стимул у крыс // Жур. высш. нервн. деят., 1999, т. 49, № 6, с. 999-1007.
- Sherstnev VV, Pletnikov MV, Storozheva ZI, Proshin AT. The selective effects of a monoclonal antibody against neural growth-related protein A3G7 on central mechanisms of several types of defensive behavior in adult rats.// Neurosci Behav Physiol., 1999, v. 29 N1, p.91-5
- Шерстнев В. В., Грудень М. А., Сторожева З. И., Прошин А. Т. Участие нейротрофических факторов в центральных механизмах поведения у взрослых животных // Российский физиологический журнал, 1999, т. 85, № 1, с. 21-28.
- Sherstnev VV, Storozheva ZI, Gruden MA, Proshin AT. The involvement of neurotrophic factors in the central mechanisms of behavior in adult animals.// Neurosci Behav Physiol., 2000, v.30, N 3, p.255-60.
- Шерстнев В.В., Грудень М.А., Сторожева З.И., Прошин А.Т. Гетерохрония участия нейротрофических факторов в нейрохимической организации процессов обучения и памяти в зрелом организме.// Российский физиологический журнал, 2001, т.87, № 6, с.752-61.
- Сторожева З.И., Афанасьев И.И., Прошин А.Т., Кудрин В.С. Динамика содержания внеклеточного дофамина в мозге крыс при формировании условного обстановочного страха и угашения акустической реакции вздрагивания. // Журн. высш. нервн. деят., 2002, т. 52, № 2, с. 189-194.
- Storozheva ZI, Afanas'ev II, Proshin AT, Kudrin VS Dynamics of dopamine contents in the rat brain during the formation of conditioned contextual fear and extinction of an acoustic startle reaction // Neurosci Behav Physiol., 2003, v.33, N 4, p. 307-12.
- Жохов С.С., Костанян И.А., Гибанова Н.В., Сурина Е.А., Сторожева З.И., Бабиченко И.И., Липкин В.М. Сходство и различие действия пептидов TGENHR и TQVEHR на промиелоциты линии HL-60 и клетки Пуркинье червя мозжечка крыс.// Доклады академии наук. 2004, т. 394, № 5, с. 696-706.
- Жохов С.С,, Костанян И.А., Гибанова Н.В., Сурина Е.А., Сторожева З.И., Бабиченко И.И., Липкин В.М. Различные механизмы протективной и дифференцировочной активности гомологичных пептидов TGENHR и TQVEHR.// Биохимия. 2004, т. 69, № 8, с. 861-9.
- Сторожева З.И. Киренская А.В. Предстимульная модификация стартл-реакции как перспективный метод психофизиологических исследований в биологической психиатрии. //Российский психиатрический журнал, 2007, №.1, с.71-79.
- Сторожева З.И. Участие мозжечка в системных механизмах различных видов оборонительного поведения // Бюллетень экспериментальной биологии и медицины, 2007, т. 143, №3, с. 247-251.
- Сторожева З.И. Участие червя мозжечка в консолидации долговременной памяти различных видов оборонительного поведения.// Бюллетень экспериментальной биологии и медицины, 2009, т. 147, №11, с. 495-8.
- Прошин А. Т., Сторожева З. И. Сравнительный анализ участия гиппокампа и мозжечка в процессах привыкания реакции вздрагивания на звуковой раздражитель у взрослых крыс // Экспериментальная и прикладная физиология, Москва, 1998, т. 7, с. 334-335.
- Sherstnev V.V., Gruden M.A., Storozheva Z.I., Proshin A.T. Neurotrophic factors as molecular markers of behavioural functional system formation // Basic and clinical aspects of the theory of functional sysmems, Novi Sad, 1998, p. 91-96.
- Прошин А.Т., Сторожева З.И., Махмутов Р.Я.,.Шерстнев В.В. Избирательное влияния белка S-100b в про- и антиапоптотических дозах на отдельные этапы формирования оборонительного поведения у взрослых крыс. // Экспериментальная и прикладная физиология, Москва, 2001, т. 10, стр. 332.
- Прошин А.Т., Сторожева З.И., Грудень М.А., Юрасов В.В., Огарева Н.В., Костанян И.А., Бабиченко И.И., Шерстнев В.В. Биологическая активность пептида HLDF6 – фактора клеточной дифференцировки. // Экспериментальная и прикладная физиология, Москва, 2000, т. 9, с. 251-252.
- Сторожева З.И. Участие мозжечка в системных механизмах различных видов оборонительного поведения.//. Экспериментальная и прикладная физиология. Москва, 2006, т.13, с 60-79.
- Сторожева З.И. Нейрохимические механизмы в мозжечке и процессы консолидации оборонительного поведения. // Функциональные системы организма в норме и патологии. Минск. РИВШ.2008, с. 336-341.
- Sherstnev V., Gruden M, Storozheva Z, Shumova E., Proshin A. Heterochronic involvement of nervous growth factor - protein S100-b in learning and memory mechanisms in adult brain. European Journal of Neuroscience. Volume 10 Supplement 10 1998. Abstr. Forum of European Neuroscince. p.154, N.056.82.
- Proshin A.T., Storozheva Z.I., Makhmutov R..J. Participation of cerebelum and hippocampus in conditional contextual fear and acoustic startle habituation : functional ablation study. In: “Conceptual advances in the studies of associative learning and memory” Abstr. Of International Meeting, Devoted to 150-year Anniversary of I.P.Pavlov. Moscow, September 23-26, 1999, p.81.
- Шерстнев В. В., Грудень М. А., Сторожева З. И., Прошин А. Т., Махмутов Р. Я. Участие нейротрофического фактора – белка S100b в процессах обучения и памяти у взрослых животных. ХХХ Всероссийское совещание по проблемам высшей деятельности, Санкт-Петербург, 2000, т. 1, с. 192-193.
- Sherstnev V.V., Gruden M., Storogeva Z., Yurasov V., Proshin A. Synaptic and biosynthetic processes at cerebellum and hypocampus in adult animals during learning and amnesia caused by antibodies to neurotrophic factors. // Behav. Pharm. Abstr. EBBS-EBPS-2001 meeting, Vol. 12, Suppl. 1, Aug. 2001, S95.
- Шерстнев В.В., Сторожева З.И., Юрасов В.В., Яковлева Н.Е., Грудень М.А., Костанян И.А., Пузырев А.В. Участие пептидных фрагментов фактора дифференциации клеток HLDF в процессах обучения и апоптоза в зрелом мозге. Материалы Российского симпозиума по химии и биологии пептидов. Москва, 17-19 ноября 2003 г. с.94.
- Storozheva Z.I., Kostanyan I.A., Bogachuk A.P., Proshin A.T, Surina E.A., Yurovsky V.V. New protective peptide for neurodegeneration correction: effect on beta-amyloid toxicity. Abstracts of SIXTH IBRO World Congress of neuroscience. Prague July 13-18 2003. N 1317.
- Sherstnev V.V., Storozheva Z.I., Pletnikov M.V., Gruden M.A., Proshin A.T. Antibodies to neurotrophic factors modulate different kinds of defensive behaviour in adult rats, Abstracts of the PsychoNeuroimmunology Research Society Meeting in J. Neuroimmunomodulation, 1998, v.5, P.47
- Sherstnev V.V., Gruden M.A., Storogeva Z.I., Shumova E.A., Proshin A.T. Molecular heterochronia of memory trace. Abstract of 1V Eurupean Research Conference : Neural Mechanisms of learning and memory " Dynamics of the trace", 1998, Italy,P. A35.
- Sherstnev V.V., Gruden M.A., Storozheva Z.I., Proshin A.T., Kuzilina V.B. Molecular mechanisms of neurotrophic factor – S100B participation in leaning and memory processes // Abstracts, Society for neuroscience, New Orleans, 2000, p. 2240.
- Kostanyan I.A., Storozheva Z.I., Bogachuk A.P., Proshin A.T., Surina E.A., Makchmutov R.Y., Yurovsky V.V. New protective peptide for neurodegeneration correction. // Neurobiology of aging, The 3rd conference of neurobiological society, Orlando, USA, SEPTEMBER 25-29, 2002 P.345
- Sherstnev V.V., Gruden M.A., Storogeva Z.I., Kostanyan I.A., Proshin A.T, Yurasov V.V Gubskaya O.B., Jakovleva N.K., Skvortcova V.I. Participation of endogenous regulators of apoptosis in mechanisms of specific brain functions at normal and pathological conditions. Xth World Congress on Psychiatric Genetics, 2002. p. 264
- Шерстнев В.В., Сторожева З.И., Прошин А.Т., Грудень М.А., Kостанян И.А Влияние пептидных фрагментов фактора HLDF, обладающих про- и антиапоптотической активностью, на процессы обучения и памяти. Материалы сб. Международной Конференции: Новые информационные технологии в медицине и экологии IT+ME’2003, Гурзуф, Крым, Украина, стр.343-344
- Sherstnev V.V., Gruden M.A., Storogeva Z.I., Yurasov V.V., Jakovleva N.K Effect of protein S100b on caspase- 3 activation and specific fragmentation DNA in nervous cells of various brain structures at doses which modulate learning and memory (2003)Abstracts of BNA, Harrogate, UK p.172.
- Storozheva Z.I. Comparative study of cerebellum and hippocampus participation in different types of defensive behaviour. International Symposium “Hippocampus and memory” Abstracts. Pushchino, Russia, p.108. 2006.
- Сторожева З.И. Механизмы оборонительного поведения и нейрохимические процессы в мозжечке. Тезисы докладов XX Съезда Физиологического общества им. И.П.Павлова. Москва, 2008. с. 92.
- Сторожева З.И., Прошин А.Т. Избирательное вовлечение нейромедиаторных систем мозжечка в механизмы формирования различных видов оборонительного поведения. // Жур. высш. нервн. деят., 2010, т. 60, № 3-4 (принята в печать).

