Структурно-функциональное состояние тимуса лабораторных крыс, употребляющих питьевую воду с добавлением соединений кальция и кремния
На правах рукописи
ДЬЯЧКОВА ИРАИДА МИХАЙЛОВНА
СТРУКТУРНО-ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ
ТИМУСА ЛАБОРАТОРНЫХ КРЫС,
УПОТРЕБЛЯЮЩИХ ПИТЬЕВУЮ ВОДУ С ДОБАВЛЕНИЕМ СОЕДИНЕНИЙ КАЛЬЦИЯ И КРЕМНИЯ
03.03.04 – клеточная биология, цитология, гистология
03.03.01 – физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Чебоксары 2011
Работа выполнена на кафедре медицинской биологии ФГОУ ВПО
«Чувашский государственный университет имени И. Н. Ульянова»
Научный руководитель: доктор биологических наук, профессор
Сергеева Валентина Ефремовна
Научный консультант: доктор медицинских наук, профессор
Сапожников Сергей Павлович
Официальные оппоненты: доктор медицинских наук, профессор
Герасимова Людмила Ивановна
ГОУ «Институт усовершенствования врачей» Минздравсоцразвития ЧР
кандидат биологических наук, доцент
Александрова Людмила Антоновна
ГОУ ВПО «Чувашский государственный педагогический университет им. И. Я. Яковлева»
Ведущая организация: ФГОУ ВПО «Казанская государственная академия ветеринарной медицины
им. Н. Э. Баумана»
Защита диссертации состоится «18» марта 2011 г. в ____ часов на заседании объединенного совета ДМ 212. 300. 03 в ГОУ ВПО «Чувашский государственный педагогический университет им. И.Я. Яковлева» (428000, г. Чебоксары, ул. К. Маркса, 38, ГОУ ВПО «ЧГПУ им. И. Я. Яковлева», тел.: (8352)62-02-83, http: //www.chgpu.edu.ru
С диссертацией можно ознакомиться в библиотеке
ГОУ ВПО «ЧГПУ им. И. Я. Яковлева»
Автореферат разослан «18» февраля 2011 г.
| Ученый секретарь диссертационного совета д-р. биол. наук, профессор | В. В. Алексеев |
1. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Несмотря на успехи современной медицины, уровень заболеваемости населения неуклонно растет. Не являются исключением и болезни, связанные с нарушениями деятельности иммунной системы. Известно, что влияние окружающей среды на человека складывается из непрерывных воздействий физических, химических, социальных факторов. Это связано как с развитием промышленности, так и с освоением новых территорий, характеризующихся различным соотношением химических элементов в почве и в питьевой воде. Рядом исследователей доказано, что поступление химических элементов с водно-пищевыми рационами может колебаться в значительных пределах, а питьевая вода может являться основным поставщиком при обеспечении человека химическими веществами по ряду элементов (А.П. Авцын, 1991; В. Л. Сусликов, 2007). Установлено также, что различная обеспеченность организма человека химическими элементами предопределяет развитие ишемической болезни сердца, острого инфаркта миокарда, сахарного диабета второго типа (Т. В. Агафонкина, 2006; С. П. Сапожников, 2009). Неблагоприятная геохимическая обстановка часто усугубляется бесконтрольным применением фармакологических препаратов и биологически активных добавок, содержащих различные химические элементы. Сложившаяся ситуация свидетельствует о необходимости расширения научных знаний о влиянии химических элементов на деятельность эндокринной, нервной и иммунной систем.
Известно, что для нормального протекания жизненных процессов в клетках и тканях необходимы микро- и макроэлементы. Доказано, что кальций активизирует многие катаболические процессы (гликогенолиз, липолиз, протеолиз), стимулирует синтез белка, мышечное сокращение и немышечную подвижность, экзо-, эндоцитоз, ионный транспорт, секрецию нейромедиаторов, работу нервной и сердечно-сосудистой системы (В. А. Ткачук, 2000). Он принимает активное участие в процессах высвобождения катехоламинов из надпочечников и выделения нейромедиаторов пресинаптическими нервными окончаниями, участвует в стабилизации мембран тучных клеток, препятствует высвобождению гистамина и уменьшает проявление аллергических реакций, воспалительных процессов (В. И. Быков, 2000; M. Ficher, 2001; Т. Л. Пилат, 2002; Н. М. Бережная и соавт., 2003 и др.).
Соединения кремния участвуют в механизмах гормональной регуляции, стимулируют функцию макрофагов, продукцию этими клетками ИЛ-1, простагландина Е2 (G. E. Claudio, 1995; Л. А. Мансурова, 2009). ИЛ-1 стимулирует продукцию Т-хелперами ИЛ-2, способствует появлению рецепторов к ИЛ-2 на Т-лимфоцитах, влияет на созревание В-лимфоцитов, стимулирует образование молекул MHC (Е. С. Воронин, 2002; X. Li, 2004; С. П. Сапожников и соавт., 2007; И. М. Дьячкова, 2010).
Анализ научной литературы показывает, что действие кальция и кремния на биоаминсодержащие структуры иммунокомпетентных органов практически не изучено. В этой связи чрезвычайно важным и актуальным является системное исследование действия соединений кальция и кремния, поступающих с питьевой водой, на морфофизиологическую характеристику био- и моноаминсодержащих структур тимуса, антигенпрезентирующих макрофагов, кальций-связывающего белка в Iba-1 (кальмодулин) позитивных клеток.
Цель работы – исследование и сравнение морфофизиологического состояния структур тимуса лабораторных крыс при поступлении в организм хлорида кальция и метасиликата натрия с питьевой водой.
Задачи исследования:
- Изучить микро- и макроморфологию тимуса и количественное распределение тимоцитов в структурах органа у подопытных лабораторных крыс при водном воздействии солей кальция и кремния.
- Исследовать микро- и макроморфологию и количественное распределение кальций-связывающего белка (Iba-1 позитивных клеток) в структурах вилочковой железы.
- Оценить водное воздействие хлорида кальция и метасиликата натрия на состояние популяций антигенпредставляющих (MHС-II) клеток тимуса.
- Проанализировать изменения содержания биогенных аминов (катехоламины, серотонин, гистамин) в люминесцирующих структурах тимуса.
- Определить состояние тучных клеток тимуса, их обеспеченность биогенными аминами, степень созревания гепарина и дегрануляции тучных клеток тимуса в условиях приема соединений кальция и кремния с питьевой водой.
Научная новизна. Впервые с помощью люминесцентно-гистохимических методов исследования проведена качественная и количественная оценка изменений обеспеченности морфофункциональных структур тимуса нейромедиаторными биогенными аминами (катехоламины, серотонин, гистамин) при водном поступлении в организм лабораторных животных солей кальция и кремния.
Получены новые морфофизиологические и гистологические данные по локализации и распределению антигенпредставляющих макрофагов (MHC-II позитивных клеток) и кальций-связывающих рецепторных белков (кальмодулина) в Iba-1 позитивных клетках тимуса при водно-солевом воздействии на организм хлорида кальция (CaCl2) и метасиликата натрия (Na2SiO3).
Впервые показаны особенности секреторного цикла тучных клеток тимуса, свидетельствующие о разной степени приспособительных реакций (степень дегрануляции, созревание гепарина) у лабораторных животных в моделируемых экспериментальных условиях.
Теоретическое и практическое значение. Научные положения и выводы диссертационных исследований заметно дополняют современные данные о морфофизиологических механизмах воздействия хлорида кальция и метасиликата натрия на структурно функциональный статус вилочковой железы лабораторных животных.
Результаты и практические рекомендации диссертации используются в учебном процессе и могут быть использованы при написании учебных пособий по клеточной биологии, цитологии, гистологии, а также в теоретической медицине.
Реализация результатов исследований. Научные разработки и положения диссертационных исследований используются в учебном процессе ФГОУ ВПО «Чувашский государственный университет им. И. Н. Ульянова», ГОУ ВПО «Чувашский государственный педагогический университет им. И. Я. Яковлева».
Апробация работы. Основные научные положения, выводы и результаты работы доложены и обсуждены на ХII Международном симпозиуме «Эколого-физиологические проблемы адаптации» (М., РУДН, 2007); XIV Международном конгрессе по реабилитации в медицине и иммунореабилитации (Израиль, 2009); XIV международном симпозиуме «Эколого-физиологические проблемы адаптации» (М.: РУДН, 2009); Международном конгрессе по реабилитации в медицине и иммунореабилитации (ОАЭ, Дубай, 2010); IV и V международном семинаре «Фундаментальные исследования» и Всероссийском молодежном научном семинаре «Наука и инновации» (Йошкар-Ола, 2009; 2010); Всероссийской конференции с международным участием «Морфология в теории и практике», посвященной 85-летию со дня рождения Д. С. Гордон (Чебоксары, 2008); VI Всероссийском съезде анатомов, гистологов и эмбриологов (Саранск, 2009); V Общероссийской научной конференции «Современные проблемы науки и образования» (М., 2010); на 41-й и 42-й итоговых научных конференциях ФГОУ ВПО «Чувашский государственный университет им. И. Н.Ульянова» (Чебоксары, 2007; 2008); Открытой научной конференции молодежи и студентов «У.М.Н.И.К.» (Чебоксары, 2010); и расширенном заседании кафедры медицинской биологии ФГОУ ВПО «Чувашский государственный университет им. И. Н. Ульянова» (Чебоксары, 2010).
Научные положения, выносимые на защиту:
- Употребление с питьевой водой хлорида кальция и метасиликата натрия лабораторными животными сопровождается увеличением числа больших и малых тимоцитов, антигенпредставляющих (MHC-II) клеток, повышает активность Iba-1 – позитивных клеток в дольках вилочковой железы.
- Имеет место причинно-следственная связь между поступлением в организм лабораторных крыс соединений кальция и кремния и перераспределением катехоламинов, серотонина, гистамина в тучных, нейроэндокринных клетках структур тимуса, тимоцитах коркового и мозгового вещества.
Публикации. По теме диссертации опубликовано 11 научных статей, из них 4 – в ведущих рецензируемых научных журналах и изданиях, определенных ВАК России.
Структура и объем диссертации. Диссертационный материал изложен на 153 страницах компьютерного исполнения и состоит из списка сокращений, введения, обзора литературы, описания материала и методов исследования, результатов собственного исследования, обсуждения результатов, выводов и списка использованной литературы. Работа иллюстрирована 25 таблицами и 30 рисунками, из которых 27 –микрофотографии. Список литературы содержит 176 отечественных и 117 иностранных источников.
- МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Работу выполняли в 2006–2011 гг. в научной лаборатории кафедры медицинской биологии при ФГОУ ВПО «Чувашский государственный университет им. И. Н. Ульянова». Согласно государственному плану по теме «Гистохимия биогенных аминов в морфофункциональном состоянии органов и тканей в норме и эксперименте (№ госрегистрации 019700743 от 1997 г. и № 0120.0851887 от 2008 г.)».
2.1. Материал исследования. Объектом исследования явилась вилочковая железа 100 белых нелинейных беспородных лабораторных крыс-самцов одного возраста и одинаковой массы (150-200 г), содержавшихся в обычных условиях при естественном освещении и сбалансированном рационе питания.
Все действия, предусматривавшие контакты с экспериментальными животными, осуществлялись согласно «Правилам проведения работ с использованием экспериментальных животных».
Животные были разделены на 3 группы: первая группа – интактные (контрольные) – 40 особей; вторая, или первая опытная, состояла из 30 особей животных, которые употребляли питьевую воду с содержанием кальция 235 мг/л (вода+CaCl2); третья, или вторая опытная, состояла из 30 особей животных, употреблявших питьевую воду с содержанием кремния 10 мг/л (вода+Na2SiO3). В среднем в течение суток опытные животные получали с питьевой водой 8,1–10,2 мг/кг кальция и 0,4–0,6 мг/кг кремния. Эксперимент длился два месяца.
2.2. Методы исследования.
1. Люминесцентно-гистохимический метод Фалька-Хилларпа в модификации Е. М. Крохиной применялся для выявления структур тимуса, содержащих биогенные амины: катехоламины (КА) и серотонин (СТ).
2. Люминесцентно-гистохимический метод Кросса, Эвена, Роста применялся для выявления структур тимуса, содержащих гистамин (Г).
3. Метод цитоспектрофлуориметрии использовался для идентификации и количественного выражения уровней серотонина, катехоламинов и гистамина в тканевых структурах вилочковой железы. Для этого на люминесцентный микроскоп ЛЮМАМ-4 была установлена дополнительная насадка ФМЭЛ-1А с выходным напряжением 900 В. Замер интенсивности свечения производился в условных единицах флуоресценции (у. е.). Показания снимались с табло регистрирующего прибора-усилителя У-5.
4. Окраска полихромным толуидиновым синим по Унна применялась для контроля состояния тканевых мукополисахаридов и гепарина в тучных клетках исследуемого органа.
5. Корреляционный анализ проводился для установления корреляционных взаимосвязей между показателями интенсивности люминесценции биогенных аминов в люминесцирующих структурах тимуса.
6. Окраска гематоксилином и эозином применялась для общегистологической характеристики структур тимуса.
7. Антигенпредставляющие структуры тимуса (дендритные клетки и макрофаги) были исследованы непрямым иммуноферментным методом с использованием антител к белкам главного комплекса гистосовместимости второго класса (МНС-II) – маркеру антигенпредставляющих клеток (АПК).
8. Для выявления кальций-связывающих адапторных молекул (Iba-1 – Calmodulin, Phosphate Acceptor Peptides – кальций-связывающий белок кальмодулин) срезы тимуса были обработаны непрямым иммуноферментным методом с использованием антител к Iba-1 (1:500; Rabbit, Wako, Japan).
9. Морфометрический анализ включал измерение ширины коркового и мозгового веществ долек тимуса (при увеличении объектива 10 и окуляра 10), а также определение размеров клеточных структур тимуса (при увеличении объектива 90 и окуляра 10). Расчет площадей клеток производился с использованием программы «Sigma Scan Pro 5.0». О количественном распределении клеток судили по подсчету их в 10 полях зрения.
10. Статистический анализ полученных цифровых данных проводился с помощью программы Microsoft Office Excel с оценкой достоверности различия средних величин по t-критерию Стьюдента. Вычислялись: М – среднеарифметическая величина, – стандартная ошибка среднего значения, p – достоверность различия показателей подопытных групп по сравнению с контрольной группой: * - p 0,05; ** - p 0,01; *** - p 0,001.
3. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
3.1. Общеморфологическая характеристика тимуса
экспериментальных животных.
Окраска препаратов тимуса гематоксилином-эозином позволила выявить в тимусе контрольной группы классическое строение вилочковой железы лабораторных крыс. В четко контурированных дольках овально-полигональной формы хорошо определяются корковое и мозговое вещества. Корковое вещество долек за счет более плотного расположения тимоцитов выглядит темнее, чем мозговое. Эпителиальная основа органа лучше просматривается в мозговом веществе в связи с меньшим количеством тимоцитов, здесь же встречаются слоистые тельца Гассаля, образованные концентрически расположенными эпителиальными клетками.
После употребления животными питьевой воды с концентрацией кальция 235 мг/л отмечается увеличение размеров изучаемого органа. Наряду с дольками средних размеров, в вилочковой железе животных данной группы появляются крупные дольки (1,88±0,20 мм2, p<0,05), ширины коркового вещества которых превышает аналогичные показатели контрольных крыс в 1,7 раза, а мозгового – в 1,4 раза. Количество тимоцитов увеличивается, по сравнению с контрольными животными, как в мозговом (87,6±8,1 шт. против 73,6±7,6 шт. соответственно), так и в корковом (140,0±10,2 шт. против 122,8±12,1 шт. соответственно) веществе долек тимуса. Исследование размеров тимоцитов коркового и мозгового вещества долек тимуса показывает, что у опытных животных преобладают большие формы тимоцитов.

Длительный прием с питьевой водой метасиликата натрия (концентрация кремния 10 мг/л) приводит к незначительному увеличению долек тимуса: площадь коркового вещества долек в среднем равна 1,07±0,14 мм2, мозгового вещества – 0,28±0,10 мм2, в то время как в контрольной группе их значения равны 0,88±0,11 мм2 и 0,25±0,04 мм2 соответственно. В данном случае нехарактерной для других групп особенностью является образование в дольках тимуса новых участков мозгового вещества. Мозговое вещество, помимо стандартного своего размещения в центре дольки, небольшими островками размещается и в корковом веществе между субкапсулярной и кортикомедуллярной зонами.
Количество тимоцитов увеличивается в корковом и в мозговом веществе долек тимуса, по сравнению с контролем (145,6±11,4 шт. (p<0,05) против 122,8±12,1 шт. и 93,4±6,3 шт. (p<0,05) против 73,6±7,6 шт. соответственно). Исследование размеров тимоцитов мозгового и коркового вещества долек железы показывает, что большая часть тимоцитов представлена средними формами.
Таким образом, можно констатировать, что употребление с питьевой водой соединения кальция приводит к увеличению средних размеров площади дольки, преимущественно за счет коркового вещества (соотношение Sк.в./Sм.в. – 4,08, а в контроле – 3,52). Повышается также компактность размещения тимоцитов, с преобладанием в корковом веществе клеток крупных размеров, в мозговом веществе долек вилочковой железы размеры тимоцитов не отличаются от таковых в контрольной группе.
Употребление соединения кремния создает тенденцию к увеличению размеров долек тимуса и увеличивает площадь коркового вещества (Sк.в./Sм.в. – 3,82). У животных данной группы достоверно (p<0,05) увеличивается количество тимоцитов на единицу площади в мозговом и в корковом веществе долек. В корковом веществе возрастает количество больших тимоцитов, а в мозговом веществе – средних.
3.2. Iba-1 позитивные клетки тимуса контрольных и опытных животных при поступлении соединений кальция и кремния.
Длительный прием соли кальция с водой приводит к увеличению количества Iba-1 позитивных клеток в 1,4 раза в мозговом веществе (в контроле – 212, в опыте – 301 клетка в пяти полях зрения) и уменьшению в 1,5 раза – в корковом веществе долек вилочковой железы (в контроле – 229, в опыте – 151 клетка в пяти полях зрения).
При оценке морфологии Iba-1 позитивных клеток тимуса животных первой опытной группы было замечено уменьшение количества мелких и увеличение числа больших клеток, содержащих кальмодулин, в мозговом и корковом веществе долек (25,2% и 31,1% соответственно при 20,8% и 16,2% в контроле). Данный сдвиг отразился и на среднем диаметре Iba-1 позитивных клеток. У животных данной группы как в корковом, так и в мозговом веществе долек тимуса площадь клеток достоверно (p<0,05) превышала таковую у контрольных животных.
У животных, употреблявших с питьевой водой соединение кремния, по сравнению с контролем, в корковом веществе долек тимуса количество клеток уменьшилось (в 1,2 раза), а в мозговом веществе – увеличилось (в 1,5 раза). В то же время у животных данной группы при снижении процента средних Iba-1 позитивных клеток увеличивается количество больших клеток (34,0%) в мозговом веществе долек тимуса. В корковом веществе долек сдвиг клеточного состава имел такую же направленность, как и в первой опытной группе. На фоне снижения количества средних клеток существенно, по сравнению с контрольной группой, увеличилось число клеток с большим диаметром (47,05% и 16,2% соответственно).
Значительно увеличилась и средняя площадь Iba-1 позитивных клеток: в мозговом веществе долек – в 1,2 раза (в контроле 30,07±1,50 мкм2, в опыте – 38,93±1,88 мкм2; p<0,05), а в корковом веществе долек тимуса – в 1,8 раза (в контроле – 21,±1,02 мкм2, в опыте – 35,71±2,02 мкм2; p<0,05), по сравнению с контролем.
Учитывая полученные данные, отметим, что поступление в организм лабораторных крыс с питьевой водой соединений кальция и кремния повышает экспрессию кальций-связывающего белка клетками тимуса, имеющими моноцитарно-макрофагальное происхождение. Об этом свидетельствует увеличение площади Iba-1 позитивных клеток, как в корковом, так и в мозговом веществе долек тимуса.
Следует заметить, что в клетках тимуса опытных групп наблюдается достоверное снижение интенсивности светопропускания Iba-1 позитивными клетками в корковом и мозговом слое тимуса животных первой опытной группы (0,20±0,05 у. е. и 0,23±0,06 у. е. соответственно; p<0,05), по сравнению с контролем (0,37±0,03 у. е. и 0,31±0,04 у. е. соответственно). Это свидетельствует об изменении плотности ионизирующих кальций-связывающих адапторных молекул. Во второй опытной группе значительных изменений не наблюдается.
Таким образом, в корковом веществе долек тимуса первой опытной группы лабораторных крыс происходит уменьшение численного состава Iba-1 позитивных клеток, вместе с тем наблюдается увеличение их площади и объема, а также снижение интенсивности их окрашивания. В то же время в мозговом веществе долек тимуса лабораторных животных наблюдается значительное увеличение количества Iba-1 позитивных клеток, укрупнение их размера и объема, при уменьшении интенсивности аккумуляции кальмодулина в них.
Iba-1 позитивные клетки в мозговом и корковом веществе долек тимуса животных, употреблявших питьевую воду с солью кремниевой кислоты, более крупные, по сравнению с контролем, имеют большое количество отростков темно-коричневого цвета. Содержание кальций связывающего белка в них увеличивается. Кальмодулин концентрируется в виде гранул в самих клетках и в их микроокружении.
Итак, воздействие соединения кремния приводит к увеличению количества Iba-1 позитивных клеток в мозговом веществе долек тимуса лабораторных животных при достоверном (p<0,05) увеличении их площади, по сравнению с контролем.
- MHC-II экспрессирующие (антигенпредставляющие)
клетки тимуса экспериментальных животных.
MHC-II-позитивные клетки у контрольных животных в большом количестве выявляются в корковом веществе (в среднем 12,0±1,58 клеток в одном поле зрения) и кортикомедуллярной зоне долек тимуса (в среднем 15,4±1,79 клеток в одном поле зрения), где они располагаются по всей ее протяженности, плотно, в один-два ряда. Многие клетки имеют полигональную форму, но среди них встречаются единичные клетки округлой формы. В мозговом веществе долек железы (в среднем 7,2±1,79 клеток в одном поле зрения) MHC-II-позитивные клетки располагаются диффузно.
Длительный прием с питьевой водой хлорида кальция приводит к достоверному увеличению количества клеток в одном поле зрения: в кортикомедуллярной зоне с 15,4±1,79 (контроль) до 26±3,94 (p<0,05), а в мозговом веществе долек – с 7,2±1,79 (контроль) до 11,4±7,5. В корковом веществе долек тимуса количество MHC-II позитивных клеток снижается с 12±1,58 (контроль) до 8,8±2,28 (p<0,05).
Длительный прием с питьевой водой метасиликата кремния приводит к увеличению количества MHC-II позитивных клеток в премедуллярной зоне, с 15,4±1,79 до 36,8±5,72 (p<0,05) в одном поле зрения, по сравнению с контролем. В то же время в корковом веществе долек тимуса наблюдается достоверное уменьшение их количества, с 12±1,58 до 3,2±1,09 (p<0,05) в одном поле зрения.
Средняя площадь MHC-II позитивных клеток в корковом веществе, в кортикомедуллярной зоне и в мозговом веществе долек тимуса контрольных животных примерно одинакова и колеблется от 43,38±1,72 до 49,92±2,10 мкм2. Площадь антигенпредставляющих клеток у животных, употреблявших с питьевой водой соединение кальция, в премедуллярной зоне долек достоверно уменьшается (в контроле – 49,92±2,10 мкм2, в опыте – 38,57±1,19 мкм2; p<0,05), а в мозговом веществе долек наблюдается тенденция к увеличению средней площади клеток до 53,22±3,69 мкм2 (43,38±1,72 мкм2 в контроле).
В корковом веществе долек тимуса животных, употреблявших с питьевой водой соединение кремния, средняя площадь MHC-II позитивных клеток незначительно уменьшается с 49,78±1,19 до 46,83±1,39 мкм2 (p<0,05). Такая же тенденция наблюдается и в кортикомедуллярной зоне долек (в контроле – 49,92±2,10 мкм2, в опыте – 45,47±1,19 мкм2; p<0,05). В мозговом веществе долек площадь антигенпредставляющих клеток существенно увеличивается с 43,38±1,72 до 72,91±2,62 мкм2 (p<0,05).
Таким образом, употребление с питьевой водой соединения кальция приводит к снижению числа антигенпредставляющих клеток в корковом веществе долек тимуса. В кортикомедуллярной зоне долек тимуса на фоне увеличения количества MHC-II позитивных клеток уменьшается их площадь, по сравнению с контрольными животными. В мозговом веществе долек наблюдается тенденция к увеличению площади клеток без изменения их количества. У животных, употреблявших с питьевой водой соединение кремния, в корковом веществе долек тимуса наблюдается снижение количества антигенпредставляющих клеток, в кортикомедуллярной зоне – увеличение их количества, а также происходит увеличение средней площади MHC-II позитивных клеток в мозговом веществе долек тимуса.
3.4. Люминесцентно-гистохимические исследования морфофункциональных структур тимуса экспериментальных животных.
Люминесцентно-гистохимическое исследование тимуса лабораторных крыс методом Фалька-Хилларпа в модификации Е. М. Крохиной (1969) для избирательного выявления биоаминсодержащих структур показало хорошо выраженное дольчатое строение органа. Во внутренней части коркового слоя долек, в области кортикомедуллярной зоны в один или два ряда располагаются люминесцирующие гранулярные клетки (премедуллярные макрофаги), которые непрерывным ободком окружают мозговое вещество. Эти клетки более крупные и лежат компактно, их форма и размеры заметно варьируют. В цитоплазме этих клеток содержатся крупные гранулы с беловато-желтой люминесценцией, межгранулярные пространства четко выражены. На периферии долек в субкапсулярной зоне локализованы хаотично расположенные люминесцирующие гранулярные клетки (субкапсулярные макрофаги) с мелкими гранулами зеленовато-желтого свечения. Ядра субкапсулярных макрофагов так же, как и премедуллярных, не люминесцируют.
Наибольшее содержание серотонина у контрольных животных регистрируется в макрофагах кортикомедуллярной зоны и макрофагах субкапсулярной зоны долек тимуса (47,53±1,26 у. е. и 70,16±1,07 у. е. соответственно). Более низкие показатели интенсивности свечения этого моноамина регистрируются в тимоцитах мозгового вещества – 24,17±2,19 у. е.
Визуальная люминесцентно-гистохимическая картина тимуса опытных лабораторных крыс, употреблявших соединение кальция с питьевой водой, мало отличается от таковой контрольных животных.
Интенсивность люминесценции серотонина в макрофагах премедуллярной зоны, в тучных клетках и в тимоцитах мозгового вещества долек тимуса у первой группы опытных животных была достоверно выше, чем у контрольных животных, и составляла 65,89±4,79 у. е., 45,79±1,65 у. е. и 30,09±0,82 у. е. (p<0,05) соответственно. Спектрофлуориметрическое исследование показывает, что содержание серотонина в субкапсулярных макрофагах незначительно снижено (61,66±4,29 у. е.) и отличается от контрольной группы (70,16±1,07 у. е.)
У животных второй опытной группы содержание серотонина в субкапсулярных макрофагах и в тимоцитах коркового вещества резко снижено до 25,30±2,30 у. е. (p<0,05) и 16,52±0,78 у. е. (p<0,05), в то время как в контрольной группе интенсивность люминесценции данного биоамина составляет 70,20±1,10 у. е. и 45,25±2,48 у. е. соответственно. Содержание серотонина в тучных клетках опытных животных увеличивается в 2,17 раза, по сравнению с контрольной группой (79,80±4,70 у. е. и 36,60±1,20 у. е. соответственно, (p<0,05))
Характер распределения катехоламинов в структурах тимуса контрольных животных был следующим: наибольшая интенсивность люминесценции была обнаружена в макрофагах премедуллярной и субкапсулярной зон на уровне 9,62±0,71 у. е. и 8,72±0,17 у. е соответственно, самые низкие уровни регистрировались в паренхиме мозгового вещества (3,71±0,29 у. е.) долек тимуса и в тучных клетках (4,50±0,18 у.е.).
У животных, получавших с питьевой водой соединение кальция, в сравнении с контрольными животными, наблюдалось увеличение содержания катехоламинов в тимоцитах мозгового вещества и в тучных клетках (4,59±0,12 у. е. и 5,69±0,19 у. е. (p<0,05) соответственно), в макрофагах же премедуллярной и субкапсулярной зон была выявлена тенденция к снижению уровней исследуемых биоаминов.
У животных, употреблявших с питьевой водой соединение кремния, произошло значительное снижение содержания катехоламинов во всех структурах тимуса, за исключением тучных клеток – в них интенсивность люминесценции была выше (10,77±0,72 у. е.; p<0,05), чем у животных контрольной группы и первой опытной.
Характер распределения серотонина и катехоламинов в структурах тимуса отразился на серотониновом индексе. У животных контрольной группы соотношения серотонин/катехоламины в макрофагах субкапсулярной зоны, в тучных клетках и тимоцитах коркового вещества тимуса были в пределах 8,05 – 8,30, в макрофагах премедуллярной зоны данное соотношение было самым низким – 4,94.
В группе животных, употреблявших питьевую воду с соединением кальция, наибольшие изменения серотонинового индекса, по сравнению с контролем, произошли в макрофагах премедуллярной зоны, где рассчитываемый коэффициент увеличился в 1,49 раза. В других структурах значительных изменений этого показателя не произошло.
У животных, употреблявших с питьевой водой соединение кремния, наблюдалось превалирование содержания серотонина над содержанием катехоламинов, по сравнению с контрольными животными, в премедуллярных макрофагах в 1,93 раза, а в субкапсулярных макрофагах и тимоцитах коркового вещества относительное преобладание, наоборот, снизилось в 1,47 раза и в 1,92 раза соответственно.
При люминесцентно-гистохимическом исследовании срезов тимуса методом Кросса было выявлено: у животных контрольной группы максимальное содержание гистамина наблюдалось в тимоцитах мозгового вещества (111,50±19,23 у. е) и в макрофагах кортикомедуллярной зоны (103,17±4,61 у. е.), минимальное – в тимоцитах коркового вещества (29,12±0,54 у. е.). В макрофагах субкапсулярной зоны и в тучных клетках уровень люминесценции данного диамина равнялся 55,37±2,26 у. е и 53,78±2,47 у. е. соответственно.
В то же время при оценке интенсивности свечения гистамина, в макрофагах кортикомедуллярной зоны и в тимоцитах мозгового вещества долек тимуса, животных, употреблявших с питьевой водой соединение кальция, было установлено, что содержание гистамина значительно снизилось, по сравнению с контролем (103,20±4,60 у. е. – контроль, 67,90±4,30 у. е. (p<0,05) – опыт; 111,50±19,20 у. е. – контроль, 26,50±1,00 у. е. (p<0,05) – опыт соответственно). Содержание гистамина в тучных клетках у животных первой опытной группы практически не отличалось от уровня люминесценции в контрольной группе (52,50±4,70 у. е. и 53,80±2,50 у. е. соответственно).
При исследовании срезов тимуса животных, употреблявших с питьевой водой соединение кремния, было обнаружено, что содержание гистамина в макрофагах кортикомедуллярной зоны, в сравнении с контрольными животными, возросло с 103,0±4,60 у. е. до 124,90±12,50 у. е., в макрофагах субкапсулярной зоны – с 55,40±2,60 у. е. до 72,50±7,10 у. е. (<0,05).
В тимоцитах мозгового вещества долек тимуса у животных данной группы содержание гистамина уменьшилось более чем в два раза – с 111,50±19,20 у. е. до 47,90±2,50 у. е. (<0,05), в корковых тимоцитах, наоборот, увеличилось в 1,7 раза – с 29,10±0,50 у. е. до 51,10±3,80 у. е. (<0,05). В тучных клетках интенсивность люминесценции гистамина снизилась (53,80±2,50 у. е. – контроль, 48,40±0,50 у. е. (p<0,05) – опыт).
3.5. Корреляционный анализ биоаминсодержащих структур тимуса контрольных и опытных животных при поступлении соединений кальция и кремния.
3.5.1. Корреляционный анализ в паре биогенных аминов в структурах тимуса. Оценивая результаты корреляционного анализа в паре серотонин – катехоламины, можно заметить, что у животных контрольной группы прямая средняя связь наблюдается в премедуллярных макрофагах, тимоцитах мозгового и коркового вещества долек тимуса. В субкапсулярных макрофагах и тучных клетках корреляционная связь обратная отрицательная. У животных первой опытной группы в премедуллярных макрофагах и тучных клетках установлены прямые положительные корреляционные связи, а в субкапсулярных макрофагах – отрицательная. У животных второй опытной группы все корреляционные связи были прямыми положительными (рис. 1).
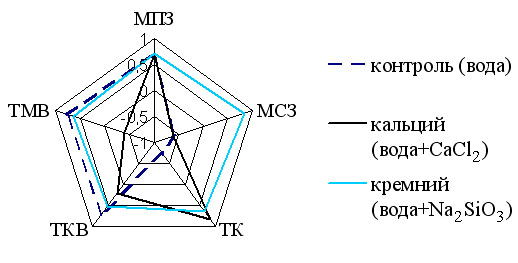
Рис.1 Результаты корреляционного анализа в паре биогенных аминов (СТ и КА) в структурах тимуса подопытных лабораторных крыс (МПЗ – макрофаги премедуллярной зоны, МСЗ – макрофаги субкапсулярной зоны, ТК – тучные клетки, ТКВ – тимоциты коркового вещества, ТМВ – тимоциты мозгового вещества) – здесь и далее.
В паре гистамин – катехоламины у животных контрольной группы были обнаружены отрицательные корреляционные связи в тимоцитах коркового и мозгового вещества. У животных первой опытной группы (поступление соединения кальция) – в субкапсулярных макрофагах, а во второй опытной группе – в премедуллярных макрофагах (рис. 2).
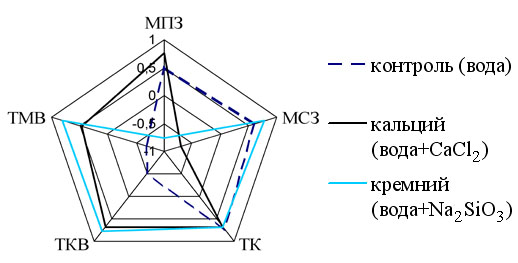
Рис.2 Результаты корреляционного анализа в паре биогенных аминов (Г и КА) в структурах тимуса подопытных лабораторных крыс.
В паре серотонин – гистамин у животных контрольной группы корреляционные связи были отрицательными. У животных первой опытной группы – только в тимоцитах мозгового вещества, а у животных второй опытной группы отрицательная связь была выявлена в премедуллярных макрофагах (рис. 3).
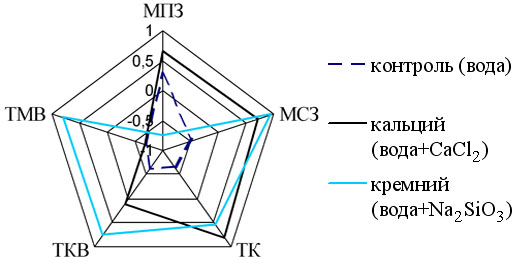
Рис. 3 Результаты корреляционного анализа в паре биогенных аминов (СТ и Г) в структурах тимуса подопытных лабораторных крыс.
Полученные результаты свидетельствуют об измененных, по сравнению с контролем, межбиоаминных взаимодействиях в структурах тимуса животных опытных групп.
3.5.2. Анализ корреляционных связей биоаминсодержащих структур тимуса. У животных первой опытной группы, получавших с питьевой водой соль кальция, в паре макрофаги премедуллярной зоны – тучные клетки корреляционная связь по серотонину положительная, по сравнению с контролем, что подтверждает аминопродуцирующую функцию макрофагов премедуллярной зоны. У животных второй опытной группы, получавших соль кремниевой кислоты, наблюдается отрицательная корреляционная связь в паре макрофаги премедуллярной зоны – макрофаги субкапсулярной зоны, положительная корреляционная связь – в паре макрофаги премедуллярной зоны – тимоциты мозгового вещества долек тимуса.
В характере параллельного изменения содержания катехоламинов в клетках структур тимуса животных первой опытной группы, в отличие от контрольных животных, обнаружена положительная связь в паре макрофаги премедуллярной зоны – тимоциты мозгового вещества.
В структурах тимуса животных второй опытной группы по данному биоамину отрицательная связь выявлена в паре макрофаги премедуллярной зоны – тучные клетки. Это объясняется усилением поглощения катехоламинов тучными клетками на фоне снижения синтеза этих биогенных аминов премедуллярными макрофагами.
У животных, употреблявших с питьевой водой соединение кальция, устанавливаются положительные корреляционные связи во всех парах биоаминсодержащих структур тимуса по гистамину вследствие снабжения им всех структур тимуса и интенсивной продукции гистамина макрофагами премедуллярной зоны.
У животных, употреблявших с питьевой водой соединение кремния, отрицательная корреляционная связь в паре макрофаги премедуллярной зоны – макрофаги субкапсулярной зоны, выявленная у контрольных животных, становится положительной, что свидетельствует об усилении синтеза гистамина макрофагами премедуллярной зоны. В паре макрофаги премедуллярной зоны – тимоциты мозгового вещества положительная корреляционная связь, выявленная у контрольных животных, становится отрицательной.
3.6. Результаты исследования популяции тучных клеток тимуса экспериментальных животных.
Наряду со специализированными в функциональном отношении клетками диффузной нейроэндокринной системы, источниками биогенных аминов и пептидных гормонов в тимусе являются тучные клетки (В. Л. Быков, 2000; В. Е. Сергеева и др., 2010). Они обладают значительной реактивной способностью, участвуют во многих приспособительных процессах, а продуцируемые ими вещества регуляторного типа – биогенные амины, гепарин и другие кислые гликозаминогликаны – имеют широкий спектр биологических эффектов. Тучные клетки, регуляторы тканевого гомеостаза, являются необходимым звеном в процессе адаптации на клеточном уровне (Д. С. Гордон, В. Е. Сергеева, И. Г. Зеленова, 1982; И. М. Кветной и соавт., 2000; В. С. Судеева, 2008, 2009).
Основное морфологическое свойство тучных клеток – наличие в них метахроматичных гранул, состоящих из белковой основы, соединенной с гепарином. Степенью созревания гепарина определяется метахромазия тучных клеток.
Окраска срезов тимуса полихромным толуидиновым синим по Унна для определения степени зрелости мукополисахаридного комплекса и для контроля состояния гепарина в тканевых базофилах позволила установить следующее: в септах и паренхиме тимуса лабораторных крыс первой опытной группы число 3-метахроматичных тучных клеток составило 18,2% и 27,3% соответственно. В тимусе крыс контрольных животных 3-метахроматичных тучных клеток обнаружено не было. Следовательно, в гранулах тучных клеток животных, получавших с питьевой водой соединение кальция, увеличивается содержание сульфатированного (зрелого) гепарина, способного связать большее количество биогенных аминов по сравнению с несульфатированным гепарином. В тимусе животных этой же группы, по сравнению с контролем, уменьшилось число тучных клеток с визуально не обнаруживаемым ядром и плотно расположенными гранулами (Т0-форма) как в септе, так и в паренхиме, но увеличилось количество клеток с частичным выходом гранул за пределы цитоплазмы при неповрежденной цитоплазматической мембране (Т2-форма).
В септах и паренхиме тимуса лабораторных крыс, употреблявших с питьевой водой соединение кремния, количество 3-метахроматичных тучных клеток в септе составило 24,5%, количество 2-метахроматичных тучных клеток в септе возросло по сравнению с контролем (72,2% и 63,6% соответственно). Таким образом, в тучных клетках, расположенных в септах долек, увеличивается содержание сульфатированного гепарина. Доля полностью дегранулированных тучных клеток (Т3-форм) составила 57,2% в септе и 50,0% в паренхиме, что в 1,3 и в 2,8 раза превышает контрольные значения.
4. ВЫВОДЫ
- Установлено, что у лабораторных животных, употреблявших соединения кальция и кремния с питьевой водой, значительно увеличиваются площади долек тимуса, преимущественно за счет коркового вещества (от 0,88±0,11 до 1,51±0,16) и, соответственно, увеличивается количество тимоцитов на единицу площади по отношению к контрольным значениям (p<0,05).
- Обнаружено влияние исследуемых солей на Iba-1 позитивные клетки: при поступлении в организм CaCl2 в корковом веществе долек тимуса уменьшается количество клеток и увеличивается их средняя площадь, в мозговом веществе – количество клеток увеличивается; при поступлении Na2SiO3 в корковом и мозговом веществе увеличивается средняя площадь клеток и количество клеток в мозговом веществе долек тимуса.
- Выявлено воздействие соли кальция на иммунокомпетентные (MHC-II) клетки тимуса, что проявляется достоверным увеличением их количества в мозговом веществе и в кортикомедуллярной зоне долек тимуса и снижением средней площади антигенпредставляющих клеток в кортико-медуллярной зоне.
- Употребление метасиликата натрия привело к снижению количества антигенпредставляющих клеток в корковом веществе долек и увеличению их количества в кортикомедуллярной зоне, а также к увеличению средней площади MHC-II позитивных клеток в мозговом веществе долек тимуса (p<0,05).
- Влияние CaCl2 на организм лабораторных белых крыс сопровождалось увеличением интенсивности свечения серотонина в премедуллярных макрофагах, тучных клетках, тимоцитах мозгового вещества (от 30,09±0,82 до 65,89±4,79 у. е.), а также катехоламинов в тучных клетках и тимоцитах мозгового вещества (от 4,59±0,12 до 5,69±0,19 у. е.; p<0,05).
- Воздействие Na2SiO3 приводит к достоверному снижению уровня серотонина и катехоламинов в изучаемых структурах тимуса и накоплению этих биоаминов в тучных клетках, и одновременно, к усилению синтеза гистамина и поглощению его субкапсулярными макрофагами и тимоцитами коркового вещества долек тимуса.
- Отмечено, что в моделируемых экспериментальных условиях: соединение кальция способствует созреванию гепарина в тучных клетках тимуса, а соединение кремния – как созреванию гепарина в тучных клетках, так и усиленному их разрушению.
5. СПИСОК ОПУБЛИКОВАННЫХ РАБОТ
ПО ТЕМЕ ДИССЕРТАЦИИ
1. Дьячкова, И. М. Влияние кремния и кальция на биоаминсодержащие структуры тимуса / И. М. Дьячкова, В. Е. Сергеева, С. П. Сапожников // Эколого-физиологические проблемы адаптации: мат. ХII Междунар. симпозиума. – М.: РУДН 2007. – С. 401-402.
2. Дьячкова, И. М. Морфофункциональное изменение биоаминсодержащих структур тимуса при введении кальция / И. М. Дьячкова, Н. В. Андреева, В. Е. Сергеева, С. П. Сапожников // Актуальные вопросы клинической и экспериментальной медицины: сб. науч. тр. молодых ученых и специалистов. – Чебоксары: Изд-во Чуваш. ун-та, 2007. – С. 128-131.
3. Смирнова Т. Л. Нейромедиаторное обеспечение лимфоидных и нелимфоидных органов в условиях экспериментальной нейромодуляции / Т. Л. Смирнова, С. П. Сапожников, В. Е. Сергеева, И.М. Дьячкова // Аллергология и иммунология. – 2009. – №1 – Т. 10. – С. 32-33. *
4. Дьячкова, И.М. Изменения Iba-1 позитивных клеток тимуса при воздействии кремния и кальция / И.М. Дьячкова // Вопросы клинической и экспериментальной медицины: мат. регион. науч.-практ. конф. – Чебоксары: Изд-во Чуваш.ун-та,2009. – С. 190-192.
5. Дьячкова, И. М. Влияние кремния и кальция на изменение популяции Iba-1 клеток в тимусе / И. М. Дьячкова, В. Е. Сергеева, С. П. Сапожников // Эколого-физиологические проблемы адаптации: мат. ХIV Междунар. симпозиума. – М.: РУДН, 2009. – С. 175-176.
6. Лузикова, Е. М. Исследования нейропептид содержащей энолазы, белков MHC-II класса и кальций-связывающих молекул макрофагов тимуса / Е. М. Лузикова, И. М. Дьячкова, В. Е. Сергеева, А. Т. Смородченко // Морфология. – 2009. – № 3. – Т. 135. – С. 90-91.*
7. Дьячкова, И. М. Исследование тучных клеток при воздействии соединений кальция / И. М. Дьячкова, Н. В. Андреева, В. Е. Сергеева // Наука и инновации-2009 ISS «SI-2009»: мат. IV междунар. научн. школы. – Йошкар-Ола, 2009. – С. 145-146.
8. Дьячкова, И. М. Адаптация тучных клеток тимуса к кальцию и кремнию / И. М. Дьячкова, В. Е. Сергеева, С. П. Сапожников // Наука и инновации-2010 ISS «SI-2010»: мат. V междунар. научн. школы. – Йошкар-Ола, 2010. – С. 256-258.
9. Дьячкова, И. М. Участие кремния и кальция в иммунном ответе / И.М. Дьячкова // Сб. тр. Открытой научн. конф. Молодежи и студентов. – Чебоксары: Чебоксарский политехнический институт МГОУ, 2010. – Вып. 5. – С. 38-40.
10. Дьячкова, И. М. Иммунологическая роль кальция в выявлении MHC-класса макрофагов селезенки и тимуса / И. М. Дьячкова, О. В. Воронкова // Международный журнал экспериментального образования. – М., 2010. – № 3. – С. 30-31.*
11. Дьячкова, И. М. Исследование популяции тучных клеток тимуса при длительном воздействии соединений кремния и кальция / И. М. Дьячкова, В. Е. Сергеева, С. П. Сапожников // Вестник Чувашского государственного педагогического университета имени И.Я.Яковлева. – 2010. – № 4(68). – С. 50-55.*
* – публикации в ведущих рецензируемых научных журналах и изданиях, определенных ВАК РФ.
Подписано к печати 11. 02. 2011 г. Бумага писчая. Печать оперативная.
Усл. печ. л. 1,0. Тираж 100 экз. Заказ № 59
Отпечатано в типографии ФГОУ ВПО «Чувашский государственный
университет им. И. Н. Ульянова»
428015, г. Чебоксары, Московский проспект, 15

