Бета-адренореактивные структуры в регуляции адаптационных возможностей системы кровообращения
На правах рукописи
Сальников Евгений Валентинович
БЕТА-АДРЕНОРЕАКТИВНЫЕ СТРУКТУРЫ В РЕГУЛЯЦИИ АДАПТАЦИОННЫХ ВОЗМОЖНОСТЕЙ
СИСТЕМЫ КРОВООБРАЩЕНИЯ
03.03.01 - физиология
Автореферат
диссертации на соискание ученой степени
доктора биологических наук
Ярославль – 2010
Работа выполнена на кафедрах нормальной физиологии с биофизикой и фармакологии ГОУ ВПО «Ярославская государственная медицинская академия» Федерального агентства по здравоохранению и
социальному развитию Российской Федерации
| Научный консультант: | доктор биологических наук, профессор Фатеев Михаил Михайлович |
| Официальные оппоненты: | Заслуженный деятель науки РФ, доктор биологических наук, профессор Шмаков Дмитрий Николаевич доктор биологических наук Александров Вячеслав Георгиевич доктор биологических наук, профессор Викулов Александр Демьянович |
| Ведущая организация | Институт физиологии имени И.П. Павлова Российской академии наук |
Защита состоится 24 июня 2010 г. в ___ часов на заседании совета
Д 212.307.02 по защите докторских и кандидатских диссертаций при
ГОУ ВПО «Ярославский государственный педагогический университет
им. К.Д. Ушинского» по адресу: 150000, г. Ярославль, Которосльная наб., 46 в, ауд. 203).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Ярославский государственный педагогический университет им. К.Д. Ушинского»
Автореферат разослан «___» _______ 2010 г.
Ученый секретарь диссертационного совета
кандидат биологических наук, доцент И.А. Осетров
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Сердечно-сосудистая система (ССС) и циркулирующая по ее сосудам кровь являются основными транспортными системами организма, связывающими в единое целое все органы и ткани организма и обеспечивающими наряду с другими системами поддержание гомеостаза. На их нормальное функционирование оказывают влияние нервная и эндокринная регуляция. Сбой в деятельности любой из этих систем приводит к нарушению в обеспечении органов, тканей и клеток необходимыми веществами для поддержания их нормальной работоспособности (Гуревич, 2008; Bleeke, Zhang et al., 2004).
В наш век научно-технического прогресса и урбанизации населения произошло повсеместное ухудшение экологической обстановки. В связи с этим возросло напряжение современной жизни, а адаптационные возможности организма резко снизились. Вся совокупность абиотических и биотических факторов, воздействующих на организм человека, довольно часто приводит к срыву адаптации – дезадаптации (Брехман, 1990). В ряде исследований показано (Бородкин и др., 1986; Арутюнов, Рылова, 2000), что снижение адаптационных возможностей организма сопровождается ростом специфических патологических изменений, которые проявляются в виде разнообразных заболеваний. В состоянии неудовлетворительной адаптации организм обладает настолько сниженными функциональными резервами, что даже небольшие нагрузки (как физические, так и эмоциональные) могут нарушить его неустойчивое равновесие со средой (Арутюнов, Рылова, 2000; Крыжановский, 2002).
В большинстве случаев систему кровообращения можно рассматривать как индикатор адаптационных реакций целостного организма (Меерсон, 1986). Уровень функционирования ССС является регулируемой величиной, постоянство которой поддерживается механизмами нейроэндокринной регуляции, путем изменения как межсистемных, так и внутрисистемных взаимодействий и взаимосвязей (Гейченко, Курята и др., 2007).
В настоящее время заболевания ССС вышли на первое место в мире. Одним из них является сердечная недостаточность – важнейший клинический синдром, характеризующийся неуклонным прогрессированием, что приводит к потере трудоспособности и значительно ухудшает качество жизни всё большего количества больных (Беленков и др., 2006; Провоторов, Бурлова, 2007; Шляхто и др., 2009). Увеличение заболеваемости сердечной недостаточностью происходит на фоне все более заметных достижений в лечении людей с болезнями сердца и, в первую очередь, ишемической болезнью сердца (Шевченко и др., 2008; Han. et al., 2006). С точки зрения физиологии ССС хроническая сердечная недостаточность (ХСН) является состоянием, при котором снижается адаптация сердца к предлагаемым ему нагрузкам, и, следовательно, нарушается способность миокарда обеспечивать необходимый уровень кровообращения в зависимости от метаболических потребностей организма (Федоров, 1999; Смирнова, 2002; Милакова и др., 2003). ХСН представляет собой финальную стадию большинства болезней ССС, а нарушение активности центральных и периферических (тканевых) нейроэндокринных систем занимает важное место в патогенезе ХСН. В этом отношении она является классическим примером дисрегуляционной патологии (Меерсон, 1986; Барт и др., 2007).
Важнейшая роль в обеспечении адаптации организма к стрессовым воздействиям принадлежит симпатической нервной системе (Орбели, 1962), чрезмерная активация которой может иметь значение в генезе ишемического повреждения миокарда (Меерсон, 1984; Прибылова, Осипова, 2009; Schlaich, Kaye et al., 2003). Свое влияние на ткани симпатическая нервная система осуществляет через адренорецепторы, которые являются гетерогенными структурами. Если роль адренорецепторов в деятельности системы кровообращения изучена достаточно полно (Erami, Zhang et al., 2002), то функциональная значимость в данном процессе -адренореактивных структур в ряде случаев остается неясной. Прежде всего, это касается конкретного влияния 1- и 2-адренорецепторов на регуляцию работы сердца и функционирование системы гемостаза.
Основным инструментом работы с -адренорецепторами являются адреноблокаторы и -адреномиметики. В физиологии они часто используются для изучения функционального состояния, как самой симпатической нервной системы, так и ее роли в регуляции деятельности других систем организма (Ноздрачев, 1983; Ноздрачев, Янцев, 1995, Ноздрачев, Фатеев, 2002).
В терапии заболеваний ССС -адреноблокаторы являются одной из основных групп препаратов. В частности, в последние полтора десятилетия -адреноблокаторы стали широко применять в комплексной терапии ХСН (Терещенко, 2006; Гуревич, 2008, 2009; Национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН, 2009; The Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology, 2005; Douglas et al., 2008). Обоснованием к их применению послужило открытие регулирующего влияния катехоламинов на активность ренин-ангиотензин-альдостероновой системы (Раков, 2005; Беленков и др. 2006; Гуревич, 2009; Драпкина, Ашихман, 2009; Fu, Hajalmarson, 1991; Douglas et al., 2008). Также было выяснено, что при различных вариантах застойной ХСН у человека и животных в миокарде «недостаточного» сердца отмечается снижение плотности 1-адренорецепторов и уменьшение инотропной реакции на их стимуляцию, трактующееся как развитие специфической десенситизации адренергической системы сердца, обусловленной избыточной концентрацией норадреналина (Leinewelde et al., 2002). Блокаторы -адренорецепторов, снижая избыточную симпатическую стимуляцию миокарда, приводят к ресенсибилизации 1-адренорецепторов (нормализация систолической функции) и уменьшению перегрузки кардиомиоцитов кальцием, что оказывает благоприятное влияние на релаксацию желудочков (нормализация диастолической функции) (Доказательная медицина. Ежегодный справочник, 2002; Арутюнов, Агеев, 2003; Терещенко, 2006; Драпкина, Ашихман, 2009; Hamroff et al., 1999; Douglas et al., 2008). Существенна роль катехоламинов в регуляции системы про- и антивоспалительных цитокинов (Ольбинская, Сизова и др., 2006) и в развитии эндотелиальной дисфункции, что имеет большое значение в прогрессировании ХСН (Денисов и др., 2007; Ольбинская, Сизова и др., 2007; Прощаев и др., 2007; Сукманова, Яхонтов, 2009; Gonzalez-Juanatey et al., 2007; Tam et al., 2008).
Группа -адреноблокаторов не является однородной: выделяют 3 больших класса: кардиоселективные (метопролол, атенолол, бисопролол и др.) действующие преимущественно на 1-адренорецепторы, неселективные (пропранолол, надолол, пиндолол и др.) действующие на 1- и 2-адренорецепторы, и вазоактивные препараты (карведилол, небиволол и др.) (Гуревич, 2008, 2009; Леонова, 2009). Однако до сих пор многие механизмы их действия на показатели сердечно-сосудистой системы и системы крови при однократном и длительном их применении остаются до сих пор мало изученными. Это делает актуальным сравнение влияния -адреноблокаторов различных классов на сердечную деятельность, состояние гормонально-медиаторных систем, обмен липидов, гемостазиологические показатели, выживаемость и продолжительность жизни у лабораторных животных в норме и в условиях дезадаптации миокарда.
В настоящее время в практике физиологических и клинических исследований широко используется метод анализа вариабельности сердечного ритма. В физиологии метод ВСР расширяет возможности научного изучения механизмов становления (Абзалов и др., 2006; Фатеев и др., 2009; Макаров и др., 2009; Sato et al., 2007) и регуляции сердечной деятельности (Баевский, Иванов, 2001; Баевский, 2002; ШейхЗаде и др., 2005, 2006; Минасян и др., 2006; Миронова, Миронов и др, 2007); в фармакологии и физиологии применяется для исследования воздействия различных биологически активных веществ на функции миокарда (Тепляков и др., 2004; Алипов и др., 2005; Линник, Наурбиева, 2007; Стаценко, Землянская, 2007; Тарасов и др., 2008; Цорин и др., 2008; Арушанян, 2009; Каверина и др., 2009; Lin et al., 1999; Gullestad et al., 2001), в том числе и -адреноблокаторов (Алексеева, Малкина., Соколов, 2007; Каверина, Лысковцев и др., 2008; Прасолов, Москалюк, 2009; Theodorakis et al., 1993). Особую значимость анализ ВСР имеет в клинической практике, этот метод используется для диагностики, контроля эффективности терапии и определения прогноза, в том числе ХСН (Миронова, Миронов, 2006; Сетынь, Колпаков, Волов, 2007; Стаценко и др., 2007; Чихирев и др., 2007; Рябыкина и др., 2008; Улыбина и др., 2008; Наумова, Земцова, 2009; Абдрахманов, 2009; Калмыкова, Миронова, Давыдова, 2009; Шпак, Волкова, 2009; Самохвалова, Гераскина, Фонякин, 2009; Lombardi, Mortara, 1998; Suzuki et al., 2003; Sajadieh et al., 2004; Cook et al., 2006; Dietrich et al., 2006).
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить особенности функционирования сердечно-сосудистой системы у крыс в норме и при дезадаптации при кратковременном и длительном изменении активности -адренореактивных структур.
ЗАДАЧИ ИССЛЕДОВАНИЯ
- Разработать в качестве модели дезадаптации сердечно-сосудистой системы динамическую модель хронической сердечной недостаточности и изучить ее характеристики.
- Исследовать особенности вариабельности сердечного ритма (ВСР) и гемодинамических показателей работы сердца у крыс, находящихся в различных состояниях (наркоз, кратковременный иммобилизационный стресс, модель ХСН) и провести их сравнительный анализ.
- Выяснить роль -адренореактивных структур в регуляции сердечного ритма и гемодинамических показателей работы сердца при кратковременном и длительном изменении их активности.
- Исследовать особенности гормонально-медиаторного, липидного обменов и гемостаза у крыс, находящихся в различных состояниях (интактные животные и модель ХСН) и провести их сравнительный анализ.
- Изучить роль длительного ингибирования активности адренореактивных структур на регуляцию гормонально-медиаторного обмена в условиях дезадаптации организма.
- Установить влияние продолжительного выключения активности -адренорецепторов на липидный обмен (содержание в крови липопротеидов, триглицеридов и холестерина) у дезадаптированных крыс.
- Выяснить роль длительного подавления активности адренореактивных структур на показатели гемостаза у крыс, находящихся в условиях дезадаптации.
НАУЧНАЯ НОВИЗНА
Впервые проведено комплексное исследование по выяснению роли адренореактивных структур в регуляции системы кровообращения у крыс, находящихся в различных состояниях (наркоз, иммобилизационный стресс, моделированная ХСН) с применением физиологических, биохимических и фармакологических методов.
Впервые в качестве модели дезадаптации применена оригинальная модель ХСН, разработанная на основе модели Н.Н. Пятницкого и Ю.А. Блинкова (1970). И с помощью физиологических и морфологических методов доказана ее действенность, возможность создавать ХСН различной степени тяжести и близость ее к ХСН, возникающей у человека.
Впервые проведено подробное изучение показателей ВСР с применением временного, геометрических методов и метода спектрального анализа у животных при различных состояниях, а также при активации и подавлении активности -адренореактивных структур.
Впервые предложено оценивать влияние биологически активных веществ на ВСР по показателю суммарной степени воздействия (ССВ) на сердечный ритм. Показано, что однократное воздействие -адреномиметика добутамина на наркотизированных крыс практически не влияло на сердечный ритм, а наибольшее действие оказывало блокирование -адренореактивных структур высокоселективными 1-адреноблокаторами бисопрололом и метопрололом, комбинированный небиволол с вазодилятирующим эффектом и водорастворимый атенолол практически не оказывали влияния на ВСР. При иммобилизационном стрессе однократное использование этих же веществ влияло на ВСР таким же образом и в такой же последовательности, но воздействие на сердечный ритм было сильнее, особенно это касается бисопролола и метопролола. Длительное применение изучаемых веществ на организм дезадаптированных крыс с ХСН имело значительно меньшее влияние на ВСР, и наименьшее воздействие оказывали высокоселективные 1-адреноблокаторы метопролол, бисопролол и небиволол.
Впервые обнаружены разнонаправленные изменения показателей спектрального анализа ВСР по сравнению с временным, геометрическим анализом и корреляционной ритмографией при изменении активности адренореактивных структур у крыс, находившихся в состоянии кратковременного иммобилизационного стресса. Установлено, что в этом случае в показателе LF отражается не только активность симпатического отдела АНС, но иные нейрогуморальные механизмы.
Изучено влияние активности -адренореактивных структур на изменение гемодинамических показателей (СОК и МОК) работы сердца у стрессированных животных. Введение добутамина вызывало увеличение этих показателей, а блокаторов -адренорецепторов практически их не изменяло. У крыс с моделированной ХСН достоверно снижались СОК и МОК, а длительное подавление активности -адренореактивных структур высокоселективными метопрололом, бисопрололом и небивололом с вазодилататорной активностью возвращало их к таковым у интактных животных.
Впервые в эксперименте при помощи шести -адреноблокаторов (пропранолол, пиндолол, атенолол, метопролол, бисопролол и небиволол) различных классов проведено сравнительное исследование функционального вклада 1- и 2-адренорецепторов в регуляции сердечно-сосудистой системы, системы гемостаза и липидного обмена в организме на фоне длительного их применения у интактных и дезадаптированных животных.
Установлено, что для возникновения дезадаптации системы кровообращения (модель ХСН) дизрегуляция 1-адренореактивных структур имеет большее значение, чем нарушение функциональной активности 2-адренорецепторов. Это подтверждает более высокая нормализующая способность селективных -адреноблокаторов в регуляции функций кортико-адреналовой и симпатоадреналовой систем, системы гистамин/серотонин, липидного обмена и системы гемостаза. Наиболее активным нормализующим действием в отношении липидного обмена при ХСН обладали кардиоселективные адреноблокаторы (небиволол, бисопролол, метопролол и атенолол): только их введение приводило к одновременному снижению содержания общего ХС, ХС ЛПНП, ТГ и коэффициента атерогенности плазмы. На фоне ХСН все исследуемые -адреноблокаторы способствовали у животных гармонизации показателей агрегации тромбоцитов, свертывающей, антисвертывающей и фибринолитической систем крови. Выявлен дополнительный механизм в действии -адреноблокаторов – центральный, связанный с обменом дофамина, гистамина и серотонина в ЦНС.
Впервые показано, что снижение функциональной активности адренореактивных структур на фоне введения -адреноблокаторов способствовало увеличению выживаемости и продолжительности жизни дезадаптированных животных с экспериментальной ХСН, а также препятствовало у них развитию гипертрофии миокарда.
Было показано, что наличие у -адреноблокаторов внутренней симпатомиметической активности уменьшало их нормализующее влияние в отношении регуляции функций кортико-адреналовой и симпатоадреналовой систем, системы гистамин/серотонин, липидного обмена и системы гемостаза на фоне длительной дезадаптации.
Проведенное исследование позволило также впервые выстроить следующий ряд нормализующей активности -адреноблокаторов при экспериментальной ХСН: небиволол > бисопролол > метопролол > атенолол > пропранолол > пиндолол.
ТЕОРЕТИЧЕСКАЯ И ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ
Результаты исследований дополняют знания о механизмах действия адреноблокаторов в зависимости от их физико-химических свойств и степени селективности на функционирование -адренореактивных структур организма, участвующих в нейроэндокринной регуляции деятельности ССС и системы крови, у интактных животных и у крыс в условиях дезадаптации на примере модели ХСН. Так, применение -адреноблокаторов предупреждает или значимо уменьшает патологические изменения в состоянии симпато-адреналовой и кортико-адреналовой систем, обмене липидов, гистамина, серотонина и системе гемостаза, которые возникают у крыс с экспериментальной ХСН.
Полученные в ходе данного исследования результаты имеют существенное практическое значение для клиницистов, т.к. показывают их эффективность и безопасность при лечении ХСН per se, то есть вне комплексной терапии. Исходя из наших данных, наибольшую эффективность имеют кардиоселективные липофильные препараты (небиволол, бисопролол, метопролол).
Результаты настоящего исследования дополняют знания о механизмах нейроэндокринной регуляции деятельности сердечно-сосудистой системы. Выявленные изменения показателей ВСР представляют интерес для физиологов, изучающих роль -адренореактивных структур на функционирование организма, находящегося в условиях нормы, в состоянии иммобилизации и при дезадаптации, вызванной патологическим процессом.
ОСНОВНЫЕ ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ
- Предложенная модель дезадаптации – модель хронической сердечной недостаточности у крыс – по основным физиологическим и морфологическим критериям соответствует течению хронической сердечной недостаточности у человека. При этом длительная инактивация -адренореактивных структур у интактных животных не оказывает существенного влияния на такие интегральные показатели организма как динамика веса тела и весовой коэффициент сердца. На фоне хронической сердечной недостаточности применение адреноблокаторов предупреждают развитие гипертрофии миокарда, способствует выживаемости подопытных крыс и увеличивает продолжительность их жизни. Наиболее активными являются липофильные селективные препараты (метопролол, бисопролол, небиволол).
- Исследование по изучению роли -адренореактивных структур на сердечный ритм показывает, что активация -адренорецепторов добутамином у наркотизированных крыс практически не влияет на сердечный ритм, а их блокада приводит к согласованному изменению показателей ВСР, свидетельствующих о преобладании у них тонуса парасимпатического отдела АНС. У бодрствующих иммобилизированных крыс наблюдается повышение тонуса симпатического отдела АНС. Блокада -адренорецепторов, согласно данным временного и геометрического анализов, приводит к преобладанию тонуса парасимпатического отдела АНС, а повышение их чувствительности - наоборот. При этом блокада -адренорецепторов метопрололом, бисопрололом и пропранололом способствует большему подавлению тонуса симпатического отдела АНС по сравнению с атенололом, небивололом и особенно пиндололом. Систолический объем крови повышается только при действии адреномиметика. При использовании -адреноблокаторов систолический и минутный объемы практически не изменяются.
- Экспериментальная ХСН у животных приводит к повышению тонуса парасимпатической нервной системы и снижению систолического и минутного объемов крови. Длительное применение высокоселективных адреноблокаторов: метопролола, бисопролола и небиволола возвращает многие показатели ВСР к таковым у интактных крыс и нормализует систолический и минутный объемы крови.
- Снижении активности -адренореактивных структур у интактных животных показывает, что используемые -адреноблокаторы вне зависимости от их физико-химических свойств и степени селективности обладают схожим эффектом – в крови они вызывают достоверное и в целом равномерное снижение уровня АД и НА; в миокарде уровень катехоламинов остается в пределах нормы. Концентрация ГТ, СТ и 11-ОКС в исследуемых тканях практически не изменяется. При ХСН -адреноблокаторы в крови снижают количество вазоспастических катехоламинов (АД и НА) на фоне повышения концентрации ДА; в миокарде - повышают синтез НА и ДА. Одновременно в исследуемых тканях нормализуется содержание ГТ, СТ и 11-ОКС. адреноблокаторы обладают способностью к регуляции обмена биогенных аминов в головном мозге. Как у интактных, так и у дезадаптированных крыс они снижают содержание возбуждающих агентов (ДА, НА, ГТ) и повышают содержание тормозных (СТ).
- Изучение липидного спектра плазмы крови интактных крыс показывает, что применение пропранолола и пиндолола способствует повышению в крови ТГ и ЛПОНП. Неселективные -адреноблокаторы вызывают повышение степени атерогенности плазмы, а селективные ее снижают, и все они практически не оказывают влияния на показатели гемостаза. На фоне экспериментальной хронической сердечной недостаточности наиболее активным нормализующим действием в отношении липидного обмена обладают высокоселективные -адреноблокаторы (небиволол, бисопролол, метопролол и атенолол): только их введение приводит к одновременному снижению содержания общего ХС, ХС ЛПНП, ТГ и коэффициента атерогенности плазмы. При этом все адреноблокаторы, вне зависимости от их селективности и липофильности, снижают уровень спонтанной и индуцированной коллагеном и АДФ агрегации тромбоцитов, уменьшают (кроме пропранолола) ПТИ, повышают активность антитромбина-III и фибринолитическую активность крови.
АПРОБАЦИЯ РАБОТЫ
Материалы и положения диссертации представлены и доложены на научных конференциях Ярославской государственной медицинской академии 2005, 2006, 2007 гг.; XII, XIII, XV Всероссийской конференции «Человек и лекарство», Москва, 2005, 2006, 2008 гг.; Первом Всероссийском съезде аритмологов, Москва, 2005 г.; Международной конференции «Гемореология в микро- и макроциркуляции», Ярославль, 2005 г.; I, II съездах физиологов СНГ, Сочи, Дагомыс, 2005 г., Кишинев, 2008 г.; VI Международной конференции «Здоровье и образование в XXI веке», Москва, 2005 г.; Международном конгрессе «Кардиостим-2006», Санкт-Петербург, 2006 г.; IV, VI и VII всероссийских конференциях c международным участием: «Механизмы висцеральных систем», Санкт-Петербург, 2005, 2008, 2009 гг.; 2-ой Российско-Китайской международной конференции по фармакологии, Пермь, 2006 г.; XX съезд физиологического общества им. И.П. Павлова, 2007 г.; III съезде фармакологов России, Санкт-Петербург, 2007 г.; Международной научно-практической конференции, посвящённой 100-летию ЯГПУ им. К.Д. Ушинского и 5-летию кафедры безопасности жизнедеятельности, Ярославль, 2008 г.; II Международной научной конференции «Актуальные проблемы биологии, нанотехнологий и медицины», Ростов-на-Дону, 2008 г.
ПУБЛИКАЦИИ
По материалам диссертации опубликовано 37 научных работ (в том числе 9 в журналах из перечня периодических изданий, рекомендуемых ВАК РФ).
ОБЪЕМ И СТРУКТУРА РАБОТЫ
Диссертация изложена на 303 страницах машинописного текста и состоит из введения, описания общих методических приемов, трех глав экспериментальной работы (каждая из которых содержит литературную предпосылку, особенности методики исследования, результаты исследования, заключительные замечания), заключения, выводов, списка литературы, включающего 521 наименование, в том числе 311 отечественных и 210 иностранных источников. Работа иллюстрирована 30 таблицами и 49 рисунками.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования выполнены на 1189-ти белых беспородных крысах-самцах весом 180-230 г. С лабораторными животными работали в соответствии с действующими «Правилами проведения работ с использованием экспериментальных животных» и «Международными рекомендациями по проведению медико-биологических исследований с использованием животных» (1985). Все эксперименты согласно задачам исследования можно разделить на 6 групп: изучение адекватности предложенной модели (60 крыс), изучение выживаемости и продолжительности жизни животных (140 крыс), исследование ВСР (334 крысы), СОК и МОК (235 крыс), изучение влияния исследуемых -адренергических веществ на биохимические показатели и показатели гемостаза (210 крыс). Каждая группа была разделена на 4 подгруппы: интактные без воздействия -адренергических веществ, интактные, которым вводили препараты, контрольные дезадаптированные (ХСН) и дезадаптированные, которым вводили препараты. А каждая подгруппа в зависимости от задач включала несколько серий экспериментов.
Оценка предложенной модели дезадаптации хронической сердечной недостаточности была произведена физиологическими и морфологическими методами. С помощью реовазографии определяли ОПСС, СОК и МОК, по ЭКГ – ЧСС, кровавым способом измеряли САД (Исмаилов и др., 1982). Для морфологического изучения модели ХСН у крыс забирали сердце, печень и легкие, проводили макро- и микроскопическое исследование (Меркулов, 1969; Автандилов, 1973).
В качестве -адренергических веществ были выбраны представители различных классов адреноблокаторов, наиболее широко применяемые в нашей стране. Из неселективных (действующих на 1- и 2-адренорецепторы) без внутренней симпатомиметической активности (ВСМА) – пропранолол и с ВСМА - пиндолол, из кардиоселективных (действующих преимущественно на 1-адренорецепторы) – атенолол, бисопролол, метопролол, обладающих различными физико-химическими свойствами, и небиволол с вазодилатирующей активностью (табл. 1). В качестве -адреномиметика был выбран селективный 1-адреномиметик – добутамин.
Таблица 1
Характеристика биологически активных веществ выбранных для исследования (Метелица, 2002; Перепеч, Михайлова, 2004)
| Препарат | Доза мг/кг | Коэффициент селективности* |
| Добутамин | 1,0 | - |
| Пропранолол | 10,0 | 0,98 |
| Пиндолол | 2,5 | 1,56 |
| Атенолол | 5,0 | 19 |
| Метопролол | 10,0 | 25 |
| Бисопролол | 0,8 | 50 |
| Небиволол | 0,5 | 297 |
*- коэффициент селективности – аффинитет по отношению 1/ 2
При определении дозы препаратов использовали коэффициент перерасчета – 5.9. -адреноблокаторы вводились крысам внутрижелудочно в виде растворов в объеме 1 мл. Добутамин вводился внутрибрюшинно. Он применялся только при исследовании ВСР у наркотизированных и бодрствующих иммобилизированных животных, а также при определении СОК и МОК у интактных бодрствующих крыс.
В качестве наркоза использовали гексенал (100 мг/кг массы животного внутрибрюшинно) или нембутал (40 мг/кг). Для морфологических исследований животных забивали под гексеналовым наркозом (150 мг/кг).
Для изучения влияния исследуемых препаратов на ВСР провели 3 серии экспериментов: на интактных крысах, находящихся в состоянии наркоза, на бодрствующих иммобилизированных животных в положении на спине в состоянии кратковременного стресса и на бодрствующих иммобилизированных крысах с экспериментальной ХСН. Регистрацию ЭКГ осуществляли с помощью двухканальной электрофизиологической установки, связанной через АЦП («L-CARD E-440») с компьютером «Pentium II». Частота дискретизации составляла 4.0 кГц. ЭКГ записывалась во II-м стандартном отведении в течение 4-х минут с помощью программы «L-GRAPH», поставляемой вместе с АЦП. Просмотр ЭКГ и первичная обработка ее проводилась с помощью программы «RRMatch», а окончательный расчет показателей ВСР и их графическое отображение в программе «CRGraph».
При анализе ВСР использовали показатели временного анализа: минимальная – Mn (мс) и максимальная – Мх (мс) длительность всех интервалов R-R, ЧСС, среднее квадратичное отклонение – SDNN (мс), коэффициент вариации – CV (%), квадратный корень из суммы квадратов разности величин последовательных пар интервалов R-R – RMSSD (мс); геометрического анализа: вариационный размах – MxDMn (мс), мода – Мо (мс), амплитуда моды – АМо (%), стресс-индекс – SI (усл. ед.); скаттерограммы: площадь скаттерограммы – EllSq (мс2), отношение ширины к длине скаттерограммы – EllAs (%); и спектрального анализа: мощность волн низкой частоты – LF (мс2), мощность волн высокой частоты – НF (мс2), общая мощность спектра TP (мс2), относительное значение мощности волн высокой НF (%) и низкой LF (%) частот, индекс вагосимпатического взаимодействия – LF/НF (усл. ед.). При расчете геометрических показателей шаг гистограммы был равен 2 мс. У наркотизированных крыс диапазон LF составлял 0.020.15 Гц, у бодрствующих стрессированных животных 0.02-0.75 Гц. Диапазон НF – 0.15-2.0 Гц у наркотизированных крыс и 0.75-3.0 Гц у бодрствующих.
Регистрация СОК и МОК осуществлялась с помощью модернизированного для мелких лабораторных животных допплеровского анализатора сердечно-сосудистой деятельности «Кроха-М» (г. Тула) с соответствующим программным обеспечением. Использовали датчик диаметром 4 мм и частотой 8.0 МГц. Длительность записи составляла 3 минуты.
Изучение биохимических показателей осуществлялось при помощи спектрофлюориметрических (спектрофлюориметр «Hitachi» MPF-4) и колориметрических (фотоэлектроколориметр КФК-2-УХЛ 4,2) методов. Для исследования у крыс брали кровь, сердце, ткани головного мозга. Определяли концентрацию АД, НА, ДА (Осинская, 1977), 11-ОКС (Панков и др., 1973; Колб, Камышников, 1982), ГТ и СТ (Мещерякова, Герасимова, 1974; Лабораторные методы исследования в клинике, 1987). Вычисляли коэффициенты АД/НА («адреналиновый» коэффициент); ДА/(АД+НА) («дофаминовый» коэффициент); ГТ/СТ. В плазме крови определяли концентрацию ОХС, ХС ЛПВП и ЛПНП, ТГ и ЛПОНП. Рассчитывали коэффициент атерогенности плазмы (Окороков, 2002; Камышников, 2003). Изучались показатели гемостаза, характеризующие активность свертывающей (протромбиновый индекс, содержание фибриногена, растворимых фибрин-мономерных комплексов), противосвертывающей (активность антитромбина III), фибринолитической (фибринолитическая активность) систем. Исследовали спонтанную и индуцированную коллагеном и АДФ агрегацию тромбоцитов, фактор Виллебранда, характеризующий адгезию тромбоцитов (Балуда, Баркаган, 1980; Ройтман, Смоляницкий, 2000; Corriveau, Fritsma, 2001).
Была произведена статистическая обработка результатов. С этой целью использовались статистические программы: «StatPlus 2007», «Statistica 6.0». В случае нормального распределения для оценки достоверности отличий применяли t критерий Стьюдента, для множественных сравнений – критерий Стьюдента с поправкой Бонферрони. Если распределение отличалось от нормального – непараметрический критерий Уилкоксона. Различия считали достоверными при p<0.05. Данные представлены в виде M±m (Гланц, 1999).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Экспериментальная хроническая сердечная недостаточность как модель дезадаптации
При разработке модели ХСН за основу взяли модель ХСН, предложенной Н.Н.Пятницким и Ю.А.Блинковым (1970), для создания которой авторы использовали однократное введение в каждую плевральную полость силиконового масла в объеме 5 мл. В результате чего происходило сдавливание легочных сосудов и повышение давления в области легочной вены, что усиливало нагрузку на правое сердце. При этом также имело место тотальное давление жидкости на все отделы миокарда. Метод легко воспроизводим, не требует специального оборудования, не трудоёмок и разработан специально для мелких лабораторных животных (крысы).
Сущность нашей модификации заключалась в дробном введении силиконового масла в каждую плевральную полость, за счет чего патология развивалась постепенно: первое введение масла – по 1,5 мл/100 г массы крысы в каждую плевральную полость, второе через месяц в дозе по 1 мл/100 г массы, третье введение еще через 2 месяца по 1 мл/100 г, т.о. в зависимости от срока получали ХСН различной степени тяжести (Федоров и др., 2006; Румянцева и др., 2009). Применение -адреноблокаторов начиналось через сутки после второй инъекции масла.
В физиологических исследованиях было установлено, что при ХСН-2 САД и ЧСС снижались на 16.2%, СОК на 18.1%, МОК на 32.4%, а ОПСС повышалось на 22.9% относительно интактной группы (p<0.05). У крыс с ХСН-3 происходило дальнейшее усугубление нарушений гемодинамики. По сравнению с интактными САД снижалось на 18.5%, ЧСС на 29.1%, СОК на 22.5%, МОК на 44.8%, а ОППС возрастало на 49.0% (p<0.05). ЧСС при ХСН-3 была достоверно меньше, чем при ХСН-2 на 16.2%, а ОПСС соответственно выше на 20.1%.
При морфологическом исследовании выявлялись характерные для ХСН изменения сердца. Сердце было увеличено в размерах, шаровидной формы. Отражением гипертрофии миокарда было возрастание среднего весового коэффициента сердца на 11.6% при ХСН-1, 13.8% при ХСН-2 и 12.7% при ХСН-3 (p<0.05). В сердце у интактных крыс достоверное отличие имела толщина стенки: в правом желудочке она была в 1.2 раза больше по сравнению с левым (p<0.05). При ХСН появились изменения. Так, в правом желудочке толщина задней стенки увеличилась в среднем в 1.5 раза (p>0.05), толщина кардиомиоцитов также в 1.5 раза (p<0.001), а минимальный диаметр их ядер в 1.3 раза (p<0.05). В левом желудочке также произошло увеличение толщины этих структур в среднем в 1.1 раза (p>0.05). Причем, как и у здоровых животных, у крыс с ХСН наблюдались достоверно большая толщина кардиомиоцитов и минимальный диаметр ядра кардиомиоцита в правом желудочке (соответственно в 1.7 и 1.1 раза) по сравнению с левым. Было также установлено, что в части кардиомиоцитов исчезла поперечная исчерченность мышечных волокон.
В печени у крыс с ХСН также были обнаружены патологические изменения, исходя из которых, можно заключить, что в гепатоцитах центральных зон долек преобладали явления набухания и отека. В некоторых дольках выявлены кровоизлияния. Центральные вены и прилежащие к ним отделы синусоидов были расширены. В части долек в центральных отделах не прослеживались печеночные балки, часть клеток имела нечеткие контуры. Отмечалась гибель гепатоцитов.
В легких у животных с ХСН наблюдались изменения: зоны ателектазов, очаги кровоизлияний, множественные диапедезные кровоизлияния, выраженное утолщение межальвеолярных перегородок.
Опираясь на результаты измерения гемодинамических параметров и данные морфологического исследования органов крыс, можно сделать вывод, что представленная модель соответствует тотальной ХСН и сопоставима с существующими моделями, предложенными рядом авторов (Doggrell, Brown, 1998; Einstein, Abdul-Hussein, 1995). Дробное дозированное введение силиконового масла позволяет создавать динамическую модель ХСН, и таким образом, моделировать различную степень ее тяжести. В дальнейшем все эксперименты были проведены на модели ХСН-2.
В исследованиях установлено, что -адреноблокаторы способны снизить степень дезадаптации системы кровообращения при ХСН (контроль), увеличить выживаемость и продолжительность жизни животных. Шестимесячную выживаемость достоверно повышали в 1.7-2.3 раза все исследуемые соединения, кроме пиндолола (рис.1). Более того, в отличие от контроля, адреноблокаторы способствовали у 15-40% животных переживанию годового рубежа эксперимента (за исключением пиндолола). Длительность жизни подопытных животных достоверно удлиняли все исследуемые адреноблокаторы на 40.0-94.0%.
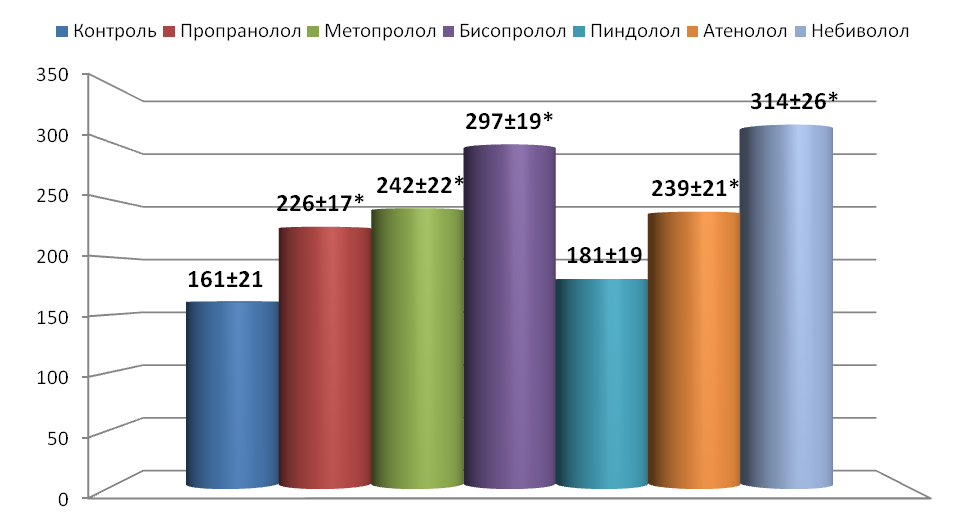
Рис 1. Продолжительность жизни крыс с экспериментальной ХСН при длительном применении -адреноблокаторов (дни).
*- p<0.05 по сравнению с группой контроля.
Вклад -адренореактивных структур в регуляцию
сердечной деятельности
Несомненный интерес представляет выяснение механизмов функционирования системы кровообращения у крыс с помощью метода определения ВСР в состоянии покоя (под наркозом), при кратковременном иммобилизационном стрессе и при дезадаптации – экспериментальной ХСН, а также при воздействии в этих состояниях изучаемых препаратов.
Проведенное исследование позволило определить особенности механизмов регуляции деятельности ССС у животных при указанных выше состояниях организма и выявить вклад -адренореактивных структур в формировании тех или иных механизмов регуляции за счет уменьшения их активности с помощью различных -адреноблокаторов и стимулирования адреномиметиком добутамином.
Временной анализ. ЧСС у крыс, находящихся в состоянии наркоза, составляла в среднем 373±8.4 /мин, у бодрствующих животных при кратковременном иммобилизационном стрессе 493±4.3 /мин и, наконец, у бодрствующих иммобилизированных крыс с экспериментальной ХСН 456±4.4 /мин, т.е. у иммобилизированных интактных крыс она была достоверно в 1.3 раза больше по сравнению с наркотизированными и в 1.1 раза больше по сравнению с дезадаптированными животными.
Блокада -адренорецепторов всеми исследуемыми препаратами показала, что их введение приводит к достоверному снижению ЧСС во всех группах животных, что согласуется с данными других исследователей (Perlini et al., 1995; Souza Neto et al., 2001; Barbier et al., 2006; Waki, Katahira, 2006). Воздействие -адреноблокаторов на наркотизированных животных привело к снижению ЧСС (рис. 2), максимальное влияние оказали неселективный пропранолол и высокоселективные бисопролол и метопролол (снижение ЧСС на 26.0 %, 30.8 % и 37.3 % соответственно), а минимальное низкоселективный атенолол и неселективный пиндолол с симпатомиметической активностью (снижение ЧСС на 11.5 % и 13.7 % соответственно).
У бодрствующих иммобилизированных животных наблюдалась почти такая же картина (рис. 2). К наибольшему снижению ЧСС приводило однократное воздействие пропранолола (13.0 %), бисопролола (17.4 %), метопролола (26.0 %) и небиволола (15.1 %), а к наименьшему – пиндолола (5.1 %) и атенолола (8.1 %). Т.о. степень воздействия на ЧСС у стрессированных крыс была в целом меньше, чем у наркотизированных.
У крыс с экспериментальной ХСН происходило снижение ЧСС, что согласуется с данными других авторов (Radaelli, Cazzaniga, 2006; Cilliam et al., 2007). Длительное применение -адреноблокаторов привело к еще большему достоверному уменьшению ЧСС по сравнению с контрольными (ХСН) животными только при воздействии пропранолола, пиндолола, атенолола и небиволола (на 6.8 %, 14.9 %, 17.5 % и 4.6 % соответственно) (рис. 2). Максимальное снижение ЧСС по сравнению с интактными крысами было при применении пиндолола (21.3 %) и атенолола (23.7 %), а минимальное – бисопролола (7.7 %) и метопролола (5.5 %).

Рис. 2. Влияние -адреноблокаторов на частоту сердечных сокращений (ЧСС) по сравнению с исходным состоянием.
Достоверные отличия: * - по сравнению с интактными, + - по сравнению с контролем, ^ - пропранолол с остальными адреноблокаторами, # - пиндолол с остальными адреноблокаторами, > - атенолол с остальными адреноблокаторами, < - бисопролол с остальными адреноблокаторами, / - метопролол с остальными адреноблокаторами.
Стандартное отклонение кардиоинтервалов (SDNN) у наркотизированных крыс в среднем было равно 2.61±0.226 мс, у интактных стрессированных животных 1.55±0.067 мс, а у крыс с моделированной ХСН 2.02±0.147 мс. Таким образом, SDNN у наркотизированных животных и животных с ХСН было больше соответственно в 1.7 и 1.3 раза (p<0.05), чем у интактных стрессированных крыс, что говорит о преобладании у последних тонуса симпатического отдела АНС (Inagaki et al., 2004). Блокада -адренореактивных структур у интактных наркотизированных, иммобилизированных крыс, а также крыс с ХСН способствовала повышению SDNN. Но у животных под наркозом повышение SDNN при воздействии -адреноблокаторов в 1.3 раза по сравнению с интактной группой было недостоверным.
Напротив, у стрессированных интактных крыс и крыс с ХСН показатель SDNN повышался достоверно при действии всех -адреноблокаторов независимо от длительности их применения. Причем при однократном воздействии на организм интактных иммобилизированных крыс больше остальных увеличивало этот параметр введение бисопролола и метопролола (в среднем в 3.5 раза), затем пропранолола и атенолола (в среднем в 2.2 раза) и, наконец, пиндолола и небиволола (в среднем в 1.7 раза).
У животных с моделированной ХСН, длительно принимавших адреноблокаторы показатель, SDNN был достоверно выше под воздействием всех препаратов, кроме метопролола. Имело место повышение этого показателя в 1.9 раза по сравнению с интактными и в 1.5 раза по сравнению с контрольными животными. Причем картина воздействия изученных адреноблокаторов у дезадаптированных крыс отличалась от таковой у интактных стрессированных. В последнем случае сильнее действовали пропранолол, пиндолол и атенолол, чем бисопролол, метопролол и небиволол.
Геометрический анализ (вариационная пульсометрия). Вариационный размах у наркотизированных крыс составлял 13.6±0.86 мс, у крыс в состоянии иммобилизации 9.2±0.39 мс, а при ХСН 13.1±0.96 мс. У стрессированных животных он был в 1.5 раза меньше, чем у наркотизированных крыс и в 1.4 раза – чем у крыс с ХСН (p<0.001), что указывает на преобладание у них тонуса симпатического отдела АНС.
У животных в состоянии наркоза показатель MxDMn по сравнению с исходным значением достоверно увеличился только при воздействии атенолола (в 1.1 раза), бисопролола (в 1.7 раза), метопролола (в 1.5 раза) и небиволола (в 1.4 раза). Значимых различий между воздействием изучаемых веществ не было выявлено (рис. 3).
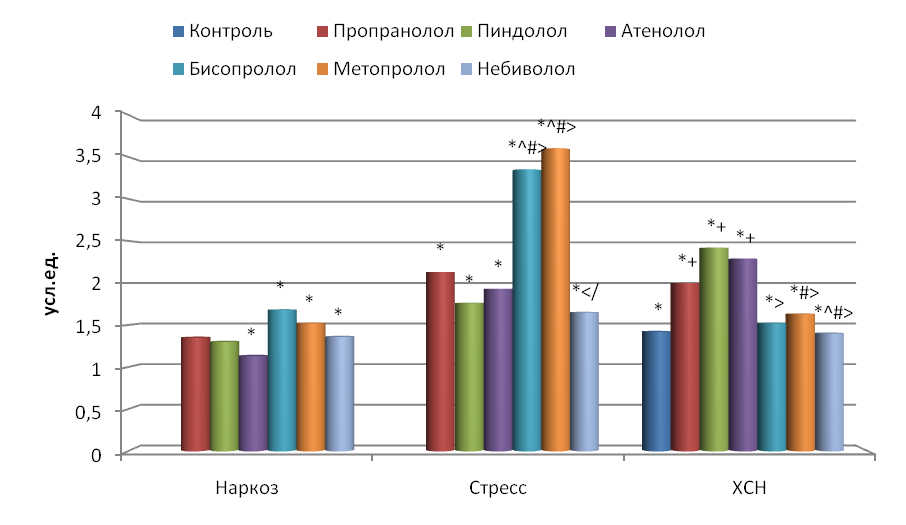
Рис. 3. Влияние -адреноблокаторов на изменение вариационного размаха (MxDMn) по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.
У стрессированных крыс, увеличение вариационного размаха по сравнению с интактными животными обнаружено при использовании всех адреноблокаторов (p<0.05). Причем наибольшее повышение MxDMn наблюдалось при применении бисопролола и метопролола в среднем в 3.5 раза, а остальных – в среднем в 1.9 раза.
У животных с ХСН показатель MxDMn был в 1.2 раза больше, чем у наркотизированных крыс (p>0.05) и в 1.4 раза больше по сравнению с иммобилизированными крысами (p<0.001). Применение -адреноблокаторов сопровождалось увеличением вариационного размаха (в среднем в 1.9 раза) по сравнению с интактными животными (p<0.05), а по сравнению с контрольными – только при длительном воздействии пропранолола, пиндолола и атенолола (в среднем в 1.6 раза) (p<0.05).
У наркотизированных крыс стресс-индекс (SI) составил 11814±1219 усл. ед., у иммобилизированных – 25360±1819 усл. ед., у животных с ХСН – 16958±1649 усл. ед. Таким образом, у животных при иммобилизационном стрессе данный показатель был достоверно в 2.1 раза выше, чем у крыс в состоянии наркоза, и в 1.5 раза выше по сравнению с контрольными крысами с ХСН. Это подтверждает высокую чувствительность SI к повышению тонуса симпатического отдела АНС, преобладание которого имеет место при стрессе (Inagaki et al., 2004).
Блокада -адренореактивных структур у наркотизированных крыс отмечалась снижением стресс-индекса по сравнению с исходным состоянием, но достоверно только под влиянием пропранолола на 66.6 %, бисопролола на 62.5 %, метопролола на 72.8 % и небиволола на 65.7 % (рис. 4). При иммобилизационном стрессе все изученные -адреноблокаторы достоверно уменьшали SI: при использовании пропранолола на 70.0 %, пиндолола на 58.8 %, атенолола на 70.8 %, бисопролола на 89.4 %, метопролола на 93.1 % и небиволола на 63.4 %. При этом более выраженным действием обладали бисопролол и метопролол по сравнению с пропранололом, пиндололом, атенололом и небивололом (p<0.05). Снижение SI под действием -адреноблокаторов свидетельствует об увеличении адаптационных возможностей организма у наркотизированных и бодрствующих стрессированных крыс.
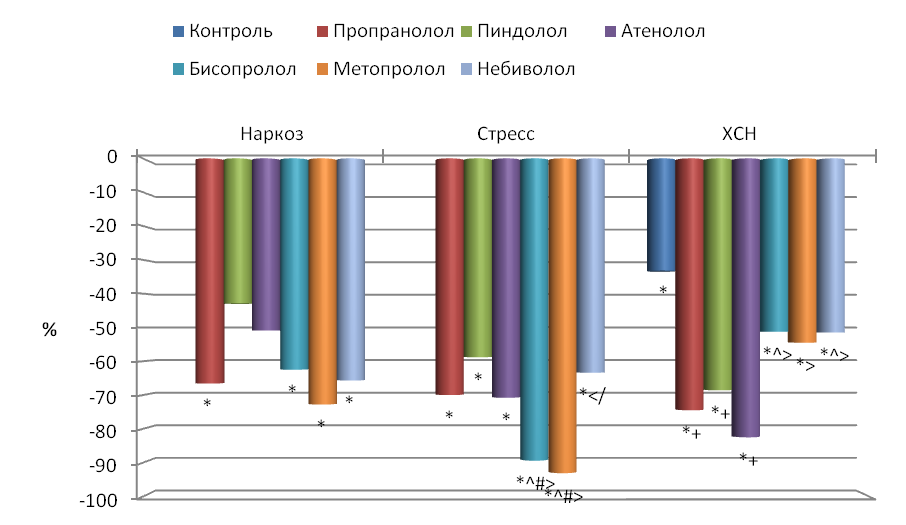
Рис. 4. Влияние -адреноблокаторов на изменение стресс-индекса (SI) по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.
ХСН у крыс также привела к уменьшению этого показателя на 33.2 % (p<0.01) по сравнению с интактными животными. Воздействие адреноблокаторов еще больше снизило SI по сравнению с иммобилизированными интактными крысами: при действии пропранолола, пиндолола и атенолола в среднем на 75.2 %; бисопролола, метопролола и небиволола – в среднем на 52.4 % (p<0.05), по сравнению с контрольными крысами различия были достоверны только при действии пропранолола, пиндолола и атенолола (в среднем снижение на 62.9 %).
Анализируя полученные результаты, можно заключить, что развитие ХСН у крыс сопровождалось увеличением ВСР, а, следовательно, тонуса парасимпатического отдела АНС, что согласуется с результатами ряда авторов (Malliani et al., 1994; Galinier et al., 1999; Flevari et al., 2006). Данные временного и геометрического анализов, характеризующие использование адреноблокаторов у наркотизированных крыс не противоречат результатом других исследователей (Алипов и др., 2005; Souza Neto et al., 2001; Beckers et al., 2006; Sun et al., 2006). Блокада -адренореактивных структур при иммобилизационном стрессе и экспериментальной ХСН вызывала однонаправленные изменения, выражавшиеся в снижении активности симпатического и повышении активности парасимпатического отдела АНС и увеличении общей вариабельности ритма сердца.
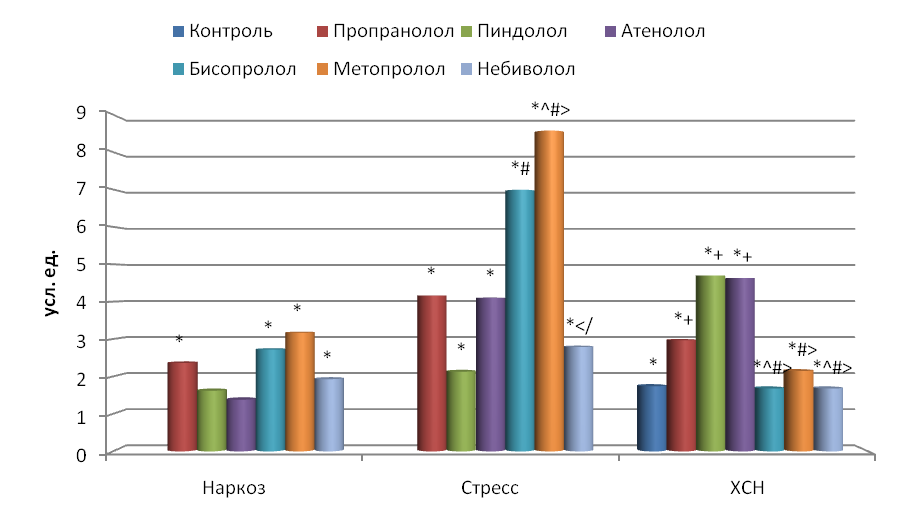
Рис. 5. Влияние -адреноблокаторов на изменение площади скаттерограммы (EllSq) по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.
Корреляционная ритмография. Площадь скаттерограммы (EllSq) у интактных наркотизированных животных составляла 118.3±15.31 мс2, у иммобилизированных крыс 56.0±3.99 мс2, а у контрольной группы (ХСН) 97.5±13.18 мс2. Причем у крыс в состоянии наркоза площадь скаттерограммы была в 2.1 раза больше, а с ХСН в 1.7 раза больше, чем у интактных стрессированных крыс (p<0.05). У наркотизированных животных площадь скаттерограммы возрастала на фоне введения пропранолола, бисопролола, метопролола и небиволола в среднем в 2.5 раза (p<0.05), а при введении пиндолола и атенолола увеличение EllSq было недостоверным (рис. 5).
При введении всех -адреноблокаторов иммобилизированным крысам произошло достоверное увеличение EllSq. Она возросла под воздействием бисопролола и метопролола (в среднем в 7.8 раза), затем пропранолола и атенолола (в среднем в 4.1 раза) и менее всего – пиндолола и небиволола (в среднем в 2.5 раза). Причем влияние бисопролола и метопролола на EllSq было достоверно сильнее, чем пиндолола и небиволола, а метопролола сильнее, чем пропранолола (p<0.05).
У животных с ХСН введение препаратов вызывало дальнейшее достоверное увеличение площади скаттерограммы по сравнению с интактными стрессированными крысами (рис. 5): пропранолола в 3.0 раза, пиндолола и атенолола в среднем в 4.7 раза, а бисопролола, метопролола и небиволола в среднем в 1.8 раза. По сравнению с контрольными крысами достоверно увеличивалась EllSq только при введении пропранолола (в 1.7 раза), пиндолола и атенолола (в среднем в 2.7 раза).
Спектральный анализ. Мощность низкочастотного диапазона LF у наркотизированных животных составляла 0.26±0.040 мс2, у интактных стрессированных – 0.27±0.036 мс2 и у контрольных с ХСН – 0.58±0.110 мс2, мощность высокочастотного диапазона HF - 0.37±0.056 мс2, 0.23±0.021 мс2 и 0.27±0.032 мс2 соответственно, а общая мощность спектра (ТР) – 0.63±0.084 мс2, 0.50±0.050 мс2 и 0.85±0.135 мс2 соответственно. При этом у крыс с ХСН мощности LF и ТР были выше, чем у крыс в состоянии наркоза и у интактных иммобилизированных животных (p<0.05).
Результаты спектрального анализа указывают на то (рис. 6-8), что у наркотизированных крыс при однократном введении исследуемых адреноблокаторов значимо увеличивали мощность LF только пиндолол и бисопролол (соответственно в 3.3 и 3.4 раза), мощность HF – пропранолол, бисопролол и метопролол (соответственно в 4.2, 3.8 и 5.9 раза), а общую мощность ТР – пропранолол, пиндолол, бисопролол и метопролол (соответственно в 2.8, 2.2, 3.6 и 4.2 раза, p<0.05). Индекс вагосимпатического взаимодействия (LF/HF) уменьшился при действии пропранолола (в 5.3 раза, p<0.001), метопролола и атенолола (в среднем в 3.2 раза, p<0.05) бисопролола и небиволола (в среднем в 1.6 раза, p>0.05), а при действии пиндолола произошло незначительное увеличение этого индекса в 1.4 раза (p>0.05).
Полученные результаты полностью согласуются с данными временного и геометрического анализов, свидетельствуя об увеличении общей ВСР и тонуса парасимпатического отдела АНС, а также о снижении симпатических влияний на сердце у крыс в состоянии наркоза (Safa-Tisseront et al., 1989; Souza Neto et al., 2001; Waki et al., 2006).

Рис. 6. Влияние -адреноблокаторов на изменение мощности (LF) по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.

Рис. 7. Влияние -адреноблокаторов на изменение мощности (HF) спектра по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.
Введение всех изучаемых блокаторов -адренорецепторов (рис. 6-7). при иммобилизационном стрессе у интактных крыс приводило к достоверному увеличению всех мощностей (LF, HF и ТР) спектра. Так, мощность LF больше возрастала при воздействии бисопролола и метопролола (в 14.9 и 26.0 раз соответственно), тогда как другие -адреноблокаторы увеличивали ее в среднем всего в 4.2 раза. Мощность HF возрастала при действии пиндолола, атенолола, бисопролола и небиволола в среднем в 2.5 раза, а метопролола – в 4.0 раза. Причем воздействие метопролола было значительно сильнее по сравнению с пропранололом, пиндололом и атенололом (p<0.05).
В связи с тем, что мощность LF возросла больше, чем HF, увеличился и индекс LF/HF при действии бисопролола и метопролола (в среднем в 5.2 раза, p<0.001), пропранолола и атенолола (в среднем в 1.9 раза, p<0.05), пиндолола и небиволола (в среднем в 1.3 раза, p>0.05). Причем бисопролол и метопролол увеличивали этот показатель в большей степени, чем пропранолол, пиндолол, атенолол и небиволол (p<0.05).
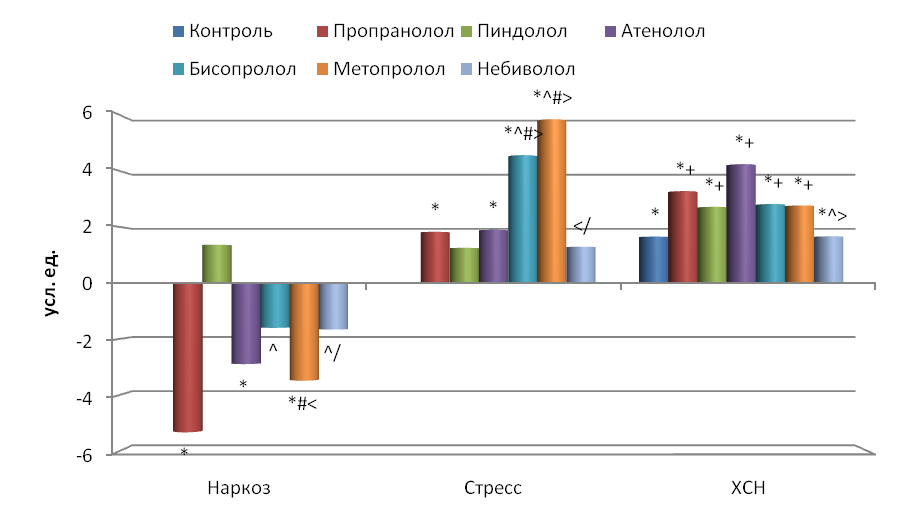
Рис. 8. Влияние -адреноблокаторов на изменение индекса вагосимпатического взаимодействия (LF/HF) по сравнению с исходным состоянием.
Остальные обозначения те же, что и на рис. 2.
У крыс с ХСН повышалась мощность LF в 2.2 раза (p<0.05), незначимо HF в 1.2 раза (p>0.05) и достоверно общая мощность спектра в 1.7 раза (рис. 6-8). Мощность LF возрастала у животных с ХСН при длительном применении всех -адреноблокаторов по сравнению с интактными крысами: более всего при действии пропранолола, пиндолола, атенолола в среднем в 7.4 раза (p<0.001), бисопролола и метопролола в среднем в 3.2 раза (p<0.05), и менее всего небиволола - в 1.6 раза (p>0.05). А по сравнению с контрольными животными достоверное увеличение показателя LF было только при действии пропранолола, пиндолола и атенолола – в среднем в 3.5 раза. Сильнее воздействовал на LF атенолол по сравнению с метопрололом и небивололом, а также пиндолол по сравнению с небивололом (p<0.05).
Изменение же мощности HF у крыс с ХСН при использовании адреноблокаторов было разнонаправлено и в большинстве случаев недостоверно (рис. 7). Только пиндолол и атенолол значительно повышали показатель HF – в среднем в 2.3 раза (p<0.05) по сравнению с интактными животными, в среднем в 1.9 раза по сравнению с контрольными (p<0.05). Причем пропранолол и пиндолол сильнее влияли на HF, чем небиволол, а атенолол сильнее, чем бисопролол и небиволол.
Индекс вагосимпатического взаимодействия достоверно увеличился как у контрольных животных по сравнению с интактными (в 1.7 раза), так и при воздействии блокаторов -адренорецепторов на крыс с ХСН по сравнению с интактными: пропранолола и атенолола в среднем в 3.8 раза, а остальных – в среднем в 2.8 раза; по сравнению с контрольными - пропранолола и атенолола в среднем в 2.3 раза, пиндолола, бисопролола и метопролола в среднем в 1.7 раза. Небиволол практически не повышал LF/HF (рис. 8). Причем пропранолол и атенолол влияли на этот показатель достоверно сильнее, чем небиволол (p<0.05).
В качестве вещества, возбуждающего -адренореактивные структуры взяли 1-адреномиметик – добутамин (Aronson, Burger, 2004; Chenzbraun et al., 2003; Barletta, 2003). У наркотизированных крыс он вызвал разнонаправленные изменения в показателях ВСР, но все они были недостоверными.

Рис. 9. Динамика изменений основных показателей ВСР у бодрствующих стрессированных крыс при воздействии добутамина по отношению к исходному уровню.
* - p<0.05 по сравнению с исходным уровнем.
У интактных иммобилизированных животных эти изменения также были разнонаправленными. Но удалось выявить достоверные изменения в некоторых показателях ВСР (рис. 9): в MxDMn и LF/HF (уменьшение), AMo, SI и EllAs (увеличение). Причем и в этом случае, как и при воздействии адреноблокаторов, данные временного и геометрического анализов не совпадали со спектральным. По изменению показателей первых двух можно судить о некотором повышении тонуса симпатического отдела АНС, а спектральный анализ показывал увеличение активности ее парасимпатического отдела.
Впервые обнаруженное нами при оценке спектрального анализа большее увеличение мощности низкочастотного диапазона LF наряду с увеличением высокочастотного диапазона HF при действии адреноблокаторов и, наоборот, большее уменьшение мощности LF по сравнению с HF при действии -адреномиметика добутамина на иммобилизированных животных, указывает на то, что в показателе мощности LF отражается активность не только симпатического отдела АНС, но и включенность других нервно-гуморальных звеньев регуляции ССС (возможно гипоталамического и коркового уровней регуляции, гуморальные механизмы).
Проанализировав полученные результаты, мы пришли к целесообразности введения показателя суммарной степени воздействия (ССВ) того или иного вещества на сердечный ритм. ССВ складывается из суммы показателей RRNN, SDNN, CV, RMSSD, MxDMn, АМо, SI, EllSq, EllAs, LF и HF, выраженных в относительных единицах к одноименным показателям в исходном состоянии (принятых за единицу), деленной на число используемых для определения ССВ показателей:
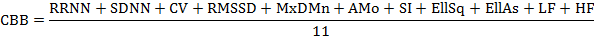
Такие показатели, как Mn и Мх, ЧСС и Мо, LF% и HF% исключили из определения ССВ в связи с тем, что они отражают разнонаправленные одинаковые изменения, ТР – сумму LF и HF и LF/HF (уже является коэффициентом).
По нашему мнению, если значение показателя меньше единицы, это соответствует активации симпатического отдела АНС и катехоламинергической системы, а если больше единицы – активации парасимпатического отдела.
Таким образом (рис. 10), при длительном применении адреноблокаторов влияние на сердечный ритм отличается от влияния при однократном их воздействии на организм как стрессированных, так и наркотизированных животных. Если при однократном воздействии сильнее влияли на ВСР высокоселективные 1-адреноблокаторы, такие как бисопролол и метопролол, то при их длительном использовании на организм дезадаптированных крыс эти вещества, наоборот, менее всего влияли на сердечный ритм. Тогда как неселективный пиндолол с ВСМА и среднеселективный водорастворимый атенолол вызывали наибольшие изменения в ВСР.
Применение -адреноблокаторов привело к изменению СОК и МОК. СОК у интактных крыс составил 0.52±0.042 мл, а МОК - 250±16.9 мл/мин. У животных с ХСН эти значения были равными 0.31±0.031 мл/мин и 141±13.2 мл/мин соответственно. Т.о., при развившейся дезадаптации произошло уменьшение СОК и МОК соответственно на 40.4 % и 43.4 % (p<0.001). У интактных стрессированных крыс -адреномиметик добутамин привел к увеличению СОК на 23.1 % (p<0.05), что согласуется с данными, полученными на человеке (Barletta, 2003).
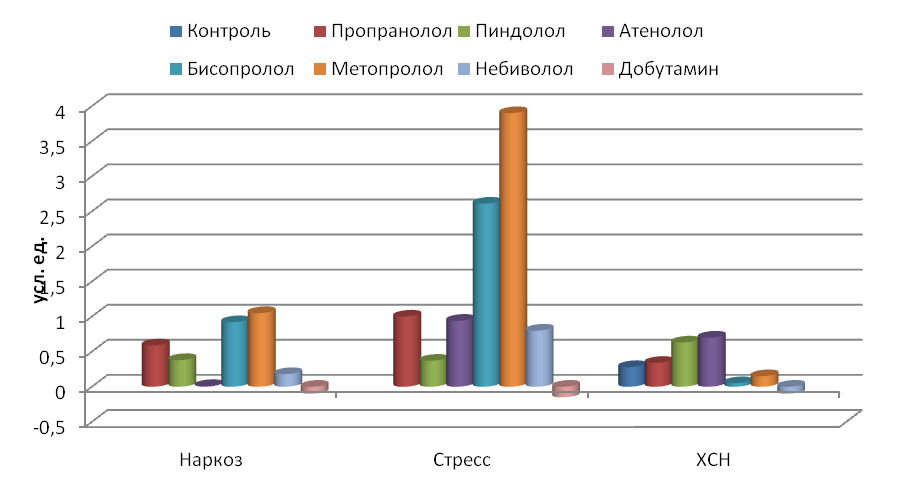
Рис. 10. Изменения суммарной степени воздействия (ССВ) препаратов на сердечный ритм у животных по отношению к исходному состоянию (ССВ=1.0).
-адреноблокаторы мало воздействовали на СОК и МОК (p>0.05) интактных крыс. При длительном применении блокаторов адренорецепторов у животных при дезадаптации (ХСН) неселективные пропранолол и пиндолол с ВСМА и низкоселективный атенолол привели к незначительному повышению СОК и МОК (пиндолол МОК даже несколько уменьшил) по сравнению с контрольными крысами с ХСН. Но все равно эти параметры остались существенно ниже, чем у интактных животных (p<0.05). Напротив, высокоселективные бисопролол, метопролол и небиволол с вазодилатирующей активностью существенно повысили СОК и МОК по сравнению с контрольными животными (СОК в среднем на 41.7 %, МОК – на 41.5 %, p<0.05), и эти показатели практически перестали отличаться от таковых у интактных крыс. Таким образом, длительное воздействие -адреноблокаторов на организм дезадаптированных крыс было более выраженным, чем на организм крыс при однократном их воздействии.
Влияние длительного снижения активности -адренореактивных структур на гормональный и липидный обмен, и гемостаз
в норме и при дезадаптации
Изучение показателей гормонально-медиаторного баланса у интактных животных показало, что -адреноблокаторы вне зависимости от степени селективности и липофильности вызывали достоверное снижение уровня АД и НА в крови интактных животных. При этом пропранолол, пиндолол и метопролол влияли на липидный спектр плазмы крови интактных крыс: они способствовали повышению в крови животных содержания транспортных форм жиров (триглицериды и ЛПОНП), причем неселективные адреноблокаторы повышали степень атерогенности плазмы на 11.5-26.4%, а высокоселективные метопролол, бисопролол и небиволол, наоборот, ее снижали в среднем на 29.1%.
Хроническая сердечная недостаточность, несмотря на ее этиологию, практически всегда сопровождается дисбалансом активности различных звеньев катехоламинергической системы (Чазов, 1997). Это наблюдалось и в нашем исследовании. У крыс с ХСН имело место нарушение обмена катехоламинов во всех изучаемых тканях, особенно выраженное в крови и миокарде. Так, в крови отмечалось повышение концентрации АД (на 48.9%) и НА (на 78.2%) на фоне снижения содержания ДА (на 32.8%) и коэффициента ДА/(АД+НА) в 2.5 раза (рис. 11). Активация симпатоадреналовой системы является одним из основных патогенетических звеньев в прогрессировании ХСН. Повышение содержания в крови вазоконстрикторных катехоламинов (АД и НА) при одновременном снижении вазодилатирующего ДА свидетельствует о выраженном нарушении периферической гемодинамики, микроциркуляции и трофики тканей, а также повышении пост- и преднагрузки на миокард (Беленков, 2001; Ольбинская, Игнатенко, 2000). Известно, что увеличение концентрации адреналина и норадреналина в плазме крови положительно коррелируют с выраженностью диастолической дисфункции сердца, а концентрации дофамина - отрицательно (Карсанов и др., 2002).


Рис. 11. Изменения в системе норадреналин / дофамин при хронической сердечной недостаточности
* - p<0.05 – по сравнению с интактной группой.
При развитии ХСН в сердце имели место снижение концентрации норадреналина и дофамина на 31.0% и 29.3% соответственно и одновременно нарастание содержания адреналина на 85.1% (рис. 11). Это привело к увеличению значения «адреналинового» коэффициента в 2.7 раза и уменьшению в 2 раза коэффициента ДА/(АД+НА), что свидетельствовало о снижении активности норадреналинергической и дофаминергической медиаторных систем. Эксперимент показал, что у животных на фоне ХСН происходило истощение запасов НА и ДА на фоне повышения количества АД. Между тем, основная роль в функционировании адренергических структур сердца принадлежит именно НА и ДА (Чазов, 1999).
Известно, что концентрация норадреналина в миокарде положительно коррелирует с величиной фракции выброса (Мазур, 2002), поэтому уменьшение содержания норадреналина и дофамина при ХСН является важным моментом в патогенезе снижения инотропной функции сердца. Это обычно связывают, с одной стороны, с истощением запасов КА под влиянием возросшей потребности в них сердца (Кушаковский, 1998), а с другой, - с блокадой синтеза КА на этапе перехода тирозина в ДОФА вследствие нарастания циркуляторного и тканевого ацидоза и угнетения активности тирозингидроксилазы. Повышение содержания АД может быть связано с возросшей способностью декомпенсированного сердца захватывать экстракардиальный АД из крови и с усилением его обратного захвата из синаптической щели (Карсанов и др., 2002), также со снижением активности МАО А в миокарде.
В КБП мозга крыс с ХСН отмечалось достоверное повышение уровня ДА на 26.3%.
Повышение в крови у дезадаптированных животных содержания глюкокортикоидов (11-ОКС) в 3 раза в определенной степени можно считать компенсаторной реакцией, т.к. они увеличивают синтез миокардиальных белков и концентрацию кальция в кардиомиоцитах, что способствует повышению насосной функции сердца. Это особенно важно в условиях дефицита в миокарде норадреналина и дофамина. С другой стороны, естественные глюкокортикоиды обладают минералокортикоидной активностью и повышают содержание натрия и объем циркулирующей крови, стимулируют синтез АПФ в сосудистой стенке и образование АТ-II, потенцируют действие катехоламинов на сосудистую стенку.


Рис. 12. Изменения в системе гистамин / серотонин в тканях при хронической сердечной недостаточности
* - p<0.05 – по сравнению с интактной группой.
При ХСН уровень гистамина повышался во всех исследуемых тканях (кровь, сердце и мозг) на 37.2-39.2% (рис. 12). Если говорить о крови и миокарде, то повышение в них концентрации гистамина можно считать адаптивным явлением. Стимулируя Н1-рецепторы эндотелия, ГТ через выделение эндотелий-релаксирующего фактора способствует снижению периферического сопротивления сосудистой стенки и постнагрузки на миокард и уменьшает артериальное давление. Увеличение концентрации ГТ в сердце оказывает положительное инотропное и дромотропное действие. ГТ повышает силу сердечных сокращений через Н2-рецепторы. Однако высокие концентрации ГТ в крови приводят к нарушению проницаемости сосудистой стенки и отеку тканей, повышению вязкости и коагуляционного потенциала плазмы. (Сергеев и др., 1999).
Уровень серотонина у животных с ХСН повышался в крови и сердце на 20.7 и 19.4 % соответственно и снижался в мозге на 18.1% (рис.12). Серотонин, с одной стороны, оказывает прямое положительное хронотропное и инотропное действие, тормозя обратный захват НА (Vasan et al., 1999; Whorlow, Krum, 2000), а с другой - оказывает вазоспастическое действие на артерии, поэтому повышает постнагрузку на сердце. Он вызывает также и веноконстрикцию, приводит к усилению венозного возврата и повышению преднагрузки. (Сергеев и др., 1999). СТ стимулирует образование альдостерона и повышает ОПСС, стимулирует секрецию АКТГ и кортикостерона, является одним из звеньев патогенеза эндотелиальной дисфункции (Сергеев, Валеева, 1999). Ускоряя переход фибриногена в фибрин, СТ способствует тромбообразованию (Доказательная медицина. Ежегодный справочник, 2002). Таким образом, повышение активности серотонинергической системы можно считать патогенетически неблагоприятным фактором в развитии и прогрессировании ХСН.
Длительное использование -адреноблокаторов при ХСН препятствовало глубокому изменению исследуемых биохимических показателей. В большей степени препараты способствовали нормализации показателей симпатоадреналовой и кортико-адреналовой систем.
В крови и миокарде животных с ХСН при действии адреноблокаторов по сравнению с контролем достоверно снижалось содержание АД на 28.3-34.6% и 32.8-50.1% соответственно (рис. 13, 14). Концентрация НА снижалась в крови и повышалась в сердце на 15.6-80.3%. Уровень ДА под воздействием -адреноблокаторов повышался и в крови на 21.3-54.9%, и в миокарде на 6.1-57.6%. Исключение составил лишь пиндолол: на фоне его введения содержание гормонов в крови достоверно не отличалось от такового у контрольной группы животных с ХСН.
Положительные сдвиги в обмене КА, наблюдаемые при введении препаратов дезадаптированным животным, способствовали нормализации показателей как «дофаминового» (кроме пиндолола), так и «адреналинового» коэффициентов.

Рис. 13. Динамика уровня моноаминов в плазме крови у крыс с ХСН при длительном воздействии -адреноблокаторов (мкг/мл)
* - p<0.05 – по сравнению с интактной группой,
+- p<0.05 – по сравнению с контрольной группой с ХСН.
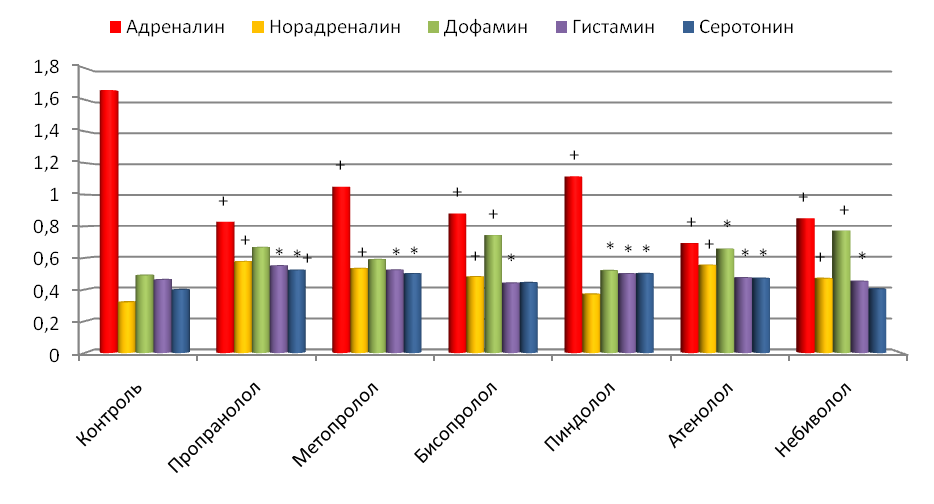
Рис. 14. Динамика уровня моноаминов в миокарде у крыс с ХСН при длительном воздействии -адреноблокаторов (мкг/мг)
* - p<0.05 – по сравнению с интактной группой,
+ - p<0.05 – по сравнению с контрольной группой с ХСН.
Учитывая важную роль симпатоадреналовой системы в патогенезе ХСН, можно предположить, что именно способность -адреноблокаторов к нормализации ее функциональной активности в условиях ХСН во многом определяет их адаптационные возможности. Т.о., при ХСН адреноблокаторы различных классов действуют схоже: в крови они снижают количество вазоспазмирующих катехоламинов (АД и НА) и повышают концентрацию ДА, который через D1, D2рецепторы оказывает вазодилатирующее действие, приводит к снижению постнагрузки и облегчению работы сердца, а возбуждая D1-рецепторы сердца, приводит к положительному инотропному эффекту, не влияя на ЧСС и не повышая потребность сердца в кислороде (Сергеев и др., 1998, 1999; Fisher, Gottlieb, 1994).
Анализируя полученные данные, можно заключить, что нормализующая активность -адреноблокаторов в отношении обмена катехоламинов в условиях ХСН не зависит от их селективности по отношению к различным типам -адренорецепторов. Однако, на активность используемых веществ влияет наличие ВСМА. Так, пиндолол, единственный из исследуемых адреноблокаторов обладающий ВСМА, был и менее эффективным из них.
Все исследуемые -адреноблокаторы препятствовали нарастанию 11ОКС в крови дезадаптированных крыс (рис. 15). Однако анализ этого влияния показал, что глюкокортикоидную активность крови значимо нормализовали лишь липофильный кардиоселективный бисопролол и вазодилатирующий небиволол. Метопролол, и атенолол способствовали снижению концентрации 11-ОКС крови у дезадаптированных крыс на 31.8-43.2% (p<0.05), однако она оставалась достоверно повышенной по отношению к интактной группе. При применении пропранолола и пиндолола имела место лишь тенденция к уменьшению концентрации 11-ОКС у крыс с экспериментальной ХСН.

Рис. 15. Динамика уровня 11-оксикортикостероидов в плазме крови у крыс с ХСН при длительном воздействии -адреноблокаторов (мкг/мл)
* - p<0.05 – по сравнению с интактной группой,
+- p<0.05 – по сравнению с контрольной группой с ХСН.
«Надпочечниковый» коэффициент на фоне длительной дезадаптации миокарда достоверно возрастал почти в 2 раза. Нормализация его показателей происходила только при введении бисопролола и небиволола.
Таким образом, бисопролол и небиволол при ХСН более полноценно, чем пропранолол, пиндолол, атенолол и метопролол регулировали активность как симпатоадреналовой, так и кортико-адреналовой систем.
Под воздействием изучаемых препаратов уровень ГТ в крови и сердце в целом изменялся незначительно. Снижение содержания ГТ в головном мозге у дезадаптированных крыс происходило под действием только липофильных -адреноблокаторов: пропранолола на 21.2%, метопролола – на 28.9%, бисопролола – на 31.0% и небиволола – на 32.3%. Это позволяет предположить, что обмен гистамина в структурах головного мозга, возможно, контролируется при помощи 1-адренорецепторов.
Под влиянием всех исследуемых -адреноблокаторов у дезадаптированных животных происходило снижение СТ крови (достоверно в 1.5 раза только под действием атенолола). Поскольку СТ усиливает дисбаланс вазоконстрикторов / вазодилататоров в крови, тем самым способствуя прогрессированию эндотелиальной дисфункции, то уменьшение его содержания имеет важное физиологическое значение.
Концентрация СТ в миокарде или существенно не изменялась (бисопролол, небиволол, атенолол), или возрастала по отношению к контролю на 25.6-31.1% (пропранолол, метопролол, пиндолол), однако, достоверное снижение было только при действии пропранолола.
Введение -адреноблокаторов способствовало достоверному росту концентрации СТ в головном мозге по отношению к контролю: при использовании пропранолола - в 2.0 раза, метопролола и атенолола – 1.8 раза, бисопролола и небиволола – в 1.9 раза, пиндолола – 1.6 раза. Значение коэффициента ГТ/СТ достоверно снижалось не менее чем, в 1.9 раза во всех опытных группах.
Полученные экспериментальные данные указывают на то, что адреноблокаторы обладают способностью к регуляции обмена биогенных аминов в головном мозге. Результаты данной регуляции сходны как у интактных животных, так и у крыс с экспериментальной ХСН, но в последнем случае значительно более выражены. Суть изменений заключается в снижении содержания возбуждающих агентов (ДА, НА, ГТ) и повышении значимости тормозных (СТ). Это же относится и к коэффициентам ГТ/СТ, (НА+ДА)/СТ и (НА+ДА+ГТ)/СТ, показывающим соотношение в ЦНС активности возбуждающих и тормозных моноаминов (таблица 2).
В условиях дезадаптации в крови крыс происходило нарушение липидного обмена, сопровождавшееся повышением степени атерогенности плазмы за счет возрастания, главным образом, ХС ЛПНП при минимальных колебаниях ХС ЛПОНП и ЛПВП. Возрастал также уровень триглицеридов на 30.2%. Следовательно, нарушение липидного обмена при моделировании экспериментальной патологии системы кровообращения соответствовали IIа типу гиперлипидемии по классификации Fredrickson (Раков, 2005).
Таблица 2
Центральное действие -адреноблокаторов
| Показатели в мозге | |||||||
| Группа | НА | ДА | ГТ | СТ | ГТ/СТ | НА+ДА/СТ | КА+ГТ/СТ |
| Интактные | 0.362 | 0.504 | 0.434 | 0.459 | 0.94 | 1.89 | 2.83 |
| Контроль | 0.431 | 0.636* | 0.604* | 0.311* | 1.94* | 3.42* | 5.37* |
| Пропранолол | 0.414 | 0.626* | 0.475+ | 0.624*+ | 0.76+ | 1.67+ | 2.43+ |
| Пиндолол | 0.405 | 0.600 | 0.526 | 0.500 | 1.05+ | 2.00+ | 3.06+ |
| Атенолол | 0.435 | 0.606 | 0.582 * | 0.559 | 0.96+ | 1.86+ | 2.90+ |
| Бисопролол | 0.388 | 0.488 | 0.418+ | 0.598 | 0.70+ | 1.46+ | 2.16+ |
| Метопролол | 0.430 | 0.558 | 0.430+ | 0.558+ | 0.77+ | 1.77+ | 2.54+ |
| Небиволол | 0.380 | 0.492 | 0.409+ | 0.587+ | 0.69+ | 1.11+ | 2.19+ |
* - р<0.05 по сравнению с интактной группой;
+- р<0.05 по сравнению с контрольной группой c ХСН.

Рис. 16. Липидный спектр (мМоль/л) и коэффициент атерогенности (Ка) плазмы крови у крыс с ХСН при длительном воздействии адреноблокаторов
* - р<0.05 по сравнению с интактной группой;
+- р<0.05 по сравнению с контрольной группой c ХСН.
Введение исследуемых -адреноблокаторов при экспериментальной ХСН приводило к положительным сдвигам липидного обмена (рис. 16): они способствовали снижению у них общего холестерина на 10.1-25.5% (достоверно небиволол, бисопролол и метопролол) преимущественно за счет холестерина ЛПНП, содержание которого уменьшалось на 26.7-40.6% (достоверно при введении небиволола, бисопролола, метопролола и атенолола) и нормализации содержания ТГ. Коэффициент атерогенности плазмы уменьшался при введении всех исследуемых веществ, однако его нормализация происходила только при использовании небиволола, бисопролола, метопролола и атенолола. На фоне введения пропранолола он оставался достоверно более высоким (на 45.0%), чем у интактных крыс.
Т.о., -адреноблокаторы играют важную роль в регуляции метаболизма липидов. Исследование показало, что при экспериментальной ХСН наиболее активным нормализующим действием в отношении липидного обмена обладали кардиоселективные -адреноблокаторы (небиволол, бисопролол, метопролол и атенолол): только их введение приводило к одновременному снижению содержания общего ХС, ХС ЛПНП, ТГ и коэффициента атерогенности.
Формирование дезадаптации приводило у крыс к существенному дисбалансу между активностью свертывающей и противосвертывающей систем крови в пользу свертывающей на фоне снижения фибринолиза. Об этом свидетельствовало: во-первых, развитие дисфункции эндотелия и усиление адгезии тромбоцитов, и поэтому рост значения фактора Виллебранда в 1.4 раза; во-вторых, повышение уровня агрегации тромбоцитов: в 6.5 раз спонтанной, в 1.6 раза индуцированной коллагеном и в 4.8 раза индуцированной АДФ; в-третьих, увеличение в 1.5 раза значений протромбинового индекса и на 24.8% количества РФМК при одновременном снижении на 41.1% активности антитромбина-III и на 50.0% фибринолитической активности крови.
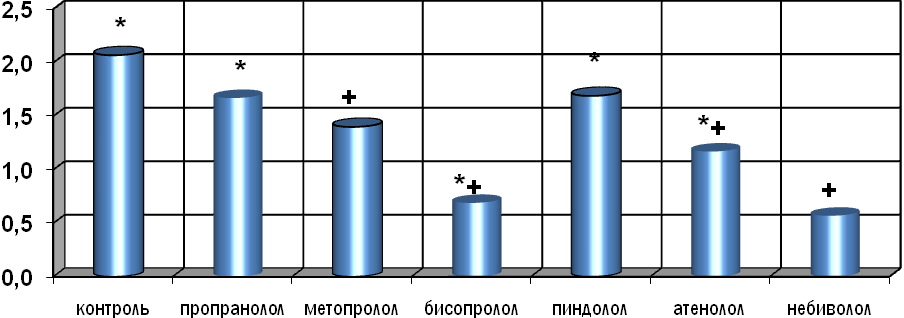
Рис. 17. Спонтанная агрегация тромбоцитов у крыс с ХСН при длительном воздействии -адреноблокаторов (% светопропускания)
* - р<0.05 по сравнению с интактной группой;
+- р<0.05 по сравнению с контрольной группой c ХСН.

Рис. 18. Фибринолитическая активность у крыс с ХСН при длительном воздействии -адреноблокаторов (%).
* - р<0.05 по сравнению с интактной группой;
+- р<0.05 по сравнению с контрольной группой c ХСН.
Использование -адреноблокаторов способствовало гармонизации показателей агрегации тромбоцитов, свертывающей, антисвертывающей и фибринолитической систем крови (рис. 17, 18). Все они на 13.3-29.3% уменьшали значения фактора Виллебранда, причем селективные достоверно. Также они снижали уровень спонтанной агрегации тромбоцитов в 1.2-3.0 раза (достоверно по отношению к контролю лишь бисопролол и атенолол, а к интактным крысам и контролю – только небиволол); в 1.2-1.7 раза индуцированную коллагеном агрегацию тромбоцитов (достоверно бисопролол, атенолол, небиволол) и в 2.8-5.0 раз индуцированную АДФ (достоверно все препараты, но полностью показатель нормализовали только бисопролол и небиволол); уменьшали (кроме пропранолола) ПТИ на 12.0-19.4%, снижали или нормализовали (только бисопролол и небиволол) уровень РФМК в крови дезадаптированных крыс, одновременно повышая активность антитромбина-III на 22.273.3% и фибринолитическую активность крови в 1.5-2.9 раза.
Положительное влияние блокаторов -адренорецепторов на активность свертывающей, антисвертывающей и фибринолитической систем крови на фоне экспериментальной ХСН у крыс, по-видимому, не связано с их биологическими эффектами, а зависит от их общего воздействия и, в частности, от влияния этих веществ на биохимические параметры крови, например, систему катехоламинов, серотонина и гистамина. В то же время, агрегацию и адгезию тромбоцитов в большей степени тормозили кардиоселективные адреноблокаторы.
В контрольной группе животных с ХСН на фоне выраженного нейрогормонального дисбаланса гибель составляла 30.0% и была достоверно выше, чем в интактной группе. Введение пиндолола не оказывало влияния на смертность крыс с экспериментальным поражением миокарда. При использовании прочих -адреноблокаторов смертность снизилась в 1.53.0 раза в сравнении с контрольной группой и перестала достоверно отличаться от интактного контроля.
Рассматривая влияние исследуемых -адреноблокаторов на функционирование систем кровообращения и крови в условиях дезадаптации, следует отметить, что наименьшая нормализующая активность наблюдалась у пиндолола, обладающего ВСМА, затем короткодействующего неселективного пропранолола. Анализ данных по сравнительному действию четырех селективных -адреноблокаторов показал, что наибольшим нормализующим действием обладал небиволол, ему незначительно уступал бисопролол, затем следовал метопролол и замыкал ряд атенолол.
Заключение
Проведенное комплексное исследование по изучению роли адренореактивных структур на функционирование систем кровообращения и крови у животных, находящихся в различных состояниях: наркоз, стресс, ХСН, показало, что их влияние зависит как от исходного состояния организма, так и от степени активности самих -адренорецепторов. Так, при однократном подавлении активности -адренореактивных структур у наркотизированных и бодрствующих стрессированных животных наибольшее влияние на ВСР оказали липофильные высокоселективные 1-адреноблокаторы метопролол и бисопролол и липофильный неселективный 1-, 2-адреноблокатор пропранолол, причем суммарная степень воздействия их на сердечный ритм стрессированных животных была гораздо выше, чем на ВСР наркотизированных крыс. Однократная активация -адренореактивных структур добутамином у наркотизированных крыс практически не повлияла на сердечный ритм, а их активация у стрессированных животных привела к небольшому увеличению тонуса симпатического отдела АНС, а также к увеличению СОК. Блокада же -адренореактивных структур у интактных крыс не вызвала сколь-нибудь значимых изменений в показателях СОК и МОК.
Разработанная нами модель дезадаптации – экспериментальная ХСН – по данным исследования ВСР вызывала у животных некоторое увеличение тонуса парасимпатического отдела АНС, суммарной степени воздействия на сердечный ритм и снижение СОК и МОК. Длительное применение блокаторов адренорецепторов на животных с ХСН привело к тому, что наибольшее воздействие на ВСР оказывали неселективный пиндолол с ВСМА и среднеселективный водорастворимый атенолол, они повышали тонус парасимпатического отдела АНС по сравнению с контрольными животными с ХСН. Напротив, высокоселективные метопролол, бисопролол и особенно небиволол с вазодилатирующей активностью практически привели к ВСР к таковому у интактных крыс и нормализовали СОК и МОК.
В исследованиях ВСР у стрессированных интактных животных и крыс с ХСН было обнаружено, что данные временного, геометрического анализов и корреляционной ритмографии не совпадают с данными спектрального анализа, как при активации, так и ингибировании -адренорецепторов. Наряду с изменением мощности высокочастотного диапазона HF еще в большей степени однонаправлено изменялась мощность низкочастотного диапазона LF. Следовательно, в мощности LF нашли свое отражение и другие нервные (возможно, активация корково-подкорковых структур) и/или гуморальные механизмы (по-видимому, серотонин-, гистамин-, и холинергические).
Длительное уменьшение активности -адренорецепторов у интактных животных привело к достоверному снижению в крови уровня АД и НА. Одновременно изменения были выявлены и в липидном спектре плазмы крови, выразившиеся в том, что блокада 1- и 2-адренорецепторов вызывала повышение степени атерогенности плазмы, а блокада только 1-адренорецепторов - наоборот, ее снижение.
Использование -адреноблокаторов на фоне длительной дезадаптации препятствовало глубокому изменению исследуемых показателей гормонально-медиаторного баланса, липидного обмена и гемостаза. Так, наиболее активно препараты способствовали нормализации показателей симпатоадреналовой и кортико-адреналовой систем. Нормализующая активность адреноблокаторов в отношении обмена катехоламинов в условиях длительной дезадаптации системы кровообращения не зависела от их селективности по отношению к различным типам -адренорецепторов. Однако, на активность препаратов влияла ВСМА. Так, пиндолол - единственный из исследуемых веществ обладающий ВСМА, был и менее эффективным из них.
Все исследуемые -адреноблокаторы препятствовали нарастанию 11ОКС в крови дезадаптированных крыс. Тем не менее, глюкокортикоидную активность крови значимо нормализовали лишь липофильный высокоселективный бисопролол и вазодилатирующий небиволол. Под воздействием изучаемых веществ уровень ГТ в крови и сердце в целом изменялся незначительно, но происходило снижение содержания СТ крови в среднем в 1.5 раза.
Полученные данные указывают на то, что -адреноблокаторы обладают способностью к регуляции обмена биогенных аминов в головном мозге. Суть изменений заключается в снижении содержания возбуждающих агентов (ДА, НА, ГТ) и повышении значимости тормозных (СТ).
Длительная дезадаптация системы кровообращения приводила у крыс к нарушению липидного обмена, сопровождалась повышением степени атерогенности плазмы. Введение -адреноблокаторов способствовало снижению общего ХС, преимущественно за счет ХС ЛПНП, и нормализации содержания ТГ, уменьшался и коэффициент атерогенности плазмы, и даже нормализовался при использовании селективных 1-адренорецепторов: небиволола, бисопролола, метопролола и атенолола.
Развитие ХСН приводило у крыс к существенному дисбалансу между активностью свертывающей и противосвертывающей систем крови в пользу свертывающей на фоне снижения фибринолиза. Использование блокаторов адренорецепторов способствовало гармонизации активностей показателей адгезии и агрегации тромбоцитов, свертывающей, антисвертывающей и фибринолитической систем крови, причем агрегацию и адгезию тромбоцитов в большей степени тормозила высокоселективная инактивация 1адренорецепторов.
Положительные изменения в системах кровообращения и крови привели к тому, что снизилась смертность животных в 1.5-3.0 раза под воздействием всех -адреноблокаторов, кроме пиндолола, обладающего ВСМА. Таким образом, анализ данных показал, что наиболее выраженным нормализующим действие на организм в условиях дезадаптации обладают селективные 1адреноблокаторы: небиволол, бисопролол, затем метопролол и атенолол.
ВЫВОДЫ
- Предложенная модель дезадаптации – экспериментальная хроническая сердечная недостаточность, развитие которой происходит за счет дозированного введения силиконового масла в плевральные полости животного, показывает возможность получения сердечной недостаточности различной степени тяжести. Состоятельность модели была подтверждена в физиологических и морфологических исследованиях.
- Длительная инактивация как совместная 1- и 2-адренорецепторов (пропранололом), так и отдельно 1-адренореактивных структур (атенололом, метопрололом, бисопрололом и небивололом) у дезадаптированных животных увеличивают их выживаемость и продолжительность жизни; применение 1-, 2-адреноблокатора с ВСМА пиндолола достоверно на них не влияет.
- Кратковременное снижение активности -адренореактивных структур у наркотизированных интактных животных приводит к согласованному изменению показателей временного, геометрического и спектрального анализов вариабельности сердечного ритма, свидетельствующих о преобладании у них тонуса парасимпатического отдела автономной нервной системы. Значительное воздействие на сердечный ритм оказывает как высокоселективная блокада 1-адренорецепторов (метопрололом и бисопрололом), так и неселективная 1- и 2-адренорецепторов (пропранололом). Активация 1адренореактивных структур добутамином практически не влияет на вариабельность сердечного ритма.
- У интактных крыс, находящихся в состоянии кратковременного иммобилизационного стресса, изменение всех изученных показателей вариабельности сердечного ритма указывает на увеличение тонуса симпатического отдела автономной нервной системы. Кратковременное снижение активности -адренореактивных структур у этих животных путем их блокады по данным временного и геометрического анализов приводит к перераспределению тонуса в пользу парасимпатического отдела автономной нервной системы, однако, вызывает не только увеличение мощности волн высокочастотного диапазона HF спектрального анализа, но и еще большее повышение мощности волн низкочастотного диапазона LF, а также индекса LF/HF. На эти показатели влияет активность как 1- так и 2-адренореактивных структур. У стрессированных животных суммарная степень воздействия на сердечный ритм намного выше. Напротив, активация 1-адренорецепторов добутамином увеличивает активность симпатического отдела автономной нервной системы. Длительная дезадаптация животных, вызванная хронической сердечной недостаточностью, приводит снижению тонуса симпатического и повышению тонуса парасимпатического отдела автономной нервной системы.
- Продолжительное подавление активности -адренореактивных структур у дезадаптированных животных по данным анализа вариабельности сердечного ритма показывает, что больше повышают тонус парасимпатического отдела автономной нервной системы совместная блокада 1- и 2адренорецепторов пиндололом с внутренней симпатомиметической активностью и среднеселективная блокада 1-адренорецепторов водорастворимым атенололом. Высокоизбирательное снижение активности 1-адренорецепторов бисопрололом, метопрололом и небивололом с вазодилатирующей активностью, напротив, меньше всего изменяет сердечный ритм, и часть показателей вариабельности сердечного ритма возвращаются к таковым у интактных животных. Т.о., высокоселективная блокада оказывает нормализующее воздействие на функционирование сердечно-сосудистой системы.
- Кратковременная активация -адренорецепторов добутамином у интактных стрессированных животных приводит к увеличению только систолического объема крови. Подавление же активности -адренореактивных структур у таких животных практически не изменяет систолический и минутный объемы крови. В результате развития дезадаптации у крыс происходит уменьшение систолического и минутного объемов крови. Длительное выключение активности 1-адренорецепторов высокоселективными метопрололом, бисопрололом и небивололом с вазодилатирующей активностью практически приводит к возвращению этих гемодинамических показателей к нормальным значениям.
- Продолжительная инактивация -адренореактивных структур у интактных животных, независимо от избирательности воздействия, не оказывает существенного влияния на изучаемые биохимические показатели. У крыс с экспериментальной хронической сердечной недостаточностью блокада адренорецепторов препятствует формированию гормонально-медиаторного дисбаланса (прежде всего со стороны кортико-симпато-адреналовой системы) и уменьшает степень гипертрофии миокарда. В этом случае способность к нормализации изучаемых показателей в первую очередь зависит от избирательности воздействия на -адренорецепторы (высокоселективные 1адреноблокаторы действуют более эффективно) и наличия у -адреноблокаторов вазодилатирующей активности.
- Активность -адренореактивных структур оказывает влияние на липидный обмен только при дезадаптации. На фоне исходной дизлипидемии при хронической сердечной недостаточности наиболее активное нормализующее действие оказывает длительное избирательное подавление активности 1-адренорецепторов: только введение селективных небиволола, бисопролола, метопролола и атенолола приводит к одновременному снижению содержания общего ХС, ХС ЛПНП, ТГ и коэффициента атерогенности плазмы.
- Тоническая активность -адренореактивных структур влияет на гемостаз. При дезадаптации происходят неблагоприятные сдвиги в показателях гемостаза. При продолжительной блокаде как совместно 1- и 2адренорецепторов, так и избирательно 1-адренорецепторов, повышается активность антитромбина-III, фибринолитическая активность крови, уменьшается значение протромбинового индекса (но не пропранололом) и снижается уровень спонтанной агрегации тромбоцитов (небивололом, бисопрололом и атенололом).
- На функционирование систем кровообращения и крови у животных, находящихся в различных состояниях, оказывают влияние в разной степени активность как 1-, так и 2-адренореактивных структур. Но при дезадаптации, вызванной хронической сердечной недостаточностью, снижение активности 1-адренорецепторов в большей степени способствует нормализации функций организма, чем совместная блокада 1- и 2адренорецепторов. Т.о., адаптационные возможности -адреноблокаторов зависят от избирательности их действия, длительности применения, физико-химических свойств и дополнительных свойств (ВСМА, вазодилатация) этих веществ.
СПИСОК ОСНОВНЫХ РАБОТ, ОПУБЛИКОВАННЫХ
ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи в рецензируемых журналах
- Федоров В.Н., Сальников Е.В., Сидоров А.В., Богатушин А.В., Фатеев М.М. Влияние фармакодинамических и фармакокинетических особенностей ингибиторов ангиотензинпревращающего фермента и адреноблокаторов на выживаемость крыс с экспериментальной хронической сердечной недостаточностью. [Текст]. // Бюллетень экспериментальной биологии и медицины. Т. 141, № 1. – М., 2006. – С. 45-48 (авторских – 20%).
- Федоров В.Н., Ноздрачев А.Д., Сальников Е.В., Сидоров А.В., Яльцев А.В., Фатеев М.М. Динамическая модель тотальной хронической сердечной недостаточности у крыс. [Текст]. // Вестник Санкт-Петербургского государственного университета. Сер.3. Вып.2. – Санкт-Петербург, 2006. – С. 103-107 (авторских – 16,7%).
- Сальников Е.В., Фатеев М.М., Сидоров А.В., Федоров В.Н., Григорьева М.В. Вариабельность сердечного ритма у бодрствующих и наркотизированных крыс при воздействии -адреноблокаторов. [Текст]. // Бюллетень экспериментальной биологии и медицины. Т. 144, № 10. – М., 2007. – С. 372-375 (авторских – 20%).
- Сальников Е.В., Сидоров А.В., Ноздрачев А.Д., Фатеев М.М. Вариабельность сердечного ритма у крыс, находящихся в различных состояниях. [Текст]. // Вестник Санкт-Петербургского государственного университета. Сер. 3. Вып. 4. – Санкт-Петербург, 2008. – С. 137-142 (авторских –25%).
- Сальников Е.В. Вариабельность сердечного ритма у крыс с экспериментальной хронической сердечной недостаточностью, длительно получавших бета-адреноблокаторы. [Текст]. // Бюллетень экспериментальной биологии и медицины. – Том 147 – № 2. – М., 2009. – С.139-143 (авторских – 100%).
- Сидоров А.В., Федоров В.Н., Сальников Е.В., Фатеев М.М. Изменение липидного спектра у крыс с хронической сердечной недостаточностью. [Текст]. // Бюллетень экспериментальной биологии и медицины. Т. 148, № 7. – М., 2009. – С. 23-26 (авторских – 25%).
- Федоров В.Н., Фатеев М.М., Сальников Е.В., Сидоров А.В. Нейрогуморальные механизмы адаптации сердца крыс к перегрузке. [Текст]. // Журнал эволюционной биохимии и физиологии. Т. 45, № 4. – М., 2009. – С. 398-402 (авторских – 25%).
- Сальников Е.В., Фатеев М.М., Федоров В.Н., Сидоров А.В. Влияние кардиоселективности и внутренней симпатомиметической активности в реализации эффектов бета-адреноблокаторов на вариабельность сердечного ритма бодрствующих и наркотизированных крыс. [Текст]. // Вестник Волгоградского государственного медицинского университета. № 2 (30). – Волгоград, 2009. – С.52-55 (авторских – 25%).
- Румянцева Т.А., Фатеев М.М., Федоров В.Н., Сальников Е.В., Сидоров А.В. Морфологические доказательства наличия хронической сердечной недостаточности, индуцированной у крыс методом дробного дозированного олеоторакса. [Текст]. // Вестник Нижегородского университета им. Н.И. Лобачевского. № 5. – Нижний Новгород, 2009. – С.123-127 (авторских – 20%).
Статьи в сборниках материалов конференций и тезисы докладов
- Фёдоров В.Н., Милакова Н.Е., Сальников Е.В., Осипова Н.Н., Богатушин А.В., Смирнов А.В., Стовичек В.Г., Смирнов Н.А., Захарова М.Н., Фатеев М.М. Метопролол и эналаприл в терапии экспериментальной сердечной недостаточности. [Текст]. // Тезисы докладов XII Российского национального конгресса «Человек и лекарство», 18-22 апреля 2005 г., Москва. Общероссийский общественный фонд «Здоровье человека». – М., 2005. – С. 808-809 (авторских – 10%).
- Фатеев М.М., Сидоров А.В., Сальников Е.В., Богатушин А.В., Григорьева М.В. Влияние анаприлина на вариабельность сердечного ритма у крыс при хронической сердечной недостаточности. [Текст]. // Материалы Первого Всероссийского съезда аритмологов, 16-18 июня 2005 г., Москва / Анналы аритмологии. – 2005, №2. – М., 2005. – С. 130 (авторских – 20%).
- Сальников Е.В., Сидоров А.В., Григорьева М.В., Богатушин А.В., Фатеев М.М. Влияние небиволола на показатели вариабельности сердечного ритма у крыс с хронической сердечной недостаточностью. [Текст]. // Материалы Международной конференции «Гемореология в микро- и макроциркуляции», 21-23 августа 2005 г. – Ярославль, 2005. – С.239 (авторских – 20%).
- Сальников Е.В., Фёдоров В.Н., Сидоров А.В., Богатушин А.В., Яльцев А.В. Выживаемость крыс с экспериментальной сердечной недостаточностью при лечении ингибиторами АПФ и бета-блокаторами разных классов. [Текст]. // Научные Труды I съезда физиологов СНГ, 19-23 сентября 2005., Сочи, Дагомыс. Т.2. – М., 2005. – С.72 (авторских – 20%).
- Сальников Е.В., Фатеев М.М., Григорьева М.В., Сидоров А.В. Сравнительный анализ показателей вариабельности сердечного ритма у крыс с хронической сердечной недостаточностью при лечении бета-адреноблокаторами различных групп. [Текст]. // Тезисы докладов IV Всероссийской конференции с международным участием, посвященной 80-летию Института физиологии им. И.П. Павлова РАН. «Механизмы функционирования висцеральных систем», Санкт-Петербург, 4-6 октября 2005 г. – Санкт-Петербург, 2005. – С. 215-216 (авторских – 25%).
- Сидоров А.В., Сальников Е.В., Богатушин А.В., Фёдоров В.Н., Смирнов А.В. Влияние бета-блокаторов различных классов на активность симпатико-кортико-адреналовой системы у крыс с экспериментальной хронической сердечной недостаточностью. [Текст]. // Материалы VI Международной научно-практической конференции «Здоровье и Образование в XXI веке», 8-10 декабря 2005 г. – М., 2005. – С.434-435 (авторских – 20%).
- Сидоров А.В., Сальников Е.В., Богатушин А.В., Григорьева М.В. Способ моделирования хронической сердечной недостаточности у крыс методом дробного дозированного олеоторакса. [Текст]. // В сборнике «Актуальные проблемы хирургии и клинической анатомии». – Ярославль, 2005. – С.216218 (авторских – 25%).
- Сальников Е.В., Сидоров А.В., Богатушин А.В., Григорьева М.В., Фатеев М.М. Влияние целипролола на вариабельность сердечного ритма у крыс с хронической сердечной недостаточностью. [Текст]. // Тезисы докладов VII Международного славянского Конгресса по электростимуляции и клинической электрофизиологии сердца. IX Всероссийской конференции по электростимуляции и клинической электрофизиологии сердца. VII Всероссийского симпозиума «Диагностика и лечение аритмий у детей». V Международного симпозиума «Электроника в медицине. Мониторинг, диагностика, терапия». 9 – 11 февраля 2006 года, Санкт-Петербург / Вестник аритмологии. Приложение А. – Санкт-Петербург, 2006. – С. 185 (авторских – 20%).
- Федоров В.Н., Сальников Е.В., Богатушин А.В., Сидоров А.В., Смирнов А.В., Стовичек Е.П., Федорова Т.Б., Смирнов Н.А., Фатеев М.М., Журавлева Т.Б. Сравнительное влияние гидрофильных и липофильных ингибиторов АПФ и -адреноблокаторов на липидный обмен при хронической сердечной недостаточности. [Текст]. // Тезисы докладов XIII Российского национального конгресса «Человек и лекарство», 3-7 апреля 2006 г., Москва. Общероссийский общественный фонд «Здоровье человека» – М., 2006. – С. 312 (авторских – 10%).
- Fedorov V.N., Salnikov E.V., Bogatushin A.V. Life-long introduction of beta-adrenoblockers and ACE-inhibitors in rats with chronic heart failure. Fundamental pharmacology and pharmacy – clinical practice. [Text]. // Materials of the 2nd Russian-Chinese international scientific conferences on pharmacology. – Perm, 2006. – P. 147-148 (авторских –33,3%).
- Сальников Е.В., Григорьева М.В., Сидоров А.В., Фатеев М.М. Спектральный анализ вариабельности сердечного ритма у крыс в норме, при хронической сердечной недостаточности и при действии бета-адреноблокаторов. [Текст]. // Тезисы докладов ХХ съезда Физиологического общества имени И.П.Павлова. Москва, 4-8 июня 2007 г. – М.: Издательский дом «Русский врач», 2007. – С. 278-279 (авторских – 25%).
- Сальников Е.В., Фёдоров В.Н., Богатушин А.В. Роль бета-адреноблокаторов и ингибиторов АПФ в терапии экспериментальной хронической сердечной недостаточности. [Текст]. // Фармакология – практическому здравоохранению: Материалы III съезда фармакологов России (23-27 сентября 2007 г., Санкт-Петербург). / Психофармакология, биология, наркология 2007. Т.7, спец. выпуск (сентябрь) Ч.2 (М-Я). – Санкт-Петербург, 2007. – С.1839 (авторских – 33,3%).
- Фёдоров В.Н., Сальников Е.В., Стовичек В.Г., Стовичек Е.П. Селективные, неселективные и вазодилатирующие бета-блокаторы в терапии хронической сердечной недостаточности. [Текст]. //Тезисы докладов XV Российского национального конгресса «Человек и лекарство», Москва, 1418 апреля 2008 г., – М., 2008. – С.717 (авторских – 25%).
- Сальников Е.В., Сидоров А.В., Фатеев М.М., Григорьева М.В. Вариабельность сердечного ритма у крыс при дезадаптации и при длительном воздействии -адреноблокаторов. [Текст]. // Тезисы докладов VI Всероссийской конф. с международным участием, посвященной 50-летию открытия А.М. Уголевым мембранного пищеварения: «Механизмы функционирования висцеральных систем». Санкт-Петербург, 30 сентября – 2 октября 2008 г. – Санкт-Петербург, 2008. – С.181 (авторских – 25%).
- Фатеев М.М., Сальников Е.В., Сидоров А.В., Григорьева М.В. Вариабельность сердечного ритма у наркотизированных и бодрствующих стрессированных крыс при воздействии пиндолола и бисопролола. [Текст]. // Материалы II Междунар. научной конференции: «Актуальные проблемы биологии, нанотехнологий и медицины». Ростов-на-Дону, 8-10 октября 2008 г. – Ростов-на-Дону, 2008. – С. 41-42 (авторских – 25%).
- Фатеев М.М., Сальников Е.В., Сидоров А.В., Григорьева М.В. Воздействие метопролола и небиволола на вариабельность сердечного ритма у наркотизированных и бодрствующих иммобилизированных крыс [Текст].// Научные труды II съезда физиологов СНГ. Кишинэу, Молдова, 29-31 октября 2008 г. – М.-Кишинэу, Издательство Медицина – Здоровье, 2008. – С.122 (авторских – 25%).
- Сальников Е.В., Сидоров А.В., Фатеев М.М. Изменения систолического и минутного объемов крови под действием -адреноблокаторов у интактных крыс и при хронической сердечной недостаточности. [Текст]. // Тезисы докладов VII Всероссийской конференции с международным участием, посвященной 160-летию со дня рождения И.П. Павлова: «Механизмы функционирования висцеральных систем». Санкт-Петербург, 29 сентября – 2 октября 2009 г. – Санкт-Петербург, 2009. – С.383 (авторских – 33,3%).
- Сальников Е.В., Сидоров А.В., Федоров В.Н., Фатеев М.М., Богатушин А.В. Влияние -адреноблокаторов на гемостазиологические показатели крови у крыс [Текст]. // Тезисы докладов VII Всероссийской конференции с международным участием, посвященной 160-летию со дня рождения И.П. Павлова: «Механизмы функционирования висцеральных систем». Санкт-Петербург, 29 сентября – 2 октября 2009 г. – Санкт-Петербург, 2009. – С.384 (авторских – 20%).
- Фатеев М.М., Сальников Е.В., Григорьева М.В. Влияние -адреномиметика добутамина на вариабельность сердечного ритма у наркотизированных и бодрствующих иммобилизированных крыс [Текст]. // Тезисы докладов VII Всероссийской конференции с международным участием, посвященной 160-летию со дня рождения И.П. Павлова: «Механизмы функционирования висцеральных систем». Санкт-Петербург, 29 сентября – 2 октября 2009 г. – Санкт-Петербург, 2009. – С.427-428 (авторских – 33,3%).
СПИСОК СОКРАЩЕНИЙ
11-ОКС 11-оксикортикостероиды
АГ артериальная гипертензия
АД адреналин
АНС автономная нервная система
АПФ ангиотензин-превращающий фермент
АТ II ангиотензин II
ВСМА внутренняя симпатомиметическая активность
ВСР вариабельность сердечного ритма
ГТ гистамин
ДА дофамин
ИБС ишемическая болезнь сердца
Ка коэффициент атерогенности
КА катехоламины
КБП кора больших полушарий
ЛПВП липопротеиды высокой плотности
ЛПНП липопротеиды низкой плотности
ЛПОНП липопротеиды очень низкой плотности
МАО моноаминоксидаза
МОК минутный объем крови
НА норадреналин
ОПСС общее периферическое сопротивление сосудов
ПОЛ перекисное окисление липидов
РААС ренин-ангиотензин-альдостероновая система
РФМК растворимые фибрин-мономеров комплексы
САД системное артериальное давление
САС симпатоадреналовая система
СВ сердечный выброс
СОК систолический объем крови
ССС сердечно-сосудистая система
СТ серотонин
ТГ триацилглицериды
ХС холестерин
ХСН хроническая сердечная недостаточность
ЦНС центральная нервная система
ЧСС частота сердечных сокращений

