Структурные изменения в головном мозге у мышей при кандидозном менингоэнцефалите и их лечении композицией амфотерицина в с окисленным декстраном
на правах рукописи
ГУСЕВА
Екатерина Васильевна
СТРУКТУРНЫЕ ИЗМЕНЕНИЯ В ГОЛОВНОМ МОЗГЕ У МЫШЕЙ ПРИ КАНДИДОЗНОМ МЕНИНГОЭНЦЕФАЛИТЕ И ИХ ЛЕЧЕНИИ КОМПОЗИЦИЕЙ АМФОТЕРИЦИНА В С ОКИСЛЕННЫМ ДЕКСТРАНОМ
03.03.04 – клеточная биология, цитология, гистология
14.03.02 - патологическая анатомия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
НОВОСИБИРСК – 2011
Работа выполнена в Учреждении Российской академии медицинских наук Научный центр клинической и экспериментальной медицины Сибирского отделения РАМН (Новосибирск) и ГОУ ВПО Новосибирский государственный медицинский университет Росздрава
Научные руководители:
Заслуженный деятель науки РФ,
академик РАМН,
доктор медицинских наук, профессор Шкурупий Вячеслав Алексеевич
доктор медицинских наук, профессор Надеев Александр Петрович
Официальные оппоненты:
доктор медицинских наук, профессор Обухова Лидия Александровна
доктор медицинских наук Волков Александр Михайлович
Ведущая организация: Научно-исследовательский институт региональной патологии и патоморфологии Сибирского отделения РАМН (Новосибирск)
Защита состоится «26» апреля 2011 г. в 10 часов на заседании Диссертационного Совета Д 001.048.01 при Научном центре клинической и экспериментальной медицины СО РАМН по адресу: ул. Тимакова, 2, г. Новосибирск, 630117
Тел/факс 8 (383) 333-64-56
С диссертацией можно ознакомиться в библиотеке НЦКЭМ СО РАМН.
Автореферат разослан «___» марта 2011 г.
Ученый секретарь

диссертационного совета,
доктор биологических наук Пальчикова Н.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Значительный рост заболеваемости поверхностными и глубокими формами кандидоза, отмечающийся в последние годы (Wisplinghoff H., 2004; Castn-Osorio J.J. et al., 2008), связан с тем, что эта инфекция, являясь оппортунистической, поражает, прежде всего, ослабленный организм (Джавадов С.С., 2007; Ruhnke M., 2006; Algar V., Novelli V., 2007; Badiee P., Kordbacheh P. et al., 2009), что свидетельствует о снижении резистентности к данной инфекции в популяции человека. За последние годы наблюдают тенденцию к росту числа случаев инвазивного кандидоза (Venkatesan P. et al., 2005; Pfaller M.A., 2007; Metcalf S.C., Dockrell D.H., 2007). Это связано с рядом факторов: усиление иммуносупрессии у больных злокачественными опухолями вследствие интенсификации программ химиотерапии (DiNubile M.J. et al., 2005), увеличение числа больных с синдромом приобретенного иммунодефицита (СПИД) (Kontoyiannis D. et al., 2003), расширение трансплантации органов и гемопоэтических стволовых клеток (Pfaller M.A., Diekema D.J., 2007; Muoz P., 2008), проведение активной, на высокотехнологичном уровне, терапии выхаживания (Кулько А.Б., Митрохин С.Д., 2005), прежде всего больным в отделениях интенсивной терапии (Vincent J.L. et al. 1998; Pauw B., 1998; Edmond M. et al., 1999; Trick W.E. et al., 2002), недоношенным новорожденным (Castro B.A., 2008). Наибольшей проблемой являются кандидозы центральной нервной системы (ЦНС), составляющие 14,9% всех случаев инфекционного поражения ЦНС у новорожденных, в том числе недоношенных детей, летальность от которых достигает 50-56% (Сорокина М.Н. и др., 2000; Романюк Ф.П. и др., 2003; Castro B.A., 2008).
Внутриклеточное персистирование грибов в вакуолярном аппарате макрофагов сопряжено с формированием гранулем, состоящих преимущественно из клеток системы мононуклеарных фагоцитов (СМФ) (Струков А. И., Кауфман О. Я., 1989; Шкурупий В. А., 2007; Boros D. L., 2003). Поступление гранулемогенных факторов, равно как и клеток СМФ, в головной мозг ограничено в связи с наличием в нем гемато-энцефалического барьера (ГЭБ) (Hawkins B. T., Davis T. P., 2005). Вместе с тем, защитная способность ГЭБ в отношении грибов, очевидно, не абсолютна, поскольку менингоэнцефалиты, особенно при иммунодефицитных состояниях, обусловленные проникновением в головной мозг C. albicans (Castro B.A., 2008), наблюдают в клинической практике. В головном мозге имеются клетки микроглии, которые относят к представителям СМФ (Струков А. И., Кауфман О. Я., 1989), однако, нет ясных представлений о том, в какой мере они способны участвовать в гранулемообразовании при условии проникновения в головной мозг гранулемогенных факторов.
Терапия микотических поражений ЦНС, в частности, кандидозного менингоэнцефалита, затруднена в связи с ограничением транспорта лекарственных препаратов через ГЭБ. Решение проблемы его преодоления может состоять в применении высокомолекулярных лизосомотропных носителей лекарственных средств, в частности, декстранов, которые обладают тропностью к рецепторным системам фагоцитов и клеток эндотелия ГЭБ, к вакуолярному аппарату макрофагов и могут быть использованы для доставки и концентрации в них лекарственных средств (В.А. Шкурупий и др., 1991, 1993, 1994, 1997), что обусловило бы эффективность лечения при микозах головного мозга. Ранее было выполнено большое количество работ по изучению влияний комплекса изониазида с окисленным декстраном молекулярной массой 35 и 60 кД на развитие генерализованного хронического туберкулезного гранулематоза в эксперименте (Шкурупий В.А. и др., 1991; Чернова Т.Г., 1993; Филимонов П.Н., 1996; Козяев М.А., 1999; Потапова О.В., 2003; Шкурупий В.А., 2007).
Учитывая большое сходство туберкулезных и микотических гранулем, обусловленное феноменом внутривакуолярной персистенции возбудителей, была создана новая антимикотическая лизосомотропная композиция из амфотерицина В и окисленного декстрана. Получены свидетельства большей терапевтической эффективности этой композиции, по сравнению со свободной формой амфотерицина В, при лечении хронического системного кандидоза, в частности, в лимфатических узлах (Шкурупий В. А. и др., 2005), печени (Травин М. А., 2006), почках (Приставка А. А. и др., 2008). Однако остается неизученной эффективность данной композиции в отношении кандидозного менингоэнцефалита, что является актуальной проблемой при поиске и выборе лекарственных препаратов для лечения микозов с поражением ЦНС.
Цель исследования. Исследовать структурные особенности повреждения сосудов гемато-энцефалического барьера, вещества головного мозга и проявлений гранулематоза у мышей-самцов линии СВА при кандидозном менингоэнцефалите и их лечении композицией амфотерицина В с окисленным декстраном.
Задачи исследования:
- Методом морфометрии изучить структурную организацию сосудов гемато-энцефалического барьера и вещества головного мозга у мышей-самцов линии СВА в норме;
2. Исследовать морфологические изменения головного мозга мышей-самцов линии СВА после субдурального инфицирования С. albicans, на фоне введения циклофосфана.
3. Изучить структурные проявления C. albicans-энцефалита после субдурального инфицирования мышей-самцов линии СВА на фоне введения циклофосфана, и их лечения амфотерицином В, композицией амфотерицина В с окисленным декстраном.
4. Исследовать характер структурных преобразований в головном мозге и висцеральных органах мышей-самцов линии СВА, микотических гранулемах, после гематогенного инфицирования мышей C. albicans.
5. Методами морфологии изучить эффективность лечения генерализованного кандидоза у мышей-самцов линии СВА амфотерицином В и композицией амфотерицина В с окисленным декстраном.
Научная новизна результатов исследования. Впервые методами морфометрии изучены количественные характеристики клеток вещества головного мозга разных типов и сосудов гемато-энцефалического барьера у интактных мышей-самцов линии СВА.
Впервые в эксперименте с субдуральным инфицированием мышей-самцов линии СВА на фоне введения циклофосфана показано, что клетки микроглии мозга не участвуют в образовании микотических гранулем. Но при этом отсутствие гранулем не сопряжено с редукцией патоморфологических проявлений кандидозного менингоэнцефалита. При вышеуказанном способе инфицирования C. albicans не преодолевают гемато-энцефалический барьер, что не исключает поражения печени метаболитами грибов.
Впервые в рамках одного эксперимента, проведено сопоставление гранулемобразования и клеточного состава гранулем в головном мозге, печени, почках и легких у мышей-самцов линии СВА после их внутривенного инфицирования C. albicans. По клеточному составу гранулем в головном мозге и этих органах обнаружены отличия, обусловленные различными стадиями гранулемообразования, в конкретные периоды после инфицирования, в связи с местом введения инфекта. Показано, что гемато-энцефалический барьер существенно ограничивает проникновение C. albicans и макрофагов/моноцитов в головной мозг, что определяет меньшую концентрацию гранулем в мозге, чем в легких и почках.
Впервые методами морфологии и по показателям летальности показано, что окисленный декстран при лечении кандидозного энцефалита при внутривенном инфицировании C. albicans мышей-самцов линии СВА обладает самостоятельным лечебным эффектом.
Впервые, согласно данным морфологического исследования головного мозга у мышей-самцов линии СВА, инфицированных гематогенным путем C. albicans, и показателей летальности, показано, что композиция амфотерицина В с окисленным декстраном более эффективна, как средство лечения системного кандидоза в эксперименте, чем амфотерицин В.
Научно-практическое значение работы. Полученные данные о большей терапевтической эффективности композиции амфотерицина В с окисленным декстраном, по сравнению со свободной формой амфотерицина В, и самостоятельном лечебном эффекте окисленного декстрана, при лечении кандидозного энцефалита, могут послужить основой для создания противогрибкового препарата в качестве средства лечения системных микозов (кандидозов), в том числе кандидозных менингоэнцефалитов.
Результаты морфометрического исследования структурной организации гемато-энцефалического барьера и вещества головного мозга уточняют известные сведения о строении этих структур в головном мозге, в том числе у мышей-самцов линии СВА, и могут быть использованы при преподавании гистологии в разделах «Нервная система», «Гемато-энцефалический барьер» и внесены в периодические специализированные издания, публикующие сведения о лабораторных линейных (инбредных) животных. Результаты исследования структурных изменений в головном мозге при гематогенном инфицировании C. albicans и в условиях иммунодефицита могут быть использованы для преподавания курса общей патологической анатомии в разделах «Воспаление» и «Общие вопросы инфекционных заболеваний», «Перинатальные инфекции», клинической фармакологии в разделе «Антибиотики и противогрибковые средства».
Положения, выносимые на защиту:
- При гематогенном инфицировании мышей-самцов линии СВА C. albicans в головном мозге концентрация кандидозных гранулем существенно меньше, чем во внутренних органах (почки и легкие), что определяется ограниченным проникновением грибов и клеток системы мононуклеарных фагоцитов через гемато-энцефалический барьер. Кандидозные гранулемы в головном мозге, печени, легких и почках сходны по клеточному составу, но имеют некоторые отличия по их количественному представительству. Клетки микроглии не участвуют в формировании микотических гранулем. Отсутствие гранулем в головном мозге при субдуральном инфицировании, однако, не сопряжено с редукцией патологических проявлений кандидозного менингоэнцефалита.
- При лечении кандидозного менингоэнцефалита композицией амфотерицина В с окисленным декстраном достигается более выраженный терапевтический антимикотический эффект, чем при лечении амфотерицином В. Это проявлялось существенно меньшей летальностью животных, и, по данным морфологического исследования, уменьшением масштабов гранулематозного воспаления, повреждения сосудов ГЭБ, отечно-деструктивных изменений вещества головного мозга, что обусловлено самостоятельным терапевтическим эффектом окисленного декстрана в составе композиции, усиливающего антимикотические свойства амфотерицина В.
Апробация диссертации. Основные положения диссертации доложены и обсуждены на: 3-й Всероссийской конференции «Фундаментальные аспекты компенсаторно-приспособительных процессов (Новосибирск, 2007), 2-м Съезде микологов России (Москва, 2008), Всероссийской научной конференции, посвященной 150-летию кафедры патологической анатомии Военно-медицинской академии им. С.М. Кирова (Санкт-Петербург, 2009), Научно-практической конференции по медицинской микологии (XII Кашкинские чтения) (Санкт-Петербург, 2009), III съезде Российского общества патологоанатомов (Самара 2009), IV Всероссийской научно-практической конференции с международным участием «Фундаментальные аспекты компенсаторно-приспособительных процессов» (Новосибирск, 2009), Научно-практической конференции по медицинской микологии (XIII Кашкинские чтения) (Санкт-Петербург, 2010), Республиканской научно-практической конференции ВГМУ (Витебск, 2010).
Публикации. По материалам исследования опубликовано 10 научных работ, 2 из которых – статьи в рецензируемых научных журналах, определенных ВАК РФ для опубликования материалов диссертационных исследований.
Объем и структура диссертации. Диссертация изложена на 181 страницах машинописного текста, состоит из введения, обзора литературы, описания материалов и методов исследования, главы результатов собственных исследований и их обсуждения, заключения, выводов, списка литературы, приложения. Диссертация иллюстрирована 53 рисунками, из них 13-ю микрофотографиями, 13 таблицами. Указатель литературы включает 105 работ отечественных и 253 работы зарубежных авторов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на 390 двухмесячных мышах-самцах линии СВА массой 20-25 г., полученных из питомника НИИ цитологии и генетики СО РАН (г. Новосибирск). Работа проведена в 2 экспериментах.
Эксперимент 1.
Моделировали состояние лейкопении у мышей путем двухнедельного, внутримышечного введения циклофосфана в дозе 30 мг/кг массы тела в режиме 2 раза в неделю, до инфицирования, и далее – у этих же мышей, после их инфицирования C. albicans до 56-х суток в том же режиме (Хмельницкий О. К, Котович В.М, 1995).
На этом фоне моделировали кандидозный менингоэнцефалит путем однократного введения взвеси суточной культуры низковирулентного штамма C.albicans (АТСС24433) в изотоническом растворе NaCl (1109 микробных тел в 1 мл), объемом 0,05 мл в субдуральное пространство. Низковирулентная культура C.albicans индуцирует гранулемогенный эффект (Шкурупий В.А. и др., 2007). Кроме того, ее использовали с целью избегания высокой летальности животных от самой процедуры внутричерепного введения, которая могла увеличиться деструктивными эффектами метаболитов грибов (Лисовская С. А. и др., 2007).
Для верификации лейкопении, как проявления иммунодефицита, в камере Горяева подсчитывали общее количество лейкоцитов в периферической крови.
На фоне кандидозного процесса применяли препараты амфотерицин В и композицию амфотерицина В с окисленным декстраном.
Амфотерицин В (АмВ) вводили интраперитонеально в дозе 250 ЕД/кг массы тела в 0,2 мл 5% раствора глюкозы в весовом соотношении 5 мкг амфотерицина В к 10 мг глюкозы.
Комплексную композицию амфотерицина В с окисленным декстраном (КАД) получали путем смешивания окисленного декстрана молекулярной массой 30-40 кД с амфотерицином В, в весовом соотношении 5 мкг амфотерицина В к 5 мг окисленного декстрана. КАД вводили интраперитонеально в дозе 250 ЕД/кг массы тела в 0,2 мл окисленного декстрана.
Препараты вводили на следующие сутки после инфицирования. Курс составил 10 инъекций в режиме «через день», в утренние часы.
Экспериментальные животные были разделены на 7 групп. Первую группу составили интактные мыши. У мышей 2-7-й групп моделировали лейкопению. Мышам 3-й группы на этом фоне вводили окисленный декстран. У животных, 4-й и 5-й, 6-й и 7-й групп моделировали грибковый менингоэнцефалит. Животных 4-ой группы не лечили. Мышам 5-ой группы вводили амфотерицин В. Мышам 6-ой группы вводили композицию амфотерицина В с окисленным декстраном (КАД). Животные 7-й группы получали окисленный декстран.
Для морфологического исследования в каждой группе использовали по 8-10 мышей. Животных выводили из эксперимента путем дислокации позвонков в шейном отделе под эфирным наркозом. Объектами исследований служили головной мозг и печень. Образцы органов для светооптического исследования получали на 10, 28 и 56 сутки.
Для светооптического исследования образцы головного мозга (фронтальный срез через теменную область) и печени (край правой доли) фиксировали в 10% растворе нейтрального формалина, обезвоживали в серии спиртов возрастающей концентрации и заключали в парафин (Меркулов Г.А., 1969; Волкова О.В., Елецкий Ю.К., 1971). На ротационном микротоме «Microm» (Germany) готовили гистологические срезы толщиной 5 мкм. Препараты печени окрашивали гематоксилином и эозином, головного мозга - гематоксилином и эозином, ШИК-реактивом, по Нисслю. С эндотелием сосудов вещества головного мозга проводили иммуногистохимическую реакцию с моноклональными антителами CD34 (маркер эндотелиальных клеток) («Abcam», USA) с дополнительным окрашиванием гематоксилином Майера. Препараты заключали в среду Био-Маунт на предметных стеклах. От каждого животного получали по 5-6 гистологических срезов.
Эксперимент 2.
Генерализованный кандидоз моделировали путем однократного введения взвеси суточной культуры высоковирулентного штамма C.albicans (РКПГY-1129/13, полученного из НИИ медицинской микологии СПбМАПО, г. Санкт-Петербург) в дозе 12,5106 микробных тел в 0,5 мл изотонического раствора NaCl, в латеральную хвостовую вену.
На фоне кандидозного процесса применяли препараты амфотерицин В, окисленный декстран и комплексную композицию амфотерицина В с окисленным декстраном в дозах и режиме, аналогичных таковым в первом эксперименте.
Животные были разделены на 5 групп. Мышам 1-й (контрольной) группы, однократно, внутривенно вводили 0,5 мл изотонического раствора NaCl. У мышей 2-й, 3-й, 4-й и 5-й групп моделировали генерализованный кандидоз путем введения взвеси суточной культуры C.albicans в латеральную хвостовую вену. Мыши 2-й группы были нелеченными. Животным 3-й группы вводили амфотерицин В, мышам 4-й группы вводили композицию амфотерицина В с окисленным декстраном; мышам 5-й группы – окисленный декстран.
Для морфологического исследования в каждой группе использовали по 8-10 мышей. Животных выводили из эксперимента дислокацией позвонков в шейном отделе под эфирным наркозом. Образцы органов для светооптического исследования получали на 3, 7, 10, 28 сутки после инфицирования. Объектами исследований были головной мозг, печень, почки и легкие. Готовили гистологические препараты по методике, описанной в первом эксперименте. Препараты печени, почек, легких окрашивали гематоксилином и эозином, головного мозга – гематоксилином и эозином, ШИК-реактивом, по Нисслю. Окрашенные срезы заключали в среду Био-Маунт на предметных стеклах. От каждого животного получали по 5-6 гистологических срезов. Для выявления сосудов и астроцитов вещества головного мозга проводили иммуногистохимическую реакцию с моноклональными антителами CD34 (маркер эндотелиальных клеток) и, соответственно, GFAP (кислый фибриллярный белок астроцитов) («Abcam», USA) с дополнительным окрашиванием гематоксилином Майера.
В обоих экспериментах проводили морфометрическое исследование головного мозга, а так же гранулем в печени, легких и почках мышей в соответствии с рекомендациями (Автандилов Г.Г., 1990). Светооптическое исследование образцов головного мозга, печени, легких и почек проводили на микроскопе Carl Zeiss Axio Imager A1, с помощью программы AxioVision 6.0 и окулярной сетки из 100 точек.
В первом эксперименте подсчитывали численную плотность (Nai) и объемную плотность (Vv) поперечно и тангенциально срезанных сосудов в веществе головного мозга в тестовой площади 6,76104 мкм, объемные плотности (Vv) зон перицеллюлярного и периваскулярного отека, нейронов, астроцитов и клеток микроглии.
Во втором эксперименте в головном мозге, помимо выше описанных параметров, подсчитывали численную плотность (Nai) гранулем в тестовой площади 6,76104 мкм и их клеточный состав. Печень, почки и легкие исследовали для подсчета численной плотности гранулем и их клеточного состава.
Статистическую обработку результатов проводили в соответствии с принципами вариационной статистики, изложенными в работах Г.Г. Автандилова (1990), С. Гланца (1999). Вероятность достоверности различий средних величин в сравниваемых группах по различным признакам определяли на основании критериев Стьюдента (при условии нормальности распределения величин исследуемых параметров в выборке) и Колмогорова-Смирнова. Различия считали достоверными при p<0,05. Данные в таблицах и на рисунках приведены как M±m, где М - среднее арифметическое, m - ошибка среднего.
Статистическую обработку данных морфометрического исследования проводили на компьютере с использованием программы Microsoft Office Excel, SPSS Statistics.
Результаты собственных исследований и их обсуждение
- Результаты морфометрического исследования клеточного строения головного мозга мышей-самцов линии СВА в норме
В работе были изучены структурные особенности и клеточный состав вещества головного мозга, а так же сосуды микроциркуляторного русла интактных инбредных животных – мышей-самцов линии СВА: величины объемных плотностей астроцитов, нейронов и клеток микроглии, численная и объемная плотности поперечных и тангенциальных срезов микрососудов головного мозга.
Таблица 1.
Результаты морфометрического исследования клеточного строения головного мозга мышей-самцов линии СВА в норме (M±m)
| № группы | Исследован-ные группы мышей, условия эксперимента | Исследованные параметры | ||||
| Численная плотность сосудов (Nai) | Объемная плотность сосудов (Vv),% | Объемная плотность астроцитов (Vv),% | Объемная плотность нейронов (Vv),% | Объемная плотность микроглии (Vv),% | ||
| 1 | Интактные | 16,56±0,66 | 3,52±0,23 | 10,88±0,53 | 1,86±0,29 | 0,92±0,10 |
Лейкопения, выявленная при подсчете общего количества лейкоцитов в периферической крови мышей-самцов линии СВА, подтверждала наличие иммунодефицита у животных после введения циклофосфана, вне зависимости от условий эксперимента. В указанных условиях окисленный декстран не обладал способностью стимулировать костномозговое кроветворение.
- Структурные изменения в головном мозге мышей-самцов линии СВА при субдуральном инфицировании C. albicans
При морфологическом исследовании оболочек головного мозга у инфицированных животных, начиная с 10 суток после инфицирования, были выявлены отек мягкой мозговой оболочки, полнокровие сосудов, единичные лимфоциты. При исследовании срезов ГМ у субдурально инфицированных мышей не было обнаружено ни инфильтратов, ни гранулем, характерных для C. albicans – гранулематоза. В печени клеточных инфильтратов и гранулем также не было, но наблюдали вакуольную дистрофию, некроз гепатоцитов.
Кандидозное поражение вещества головного мозга проявлялось застойным полнокровием, тромбозом, десквамацией эндотелия и фибриноидными изменениями стенок сосудов ГЭБ, их деструкцией. Распространенные гемоциркуляторные нарушения, развившиеся в результате воздействия протеаз и фосфолипаз возбудителя на эндотелий церебральных микрососудов, приводили к развитию периваскулярного и перицеллюлярного отека и деструкции вещества ГМ.
Деструкция сосудов приводила к уменьшению их количества. В группе нелеченных животных численная плотность сосудов (концентрация сосудов в единице площади среза вещества головного мозга) на 10-е и 28-е сутки наблюдения не отличалась от величины таковой в 1-й (интактной) и 2-й (циклофосфан) группах, однако, к 56 суткам отмечено уменьшение величины данного показателя в 3,6 раз по сравнению с таковой на 10 сутки (рис.1), что, помимо деструкции, отчасти, связано с разрежением вещества головного мозга вследствие нарастающего перицеллюлярного и периваскулярного отека, деструкцией сосудов в зонах некротических изменений вещества ГМ и сдавлением части сосудов отечной жидкостью. В то же время объемная плотность сосудов к 56 суткам наблюдения была равна величине аналогичного параметра у интактных животных (рис.2), очевидно, в связи с застойным полнокровием сосудов.
1, 2, 4 – группы мышей
Рис. 1. Численная плотность (Nai) сосудов головного мозга мышей-самцов линии СВА при субдуральном способе инфицирования C. albicans
1, 2, 4 – группы мышей
Рис. 2. Объемная плотность (Vv) сосудов головного мозга мышей-самцов линии СВА при субдуральном способе инфицирования C. albicans
Данные особенности динамики изменений численности и объемной плотности сосудов свидетельствовали о нарастании процессов деструкции и фибриноидных изменений стенок сосудов и их застойном полнокровии на 56-е сутки после инфицирования и, как следствие, о состоянии гипоксии, приведшей к деструкции клеток вещества головного мозга, нарастанию выраженности перицеллюлярного и периваскулярного отека. Объемная плотность зон отека нарастала, и к 56 суткам была большей в 2 раза, чем после введения циклофосфана (рис.3).
2, 4 – группы мышей
Рис.3. Суммарная объемная плотность (Vv) зон перицеллюлярного и периваскулярного отека в головном мозге мышей-самцов линии СВА при субдуральном инфицировании C. albicans на фоне введения циклофосфана
При морфологическом исследовании ГМ нейроны были подвержены процессам вакуольной дистрофии и некрозу, что было обусловлено цитопатическим действием грибковых фосфолипаз и протеаз, а так же гипоксией и ишемией. Объемная плотность нейронов на 28-е сутки после инфицирования была меньшей, чем в контрольных группах, что свидетельствовало о «пике» их деструкции в этот период. На 56 сутки величина данного показателя была равна таковому в контрольных группах, что обусловлено процессами вакуольной дистрофии в «выживших» нейронах, выраженной в большей степени, чем на 10-е сутки эксперимента (рис.4).
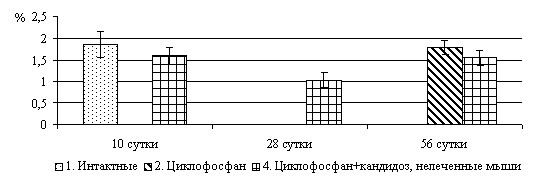
1, 2, 4 – группы мышей
Рис. 4. Объемная плотность (Vv) нейронов в веществе головного мозга мышей-самцов линии СВА при субдуральном способе инфицирования C. albicans
Одной из целей данного исследования было изучить структурные изменения клеток микроглии и их причастность к гранулемообразованию. Для этого, кроме гистологического изучения, исследовали объемную плотность этих клеток. Введение циклофосфана существенно не влияло на величину объемной плотности клеток микроглии. Но после инфицирования животных C. albicans она, в период с 10 по 28 сутки от начала инфицирования увеличивалась, по-видимому, в связи с эндоцитозом клетками микроглии продуктов деструкции клеток вещества ГМ. Поскольку гранулем не было выявлено ни в один из периодов патологического процесса, а костный мозг «блокирован» циклофосфаном, что резко ограничивает участие костномозговых предшественников в формировании гранулем, и объемная плотность микроглии не уменьшалась, можно полагать, что клетки микроглии в образовании гранулем не участвовали.
Таким образом, при субдуральном инфицировании C. albicans, клетки вещества головного мозга были подвержены процессам вакуольной дистрофии и некрозу, что косвенно было обусловлено гипоксией и ишемией как следствие поражения сосудов ГЭБ и прямым цитопатическим действием грибковых метаболитов. Это отражалось в увеличении их объема. Кроме того, учитывая отсутствие гранулем в веществе головного мозга во все периоды исследования, на фоне лейкопении, обусловленной введением циклофосфана, можно полагать, что клетки микроглии не участвовали в формировании гранулем.
3. Морфологическая характеристика C. albicans-индуцированного гранулематозного воспаления в головном мозге мышей СВА при гематогенном инфицировании
При внутривенном заражении мышей C. albicans (штамм РКПГY-1129/13) развивалась кандидозная инфекция, проявлявшаяся неврологической симптоматикой у большинства животных и их 100% гибелью на 18-20 сутки после инфицирования. В 1-е сутки после инфицирования в веществе ГМ наблюдали крупные, преимущественно нейтрофильные инфильтраты, с неупорядоченным, сравнительно рыхлым расположением клеток, в их центре обнаруживали вегетирующие формы гриба и апоптотические тельца. Начиная с 3-их суток выявлено формирование макрофагальных гранулем, расположенных диффузно, преимущественно периваскулярно, отдельно и с тенденцией к их слиянию. На 7-е и 10-е сутки после инфицирования в гранулемах, наряду с макрофагами, увеличивалась доля эпителиоидных клеток. Периферию гранулем составляли макрофаги и лимфоциты, нейтрофилы встречались сравнительно редко.
Несмотря на высокую вирулентность используемого штамма, количество гранулем в ГМ резко уменьшалось на 10 сутки (рис. 5). Это свидетельствует об успешной элиминации C. albicans макрофагами гранулем вне условий лейкопении. На 28 сутки этот параметр и клеточный состав гранулем не исследовали, поскольку 100% нелеченных животных погибло в период между 18 и 20 суткам.
После внутривенного инфицирования мышей C. albicans, гранулемы так же обнаруживали в легких, печени, почках и головном мозге, что свидетельствовало о генерализации кандидозного воспаления. Количество гранулем в почках и легких с 3 по 10 сутки после гематогенного инфицирования было существенно большим (рис. 6), а в печени несколько меньшим, чем в головном мозге. Эти данные свидетельствуют о достаточно высокой барьерной функции ГЭБ как в отношении С. albicans, так и моноцитов, макрофагов.
 | 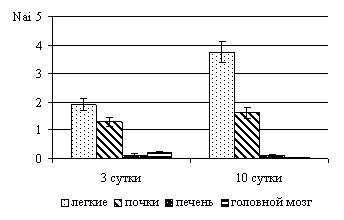 |
| Рис. 5. Численная плотность (Nai) гранулем в головном мозге мышей-самцов линии СВА после их внутривенного инфицирования C. albicans | Рис. 6. Численная плотность (Nai) гранулем в легких, почках, печени и головном мозге мышей-самцов линии СВА после их внутривенного инфицирования C. albicans |
Так как поступление агентов инфекционной природы в кровоток сопровождается их захватом клетками системы мононуклеарных фагоцитов (Шкурупий В.А. и др., 1999), большее, чем в головном мозге, количество гранулем в легких и почках могло быть связано с высокой концентрацией в этих органах резидентных макрофагов, захвативших из крови большую часть введенных грибов. Меньшее количество гранулем в печени определялось способом инфицирования (в хвостовую вену). В этом случае изначально С. albicans попадали в почки, легкие и головной мозг, а затем в печень. В более же поздние сроки количество гранулем в печени было наибольшим (Травин М. А. и др., 2005) в связи с наибольшей концентрацией в ней резидентных макрофагов – центров гранулемообразования.
По клеточному составу гранулем в исследованных органах это были типичные микотические гранулемы с соответствующим их строением и составом клеток в определенные периоды их формирования и «диссоциации». Существенные отличия по этим параметрам обнаружили лишь в легких, где количество нейтрофилов на 10-е сутки было примерно в 10 раз большим, чем в ГМ, а количество эпителиоидных клеток наименьшим. Возможно, что это связано с различными временем начала, скоростью и «местными» условиями гранулемообразования в связи с органными особенностями их кровоснабжения.
После внутривенного инфицирования, так же как и в первом эксперименте, наблюдали деструктивные изменения вещества ГМ, нарастающие на фоне дисциркуляторных нарушений периваскулярный и перицеллюлярный отек, фибриноидные изменения стенок сосудов и их застойное полнокровие, тромбоз, что выражалось в увеличении объемной плотности сосудов, при величине численной плотности, равной таковой в контрольной группе.
При морфометрическом исследовании клеток головного мозга, объемная плотность клеток микроглии увеличивалась на 10-е сутки, видимо, также как и в первом эксперименте в связи с эндоцитозом ими продуктов деструкции вещества головного мозга, что приводило к увеличению их объемов. Эти данные также можно рассматривать как свидетельство того, что клетки микроглии не участвовали в формировании гранулем, т.к., в данном случае, объемная плотность клеток микроглии должна была уменьшиться. Вместе с тем, эти данные дают основание предполагать, что клетки микроглии можно рассматривать как потенциальные мишени для депонирования в ГМ крупномолекулярных веществ или корпускулярных объектов.
С 3 по 10-е сутки были выявлены дистрофические изменения астроцитов, которые развивались вследствие ишемии и повреждения их мембран фосфолипазами и протеазами C. albicans. Это проявлялось отеком их тел, что выражалось в увеличении их объемной плотности, и, в частности, в увеличении объемной плотности отростков астроцитов что могло способствовать ограничению проницаемости гемато-энцефалического барьера. Деструктивные изменения в веществе головного мозга мышей, инфицированных C. albicans, проявлялись так же вакуольной дистрофией и некрозом нейронов.
4. Структурные изменения в головном мозге мышей-самцов линии СВА после их субдурального инфицирования C. albicans и при лечении препаратами амфотерицина В и окисленным декстраном
При лечении АмВ мышей-самцов линии СВА, после их субдурального инфицирования C. albicans, численная плотность сосудов к 56 суткам была в 3 раза большей, чем у нелеченных мышей, что могло свидетельствовать о терапевтическом эффекте АмВ, проявившемся к 56 суткам после инфицирования уменьшением цитотоксического отека вследствие снижения концентрации метаболитов грибов за счет их элиминации и «открытием» просветов сдавленных в результате разрежения вещества головного мозга мелких церебральных капилляров. Однако у мышей, леченных АмВ, не происходило полного восстановления величины этого параметра до его значения в контрольной группе. У мышей, леченных КАД, величина этого параметра на 56-е сутки увеличивалась и была большей в 3,3 раза, чем у нелеченных животных (рис. 7). Такое увеличение численности микрососудов на позднем сроке исследования могло так же быть обусловлено активацией неоангиогенеза (подтвержденной при ИГХ-исследовании с эндотелиальным маркером CD34). Видимо, это отражает способность окисленного декстрана, входящего в состав КАД, стимулировать пластические и репаративные процессы (Шкурупий В.А. и др., 2008). При этом наблюдали уменьшение объемной плотности сосудов у леченных мышей, наиболее выраженное в группе животных, леченных КАД, лечение которым приводит к ослаблению цитотоксического влияния метаболитов возбудителя на сосуды микроциркуляторного русла (за счет фунгицидного действия АмВ, входящего в состав композиции).
1, 2, 3, 4, 5, 6, 7 – группы мышей
Рис.7. Численная плотность (Nai) сосудов головного мозга у мышей-самцов линии СВА после субдурального инфицирования C. albicans и их лечения
Наиболее выраженная антимикотическая активность при применении КАД проявилась так же в уменьшении степени перицеллюлярного и периваскулярного отека в веществе головного мозга на 56-е сутки эксперимента (рис. 8). Возможно, антимикотический эффект реализовался в связи с лучшим преодолением композицией гемато-энцефалического барьера.
2, 3, 4, 5, 6, 7 – группы мышей
Рис. 8. Суммарная объемная плотность (Vv) зон перицеллюлярного и периваскулярного отека в веществе головного мозга мышей-самцов линии СВА после введения циклофосфана, субдурального инфицирования C. albicans и лечения препаратами амфотерицина В
При этом при лечении только окисленным декстраном объемная плотность зон отека была равна величине аналогичного показателя в группе мышей, леченных АмВ. Эти данные дают основание предполагать у окисленного декстрана наличие самостоятельного лечебного эффекта, усиливающего действие АмВ в составе композиции. Этот эффект можно объяснить свойством ОД повышать окислительно-метаболическую функцию макрофагов, а так же стимулировать завершенность фагоцитоза посредством стимулирования фагосомо-лизосомального слияния (Шкурупий В.А. и др., 1997). Кроме того, возможно, ОД мог конкурировать с грибами за маннозные рецепторы эндотелиоцитов, не позволяя проникать возбудителю через ГЭБ.
5. Морфологические проявления генерализованного кандидозного гранулематоза в головном мозге мышей-самцов линии СВА, леченных препаратами амфотерицина В и окисленным декстраном
При лечении мышей-самцов линии СВА после их гематогенного инфицирования в группе инфицированных, нелеченных мышей, погибли 100% животных в период между 18 и 20 сутками после заражения. У животных, леченных ОД к 28 суткам после инфицирования погибло лишь 40% животных.
На 3-и сутки от начала лечения мышей амфотерицином В, количество гранулем было равно таковому у нелеченных животных, тогда как у леченных ОД и КАД оно было значительно меньшим. На 7-е сутки после инфицирования концентрация гранулем у мышей, леченных препаратами амфотерицина В и ОД– уменьшалась в несколько раз и была равной во всех группах. На 10-е сутки количество гранулем было равным у мышей всех групп и чрезвычайно малым, а к 28 суткам у выживших животных гранулем не наблюдали (рис. 9).

2, 3, 4, 5 – группы мышей;
«*» - нелеченные животные погибли в период с18 по 20 сутки после инфицирования, у леченных животных гранулем не наблюдали
Рис. 9. Численная плотность (Nai) гранулем в головном мозге мышей-самцов линии СВА после их гематогенного инфицирования C. albicans и лечения различными формами амфотерицина В
Полученные данные свидетельствуют о том, что лечебный эффект амфотерицина В в головном мозге, судя по количеству инфильтратов и гранулем, еще не реализовался на 3-и сутки от начала лечения, а окисленный декстран, с учетом показателей летальности и концентрации гранулем, обладает самостоятельным, ранее, чем у амфотерицина В проявляющимся, лечебным эффектом, усиливающим таковой у амфотерицина В в составе композиции.
Изменения просвета сосудов ГЭБ в совокупности с упомянутыми изменениями могут быть рассмотрены как показатель их повреждения и степени успешности лечебных воздействий. Так, на 3-и сутки у мышей, получавших АмВ или КАД, величины объемной плотности сосудов были меньшими, чем у нелеченых животных. Но уже с 7-х суток наименьшей объемная плотность просветов сосудов была у мышей, леченных КАД (рис. 10), что указывает на больший эффект КАД в отношении уменьшения деструктивных изменений в стенках сосудов. На 28-е сутки величины объемной плотности сосудов в группах, леченных АмВ и КАД были больше величины аналогичного показателя в контрольной группе, что могло быть вызвано токсическим эффектом амфотерицина на эндотелий сосудов.

1, 2, 3, 4, 5 – группы мышей
Рис. 10. Объемная плотность (Vv) сосудов в головном мозге мышей-самцов линии СВА после их гематогенного инфицирования C. albicans и лечения различными формами амфотерицина В
Объемы зон перицеллюлярного и периваскулярного отека – следствие повреждения сосудов и повышения их проницаемости – так же были меньшими у животных, леченых АмВ и КАД, во все периоды исследования (рис. 11), что свидетельствовало об эффективности элиминации возбудителя и уменьшении выраженности цитотоксического воздействия его метаболитов на клетки вещества головного мозга и эндотелий сосудов при применении АмВ и, в частности, КАД.

2, 3, 4, 5 – группы мышей
Рис. 11. Суммарная объемная плотность (Vv) зон перицеллюлярного и периваскулярного отека вещества головного мозга мышей-самцов линии СВА после их гематогенного инфицирования C. albicans и лечения препаратами амфотерицина В
Таким образом, в результате анализа морфологических и морфометрических данных, полученных при исследовании образцов головного мозга, в эксперименте с моделированием иммунодефицитного состояния, при субдуральном инфицировании мышей-самцов линии СВА C. albicans, было установлено, что, наряду с ним, фактором, лимитирующим гранулемообразование в головном мозге, являлось неучастие клеток микроглии в формировании гранулем и, прежде всего, в качестве центров гранулемообразования. Отсутствие гранулем было обусловлено ингибированием эффекторных функций клеточного звена иммунитета в результате повреждения циклофосфаном клеточных элементов костного мозга, что привело к уменьшению числа дифференцированных фагоцитирующих клеток.
Отсутствие микотических гранулем не является препятствием для формирования патологических изменений в головном мозге, проявившихся диффузным поражением церебральных микрососудов в следствие цитопатического действия грибковых метаболитов, что приводило к развитию отечно-деструктивных изменений. Это дает основание охарактеризовать исследуемую патологию как менингоэнцефалит, поскольку мозговые оболочки неизбежно вовлекались в процесс в связи с субдуральным введением взвеси культуры C. albicans, хотя таковые не были объектом данного исследования.
При изучении особенностей гранулемообразования в головном мозге мышей после их инфицирования C. albicans через латеральную хвостовую вену, установлено, что ГЭБ лимитирует проникновение грибов в головной мозг, несмотря на высокую вирулентность используемого штамма. Кроме того, быстрое уменьшение количества гранулем уже к 10 суткам после инфицирования свидетельствовало об успешной элиминации C. albicans макрофагами сформировавшихся гранулем вне условий лейкопении (иммунодефицита).
После внутривенного инфицирования мышей, как и в случае субдурального инфицирования, выявлены выраженные отечно-деструктивные изменения в веществе головного мозга, которые были обусловлены как цитотоксическим воздействием грибковых метаболитов на клетки ГМ, так и развитием гипоксии вследствие распространенных деструктивных изменений сосудов и гемоциркуляторных нарушений, развившихся в результате воздействия литических ферментов возбудителя на эндотелий церебральных микрососудов.
После внутривенного инфицирования мышей C. albicans, генерализация кандидозного воспаления подтверждалась наличием гранулем в легких, печени, почках, а так же деструктивно-воспалительных изменений в их паренхиме и строме. При этом меньшая концентрация гранулем в головном мозге, по сравнению с таковой в почках и легких свидетельствовала о достаточно высокой барьерной функции ГЭБ как в отношении С. albicans, так и моноцитов, макрофагов.
По клеточному составу в головном мозге и иных органах это были достаточно типичные микотические гранулемы, с соответствующим их строением и клеточным составом. Отличия по клеточному составу гранулем в легких, почках и печени, в конкретные периоды наблюдения, были обусловлены способом введения возбудителя – в латеральную хвостовую вену, и, следовательно, неодновременным «прохождением» ими различных стадий гранулемообразования.
Полученные на двух экспериментальных моделях кандидозного менингоэнцефалита результаты морфологического и морфометрического исследований головного мозга свидетельствуют о большем антимикотическом эффекте композиции АмВ с окисленным декстраном по сравнению со свободным АмВ. Это проявлялось меньшим повреждением микрососудов гемато-энцефалического барьера и уменьшением зон отечно-деструктивных изменений в веществе головного мозга. Во втором эксперименте о высокой терапевтической эффективности КАД свидетельствовало так же уменьшение численной плотности гранулем, существование которых обусловлено наличием в центре гранулем (резидентном макрофаге) живых C. albicans. Уничтожение грибов сопряжено со снижением хематтрактантного потенциала, формируемого возбудителем и клетками микроокружения (моноцитами, макрофагами, эпителиоидными клетками). Это сопряжено с феноменом «диссоциации» гранулем.
На основании морфологических и морфометрических данных установлено, что, при лечении кандидозного менингоэнцефалита, окисленный декстран обладает самостоятельным лечебным эффектом, на что указывает меньшие, чем без лечения, летальность и концентрация гранулем в головном мозге животных после его применения на фоне инфицирования. При этом эффективность окисленного декстрана проявилась раньше, чем у амфотерицина В, и сопоставима по уменьшению отечного синдрома в веществе ГМ с эффективностью амфотерицина В. Кроме того, окисленный декстран усиливает эффект амфотерицина В в составе композиции. Это подтверждалось большим, по сравнению с эффектами амфотерицина В, увеличением численной плотности сосудов (их новообразованием), меньшей выраженностью отечного синдрома, а так же в более ранним редуцированием кандидозных гранулем.
ВЫВОДЫ
1. Клетки микроглии не участвуют в гранулемообразовании, что установлено на модели субдурального инфицирования мышей-самцов линии СВА C. albicans на фоне введения циклофосфана, отсутствие микотических гранулем в головном мозге не сопряжено с редукцией проявлений микотического воспаления в нем.
2. Образование кандидозных гранулем в головном мозге после гематогенного инфицирования C.albicans мышей-самцов линии СВА лимитировано гемато-энцефалическим барьером в отношении C. albicans и клеток, формирующих гранулемы в головном мозге. Это проявилось меньшим количеством гранулем в головном мозге, по сравнению с другими органами.
3. По количественным параметрам клеточного состава кандидозные гранулемы в головном мозге несколько отличаются от таковых в печени, почках и легких, что обусловлено различными условиями проникновения в них C.albicans и фагоцитирующих клеток при внутривенном инфицировании и, следовательно, неодновременным «прохождением» различных стадий гранулемообразования, определяющих эти отличия.
4. Терапевтическая эффективность композиции амфотерицина В с окисленным декстраном при лечении кандидозного менингоэнцефалита у мышей-самцов линии СВА после субдурального и гематогенного инфицирования, по данным морфологического и морфометрического исследований, была существенно большей, по сравнению со свободным амфотерицином В. Это проявлялось меньшим повреждением сосудов гемато-энцефалического барьера и уменьшением количества гранулем, выраженности отечно-деструктивных изменений в веществе головного мозга.
5. Окисленный декстран обладает собственным и рано проявляющимся антимикотическим эффектом, сопоставимым со свободным амфотерицином В. Это проявилось существенным снижением величины показателя летальности животных при его применении, чем у нелеченных мышей, о чем судили по более быстрому уменьшению проявлений гранулематозного микотического воспаления.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ:
1. Структурная организация и содержание стероидных гормонов в надпочечниках мышей при системном кандидозе и его лечении композицией амфотерицина В с диальдегиддекстраном / Е.В. Гусева, Н.А. Пальчикова, В.Г. Селятицкая, А.П. Надеев, В.А. Шкурупий // Сибирский консилиум – 2007. – №7 (62). – С. 102.
2. Гусева Е.В. Экспериментальная модель кандидозного менингоэнцефалита / Е.В. Гусева, В.А. Шкурупий // Современная микология в России: Материалы 2-го Съезда микологов России. – М., 2008. – Т.2. – С. 488.
3. Патоморфологические особенности сосудистого русла головного мозга при кандидозном менингоэнцефалите и его лечении композицией амфотерицина В с диальдегиддекстраном в эксперименте / Е.В. Гусева, О.В. Потапова, А.П. Надеев, В.А. Шкурупий // Материалы Всероссийской научной конференции, посвященной 150-летию кафедры патологической анатомии Военно-медицинской академии им. С.М. Кирова. – СПб, 2009. – С.38-40.
4. Патоморфология поражения головного мозга мышей при кандидозном менингоэнцефалите и его лечении композицией амфотерицина В с диальдегиддекстраном / Е.В. Гусева, О.В. Потапова, А.П. Надеев, В.А. Шкурупий // Проблемы медицинской микологии – 2009.-Т.11- №2 – С.68.
5. Морфологические особенности кандидозного менингоэнцефалита у мышей на фоне иммунодефицита и лечения комплексной композицией амфотерицина В / Е.В. Гусева, А.П. Надеев, С.В. Позднякова, В.А. Шкурупий // Материалы III съезда Российского общества патологоанатомов, Самара 2009. – Т.2. – С. 130-131.
6. Гусева Е.В. Реакция глиальных клеток у мышей при интрацеребральном инфицировании Candida albicans / Е.В Гусева, О.В Потапова, А.П. Надеев // Фундаментальные аспекты компенсаторно-приспособительных процессов: IV Всероссийская научно-практическая конференция с международным участием – Новосибирск, 2009. – С. 64-65.
7. Гранулемогенез при экспериментальном кандидозном энцефалите и при применении композиции амфотерицина В с окисленным декстраном / Е.В. Гусева, А.П. Надеев, О.В. Потапова, В.А. Шкурупий // Проблемы медицинской микологии – 2010.-Т.12- №2 – С.81-82.
8. Структурная организация головного мозга при церебральном кандидозе у мышей, леченных композицией амфотерицина В с окисленным декстраном / Е.В. Гусева, В.А. Шкурупий, А.П. Надеев, О.В. Потапова // Сибирское медицинское обозрение – 2010. – № 6 – С. 25-28. (Из списка ВАК)
9. Особенности гранулематоза при кандидозном энцефалите и его лечении композицией амфотерицина В с окисленным декстраном / Е.В. Гусева, А.П. Надеев, О.В. Потапова, В.А. Шкурупий // Актуальные вопросы морфологической диагностики заболеваний: Материалы Республиканской научно-практической конференции. – Витебск: ВГМУ, 2010 – С. 160-163.
10. Морфологические изменения в головном мозге мышей, леченных композицией амфотерицина В с окисленным декстраном, при генерализованном кандидозе / В.А. Шкурупий, Е.В. Гусева, О.В. Потапова, А.П. Надев // Бюлл. эксперим. биологии и медицины. – 2011. – Т. 151, №1. – С. 107-111. (Из списка ВАК)
СПИСОК СОКРАЩЕНИЙ
АмВ -амфотерицин В
ГМ -головной мозг
ГЭБ -гемато-энцефалический барьер
КАД -композиция амфотерицина В с окисленным декстраном
ОД -окисленный декстран
СМФ -система мононуклеарных фагоцитов
ЦНС -центральная нервная система

Соискатель Гусева Е.В.

