Адаптационные процессы в системе иммунитета человека при воздействии факторов космического полета
На правах рукописи
Рыкова Марина Петровна
Адаптационные процессы в системе иммунитета человека при воздействии факторов космического полета
14.03.08 – авиационная, космическая и морская медицина
03.03.04 - клеточная биология, цитология, гистология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва – 2013
Работа выполнена в Федеральном государственном бюджетном учреждении науки Государственном научном центре Российской Федерации – Институте медико-биологических проблем Российской академии наук.
Научные консультанты:
- доктор медицинских наук, профессор,
- член-корреспондент РАМН Моруков Борис Владимирович
- доктор медицинских наук, профессор,
- член-корреспондент РАН Буравкова Людмила Борисовна
| Официальные оппоненты: | |
| доктор медицинских наук, профессор, академик РАЕН, заведующий поликлиническим отделением №1 ФГБУ «ГНЦ Институт иммунологии» ФМБА России | Лусс Людмила Васильевна |
| доктор медицинских наук, профессор кафедры гистологии, цитологии и эмбриологии ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздравсоцразвития России | Яцковский Александр Никодимович |
| доктор медицинских наук, профессор, заведующий отделом cанитарно-гигиенической безопасность человека в искусственной среде обитания ФГБУН ГНЦ РФ Институт медико-биологических проблем РАН | Ильин Вячеслав Константинович |
Ведущая организация: Федеральное государственное бюджетное учреждение “Научно-исследовательский испытательный центр подготовки космонавтов имени Ю.А. Гагарина”
Защита диссертации состоится «____» декабря 2013 г. в 10 часов на заседании диссертационного совета Д 002.111.01, созданного на базе Федерального государственного бюджетного учреждения науки Государственного научного центра Российской Федерации – Института медико-биологических проблем Российской академии наук по адресу: 123007, г. Москва, Хорошевское шоссе д.76а.
С диссертацией можно ознакомиться в библиотеке Федерального государственного бюджетного учреждения науки Государственного научного центра Российской Федерации – Института медико-биологических проблем Российской академии наук по адресу (123007, г. Москва, Хорошевское шоссе д.76а).
Автореферат разослан «____». сентября 2013 г.
Ученый секретарь диссертационного совета,
доктор биологических наук М.А. Левинских
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Для жизнедеятельности организма, для его существования всеобъемлющее значение имеет постоянство внутренней среды. Живой организм является ультрастабильной системой, которая осуществляет активный поиск наиболее оптимального и наиболее устойчивого состояния (Горизонтов П.Д., 1981; Нефедов В.П., Ясайтис А.А., Новосельцев В.Н. и др. 1991; Наточин Ю.В., 2002). Этот поиск приводит к адаптации, т.е. к поддержанию некоторых важных переменных показателей организма в физиологических границах, несмотря на изменение обычных условий существования. Начало третьего тысячелетия отмечено ростом интереса мирового сообщества к межпланетным полетам. Об этом свидетельствует интенсивная разработка проектов, связанных с возможностью пилотируемых полетов на спутник Земли – Луну, и на одну из планет Солнечной системы - Марс, представляющих наибольший интерес для исследователей. Несомненно, для осуществления полета человека к Марсу необходимо решение комплекса проблем, в частности, выяснение закономерностей адаптации к длительному воздействию факторов космического полета (Григорьев А.И., 2007). Актуальность исследований процессов адаптации организма к различным неблагоприятным условиям существования на борту космического объекта (в частности, к невесомости) и последующей реадаптации к земным условиям связана, прежде всего, с тем, что изучение этих процессов позволяет глубже понять: что есть физиологическая адаптация, каковы ее пределы в различных системах организма, насколько стабильна эта адаптация и какой ценой для организма она достигается (Газенко О.Г., Григорьев А.И., Гюрджиан А.А., 1991).
Одним из факторов, которые могут лимитировать увеличение продолжительности пребывания человека в условиях космического полета, является снижение адаптивных возможностей одной из ключевых интегральных и регуляторных систем организма человека, направленной на сохранение и поддержание генетического гомеостаза организма, - иммунной системы. Практика полетов длительностью до одного года и более подтверждает, что человек может не только успешно приспосабливаться к существованию в условиях микрогравитации, но и эффективно осуществлять профессиональную деятельность, а после полетов сравнительно быстро реадаптироваться к земному уровню гравитации. В то же время за последние десятилетия накоплены данные, свидетельствующие о том, что под влиянием действия комплекса факторов космического полета у космонавтов и астронавтов, совершивших полеты различной продолжительности на кораблях типа «Салют», «Апполон», «Союз» и «Спейс Шаттл», а также на орбитальных станциях «Скайлэб», «Салют-6, 7» и «МИР», происходят изменения в функционировании системы иммунитета (Константинова И.В., 1988; Stowe R.P., Sams C.F. Mehta S.K. et al., 1999; Sonnenfeld G, Butel JS, Shearer WT., 2003; Gueguinou N., Huin-Schohn C., Bascove M. Et al., 2009).
За значительный отрезок времени, прошедший с начала исследований влияния условий космического полета на организм человека, в связи с быстрым и все ускоряющимся прогрессом естественных наук (в том числе в иммунологии, клеточной и молекулярной биологии) не только существенно изменились подходы к изучению иммунитета космонавтов, но и стало совершенно очевидно, что, поскольку иммунная система, как и всякая другая гомеостатическая система, не является конгломератом отдельных элементов, а представляет собой сложную систему, обладающую организацией и целостностью (Петров Р.В., 1987; Лозовой В.П., 1988; Хаитов Р.М., 2001; Сепиашвили Р.И., 2003), то для реального суждения о направленности и динамики развития адаптационных изменений иммунной системы при воздействии факторов космического полета необходима интегральная оценка всей системы иммунитета. Представляется, что такие исследования имеют и теоретический, и прикладной аспекты, так как только основываясь на понимании адаптационных реакций иммунной системы возможно разработать эффективные меры профилактики и коррекции неблагоприятного воздействия условий космического полета на организм человека.
Цель и задачи исследования
Целью данной работы является комплексное изучение адаптационных возможностей системы иммунитета человека к реальным и моделируемым факторам космического полета.
В ходе работы решались следующие задачи:
- изучить особенности реакций иммунокомпетентных клеток при моделировании в наземных условиях различных факторов космического полета;
- оценить количественное содержание и функциональную активность клеточных факторов врожденного и адаптивного иммунитета у космонавтов до и после космических полетов различной продолжительности;
- исследовать механизмы адаптационной перестройки системы иммунитета в ответ на воздействие факторов космического полета;
- разработать основные принципы оценки эффективности средств профилактики неблагоприятного воздействия факторов космического полета на систему иммунитета человека.
Научная новизна
В проведенных исследованиях впервые был использован комплексный подход оценки врожденного и адаптивного иммунитета человека при анализе процессов адаптации системы иммунитета к воздействию факторов космического полета. При иммунологическом обследовании космонавтов до и после завершения космических полетов различной продолжительности и испытателей-добровольцев, находившихся в условиях наземного моделирования факторов космического полета, установлено, что процесс адаптации реализуется по мобилизационному типу компенсаторно-приспособительных реакций. При этом происходит перестройка уровня функционирования иммунной системы, проявляющаяся разнонаправленными сдвигами субпопуляционного состава клеточных факторов иммунной системы и их функциональной активности с преобладанием показателей активации. Отмеченное в ряде случаев угнетение функциональной активности иммунокомпетентных клеток может быть расценено не только как один из признаков истощения функциональных резервов иммунной системы, но и признаком состояния «риска» развития вторичного иммунодефицита.
Впервые показано, что адаптация системы иммунитета человека к условиям космического полета достигается ценой значительного повышения напряженности ее функционирования на уровне системных взаимоотношений иммунокомпетентных клеток. Выявлено, что кратковременное воздействие факторов космического полета ведет к интенсификации работы иммунной системы, проявляющейся в повышении связанности ее компонентов, тогда как длительное воздействие этих факторов приводит к перенапряжению, а в дальнейшем и к истощению функциональных резервов иммунной системы, проявляющемся в ослаблении связанности ее компонентов.
Установлено, что изменения в функционировании системы иммунного гомеостаза при действии комплекса факторов космического полета обеспечиваются различными механизмами. Впервые показано, что нарушение функций Т-звена иммунитета может быть связано как с изолированными, так и сочетанными изменениями главных этапов иммунного ответа, т.е. активации, пролиферации и регуляции. Выявлены основные типы реакции Т-звена иммунитета на условия длительного космического полета: снижение способности Т-лимфоцитов к пролиферации со снижением их способности к активации, свидетельствующее о нарушениях в системе иммунитета на уровне процессов активации; снижение способности Т-лимфоцитов к пролиферации с сохранением их способности к активации. Комплексное исследование показателей, характеризующих состояние иммунной и цитокиновой систем, впервые позволило оценить роль цитокинов в формирования сдвигов в системе иммунитета при действии на организм человека факторов космического полета. Показано, что, снижение функциональной активности Т-лимфоцитов космонавтов в периоде послеполетной реадаптации определяется не столько недостатком ИЛ-2, сколько повышением продукции ИЛ-10.
Теоретическая и практическая значимость работы
Результаты комплексного исследования показателей, характеризующих состояние иммунной системы, при действии факторов космического полета позволяют более полно представить механизмы адаптации физиологических систем организма человека.
Практическая значимость работы заключается в обосновании необходимости при отборе «устойчивых» к воздействию экстремальных факторов орбитального полета космонавтов, а также для прогноза адаптационных возможностей организма членов экипажей к условиям межпланетного космического полета включать в предполетный контроль методы оценки функциональных резервов системы иммунного гомеостаза.
Практическую значимость представляют также разработанные теоретические положения, которые могут быть использованы для обоснования, разработки и апробации новых, перспективных средств профилактики и коррекции неблагоприятных сдвигов в системе иммунитета в условиях длительных орбитальных и межпланетных полетов.
Положения, выносимые на защиту
- Механизмы адаптационной перестройки системы иммунитета человека в ответ на комплексное воздействие факторов космического полета закономерно приводят к изменению параметров, характеризующих состояние врожденного и адаптивного иммунитета. Характер сдвигов на измененные условия среды обитания в начале однотипен и включает активацию иммунной системы. В свою очередь длительная активация может приводить к истощению резервных возможностей этой гомеостатической системы, что проявляется в снижении содержания функционально активных зрелых иммунокомпетентных клеток, обеспечивающих защиту организма. Выраженность этих изменений зависит от индивидуальных особенностей функционирования системы иммунитета.
- Изменения в функционировании системы иммунного гомеостаза человека при адаптации к комплексу факторов космического полета происходят на различных уровнях иммунного процесса: активации, пролиферации, дифференцировки.
- Адаптация системы иммунитета к факторам космического полета достигается ценой значительного повышения напряженности ее функционирования. Длительное пребывание в условиях орбитального космического полета может приводить к дисрегуляции иммунной системы космонавтов.
- Использование функциональных тестов, характеризующих резервные возможности иммунной системы, позволяет оценить эффективность профилактических и коррегирующих мероприятий с учетом индивидуальных возможностей организма космонавтов.
Апробация работы
Основные результаты и положения диссертации были представлены и обсуждены на XI, XVII Международных симпозиумах «Человек в космосе» (Тулуза, 1995; Москва, 2009 г.); Международной конференции «Гипокинезия (Медицинские и психологические проблемы)» (Москва, 1997 г.), Международном симпозиуме «Международная научная кооперация на борту орбитальной станции Мир» (Лион, 2001), XIII Международной конференции «Космическая биология и авиакосмическая медицина» (Москва, 2006 г.), LX конгрессе Международной астронавтической федерации ( Тэджон, 2009), XXI съезде Физиологического общества им. И.П.Павлова (Калуга, 2010 г.), Международном симпозиуме по результатам экспериментов, моделирующих пилотируемый полет на Марс (Марс-500) (Москва, 2012 г.)
По теме диссертации опубликовано 58печатных работ, в том числе 17 статей в журналах из перечня ВАК РФ.
Диссертация апробирована на заседании секции «Космическая физиология и биология» Ученого совета ГНЦ РФ – ИМБП РАН «Космическая физиология и биология» 02.07. 2013 г.
Связь работы с научными программами
Работа выполнена при поддержке программ РАН и Роскосмоса, а также грантов президента РФ “Поддержка ведущих научных школ» и РФФИ.
Структура и объем диссертации
Диссертация изложена на 93 страницах и состоит из глав: «Введение», «Обзор литературы», «Материалы и методы исследований», «Результаты и обсуждение», «Выводы» и «Список литературы». Текст диссертации изложен на 216 страницах, содержит 34 рисунков и 25 таблиц. Список литературы состоит из 289 цитируемых источников, из которых 163 – на русском и 126 – на иностранном языке.
Основное СОДЕРЖАНИЕ РАБОТЫ
Объем и условия исследований
Содержание и общий объем проведенных исследований представлены в таблице 1.
Таблица 1. Объем и структура исследований
| №№ п/п | Направления исследований | Продолжительность (сутки) | Количество обследованных |
| 1. | Космические полеты на орбитальной станции Мир | ||
| 1.1 | Кратковременные космические полеты | 8-31 | 18 |
| 1.2 | Продолжительные космические полеты | 115-428 | 52 |
| 2. | Космические полеты на МКС | ||
| 2.1 | Кратковременные космические полеты | 8-10 | 20 |
| 2.2 | Продолжительные космические полеты | 125– 215 | 41 |
| 3. | Модельные эксперименты с «сухой» иммерсией без применения средств профилактики | ||
| 3.1. 3.2. | Модельный эксперимент с «сухой» иммерсией Модельный эксперимент с «сухой» иммерсией | 7 5 | 5 13 |
| 4. | Модельный эксперимент с антиортостатической (-5°) гипокинезией (АНОГ) без применения профилактических средств | 120 | 6 |
| 5. 5.1. 5.2. | Модельные эксперименты с длительной изоляцией в гермообъеме: Модельный эксперимент с длительной изоляцией в гермообъекте (SFINCSS-99) Модельный эксперимент с 520-суточной изоляцией, моделирующем элементы межпланетной экспедиции к Марсу | 110-240 520 | 11 6 |
| 6. 6.1. 6.2. | Эксперименты с физическими нагрузками: Эксперименты с силовыми тренировками по схеме классической силовой тренировки и по схеме низкоинтенсивной силовой тренировки без расслабления с нагрузкой 50% от максимальной произвольной силы Эксперименты с длительной аэробной нагрузкой по программе низкоскоростной эксцентрической тренировки, по программе высокоскоростной эксцентрической тренировки и по программе высокоскоростной концентрической тренировки. | 56 56 | 37 22 |
Исследования влияния факторов реального космического полета на состояние системы иммунитета были выполнены до и после завершения кратковременных (8-31 суток) и длительных (115-438 суток) экспедиций на орбитальных космических станциях Мир и МКС с участием 131 космонавта.
Моделирование факторов космического полета в наземных условиях (5- и 7-суточная «сухая» иммерсия, 120-суточная АНОГ -5°, 110-520-суточная изоляция в гермообъеме) проводили на экспериментальных базах ГНЦ РФ ИМБП РАН. Общие условия проведения комплексных испытаний, циклограмма исследований, научно-практические цели экспериментов описаны Козловской И.Б. (2008), Лариной И.М. с соавт. (1999), Барановым В.М. (2001), Моруковым Б.В. (2011).
Эксперименты с физическими нагрузками включали эксперименты с силовыми тренировками по схеме классической силовой тренировки и по схеме низкоинтенсивной силовой тренировки без расслабления, а также эксперименты с длительной аэробной нагрузкой по программе низкоскоростной эксцентрической тренировки, по программе высокоскоростной эксцентрической тренировки и по программе высокоскоростной концентрической тренировки (Виноградова О.Л. и соавт, 2007).
Материалом для исследования являлась периферическая кровь космонавтов и испытателей-добровольцев, участвовавших в наземных модельных экспериментах. Взятие проб крови у космонавтов проводилось за 60 суток до старта и на 1-7-е сутки после приземления, у испытателей-добровольцев - в фоновом периоде, во время воздействия и после его завершения. Испытатели-добровольцы, принимавшие участие в наземных экспериментах, были допущены врачебно-экспертной комиссией ГНЦ РФ – ИМБП РАН к проведению испытаний. Предварительно процедуры и методики исследований были рассмотрены Комиссией по биомедицинской этике при ГНЦ РФ-ИМБП РАН, а от испытателей, принимавших участие в исследованиях, было получено добровольное информированное согласие.
Методы исследований
Иммунологическое обследование проводилось с использованием методов проточной цитофлюориметрии, иммуноферментного анализа, радиоиммунологического анализа, турбидиметрии и включало изучение следующих параметров:
- содержание в периферической крови, лейкоцитов, лимфоцитов, моноцитов и нейтрофильных гранулоцитов;
- система врожденного иммунитета: содержание в периферической крови моноцитов и гранулоцитов, экспрессирующих сигнальные и эндоцитозные образраспознающие рецепторы (TLR2, TLR 4, TLR6, CD36, CD206), молекулы межклеточной адгезии (CD24, CD54) и Fc-рецептор (CD16); фагоцитарная активность моноцитов и гранулоцитов периферической крови;
- система естественной цитотоксичности: содержание в периферической крови ЕК (CD16+ и СD56+-лимфоциты); содержание ЕК, экспрессирующих активационный маркер CD69, в культурах клеток in vitro при стимуляции интерлейкином 2 (ИЛ2); цитотоксическая активность ЕК-клеток периферической крови;
- Т-звено адаптивного иммунитета: содержание в периферической крови CD3+, CD3+CD4+, CD3+CD8+, CD3+CD25+, CD4+CD25+Bright, CD3+HLA-DR+, CD3+CD71+, CD3+CD95+, CD4+CD45RА+, CD4+CD45RО+, CD4+38+- CD8+CD38+-лимфоцитов; содержание CD3+CD69+ лимфоцитов в нестимулированных и стимулированных митогеном (ФГА) 18-часовых культурах мононуклеарных клеток; содержание CD3+CD25+-лимфоцитов в нестимулированных и стимулированных митогеном (ФГА) 48-часовых культурах мононуклеарных клеток; функциональная активность Т-лимфоцитов по уровню спонтанного и индуцированного митогенного (ФГА-фитогемагглютинин) пролиферативного ответа в 48-часовых культурах мононуклеарных клеток;
- В-звено адаптивного иммунитета: содержание в периферической крови CD19+, CD20+, CD19+CD23+-лимфоцитов; содержание CD19+CD69+ лимфоцитов в нестимулированных и стимулированных митогеном лаконоса (МЛ) 18-часовых культурах мононуклеарных клеток; функциональная активность В-лимфоцитов по уровню спонтанного и индуцированного МЛ пролиферативного ответа в 5-суточных культурах мононуклеарных клеток; количество IgA, IgM, IgG в нестимулированных и стимулированных МЛ 5-суточных культурах мононуклеарных клеток; уровень сывороточных иммуноглобулинов классов A, M, G (IgA, IgM, IgG);
- апоптоз иммунокомпетентных клеток;
- цитокиновый профиль: уровень цитокинов в сыворотке крови - ИЛ-1, ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12р70, ИФН, ФНО и ФНО; способность иммунокомпетентных клеток секретировать цитокины - ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12р70, ИФН, ФНО и ФНО, в системе in vitro при стимуляции ЛПС и ФГА.
- содержание белка теплового шока HSP70 в сыворотке крови.
Статистическую обработку полученных данных выполняли с использованием пакета прикладных программ «Statistica 6.0» для Windows. Достоверность уровня различия сравниваемых величин оценивали, используя непараметрический метод анализа повторных измерений Уилкоксона. Данные представлены в виде среднего значения ± стандартная ошибка среднего, медианы и интерквартильной широты (0,25-0,75).
Результаты исследований и их обсуждение
1. Исследования системы иммунитета человека в условиях наземного моделирования факторов космического полета
1.1. Эксперименты с «сухой» иммерсией. Показано, что при пребывании испытателей-добровольцев в течение 5-7 суток в условиях «сухой» иммерсии (СИ) наблюдалось изменение показателей, характеризующих состояние врожденного и адаптивного иммунитета. Отклонения изученных иммунных параметров были подвержены значительной индивидуальной вариабельности. Так, у 58% обследованных было отмечено повышение относительного содержания в периферической крови моноцитов (Мн) и нейтрофильных гранулоцитов (НГ), экспрессирующих на своей поверхности сигнальные образраспознающие рецепторы (pattern recognition receptors, PRR) - То11-подобных рецепторов (Toll-like receptors, TLR) 2, 4, и 6. В то же время у некоторых из обследованных пребывание в условиях СИ, напротив, привело к существенному снижению содержания в периферической крови Мн и НГ, экспрессирующих TLR. При этом в обследованной группе испытателей-добровольцев были установлены сильные прямые корреляционные связи между уровнем белка теплового шока с молекулярной массой 70 кДа (HSP70) в сыворотке крови и содержанием в периферической крови Мн, экспрессирующих TLR2 (r=0,88; р<0,001) и TLR4 (r=0,78; р<0,001).
Кроме того, на заключительном этапе СИ в 42% наблюдений отмечалось не только повышение содержания в периферической крови лимфоцитов-естественных киллеров (ЕК) - подклассов лимфоцитов, экспрессирующих мембранные молекулы CD56 (CD56dim+- и CD56bright+-клеток) и CD16, а также их субтипов, имеющих высокую, умеренную и низкую цитолитическую активность (CD56+CD16+, CD16-CD56+ и CD16+CD56-), но и повышение индуцированной ИЛ-2 способности CD56+-клеток экспрессировать ранний активационный маркер CD69.
Анализ такого показателя как соотношение числа отклонений абсолютного и относительного содержания в периферической крови субпопуляций клеточных факторов адаптивного иммунитета – Т- и В-лимфоцитов, в сторону повышения от фоновых значений к числу отклонений в сторону снижения показал, что у 54% обследованных испытателей было выявлено его уменьшение. При идентификации раннего активационного маркера CD69 на Т-лимфоцитах, стимулированных ФГА в культурах клеток in vitro, у части обследованных было также отмечено снижение количество CD3+-клеток, экспрессирующих этот маркер, что свидетельствует о недостаточном запасе функциональных резервов эффекторных клеток Т-звена адаптивного иммунитета.
Таким образом, совокупность выявленных изменений параметров врожденного и адаптивного иммунитета при воздействии на организм факторов снижения опоры, свидетельствует о том, что перенастройка на новый уровень функционирования в новых условиях происходит в зависимости от индивидуальных особенностей и функциональных резервов иммунной системы.
1.2. Эксперимент со 120-суточной антиортостатической гипокинезией (АНОГ). Показано, что при длительном воздействии на организм здоровых добровольцев условий пребывания в АНОГ индивидуальные показатели, характеризующие функциональное состояние и содержание в периферической крови клеточных факторов системы естественной цитотоксичности, характеризовались большой вариабельностью и разнонаправленностью изменений. На 110-е сутки АНОГ отмечено три типа реакций этой системы: снижение цитотоксической активности и количества ЕК-клеток c фенотипом CD16+; повышение цитотоксической активности и количества CD16+-клеток; угнетение цитотоксической активности при повышении количества CD16+-клеток. Таким образом, длительное пребывание в неблагоприятных для человека условиях АНОГ приводит к активной мобилизации резервов системы естественной цитотоксичности, признаком которой является повышение выхода в циркуляцию ЕК-клеток. А снижение функциональной активности эффекторных клеток являются следствием перенапряжения этой системы у лиц, «неустойчивых» к воздействию экстремальных факторов.
Изучение функциональной активности Т-лимфоцитов выявило на заключительном этапе АНОГ снижение пролиферативной активности Т-лимфоцитов в ответ на стимуляцию ФГА в 48-часовых культурах клеток (на 39,1±7,87%; р<0,05). Анализ фенотипа иммунокомпетентных клеток позволил установить, что в этот период наблюдалось значительное повышение экспрессии рецепторов CD25 на лимфоцитах периферической крови (рис. 1).
Рис. 1. ФГА-индуцированная пролиферативная активность Т-лимфоцитов в 48-часовых культурах клеток (% бластов) и процент CD25+-Т-лимфоцитов в периферической крови обследуемых в условиях 120-суточной АНОГ (индивидуальные данные).
По-видимому, усиление экспрессии рецепторов к интерлейкину-2 на Т-лимфоцитах периферической крови, отражающее состояние активации иммунной системы in vivo в результате эндогенной антигенной стимуляции, возможно опосредованной продуктами распада мышечной ткани, является важным фактором нарушения Т-звена иммунитета при длительном ограничении подвижности.
Таким образом, результаты исследований показали, что при длительном пребывании здоровых добровольцев в условиях АНОГ возникают негативные сдвиги в системе иммунитета, проявляющиеся на уровне процессов активации и способности иммуноцитов к дифференцировке.
1.3. Эксперимент с 520-суточной изоляцией, моделирующей элементы межпланетной экспедиции к Марсу. В ходе эксперимента отрабатывались принципы, методы и аппаратура для автономного обеспечения марсианской экспедиции, включая новые методы и средства профилактики неблагоприятного действия факторов межпланетного полета (Григорьев А.И., Моруков Б.В., 2011). Результаты иммунологических исследований показали, что наиболее выраженными и закономерно наблюдающимися уже после 120 суток пребывания в условиях изоляции являются изменения в системе TLR. которые связаны со значительным снижением абсолютного содержания TLR2+-, TLR4+- и TLR6+CD14+-клеток в периферической крови (рис. 2А) и процентного содержания TLR2+-, TLR4+- и TLR6+-клеток среди CD14+-Мн, а также снижение абсолютного и процентного содержания в периферической крови НГ, экспрессирующих эти рецепторы. В то же время на протяжении всего периода экспериментального воздействия лиганд TLR4 ЛПС оказывал выраженное стимулирующее действие на выработку цитокинов (рис. 2Б), что свидетельствует о высокой функциональной активности системы TLR врожденного иммунитета. Следует отметить, что в условиях изоляции изменения количества Мн и НГ, экспрессирующих TLR, имели волнообразный характер. Учитывая тот факт, что TLR непосредственно и специфически взаимодействуют со стереотипными и консервативными в эволюции молекулами микроорганизмов, присущие одновременно большим систематическим группам микробов (pathogen-associated molecular patterns, PAMP) [Medzhitov R., 2007], можно с большой долей вероятности предположить, что отмеченные особенности изменений в системе TLR обусловлены волнообразным характером периодов активации и стагнации условно-патогенной микрофлоры.
Анализ фагоцитарной активности Мн выявил повышение на 10-15% этого показателя на 168 сутки изоляции. Однако, в дальнейшем, происходило её постепенное уменьшение. Динамика фагоцитарной активности НГ несколько отличалась от моноцитарной и имела статистически значимое повышение на 168, 248 и 360 сутки изоляции. Таким образом, исследование одной из эффекторных функций клеточных факторов естественной резистентности – поглотительной способности, позволило установить, что характерной чертой адаптационной перестройки системы врожденного
иммунитета в условиях длительного пребывания в гермообъекте является высокая активность фагоцитирующих клеток.
Рис.2. Динамика показателей врожденного и адаптивного иммунитета у добровольцев-испытателей в эксперименте с 520-суточной изоляцией в гермообъекте с искусственной средой обитания: А - процентное содержание клеток, экспрессирующих на своей мембране рецепторы TLR2+, TLR4+, TLR6+, среди CD14+-моноцитов; Б – продукция цитокинов мононулеарными клетками периферической крови в ответ на стимуляцию ЛПС в 24-часовых культурах клеток in vitro; В- содержание ЕК-лимфоцитов в периферической крови; Г - содержание ЕК – лимфоцитов, экспрессирующих ранний маркер активации CD69 в 18-часовых нестимулированных и стимулированных ИЛ-2 культурах клеток Д – содержание В – лимфоцитов, экспрессирующих ранний маркер активации CD69 в 18-часовых культурах клеток в присутствии МЛ; содержание Т – лимфоцитов, экспрессирующих ранний маркер активации CD69 в 18-часовых культурах клеток в присутствии ФГА; содержание Т – лимфоцитов, экспрессирующих маркер активации CD25 в 48-часовых культурах клеток в присутствии ФГА; Е – продукция цитокинов мононулеарными клетками периферической крови в ответ на стимуляцию ФГА в 48-часовых культурах клеток in vitro.
* - Достоверное различие с исходным уровнем, р <0.05.
Анализ результатов, полученных при изучении состояния системы естественной цитотоксичности, показал, что, начиная с 12-ти месяцев пребывания в гермообъекте и
заканчивая 7-ми сутками восстановительного периода, у испытателей-добровольцев наблюдалось значительное уменьшение не только относительного, но и абсолютного содержания в периферической крови зрелых циркулирующих CD3-CD16+CD56+-лимфоцитов (рис. 2В). Исследование особенностей фенотипа ЕК позволило установить, что выявленные изменения были связаны со снижением уровня в периферической крови как подкласса ЕК-лимфоцитов, экспрессирующих мембранную молекулу CD16, так и подкласса ЕК-лимфоцитов, экспрессирующих мембранную молекулу CD56. На заключительном этапе экспериментального воздействия у большинства обследованных наблюдалось преимущественно уменьшение содержания лимфоцитов, относящихся к субтипу ЕК-лимфоцитов с высокой цитолитической активностью (CD56+CD16+ЕК- клеток), а не субтипов ЕК-лимфоцитов, имеющих умеренную и низкую цитолитическую активность (CD16-CD56+ - и CD16+CD56- -ЕК-клетки). Таким образом, перестройка системы естественной цитотоксичности в ответ на воздействие факторов пребывания в условиях гермообъекта, влияющих, в частности, на взаимоотношения организма с представителями, как экзогенной микрофлоры, так и аутомикрофлоры, потребовала определенного напряжения этой системы, о чем свидетельствует изменение уровня эффекторных клеток в периферической крови у большинства обследуемых.
При изучении экспрессии раннего активационного маркера CD69 на CD56+-лимфоцитах в нестимулированных и стимулированных ИЛ-2 18-часовых культурах клеток к 4-му месяцу пребывания в экспериментальных условиях наблюдалось снижение экспрессии СD69 на ЕК-лимфоцитах как в отсутствии стимуляции, так и при культивировании в присутствии ИЛ-2 (рис. 2Г). Такой феномен может отражать не только снижение функциональной потенции ЕК-клеток, но и свидетельствовать об истощении резервных возможностей системы естественной цитотоксичности.
Изучение количественных характеристик клеточных факторов адаптивного иммунитета показало, что после 8 месяцев пребывания в условиях экспериментального воздействия наблюдалось значительное увеличение доли CD4+- клеток в популяции Т-лимфоцитов, связанное, с увеличением уровня как «наивных» CD4+-Т-клеток (CD4+CD45RA+), так и CD4+-Т-клеток памяти (CD4+CD45RО+). Повышение относительного и абсолютного содержания CD3+CD4+-лимфоцитов в периферической крови, по-видимому, связано со сдвигом равновесия системы в сторону интенсификации образования факторов, стимулирующих иммунные реакции. В 50% наблюдений также в отдельные периоды пребывания в гермообъекте наблюдалось повышение относительного и/или абсолютного содержания CD4+CD25+bright –лимфоцитов.
После года пребывания в гермообъекте и до окончания воздействия отмечалось повышение способности Т- и В-лимфоцитов экспрессировать на своей поверхности ранний активационный маркер CD69, а также повышение ФГА-индуцированной продукции цитокинов мононуклеарными клетками периферической крови (рис 2Д, рис. 2Е). Отличительной особенностью цитокинового профиля на этапе, соответствующему по сценарию эксперимента возвращению экипажа на Землю, являлось развитие дисбаланса цитокинов в сторону Th2 гуморального иммунного ответа, о чем свидетельствует снижение соотношения ИФН, являющегося маркером клеточно-опосредованных иммунных реакций Th1, к ИЛ-10, являющегося маркером гуморальных иммунных реакций Th2.
Таким образом, использование функционального подхода к оценке адаптивного иммунитета позволило установить, что для поддержания гомеостаза в условиях длительного воздействии на организм человека комплекса факторов изоляции в гермообъекте требуется высокая степень напряжения клеточных факторов этого звена иммунной системы. Выраженные признаки активной мобилизации механизмов адаптивного иммунитета наблюдались на заключительном этапе эксперимента. Такой характер сдвигов свидетельствует о том, что в этот период произошел переход функциональной активности иммунокомпетентных клеток на новый уровень, соответствующий условиям длительной изоляции в гермообъекте.
2. Исследование системы иммунитета человека при воздействии факторов космического полета
2.1. Влияние факторов космического полета на систему образраспознающих рецепторов врожденного иммунитета. Анализ результатов, полученных при оценке экспрессии TLR Мн и НГ периферической крови у членов экипажей экспедиций на МКС выявил высокую вариабельность и разнонаправленную динамику этих параметров (рис. 3). Так, у 5 космонавтов на 1-е сутки после возвращения на Землю было отмечено повышение относительного содержания в периферической крови Мн и НГ, экспрессирующих на своей поверхности TLR (рис. 3, группа А). В то же время у 9 космонавтов в раннем периоде реадаптации, напротив, наблюдалось снижение содержания в периферической крови клеточных факторов врожденного иммунитета, экспрессирующих эти рецепторы (рис. 3, группа Б).
Рис.3. Показатели врожденного иммунитета у космонавтов на 1-е сутки после завершения длительных космических полетов (процент от предполетного уровня).
Исследование уровня HSP70 выявило на 1-е сутки после приземления значительное повышение концентрации HSP70 (р<0,05).
Анализ результатов, полученных при оценке уровня HSP70 и количества клеток врожденного иммунитета, экспрессирующих TLR, в периферической крови космонавтов, отчасти проливает свет на роль стресса в изменении функции иммунной системы космонавтов в раннем периоде реадаптации к земным условиям после завершения длительных космических полетов. Общеизвестно, что при воздействии на организм различных стрессовых факторов, включая физические и психологические, инфекционные, токсические, происходит массивная экспрессия и возрастание уровня HSP, в частности HSP70 [Wendling U., Paul L., van der Zee R. et al., 2000], оказывающего протективное действие на клетки моноцитарно-гранулоцитарного ряда, и как следствие этого повышение количества Мн и НГ, экспрессирующих на своей поверхности TLR. Таким образом, возможно, что выявленное увеличение в периферической крови космонавтов количества Мн и НГ, экспрессирующих сигнальные образраспознающие рецепторы, является ответной реакцией системы врожденного иммунитета на стресс-факторы заключительного этапа полета. В то же время наиболее вероятной причиной отмеченного в раннем послеполетном периоде у части обследованных космонавтов уменьшения количества МН и НГ, экспрессирующих TLR2, TLR4 и TLR6 рецепторы, может быть истощение костномозгового пула.
Анализ одного из характеризующих функциональное состояние TLR показателей – продукции цитокинов клетками периферической крови в ответ на лиганд TLR4 ЛПС in vitro, показал, что в раннем периоде реадаптации к земным условиям после завершения длительных космических полетов, в супернатантах, полученных при 24-часовой инкубации мононуклеарных клеток, наблюдалась тенденция к снижению синтеза провоспалительных цитокинов (ИЛ-1, ИЛ-6, ИЛ-8, ФНО), причем глубина выявленных изменений не зависела от уровня в периферической крови моноцитов и гранулоцитов, экспрессирующих на своей поверхности CD14/TLR4 рецепторный комплекс (рис. 4). Такое снижение могло бы быть объяснено увеличением ЛПС-индуцированного синтеза ИЛ-10, однако, проведённые исследования наглядно продемонстрировали также снижение и этого показателя на первые сутки после завершения длительных космических полетов.
Рис. 4. Продукция цитокинов мононуклеарными клетками периферической крови космонавтов до и после длительных космических полетов на МКС: I – продукция цитокинов в 18-часовых нестимулированных культурах клеток; II – продукция цитокинов в 18-часовых ЛПС- стимулированных культурах клеток.
Результаты, полученные при изучении содержания в периферической крови обследованных космонавтов Мн и НГ, экспрессирующих на своей мембране эндоцитозные (маннозный рецептор – CD206, скавенджер рецептор – CD36, интегрины – CD11b/CD18) PRR, а также рецептор цитотоксичности (CD16) и активационные молекулы (CD24 и CD54), свидетельствуют об индивидуальном характере изменений фенотипа этих популяций клеток в раннем послеполетном периоде (рис. 3).
Таким образом, процесс адаптации системы PRR врожденного иммунитета к комплексу факторов длительного космического полета реализуется через полиморфные изменения системы TLR клеточных факторов врожденного иммунитета. Активизацию работы системы врожденного иммунитета, осуществление ее на качественно ином уровне, по-видимому, следует считать признаком адаптационной перестройки организма в ответ на длительное комплексное воздействие неблагоприятных факторов, направленных на сохранение иммунного гомеостаза. Однако в ряде случаев выявленное снижение функциональной активности иммунокомпетентных клеток может быть расценено не только как один из признаков перенапряжения и истощения функциональных резервов системы врожденного иммунитета космонавта к условиям космического полета, но и признаком состояния «риска» развития вторичного иммунодефицита.
2.2. Влияние факторов космического полета на систему естественной цитотоксичности. Анализ изменений параметров, характеризующих систему естественной цитотоксичности, показал, что по усредненным данным на первые и седьмые сутки после возвращения на Землю наблюдалось существенное снижение индекса цитотоксичности (ИЦ) ЕК (рис. 5). Однако анализ динамики индивидуальных значений ИЦ выявил несколько типов реакции системы естественной цитотоксичности на условия длительных космических полетов: уменьшение цитотоксической активности на первый день после приземления с тенденцией к увеличению показателя до предполетного уровня на 7 сутки периода реадаптации; отсутствие снижения цитотоксической активности на первый день после приземления и значительное угнетение цитотоксической активности на 7 сутки периода реадаптации; уменьшение цитотоксической активности на 1-7 день после полета; увеличение цитотоксической активности на первый день после приземления с тенденцией возвращения значения показателя к предполетному уровню в более поздние сроки обследования. Важно отметить, что у некоторых членов экипажей даже после 12 или 15 месяцев полета, функциональная активность ЕК-лимфоцитов была высокой, по крайней мере, во все послеполетные периоды обследования. Эти результаты указывают на то, что при достаточном запасе функциональных резервов иммунная система (или некоторые ее компоненты) может адаптироваться к длительному влиянию микрогравитации. Однако следует отметить, что анализ индуцированной ИЛ-2 экспрессии поверхностного клеточного маркера CD69 на ЕК-клетках периферической крови 17 космонавтов показал, что после завершения длительных полетов на борту МКС у всех обследованных наблюдалось значительное уменьшение доли клеток, экспрессирующих этот ранний активационный маркер, свидетельствующее о снижении функциональных резервов клеточных факторов естественной цитотоксичности.
Рис. 5. Функциональная активность ЕК-лимфоцитов и экспрессия раннего маркера активации CD69 на CD69+-ЕК-лимфоцитах.
У космонавтов, совершивших космические полеты на Международной космической станции (МКС), наряду с изучением функциональной активности исследовались и фенотипические особенности ЕК периферической крови космонавтов. Показано, что в значительной части наблюдений угнетение цитотоксической активности отмечалось на фоне уменьшения процента циркулирующих ЕК с фенотипом CD3-CD56+CD16+. Однако снижение цитотоксической активности ЕК клеток после космического полета нельзя связывать только с изменением количества циркулирующих
Таблица 2. Показатели системы естественной цитотоксичности у космонавтов до и после космических полетов на МКС (М±m; медиана; нижний – 25% и верхний –75%, квартили)
| Показатели | Длительные полеты | Короткие полеты | ||||
| До полета | 1 сут | 7 сут | До полета | 1 сут | ||
| CD3-CD16+CD56+, | отн., % | 14,5±0,87; 15; 9-18 | 10,3±0,92*; 10; 7-12 | 11,5±0,72*; 11; 9-15 | 22,8±3,07; 24; 14-28 | 13,6±1,37*; 14; 9-17 |
| абс., х109/л | 0,278±0,0234; 0,26; 0,16-0,37 | 0,251±0,0229; 0,22; 0,16-0,32 | 0,234±0,0187*; 0,23; 0,15-0,30 | 0,398±0,0287; 0,17; 0,32-0,48 | 0,273±0,0346*; 0,18; 0,19-0,35 | |
| CD16+, | отн., % | 15,2±1,29; 15; 10-19 | 9,1±1,52*; 8; 4-12 | 11,6±1,43*; 10; 6-16 | 24,0±4,84; 23; 15-35 | 14,0±1,79; 15; 11-16 |
| абс., х109/л | 0,302 0,0349; 0,30; 0,20-0,39 | 0,225 0,0344; 0,20; 0,08-0,34 | 0,243 0,0352*; 0,21; 0,13-0,35 | 0,397±0,0688; 0,39; 0,33-0,53 | 0,285±0,0490; 0,26; 0,25-0,35 | |
| CD16+CD56+, | отн., % | 11,5±1,06; 12; 7-14 | 5,7±0,83*; 6; 2-9 | 8,4±1,15*; 7; 4-12 | 21,4±4,26; 21; 13-31 | 11,8±1,93*; 12; 8-15 |
| абс., х109/л | 0,225±0,0254; 0,19; 0,13-0,30 | 0,143±0,0241*; 0,11; 0,05-0,23 | 0,169±0,0236*; 0,16; 0,07-0,24 | 0,354±0,0604; 0,36; 0,28-0,47 | 0,239±0,0162*; 0,24; 0,19-0,28 | |
| CD16-CD56+, | отн., % | 9,0±1,01; 7; 5-11 | 8,0±0,82; 8; 5-12 | 8,4±1,01; 7; 5-12 | 5,6±1,57; 4; 4-7 | 4,6±0,68; 4; 4-5 |
| абс., х109/л | 0,170±0,0219; 0,12; 0,09-0,22 | 0,189±0,0290; 0,17; 0,09-0,24 | 0,173±0,0284; 0,13; 0,09-0,22 | 0,093±0,0233; 0,09; 0,06-0,12 | 0,090±0,0108; 0,09; 0,07-0,11 | |
| CD16+CD56-, | отн., % | 3,7±0,61; 2; 1-6 | 3,5±1,07; 2; 1-5 | 3,1±0,76; 2; 1-4 | 2,6±0,68; 2; 2-3 | 2,2±0,37; 2; 2-3 |
| абс., х109/л | 0,077±0,0147; 0,05; 0,02-0,12 | 0,080±0,0193; 0,05; 0,02-0,12 | 0,073±0,0210; 0,03; 0,02-0,11 | 0,043±0,0099; 0,04; 0,03-0,05 | 0,046±0,0106; 0,05; 0,03-0,07 | |
| CD56+, | отн., % | 20,5±1,28; 19; 17-25 | 13,4±1,03*; 12; 11-16 | 16,3±1,47*; 15; 11-21 | 26,8±3,25; 28; 22-33 | 16,4±1,36*; 16; 14-19 |
| абс., х109/л | 0,395±0,0340; 0,41; 0,24-0,51 | 0,327±0,0425*; 0,29; 0,20-0,38 | 0,334±0,0113*; 0,30; 0,19-0,42 | 0,444±0,0398; 0,48; 0,37-0,50 | 0,328±0,0398*; 0,31; 0,30-0,37 | |
| CD8+CD56+, | отн., % | 11,0±1,18; 8; 6-15 | 8,6±0,91*; 7; 6-12 | 9,4±1,25*; 8; 5-14 | 26,8±3,25; 28; 22-33 | 16,4±1,36*; 16; 14-19 |
| абс., х109/л | 0,213±0,0270; 0,18; 0,13-0,27 | 0,219±0,0330; 0,17; 0,11-0,29 | 0,211±0,0376*; 0,14; 0,10-0,28 | 0,444±0,0398; 0,48; 0,37-0,50 | 0,328±0,0398*; 0,31; 0,30-0,37 | |
| CD11b+CD56+, | отн., % | 13,9±0,96; 14; 10-18 | ||||
| 9,3±0,93*; 9; 6-12 |
| 12,3±1,50; 11; 7-16 |
| 26,8±3,25; 28; 22-33 |
| 16,4±1,36*; 16; 14-19 | ||||||
| абс., х109/л | 0,266±0,0248; 0,24; 0,18-0,35 | 0,236±0,0374; 0,19; 0,13-0,29 | 0,247±0,0442*; 0,17; 0,14-0,33 | 0,444±0,0398; 0,48; 0,37-0,50 | 0,328±0,0398*; 0,31; 0,30-0,37 |
* -Достоверное различие с фоном (р<0,05)
ЕК. В частности, отмечены два варианта изменений уровня ЕК в периферической крови. Первый - процент CD3-CD56+CD16+-лимфоцитов не изменялся или даже увеличивался по сравнению с предполетными значениями, а функциональная активность ЕК была снижена. Второй - процент CD3-CD56+CD16+-лимфоцитов значительно уменьшался, однако цитотоксическая активность этих клеток существенно превышала предполетный уровень. Анализ фенотипических особенностей ЕК показал, что в раннем периоде реадаптации наблюдалось снижение содержания в периферической крови CD56+- клеток (как CD56+dim -, так и CD56+bright –клеток) и CD16+-клеток, связанное преимущественно с уменьшением уровня лимфоцитов, относящихся к субтипу CD56+CD16+ЕК- клеток, а не к субтипам CD16-CD56+ - и CD16+CD56- - клеток (табл. 2).
До настоящего времени остается неясным вопрос - происходят ли изменения ЕК уже во время полета или эти изменения вызваны исключительно действием на организм человека факторов посадки. Сравнение данных, полученных после коротких и длительных полетов, может пролить свет на понимание различий и взаимодействие между мультифакторным стрессом, связанным непосредственно с космическим полетом и стрессом, связанным с этапом приземления. Результаты исследований, проводившихся в предполетном периоде и после завершения коротких полетов (8-10 суток), выявили в раннем периоде реадаптации к земным условиям у некоторых из обследованных космонавтов уменьшение функциональной активности ЕК, снижение содержания ЕК в периферической крови и подавление способности ЕК к активации в ответ на стимуляцию ИЛ-2 в раннем периоде реадаптации к земным условиям. Следует отметить, что американскими исследователями у астронавтов, совершивших космические полеты продолжительностью 4-16 суток, также было отмечено угнетение цитотоксической активности и содержания в периферической крови ЕК [Tipton C.M., Greenleaf J.E., Jackson C.G., 1996; Sonnenfeld G., Shearer W.T., 2002; Mehta S.K., Kaur I., Grimm E.A. et al., 2001; Mills P.J., Meck J.V., Waters W.W. et al., 2001; Borchers A.T., Keen C.L., Gershwin M.E., 2002; Crucian B.E., Stowe R.P., Pierson D.L., Sams C.F., 2008 ]. Эти данные подтверждают, что стресс, который испытывают космонавты во время приземления (т.е. острый ответ на возвращение и реадаптацию к условиям земной гравитации), может вносить существенный вклад в ослабление функции ЕК-клеток. По всей видимости, эти изменения являются результатом действия совокупности многих факторов, включая нейропептидные гормоны, катахоламины (в особенности глюкокортикоиды) и др. [Meehan R., Whitson P., Sams C., 1993; Stowe R.P., Sams C.F., Pierson D.L., 2003]. Однако только исследования, проведенные непосредственно на борту орбитальной станции, позволят составить представление о реакции системы естественной цитотоксичности на условия космического полета. Создание новой методологии слежения за иммунологической резистентностью во время космического полета невозможно без предварительного исследования эффектов микрогравитации на изолированные иммунокомпетентные клетки. Изучение цитотоксической активности изолированных лимфоцитов крови человека при совместном культивировании с суспензионной линией человеческих эритролейкемических лимфобластоидных клеток К-562 в условиях микрогравитации было проведено в рамках космического эксперимента «Межклеточное взаимодействие». Этот эксперимент, выполненный российскими членами основных экипажей МКС-7-12, является первым и пока единственным осуществленным экспериментом, направленным на изучение влияния микрогравитации на ЕК. Для проведения исследований на борту МКС в ГНЦ РФ ИМБП РАН разработана модификация технологии с использованием культуры лимфоцитов человека и суспензионной культуры клеток-мишеней применительно к условиям на борту орбитальной космической станции, а также специальная укладка «ФИБРОБЛАСТ-1», предназначенная для доставки на борт МКС биологического материала и оборудования, необходимого для выполнения космонавтами во время космического полета основных операций, предусмотренных программой эксперимента [Буравкова Л.Б. и соавт., 2004; 2005; 2006]. Полученные экспериментальные данные показали, что в условиях микрогравитации ЕК сохраняли способность оказывать in vitro цитотоксическое действие на клетки-мишени (табл. 3).
Необходимо отметить разную степень выраженности эффекта активации цитотоксической активности в условиях микрогравитации у различных доноров. В ряде случаев отмечалось лишь незначительное повышение данного показателя от 2,5 до 25,8% у четырех обследуемых доноров. В то же время в остальных шести случаях наблюдалось довольно существенное повышение цитотоксического индекса в условиях космического полета по сравнению с наземным контролем (от 53,3% до 171,7%), что может свидетельствовать о весьма широких индивидуальных особенностях клеток – ЕК, различных доноров.
Таким образом, проведенные исследования позволили получить ответ на принципиально важный вопрос: возможен ли контакт между лимфоцитом-естественным киллером и клеткой-мишенью в условиях микрогравитации. Установлено, что фактор микрогравитации не оказывал угнетающего влияния на функцию лимфоцитов-ЕК, более того, в половине полетных экспериментов наблюдалось даже существенная активация
Таблица 3. Цитотоксическая активность лимфоцитов, выделенных из периферической крови здоровых доноров при совместном культивировании с опухолевыми миелобластами линии К-562 в условиях микрогравитации
| Донор | % ЕK-клеток | Индекс цитотоксичности | Активация (%) | |
| контроль | полет | |||
| Донор 1 (МКС-8) | 16.3 | 9,7 | 12,2 | 125.8 |
| Донор 2 (МКС-9) | 26.1 | 16,2 | 32,0 | 197.5 |
| Донор 3 (МКС-9) | 12.8 | 25,0 | 44,2 | 176.8 |
| Донор 4 (МКС-10) | 10.0 | 26,5 | 31,5 | 118.9 |
| Донор 5 (МКС-10) | 20.4 | 11,4 | 18,7 | 164.0 |
| Донор 6 (МКС-10) | 15.1 | 11,6 | 31,5 | 271.7 |
| Донор 7 (МКС-11) | 15.5 | 26,8 | 29,3 | 109.3 |
| Донор 8 (МКС-11) | 18.0 | 15,7 | 16,1 | 102.5 |
| Донор 9 (МКС-12) | 16.5 | 18,4 | 28,2 | 153.3 |
| Донор 10 (МКС-12) | 6.7 | 12,7 | 15,1 | 118.9 |
| M+m | 15.7+3.7 | 17.4+5.4 | 25.9+8.3 | 153.9+38.9 |
функциональной активности ЕК. Полученные данные свидетельствуют о возможности проведения мониторинга функционального состояния ЕК, а разработанная методика и специальная укладка («Фибробласт-1») могут явиться прообразом новой методологии.
2.3. Влияние факторов космического полета на систему адаптивного иммунитета
В-звено адаптивного иммунитета. Результаты исследований количественных характеристик В-лимфоцитов показали, что по усредненным данным на 1-е сутки после завершения как коротких, так и длительных экспедиций наблюдалось не только увеличение абсолютного и относительного CD19+- и CD20+-клеток, но и клеток, имеющих фенотип CD23+ (табл. 4). Одновременно с этим определение активационного потенциала В-клеток в нагрузочном тесте с адекватным митогеном (митоген лаконоса) позволил выявить повышение содержания CD19+-лимфоцитов, экспрессирующих ранний маркер активации CD69. В частности, анализ индивидуальных данных выявил повышение этого показателя на 26,6–166,6% по сравнению с предполетными величинами более чем у половины обследованных. В то же время уровень иммуноглобулинов классов А, М и G в сыворотке крови космонавтов существенно не изменялся.
Т-звено адаптивного иммунитета. Результаты исследований функциональной полноценности Т-клеточного звена адаптивной иммунной системы членов экипажей длительных экспедиций на МКС (125 - 215 суток) показали, что в раннем периоде реадаптации к условиям Земли в 65% наблюдений отмечалось угнетение
Таблица 4. Показатели В-звена иммунитета у космонавтов до и после космических полетов на МКС (М±m; медиана; нижний – 25% и верхний –75%, квартили)
| Показатели | Длительные полеты | Короткие полеты | ||||
| До полета | 1 сут | 7 сут | До полета | 1 сут | ||
| CD19+, | отн., % | 10,0±0,56; 9; 8-12 | 12,8±0,69*; 13; 10-15 | 11,0±0,54*; 11; 9-13 | 10,0±1,11; 11; 8-11 | 14,0±1,46*; 14; 10-17 |
| абс., х109/л | 0,190±0,0148; 0,19; 0,12-0,24 | 0,302±0,0161*; 0,31; 0,24-0,35 | 0,233±0,0174*; 0,24; 0,16-0,26 | 0,183±0,0353; 0,15; 0,11-0,28 | 0,269±0,0500*; 0,21; 0,16-0,38 | |
| CD20+, | отн., % | 10,4±0,75; 11; 8-12 | 13,7±0,88*; 12; 11-16 | 11,4±0,68; 11; 10-13 | 10,3±2,59; 11; 6-15 | 14,3±2,84; 15; 10-19 |
| абс., х109/л | 0,192±0,0148; 0,20; 0,14-0,23 | 0,306±0,0207*; 0,29; 0,25-0,33 | 0,222±0,0186; 0,22; 0,15-0,26 | 0,110±0,0428; 0,07; 0,06-0,16 | 0,170±0,0999; 0,07; 0,06-0,27 | |
| CD19+CD23+, | абс., х109/л | 7,5±0,98; 7; 6-9 | 9,6±0,63*; 9; 8-11 | 8,6±0,72*; 8; 7-10 | 9,3±2,60; 9; 5-14 | 12,0±3,61; 10; 7-19 |
| отн., % | 0,142±0,0148; 0,15; 0,11-0,18 | 0,232±0,0150*; 0,21; 0,18-0,29 | 0,167±0,0159; 0,19; 0,12-0,21 | 0,151±0,0466; 0,14; 0,08-0.24 | 0,237±0,1054; 0,15; 0,11-0.45 | |
| CD19+ CD69+, | % в нестимулированных 18-часовых культурах лимфоцитов, | 0,65±0,200; 0,5; 0,3-0,7 | 0,52±0,122; 0,6; 0,1-1,0 | 0,58±0,131; 0,5; 0,3-1,0 | 0,42±0,201; 0,3; 0,0-1,0 | 0,80±0,163; 1,0; 0,8-1,0 |
| % в стимулированных МЛ 18-часовых культурах лимфоцитов, | 7,02±0,538; 7; 5-9 | 9,38±1,144*; 9; 6-11 | 8,06±1,063; 7; 6-8 | 5,83±0,791; 5,7; 4,0-8,0 | 8,33±1,409; 7,1; 6,0-9,0 | |
| IgA | г/л | 2,10±0,248; 2,2; 1,3-2,6 | 2,03±0,188; 2,1; 1,7-2,5 | 2,20±0,261; 2,3; 1,3-3,0 | 1,85±0,144; 1,6; 1,4-2,3 | 1,99±0,181; 2,0; 1,4-2,3 |
| IgM | г/л | 1,37±0,228; 1,3; 0,8-1,5 | 1,23±0,183; 1,0; 0,7-1,7 | 1,30±0,148; 1,5; 0,9-1,7 | 1,25±0,122; 1,1; 0,9-1,4 | 1,20±0,087; 1,0; 1,0-1,5 |
| IgG | г/л | 10,11±0,711; 10,3; 8,6-12,0 | 10,38±0,606; 10,7; 9,6-11,1 | 10,38±0,391; 10,3; 9,9-10,8 | 11,29±0,478; 11,1; 9,8-12,9 | 10,61±0,365; 11,0; 9,3-11,5 |
* -Достоверное различие с фоном (р<0,05)
Таблица 5. Показатели субпопуляционного состава Т-лимфоцитов периферической крови космонавтов до и после космических полетов на МКС (М±m; медиана; нижний – 25% и верхний –75%, квартили )
| Показатели | Длительные полеты | Короткие полеты | ||||
| До полета | 1 сут | 7 сут | До полета | 1 сут | ||
| CD3+, | отн., % | 73,2±1,25; 72; 69-78 | 76,1±0,98*; 77; 73-78 | 75,6±1,05*; 77; 72-79 | 67,8±2,80; 67; 60-73 | 70,6±2,49; 69; 63-75 |
| абс., х109/л | 1,393±0,0697; 1,39; 1,13-1,66 | 1,886±0,1190*; 1,81; 1,44-2,33 | 1,589±0,1060; 1,52; 1,10-1,92 | 1,290±0,2810; 0,96; 0,87-1,32 | 1,448±0,2554; 1,34; 1,03-1,53 | |
| CD3+CD4+, | отн., % | 43,7±1,42; 42; 37-49 | 49,8±1,37*; 48; 44-55 | 46,9±1,36*; 48; 41-51 | 42,3±2,49; 40; 38-46 | 45,8±1,34; 47; 42-48 |
| абс., х109/л | 0,808±0,0409; 0,80; 0,63-1,00 | 1,220±0,0732*; 1,23; 0,95-1,52 | 0,972±0,0649*; 0,91; 0,72-1,20 | 0,828±0,1979; 0,63; 0,59-0,76 | 0,948±0,1606; 0,82; 0,72-1,05 | |
| CD3+CD8+, | отн., % | 24,7±1,15; 23; 20-28 | 23,0±1,08*; 22; 19-27 | 24,1±0,99*; 24; 20-26 | 20,8±1,45; 19; 18-25 | 20,8±1,55; 21; 17-22 |
| абс., х109/л | 0,477±0,0355; 0,47; 0,30-0,62 | 0,581±0,0529*; 0,53; 0,41-0,65 | 0,675±0,1674; 0,47; 0,37-0,68 | 0,360±0,0621; 0,30; 0,25-0,44 | 0,395±0,0515; 0,41; 0,27-0,47 | |
| CD3+CD25+, | отн., % | 13,5±1,93; 12; 6-17 | 13,9±2,17; 12; 5-18 | 12,6±2,04; 12; 6-15 | 2,2±0,28; 2; 2-3 | 2,0±0,31; 2; 1-2 |
| абс., х109/л | 0,229±0,0296; 0,21; 0,10-0,30 | 0,328±0,0609; 0,22; 0,15-0,39 | 0,254±0,0467; 0,18; 0,11-0,35 | 0,041±0,0089; 0,03; 0,02-0,05 | 0,038±0,0053; 0,05; 0,02-0,05 | |
| CD4+CD25+bright, | отн., % | 1,75±0,162; 1,6; 1,1-2,2 | 2,13±0,156*; 2,0; 1,4-2,7 | 1,69±0,186; 1,5; 1,3-2,0 | 2,01±0,598; 1,9; 1,2-2,8 | 1,43±0,309; 1,5; 0,9-2,0 |
| абс., х109/л | 0,0311±0,00252; 0,029; 0,021-0,040 | 0,0524±0,00597*; 0,048; 0,034-0,065 | 0,0342±0,00401; 0,030; 0,023-0,043 | 0,034±0,0093; 0,035; 0,019-0,049 | 0,020±0,0091; 0,015 0,008-0,032; | |
| CD4+CD45RA, | отн., % | 16,3±1,64; 16; 9-20 | 18,2±1,48; 19; 13-25 | 19,2±2,01; 18; 10-27 | 21,3±5,94; 20; 13-24 | 21,5±5,28; 22; 13-29 |
| абс., х109/л | 0,305±0,0333; 0,30; 0,15-0,36 | 0,420±0,378*; 0,40; 0,28-0,60 | 0,360±0,0354; 0,35; 0,23-0,44 | 0,529±0,2597; 0,32; 0,27-0,41 | 0,540±0,2091; 0,36; 0,25-0,68 | |
| CD4+CD45RО, | отн., % | 32,5±2,08; 34; 24-42 | 37,9±2,22*; 40; 30-46 | 35,7±2,95; 34; 27-46 | 37,2±1,98; 40; 34-40 | 46,6±1,50; 44; 43-45 |
| абс., х109/л | 0,634±0,0710; 0,60; 0,46-0,71 | 0,858±0,1069*; 0,70; 0,54-1,18 | 0,638±0,0790; 0,58; 0,43-0,81 | 0,638±0,0732; 0,60; 0,54-0,68 | 0,897±0,0979*; 0,94; 0,69-1,02 | |
| CD8+CD38+, | отн., % | 19,2±1,67; 18; 14-24 | 14,8±1,56*; 12; 9-20 | 15,5±1,46; 14; 10-22 | 18,2±3,80; 15; 14-26 | 16,0±4,24; 13; 10-19 |
| абс., х109/л | 0,375±0,0425; 0,32; 0,21-0,54 | 0,354±0,0481; 0,25; 0,20-0,44 | 0,318±0,0408*; 0,29; 0,20-0,35 | 0,305±0,0593; 0,31; 0,24-0,42 | 0,307±0,0680; 0,30; 0,16-0,45 | |
* -Достоверное различие с фоном (р<0,05).
пролиферативного ответа Т-лимфоцитов на ФГА в культуре клеток in vitro на 14-55% от исходного уровня. В то же время анализ фактического материала, полученного при определении фенотипических характеристик этой популяции клеток (табл. 5), выявил в послеполетном периоде повышение относительного и абсолютного содержания в периферической крови Т-лимфоцитов (CD3+-клеток). Исследование уровня двух основных субпопуляциий Т-лимфоцитов - CD4+- и CD8+-Т-клеток показало, что в раннем периоде реадаптации к земным условиям относительное содержание Т-клеток, имеющих рецептор CD8, либо не изменялось, либо незначительно снижалось по сравнению с предполетным уровнем. Однако их абсолютное содержание значительно возрастало вследствие увеличения общего количества лейкоцитов в крови. При этом наблюдалось увеличение относительного и абсолютного содержания CD4+-Т-клеток в периферической крови, связанное, вероятно, со сдвигом равновесия системы в сторону интенсификации образования факторов, стимулирующих иммунные реакции. Анализ содержания в периферической крови «наивных» CD4+-Т-клеток (CD4+CD45RA+) и CD4+-Т-клеток памяти (CD4+CD45RО+) позволил отметить, что на 1-е сутки после возвращения на Землю, наблюдалось увеличение относительного и абсолютного содержания CD4+CD45RО+-клеток.
При изучении экспрессии активационных маркеров лимфоцитов (как ранних, так и поздних) после завершения длительных полетов на МКС в раннем периоде реадаптации не было отмечено статистически достоверных изменений относительного и абсолютного содержания в периферической крови Т-клеток, экспрессирующих активационный маркер CD25 (табл. 5). Однако у части обследованных космонавтов наблюдалась выраженная тенденция к увеличению содержания Т-лимфоцитов, имеющих рецептор CD25. Привлекает внимание следующая деталь: у всех обследованных, у которых наблюдалось повышение в периферической крови уровня CD25+-лимфоцитов, было выявлено подавление способности лимфоцитов к пролиферации в ответ на стимуляцию ФГА. Складывается впечатление, что одним из важных факторов нарушения Т-звена иммунитета у космонавтов после длительных космических полетов является усиление экспрессии рецептора CD25 на Т-лимфоцитах, отражающее состояние активации иммунной системы in vivo. В то же время у большинства обследованных в этот период космонавтов содержание Т-лимфоцитов, несущих активационный маркер HLA-DR, а также маркер-рецептор для Fas-зависимого апоптоза CD95, существенно не отличалось от предполетного уровня.
Развитие пролиферативного ответа Т-клетками во многом определяется способностью лимфоцитов к активации. В связи с этим исследование функционального состояния Т-лимфоцитов было дополнено анализом экспрессии раннего активационного маркера CD69 на CD3+-Т-лимфоцитах в 18-часовых культурах нестимулированных и стимулированных ФГА мононуклеарных клеток. Анализ состояния двух важных компонентов жизненного цикла Т-клеток - процессов активации и пролиферации, позволил выявить основные типы реакции Т-звена иммунитета на условия длительного космического полета: снижение способности Т-лимфоцитов к пролиферации со снижением их способности к активации, свидетельствующее о нарушениях в системе иммунитета на уровне процессов активации; снижение способности Т-лимфоцитов к пролиферации с сохранением или увеличением их способности к активации, свидетельствующее о нарушениях в системе иммунитета на уровне процессов пролиферации (рис. 6).
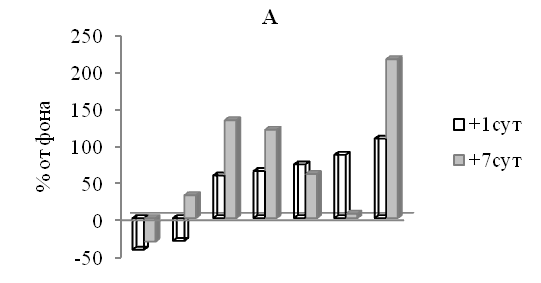


Рис. 6. Показатели активации и пролиферации Т-клеточного звена иммунитета у космонавтов после завершения длительных космических полетов (% от предполетного уровня, индивидуальные данные): А – содержание T-лимфоцитов, экспрессирующих ранний маркер активации CD69 в 18-часовых культурах клеток периферической крови в присутствии ФГА; Б – содержание T-лимфоцитов, экспрессирующих маркер активации CD25 в 48-часовых культурах клеток периферической крови в присутствии ФГА; В – пролиферативная активность Т-лимфоцитов в 48-часовых культурах клеток периферической крови в присутствии ФГА.
По оси ординат – процентное отклонение показателей от фона; вверх от оси абсцисс – повышение показателя; вниз от оси абсцисс – снижение показателя.
Исследование апоптоза иммунокомпетентных клеток космонавтов в до- и послеполетном периоде показало, что после длительного пребывания на борту МКС повышение уровня апоптотических клеток в стимулированных клеточных культурах и снижение ФГА-индуцированной пролиферативной активности, отмечена только у одного из пяти обследованных космонавтов (рис. 7). В то же время у двух космонавтов выявлено однонаправленные изменения этих показателей. Эти данные позволяют предположить, что в отдаленном периоде адаптации к условиям микрогравитации угнетение функциональной активности иммунокомпетентных клеток может быть обусловлено не только повышенным апоптозом, но в значительной степени функциональной неполноценностью не вовлеченных в апоптоз лимфоцитов.
Рис.7. Ранний апоптоз и пролиферативная активность Т-лимфоцитов периферической крови космонавтов в нестимулированных и стимулированных ФГА 48-ч культурах клеток in vitro на 1-е сутки после завершения длительных космических полетов на МКС (% от предполетного уровня, индивидуальные данные).
Анализ продукции Th1- и Th2-цитокинов (ФНО, ИФН, ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-10) и пролиферативной активности Т-лимфоцитов в ответ на адекватную митогенную стимуляцию у членов экипажей длительных экспедиций на МКС позволил отметить, что в раннем периоде реадаптации после завершения полетов продолжительностью 137-191 суток у большинства космонавтов со сниженной пролиферативной активностью наблюдалось повышение способности лимфоцитов к синтезу ИЛ-2 в ответ на стимуляцию ФГА. Учитывая тот факт, что функция ИЛ-2, продуцируемого активированными Т-клетками, состоит в поддержании пролиферации Т-лимфоцитов, активации В-лимфоцитов и ЕК-клеток, выявленные изменения функциональной активности Т-лимфоцитов можно расценивать, как низкую способность клеток отвечать на эндогенные активационные сигналы. Это дает основание предположить, что снижение пролиферативной активности Т-лимфоцитов космонавтов в периоде послеполетной реадаптации определялось не недостатком ИЛ-2, а могло быть связано с таким фактором как увеличение в популяции Т-лимфоцитов клеток, которые не могут пройти весь цикл активации под влиянием митогенов. В то же время практически у всех обследованных космонавтов на 1-е сутки послеполетного периода было отмечено усиление продукции ИЛ-10, что сопровождалось изменением направленности иммунного ответа с переключением его с Th1- на Th2-зависимый, т.е. происходит переход клеточного иммунитета в гуморальный. Возможно, формируемый Th2-цитокинами иммуномедиаторный фон может оказывать негативное влияние на протекторные функции иммунокомпетентных клеток-эффекторов Th1-ответа. Нельзя также исключить, что увеличение продукции ИЛ-10, отражает накопление регуляторных Т-клеток с супрессорной активностью (Tr1).
При изучении регуляторных CD4+-Т-клеток с высокой экспрессией на их поверхности цепи рецептора ИЛ-2 (CD4+CD25+bright) в периферической крови космонавтов после завершения длительных полетов на МКС было отмечено, что на 1-е сутки после приземления у 74% обследованных космонавтов наблюдалось повышение содержания в периферической крови CD4+CD25+bright–клеток. Однако уже на 7-е сутки периода реадаптации этот показатель не отличался от предполетных значений. При этом на 1-е сутки после возвращения космонавтов на Землю между содержанием CD4+CD25+bright –клеток и пролиферативной активностью Т-лимфоцитов выявлены разнонаправленные изменения этих показателей (рис. 8).
Рис. 8. Пролиферативная активность Т-лимфоцитов и процент CD4+CD25+bright –лимфоцитов в периферической крови космонавтов после длительных космических полетов на МКС (% от предполетного уровня).
На основании этих данных можно высказать предположение, что одним из механизмов снижения Т-клеточной пролиферации, наблюдаемой у космонавтов после длительного пребывания в условиях орбитального полета, является накопление пула естественных регуляторных Т-клеток.
Исследования, выполнение после завершения кратковременных полетов продолжительностью 8-10 суток на МКС, показали, что у большинства обследованных космонавтов отмечался ряд признаков активной мобилизации механизмов Т-клеточного звена адаптивного иммунитета, в частности, в 71% наблюдений было выявлено повышение пролиферативной активности Т-лимфоцитов.
Кроме того, при рассмотрении особенности острого периода адаптации к условиям космического полета обращают на себя внимание два следующих наблюдения. Во-первых, на первые сутки после приземления ни у одного из обследованных космонавтов не наблюдалось увеличения относительного и абсолютного содержания в периферической крови CD4+CD25+bright –клеток, ассоциирующихся с появлением супрессорной активности мононуклеарных клеток (табл. 5). Во-вторых, при исследовании ФГА-индуцированной продукции цитокинов Т-лимфоцитами периферической крови космонавтов на 1-е сутки после завершения кратковременных космических полетов, несмотря на то, что также как и после завершения длительных космических полетов на МКС, наблюдались изменения как в сторону повышения, так и снижения содержания ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12р70, ИФН, ФНО и ФНО в супернатантах в 48-часовых культурах клеток, однако определение показателя, выражающего баланс клеточных и гуморальных иммунных реакций, позволило выявить, что для кратковременных полетов, в отличие от длительных экспедиций, было характерно не снижение, а повышение соотношения ИФН/ИЛ-10 и смещение баланса в сторону Тh1-ответа. Эти данные наглядно демонстрируют существенные различия в реагировании иммунокомпетентных клеток периферической крови космонавтов после длительных и коротких космических полетов. Можно предположить, что пребывание в условиях космического полета существенным образом меняет функциональную структуру иммунной системы, сдвигая баланс Th1/Th2 сначала в сторону Th1, а в более отдаленные сроки – в сторону Th2, т.е. на ранних периодах воздействия микрогравитации адаптация иммунной системы осуществляется за счет функциональных резервов Т-клеточного звена адаптивного иммунитета, однако при длительном воздействии на организм факторов космического полета процесс адаптации реализуется за счет функциональных резервов В-клеточного звена адаптивного иммунитета.
Таким образом, использование функционального подхода к оценке адаптивного иммунитета позволило установить, что для поддержания гомеостаза в условиях длительного воздействия на организм человека комплекса факторов космического полета требуется высокая степень напряжения клеточных факторов этого звена иммунной системы. Это означает, что такая важная регуляторная система, как иммунная, для сохранения гомеостаза должна обладать определенными функциональными резервами. Анализ результатов исследований функциональных резервов В- и Т-клеток в ряде нагрузочных тестов с митогенами позволил выявить ряд признаков активной мобилизации механизмов адаптивного иммунитета - повышение способности иммунокомпетентных клеток к активации и продукции цитокинов в ответ на адекватную митогенную стимуляцию, свидетельствующих о том, что произошел переход функциональной активности иммунокомпетентной клетки на новый уровень, соответствующий условиям космических экспедиций. Однако у некоторых из обследованных космонавтов после завершения длительных космических полетов отмечалось значительное уменьшение активационного потенциала и цитокинпродуцирующей способности Т-лимфоцитов, указывающие на перенапряжение и истощение иммунной системы.
3. Особенности баланса иммунной системы при воздействии факторов космического полета
Иммунная система включает в себя многочисленные компоненты, обладающие разными функциями и степенью специфичности к чужеродному, но в целостной иммунной системе они работают как неразрывное сбалансированное единое целое. Очевидно, что между самыми разнообразными показателями, характеризующими различные компоненты иммунной системы, имеются многочисленные статистически выявляемые взаимосвязи как положительные, так и отрицательные [Лебедев К.А., Понякина И.Д., 1989; 1991]. Поэтому в основу изучения системы иммунитета при воздействии на организм человека факторов космического полета с позиции целостного восприятия ее функционирования было положено исследование взаимодействия изученных показателей методом корреляционного анализа.
Использование комплексного подхода при изучении реакций системы иммунитета в раннем периоде адаптации к условиям моделируемой микрогравитации позволило установить, что общее количество достоверных взаимосвязей (р<0,05) между изученными показателями врожденного и адаптивного иммунитета, как на заключительной стадии пребывания в условиях 5-ти, так и 7-ми суточной СИ существенно не отличалось от фоновых значений (рис. 9). Не менее важно, что соотношение между прямыми и обратными связями также практически полностью соответствовало аналогичному показателю, полученному в фоновом периоде. В фоновом периоде и на заключительном этапе пребывания в условиях 5-ти суточной СИ оно составляло соответственно, 1,2 и 1,1, а в фоновом периоде и на заключительном этапе пребывания в условиях 7-ми суточной СИ – 0,96 и 0,98. Эти данные свидетельствуют о сбалансированном функционировании иммунной системы.
Рис.9. Уровень сопряженности параметров системы иммунитета лиц, находившихся в условиях СИ (процент от фоновых значений).
При анализе характера взаимосвязей изученных показателей, характеризующих состояние системы иммунитета лиц, находившихся в условиях 120-суточной АНОГ, было выявлено значительное увеличение общей связанности всего изученного фрагмента системы, выражавшееся в повышении общего количества взаимосвязей и увеличении соотношения между прямыми и обратными связями к концу эксперимента (рис. 10).
Рис.10. Уровень сопряженности параметров системы иммунитета лиц, находившихся в условиях 120-суточной АНОГ: А - уровень сопряженности параметров системы иммунитета и Б - соотношение между прямыми и обратными связями (процент от фоновых значений).
Эти изменения свидетельствуют, с одной стороны, о значительном повышении интегративной кооперации функционирования компонентов иммунной системы, т.е. ее напряженности по сравнению с предэкспериментальным уровнем, а, с другой стороны, о снижении возможностей иммунной системы к поддержанию состояния устойчивого равновесия с помощью обратных связей. Спад связанности параметров и преобладание прямых положительных связей, наблюдаемое на 10-е сутки восстановительного периода после завершения АНОГ, можно расценить как срыв эффективной работы и определенную «потерю» саморегуляции иммунной системы после длительного напряжения, связанного с пребыванием в непривычных условиях среды обитания.
Результаты исследования уровня сопряженности параметров системы иммунитета испытателей-добровольцев, находившихся в течение 520-суток в условиях изоляции в замкнутом гермообъекте с искусственной средой обитания показали, что начиная с четвертого месяца пребывания в условиях изоляции наблюдалось снижение количества сочетаний, в которых параметры достоверно (р0,05) взаимосвязаны (независимо от направления связей) в изученном фрагменте, состоящем из 528 сочетаний, включавших 32 параметра (рис. 11). Необходимо отметить, что снижение корреляционных взаимосвязей на протяжении всего периода пребывания в условиях изоляции происходило в основном за счет снижения количества взаимосвязей в звене врожденного иммунитета, а на заключительном этапе – и за счет снижения количества взаимосвязей между компонентами врожденного и адаптивного звеньев иммунной системы, что еще раз свидетельствуют о неразрывной связи компонентов врожденного и адаптивного иммунитета. В тоже время, в лимфоцитарном звене адаптивного иммунитета, начиная с шестого месяца, количество связей не только не снижалось, но даже несколько повышалось. Поскольку величина связанности компонентов отражает степень напряженности системы, то повышение связанности можно расценивать как наличие "синдрома напряженности" адаптивного звена системы иммунитета. Складывается впечатление, что отсутствие значительных сдвигов ряда иммунологических показателей, характеризующих содержание в периферической крови клеточных факторов адаптивного иммунитета, во время экспериментального воздействия еще не указывает на то, что этот компартмент иммунной системы не претерпевал существенных изменений. По-видимому, эти изменения были достаточно интенсивны, но проявлялись они в основном на другом уровне - уровне системных взаимоотношений компонентов иммунной системы.
Рис.11. Уровень сопряженности параметров системы иммунитета лиц, находившихся в
течение 520-суток в условиях изоляции в замкнутом гермообъекте с искусственной средой обитания: по оси ординат - количество достоверных (р0.05) корреляций между изученными параметрами иммунной системы: I - клеточными факторми адаптивного иммунитета; II - клеточными факторами адаптивного и врожденного иммунитета; III - клеточными факторами врожденного иммунитета; IV - всеми изученными показателями системы иммунитета.
Результаты исследований сопряженности параметров иммунитета у членов экипажей МКС показали, что на первые сутки после завершения коротких космических полетов наблюдалось повышение количества сочетаний, в которых параметры достоверно (р0,05) взаимосвязаны (независимо от направления связей), причем это увеличение происходило как между различными субпопуляциями лимфоцитов (В-, Т- и ЕК-клетками), так и относительным содержанием в периферической крови В- и Т-лимфоцитов с их функциональной активностью (рис. 12). При этом изменялась и направленность корреляционных связей в сторону уменьшения соотношения между прямыми и обратными связями (в 1,6 раза по сравнению с предполетным уровнем).
В то же время на первые сутки после завершения длительных космических полетов не наблюдалось значительных отличий количества корреляционных связей между субпопуляциями В-, Т- и ЕК-лимфоцитами по сравнению с предполетным уровнем (рис. 12). Однако в раннем периоде реадаптации к земным условиям было выявлено ослабление связанности относительного содержания В- и Т- клеток в периферической крови с показателями, характеризующими их спонтанную и митогениндуцированную функциональную активность. Кроме того, через неделю после приземления наблюдалось также снижение количества взаимосвязей между клеточными факторами врожденного и адаптивного звеньев иммунной системы. Не менее важно, что направленность выявленных связей имела выраженную тенденцию к увеличению соотношения между прямыми и обратными связями (в 1,2 и 1,5 раза по сравнению с предполетным показателем на 1-е и 7-е сутки после приземления, соответственно).
Рис. 12. Уровень сопряженности параметров системы иммунитета космогавтов. (процент от предполетного уровня): по оси ординат - количество достоверных (р0.05) корреляций между изученными параметрами иммунной системы: I – субпопуляциями лимфоцитов (Т-, В- и ЕК-клетками); II – субпопуляциями Т-, В-лимфоцитов и показателями, характеризующими их функциональную активность; III - субпопуляциями ЕК-лимфоцитов и показателями, характеризующими их функциональную активность
Завершающий этап полета является не только ответственным, трудным и эмоционально напряженным этапом, но и первым серьезным испытанием для человека после предшествующего пребывания его в микрогравитации, когда при действии перегрузок спуска определяются резервные возможности и «слабые места» организма [Котовская А.Р., 2008]. Поэтому, для успешной адаптации системы иммунитета космонавтов к комплексу факторов этого этапа полета система иммунитета должна обладать определенными функциональными резервами. Отмеченное после завершения кратковременных космических полетов повышение общей связанности параметров, свидетельствует о наличии достаточных функциональных резервов, необходимых для развития адекватных адаптационно-компенсаторных реакций этой гомеостатической системы организма, причем их формирование построено на физиологически оптимальном преобладании отрицательных обратных зависимостей. Спад связанности параметров и преобладание прямых положительных связей, наблюдаемый после возвращения на Землю космонавтов, совершивших длительные космические полеты, можно расценить как срыв эффективной работы и определенную «потерю» саморегуляции иммунной системы после длительного напряжения, связанного с пребыванием на борту космических объектов.
Таким образом, проведенные исследования показали, что кратковременное воздействие факторов космического полета ведет к активизации работы иммунной системы, тогда как длительное воздействие этих факторов приводит к длительному напряжению, а в дальнейшем и к перенапряжению и истощению функциональных резервов этой регуляторной системы.
Обобщая результаты исследований системы иммунитета космонавтов после завершения длительных космических полетов на МКС, следует отметить, что механизмы адаптационной перестройки системы иммунитета человека в ответ на комплексное воздействие факторов космического полета закономерно приводят к изменению параметров, характеризующих состояние врожденного и адаптивного иммунитета. Анализ характера изменений иммунологической реактивности, выявляемых в периоде ранней реадаптации к земным условиям после завершения длительных космических полетов, позволяет выдвинуть концепцию о развитии в условиях адаптации к комплексу факторов длительной космической миссии «синдрома напряженности» иммунной системы. Эта концепция основана на представлении о том, что адаптация иммунной системы к изменениям воздействий внешней среды сопровождается общей, системной реакцией антигенно-структурного гомеостаза, направленной на сохранение структурной целостности и гено- и фенотипической индивидуальности организма. В этом понимании сутью предлагаемой концепции является следующее: при длительном воздействии на организм здорового человека экстремальных факторов космического полета происходит перестройка уровня функционирования иммунной системы, уровень соответствующий новым условиям окружающей среды. Комплекс признаков этой приспособительной по своей сути реакции (изменения субпопуляционного состава клеточных факторов врожденного и адаптивного иммунитета и их функциональной активности) свидетельствует о том, что для такой перестройки требуется мобилизация функциональных ресурсов, достигающаяся за счет напряжения этой регуляторной системы. Но длительное напряжение иммунной системы может приводить к истощению резервных возможностей этой гомеостатической системы и возникновению риска развития вторичного иммунодефицитного состояния. Следовательно, для обеспечения компенсаторно-адаптационных реакций организма на всех этапах длительной космической экспедиции иммунная система космонавтов должна обладать достаточными функциональными резервами.
4. Оценка эффективности средств профилактики и коррекции неблагоприятного воздействия факторов космического полета на систему иммунитета
4.1. Оценка влияния длительных физических тренировок на систему иммунитета Поддержание хорошего состояния здоровья и достаточной работоспособности космонавтов в длительных космических полетах достигается целым комплексом мероприятий, который включает: создание достаточного комфорта на орбитальных станциях; рациональный режим труда и отдыха с адекватным по продолжительности сном; обеспечение полноценным питанием; выполнение физических тренировок; использование ряда пассивных физических средств воздействия, средств, направленных на воспроизведение в невесомости и при действии перегрузок распределения жидких сред близкого к земному, водно-солевых добавок, способствующих задержанию жидкости в организме, и фармакологических препаратов, купирующих симптомы венозного переполнения сосудов головы и космической болезни движения [Газенко О.Г., 1990; Григорьев А.И. и соавт., 1987; Козловская И.Б., Пестов И.Д., Егоров А.Д., 2008; Козловская И.Б., Ярманова Е.Н., Фомина Е.В., 2013]. Ключевым элементом российской системы профилактики являются физические упражнения, обеспечивающие необходимую нагрузку на скелетно-мышечную и сердечно-сосудистые системы и способствующие сохранению постуральной и локомоторной функций. В настоящее время физические тренировки в ходе полетов осуществляются с использованием тренажеров – беговая дорожка, велотренажер, резистивные тренажеры. Чтобы оценить, какое влияние на состояние системы иммунитета могут оказывать выполняющиеся в течение 2 месяцев физические тренировки, было проведено исследование особенностей функционирования иммунной системы молодых здоровых мужчин при различных вариантах физических нагрузок, разработанных в ГНЦ РФ ИМБП РАН под руководством профессора О.Л. Виноградовой.
При изучении эффектов силовых тренировок на систему иммунитета установлено, что после завершения 8-9-недельных циклов тренировок на силовом тренажере типа “HUMMER” по схеме классической силовой тренировки с нагрузкой 80-85% от максимальной произвольной силы и по схеме низкоинтенсивной силовой тренировки мышц с неполным расслаблением с нагрузкой 50% от максимальной произвольной силы наблюдалось признаки активации иммунной системы: увеличение содержания лимфоцитов с фенотипом CD19+CD23+, СD3+СD25+ и CD4+CD45RA+ в периферической крови; увеличение содержания в культурах клеток in vitro Т-, В-, ЕК-лимфоцитов, экспрессирующих в ответ на адекватный стимул (ФГА, МЛ, ИЛ-2, соответственно) ранний активационный маркер CD69, и Т-лимфоцитов, экспрессирующих в ответ на стимуляцию ФГА активационный маркер CD25; повышение спонтанной и митогениндуцированной способности В-лимфоцитов синтезировать иммуноглобулины классов А, М, G; усиление цитотоксической активности ЕК-клеток. При этом наблюдалось снижение готовности лимфоцитов к апоптозу, ассоциировавшееся с повышением пролиферативного ответа Т-лимфоцитов в нестимулированных и стимулированных ФГА культурах клеток (рис. 13 А, Б). Кроме того, после завершения цикла низкоинтенсивной силовой тренировки без расслабления было выявлено снижение экспрессии специализированного рецептора индукторных факторов апоптоза CD95 в нестимулированных и стимулированных ФГА-культурах мононуклеарных клеток (рис. 14 А, Б). Напротив, после завершения цикла классической силовой тренировки в стимулированных культурах клеток была отмечена отчетливая тенденция к усилению экспрессии этого антигена.
Рис. 13. Содержание лимфоцитов, экспрессирующих активационные антигены, в нестимулированных и стимулированных культурах клеток после 8-ми недель силовой тренировки (процент от фона): I – содержание CD19+CD69+ – лимфоцитов в нестимулированных 18-часовых культурах клеток; II - содержание CD19+CD69+ – лимфоцитов в стимулированных МЛ 18-часовых культурах клеток; III - содержание CD3+CD69+ – лимфоцитов в нестимулированных 18-часовых культурах клеток; IV- содержание CD3+CD69+ – лимфоцитов в стимулированных ФГА 18-часовых культурах клеток; V- содержание CD56+CD69+ – лимфоцитов в нестимулированных 18-часовых культурах клеток; VI - содержание CD56+CD69+ – лимфоцитов в 18-часовых культурах клеток в присутствии ИЛ2; VII - содержание CD3+CD25+ – лимфоцитов в нестимулированных 48-часовых культурах клеток; VIII - содержание CD3+CD69+ – лимфоцитов в стимулированных ФГА 48-часовых культурах клеток.
Рис. 14. Апоптоз и пролиферативная активность Т-лимфоцитов в нестимулированных и стимулированных ФГА 48-ч культурах клеток in vitro после 8-ми недель силовой тренировки (процент от фона): I – ранний апоптоз без стимуляции; II – ранний апоптоз, стимуляция ФГА; III – поздний апоптоз без стимуляции; IV- поздний апоптоз, стимуляция ФГА; V- CD3+CD95+ – лимфоциты без стимуляции; VI - CD3+CD95+ – лимфоциты, стимуляция ФГА; VII – спонтанная пролиферативная активность Т-лимфоцитов; VIII – ФГА-индуцированная пролиферативная активность Т-лимфоцитов
Повышение содержания лимфоцитов, экспрессирующих, такой активационный маркер, как СD25, в стимулированных ФГА культурах клеток, увеличение ФГА-индуцированной пролиферативной активности лимфоцитов и уменьшение процента апоптотических клеток, экспрессирующих на плазматической мембране фосфатидилсерин, выявляемый по связыванию с поверхностью клеток аннексина V (ранний апоптоз), и гиподиплоидных клеток, окрашенных аннексином V и пропидиумом йодидом (поздний апоптоз), в 48-часовых культурах нестимулированных и стимулированных ФГА клеток у испытуемых после завершения цикла силовых тренировок, по-видимому, свидетельствует о стабильности процесса активации и переходе к пролиферации, т.е. о позитивном характере процесса активации. Однако следует отметить, что после завершения тренировочных циклов в ряде наблюдений отмечалось снижение ФГА-индуцированной пролиферативной активности Т-лимфоцитов, а также уменьшение соотношений содержания CD25+ -лимфоцитов и иммуноглобулинов классов А, М, G в стимулированных митогеном и нестимулированных клеточных культурах, указывающее на снижении потенциальных ресурсов Т- и В-лимфоцитов.
При изучении эффектов на систему иммунитета тренировок на велоэргометре с электродвигателем по программам низкоскоростной эксцентрической тренировки (НЭ-группа), высокоскоростной эксцентрической тренировки (ВЭ-группа) и высокоскоростной концентрической тренировки (ВК-группа) установлено, что после 9-недельного тренировочного цикла у значительной части обследованных отмечено увеличение содержания в культурах клеток in vitro Т-лимфоцитов, экспрессирующих в ответ на стимуляцию ФГА активационный маркер CD25, и повышение митогениндуцированной пролиферативной активности В-лимфоцитов. Одновременно с этим отмечено, что в ВК-группе наблюдалось снижение синтеза IgG в нестимулированных и стимулированных МЛ клеточных культурах (р<0,05). Обращает на себя внимание большой индивидуальный разброс полученных результатов. Анализ частоты отклонений показателей, характеризующих Т-звено иммунитета (содержание в периферической крови CD3+ -, CD3+CD4+ - CD3+CD8+ -клеток, содержание CD4+CD25+- лимфоцитов в нестимулированных и ФГА-стимулированных культурах клеток, спонтанная и ФГА-ндуцированная пролиферативная способность Т-лимфоцитов), В-звено иммунитета (содержание в периферической крови CD19+-клеток, уровень IgA, IgM и IgG в сыворотке крови, спонтанная и индуцированная митогеном лаконоса пролиферативная способность В-лимфоцитов, спонтанная и митогениндуцированная способность В-лимфоцитов синтезировать иммуноглобулины классов А, М, G), а также содержания в периферической крови и цитотоксической активности ЕК-лимфоцитов киллеров, выявил и некоторые различия между исследованными группами (Рис. 15).
Таким образом, анализ результатов, полученных при изучении влияния на систему иммунитета здоровых мужчин различных вариантов физических тренировок на силовом тренажере и велоэргометре с электродвигателем выявил разнонаправленные сдвиги показателей, характеризующих состояние Т-клеточного иммунитета, гуморального иммунитета и системы естественной цитотоксичности, в ответ на длительное воздействие физических нагрузок. Разнородность иммунологических реакций определяется, в основном, изменениями на уровне активационных процессов. Полученные данные не противоречат литературным данным, свидетельствующим о том, что адекватные физические нагрузки стимулируют иммунный ответ, в то же время при повышенных по длительности или интенсивности нагрузках, выявляется их негативное влияние на иммунную систему испытателей, причем для каждого физиологического состояния имеется свой предельный уровень физических нагрузок, при превышении которого возникает общее нарушение метаболизма и иммунитета [Аронов Г.Е., Иванова Н.И., 1987; Mackinnon L.T., 1999; Pedersen B.K., Hoffman-Goetz L., 2000]. Учитывая тот факт, что снижение иммунитета не только служит патогенетическим механизмом развития целого ряда заболеваний, но и является одним из ранних признаков нарушения адаптации человека к условиям физических тренировок, исследование активационных процессов лимфоцитов - базисного процесса разнообразных проявлений
Рис.15. Частота отклонений показателей адаптивного иммунитета и системы естественной цитотоксичности при различных вариантах тренировок на велоэргометре с электродвигателем (процент отклонений от фонового уровня): НЭ – низкоскоростная эксцентрическая тренировка; ВЭ – низкоскоростная эксцентрическая тренировка; ВК - высокоскоростная концентрическая тренировка
функциональной активности иммуноцитов, может оказаться продуктивным методологическим подходом как для оценки эффективности режимов физических тренировок на борту космических станций, так и для подбора методов и средств системы профилактики с учетом индивидуальных особенностей членов экипажей космических экспедиций.
4.2. Исследование влияния иммуномодулирующих препаратов на функциональную активность иммунокомпетентных клеток периферической крови космонавтов в системе in vitro. В последнее время широкое применение в клинической практике иммунокоррекции находят иммуномодулирующие препараты на основе цитокинов, интерферонов и индукторов интерферонов (реаферон, ронколейкин, лейкинферон, виферон, беталейкин, циклоферон и др.). В связи с этим представлялось целесообразным провести изучение влияния ИЛ-2 и ИФН на функциональную активность Т-лимфоцитов и лимфоцитов-естественных киллеров (ЕК), изменения которых наиболее постоянно возникают под влиянием условий длительного космического полета. Учитывая тот факт, что о суммарной функциональной активности Т-клеток дает представление реакция ФГА-индуцированной бласттрансформации лимфоцитов, а о функциональной активности ЕК-лимфоцитов – способность мононуклеарных клеток оказывать цитотоксическое действие на клетки-мишени, в качестве которых используют суспензионную культуру опухолевых миелобластов К-562, то изучение действия иммуномодуляторов на функционирование иммунокомпетентных клеток было проведено в клеточных культурах in vitro при инкубации в присутствии ИЛ-2 и ИФН (были использованы концентрации этих биологических веществ эквивалентные уровням в сыворотке крови после введения терапевтических доз иммуномодулирующих препаратов, принятых в настоящее время). Результаты, полученные при оценке действия ИЛ-2 и ИФН на функционирование ЕК-лимфоцитов периферической крови российских космонавтов - членов экипажей МКС, показали, что в раннем периоде реадаптации к земным условиям не было отмечено стимулирующего действия этих цитокинов на цитотоксическую активность ЕК ни в одном из восьми наблюдений. Напротив, в трех случаях культивирование мононуклеарных клеток в присутствии ИФН привело к значительному снижению (более чем на 25% по сравнению с контрольными культурами клеток) способности эффекторных клеток оказывать цитотоксическое действие на клетки-мишени линии К-562. При этом у двух из космонавтов цитотоксическая активность была достаточно высокой, а у одного – резко сниженной. Возможно такое глубокое угнетение функциональной активности ЕК и ингибирующее действие на цитотоксическую способность ЕК не только ИФН, но и ИЛ-2 связано, в первую очередь, с нарушениями сложных процессов внутриклеточного метаболизма.
Анализ действия ИЛ-2 и ИФН на функциональную активность Т-лимфоцитов, выявил значительный стимулирующий эффект этих иммуномодуляторов на ФГА-индуцированный пролиферативный ответ только в одном из восьми наблюдений, тогда как в остальных наблюдениях, напротив, наблюдалось снижение пролиферативной активности Т-лимфоцитов в присутствии как ИЛ-2, так и ИФН.
Таким образом, представленные результаты исследований влияния биологически активных веществ (ИЛ-2 и ИФН) на функциональную активность Т-лимфоцитов и лимфоцитов - естественных киллеров периферической крови космонавтов после завершения длительных космических полетов в системах in vitro показали, что стимулирующий эффект этих препаратов на функциональную активность мононуклеарных клеток в большинстве наблюдений отсутствовал. Напротив, в ряде случаев наблюдался ингибирующий эффект этих иммуномодуляторов на функционирование Т- и ЕК-клеток. Это позволяет усомниться в правомочности однозначных подходов к проблеме иммунокоррекции как во время космического полета, так и после его завершения. Есть все основания считать, что при разработке комплекса мер иммунокоррегирующей терапии необходимо учитывать как состояние системы иммунитета, так и характер реакции иммунокомпетентных клеток на иммуномодуляторы.
Заключение
В условиях космического полета иммунная система человека прямо или опосредованно подвергается воздействию разнообразных факторов, среди которых, кроме эффектов микрогравитации, немаловажными являются условия обитания в герметически замкнутом помещении с искусственно создаваемым микроклиматом, стрессорное напряжение, гипергравитация при старте, маневрировании и приземлении.
Результаты проведенных исследований адаптационных процессов иммунной системы космонавтов в раннем периоде реадаптации к земным условиям после завершения кратковременных и длительных космических полетов, подтверждают полученные ранее данные, что комплекс факторов космического полета оказывает существенное влияние на эту гомеостатическую систему. Вместе с тем, несомненный интерес представляет изучение иммунной системы космонавтов в соответствии с целостным восприятием ее функционирования с использованием комплексного подхода к оценке способности компонентов врожденного и адаптивного иммунитета выполнять свои физиологические функции.
Установлено, что кратковременное пребывание в условиях реального космического полета (8-31 суток) и в условиях, моделирующих некоторые эффекты микрограватации, привело к изменению ряда показателей врожденного и адаптивного иммунитета. Однако предложенный системный подход, основанный на исследовании взаимодействия изученных показателей методом корреляционного анализа, подчеркивает тот факт, что хотя перенастройка на новый уровень функционирования потребовала определенного напряжения иммунной системы, в то же время повышение общей связанности параметров указывает на сохранение достаточного запаса функциональных резервов и высокий уровень готовности к нагрузкам, связанным с возвращением на Землю.
Полученные результаты исследований системы иммунитета, выполненных после завершения космических полетов продолжительностью 115-428 суток, а также на различных этапах 120-суточной АНОГ и 520-суточной изоляции в гермообъекте, свидетельствуют о том, что при длительном воздействии на организм здорового человека неблагоприятных факторов среды обитания характер сдвигов, однотипен и включает активацию клеточного компартмента иммунитета. Активизацию работы иммунной системы, осуществление ее на качественно ином уровне, по-видимому, следует считать признаком адаптационной перестройки организма, направленной на сохранение иммунного гомеостаза. Однако выявленное в ряде наблюдений угнетение функциональной активности иммунокомпетентных клеток свидетельствует об истощении функциональных резервов иммунной системы.
В целом, проведенные исследования позволили установить, что состояние иммунной системы – один из ранних и высокочувствительных показателей неблагоприятного действия факторов космического полета. Изменения показателей, характеризующих количество и функциональную активность иммунокомпетентных клеток врожденного и адаптивного иммунитета космонавтов, могут служить критериями не только развития преморбидных состояний, но и адекватности возможностям организма перспективных методов и средств профилактики и коррекции неблагоприятного воздействия факторов космического полета. Выявление индивидуальных особенностей функционирования системы иммунитета, ее функциональных резервов является перспективным направлением предполетного контроля при отборе «устойчивых» к воздействию микрогравитации космонавтов и для прогноза адаптационных возможностей организма к условиям межпланетного космического полета.
Выводы
- Процесс адаптации к комплексу факторов космического полета приводит как к количественным, так и качественным изменениям врожденного и адаптивного иммунитета, которые проявляются после полета в сдвигах в системе сигнальных образраспознающих рецепторов, системе естественной цитотоксичности, Т- и В- звена системы адаптивного иммунитета и системе цитокинов.
- Переход на новый уровень функционирования системы иммунитета в ответ на воздействие факторов космического полета, направленный на сохранение иммунного гомеостаза, осуществляется по мобилизационному типу компенсаторно-приспособительных реакций, характеризующийся разнонаправленными сдвигами параметров врожденного и адаптивного иммунитета с преобладанием показателей активации.
- В раннем периоде адаптации к условиям космического полета поддержание гомеостаза и обеспечение нормального функционирования системы иммунитета достигается за счет большей напряженности (связанности) ее параметров.
- Длительное воздействие комплекса факторов космического полета приводит к перенапряжению и истощению функциональных резервов, необходимых для развития адекватных адаптационно-компенсаторных реакций иммунной системы.
- При наземном моделировании кратковременного воздействия физиологических эффектов микрогравитации в экспериментах с 5-7суточной «сухой» иммерсией реакции системы иммунитета отличались значительной индивидуальной вариабельностью степени и направленности сдвигов параметров врожденного и адаптивного иммунитета, свидетельствующие о роли индивидуальных особенностей организма адаптироваться к необычным условиям жизнедеятельности.
- Отдаленный период адаптации иммунной системы здорового человека к условиям длительной антиортостатической гипокинезии характеризуется повышением выхода в циркуляцию естественных киллеров и активированных Т-лимфоцитов.
- Изменения системы антигенно-структурного гомеостаза в ответ на комплексное воздействие факторов длительной изоляции в гермообъеме проявляются в мобилизации механизмов адаптивного иммунитета на фоне снижения количественного содержания и функциональной активности клеточных факторов врожденного иммунитета.
- Длительные физические тренировки, адекватные возможностям организма, способствуют повышению резервных возможностей системы иммунитета здоровых мужчин. Полиморфизм изменений показателей, характеризующих количественное содержание и функциональную активности ЕК, Т- и В-лимфоцитов, свидетельствует о необходимости индивидуального подхода к формированию программ физических тренировок на борту космических объектов.
- Изменения системы иммунного гомеостаза человека в процессе адаптации к комплексу факторов космического полета и реадаптации к земным условиям проявляются на различных уровнях функционирования иммунной системы, что свидетельствует о необходимости при проведении профилактических и иммунореабилитационных мероприятий использования иммуномодулирующих препаратов, имеющих различные механизмы действия, в соответствии с выявленными количественными и функциональными сдвигами и характером реакции системы иммунитета на действие иммуномодулирующих препаратов в каждом конкретном случае.
Список работ, опубликованных по материалам диссертации
- Konstantinova I.V., Rykova M., Lesnyak A.T., Antropova E.N. Immune changes during long-duration missions // Journal of Leukocyte biology. 1993. V. 54. № 3. P. 189-201.
- Konstantinova I.V., Rykova M., Meshkov D., Peres C., Husson D., Schmitt D.A. Natural killer cells after ALTAIR mission // Acta Astronautica. 1995. V.36. Issues 8–12. P.713-718.
- Meshkov D., Rykova M. The natural cytotoxicity in cosmonauts on board space stations // Acta Astronautica. 1995. V.36. Issues 8–12. P.719-726.
- Константинова И.В., Антропова Е.Н., Мешков Д.О., Рыкова М.П., Лесняк А.Т. Иммунологическая резистентность человека при длительной изоляции // Авиакосмическая и экологическая медицина. 1997. Т. 31. №4. С. 57-60.
- Schmitt D., Abbal M., Rykova M., Meshkov D. Immune responses in extreme environments // J. Gravitation Physiology. 1998. V. 5. №1. P.9-11.
- Meshkov D., Rykova M., Antropova E., Vdovin A., Bizukin A., Nesvizhsky I. Phagocyte system under spaceflight conditions // J. Gravitation Physiology. 1998. V. 5. №1. P.139-140.
- Лесняк А.Т., Рыкова М.П., Мешков Д.О., Антропова Е.Н., Митирев Г.Ю., Воротникова И.Е., Константинова И.В. Клеточный иммунитет человека и космический полет // Авиакосмическая и экологическая медицина. 1998. Т. 32. №1. С. 29-35.
- Мешков Д.О., Рыкова М.П., Белозерова И.Н. Миграционная способность фагоцитирующих клеток при моделировани факторов космического полета в наземных условиях // Авиакосмическая и экологическая медицина. 1998. Т.32. №5. С.18-21.
- Лесняк А.Т., Антропова Е.Н., Мешков Д.О., Рыкова М.П. Диагностика нарушений Т-клеточного звена иммунитета в космическом полете // Авиакосмическая и экологическая медицина. 1999. Т.33. №3. С. 62-67.
- Антропова Е.Н., Рыкова М.П., Мешков Д.О., Казанцева В.А. Иммунологическая реактивность и состояние кишечной вирусной флоры человека при обитании в герметически замкнутых помещениях // Авиакосмическая и экологическая медицина. 2000. Т.34. №5. С. 24-29.
- Buravkova L.B., Rykova M.P., Grigorieva O.V., Antropova E.N. Cell interactions in microgravity: cytotoxic effects of natural killer cells in vitro // J. Gravitational Physiology. V. 11. № 2. 2004. Р.177-180.
- Ларина И.М., Ничипорук И.А., Рыкова М.П., Антропова Е.Н. Гормонально-иммунное взаимодействие у человека во время длительной антиортостатической гипокинезии // Рос. физиол. журн. им. И. М. Сеченова. 2004. т.90. №8. С.335-337.
- Буравкова Л.Б., Рыкова М.П., Антропова Е.Н., Григорьева О.В. Модификация метода изучения цитотоксической активности лимфоцитов-естественных киллеров для полетных экспериментов в космосе. // Авиакосмическая и экологическая медицина. 2005. Т. 39. №1. С. 55-59.
- Buravkova L.B., Romanov Yu.A., Rykova M.P., Grigorieva O.V., Merzlikina N.V. Cell-to-cell interactions in changed gravity: ground-based and flight experiments // Acta Astronautica. 2005. V. 57. Issues 2-8. P. 67-74.
- Buravkova L.B., Grigorieva O.V., Rykova M.P. Cytotoxic activity of NK lymphocytes in vitro under microgravity // J. Gravitational Physiology. 2005. V. 12. №1. P. 173-174.
- Рыкова М.П., Герцик Ю.Г., Антропова Е.Н., Буравкова Л.Б. Уровень сывороточных иммуноглобулинов, аллерген-специфических IgE-антител и интерлейкина-4 у космонавтов до и после кратковременных космических полетов на международной космической станции // Физиология человека. 2006. Т. 32. №4. С. 97-101.
- Рыкова М.П., Антропова Е.Н., Виноградова О.Л., Ларина И.М. Адаптационные возможности системы иммунитета человека в условиях силовых тренировок // Физиология человека. Т.33. №1. 2007. С. 101-108.
- Buravkova L.B., Grigorieva O.V., Rykova M.P. The effect of microgravity on the in vitro NK cell function during six International Space Station Missions // Microgravity Sci. Technol. 2007. V. XIX-5/6. Р. 145-147.
- Буравкова Л.Б., Григорьева О.В., Рыкова М.П., Григорьев А.И. Цитотоксическая активность лимфоцитов-естественных киллеров in vitro в условиях микрогравитации // Доклады Академии Наук. 2008. Т. 421. №1. С. 128-130.
- Рыкова М.П., Антропова Е.Н., Попов Д.В., Виноградова О.Л., Ларина И.М. Активационные процессы в системе иммунитета человека при низкоинтенсивной силовой тренировке без расслабления // Рос. физиол. журн. им. И. М. Сеченова. 2008. т.94. №2. с. 212-219.
- Rykova М.P., Antropova Е.N., Larina I.M., Morukov B.V. Humoral and cellural immunity in coamonauts after the ISS missions. // Acta Astronautica. 2008. V. 63. Issues 7-10. P. 697-705.
- Берендеева Т.А., Рыкова М.П., Антропова Е.Н., Ларина И.М., Моруков Б.В. Состояние системы иммунитета человека в условиях 7-суточной «сухой» иммерсии // Авиакосмическая и экологическая медицина. 2009. Т. 43. №5. С. 36-42.
- Моруков Б.В., Рыкова М.П., Антропова Е.Н., Берендеева Т.А., Пономарев С.А. Показатели врожденного и адаптивного иммунитета у космонавтов после длительных космических полетов на Международной космической станции // Физиология человека. 2010. Т. 36. № 3. С. 1 – 12.
- Моруков Б.В., Рыкова М.П., Антропова Е.Н., Берендеева Т.А., Пономарев С.А. Состояние системы иммунитета человека в условиях 105-суточной изоляции в гермообъекте с искусственной средой обитания // Авиакосмическая и экологическая медицина. 2010. Т. 44. №4. С. 39-46.
- Пономарёв С.А., Рыкова М.П., Антропова Е.Н., Берендеева Т.А., Моруков Б.В. Состояние системы врождённого иммунитета в условиях 5-суточной “сухой” иммерсии // Авиакосмическая и экологическая медицина. 2011. №3. С. 17-23.
- Ничипорук И.А., Васильева Г.Ю., Рыкова М.П., Антропова Е.Н., Берендеева Т.А., Пономарев С.А., Моруков Б.В. Динамика концентрации нейроспецифических белков в крови и риск развития нейропатий в условиях 105-суточной изоляции в гермообъекте // Авиакосмическая и экологическая медицина. 2011. №3. С. 24-29.
- Morukov B., Rykova M., Antropova E., Berendeeva T., Ponomaryov S., Larina I.T-cell immunity and cytokine production in cosmonauts after long-duration space flights // Acta Astronautica. 2011. V.68. Issues 7-8. P.739-746.
- Моруков Б.В., Рыкова М.П., Антропова Е.Н., Берендеева Т.А., Моруков И.Б., Пономарев С.А. Иммунологические аспекты пилотируемого марсианского полета // Физиология человека. 2013. Т. 39. № 2. С. 19 – 30.
- Рыкова М.П. Иммунная система у российских космонавтов после орбитальных полетов // Физиология человека. 2013. Т. 39. № 5. С. 126 – 136.
- Рыкова М.П., Антропова Е.Н., Мешков Д.О. Результаты иммунологического обследования космонавтов в период реадаптации после КП // В кн.: «Орбитальная станция МИР». М. 2001. Т. 1. С. 615-618.
- Рыкова М.П., Антропова Е.Н., Мешков Д.О. Иммунологическое исследование // В кн.: «Орбитальная станция МИР». М. 2001. Т. 1. С. 184-192.
- Рыкова М., Мешков Д., Антропова Е., Поляков В., Шаффар Л., Шмитт Д. Результаты иммунологических исследований в рамках российско-французских проектов "АРАГАЦ", "АНТАРЕС", "АЛЬТАИР" и "ДЛИТЕЛЬНЫЙ ПОЛЕТ ВРАЧА- КОСМОНАВТА" // В кн.: «Орбитальная станция МИР». М. 2001. Т. 2. С.197-203.
- Моруков Б.В., Рыкова М.П., Антропова Е.Н., Берендеева Т.А., Пономарев С.А. Исследование системы иммунитета российских космонавтов до и после длительных космических полётов на МКС // В кн.: Международная космическая станция. Российский сегмент: космическая биология и медицина [Рос. акад. наук, Ин-т мед.-биол. проблем РАН; редкол.: А. И. Григорьев (гл. ред.) и др.]. - Москва: ИМБП. Т. 2: [Медико-биологические исследования на российском сегменте МКС], 2011. С. 209-221.
- Morykov B., Rykova M., Antropova E. NK Cells Assessments: A Thirty-Year-Old History of Immune Stress Interaction in Space // В кн.: A. Chouker (Ed.) Stress Challenges and Immunity in Space: From Mechanisms to Monitoring and Preventive Strategies. Heidelberg, Germany: Springer. 2012. P. 155-164.
- Peres C., Konstantinova I., Rykova M., Meshkov D., Schaffar L., Tkaczuk J., Abbal M., Ohayon E., Schmitt D.A. Mitogen-induced proliferation of T-Lymphocytes from cosmonautes after short- and long-duration spaceflight // In: Proceedings of the Fifth European Symposium on Life Sciences Research in Space held 26 September - 1 October, 1993 in Arcachon, France. Edited by H. Oser and T.D. Guyenne. ESA SP-366. European Space Agency, 1994.. P.413-414.
- Лесняк А.Т., Рыкова М.П., Мешков Д.О., Антропова Е.Н. Диагностика нарушений иммунитета в космическом полете (модификация методов исследования клеточного иммунитета применительно к невесомости) // В кн.: «Медико-биологические исследования по программе «Наука-НАСА», (III российско-америкаский симпозиум), Хансвилл, США, 1997. С. 63.
- Мешков Д.О., Рыкова М.П., Белозерова И.Н. Исследование миграционной способности фагоцитирующих клеток у космонавтов до и после космических полетов, а также при моделировании ряда факторов космического полета в наземных условиях в ходе длительной антиортостатической гипокинезии // В кн.: «Медико-биологические исследования по программе «Наука-НАСА», (III российско-америкаский симпозиум), Хансвилл, США, 1997. С. 67.
- Meshkov D., Rykova M. Lesnyak A., Antropova E. Peculiarities of immunity and sensitization of cosmonauts under spaceflight conditions // XXXIII International Congress of Physiological Sciences, St. Petersburg, Russia, 1997, Abstracts book P. 045.18
- Мешков Д.О., Антропова Е.Н., Рыкова М.П.. Иммунологическая резистентность человека при длительной антиортостатической гипокинезии // В сб.: «Гипокинезия (медицинские и психологические проблемы): тезисы докладов конференции». Москва, 1997. C.6.
- Лесняк А.Т., Моруков Б.В., Божиков Н.В. Рыкова М.П. Иммунологические механизмы регуляции обмена кальция костной ткани при длительной АНОГ // В сб.: «Гипокинезия (медицинские и психологические проблемы): тезисы докладов конференции». Москва, 1997. C.46-47.
- Рыкова М.П., Мешков Д.О. Противовирусный иммунитет человека при длительной АНОГ // В сб.: «Гипокинезия (медицинские и психологические проблемы): тезисы докладов конференции». Москва. 1997. С. 44-45.
- Рыкова М.П., Антропова Е.Н., Мешков Д.О. Иммунологическое обследование космонавтов: сегодня и завтра // В кн.: «Тезисы докладов Х1 конференции по космической биологии и авиакосмической медицине», Москва, 1998. Т.II. С.175.
- Рыкова М.П., Антропова Е.Н., Мешков Д.О., Шмитт Д., Кравченко В.В. Перспективы иммунокоррекции у космонавтов // В кн.: «Тезисы докладов Х1 конференции по космической биологии и авиакосмической медицине», Москва, 1998. Т.II. С. 176.
- Антропова Е.Н., Мешков Д.О., Рыкова М.П. Иммунологическая реактивность у членов экипажей в эксперименте SFINCSS–99 // В сб.: «Основные результаты исследований психофизиологического состояния операторов в эксперименте с длительной изоляцией в гермообъекте». М. 2000. С.67-68.
- Rykova M., Meshkov D., Antropova E., Polykov V., Schaffar L.,.Schmitt D. The effects of microgravity on the immune system // International Symposium « International Scientific Cooperation onboard Mir», Lyon – France – 19-21 march 2001. Actes/Proceedings. Р.235-242.
- Рыкова М.П., Антропова Е.Н. Иммунологические реакции при силовой и аэробных тренировках // Материалы III всероссийской с международным участием школы-конференции по физиологии мышц и мышечной деятельности, посвященной 250-летию МГУ им. М.В.Ломоносова. Москва. 2005. с. 90.
- Буравкова Л.Б., Григорьева О.В., Рыкова М.П. Результаты полетного эксперимента “Межклеточное взаимодействие” (МКС-7 – МКС-12) // В сб.: «Тезисы докладов 6-ой международной научно-практической конференции «Пилотируемые полеты в космос», Звездный городок, 2005. С. 84-86.
- Буравкова Л.Б., Григорьева О.В., Рыкова М.П..Межклеточное взаимодействие иммунных клеток и клеток-мишеней in vitro в условиях микрогравитации (МКС-7 – МКС-12) // Сборник материалов XIII конференции по космической биологии и авиакосмической медицине, Москва, 2006. C. 84-86.
- Рыкова М.П, Антропова ЕН., Моруков Б.В., Ларина И.М. Принципы лабораторного обследования состояния системы иммунитета космонавтов // Сборник материалов XIII конференции по космической биологии и авиакосмической медицине, Москва, 2006. с.213-215.
- Моруков Б.В., Рыкова М.П., Антропова Е.Н. Регуляция иммунной функции организма человека в условиях космического полета // В сб.: «Актуальные проблемы российской космонавтики: Труды ХХХ Академических чтений по космонавтике», Москва, 2006. С. 458-459.
- Larina I.M., Rykova M.P., Antropova Е.N., Netreba A.I. The effect of the 8 week weight training in different modes on the condition of the immune system // In: Proceedings of the XIIIth Annual International Exercise. Biochemistry Conference, Seoul, South Korea, 2006. P.144-146.
- Buravkova L.B., Grigorieva O.V., Rykova M.P. The effect of microgravity on interaction between human immune cells and target cells in vitro (flight experiments during ISS-7 – ISS-12 missions // In: Abstract book. Science on European Soyuz Mission to the International Space Station (2001-2005), Toledo (Spain), 2006. P. 20.
- Morukov B., Rykova M., Antropova E., Berendeeva T., Larina I. Immune system dysregulation after long-duration space flight // In: Book of Abstracts, 17th IAA Humans in Space Symposium. Moscow. 2009. P.16.
- Nichiporuk I., Vassilieva G., Rykova M., Antropova E., Berendeeva T., Larina I. Psychoneuroimmunological status in conditions of 18-hour bed rest with a headown tilt // In: Book of Abstracts, 17th IAA Humans in Space Symposium. Moscow. 2009. P.91.
- Ничипорук И.А., Васильева Г.Ю., Рыкова М.П., Антропова Е.Н., Берендеева Т.А., Белоусова И.В. Взаимосвязи психонейроэндокринной системы и иммунного статуса в условиях кратковременной антиортостатической гипокинезии и 7-суточной «сухой» иммерсии // В сб.: «Механизмы функционирования висцеральных систем: VII Всероссийская конференция с международным участием, посвященная 160-летию со дня рождения И.П. Павлова. Тезисы докладов», СПб.: Институт физиологии им. И.П. Павлова РАН, 2009. С. 314-315.
- Моруков Б.В., Рыкова М.П., Пономарев С.А., Антропова Е.Н, Берендеева Т.А. Влияние условий 105-суточной изоляции в гермообъекте с искусственной средой обитания на систему иммунитета // В сб.: «XXI съезд Физиологического общества им. И.П.Павлова. Тезисы докладов», М. –Калуга, 2010. С. 757-758.
- Моруков Б.В., Рыкова М.П., Антропова Е.Н., Берендеева Т.А., Пономарев С.А., Простяков И.В. Исследование роли системы иммунитета в регуляции минерального обмена при воздействии на организм человека факторов космического полета // В сб.: «Космический форум 2011, посвященный 50-летию полета в космос Ю.А. Гагарина», Москва, 2011. С. 36.
- Моруков Б.В., Рыкова М.П., Антропова Е.Н., Берендеева Т.А., Пономарев С.А. Исследование системы иммунитета человека в условиях 520-суточной изоляции в гермообъекте // В сб.: «Международный симпозиум по результатам экспериментов, моделирующих пилотируемый полет на Марс (Марс-500) (23-25 апреля 2012)». - М.: ГНЦ РФ – ИМБП РАН, 2012. С. 41-42.

