И тактика лучевой терапии вмногокомпонентном лечении местно-распространенного рака шейки матки (
На правах рукописи
КРЕЙНИНА ЮлияМихайловна
СТРАТЕГИЯ И ТАКТИКА ЛУЧЕВОЙ ТЕРАПИИ
ВМНОГОКОМПОНЕНТНОМ ЛЕЧЕНИИ
МЕСТНО-РАСПРОСТРАНЕННОГО РАКА ШЕЙКИ МАТКИ
(14.01.13 – лучеваядиагностика и лучевая терапия
14.01.12 –онкология)
АВТОРЕФЕРАТ
диссертации насоискание ученой степени
доктора медицинскихнаук
Москва -2011
Работа выполнена вФГБУ«Российский научный центр рентгенорадиологии»Минздравсоцразвития России (директор –член-корреспондент РАМН,д.м.н., профессор В.А.Солодкий)
Научныеконсультанты:
академик РАМН,профессор Харченко ВладимирПетрович
доктор медицинских наук,профессорТитова ВераАлексеевна
Официальные оппоненты:
Доктор медицинскихнаук Демидова Л.В.
Доктор медицинскихнаук,профессорКузнецов В.В.
Доктор медицинскихнаук,профессорВозныйЭ.К.
Ведущееучреждение:
ФГБУ«Научно-исследовательский институтонкологии им. Н.Н.Петрова»Минздравсоцразвития России
Защита диссертациисостоится « 26 »декабря 2011года в _____ часов на заседанииДиссертационного совета Д.208.081.01 приФГБУ«Российский научный центррентгенорадиологии»Минздравсоцразвития России по адресу: 117997, г. Москва, ул.Профсоюзная, д. 86.
С диссертацией можноознакомиться в библиотеке ФГБУ «РНЦРР» МинздравсоцразвитияРоссии (117997, г. Москва, ул.Профсоюзная, д. 86)
Автореферат разослан «»ноября2011 г.
Ученый секретарьдиссертационного совета,
доктор медицинскихнаук,профессорЦаллагова З.С.
ОБЩАЯ ХАРАКТЕРИСТИКАРАБОТЫ.
Актуальность проблемы.
Эффективное лечение местно-распространенныхформ рака шейки матки (РШМ)остается одной из важнейшихмедико–социальных задач современнойонкогинекологии. Поданным ВОЗ (2006), ежегодно в мире выявляется около 370 000 новыхслучаев заболевания, приводящего к смерти 250 000женщин в год, из которых 190 000 (51,4%)умирают от РШМ в течениепервого года с момента установлениядиагноза (WHO,2006; Jemal A., 2010). ВРФ за последние 7 лет число женщин с впервыеустановленным РШМ выросло на 8%, составляя всреднем 12 215случаев в год, до 40%которых представленызапущенными формамизаболевания (41,2% –в 2002 г., 40,6% – в 2007 г.). Анализ динамикипоказателей смертностиот РШМ в РФ также не демонстрирует за указанный период отчетливой тенденции к снижению,составляя 5,2-5,3 на 100 000 женского населения вгод, причем в некоторыхрегионах отмечено превышение этих показателей (Мерабишвили В.М., Урманчеева А.Ф.,1999; Давыдов М.И., Аксель Е.М., 2007; Важенин А.В.с соавт., 2010; Чиссов В.И., Старинский В.В.,2010).
Особую опасностьпредставляет распространенность данногозаболевания среди молодыхженщин до 40 лет. За период с 1990 года по 2007 год ввозрастной группе 15 – 24 года заболеваемость РШМ в РФувеличилась в 4 раза, в группе 25–34 года – в 2,5 раза,; при этомсмертность от РШМ в возрастных категориях20–29 и 30–39 летувеличилась за 15 летв различныхрегионах страны в1,5 – 2,2 раза, являясь основной причиной смертиот онкологического заболевания в указанной возрастной категории(Новикова Е.Г. с соавт., 2000,2008;Урманчеева А.Ф., 2002; АшрафянЛ.А. с соавт., 2003, 2004,2008; Демидова Л.В. с соавт., 2005, 2008; Кузнецов В.В.,2005; Чиссов В.И. с соавт.,2010).
В целом, в настоящеевремя в РФ до70% больных РШМ подвергаются лечению по поводу опухоли,выходящей за пределы органа и имеющейпризнаки местного распространения наприлежащую клетчатку, влагалище,лимфатические узлы таза и брюшнойполости (Костромина К.Н., 1999;Титова В.А. с соавт., 2003, 2006; Ашрафян Л.А. с соавт., 2004, 2008;Демидова Л.В., Бойко А.В., 2006, 2008; Кузнецов В.В.,Морхов К.Ю., 2007; Крикунова Л.И. ссоавт., 2010). Единственным стандартизованнымметодом лечения местно-распространенногорака шейки матки (МРРШМ) в течение многихдесятилетий является сочетанная лучеваятерапия, отдаленные результаты которойв целом невысоки и непревышают по данным отчетов Cochrane Database 65% для II-й и 47% – для III cтадии заболевания (Green J., 2005).
Расширение границкурабельности, улучшение показателейвыживаемости и качества жизни больныхМРРШМ связываются большинством исследователей с расширениемпоказаний к многокомпонентномулечению, свключениемв программыхимиотерапии и хирургических вмешательстврадикального и сверхрадикального объема(Вишневская Е.Е., Косенко И.А.,1999; Максимов С.Я., Гусейнов К.Д., 2003; Кузнецов В.В. ссоавт., 2005; Ашрафян Л.А. с соавт., 2007;Крикунова Л.И. с соавт.,2010; Benedetti–Panici P., 2002, 2007; BartelinkH., 2002; Fowler J.,2004, Eifel P.,2004;Park D.C.,2009).Активное использование,начиная с 90х годов, в программах терапии МРРШМцитостатиков в различных сочетанияхпозволилоконстатировать в последнеедесятилетие ростабсолютного числа больных РШМ, подвергающихсякомбинированному и комплексному лечению. Вместе с тем в этот жепериод отмечено снижениена 15 - 20% числа больных, закончивших лечениепервоначально запланированного объема приобъективно регистрируемом ростепервичнойнеизлеченности (Аксель Е.М.,2004; Кандакова Е.Ю., 2002; Максимов С.Я., 2004; Чиссов В.И.,Старинский В.В., 2009; BlossJ.D.., 1995;Lopes–Graniel C., 2001;Grigsby P., 2001; Narayan K., 2008).Недостаточный учет преимущественныхвидов токсичности применяемыхцитостатиков, отсутствиеобъективных критериев выбора вариантамногокомпонентного лечения, формальные принципы планирования иреализации лучевой терапии в режимах,разработанных дляпринципиально иных клинических ситуаций, признаны ведущимипричинами, снижающими эффективность проводимогомногокомпонентноголечения,особенно на этапе внедренияпредлагаемых программ в практическоездравоохранение.
В тоже времярадиологические возможности вэффективной терапии этого заболеванияотнюдь не исчерпаны и используютсядалеко не полностью. Бурное развитиемедицинской техники, создание и внедрениев практику принципиально новогооборудования для дистанционного иконтактного облучения, появление целогоспектра аппаратов для высокоточной визуализации органов и тканей исовременных компьютерныхтехнологий для обработкиданных обуславливаюттехническую возможность достижениястойкого излечения иполноценной реабилитации женщин сзапущенными формами РШМ. Однако, различия втехническом оснащении и технологическомобеспечении самого радиологическоговоздействия, предлучевых этапов, проблемы унификации лечебногопроцесса и воспроизводимостиметодик, существенно влияют на результаты(Костромина К.Н., 2001; БойкоА.В., Демидова Л.В., 2002; Марьина Л.А. с соавт.,2008; Кравец О.А., 2010; Ling C., 2006;Narayn K., 2008).
Таким образом, внастоящее время назрела необходимость вформировании рационального, медицински иэкономически обоснованного подхода клечению МРРШМ, ключевым моментомкоторого является разработкаэффективной стратегии и тактикилучевого компонента терапии.
Цельисследования.
Улучшениерезультатов лечения больных МРРШМпутем разработки эффективной
стратегии лучевогоэтапа и принципов ее индивидуальнойреализации в программахмногокомпонентного леченияМРРШМ.
Задачи исследования.
- Определить принципы формирования программоблучения при различныхвариантах многокомпонентноголечения МРРШМ.
- Оптимизироватькомплекс топометрическойподготовки и мониторинга лучевойтерапии в многокомпонентном лечении МРРШМ наоснове синтеза данных ультразвуковой,рентгеновской компьютерной имагнитно–резонансной томографии.
- Разработатьстратегию и тактику внутриполостного идистанционного этаповпослеоперационной лучевойтерапии в многокомпонентном леченииоперированных больных МРРШМ.
- Обосноватьстратегию и тактику проведениявнутриполостного и дистанционного этаповсочетанной лучевой терапии в программаххимио-лучевого лечения МРРШМ – посленеоадъювантной химиотерапии и в единомкурсе с химиотерапией.
- Разработатьметодики проведения радикальнойсочетанной лучевой терапииМРРШМ в условиях локальнойрадиомодификации – пролонгированнойхимиорадиомодификации, лазериндуцированнойгипертермии, криогипотермии.
- Оценитьнепосредственные, ближайшие и отдаленныерезультатыисследуемых программ многокомпонентноголечения МРРШМ и дать ихсравнительную характеристику.
- Оценить характер,частоту, степень тяжести исроки развития осложненийисследуемых программ многокомпонентноголечения МРРШМ и дать их сравнительнуюхарактеристику.
Научная новизна.
Впервые при МРРШМ научно обоснованы иадаптированы применительно к отечественнойклинической практике методики визуально–контролируемойлучевой терапии, разработаны оригинальныекомплексы предлучевой подготовки и мониторинга лучевойтерапии в рамках многокомпонентного лечения МРРШМ на основеоптимизации сочетания ультразвуковой,рентгеновской компьютерной и магнитно-резонансной томографии.Определены современныепринципы формированияпрограмм лучевой терапии вмногокомпонентном лечении МРРШМ наосновании индивидуальных карт учета клинико-морфологических факторов прогноза, данастатистическая оценка влияния выделенныхфакторов на отдаленные результатылечения. Разработаныстратегия, тактика исформированы алгоритмы проведениялучевой терапии в многокомпонентномлечении оперированных и неоперированныхбольных МРРШМ на основе индивидуальноговыбора и коррекции параметровоблучения с учетом профиля токсичностииспользуемых цитостатиков,результатов предлучевыхэтапов лечения, динамики опухоли в ходереализации терапевтической программы.На репрезентативномклиническом материале – 828 больных МРРШМ– в рамкаходноцентровогоисследования проведенасравнительная оценка эффективности вариантовмногокомпонентного лечения МРРШМ,статистически обоснованы принципыпредпочтительного ихприменения. Разработанаметодика и научно обоснованацелесообразность расширения объемадистанционной лучевой терапии ссимультантным облучениемпараааортальных лимфатических узловбез пролонгации лучевого этапа уоперированных инеоперированных больных МРРШМ при высокомриске лимфогенногометастазирования. Разработаныпринципиально новые длялечения МРРШМ методики локальнойрадиомодификации – пролонгированнойхимиорадиомодификации сприменением текстильныхдепо-систем, криогипотермии,лазериндуцированной гипертермии(ЛИГТ), проведенакомплексная сравнительнаяоценка результатов применения, статистическиопределена целесообразность приоритетного использованияЛИГТ в качестверадиомодификатора при МРРШМ. Дана сравнительная оценкахарактера, частоты, степени тяжести, сроковразвития токсических реакций, ранних ипоздних осложнений при различныхвариантах многокомпонентного леченияМРРШМ в соответствии с международнымиклассификациями, статистическиобоснованы противопоказания иограничения к применению различныхпрограмм многокомпонентного леченияМРРШМ.
Практическаязначимость.
Комплексный анализклинико–морфологических факторов прогнозана каждом из этапов лечения МРРШМ сформированием индивидуальных картучета позволяетобъективизироватьпараметры выбора и коррекции программ терапии и рационализироватьрасходы на многокомпонентное лечениеМРРШМ. Реализация лучевойтерапии в программахмногокомпонентного лечения МРРШМ в рамкахпредлагаемых научнообоснованных алгоритмов– с дифференцированным выборомразовых и суммарных очаговых доз, объемов иритма облучения, сроков начала,длительности курса и последовательности его этапов,оптимизацией терапиисопровождения, в том числе сприменением оригинальногоозоно–лазерного комплекса для немедикаментозной профилактики и коррекции осложнений– стойкоулучшает на 20–30% общие результаты лечениябольных МРРШМ с повышением на 35–40% уровнялокального контроля. Предлагаемые программы не требуютпри внедрении в клиническуюпрактику принципиальнонового аппаратурного оснащения,воспроизводимы нарадиотерапевтических установкахразличных поколений, позволяют оптимизировать трудовые затраты персоналарадиологических и смежных диагностических служб иформировать экономичныережимы продуктивного использованиявысокотехнологичного оборудования. Внедрение новойметодикилокальной радимодификации – ЛИГТ – расширяет терапевтическийинтервал и общие границы курабельностибольных МРРШМ, на 15% повышая общуюэффективность самостоятельного лучевоголечения без системного примененияцитостатиков.
Основныеположения, выносимые назащиту.
- Современнаястратегия эффективного лечения МРРШМтребует перехода от конвенциальнойлучевой терапии кмногокомпонентным программам на основе сочетаниямодифицированных вариантов облучения с неоадъювантной химиотерапией ипри наличии условий – с радикальнымхирургическим вмешательством. Длявыбора и коррекции вариантамногокомпонентного лечения при МРРШМнеобходим комплексный анализклинико-морфологических факторов прогнозау каждой больной с формированиеминдивидуальных карт их учета до началалечения и на каждом из его этапов.
- Современнымстратегическим принципом, определяющимтактику проведения лучевых этапов в рамкахмногокомпонентного лечения оперированныхи неоперированных больных МРРШМ, являетсядифференцированный в соответствии срезультатами анализаклинико-морфологических факторов выборобъемов облучения, разовой и суммарнойочаговых доз, способов их подведения,вариантов профилактики и коррекцииосложнений. Технологическую основу даннойстратегии составляют адаптированные методикивизуально-контролируемойлучевой терапии с интеграцией современныхультразвуковых технологий встандарт топометрии и мониторинга.
Внедрение результатовисследования.
Основные результатыисследования одобрены и внедрены в практику Российскогонаучного центра рентгенорадиологииМинздравсоцразвитияРФ в виде внутреннего протокола леченияРШМ (С53/10),используются при подготовкеспециалистов в рамках первичной специализации по специальностям «Акушерство игинекология», «Онкология», «Радиология» ина циклах повышения квалификации,проводимых на базе РНЦРР, оформлены в виде новыхмедицинских технологий – «Послеоперационная сочетаннаялучевая терапия у больныхместно-распространенным раком шейки маткис учетом клинико-морфологических факторовпрогноза» (ФС №2009/151 от 15.06.2009),«Многокомпонентные программы лечения ракашейки матки, вульвы, влагалища и прямойкишки в условиях радиосенсибилизирующегодействия локальной лазернойгипертермии» (ФС №2009/389 от25.11.2009),«Комплекснаякоррекция осложнений многокомпонентноголечения злокачественных опухолейразличных локализаций сиспользованием озонотерапии и низкоинтенсивного лазерногоизлучения» (ФС №2009/391 от 25.11.2009), разрешенных с 2009года к применению влечебных учрежденияхпрактической сети, внедрены в клиническуюпрактику Челябинского областного клиническогоонкологического диспансера,Калужского областногоонкологического диспансера, отделенияонкогинекологии ГКБ№57 г. Москвы.
Апробацияработы.
Основные положениядиссертационной работы былипредставлены и обсуждены на международномконгрессе Невский радиологическийфорум «Наука - клинике» (г. С.-Петербург, 2005),Всероссийском Научном форуме «Радиология– 2005» (г.Москва, 2005), научнойконференции «Физико-технические проблемыи гарантии качества лучевой терапии» (г. Обнинск,2006г.), Всероссийской научно-практическойконференции «Высокие медицинскиетехнологии»(Москва, 2007г.), ХII онкологическомконгрессе (г. Москва, 2008г.), на заседанииМосковского Общества Онкологов (г. Москва,2008), научно–практической конференции РНЦРР (г.Москва, 2008г.), Международном конгрессепо онкохирургии (г. Краснодар, 2008), наЕвропейской школе онкологов (г. Москва,2009), Всероссийской конференции онкологов(г. Челябинск, 2010г.), на конгрессахЕвропейского Общества по ГинекологическойОнкологии (ESGO14th–16thBiennial Meetings) в 2005-2009гг,Международного Общества поГинекологическому Раку (IGCS 10th – 14th Biennial Meetings) в 2006 – 2010гг, ЕвропейскогоОбщества Терапевтических и РадиационныхОнкологов (ESTRO–25, Leipzig, 2006),Американского Общества по Брахитерапии(ABS) (Chicago, 2007, San Diego, 2011), Первом Всемирном Конгрессе поБрахитерапии (1st World Brachytherapy Congress, г. Бостон, 2008), 13мМеждународном Конгрессе ЕвропейскойМедицинской Лазерной Ассоциации (13thInternationalCongress of the European Medical Laser Association, г.Хельсинки, 2008). Апробация диссертационной работысостоялась на научно–практической конференции ФГБУ «РНЦРР»МинздравсоцразвитияРФ 30 мая 2011 года.
Публикации.
По теме диссертацииопубликовано 59 печатныхработ, в томчисле однамонография, 15статей вроссийских рецензируемых научныхжурналах, рекомендованныхВАК, в том числе в 5 журналахс международным цитированием, 43 тезиса докладов в материалах российских(25) изарубежных (18)конференций иконгрессов 2001–2011годов. Доклад ‘Optimal integration of 3D-sonography and MRI in gynecological brachytherapy (GYN-BT) image-guided individual planning’(Оптимальная интеграциятрехмерной эхографии и МРТ виндивидуальном визуально–контролируемомпланировании брахитерапиигинекологического рака) былотмечен как лучшаяпрезентация на 12м Биеннале Международного Общества поГинекологическому Раку (IGCS–12),г.Бангкок,2008. Наметодики лучевого лечения в условияхлокальной химиорадиомодификации сиспользованием текстильных депо-систем«Колетекс» в 2004 году получены патенты наизобретения РФ (№2268763 «Способ лечения ракашейки матки с экзофитной формой опухоли» от 27 июня 2004 года; №2268724 «Способ леченияонкологических больных с опухолевымпоражением влагалища» от 25 июня 2004года).
Объем и структурадиссертационной работы.
Диссертация написана нарусском языке, изложена на300 страницах машинописноготекста, иллюстрирована 67 рисунками, 45таблицами. Работа состоит из введения, обзоралитературы, семи глав собственныхисследований, заключения, выводов,практических рекомендаций и указателя литературы, включающего145отечественных и 220 зарубежных источников.
ОСНОВНОЕ СОДЕРЖАНИЕРАБОТЫ.
Материалы и методыисследования.
Общая характеристикаклинического материала.
Настоящее исследованиеносило характер одноцентрового нерандомизированногопроспективно-ретроспективного систорическим контролем;основным критериемвключения служило проведение лучевой терапии врамках первичного противоопухолевоголечения МРРШМбез признаковотдаленного органногометастазирования. Под определение МРШРМподпадали больные Ib2–IVb стадий, в окончательныйанализ включено 828 больных.
В основе качественной иколичественнойхарактеристикиклинического материала лежали данные клинико-инструментального илабораторного обследований,выполнявшихся всоответствии с федеральными стандартамиРФ и внутренними протоколами РНЦРР. Ультразвуковые исследованиявыполнялись на ультразвуковом сканере«Voluson 730Pro» (General Electric Medical Systems®,Австрия), компьютернаятомография (КТ) – на компьютерномтомографе Asteion® (Toshiba), магнитно–резонанснаятомография (МРТ) – на томографах«Open Pro View» (Marconi) с напряженностью магнитного поля 0,23Тли «Signa» (GЕ)1,5Тл. Рентгентопометрия и КТ–топометрия врежиме conebeamпроводилась на аппарате «SimulixHQ» (Nucletron). Анализ данных проводился с помощью стандартныхметодов медико–биологическойстатистической обработки с использованиемпрограммного обеспечения для ПК (SPSS 19, SAS 8.0 для Windows, Biostatistics Version 4.3).
Основную группу (500 чел.) составили двеподгруппы: послеоперационнойлучевой терапии (ПОЛТ) 246(49,2%) пациенток, консервативноголечения –254(50,8%) пациенток. Вподгруппу ПОЛТ вошли больные МРРШМпосле хирургическогоэтапа, проведенного в рамках комбинированного лечения (M–КОМБ) у 152(61,8%)чел., комплексноголечения (КОМПЛ) с этапом неоадъювантнойполихимиотерапии (НАХТ)– у 94(38,2%) чел..В подгруппуконсервативного лечениябыли включены 112(44,1%) пациенток с химио-лучевымвариантом терапии (ХЛЛ), у которых в едином(C–ХЛЛ) или последовательном (П–ХЛЛ) с сочетаннойлучевой терапией курсе применялась системная полихимиотерапия, атакже 142(55,9%) больные,получившие курс радикальной сочетанной лучевой терапиив условиях локальнойрадиомодификации (ЛРМ), в том числе в виде локальнойхимиорадиомодификации (ЛХРМ) – 52(36,6%)пациентки, локальнойлазериндуцированной гипертермии (ЛИГТ)– 65(45,8%)пациенток, локальной криогипотермии(КГТ) – 25(17,6%)пациенток. Контрольнуюгруппу составили 328 больныхМРРШМ после конвенциального лечения, проводившегося в РНЦРРв 1986-2000 гг., из них 232 чел. послерадикальной сочетаннойлучевой терапии (РСЛТ), 96 чел. –после комбинированного лечения(КОМБ).
Возраст больныхварьировал от 16 до 86 лет в основнойи от 18 до 84 лет – вконтрольной группах. Группы былисопоставимы по возрасту, значимыхразличий между группами поповозрастному распределению не выявлено(Р>0,05). Средний возрастбольных в основной группе составил 51 + 11,3лет, медиана 49 лет, вконтрольной 54 +14,2 лет, медиана 52 года. В обеих группахпреобладали пациентки репродуктивного иперименопаузального возраста (74% в основной, 72,9% вконтрольной группах), более трети заболевших вкаждой группе составляли женщины моложе 40 лет (32,8% восновной, 32,4% - в контрольнойгруппах). Значимой зависимости выбораметода лечения от возраста в основнойгруппе не выявлено (Р>0,05), хотяпрослеживается тенденция к сокращениюдоли больных, подвергнутых хирургическомувмешательству и ПХТ по мере нарастаниявозраста. В контрольной группе у больныхмоложе 40 летпрослеживается отчетливая тенденция кпреобладанию комбинированного лечения схирургическим компонентом; во всехвозрастных группах старше 50 лет в этот период превалироваларадикальная сочетаннаялучевая терапия.
Распределение больныхпо стадиям в основной и контрольнойгруппах достоверно не отличалось (Рис.1).Пациентки с Ib2 и IIa стадиейзаболевания включались в настоящееисследование только при первичномвыявлении опухоли более 4см в наибольшемизмерении; пациентки с IVb стадиейвключались только в случаях выявленияверифицированных метастазов впарааортальные, шейные или паховыелимфатические узлы, поэтому в исследованиевошли преимущественно пациентки с IIa–b – 288 (34,8%) и IIIa–b – 375 (45,3%) стадиями.Также в соответствии с критериямивключения в исследование входили 129(15,6%)больных Ib2 и 36(4,3%) больныхIVa–b стадии.
Анализзависимости выбора метода лечения отстадии заболевания (Рис.2), отмечено достоверно большеечисло больных Ib2 стадии в подгруппахкомбинированного лечения основной иконтрольной групп по сравнению с другимиподгруппами (Р<0,01), хотя более 60% больных ив этих подгруппах имели по формальнымпризнакам первично неоперабельныеопухолевые процессы; по постадийнойструктуре подгруппы комбинированноголечения основной и контрольной группдостоверно не отличались.
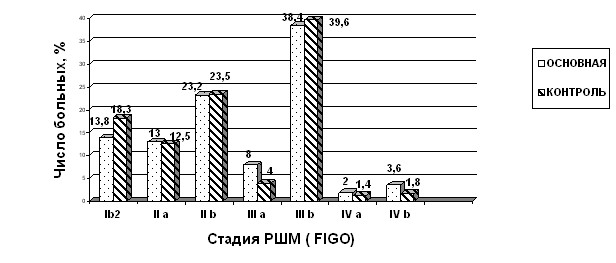
Рис. 1. Распределениебольных МРРШМ по стадиям всоответствии с классификацией FIGO, 2009, восновной и контрольной группах.
Наиболее тяжелый пораспространенности опухоли контингентбольных восновной группе концентрировался вподгруппах комплексного (КОПМЛ) и химио–лучевого лечения(ХЛЛ). В целом по тяжести контингенталеченых основная и контрольная группы былисопоставимы (Р>0,05 при всех сравнениях).
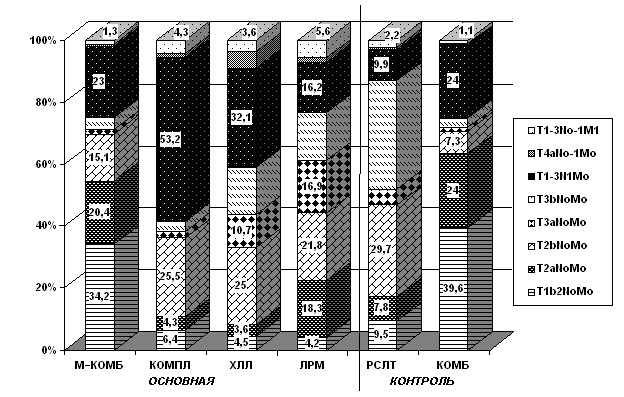
Рис. 2. Распределениебольных по стадиям TNM в соответствии свариантом лечения в основной и контрольнойгруппах.
Преобладающеечисло пациенток, входившихв исследование, характеризовалосьнеблагоприятными формамироста первичной опухоли: у 555(67%) из нихвыявлялись опухоли с эндофитной исмешанной формой роста, затрудняющейадекватную клиническуюоценку распространенности; у 116(14%)больных определялисьинфильтративно–язвенные формы, отличающиесянеблагоприятным клиническим течением итехническими трудностями в реализациивсех видов локального противоопухолевоговоздействия. Достоверных различий междуосновной и контрольной группами враспределении больных по форме ростапервичной опухоли не выявлено, преобладал смешанныйвариант (44,6% в основной, 47,6%– вконтрольной группах соответственно).Группы также достоверно не различались враспределении больных по форме ростапервичной опухоли в соответствии свариантом лечения.
По морфологическомустроению преобладающее большинствоопухолей –656 (79,3%) –имели строение плоскоклеточного ракаразличной степенидифференцировки без достоверных различий в частоте междуосновной и контрольнойгруппой; вовсех подгруппах преобладали умеренно- и высокодифференцированные егоформы, низкодифференцированныйплоскоклеточный рак достоверно чащевстречался в основной группе – 22,8% против 9,5% вконтрольной (P<0,01). Опухоль былапредставлена аденокарциномойразличной степени дифференцировки у 127(15,3%)больных, у 64(12,8%) – восновной и у 63(16,5%) – в контрольной группах, при этом до5% больных во всехподгруппах обеих группимели низкодифференцированные формыцервикальной аденокарциномы.Железисто-плоскоклеточный рак сразличными вариантами гистологическогостроения обоих компонентов был выявлен у45(5,4%) пациенток, у 35(2%) в основной и 10(3,1%) -в контрольной группах.
Из сопутствующейсоматической патологии пациентки,входившие в исследование, наиболее частострадали заболеваниямисердечно-сосудистой системы, эндокриннойпатологией, ожирением, патологией мочевыхпутей и заболеваниями ЖКТ. По спектру ичастоте выявления соматической патологииосновная и контрольная группы исоставляющие их подгруппы были сопоставимы.При этом у225(45%) больных в основной и 170(51,8%) – в контрольной выявлялось два иболее вида экстрагенитальной патологииодновременно, степень выраженностикоторых влияла на выбор параметровспециального лечения; более, чем половинебольных требовалась обязательнаякоррекция соматическойпатологии до начала противоопухолевойтерапии.
Общая характеристикаметодов лечения
Дистанционноеоблучение проводилось на отечественныхгамма-терапевтическихустановках «РОКУС»,линейных ускорителях электронов SL-75-5(Phillips), Clinac 2100-CD(Varian) с энергиейфотонов 5, 6, 18 МэВ.Внутриполостное облучениереализовывали наавтоматизированных брахитерапевтическихкомплексах,оснащенных изотопами60Со(«АГАТ-ВУ») и 192Ir высокой мощности(«Микроселектрон HDR»),с применением планирующихсистемам PLATO®и OncentraTCS® (Nucletron).
Облучению помодифицированным программам в основной группе были подвергнуты500 человек,изних 246(49,2%)больных былипредварительно оперированы по поводуМРРШМ в различныхучреждениях страны, в т.ч.135(55%) – напервом этапе лечения, 111(45,1%)– посленеоадъювантной терапии.254(51,8%) больных основной группылечились консервативно, в т.ч. 112(44,1%)чел. получили химио–лучевоелечение, у 142(55,9%) применялась только радикальнаясочетанная лучевая терапия слокальными вариантами радиомодификации.
Характеристикахирургического этапа леченияоперированных больных МРРШМ в основной иконтрольной группах представлена нарис. 3. Врамках модифицированногокомбинированного лечения в основнойгруппе лечились 152 пациентки (вариант М–КОМБ), из них 56 (36,8%)были оперированы в отделении онкогинекологии РНЦРР, 96(63,2%) – в другихучреждениях РФ и стран СНГ. 123(80,9%) больнымбыла выполнена расширенная экстирпация матки спридатками II–IIIтипа по Piver,21(13,8%) больной – простая экстирпация матки с/безпридатков, у 8(5,2%) пациенток объем операции былограничен надвлагалищной ампутацией матки составлением массива опухоли.
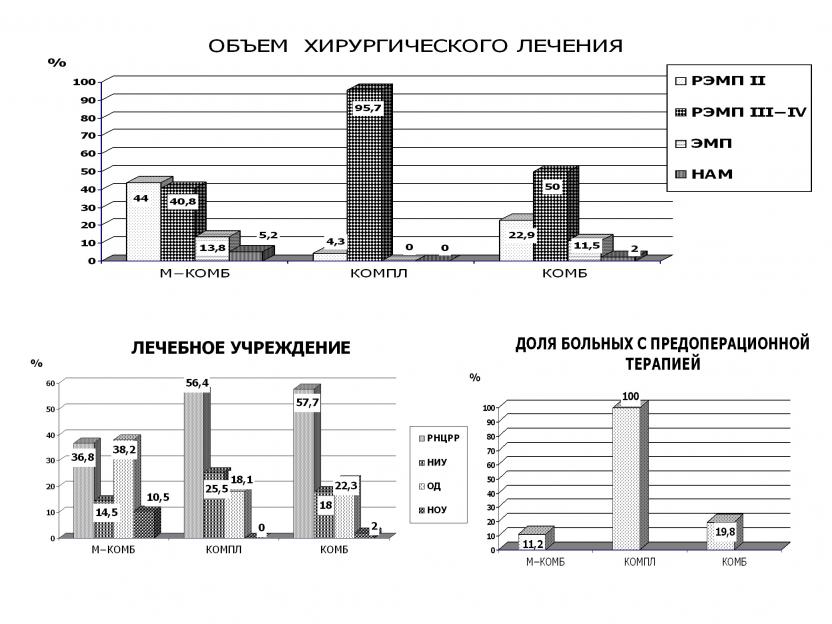
Рис. 3. Характеристикахирургического этапа леченияоперированных больных МРРШМ в основной иконтрольной группах
(М–КОМБ- – модифицированное комбинированноелечение, основная группа; КОМПЛ– комплксноелечение, основная группа; КОМБ–комбинированноелечение, контрольная группа; РЭМП – расширенная экстирпация матки спридатками II–IVтипа по Piver;ЭМП–экстирпация матки с придатками;НАМ–надвлагалищная ампутация матки; НИУ–научно–исследовательские учреждения;ОД–онкодиспансеры; НОУ–неонкологическиеучреждения).
17(11,2%) больным проводилось неоадъювантное лучевоелечение до СОД на опухоль30–40Гр;III–IV степень терапевтическогопатоморфозазафиксирована в результате неоадъювантноголечения только у половины из них – 9(5,9%)больных.
94 пациентки основной группы подвергалисьоблучениюв рамках комплексноголечения (вариант КОМПЛ) – после хирургического вмешательствас предшествовавшейнеоадъювантной химиотерапией в платиносодержащихрежимах – НАХТ (Табл.1).
Таблица 1.
Распределениеоперированных больных основнойгруппы в соответствии сосхемами НАХТ.
Характеристика СХЕМА | PtFu (Xe) CDDP100mg/m2 (Carboplatin AUC 5) 1d 5FU 500mg/m2 1–5d (Xe 2000mg/m2 1–14d) | TPt Тх 135mg/m2 ( Тdx 75 mg/m2) 1d CDDP75mg/m2 (Carboplatin AUC 5) 2d | Другие Pt | Всего | |
| Число больных, чел (%±sp) | 36 38,3±5,0 | 46 47,9±5,2 | 12 12,8±3,4 | 94 100 | |
| Число больных и кол–во циклов, чел (%) | 1 | 6 16,7 | 8 17,4 | – | 14 14,9 |
| 2 | 22 61 | 38 82,6 | 2 16,7 | 62 66 | |
| 3 | 8 22,2 | – | 6 50 | 14 14,9 | |
| 4 | – | – | 4 33,4 | 4 4,2 | |
| Среднее число циклов | 2,1±0,6 | 1,83±0,4 | 2,5±0,9 | 2,1±1,3 | |
| Средний период до хирургическоговмешательства, дней | 45±25,0 | 69,3±12,5 | 106,6±20,5 | 64,8±19,7 | |
* %±sp–выборочная доля и стандартная ошибка долив процентах; **5FU –5–фторурацил, CDDP –цисплатин, Carboplatin –карбоплатин, Xe – капецитабин (кселода), Тx – паклитаксел,Тdx – доцетаксел,Hem – гемцитабин.Другие Pt– другие режимы ПХТс включениемв комбинации препаратовплатины. %±sp – выборочная доля истандартная ошибка доли в процентах
90(95,7%) пациенток в этойподгруппе были оперированы в объемерасширенной экстирпации матки спридатками III-IVтипа, только у 4(4,2%) больныхтазовые лимфоузлы не былиудалены из–за технических сложностей.Достоверно реже приварианте КОМПЛ имелисьуказания на визуально определяемуюостаточную опухоль – в 7(7,4%) случаях против 38(25,7%) в подгруппах комбинированноголечения,Р<0,05.
В послеоперационномпериоде всем больнымподгруппы ПОЛТ проводилась модифицированнаясочетанная лучевая терапияна область таза, дополненная профилактическим облучением зоныпарааортальных лимфоузлов у 100(40,7%)оперированных больных МРРШМ с высокимриском лимфогенного метастазирования, по 50больных привариантах М–КОМБ (32,9%) и КОМПЛ(53,2%).
254 больных МРРШМ восновной группе были подвергнуты консервативномулечению; из них у 112(22,4%)пациенток реализованы химио-лучевыеварианты терапии (подгруппаХЛЛ), 142(55,9%) больные былилечены радикально сочетанной лучевойтерапией в условиях разработанных нами методов локальной радиомодификации (ЛРМ). Курс ХЛЛвключал сочетанную лучевую терапию врежиме двухэтапного облучения и цикловуюполихимиотерапию, проводившуюся на предлучевомэтапе у 78(69,6%) больных илисимультантно с облучением, начиная с 1- 3дня– у 34(30,4%)больных. Использовались комбинированные схемы свключением препаратовплатины (цисплатин, карбоплатин), таксанов(паклитаксел, доцетаксел),гемцитабина,5-фторурацила, циклофосфана, блеомицина,доксорубицина в стандартныхтерапевтических дозах, с числом циклов от 1до 4, по 2–3цикла у 89(79,5%) леченых (Табл.2.). Достоверных различий в частотеприменения тех или иных схем ПХТ в рамкахпоследовательного или симультантного курсов ХЛЛ неотмечено, в обоих случаях преобладалиплатиносодержащие схемы ПХТ.
Таблица 2.
Распределениенеоперированных больных основнойгруппы в соответствии сосхемой ПХТ
Подгруппа ХЛЛ СХЕМА | PtFu (Xe) CDDP100mg/m2 (Carboplatin AUC 5) 1d 5FU 500mg/m2 1–5d (Xe 2000mg/m2 1–14d) | TPt Тх 135mg/m2 ( Тdx 75 mg/m2) 1d CDDP75mg/m2 (Carboplatin AUC 5) 2d | HemPt H 800mg/m2 1, 8d CDDP75mg/m2 2d | Другие Pt | Другие Non-Pt | Всего | ||
| Число больных, чел (%±sp) | П–ХЛЛ | 18 23,0± 4,8 | 28 35,9± 3,6 | 10 12,8± 3.8 | 10 12,8± 3.8 | 12 15,4± 4,1 | 78 69,6± 4,3 | |
| С-ХЛЛ | 8 23,5± 7,3 | 11 32,4± 8,0 | 6 17,7± 6,5 | 4 11,8± 5,5 | 5 14,7± 6,1 | 34 30,4± 4,3 | ||
| Всего | 26 23,2± 4,0 | 39 34,8± 4,5 | 16 14,3± 3.3 | 14 12,5± 4,1 | 17 15,2± 3.4 | 112 100 | ||
| Число больных и кол–во циклов, чел (%) | 1 | – | – | 7 43,7 | 4 28,6 | 3 17,6 | 14 12,5± 4,1 | |
| 2 | 15 57,7 | 25 64,1 | 9 56,3 | 5 35,7 | 6 35,3 | 60 53,6± 4,7 | ||
| 3 | 5 19,3 | 14 35,9 | – | 5 35,7 | 5 29,5 | 29 25,9± 4,1 | ||
| 4 | 6 23 | – | – | – | 3 17,6 | 9 8,0±2,5 | ||
| Среднее число циклов | 2,7±0,8 | 2,4±0,5 | 1,6±0,5 | 2,1±0,8 | 2,5±1,0 | 2,3±0,8 | ||
* П–ХЛЛ– последовательноехимио–лучевое лечение;С–ХЛЛ– симультантноехимио–лучевое лечение; 5FU–5– фторурацил,CDDP – цисплатин,Carboplatin–карбоплатин, Xe – капецитабин (кселода), Тx – паклитаксел,Тdx – доцетаксел,Hem – гемцитабин.Pt–платиновые режимы ПХТ, Non–Pt–бесплатиновые режимы ПХТ. %±sp–выборочная доля и стандартная ошибка долив процентах
Локальнаяхимиорадиомодификация (ЛХРМ) в видепролонгированных 24-часовых аппликацийтекстильных депо-систем, содержащихцитостатики 5-фторурацил (салфетки«Колетекс–5ФТУР», рег.удостоверение ФС 01035263/1810-05 от 16.06.2005г)
и проксифеин (патентына изобретение РФ №2268763 «Способ лечения рака шейкиматки с экзофитной формой опухоли» от 27января 2006 года и №2268724 «Способ леченияонкологических больных с опухолевымпоражением влагалища» от 27 января 2006года) применялась на первом – дистанционном– этапеоблучения у 52(36,6%) пациенток.У 90 (63,4%) пациенток ЛРМ проводилась навтором этапе совместно с внутриполостнымоблучением, в том числе в виде локальнойлазериндуцированной гипертермии (ЛИГТ) наотечественной лазерной установке «Лазон-ФТ» (сертификатсоответствия РОСС RU.ИМ 02В16418 от 23.09.2009г.,рег. удост. ФСР №2009/04660 от 02 апреля 2009г.)– у 65(45,8%)пациенток; локальной криогипотермии(КГТ) на установке «КРИО-ИНЕЙ» (регистрационное удостоверениеМинздрава России №29/15040698/1893-01, сертификатГосстандарта № РОСС RU.ИМО4. ВО2761) – у25(17,6%) пациенток.
Сочетанная лучеваятерапия у неоперированных больных МРРШМ восновной группе проводилась всоответствии с отечественной традициейлучевой терапии гинекологического рака– в дваэтапа, с включением на первом – дистанционном– этапев клинический терапевтический объем(CTV) всейобласти таза, РОД 1,8 – 2Гр, на втором – сочетанном– ДЛТ РОД 2–2,4Грпроводилась только на область тазовых(обтураторных, пресакральных, наружных,внутренних, общих подвздошных)лимфатических узлов в соответствии спервичной распространенностью опухоли, СОД 44-48Гр, апервичный очаг облучалсяпреимущественно контактно, сприменением брахитерапевтических комплексов «АГАТ-ВУ» и «Микроселектрон HDR», с режимами фракционирования 5– 6Гр 2 раза внеделю до СОДэкв 40 – 50Гр в точке Аили по терапевтическомуизодозному контуру, соответствовавшемулечебному объему с высокимриском рецидива (HR–CTV). У14(5,5%) больных с визуализирующимисяметастазами в тазовых лимфатических узлахРОД на зоны метастазов эскалировалась до2,3–2,4Гр входе единого сеанса ДЛТ по принципу«field–in field». У 73(15%) неоперированных больных,вошедших в исследование, свизуализированными по УЗИ и КТ/МРТметастазами в лимфоузлы, включая 17(3,5%)больных с визуализированными передначалом лучевого этапа леченияметастазами в парааортальные лимфоузлы,объем облучения расширялся за счетоблучения средне-нижней группыпарааортальных лимфоузлов до уровняTh12.
В контрольной группеиз 328 больных МРРШМ после конвенциальноголечения, проводившегося в РНЦРР в 1986-2000 гг.,232 больным (подгруппа РСЛТ) была проведенарадикальная сочетанная лучевая терапия,соответствовавшая отечественномустандарту терапииРШМ. Суммарные дозы наопухольварьировались в зависимости от стадии от64–66Гр до70–72Гр вабсолютных величинах, не превышая 130–140 ед. ВДФ. Парааортальная область вконтрольной группе облучалась только у 5(2,2±1,0%)больных IVстадии с визуализированными до начала лечения метастазами впарааортальные лимфоузлы, после полногокурса радикальной сочетанной лучевойтерапии на таз. Дополнительного облученияшейных или паховых лимфоузлов в ходенашего исследования непроводилось. Послеоперационное облучениев рамках комбинированноголечения в контрольной группе (подгруппаКОМБ) проводилось 96 больнымМРРШМ, из нихпосле неоадъювантнойлучевой терапии – у 19(19,8%). В РНЦРР были оперированы 65(67,7%) больных,31(32,3%) – вдругих профильных учреждениях СоветскогоСоюза, РФи СНГ. Среднегодовоечисло больных МРРШМ, пролеченных в рамкахкомбинированного лечения в указанныйпериод –6,86±2,1 чел. –было достоверно (Р<0,02) ниже аналогичногопоказателя (21,7±4,8 больных в год) в основнойгруппе.
Таким образом,несмотря на изначальнонерандомизированный характерисследования, основная и контрольнаягруппа достоверно не различались постандартным прогностическим параметрам:возрастному составу исследуемых, наборустадий основного заболевания,морфологическому строению, форме ростаопухоли, спектру и степени выраженностисоматической патологии. Достоверныеразличия оцениваемых групп были связаны сразличиями в примененных методах лечения,обуславливавших необходимость разработкиновых подходов к планированию и реализациилучевого этапа лечения МРРШМ, что исоставляло предмет нашегоисследования.
Результатыисследования.
В рамках решенияпервойзадачи настоящегоисследования, для определенияпринципов формирования программ облученияпри различных вариантах терапии больныхМРРШМ, на основаниикомплексного анализа первичнойдокументации нами были выделены 20 основных клинико-морфологических факторов, чье влияние наотдаленные результаты могло бытьподвергнуто сравнительному анализу восновной и контрольной группах. Для этого первоначально было оценено влияние выделенных факторов на общую и безрецидивнуювыживаемость уоперированных и неоперированных больных МРРШМ в контрольной группе.
На основании данныхмногофакторного регрессионного анализа иоценки силы корреляционных зависимостейбыло установлено, что уоперированных больных МРРШМ, подвергнутых конвенциальномукомбинированному лечению,значимыми факторами,неблагоприятно влияющимина отдаленные результаты,являются: объем первичной опухоли до началалечения более 30см3 (r=0,967); инвазия стромы шейки маткиболее 1/3 (r=0,91); распространение на тело матки синвазией в миометрий более 5мм (r=0,87); внеорганноераспространение (параметрии, влагалище)(r=0,998); низкая (0-I) степень терапевтическогопатоморфоза в первичной опухоли посленеоадъювантного лечения (r=0,778); элементы опухоли вгранице резекции (r=0,96); опухолевые эмболы в лимфатическихщелях и кровеносных сосудах (r=0,996); метастазы в лимфатические узлы таза (r=0,998); наличие остаточных опухолей в тазупосле хирургического этапа (r=0,998); интраоперационнаякровопотеря с последующей стойкой анемией2-3 степени(r=0,768).
Для неоперированныхбольных МРРШМ, лечившихся по стандартнымметодикам радикальной сочетанной лучевойтерапии, значимыми фактораминеблагоприятного прогноза (ФНП) явились:объем опухолевого поражения на моментначала лучевого этапа более 50см3 (r=0,837);низкодифференцированные иинфильтративноязвенные формы опухоли (r=0,993); эндофитнаяформа роста первичной опухоли (r=0,76); аденогенныегистологические формы (r=0,78);распространение опухоли на матку споражением средней и верхней трети (r=0,8); опухолевоепоражение влагалища (r=0,94); поражениепараметральной клетчатки протяженностьюболее 1/3 параметрия (r=0,946); признаки метастатическогопоражения тазовых (r=0,993) и парааортальныхлимфатических узлов (r=0,998); анемияболее IIIстепени до начала и стойкая анемия II и болеестепени во время консервативного лечения(r=0,87); общаяпродолжительность лучевого этапа более 60дней (r=0,69); хронические заболеваниякишечника, мочевого пузыря (r=0,7).
На основанииполученных данных нами были сформированыиндивидуальные «Картаучета факторов прогноза», заполнявшиеся восновной группе на каждую больную доначала лучевой терапии наосновании доступнойпервичной документации.Уоперированных больных дополнительнофиксировались особенностихирургического лечения (вскрытиепросвета полых органов, техническиетрудности при вхождении в забрюшинноепространство, выделении мочеточников,выполнение резекции и пластикимочеточников, мочевого пузыря, кишки,наличие и локализация анастомозов),существенное нарушение топографии органовмалого таза после хирургического этапа,продолжительность послеоперационногопериода в сутках до начала лучевоголечения. На основании текущегоклинико-ультразвукового обследования в«Карту» вносились данные о состояниирубца в куполе влагалища, наличии и размереобъемных образований в полости таза.Оценивалось общее состояние больной припоступлении на облучение по шкалеECOG,фиксировались анамнестические данные обосложнениях IIcтепенисо стороны кишечника,мочевого пузыря, кожи, слизистых, гематологическиенарушения.
У неоперированныхбольных МРРШМ в «Карту» дополнительновносились сведения об объеме ираспространенности опухоли на моментначала лучевого лечения, дополняемыесхемой и конкретизированными порезультатам УЗИ,КТ, МРТ данными о степенивовлечения в опухолевый процесс теламатки, влагалища, клетчаточныхпространств, указывалианатомо–топографическиеформы опухоли, возможность адекватногоразмещения внутриполостных излучающихсистем. Впоследствии вэту же карту вносились данные о динамикеопухолевого процесса на СОДэкв 20,30,40,60Гр наопухоль и общий непосредственный эффектлечения на момент его окончания,дополняемые графическиманализом, фиксироваласьинформация об осложнениях.После НАХТ вкарту дополнительно включались данные обобщем эффекте химиотерапии, степенитерапевтического патоморфоза в первичнойопухоли, фиксировались осложнения IIстепени в ходе НАХТ со стороныпериферической крови, кишечника, мочевогопузыря.
Анализ частоты указанныхФНП в подгруппе ПОЛТ основнойгруппы (Приложение 1,табл. 1) позволил заключить,что у всех оперированных больных МРРШМ восновной группе имелись основания для проведенияпослеоперационной лучевой терапии на ложеопухоли и зоны регионарногометастазирования. Эффекты проведенногонеоадъюватного лечения во всех случаях небыли достаточными для отказа отпослеоперационного облучения в связи свыявлением значимых ФНП, причем сочетаниетрех и более ФНП было установлено у 89(80,1%)леченых предоперационно. В совокупностирезультаты предлучевых этапов позволялипланировать стандартный профилактическийкурс ПОЛТ только у 10% больных исследуемойгруппы; у 90,2% оперированных больных МРРШМ восновной группе программы облучения напослеоперационном этапе требовалимодификации с целью преодолениянегативного влияния выделенных ФНП.
Для неоперированныхбольных МРРШМ, учитывая тяжестьконтингента и бесперспективностьпроведения стандартной сочетанной лучевойтерапии, исходя извыявляемости и силы влиянияустановленных ФНП (Приложение 1, табл. 2),успех лечения связывался нами не с прямымувеличением дозы в опухоли в рамкахмонотерапии,а с синергичным сочетанием несколькихметодов противоопухолевого воздействияпри минимальной суммации побочныхэффектов. Основнымнаправлением методическихразработок у этой категориипациенток явилосьформирование эффективных ибезопасных программ облучения наоснове адаптации дляМРРШМ технологийвизуальноконтролируемой лучевойтерапии приразличных вариантахсочетания с цитостатиками илокальнымирадиомодификаторами несколькихмеханизмов действия.
В рамках решениявторойзадачи настоящего исследования былиоптимизированы комплексы топометрическойподготовки и мониторинга лучевой терапиив рамках исследуемыхвариантовмногокомпонентного лечениябольных МРРШМ на основеиспользования эхографии как базовогометода визуализации, наравне с КТ-МРТ-топометрией. Уоперированных больных МРРШМ алгоритм предлучевойУЗ-топометрии предполагалполучение изображения культи влагалища впоперечной и саггитальной плоскостях ив трехмерном изображении, измерениелинейных размеров и площади вагинальногорубца, визуализацию границы с мочевымпузырем, прямой кишкой сизмерением толщины стенкиполых органов для выбора объема 100%изодозного контура привнутриполостном облучении. Эхографическиймониторинг с выполнением УЗ–топометрии передкаждой фракцией внутриполостногооблучения позволил избежатьнеобоснованных процедур репланирования у 70%оперированных больных МРРШМ, а в 30%осложненных случаев – своевременноопределить показания и сроки проведенияповторной КТ-МРТ–топометрии. Проведениерентгентопометрии в двух режимах – рентгеновскойсимуляции и КТ – топометрии, в т.ч. сиспользованием технологии cone beam, требовало предварительного пероральногоконтрастирования для дифференцировки внутреннихструктур таза – мочевого пузыря, прямой кишки,петель тонкого и толстого кишечника. Внеосложненных случаях лечебный объем длядистанционного и контактного облученияформировался в ходе единойпроцедуры. Безопасное проведениеадъювантного облучениязоны парааортальныхлимфоузлов потребовалопредварительного выполнения ЭГДС, а также- дополнительногоконтрастирования желудка и12-перстной кишки специальной смесьюпри проведении рентгеновской и КТ- топометрии сцелью минимизации объема этих органов,входящих в терапевтический объем.
Одной из узких задачнастоящего исследования являлосьформирование адекватного алгоритмапредлучевой подготовки и выбороптимальной программы лучевой терапиив лечения больных МРРШМс транспозициейяичников. При этом входе комплексногоУЗ-КТ-планированияопределялось точное месторасположениеяичников, оценивалась их эхоструктура иособенности васкуляризации, после чегона уровне центра яичника накожу больной выносилась метка. При плоскостном планированииоблучения на гамма–терапевтических установках и ЛУЭ5–6МэВвыбор предполагаемойпрограммы ПОЛТ, характераформирующих устройств осуществляли всоответствии с анализом дозныхраспределений от каждого видаоблучения не только на уровнепланирования, но и на уровнепроекции транспонированных яичниковили верхних границ полей,максимально приближенных к ним, спредварительным расчетом суммарнойдозы, приходящейся на яичники,вводимых в планирующую систему как«зоны интереса». При 3D-планировании после этапаУЗ–топометрии яичникивизуализировались на серии КТ или МРТ иоконтуривались как дополнительные органыриска, дозы в оценивались по гистограммам«доза–объем». Средняя суммарная доза натранспонированных яичниках при облучениина гамма–установках составила 3,8±1,1Гр; прилечении на ЛУЭ Clinac 2100 с энергиями фотонов 6-18МэВ – 1,95±0,9Гр, чтодополнительно свидетельствует опреимуществахвизуально-контролируемой лучевой терапииперед конвенциальными вариантамиоблучения.
У неоперированныхбольных МРРШМ основной группыдинамическое измерениеобъемов первичной опухоли и определяемыхметастатических очагов (т.н. волюметрия)проводилосьсогласно современным требованиям RECIST1.1, 2000, и рекомендациямGEC–ESTRO, с помощью КТМРТтомографии,выполнявшихся постандартизированным методикам, и параллельно – на основанииданных ультразвукового исследования в2D–3Dрежимах «серой шкалы».УЗ-волюметрии первичного очага предшествовала оценка в режиме 2D формы шейки и тела матки,эхоструктуры всех внутренних половых органов,при этом особое внимание уделялось областиперешейка, стенок влагалища,ретровезикальной клетчатки, другихклетчаточных пространств таза, оцениваласьровность и четкость контуроввизуализируемых анатомическихструктур,после чего приступали непосредственно кволюметрии. При использовании только2D- эхографиив В–режиме впервые два года набора больных висследование, на этом этапе проводилисьизмерения трех наибольших размеровопухолевого очага в сагиттальной (длина, а,толщина, c,) ипоперечной (ширина,b) плоскостях, после чего объемвычислялся по формуле расчета объемаэллипса (0,5236хaхbхс).При сложной конфигурации опухолиизображения виртуально делились на части,близкие по форме к эллипсоидной; объем еерассчитывался как сумма объемоввиртуальных частей. В последующем принакоплении опыта трехмерной эхографии в В–режиме при РШМ, объемная информация собиралась вавтоматическом режиме. Дальнейшаякомпьютерная обработка изображения и оконтуривание мишени повышало точность волюметрии на5–10%.
Динамическаяволюметрия выполнялась всем 254 больнымподгруппы консервативного лечения восновной группе до начала лучевоголечения, после ДГТ СОД20Гр или перед первымсеансом ВПГТ и в дальнейшем перед каждойфракцией внутриполостногооблучения. За курс лечения уодной больной выполнялось в среднем11,2±1,6 исследований [9 – 14], по результатамизмерений оценивалидинамику размеров опухоли путем расчетапроцента регрессии объемов измеряемыхочагов и кратность регрессии n,определяемую как отношение первичногообъема опухоли-мишени V1 кизмеренному в момент n ее объему Vn. Поокончании лечения данные фиксировалисьв истории болезни в виде графика, косвенноотражающего полноту и темпрегрессии.
Во всех случаях вшейке матки,измененной по форме и структуре у всехбольных, определялся опухолевый очаг,отличавшийся по эхогенности отокружающих тканей, измеряемый вподавляющем большинстве случаев. Контурыопухоли во всех случаях были неровными,структура –неоднородной, с гипоэхогенными ианэхогенными зонами и линейнымигиперэхогенными включениями. При переходеопухоли на матку нарушалась илиотсутствовала дифференциация слоев теламатки в этой зоне, структура тела матки вобласти поражения соответствоваластруктуре опухоли шейки матки, границаперехода опухоли с шейки на тело маткиотсутствовала. Технические сложности воценке объема опухоли на этом этапевозникали преимущественно при некоторыхвариантах распространения опухоли навлагалище и параметральную клетчатку.Cравнительный анализ УЗ– и МРТ–изображений наэтом этапе продемонстрировал значимое, носравнимое снижение чувствительности обоихметодов в отношении оценкисостояния параметриев – до 67% и 74%соответственно, однако, дальнейший анализ позволил дифференцироватьварианты поражения параметральнойклетчатки, исходя из возможных механизмових развития, и выявить соответствующиеразличия в их УЗ- и МР-визуализации. Так,при прямом распространении опухоли на клетчатку со сторонышейки матки инфильтраты впараметриях не имели границс опухолью шейки матки,однако, отличались поэхогенности и тканевой плотности от окружающих тканей иподлежали измерению какединый опухолевый конгломерат с шейкойматки.Рост опухолив параметриях из метастатическиизмененных лимфатических узлов характеризовалсявизуализацией в области параметриев измеряемого опухолевого очага с измененнойэхогенностью, накапливающего контрастноевещество при МРТ, который помере роста мог сливаться сопухолью шейки матки и, соответственно,измеряться в общемобъеме опухоли. В тоже время поражениепараметриев по типу ракового лимфангоитаза счет эмболизации элементами опухоли лимфо–васкулярных пространств может быть отнесено к неизмеряемым;при УЗИ вВ–режиме вэтих случаях определяласьнеровность, нечеткость,«изъеденность» боковыхконтуров шейки матки; наМР–томограммах этотвид инфильтрации определялся как выраженная тяжистостьприлежащей клетчатки с неравномернымнакоплением контрастного вещества. В этих случаяхтребовалосьдополнительно в ходе планированиямаркировать и контролировать эти зоны какотдельные «зоны интереса», наравне свизуализируемой опухолью–мишенью, и включать вмаксимально доступном объеме втерапевтический изодозныйконтур. При динамическихисследованиях после подведения на первичный очагСОДэкв 30–40Гр необходимоиспользовать аппаратурныевозможности подстройки УЗизображений, с преимущественнойвизуализациейтрансвагинальным итранректальным доступом.
Выполнениединамической УЗ-топометриив рамках мониторингавнутриполостного облучения при консервативномлечении МРРШМ позволяло индивидуально подобратьконструкцию эндостатов,контролировать положениеаппликатора относительноопухоли, выбирать объемтерапевтического изодозного контура(CTV),определять зоны эскалации и щажения,что всреднем вдвое с 4,2±0,7 до 1,8±0,4 раз сократило число процедур КТ/МРТ-планирования.
Сформированные алгоритмы визуального контроля икоррекции параметровоблучения явилисьтехнической платформой для модификации лучевоговоздействия при многокомпонентномлечении больныхМРРШМ. Наэтапе послеоперационного облучения,стратегия и тактикакоторого разрабатывались врамках решения третьей задачи нашегоисследования, основным направлением стал дифференцированный выбор согласно установленных ФНП сроков начала лечения,длительности курсаЛТ и последовательности егоэтапов, лечебного объема, разовых исуммарных очаговых доз дистанционного ивнутриполостного облучения, способов ихподведения к «мишени» и областям сосниженной тканевойтолерантностью. Сформированный алгоритм модифицированной ПОЛТ у оперированныхбольных МРРШМ (Приложение 2а–г) предусматривал начало облученияуже на 14 - 18 сутки. При облучениизажившего вагинального рубца с использованием источниковСо60HDR ккуполу влагалища подводили трехканальный метракольпостатс размещениемизлучателей в одной горизонтальной плоскости.В зависимости от состояниякупола культи влагалища и терапевтическихзадач овоиды могут быть как плотно прижатык центральному эндостату, так и разведены вуглы культи с соответствующейгеометрией, разведение не должно превышать 4см воизбежание «провалов» дозы в центральныхотделах культи влагалища, РОД на слизистую5Гр ежедневно до СОД 25–30Гр.При повышенном риске локального рецидива наличииэлементов опухоли в краю резекции,близости опухоли (расстояние 5мм) c минимальнымипризнаками терапевтического патоморфоза кграницам резекции влагалища, длиневлагалищной трубки 10см, СОД на куполвлагалищаэскалируется до 35–40Гр,дополняетсяоблучением влагалищнойтрубки, РОД 3 - 5Гр контактнона слизистую (РОДэкв 2,5–4Гр на глубине 0,5см), до СОД 21-30Гр.При наличии признаковвоспалительной инфильтрациипаравезикальной/параректальной клетчатки,катального мукозита в куполе, влагалище облучается в щадящем режиме, со снижением на 20–30% разовых исуммарных доз. При использованииодноканальногоаппликатора требуется оптимизациястандартного плана в форме«булавы дляобеспечения равномерного охвата культи терапевтической изодозой безпереоблучения начальных отделоввлагалищной трубки, чтоможет быть достигнуто варьированием шага источникаIr192 HDR ивременистояния егов определенной позиции. При выявлении в этисроки фибринозного и некротическогомукозита в куполе влагалища, в связи сриском развития мочеполового свищаоблучение вагинальногорубца откладывается дополного его заживления,облучение начинается сдистанционного этапа.
Реализация алгоритмовДЛТ в рамках ПОЛТ(Приложение 2в) такжепредусматриваетдифференцированный выбор параметровоблучения в соответствии стипом доступного излучателя и терапевтическимизадачами,обусловленными результатами предлучевыхэтапов. Выбор оптимальногоспособа и режима ДЛТ основывается на сравнительноманализе гистограмм«доза-объем» (DVH) в отношении структур–мишеней, органовриска, зон дополнительной эскалации ищажения. Приосуществлении объемного планирования(Oncentra® Masterplan) культя влагалища и областитазовых и парааортальных лимфатическихузлов оконтуриваются и заводятсяв систему как отдельныемишени дляформирования фигурных полей облучения всоответствии с индивидуальнойпослеоперационной анатомией. Это позволяетизбегать необоснованного пере– илинедооблучения определенныхструктур таза и брюшной полости (культивлагалища, мочеточников, почечных «ножек»,мочевого пузыря, ректо–сигмоидногоотдела кишки) при их фиксированныхсмещениях и деформациях.
ДЛТ на первом этапепроводится на весь объемтаза до суммарных доз24–36Гр,далее реализуется контактное облучение культи влагалищасимультаннос дистанционным облучением регионарныхлимфоузлов. Временной интервал междудневными фракциями ДЛТ и ВПГТ – 3,5–4ч.При выборе такого вариантаинтенсификации сочетанной лучевойтерапии, позволяющего на 6–10 дней сократитьобщие сроки послеоперационного лучевоголечения, следует уделять особое вниманиеоценке суммарных доз в периферическихотделах культи влагалища, где происходитналожение полей дистанционного ивнутриполостного облучения, не превышаязапланированные РОД и СОД в этих областях.При нарушениях общего состояния больной(ECOG II ивыше),развитии осложнений IIстепени в ходе реализации I этапа, ВПГТ и ДЛТна тазовые лимфоузлыпроводятсяпоследовательно, при этом общаяпродолжительность курса ПОЛТ не должна превышать 56дней.
У больныхнормостенической конституции, вотсутствие сопутствующейпатологии и осложнений II cтепени на предлучевых этапах состороны органов риска,отдавали предпочтениеоблучению в статическом режиме с четырехвзаимно перпендикулярных полей (box–метод) на всех видах излучателей(телекобальтовых гамма–терапевтических установках,линейных ускорителяхэлектронов энергией 5–18 МэВ), РОД 2 – 2,2Гр до СОД 24 – 26Гр на центртаза. Убольных с ожирением, сопутствующейпатологией или осложнениями II степени со сторонымочевого пузыря, прямой кишки, тонкого,толстого кишечника на предлучевых этапахпри реализации облучения на гамма–установках иЛУЭ сэнергией фотонов 5–6мэВ нами использовалисьоптимизированные многопольные статические и подвижныеварианты облучения с планируемымвовлечением не более 50% органов риска втерапевтический изодозный контур. При«фартучном» типе ожиренияоблучение нагамма-установке предпочтительнее проводить вположении пациентки на животе, с использованием ткань–эквивалентныхболюсов, однако, вариантомвыбора в этой ситуацииявляется облучение на ЛУЭ 18–20МэВс высокойпроникающейспособностью исмещенным максимумом дозы.
При глубокой инвазииопухоли в толщу шейки матки,распространении на теломатки с инвазией миометрия на глубинуболее 5мм, тотальном поражении полостиматки, низкой (0-II)степени патоморфоза после неоадъювантноголечения в первичной опухоли илимфатических узлах, наличии эмболов влимфатических щелях и кровеносных сосудах,метастазов в лимфатических узлах,суммарная доза облучения, подводимая навесь объем таза,эскалируется до 30 – 34Гр, затемцентральные структурыоблучаются контактно, азоны параметриев и тазовых лимфатическихузлов подвергаются ДЛТ до СОДэкв 48 –50Гр. Для адекватного облучениялимфатических «цепочек» на всех уровнях, вособенности при наличии эмболов влимфатических щелях и кровеносныхсосудах, метастазов влимфатических узлах, предпочтительнееиспользовать оптимизированные многопольныестатические режимыоблучения, например, шестипольнуюметодику («полубокс»); общие размеры и ориентация полейсоответствуюттопографической анатомии лимфатических путей данной области(Приложение 2г) При значительных поперечных размерах, протяженности конгломератаметастатически удаленных лимфоузлов,низкой степени ТП в них, РОД увеличивается до 2,4–2,6Гр, СОДэкв до 56–60Гр в зонепораженных лимфатических узлов за счет дополнительноголокального облучения области удаленныхметастазовРОД 0,2 – 0,4Гр по принципу «fieldinfield», что требует дополнительной маркировки этих областей рентгеноконтрастными скобками.Обнаружениев зоне облучения лимфокисты или гематомылюбого размера служит причинойотказа от эскалациилокальных доз в зонах регионарногометастазирования. ввидувысокого риска обструкциимочевыводящих путей
При наличии метастазовв лимфатических узлах, в том числе – с низкой0–II степенью ТП после НАХТ, а такжепри повышенном риске лимфогенногометастазирования – раковых эмболах влимфатических щелях и кровеносных сосудах,объеме первичнойопухоли более 30см3,невыполнении радикальнойтазовой лимфодиссекции,облучение тазадополняетсяпрофилактическим облучением зоныпарааортальных лимфоузлов. Вобязательную терапию сопровождения включаютсягастропротекторы (H2-блокаторы);антиэметики центрального действия(антагонисты 5-НТ3- и NKi-рецепторов серотонина) – гранисетрон(китрил), ондасетрон (латран, зофран,эмесет), трописентрон (навобан,тропиндол), по меньшей мере однократноза час до сеанса; жидкие антациды(альмагель, фосфалюгель, маалокс) по20–40 мл за 30мин. до сеанса. При реализации облучения наустановках, оснащенныхтолько системами двухмерного планирования, целесообразно использованиеоптимизированныхстатических и подвижныхрежимов сминимизацией поглощенных доз в спинном мозге,почках и их ножках, тонком кишечнике,коже, присредней ширине поля 67см, высоте-810см.При оснащенииустановки системой 3D–планированияклинический терапевтический объем(СТV) определяетсяиндивидуально, c максимально точным соответствием(+0,5–0,7см)объему условной мишени,соответствующей зоневизуально неизмененных парааортальныхлимфатических узлов доуровня Th12, спреимущественным щажением почек с ножками и спинного мозга,РОД 1,8 – 2,0 Гр, СОДэкв 40Гр.
В рамках решениячетвертой задачи настоящего исследованияхимио–лучевое лечение(ХЛЛ) осуществлялось нами в двух вариантах, при которыхлучевая терапия – дистанционная напервом этапе и сочетанная на втором – проводилась последовательно илисимультанно с ПХТ. Выбор оптимального способа ирежима ДЛТ на первом этапе основывался насравнительном анализе гистограмм«доза-объем» с дифференцированнымвводом в планирующую систему контуровматки и регионарных лимфатических узловкак таргетных (GTV1, GTV2,GTV3), амочевого пузыря, прямой кишки, сигмовиднойкишки, кожи с подкожно-жировойклетчаткой, костей таза какорганов риска. Придополнительном облучении парааортальнойзоны клинический терапевтический объемопределялся индивидуально, на основаниитрехмерной реконструкции опухоли илинеизмененных лимфатических узлов в этойзоне по КТ-сериям, с преимущественнымщажением почек с ножками и спинного мозга,РОД составили 1,8-2,2Гр, СОД 46-50Гр. На второмэтапе дистанционно облучали только зонытазовых лимфоколлекторов, при этоммедиальные границы пахово–подвздошных икрестцовых полей формировались всоответствии с предполагаемым объемомВПГТ во избежание наложения 90–100% изодоз в области перекрестамочеточника и маточной артерии(соответствующего типично расположеннойточке А). Привизуализации метастазов в тазовых лимфоузлах эти зоныоблучались по принципу «field–in field», РОД в нихсоставляла 2,2–2,4Гр при РОД 2,0–2,2Гр на остальномпротяжении.СОД на зоны метастазовсоставили в среднем 54,7±2,9Гр [CI 95% 48,4 – 61Гр] при СОД наоставшуюся частьлимфоколлекторов 44–48Гр.
Терапевтическиеобъемы внутриполостногооблучения в программахХЛЛ формировались в максимально точномсоответствии геометрии 100-90% контура реальнойанатомии опухолевого очага,определяемого в динамике прикомплексной УЗ- и КТ/МРТ-топометрии.В рамках настоящегоисследования нами была сопоставленаколичественнаяинформация о динамике площадей и объемовопухолей-мишеней в ходе ВПГТ, оцененныху 16 больных МРРШМ с помощью 2D3Dэхографии врежиме «серой» шкалы и МРТ вТ2–взвешенных изображениях, всего 156 исследований, по 78исследований для каждого типавизуализации. Значимых различий междуметодами в точностиизмерений не выявлено(P>0,05), что позволило и приконсервативном лечении МРРШМ, наряду сПОЛТ, считать комплексное УЗИ базовымметодом визуализации для мониторинга икоррекции планов ВПГТ. Приэтом 10% изменениеплощади или 15%- объема опухоли-мишени от фракции к фракции по данным эхографии служилопоказанием для повторного КТ/МРТ-планированияс цельюкоррекции объемов ВПГТ.
Многопараметровыйсравнительный анализ продемонстрировал,что последовательноепроведение ПХТ и лучевойтерапии у неоперированныхбольных МРРШМ, в отличие отсимультанного варианталечения, достоверноулучшало условия реализации облучения в рамках ХЛЛ. Так, при сопоставимомдля двух подгрупп прогностическом индексе иотсутствии значимых различий в объемахоблучения на первом дистанционномэтапе, насочетанном этапе объемыдистанционного облучения припоследовательном ХЛЛ(П-ХЛЛ) были значимо меньше таковых присимультанном ХЛЛ (С-ХЛЛ) 6291,7±1719,3cм3против 7781,0±1715,0 см3соответственно,Р<0,05.Объем мишени(GTV) намомент начала ВПГТ вподгруппе П–ХЛЛ колебался от 22,7см3 до 216cм3, средний объем GTV составлял 49,6±8,3см3[СI 95% 33,0–66,2см3], что былодостоверно меньше аналогичного показателяв подгруппе С–ХЛЛ, в которой значения объемаGTV до началалечения колебались от 38,4см3 до 317cм3, а средний объемGTV составлял68,6±11,7см3 [СI95% 45,2–92,0см3] (Р<0,001). Адекватностьохвата мишени терапевтическимизодозным контуром в подгруппеП–ХЛЛ такжедостоверно превышала таковую в подгруппе С–ХЛЛ, что отражает значимое позитивное влияние НАХТ надинамику опухолевого процесса,способствующее сокращению курсовыхобъемов ДЛТ и ВПГТ. Так,D90 и V100 в подгруппеП–ХЛЛсоставили в среднем 98,7±2,4% [78–114%] и 92,1±1,4%[85,3–99,6%], вподгруппе С–ХЛЛ – 88,4±4,2% [74–118%] и 89,1±3,4%[82,3–97,6%]соответственно, (Р>0,001). При этомв подгруппе П–ХЛЛ достижение клинического излечения достигалось меньшими СОД на опухоль (Рис.4), отмечалась лучшая переносимостьлечения при отсутствии достоверныхразличий между подгруппами в егопродолжительности.
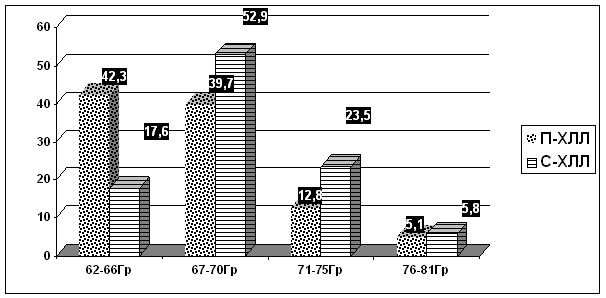
Рис. 4.Сравнительный анализ числа больных (вдолях, %) с различными уровнями СОД вопухоли на момент достижения клиническогоизлечения в подгруппахсимультанного и последовательногохимио-лучевого лечения МРРШМ.
В рамках решенияпятой задачи настоящего исследования были разработаны иоценены три новых методики локальной радиомодификации (ЛРМ) при проведении радикальной сочетанной лучевой терапии МРРШМ.Локальнаяхимиорадиомодификация (ЛХРМ) в ходе проведения первого–дистанционного– этапарадикального лучевоголечения осуществлялась ввиде протрагированных 24–часовыхаппликаций текстильных депо–систем«Колетекс», содержавших цитостатики 5–ФУ («Колетекс–5ФТУР», рег. удостоверение№ФС 01035263/1810-05 от 16.06.2005г.)или проксифеин(рег. № 97/292/1РЛС РФ) вконцентрации 9 масс % на биосовместимом полимер–полисахаридеальгинате натрия, что при аппликацииувлажненной передвведением 20% раствором димексида основы 6х10см соответствовалопостепенному высвобождению препарата за24ч в средней допустимой суточнойдозе 1,5г. Наибольшую эффективность в виде значимого ускорениярегрессии первичной опухоли при таком видеЛРМ мы отметили при опухолях спреимущественно экзофитной формойроста, а также при распространении опухолина слизистую влагалища. При опухолях спреимущественно эндофитной формойроста, а также при подслизистомраспространении опухоли на влагалищезначимого эффекта этот вид ЛРМ не имел.Также в ходе отработки методики мыотказались от проведения такого вида ЛРМ убольных МРРШМ с инфильтративно–язвенной формойроста, выраженном самопроизвольномраспаде опухоли, обильном кровотечении изполовых путей, гнойном параканкрозномвоспалении.
На этапе ВПГТ, послеколичественной оценки параметровопухолевого очага (2D-3D УЗИ, РКТ/МРТ), у 65 (45,8%) больныхМРРШМ с цельюрадиомодификации применилилокальную лазериндуцированную гипертермию (ЛИГТ) снагревом опухоли до 41-43С,у 25 (17,6%) криогипотермию жидким азотом сохлаждением опухоли до – 90-100°С. ЛИГТ проводили спомощью полупроводниковоголазера с диодной накачкой надлине волны 1,06мкм, в режимепостоянного тока с мощностью в диапазонеот 1 до 10Вт. Выбор световода производился всоответствии с преимущественной формойроста опухоли: торцевой световодиспользовался чаще при экзофитных исмешанных формах опухоли, диффузныйцилиндрический – при эндофитной, боковой (side fiber) – при распространении опухоли на влагалище.Криовоздействие проводилиперед 1-2,4-5, 7-8сеансами ВПГТ; у больныхс экзофитными формами опухоли на первыхдвух сеансах для поверхностнойкриодеструкции применяли пуговичныенаконечники различного диаметра, приэндофитных и смешанных опухоляхчередовали использованиеинтрацервикальных и пуговичныхаппликаторов. Наиболееклинически значимый модифицирующий эффект был достигнут приприменении ЛИГТ с обеспечением высокого - 76% - уровня локального контроля, сопоставимых споследовательным химио–лучевым лечениемпоказателей пятилетнейбезрецидивной выживаемости – 66,2±5,9%против 69,2±5,2% (Р=0,832) при снижении посравнению с конвенциальной лучевойтерапией частоты и степени тяжести позднихосложнений со стороны мочевого пузыря ипрямой кишки.
В рамках решенияшестойзадачи нами былиоценены непосредственные,ближайшие и отдаленные результаты исследованных вариантовмногокомпонентного лечения МРРШМ, а такжепроведена сравнительнаямногопараметровая оценка влияния на отдаленныерезультаты выделенныхранее ФНП убольных МРРШМ с различнымивариантами терапии восновной группе. В подгруппахоперированныхбольных оценканепосредственных результатов по шкалеRECIST 1.1, 2000, проведена у53(15,5%) больных с измеряемыми очагами – визуализируемыми на момент началаоблучения остаточными опухолями в маломтазу, при этом частотаполных (ПР) и частичных (ЧР) регрессийв основной группе значимопревышала таковую в контрольной (77,8±6,3 против 37,5±18,3и 11,1±4,7против 25,0±15,3соответственно, Р=0,035). Прогрессирования опухолевогопроцесса в ходе ПОЛТ у 289 (84,5%) больных,подвергнутых адъювантному облучению безвизуально определяемого опухолевогоочага, не зафиксировано, у этой частипациенток оценивались показателивыживаемости.
Непосредственныерезультаты консервативного лечения МРРШМв основной группе были значимо лучшетаковых при аналогичном варианте лечения вконтрольной группе (подгруппа РСЛТ): ПР была достигнута у 196 (77,2±2,6%) больных в основнойпротив 134 (57,8±3,2%) – вконтрольной группах (Р<0,001), в последнейпрактически вдвое чаще по сравнению с основной регистрироваласьЧР. При детальном анализерезультатов между подгруппамиосновной группы, частота ПР иЧР в подгруппахХЛЛ и ЛРМ значимо неразличались (Р=0,068 и Р= 0,126 соответственно), однако, при попарномсравнении не было выявленозначимых различий в частоте полных и частичныхрегрессий только между подгруппамиП–ХЛЛ, С–ХЛЛ и ЛИГТ.Непосредственныерезультаты лечения больных в подгруппах ЛХРМ и КГТ основной группы были значимо ниже и неимели достоверных различий с контрольнойгруппой.
При совокупной оценкеближайшие и отдаленные результатымногокомпонентного лечения в основной группе значимо превосходилитаковые в контрольной. Так, показатели общей выживаемости(ОВ) восновной группе значимо превышали таковыев контрольной на всех этапах наблюдения свысокой степенью достоверности (Р<0,001),превысив на 18,3±4,3% (68,6±2,1% против 50,3±2,8%,Р<0,001)показатели в контрольнойгруппе к концу срока наблюдения.Показатели безрецидивной выживаемости(БРВ) больныхМРРШМ в основной группе также значимопревосходили таковые в контрольной свысокой степенью достоверности (Р<0,005 навсех этапах наблюдения),составив 61,6±2,2% против 36,3±2,7% к концу сроканаблюдения ( Рис. 5).
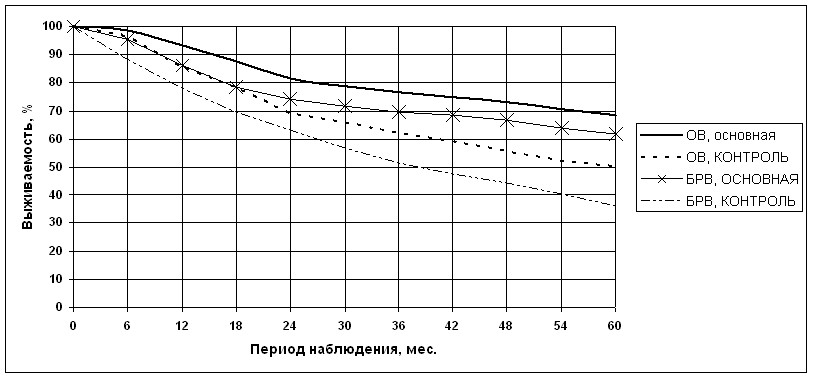
Рис. 5. Общая ибезрецидивная выживаемость больных МРРШМпосле лечения в основной и контрольнойгруппах(ОВ,ОСНОВНАЯ–общая выживаемость в основнойгруппе; ОВ, КОНТРОЛЬ– общая выживаемость в контрольнойгруппе; БРВ, ОСНОВНАЯ –безрецидивнаявыживаемость в основной группе; БРВ,КОНТРОЛЬ–безрецидивная выживаемость в контрольнойгруппе).
Показатели ОВ и БРВ уоперированных больных МРРШМ в основнойгруппе были существенновыше таковых в контрольнойна всех этапах наблюдения исоставляли к концу 5летнего периода наблюдения 74,0±2,9 против 41,6±5,3 и 71,9±4,6%против 57,9±4,0% соответственно (Р<0,001).Кроме того, показатель БРВ вподгруппе КОМПЛ к концу5го года наблюдениязначимо превышалтаковой в подгруппеМКОМБ 71,9±4,6 против 57,9±4,0, P=0,04.
Пофакторный анализзависимости характера прогрессирования отвыявленных ранее ФНП продемонстрировал наибольшиеуровни корреляции частоты развитияотдаленных органных метастазов сметастатическим поражением лимфатическихузлов (r=0,997) ивыявлением эмболов в сосудистых илимфатических щелях до начала спецлечения(r=0,83) и послехирургического этапа (r=0,912) во всехподгруппах оперированных больных МРРШМ. Однако, при анализе влияния этого фактора на ОВ и БРВзначимые различия междупациентами Noи N1 выявленытолько в подгруппах комбинированноголечения основной и контрольной групп,что составило к концу периода наблюдения78,4±3,8% против 52,8±8,3% (Р=0,005) в основной и 50,0±5,9%против 16,7±7,6% (Р=0,009) в контрольной группахсоответственно. Значимыхразличий показателей ОВ между пациентами No и N1 в подгруппеКОМПЛ невыявлено (70,0±7,2% против 68,5±6,3%, P=0,944). В тоже времяпри межгрупповом сравнениирезультатов лечения больных N1 в подгруппахКОМПЛ и М–КОМБ основной группы значимыхразличий не получено: показатели ОВ составляли92,6±3,6% против 88,9±5,2% (Р=0,82),79,6±5,5% против 61,1±8,1% (Р=0,09), 68,5±6,3% и 52,8±8,3% (Р=0,2)на первом, третьем и пятом годах наблюдениясоответственно.Дифференцированная оценка влияния различных факторов,способных нивелировать влияние НАХТ на результаты лечения,продемонстрировала сильнуюкорреляционную зависимостьпоказателей ОВ и БРВ у данной категории пациентокот объемов облучения напослеоперационном этапе (r=0,976) ипродемонстрировала положительноезначение адъювантного облучениявышележащих лимфоколлекторовпарааортальной области (Рис.6).
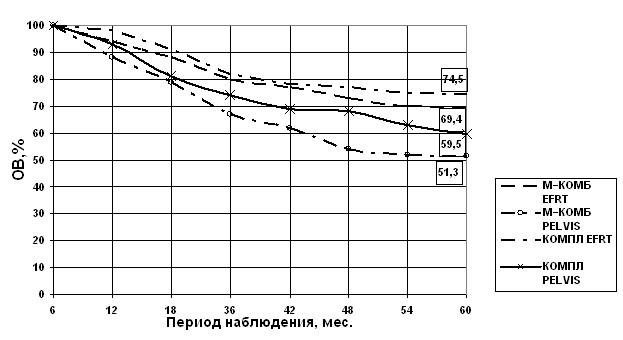
Рис. 6. Общаявыживаемость оперированных больных МРРШМв основной группе с метастазами в тазовые лимфоузлыв зависимости от объемовпослеоперационного дистанционногооблучения (EFRT– пациентки садъювантным облучением лимфоузловпарааортальной группы;PELVIS – пациентки с ПОЛТ,ограниченной тазом).
Показатели ОВ и БПВ унеоперированных больных восновной группе значимо превышалисоответствующие значения в контрольнойгруппе (P<0,05при всех погодовых сравнениях), составив кконцу периода наблюдения 66,1±3,0% против53,9±3,3% (P=0,008).При ХЛЛпоказатели ОВ значимо превышали таковые вконтрольной группе с конца третьего годанаблюдения, составив в этот период 75,0±4,1%против 67,2±3,1% (Р=0,025), а к концу 5 года 69,6±4,3% против53,9±3,3% (P=0,008)соответственно, однако, припогрупповом анализе значимые различия с контрольнойгруппой выявлены тольков подгруппе ПХЛЛ, где уже к концувторого года наблюдения ОВ составляла84,6±4,1% против 72,0±2,9% (P=0,038), а к концупериода наблюдения 74,4±4,9% против53,9±3,3% (Р=0,002) соответственно. В подгруппеСХЛЛзначимых различий с контрольной группой впоказателях ОВ не выявлено.
Значимые различияпоказателей ОВ вподгруппе ЛРМ по сравнению с контрольнойгруппой выявлялись только до концатрехлетнего периода наблюдения (76,8±3,5%против 67,2±3,1%, Р=0,042); при последующемнаблюдении значимость различийнивелировалась.Погрупповой анализпоказателей ОВ выявил значимые различияпоказателей при сравнениис контрольной группойтолько в подгруппах ЛХРМ и ЛИГТ;показатели ОВ в подгруппе КГТ и контрольнойгруппе значимо неотличались (Р 0,528). При этом вподгруппе ЛХРМ значимые различия показателей ОВ посравнению с контрольнойгруппой прослеживались навторомчетвертом году наблюдения (Р=0,05); напятом году ОВ падала на 11,5%, нашестом на15,4%. В подгруппе ЛИГТ значимые различияпоказателя ОВ с контрольной группойопределялись только в конце второго (86,2±4,3%против 72,0±2,9%, Р=0,029) и пятого годанаблюдения (69,2±5,7% против 53,9±3,3%,Р=0,033).
Показатели БРВ у неоперированных больных основной группы значимо превышалианалогичные показатели вконтрольной группе, начиная с 3го годанаблюдения (Р0,043), составив кконцу периода наблюдения 60,2±3,1% против43,1±3,3% соответственно(Р<0,001). При межгрупповоманализе динамика показателей БРВ в целом соответствовала динамикепоказателей ОВ, при этом в подгруппе ХЛЛ значимыеразличия с контрольнойгруппой были отмечены только в подгруппеПХЛЛ,начиная с 30 месяца наблюдения (79,5±4,4% против64,7±3,2%, Р=0,022), средиподвариантов ЛРМ значимые различия к концупериода наблюдения зафиксированы только вподгруппе ЛИГТ (66,2±5,9% против43,1±3,3%, Р= 0,034).
Влияние комплексавыделенных ранее прогностическихпризнаков на ОВ и БРВ и характер прогрессирования убольных МРРШМ в основнойгруппе было анализировано спомощью многофакторногорегрессионного анализа Кокса. Констатировано,что вследствие применения модифицированных программ лучевого лечения уоперированных больных МРРШМ утрачивают негативное влияние на БРВ такие факторы, как распространение опухоли на тело матки, влагалище до средней трети,наличие элементов опухоли ближе 5мм к краюрезекции, лимфо–васкулярная инвазия стромы шейкиматки, метастатическое поражение обтураторных лимфатических узлов. Втоже время модификация ПОЛТу оперированных больных МРРШМ неснижает значимость неблагоприятноговлияния на отдаленные результаты таких факторов, какраспространение первичной опухоли напараметральную клетчатку более 1/3параметрия, наличие послехирургического этапа лечения остаточнойопухоли любого размера втазу, низкая (0II)степень терапевтического патоморфоза впервичной опухоли и метастатическипораженных подвздошных лимфатическихузлах, что требует принципиально иныхподходов к адъювантной терапии в такихслучаях.
Применение всоответствии с изложенными ранее принципами П-ХЛЛ и ЛИГТ у больныхМРРШМ, не подлежащих хирургическомулечению, нивелирует негативное влияние такихфакторов, как: распространениеопухоли на матку, поражениепараметральной клетчаткидо 1/3 параметрия, эндофитная форма ростапервичной опухоли. При эффективнойНАХТ П-ХЛЛ значимо снижаетнегативное влияние на БРВ таких факторов,как аденогеннаягистологическая форма опухоли, лимфо-васкулярная инвазия, эмболыв лимфатических и сосудистых щелях, метастазы в обтураторных,внутренних, наружных подвздошныхлимфатических узлах. Негативное влияниетаких ФНП, как низкодифференцированнаягистологическая форма,инфильтративноязвенная формароста первичной опухоли, метастатическое поражение общих подвздошных, парааортальныхлимфатических узлов не былопреодолено ни в одной из подгрупп консервативного леченияМРРШМ.
В рамках решенияседьмойзадачи исследования былпроведен многопараметровый анализ спектра, частоты и степени тяжестиосложнений различных вариантов лечения МРРШМв основной иконтрольной группах в соответствии смеждународными классификациями NCIC CTCAE v3.0–4.0,RTOG, EORTC,LENT SOMA v.1.3.При этом мы придерживалисьотечественной традициидифференцированной оценки реакций,возникающих в процесселучевого лечения, раннихосложнений, диагностируемых у пролеченныхбольных на сроке 90-100 дней послеокончания лечения и поздних осложнений,возникающих в процессе наблюдения спустя 3мес. после окончания лечения. Нами не отмечено изменения спектратоксических реакций в основной группе посравнению с контрольной: все наблюдавшиесяосложнения имели прогнозируемый характер,несмотря на различия,зарегистрированные наэтапе НАХТ, связанные с токсическимпрофилем использованных цитостатиков– таксанов,препаратов платины, гемцитабина,топотекана, кселоды. Наиболее частов ходе лучевоголечения у больных МРРШМв обеих группах регистрировалисьгематологические, гастро–интестинальныетоксические реакции и реакции со стороны мочевыхпутей.
При совокупноманализе нами констатировано значимое снижениетоксичности модифицированных программлечения по сравнению с конвенциальной терапией(Рис.7).
 Рис. 7. Сравнительныйанализ частоты поздних осложнений восновной и контрольной группах,скоррегированных на показательбезрецидивной выживаемости, к концу 5гогода наблюдения.
Рис. 7. Сравнительныйанализ частоты поздних осложнений восновной и контрольной группах,скоррегированных на показательбезрецидивной выживаемости, к концу 5гогода наблюдения.
Так, присравнении скоррегированных показателейчастоты поздних осложнений обращало на себя внимание значимое снижение общейчастоты осложнений со стороны кожи иподкожной клетчатки, мочевого пузыря иуретры в основной группепротив контрольной, составившие кконцу 5го года наблюдения 36,1±3,9% против 63,2±7,5% (Р=0,042) и 38,7±3,9%против 89,5±7,0% (Р<0,001) соответственно. При сравнениискоррегированных показателей частотыпоздних осложнений со сторонымочеточников нами отмечено значимоеснижение частоты осложнений III cтепени в основнойгруппе по сравнению с контрольной кконцу 3го года наблюдения – 9,5±2,3% против28,6±8,5% (Р=0,011) и осложнений II cтепени к концу 5гогода наблюдения – 19,4±3,2% против 42,1±11,3% (Р=0,049) cоответственно.Аналогичные результаты зарегистрированыпри сравнительном анализе частотынарушений лимфо–венозного оттока в основной иконтрольной группах – 34,2±3,8% против89,5±7,0% (Р<0,001) соответственно, со значимымснижением частоты осложнений I cтепени в основной группе– 16,1±3,0% против52,6±11,5% (Р<0,001) соответственно. Различиямежду основной иконтрольной группами вчастоте формированиялимфо–венознойнедостаточности II–IIIcтепени,требовавшей интенсивной сосудистойтерапии, статистически не значимы. Прианализе скоррегированных показателейгастроинтестинальныхосложнений значимыеразличия между основной и контрольнойгруппой зафиксированы только в частотеосложнений со стороны прямой кишки – 7,7±2,1% против36,8±11,1% соответственно (Р<0,001).
Выводы.
- Многокомпонентные программызначимо улучшают результаты лечениябольных МРРШМ по сравнению сконвенциальной сочетанной лучевойтерапией с увеличением пятилетнихпоказателей общей и безрецидивнойвыживаемости с 50,3±2,8% до 68,6±2,1% и с 36,3±2,7% до61,6±2,2% соответственно (Р<0,001). Планированиемногокомпонентного лечения МРРШМ требуетиндивидуального анализаклинико-морфологических факторов сформированием карт прогноза на каждом изэтапов терапии.
- Стратегическимпринципом проведения современной лучевой терапии в рамках многокомпонентноголечения МРРШМ являетсяформирование индивидуальных программ путем дифференцированноговыбора объемов облучения,разовой и суммарной очаговых доз испособов ее подведения. Технологическуюоснову данной стратегии составляютметодики визуальноконтролируемой лучевой терапиис интеграцией комплексного ультразвуковогоисследования как базовогометода встандарт топометрии и мониторинга.
- У оперированныхбольных МРРШМ послеоперационноеоблучение должно соответствоватьрадикальному терапевтическому по объемуоблучения и суммарным дозам; при этомнивелируется негативное влияние такихфакторов как распространение опухоли натело матки, влагалище до средней трети,наличие элементов опухоли ближе 5мм к краюрезекции, лимфо–васкулярная инвазия стромы шейкиматки, метастатическое поражениеобтураторных лимфатических узлов. Позитивное влияниемодифицированной программыпослеоперационного облучения значимоснижается при продолжительности лучевогоэтапа более 50 дней, стойкой анемииIII степени входе облучения.
- Применение модифицированныхпрограмм послеоперационной лучевойтерапии не изменяет значимонеблагоприятное влияние таких факторов,как распространение первичной опухоли напараметральную клетчатку протяженностьюболее 1/3 параметрия, наличие послехирургического этапа лечения остаточнойопухоли любого размера втазу, низкая (0II)степень терапевтического патоморфоза впервичной опухоли и метастатическипораженных подвздошных лимфатическихузлах всех групп, что требуетпринципиально иных подходов к адъювантнойтерапии в таких случаях.
- Расширение объемаДЛТ с симультантным облучениемпараааортальных лимфатических узлов на15–18%улучшает пятилетние результатыизлечения больных МРРШМ при высокомриске лимфогенного метастазирования сувеличением показателя общейвыживаемости с 59,5±10,9% до 74,5±8,5% врамках комплексного и с 51,3±7,6% до 69,4±8,5%– в рамкахкомбинированного лечения.
- Последовательноехимио–лучевое лечение МРРШМ ссоблюдением принциповиндивидуализированной визуально–контролируемойлучевой терапии улучшает отдаленныерезультаты лечения больных МРРШМ сдостижением 5летней безрецидивной выживаемости69,2±5,2% против 43,1±3,3% (Р<0,001) по сравнению страдиционной СЛТ без значимого приростачастоты токсических реакций, ранних ипоздних осложнений III–IVстепени; при этомутрачивается значимость таких ФНП, какраспространение опухоли на матку,поражение параметральной клетчаткипротяженностью до 2/3 параметрия,эндофитная форма роста первичной опухоли,аденогенная гистологическая форма опухолипри терапевтическом патоморфозе послеНАХТ выше IIcтепени,метастатическое поражение обтураторных,внутренних и наружных подвздошныхлимфатических узлов.
- Проведениепоследовательногохимио–лучевого леченияМРРШМ не улучшает значимоотдаленные результаты при низкодифференцированных, инфильтративноязвенныхформах первичной опухоли,метастатическом пораженииобщих подвздошных ипарааортальныхлимфатических узлов, что определяетнеобходимость применения альтернативныхвариантов терапии.
- Симультантноехимио–лучевое лечение МРРШМ содномоментным проведением стандартныхкурсов ПХТ в платиносодержащих режимах ирадикальной СЛТ не улучшаетзначимо отдаленные результаты посравнению с конвенциальной СЛТ.
- Локальнаялазериндуцированная гипертермия предпочтительныйметод локальной радиомодификации впрограммах радикального консервативноголечения МРРШМ, обеспечивающий высокийуровень локального контроля исопоставимые с последовательнымхимио–лучевым лечением показателипятилетней безрецидивной выживаемости– 66,2±5,9%против 69,2±5,2% (Р=0,832) при снижении посравнению с конвенциальной лучевойтерапией частоты и степени тяжести позднихосложнений со стороны мочевого пузыря ипрямой кишки.
- Проведениемногокомпонентного лечения МРРШМ смодификацией в соответствии сразработанными принципами программ лучевой терапиине увеличивает частоту ранних и позднихосложнений восновной группе посравнению с контрольной созначимым снижением общейчастотыпоздних осложнений со стороны кожи иподкожной клетчатки до 36,1±3,9% против 63,2±7,5% (Р=0,042), мочевого пузыря иуретры –до 38,7±3,9%против 89,5±7,0% (Р<0,001), мочеточников – до 19,4±3,2% против 42,1±11,3% (Р=0,049), прямой кишки– до 7,7±2,1% против36,8±11,1% (Р<0,001) к концу 5го года наблюдения.
Практическиерекомендации.
- Больным сустановленным МРРШМ необходимопроведениемногокомпонентной терапии с предпочтительным использованиемв программах лечения платиносодержащихсхем НАХТ и индивидуализированныхвариантов облучения. Проведениесимультантного химио–лучевоголечения в платиносодержащих режимах ссовмещением стандартных курсовнормодозной ПХТ и радикальной СЛТнецелесообразно.
- Для выбора икоррекции варианта многокомпонентноголечения при МРРШМ необходимо у каждойбольной проводить комплексный анализклинико-морфологических факторов прогнозас формированием индивидуальных карт ихучета до начала лечения и на каждом из егоэтапов.
- В рамкахкомплексной предлучевой подготовки и мониторингалучевого лечения больных МРРШМнеобходим регулярный синтез данныхрентгеновской компьютерной и/илимагнитно-резонансной томографии икомплексного ультразвуковогоисследования для дифференцированноговыбора объемов облучения, разовой исуммарной очаговых доз, способов ихподведения к «мишени» и коррекциипараметров облучения в ходе лучевоголечения с минимизацией воздействия накритические органы.
- Для контроляположения аппликатора относительно мишении критических структур, определенияклинического терапевтического объема, зонэскалации и щажения при планировании имониторинге внутриполостного идистанционного этапов лучевой терапии длявсех вариантов лечения МРРШМцелесообразно выполнение комплекснойУЗ-топометрии трансабдоминальным,трансвагинальным и трансректальнымдоступом. Изменение по даннымкомплексной УЗ–топометрии площади и/или объема«мишени» на 10-15% в процесселучевого лечения требует коррекцииплана облучения на базе повторногоКТ/МРТ-планирования.
- Проведениехимио-лучевого лечения МРРШМ требует доначала спецлечения учета профилятоксичности выбираемых цитостатиков.Препаратами выбора являются цитостатики сминимальным негативным влиянием на органыЖКТ и мочевой системы.
- При повышенномриске локального рецидива у оперированныхбольных МРРШМ, а именно прираспространении опухоли на тело матки сего тотальным поражением, инвазией вмиометрий более 5мм, наличии элементовопухоли ближе 5мм к краю резекции,вовлечении влагалищной трубки,инфильтрации ретро-везикальной иректо-вагинальной клетчатки целесообразнаэскалация суммарных доз отсочетанной ПОЛТ до СОДэкв 60Гр в культевлагалища и прилежащих структурах за счетинтенсификации внутриполостногокомпонента.
- У больных МРРШМ свысоким риском лимфогенногометастазирования целесообразнорасширение объема дистанционной лучевойтерапии с симультантным облучениемпараааортальных лимфатических узлов.Проведение НАХТ не является нипротивопоказанием, ни альтернативойрасширению объема ДЛТ у данной категориипациенток.
- При развитии входе предлучевых этапов осложнений II и более степени состороны критических органов, а также привыполнении в ходе хирургического этапатранспозиции яичников, необходимо припланировании лучевого лечениядополнительное щажение областей сосниженной тканевой толерантностью.Выявление в зоне послеоперационногооблучения лимфокисты, гематомы, выполнениереконструктивно–пластических вмешательств намочевых путях в ходе хирургического этапатребуют отказа от эскалации илиснижения локальных СОД на 15% (810 изоГр) в связи свысоким риском обструкции мочевыводящихпутей.
- С цельюобеспечения высокого уровня локальногоконтроля в ходе лучевого лечения МРРШМцелесообразно применение в качестверадиомодификатора локальнойлазериндуцированной гипертермии.
Список печатных работпо теме диссертации.
- Титова В.А, Ашрафян Л.А., Жданов Г.П.,Крейнина Ю.М.и др. Автоматизированная сочетаннаялучевая терапия в комплексном лечениираспространенного ракаматки и яичников // Методическиерекомендации. – Москва, 1996. – 14 с.
- Титова В.А., Харченко Н.В., ГорбуноваВ.В., Крейнина Ю.М. и др. Медицинская визуализацияв сопровождении лучевой терапии ракаяичников // Медицинскаявизуализация. – 2001. – №1. – С. 37 – 44.
- Ашрафян Л.А., Крейнина Ю.М., ТеС.А., Огоев А.Ю., Пачулия Т.А.Ультразвуковая томографияв диагностике рецидивов и метастазовгинекологического рака // Материалы VIII Всероссийскогосъезда рентгенологов и радиологов «Алгоритмы в лучевой диагностике ипрограммы лучевого икомплексного лечения больных». – Москва, 2001. – С. 17.
- Ашрафян Л.А., Огоев А.Ю., Те С.А., Крейнина Ю.М.. Значениедоплерографии в оценке эффективностилучевой терапии при раке шейки матки //Материалы научно–практическойконференции «Роль лучевойтерапии в гинекологической онкологии».– Обнинск,2002. – С.28.
- Крейнина Ю.М.,Ашрафян Л.А., Титова В.А., ТеС.А. Особенностинеоадъювантной терапии приорганосохраняющем лечениираспространенного рака шейки матки //Материалы региональной научно–практической конференции НИИ онкологии ТНЦСО РАМН «Рак репродуктивных органов:профилактика, диагностика и лечение»– Томск, 2002.– С.66-67.
- Егорова Е.В., Титова В.А.,Крейнина Ю.М., Ивашин А.В..Компьютерная томография в сопровождениилучевой терапииместно-распространенного рака матки ияичников // Материалы Пленума Российскойассоциации радиологов.–Челябинск-Москва, 2002. – С.53. Режим доступа http://vestnik.rncrr.ru/vestnik/v3/papers/ego_v3.htm
- Крейнина Ю.М., Титова В.А., Горбунова В.В.Химиолучевое лечение распространенногорака шейки матки: оптимизированнаялучевая терапия и нормодознаяхимиотерапия // Российский онкологическийжурнал. –2003.– №5. – С. 4 -10.
- Ашрафян Л.А., Те С.А, Огрызкова В.Л., Крейнина Ю.М.,Алешикова О.И. Трехмерная эхография прираке шейки матки // Медицинскаявизуализация. – 2003.– 2. – С.68-73.
- Титова В.А., Крейнина Ю.М.,Курганова И.Н., Шипилова А.Н. Особенностиадъювантной лучевой терапиигинекологического рака послеэндоскопических хирургическихвмешательств // Материалы 4-гоРоссийского научного форума «Радиология -2003». –Москва, 2003. –С. 292.
- Титова В.А., Крейнина Ю.М.,Курганова И.Н., Шипилова А.Н.Терапевтический мониторингхимиолучевого леченияместнораспространенного рака шейки матки// Материалы 4-го Российского научногофорума «Радиология- 2003». – Москва, 2003. – С.293.
- Ашрафян Л.А., Те С.А.,Крейнина Ю.М.и др. Ультразвуковоймониторинг противоопухолевойтерапии рака шейки матки // Материалы4-го Российского научного форума«Радиология- 2003». –Москва, 2003. – С.23.
- Шипилова А.Н., Крейнина Ю.М., Титова В.А., Курганова И.Н. Химиолучевое лечениеместнораспространенного рака шейки матки// Материалы научно–практическойконференции «Роль лучевойтерапии в развитии органосохраняющихметодов лечения злокачественныхновообразований». – Москва, 2003. – С.108-110. Режим доступа: http://vestnik.rncrr.ru/vestnik/v1/papers/schi_v1.htm
- Ашрафян Л.А., Те С.А., Крейнина Ю.М. и др.Ультразвуковой мониторингпротивоопухолевой терапии рака шейкиматки // Сборник научных трудов научно–практической конференции «Ранняя диагностика илечение предраковых и злокачественныхзаболеваний органов репродуктивнойсистемы».–Москва, 2003. –С. 124-127.
- Ашрафян Л.А., Алешикова О.И.,Огрызкова В.Л., Ивашина С.В., Крейнина Ю.М. и др. Предварительные результатыкомплексного лечения рака шейки матки сиспользованием неоадъювантнойполихимиотерапии // Материалы научно–практическойконференции «Современныеподходы к диагностике и лечению гинекологическогорака». – Псков, 2004.–С.4-6.
- Крейнина Ю.М.,Титова В.А., Олтаржевская Н.Д. и др.Локальная монохимиотерапия вмногокомпонентном леченииместнораспространенных злокачественныхопухолей // Паллиативнаямедицина и реабилитация.– Москва, 2004.– С. 58.
- Крейнина Ю.М.,Шипилова А.Н., Титова В.А., БолтенкоА.И. Индивидуализация лучевой терапиив программах комплексного лечения ракашейки матки // Материалы конференции,посвященной 80-летию РНЦРР МЗ РФ«Научно-технический прогрессотечественной лучевой диагностики,лучевой терапии». – Москва, 2004. – С.131. Режимдоступа: http://vestnik.rncrr.ru/vestnik/v3/papers/krey_v3.htm
- Крейнина Ю.М.,Титова В.А., Шипилова А.Н., Шевченко Л.Н.,Поварова Е.В. Особенности проведениялучевой терапии у больных раком шейкиматки с транспозицией яичников //Медицинская радиология и радиационнаябезопасность – М., 2005. 4. –С. 33-42.
- Каприн А.Д., Титова В.А., КрейнинаЮ.М., Клименко А.А. Применение @-адреноблокаторов впрофилактике и лечении лучевых циститов //Материалы Невского радиологическогофорума. – СПб, 2005.– С. 372.
- Крейнина Ю.М.,Титова В.А., Шипилова А.Н. идр. Особенности проведениялучевой терапии у больных раком шейкиматки с транспозицией яичников //Материалы Российскогонаучного форума «Радиология-2005». – Москва, 2005. – С. 210.
- Крейнина Ю.М.,Титова В.А., Шипилова А.Н. Непосредственныерезультаты предлучевых этапов и стратегияпослеоперационной лучевой терапии вкомплексном лечении рака шейки маткиII-III стадий //Материалы Российскогонаучного форума «Радиология-2005». – Москва, 2005. – С. 208.
- Крейнина Ю.М.,Шипилова А.Н. Лучевая терапия в программахкомплексного и химио-лучевого леченияинвазивного рака шейки матки // МатериалыVIВсероссийского съезда онкологов. – Ростов-на Дону,2005. – С.178.
- Крейнина Ю.М., Титова В.А.,Шипилова А.Н. и др. Оптимизация послеоперационнойлучевой терапии в комплексномлечении рака шейки матки II-III стадии // Вопросыонкологии. –2006. – т.52.– №1.–С. 83-88.
- Титова В.А., Крейнина Ю.М.,Шипилова А.Н. и др. Системная илокальная озонотерапия впрофилактике осложнениймногокомпонентного лечениязлокачественных опухолей различныхлокализаций // Вестник РоссийскогоНаучного Центра Рентгенорадиологии. Москва, 2006.Режим доступа: http://vestnik.rncrr.ru/vestnik/v3/papers/krey_v3.htm
- КрейнинаЮ.М., ТитоваВ.А., Шипилова А.Н., Шевченко Л.Н., БолтенкоА.И. Облучение парааортальныхлимфатических узлов в многокомпонентныхпрограммах лечения рака шейки матки //Материалы Российского научного форума « Радиология-2006».– Москва, 2006. – С. 127.
- Дыхно А.Ю., Титова В.А.,Хмелевский Е.В., КрейнинаЮ.М. и др.Низкомощностнаябрахитерапия в современных программах мультимодальноголечения рака молочнойжелезы и половых органов // МатериалыXРоссийского ОнкологическогоКонгресса..– Москва, 2006. С. 487.
- Крейнина Ю.М.,Титова В.А., Нечеснюк А.В., Ивашин А.В.,Шипилова А.Н., Шевченко Л.Н. Адъювантноеоблучение парааортальных лимфатическихузлов в многокомпонентных программахлечения местнораспространенного ракашейки матки // Медицинская радиология и радиационная безопасность.– 2007. – т.52.– №1. – С. 134 -140.
- Титова В.А., ШипиловаА.Н., Крейнина Ю.М. и др. Системная илокальная озонотерапия в профилактикеосложнений многокомпонентного лечениязлокачественных опухолей различныхлокализаций // Медицинская радиология и радиационная безопасность.– 2007. – т.52. –№ 4. – С. 33-42.
- Крейнина Ю.М.,Титова В.А., Добровольская Н.Ю., БолтенкоА.И. Современные подходы к терапиирецидивов и метастазов рака шейки матки// Медицинская радиология ирадиационная безопасность –2007. – т.52. – №6. – С. 36–45.
- Дыхно А.Ю., Титова В.А.,Каприн А.Д.,Петровский В.Ю., Крейнина Ю.М. Радиохирургические методы вкомплексном лечении злокачественныхопухолей различных локализаций // Материалы Российского научного форума«Радиология-2007». Москва, 2007. С.121-122.
- Титова В.А., Крейнина Ю.М.,Шипилова А.Н., Шeвченко Л.Н., Петровский В.Ю.Системная и локальная озонотерапия впрофилактике осложнениймногокомпонентного лечениязлокачественных опухолей различныхлокализаций //Материалы Невскогорадиологического форума СПб., 2007.С.695.
- Титова В.А.,Шевченко Л.Н., КрейнинаЮ.М. Интенсивная локальнаялазерная гипертермия и криогенноевоздействие – универсальныерадиосенсибилизаторы в терапии опухолейженской половой системы ипрямой кишки // МатериалыXIIонкологического конгресса. – Москва, 2008. – С. 217–218.
- Каприн А.Д., Титова В.А.,Ашрафян Л.А., Костин А.А.,Крейнина Ю.М. Интервенционные технологии приурологических осложненияхмногокомпонентных программ лечения гинекологическихопухолей // Онкохирургия. – 2008. – №1. – С.74.
- Шевченко Л.Н.,Титова В.А., Крейнина Ю.М., Шипилова А.Н. Опыт применениялокальной лазерной гипертермии вмногокомпонентном леченииместно-распространенных и рецидивныхопухолей женской половой cистемы // Опухолиженской репродуктивнойсистемы. –2009.- №1–2.– С. 90–95.
- Титова В.А., Харченко Н.В.,Добровольская Н.Ю., КрейнинаЮ.М. Стратегия и тактикасовременной лучевой терапии рака шейки итела матки // Вопросы онкологии. – 2009. – №4. – С. 471–473.
- КрейнинаЮ.М. Планирование иреализация лучевой терапиив консервативном леченииместно-распространенного рака шейки матки// Вестник РОНЦ им. Н. Н.Блохина РАМН. 2009. Т. 20. №2. С. 6970.
- Крейнина Ю.М.,Титова В.А. Современные принципыпланирования и реализации лучевой терапиив консервативном леченииместно-распространенногорака шейки матки // Материалы Российской научно-практическойконференции «Пути развитияонкорадиологической помощи в регионах РФ».– Челябинск,2010. – С.61–62.
- Титова В.А., Крейнина Ю.М.,Шевченко Л.Н и др. Вторичная профилактиканейтропении, ассоциированной схимиолучевой терапией онкогинекологических заболеваний//Современная онкология.– 2010.– 4(12). –С. 38–42.
- Титова В.А., Крейнина Ю.М.,Шипилова А.Н. и др. Эритропоэтины (Эпостим®)в сопровождении химио–лучевого лечениязлокачественных опухолей у больных санемией // Опухоли женской репродуктивнойсистемы. –2010.- №3. – С. 45–49.
- Каприн А.Д., Титова В.А., Крейнина Ю.М.,Костин А.А. Урологические осложнения вонкогинекологии: диагностика,интервенционная и консервативнаякоррекция. Тверь, 2010. 167 с. (монография)
- Крейнина Ю.М.,Титова В.А., Скобелева Т.Ф. Современные принципы планированияи реализации лучевой терапии вконсервативном леченииместно-распространенного рака шейки матки// Опухоли женскойрепродуктивной системы. – 2011. №1. – С. 107111.
- Крейнина Ю.М.Современные тенденции и методывизуально–контролируемой лучевой терапии влечении местно распространенного ракашейки матки // Вестник Российского НаучногоЦентра Рентгенорадиологии. Москва, 2011. Режим доступа:http://vestnik.rncrr.ru/vestnik/v12/papers/krey_v12.htm
- Julia M. Kreinina, Vera A.Titova. Radiotherapyoptimization in chemoradiotherapy ofadvanced cervix cancer // Materials of 10th Biennale of InternationalGynecological Cancer Society. – Edinburg, 2004. – P. 191.
- L.A.Ashraphyan, N.V. Kharchenko, V.L. Ogryzkova,J.M. Kreinina etal. Transvaginal Complex Doppler Sonographyin Evaluation of Advanced Cervical Cancer TreatmentResults // Materialsof 10th Biennale of International Gynecological Cancer Society.– Edinburg,2004. – P.67.
- Julia M. Kreinina, Vera A.Titova The results of pre-radiotherapeutic phases in multimodal treatmentof advanced cervical cancer: radiotherapist’s view // Materials of 14thESGO Conference. –Stambul, 2005. – P.346 -347.
- Julia M. Kreinina, Vera A.Titova The Particular Conditions of Radiotherapy in Patients with OvarianTransposition during Invasive Cervix Cancer Treatment //Materials of14th ESGO Conference.- Stambul, 2005. – P.351.
- Julia M. Kreinina, Vera A.Titova The 3-year results of differentmulticomponent programs in advanced cervical cancer treatment:one-centre experience// Materials of14th ESGO Conference. – Stambul, 2005. – P. 406.
- Titova V.A., Kharchenko N.V., Tishenko V.A., Kreinina J.M. et al. Lazer interstitial thermotherapy in multimodal treatment of locally advanced and recurrent gynecologicalcancer: the pilot study // International Journal of GynecologicalCancer. –16(3). – P.731.
- Titova V.A., Kharchenko N.V., Khmelevsky E.V.,Dykhno A.Y., Kreinina J.M. The advantages of LDR brachytherapy in modern multimodaltreatment of breast and urogenital cancer // Radiotherapy and Oncology.– 81(1). – 2006. – P.273.
- Kreinina J.M., Titova V.A.,Shipilova A.N., Shevchenko L.N. The benefits of adjuvantextra-field radiotherapy in multimodal treatment of advanced cervical cancer// Radiotherapy and Oncology. – 81(1). – 2006. – P. 330.
- Dykhno A.Y.,Titova V.A., Kaprin A.D., Kreynina J.M. Role of LDR InterstitialBrachytherapy within Multimodality Cancer Treatment // Materials of 12thInternational Conference “Optimal Use of AdvancedRadiotherapy in Multimodality Oncology”Brachytherapy and External Beam. – Rome, 2007. – P. 479-480.
- Titova V.A.,KreininaJ.M., ShipilovaA.N. etal. Intravenousand local ozone used for therapy and prevention of complications ingynecological cancer multimodal treatment // ESGO-15 Abstracts. – Berlin, 2007. – Р. 283.
- J.M.Kreynina, V.A. Titova, N. V.Kharchenko, N.Y. Dobrovolskaya, A.I. Boltenko The actual algorithms ofrecurrent cervical cancer multimodal treatment // ESGO-15 Abstracts. – Berlin, 2007.- P. 287.
- V.A.Titova, N.V. Kharchenko, J.M. Kreynina et al. Benefits of 3D-sonography and MRI integration ingynecological HDR brachytherapy (GYN BT) image-guided planning //Materials of1st World Congress of Brachytherapy. – Boston, 2008. – P. 677.
- V.A. Titova,N.V.Kharchenko, E. Ph. Stranadko, V.A.Tishenko J.M.Kreynina et al. Laser interstitialthermotherapy and photodynamic therapy in locally advanced and recurrentgynecological cancer multimodality treatment // Photodiagnosis and photodynamicTherapy. – 2008.– 5(1). – P.8.
- V.A. Titova, N.V.Kharchenko,J.M. Kreynina etal. New laser technologies – photodynamic therapy andlocal interstitial thermotherapy– as universal radiosensitizersfor locally advanced and recurrent gynecological cancer radiotherapy //Int J Gynecol Cancer. – 2008. – Р.1491.
- V.A. Titova, N.V. Kharchenko,J.M. Kreynina Optimalintegration of 3D-sonography and MRI in gynecological brachytherapyimage-guided individual planning // Int J Gynecol Cancer.– 2008. – 7(2). – Р.154.
- J.M.Kreynina, V.A. Titova, N.V. Kharchenko et al. The clinical impact of 5-FUcontinual local applications, cryohypothermia and laser induced hyperthermia toeffective radiotherapy of locally advanced cervical cancer // Int JGynecol Cancer. –2009. – 19(2).– P.946
- J.M.Kreynina,V.A. Titova Full–dose chemoradiation in advancedcervical cancer primary treatment // Materialsof ESGO–13. –Prague, 2010. – P.614.
- Kreynina J.M., Titova V.A.,Shevchenko L.N., Shipilova A.N., Kokoncev D.A. Image-Guided 3D-OptimizedBrachytherapy In Full-Dose Chemoradiation Programs of Advanced Cervical CancerPrimary Treatment // J Am Brachytherapy. – 2011. – 4. – P. 4647.
Патенты наизобретения
1. Патентна изобретение №2268763 «Способ лечения ракашейки матки с экзофитной формой опухоли»от 25 июня 2004 года.
2. Патентна изобретение №2268724 «Способ леченияонкологических больных с опухолевымпоражением влагалища» от 25 июня 2004 года.
Медицинскиетехнологии
1. «Послеоперационная сочетаннаялучевая терапия у больныхместно-распространенным раком шейки маткис учетом клинико-морфологических факторовпрогноза» (ФС №2009/151 от 15.06.09г.)
2. «Многокомпонентные программылечения рака шейки матки, вульвы, влагалищаи прямой кишки в условияхрадиосенсибилизирующего действиялокальной лазерной гипертермии» (ФС №2009/389от 25.11.2009);
3. «Комплексная коррекция осложнениймногокомпонентного лечениязлокачественных опухолей различныхлокализаций с использованиемозонотерапии и низкоинтенсивноголазерного излучения» (ФС №2009/391 от25.11.2009).
Приложение 1.
Табл.1. Частотавыявления значимых ФНП у оперированныхбольных МРРШМ основной группы
Факторынеблагоприятного прогноза | М–КОМБ N=152 152/246(61,8%) | КОМПЛ N=94 94/246(38,2%) | ПОЛТ N=246 246/246(100%) | |||||||||||||
| абс. | p±sp, % | абс. | p±sp, % | абс. | p±sp, % | |||||||||||
| Объемопухоли до хирургического лечения | 114 | 75±3,5 | 62 | 66±4,9 | 180 | 73,2±2,8 | ||||||||||
| >100 см3 | 36 | 23,7±3,4 | 24 | 25,5±4,5 | 60 | 24,4±2,7 | ||||||||||
| 50–100 см3 | 78 | 51,3±4,1 | 38 | 40,4±1,6 | 116 | 47,2±3,2 | ||||||||||
| Низкодифференцированная формаопухоли | 57 | 37,5±3,9 | 27 | 28,7±4,7 | 84 | 34,1±3,0 | ||||||||||
| Опухоль–положительные границырезекции | 50 | 32,9±3,8 | 19 | 20,2±4,1 | 69 | 28,0±2,9 | ||||||||||
| Элементыопухоли в крае резекции | 22 | 14,5±2,9 | 7 | 7,4±2,7 | 29 | 11,8±2,1 | ||||||||||
| Близкое( 5мм)расположение опухоли к краю резекции | 28 | 18,4±3,1 | 12 | 12,7±3,4 | 40 | 16,3±2,4 | ||||||||||
| Глубокаяинвазия стромы шейки матки | 87 | 57,2±4,0 | 73 | 77,6±4,3 | 160 | 65,0±3,0 | ||||||||||
| средняятреть | 53 | 34,9±3,9 | 35 | 37,2±5,0 | 88 | 35,8±3,1 | ||||||||||
| наружнаятреть | 34 | 22,4±3,4 | 38 | 40,4±5,1 | 72 | 29,3±2,9 | ||||||||||
| Распространение на тело матки | 15 | 9,8±2,4 | 31 | 32,9±4,8 | 46 | 18,7±2,5 | ||||||||||
| без инвазиимиометрия | 4 | 2,6±1,3 | 7 | 7,4±2,7 | 11 | 4,5±1,3 | ||||||||||
| с инвазиеймиометрия | 11 | 7,2±2,1 | 24 | 25,5±4,3 | 35 | 14,2±2,2 | ||||||||||
| Опухолевоепоражение влагалища | 33 | 21,7±3,3 | 8 | 8,5±2,9 | 41 | 16,7±2,4 | ||||||||||
| Опухолевоепоражение параметриев | 28 | 18,4±3,1 | 24 | 25,5±4,5 | 52 | 21,1±2,6 | ||||||||||
| одностороннее | 24 | 15,8±3,0 | 19 | 20,2±4,1 | 43 | 17,5±2,4 | ||||||||||
| двустороннее | 4 | 2,6±1,3 | 5 | 5,3±2,3 | 9 | 3,7±1,2 | ||||||||||
| Нерадикальное ХИР | 59 | 38,8±4,0 | 11 | 11,6±3,3 | 70 | 28,5±2,9 | ||||||||||
| невыполнение тазовойлимфаденэктомии | 21 | 13,8±2,8 | 4 | 4,2±2,1 | 25 | 10,1±1,9 | ||||||||||
| визуальноопределяемая остаточная опухоль | 38 | 25,7±3,5 | 7 | 7,4±2,7 | 45 | 18,3±2,5 | ||||||||||
| Симультантные ХИР | 7 | 4,6±1,7 | 11 | 11,7±3,3 | 18 | 7,3±1,7 | ||||||||||
| на мочевыхпутях | 3 | 2 | 9 | 9,6 | 12 | 4,9 | ||||||||||
| накишечнике | 4 | 2,6 | 2 | 2,1 | 6 | 2,4 | ||||||||||
| Степеньтерапевтического патоморфоза в первичнойопухоли после НАТ | 17/152 | 11,2±2,6 | 94/94 | 100 | 111/246 | 45,1±3,2 | ||||||||||
| всегобольных с НАТ | 17/17 | 100% | 111/111 | 100 | ||||||||||||
| 0–I | 3 | 2 | 17,6 | 23 | 24,5 | 26 | 10,6 | 23,4 | ||||||||
| II | 5 | 3,3 | 29,5 | 36 | 38,3 | 41 | 16,7 | 36,9 | ||||||||
| III | 7 | 4,6 | 41,2 | 32 | 34,1 | 39 | 15,9 | 35,1 | ||||||||
| IV | 2 | 1,3 | 11,8 | 3 | 3,1 | 5 | 2,1 | 4,5 | ||||||||
| Метастазыв тазовые ЛУ | всего | 37/152 | 24,3±3,5 | 44/94 | 46,8±5,1 | 81/246 | 32,9±3,0 | |||||||||
| из числаНАТ | 12/17 | 70,6±11,0 | 44/94 | 46,8±5,1 | 56/111 | 50,5±4,7 | ||||||||||
| одностороннее | 19 | 12,5±2,7 | 26 | 27,7±4,6 | 45 | 18,3±2,5 | ||||||||||
| двустороннее | 18 | 11,8±2,6 | 18 | 19,1±4,1 | 36 | 14,6±2,3 | ||||||||||
| подвздошные* | 19 | 12,5±2,7 | 36 | 38,3±5,0 | 55 | 22,4±2,7 | ||||||||||
| обтураторные* | 17 | 5,9±1,9 | 14 | 14,9±3,7 | 31 | 12,6±2,1 | ||||||||||
| Прогрессирование в ходе НАТ | 2/17 | 11,8 | 14/94 | 14,9±3,7 | 16/111 | 14,4±3,3 | ||||||||||
| Степеньтерапевтического патоморфоза в метастатическихлимфатических узлах | 12/12 | 100 | 44/44 | 100 | 56/56 | 100 | ||||||||||
| 0–I | 2 | 16,7 | 9 | 20,5 | 11 | 19,6±5,3 | ||||||||||
| II | 3 | 25 | 19 | 43,2 | 22 | 39,3±6,5 | ||||||||||
| III | 5 | 41,6 | 12 | 27,3 | 17 | 30,4±6,1 | ||||||||||
| IV | 2 | 16,7 | 4 | 9,1 | 6 | 10,7±4,1 | ||||||||||
| Лимфо–васкулярная инвазия,эмболия | 36 | 23,8±3,5 | 26 | 27,6±4,6 | 62 | 25,2±2,8 | ||||||||||
| Беременность | 14 | 9,2±2,3 | 5 | 5,3±2,3 | 19 | 7,7±2,5 | ||||||||||
Факторы неблагоприятного прогноза Вид лечения (подгруппа) | О С Н О В Н АЯ | |||||||||||||||
| ХЛЛ | Всего ХЛЛ N=112 100% | РСЛТм | Всего ЛРМ N=142 100% | Всего КонсервативнаяЛТ N=254 100% | ||||||||||||
П–ХЛЛ N= 78 100% | С–ХЛЛ N=34 100% | |||||||||||||||
ЛХРМ N=52 100% | ЛИГТ N=65 100% | КГТ N=25 100% | ||||||||||||||
| абс. | p,% | абс. | p,% | абс. | p±sp, % | абс. | p, % | абс. | p, % | абс. | p, % | абс. | p±sp, % | абс. | p±sp, % | |
| Объемопухолидо лечения 50 cм3 | 69 | 88,5 | 31 | 91,2 | 100 | 89,3±2,9 | 38 | 73,1 | 53 | 81,5 | 21 | 84,0 | 112 | 78,9±3,4 | 212 | 83,5±2,3 |
| 50–100см3 | 40 | 51,3 | 19 | 55,9 | 59 | 52,7±4,7 | 24 | 46,2 | 25 | 38,5 | 11 | 44,0 | 60 | 42,3±4,1 | 119 | 46,9±3,1 |
| >100 см3 | 29 | 37,2 | 12 | 35,3 | 41 | 36,6±4,6 | 14 | 26,9 | 28 | 43 | 10 | 40,0 | 52 | 36,6±4,0 | 93 | 36,6±3,0 |
| Низкодифференцированная формаопухоли | 22 | 28,2 | 8 | 23,5 | 30 | 26,8±4,2 | 9 | 17,3 | 12 | 18,5 | 5 | 20,0 | 26 | 18,3±3,2 | 56 | 22,0±2,6 |
| Опухолевая обтурацияцервикального канала | 60 | 76,9 | 29 | 85,3 | 89 | 79,5±3,8 | 39 | 75 | 47 | 72,3 | 11 | 44,0 | 97 | 68,3±3,9 | 186 | 73,2±3,1 |
| Инфильтративно–язвенная формароста | 13 | 16,8 | 12 | 35,3 | 25 | 22,3±3,9 | 9 | 17,3 | 7 | 10,8 | 5 | 20,0 | 21 | 14,8±3,4 | 46 | 18,1±2,4 |
| Распространение на теломатки | 48 | 61,5 | 19 | 55,8 | 67 | 59,8±4,6 | 29 | 55,7 | 28 | 43 | 7 | 28,0 | 64 | 45,1±4,2 | 131 | 51,5±3,1 |
| из нихв сочетании с аденомиозом | 22 | 45,8 | 13 | 68,4 | 35 | 52,2±4,7 | 11 | 37,9 | 12 | 18,5 | 3 | 12,0 | 26 | 40,6±3,7 | 48 | 36,6±3,0 |
| Опухолевое поражение влагалища | 49 | 62,8 | 14 | 41,2 | 63 | 56,3±4,7 | 18 | 34,6 | 32 | 49,2 | 8 | 32,0 | 58 | 40,8±4,1 | 121 | 47,6±3,1 |
| из нихс развитием опухолевого стеноза | 19 | 24,4 | 6 | 17,6 | 25 | 22,3±3,9 | 7 | 13,5 | 4 | 6,1 | 3 | 12,0 | 14 | 24,1±3,6 | 39 | 15,4±2,3 |
Табл.2. Частотавыявления значимых ФНП у неоперированныхбольных МРРШМ основной группы.
| Опухолевое поражениепараметриев | 63 | 80,7 | 28 | 82,3 | 91 | 81,3±3,7 | 42 | 80,7 | 43 | 66,2 | 19 | 76,0 | 104 | 73,2±3,7 | 195 | 76,2±2,7 | |||||||||||||||||
| 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | ||||||||||||||||||||||||||
одностороннее | <1/3 | 9 | 14,3 | – | – | 9 | 9,9 | 8 | 19,1 | 5 | 11,6 | – | – | 13 | 12,5 | 22 | 11,3 | ||||||||||||||||
| 1/3–2/3 | 16 | 25,4 | 11 | 39,3 | 27 | 29,7 | 12 | 28,6 | 13 | 30,2 | 5 | 26,3 | 30 | 28,8 | 57 | 29,2 | |||||||||||||||||
| >2/3 | 10 | 15,9 | – | – | 10 | 11,0 | 7 | 13,7 | 7 | 16,3 | 4 | 21,1 | 18 | 17,3 | 28 | 14,4 | |||||||||||||||||
| всего | 35 | 55,6 | 11 | 39,3 | 46 | 50,6±5,2 | 27 | 64,3 | 25 | 58,1 | 9 | 47,4 | 61 | 58,7±4,8 | 107 | 54,9±3,6 | |||||||||||||||||
двустороннее | <1/3 | 5 | 7,9 | – | 5 | 5,5 | 5 | 11,9 | – | – | – | – | 5 | 4,8 | 10 | 5,1 | |||||||||||||||||
| 1/3–2/3 | 11 | 17,5 | 10 | 35,7 | 21 | 23,1 | 5 | 11,9 | 11 | 25,6 | 5 | 26,3 | 21 | 20,2 | 42 | 21,5 | |||||||||||||||||
| >2/3 | 12 | 19,0 | 7 | 25,0 | 19 | 20,9 | 5 | 11,9 | 7 | 11,1 | 5 | 26,3 | 17 | 16,3 | 36 | 18,5 | |||||||||||||||||
| всего | 28 | 44,4 | 17 | 60,7 | 45 | 49,5±5,2 | 15 | 35,7 | 18 | 28,6 | 10 | 52,6 | 43 | 41,3±4,9 | 88 | 45,1±3,6 | |||||||||||||||||
Метастазы в ЛУ | 33 | 42,3 | 12 | 35,3 | 45 | 36,6±4,6 | 13 | 25,0 | 15 | 23,0 | 5 | 20,0 | 33 | 23,2±3,5 | 78 | 30,7±2,9 | |||||||||||||||||
| одностороннее | 10 | 12,8 | 5 | 14.7 | 15 | 13,4 | 7 | 13,5 | 9 | 13,8 | 5 | 20,0 | 21 | 14,8 | 36 | 14,2 | |||||||||||||||||
| двустороннее | 23 | 29,5 | 7 | 20,6 | 30 | 26,8 | 6 | 11,5 | 6 | 9,2 | – | 12 | 8,4 | 42 | 16,5 | ||||||||||||||||||
| тазовые | 33 | 42,3 | 12 | 35,3 | 45 | 36,6 | 13 | 25 | 15 | 23,1 | 5 | 20,0 | 33 | 23,2 | 78 | 30,7 | |||||||||||||||||
| парааортальные | 2 | 2,6 | 2 | 5,9 | 4 | 3,8 | – | – | 8 | 12,3 | – | – | 8 | 5,6 | 12 | 4,7 | |||||||||||||||||
| шейные/паховые | 1 | 1,3 | – | – | 1 | 0,9 | – | – | 3 | 4,6 | – | – | 3 | 2,1 | 4 | 1,8 | |||||||||||||||||
| СОДср в опухоли, Гр | 67,3±4,3 | 69,0±2,6 | 67,8±4,1 | 70,8±6,4 | 67,6±2,5 | 69,9±4,0 | 69,2±3,7 | 68,6±4,1 | |||||||||||||||||||||||||
| Длительность курса, нед | 16,7±6,3 | 10,5±2,5 | 14,8±4,7 | 5,7±2,2 | 5,9±2,1 | 8,5±2,1 | 6,3±1,6 | 10,1±4,3 | |||||||||||||||||||||||||
| в т.ч. лучевой терапии, нед. | 6,3±1,8 | 10,5±2,5 | 8,4±2,1 | 5,7±2,2 | 5,9±2,1 | 8,5±2,1 | 6,3±1,6 | 7,4±1,1 | |||||||||||||||||||||||||
| Инкуррентная патология вкритических органах | 54 | 69,2 | 26 | 76,5 | 80 | 71,4±4,3 | 36 | 69,2 | 40 | 61,5 | 13 | 52 | 89 | 62,7±4,1 | 169 | 66,5±3,0 | |||||||||||||||||
Приложение 2.
Алгоритмыпослеоперационной сочетанной лучевойтерапии в комбинированном и комплексномлечении больных МРРШМ

а – алгоритмвнутриполостного облучениявагинального рубца

б – алгоритм облучения влагалищнойтрубки

в– алгоритм дистанционногооблучения таза

г–суммарное дозноераспределение при оптимизированномоблучении тазовых лимфатических узлов пошестипольной методике («полубокс») втрансверзальной (справа), сагиттальнойи коронарной (слева) проекциях.
Списоксокращений
ВПГТ – внутриполостнаягамма-терапия
ВОЗ – Всемирная ОрганизацияЗдравоохранения
ДЛТ – дистанционнаялучевая терапия
КГТ–криогипотермия
КОМБ–комбинированноелечение, контрольная группа
КОМПЛ – комплексноелечение, основнаягруппа
ЛИГТ – локальнаялазериндуцированная гипертермия
ЛРМ – локальнаярадиомодификация
ЛХРМ – локальнаяхимио–радиомодификация
М–КОМБ– модифицированноекомбинированное лечение,основная группа
МРРШМ –местнораспространенный рак шейкиматки
МРТ –магнитно-резонансная томография
НАХТ – неоадъювантнаяхимиотерапия
ПОЛТ –послеоперационная лучевая терапия
П-ХЛЛ–последовательный курс химио-лучевого лечения
РКТ-рентгеновскаякомпьютерная томография
РОД – разовая очаговаядоза
РЭМП – расширеннаяэкстирпация матки с придатками
СЛТ - сочетаннаялучевая терапия
СОД – суммарнаяочаговая доза
С- ХЛЛ– единый(симультантный) курс химио-лучевого лечения
УЗИ- ультразвуковоеисследование
ФНП – факторынеблагоприятного прогноза
ХЛЛ – химио-лучевоелечение
ЭГДС-эзофагогастродуоденоскопия
CTV– clinical target volume– клинический терапевтическийобъем мишени
D90– доза,покрывающая 90% мишени
DVH– dose–volume histogram – гистограмма«доза–объем»
GTV – gross target volume – объем опухоли–мишени
IGRT ( image–guided radiotherapy) – визуально контролируемаялучеваятерапия
IR–CTV–intermediate– risk clinical target volume – клинический терапевтическийобъем промежуточногориска
V100 – индекс охватамишени 100% изодозным контуром

