Сопроводительная терапия цитостатического лечения системных заболеваний в педиатрии на модели солидных опухолей у детей
На правах рукописи
Копосов Павел Валентинович
«Сопроводительная терапия цитостатического лечения системных заболеваний в педиатрии на модели солидных опухолей у детей»
14.00.09 - педиатрия
14.00.14 - онкология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Санкт-Петербург - 2009
Работа выполнена в Государственном учреждении «Российская детская клиническая больница Федерального агентства по здравоохранению и социальному развитию (Москва)», на кафедре госпитальной педиатрии и на кафедре онкологии с курсом лучевой диагностики и лучевой терапии Государственного образовательного учреждения высшего профессионального образования «Санкт-Петербургская государственная педиатрическая медицинская академия Федерального агентства по здравоохранению и социальному развитию».
Научные консультанты:
доктор медицинских наук, профессор Часнык Вячеслав Григорьевич
доктор медицинских наук, профессор Белогурова Маргарита Борисовна
Официальные оппоненты:
доктор медицинских наук, профессор Юрьев Владимир Владимирович
доктор медицинских наук, профессор Эрман Михаил Владимирович
Заслуженный деятель науки РФ, доктор медицинских наук,
профессор Гершанович Михаил Лазаревич
Ведущая организация: Государственное образовательное учреждение дополнительного профессионального образования «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию»
Защита состоится 14 декабря 2009 г. В 10:00 часов на заседании совета по защите докторских и кандидатских диссертаций Д 208.087.03 при ГОУ ВПО СПбГПМА Росздрава по адресу: 194100, Санкт-Петербург, Литовская ул., д. 2
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО (194100, Санкт-Петербург, ул. Кантемировская, 16)
Автореферат разослан “___” _______________ 2009 г.
Ученый секретарь диссертационного совета
доктор медицинский наук, профессор Чухловина М.Л.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Даже поверхностный анализ истории использования цитостатической терапии с момента первых наблюдений лимфопении с последующей гипоплазией красного костного мозга после отравления горчичным газом и первых попыток целенаправленного использования этого эффекта для лечения лимфопролиферативных состояний [Rhoads C., 1946; Karnofsky D., 1958] до формирования фундаментальных представлений о действии основных фармакологических групп препаратов, используемых для лечения неопластических заболеваний [Wiemlann MC, Calabresi P., 1985] и разработки высокоэффективных схем цитостатической терапии [см.: "New Guidelines Updates from National Comprehensive Cancer Network" Cancerwatch Online, Volume 13 Issue Number 3, March 2004] приводит к выводу о наличии устойчивой тенденции к постепенному переносу накопленного в области онкологии опыта применения этих препаратов на прочие классы заболеваний, в процессах саногенеза которых необходимо, по современным представлениям, усилить иммуносупрессию. Причем, детский и юношеский возраст традиционно [Goodman L. et al., 1946; Farber S., et al., 1948] является наиболее перспективным с точки зрения отработки новых схем терапии многих заболеваний, что обусловлено особенностями становления процессов иммунологического контроля и – в немалой степени – лучшим прогнозом.
В настоящее время в педиатрической практике программы цитостатической терапии применяются при лечении очень широкого круга заболеваний, входящих в компетенцию ревматологов, кардиологов, нефрологов, пульмонологов, гематологов и других специалистов. [Kliegman R. M. et al, 2007]. Вместе с тем, надо признать, что до сих пор в клинической педиатрии показания к назначению цитостатиков и сами программы терапии детализированы значительно меньше в отличие от онкологии, где в настоящее время несколько десятков программ цитостатической химиотерапии имеют показания и программы, основанные, как правило, на результатах многоцентровых международных исследований. В значительной мере, результатом такой детализации явилось и введение с 90-х годов прошлого века раздела «Сопроводительное лечение» («Supportive drugs») в качестве декретированного направления разработки программ терапии онкологических заболеваний [Eckhardt S., 2006], весьма востребованного в терапии онкологических заболеваний взрослых и онкогематологических заболеваний у детей, но практически не разработанного для поддержки цитостатических программ терапии солидных опухолей у детей.
Вместе с тем, хорошо известно, что при солидных опухолях у детей химиотерапия является ключевым элементом лечения. В последние десятилетия в экономически развитых странах удалось добиться перелома в диагностике и лечении злокачественных опухолей у детей: из фатальной рак превратился в курабельную патологию [Дурнов Л.А., 2005, Румянцев А.Г., 2003, Ковалев В.И. и соавт., 2001, A. Medaws, 2008, G. Schaub, 2008]. Химиотерапия, как метод высокоэффективного лечения многих опухолей у большинства опухолей у детей, занимает в настоящее время лидирующее место в лечении абсолютного большинства злокачественных новообразований [Гершанович М.Л., 2009, Переводчикова Н.И., 2006, Klastersky J и соавт., 1999, Lowenthal R.M. и соавт.2006, Nesbit M., 2001]. Комплекс мер, способствующих удовлетворительной переносимости химиотерапии, получивший название сопроводительного лечения [Гершанович М.Л. и соавт., 2009, Pratt C., 2004, Meadows A.T., 2005, Lansky S., 1999] в существенной степени обеспечил прогресс в терапии онкологических заболеваний.
Как известно, химиотерапия наряду с цитопатическим действием на опухолевую пролиферацию оказывает также повреждающее действие и на нормальные ткани организма, нарушая его гомеостаз, физиологическое взаимодействие органов и систем. Дозо-лимитирующими факторами в переносимости цитостатического лечения являются различные степени толерантности физиологических тканей и систем организма [Lowenthal R.M., 2001, Meadows A., 2002]. Таким образом, искусство проведения цитостатического лечения связано, в первую очередь, не только с формальным соблюдением режима введения цитостатиков в организм больного, сколько с возможностью профилактики и лечения острых и отсроченных осложнений химиотерапии, т.е., с проведением сопроводительного лечения. Прогресс в химиотерапии детей, больных раком, состоит наряду с внедрением интенсивных схем цитостатического лечения, в предотвращении и коррекции дозолимитирующих факторов, являющихся неизбежным следствием химиотерапии. Сопроводительное лечение является интегральным дополнением и неотъемлемой частью современных программ и протоколов лечения различных нозологических форм. Основными разделами сопроводительного лечения являются: профилактика инфекционных осложнений; лечение инфекционных осложнений в периоде цитостатически индуцированной аплазии кроветворения; коррекция электролитных нарушений во время цитостатического и антибактериального лечения; трансфузионная и заместительная терапия компонентами крови; профилактика и лечение тошноты и рвоты, кардиотоксичности, нейро -, нефро -, и уро- токсичностей, легочной токсичности, других видов органной токсичности, индуцированных химиотерапией; энтеральное питание; проведение целенаправленного психологического консультирования пациентов и их родителей [Гершанович М.Л. и соавт., 2009, Ковалев Д.В. и соавт, 2004, Румянцев А.Г и соавт., 2005, Meadows A, 2002]. Комплексное лечение детей, страдающих злокачественными новообразованиями, системными заболеваниями требует возможности диагностики и лечения специфических неотложных состояний, при которых наряду с проведением реанимационных мероприятий, требуется либо назначение химиотерапии, либо лечение ее осложнений.
В настоящее время при выборе программ сопроводительного лечения при полихимиотерапии у детей приходится ориентироваться на опыт иностранных специалистов. В сентябре 2009 года при запросе по ключевым словам «supportive treatment polychemotherapy children” поисковый сервер Google предоставлял 86800 ссылок, при запросе по ключевым словам «сопроводительное лечение полихимиотерапия дети» - 193 ссылки. В отечественной практике вопросы объемов сопроводительного лечения при химиотерапии солидных опухолей в большей степени носят характер спорадических публикаций по отдельным разделам сопроводительного лечения и, в основном, при гемобластозах. Они преимущественно касаются гематологической токсичности, инфекционных осложнений в периоде нейтропении, индуцированных химиотерапией. Недостаточно освещены и научно проработаны основы проведения сопроводительной терапии, систематизация специфических неотложных состояний у детей, страдающих раком, меры профилактики органной негематологической токсичности.
Химиотерапия, как вид цитопатического и иммуносупрессивного воздействия, широко используемого в лечении широкого спектра заболеваний у детей, нуждается в разработке научно обоснованной модели профилактики и лечения ее осложнений, могущей быть эталоном как для специалистов в области детской онкологии, так и для специалистов в других областях педиатрии.
Цель работы: Разработка научно-методических основ оптимизации программ профилактики, ранней диагностики и поэтапного сопроводительного лечения осложнений цитостатической терапии на модели солидных злокачественных опухолей у детей.
Задачи:
- Оценить эффективность профилактики тошноты и рвоты при использовании высокоэметогенных режимов химиотерапии солидных опухолей у детей, обосновать оптимальный режим антиэметогенного воздействия.
- Изучить кардиотоксическое действие различных режимов назначения антрациклиновых антибиотиков, оценить раннюю и отсроченную кардиотоксичность нового класса антрациклиновых антибиотиков – эпирубицина гидрохлорида.
- Изучить развитие реакций гиперчувствительности на примере анафилактогенного цитостатического препарата блеомицина гидрохлорида.
- Обосновать критерии клинических проявлений, профилактики и лечения легочной токсичности на примере "блеомицинового" легкого.
- Провести анализ фармакокинетики сублетальных доз метотрексата при химиотерапии опухолей центральной нервной системы у детей и выявить закономерности, способствующие удовлетворительной переносимости этого высокотехнологичного лечения.
- Обобщить научно-обоснованные подходы при неотложных состояниях в детской онкологической практике: развития периферической вегетативной нейропатии, синдрома неадекватной секреции антидиуретического гормона, проведения циторедуктивной химиотерапии при синдроме компрессии верхней полой вены интраторакально расположенной опухолью.
- Изучить факторы, способствующие повышению токсичности высоких доз цисплатина при остеосаркоме и определить подходы к ее профилактике.
- Оценить показания и эффективность трансфузионной терапии эритроцитарной массы и концентрата тромбоцитов, разработать алгоритм проведения трансфузионной терапии.
- Рассмотреть наиболее частое осложнение химиотерапии – фебрильную нейтропению – с точки зрения минимальных объемов диагностических вмешательств без учета общеизвестной и общепринятой в настоящее время лечебной тактики.
- Обобщить опыт психологического консультирования как неотъемлемой части сопроводительного лечения в детской онкологической практике.
Научная новизна и практическая значимость работы
На основании обобщения большого клинического материала впервые в клинической педиатрии и детской онкологии:
- выявлено, что наилучшие показатели полной защиты от острых тошноты и рвоты при высокоэметогенных режимах химиотерапии достигаются комбинацией блокаторов серотониновых рецепторов с дексаметазоном; впервые рассчитан кумулятивный эффект этой комбинации;
- выявлено, что профилактика отсроченной рвоты, индуцированной химиотерапией, лучше всего обеспечивается назначением глюкокортикоидов, либо их сочетанием с блокаторами серотониновых рецепторов;
- выявлено, что эпирубицин гидрохлорид в кумулятивной дозе 450-600 мг/м2, значимо более безопасен в плане развития антрациклиновой кардиомиопатии по сравнению с доксорубицином
- определена вероятность развития реакции анафилактического типа при назначении блеомицина и установлено, наличие такой реакции не является противопоказанием для продолжения курса блеомицина при назначение гипосенсибилизирующих средств,
- определена кумулятивная доза риска развития интерстициального пульмонита и легочного фиброза при назначении блеомицина ребенку,
- установлена возрастная динамика клиренса метотрексата, назначенного в сублетальных дозах;
- детально описан синдром неадекватной секреции антидиуретического гормона и определена вероятность его развития при полихимиотерапии;
- определены вероятность развития вегетативной периферической нейропатии при нейробластоме, вероятность выявления рентгенологических изменений в органах грудной полости при фебрильной нейтропении по ходу проведения химиотерапии и впервые оценена необходимость и эффективность трансфузии концентрата тромбоцитов при миелотоксической химиотерапии;
- с помощью проективных методик определены индивидуальные психологические факторы адаптации детей к цитостатическому лечению, которые способствуют преодолению социальной депривации и эмоциональной реабилитации.
Практическая значимость работы определяется тем, что накопленный опыт по профилактике и лечению ранних и отсроченных осложнений химиотерапии позволил внедрить к клиническую педиатрию и детскую онкологию научно-обоснованное этапное сопроводительное лечение, в зависимости от вида предполагаемого цитостатического лечения. Выявленные закономерности на модели профилактического лечения осложнений химиотерапии солидных опухолей можно использовать в качестве эталона и при других заболеваниях у детей, требующих цитостатического и иммуносупрессивного воздействия. Обобщены проблемы системной токсичности в разрезе нозологических форм и конкретного вида цитостатического воздействия, фармакокинетических параметров, на организм ребенка. Рассмотрены организационные вопросы междисциплинарного характера по оптимизации оказания высокотехнологичной медицинской помощи детям в условиях детской многопрофильной больницы.
Основные результаты работы в настоящее время включены в учебную программу курса онкологии на кафедре онкологии с курсами лучевой диагностики и лучевой терапии ГОУ ВПО СПбГПМА, в учебные программы курсов ревматологии, кардиологии и гематологии на кафедре госпитальной педиатрии ГОУ ВПО СПбГПМА, в учебные программы курсов ревматологии и кардиологии на кафедре педиатрии им. И.М.Воронцова ФПК и ПП ГОУ ВПО СПбГПМА, в учебную программу курса детской хирургии на кафедре детской хирургии РГМУ. Предложенные схемы профилактики, диагностики и сопроводительного лечения осложнений цитостатической терапии у детей используются в работе клиники педиатрии №3 клинической базы ГОУ ВПО СПбГПМА, кардиоревматологического отделения СПб ГУЗ "Детская городская больница №2 святой Марии Магдалины", СПб ГУЗ "Детская городская больница №1", СПб ГУЗ "Городская больница №31".
Личный вклад автора. Автором самостоятельно выполнен аналитический обзор отечественной и зарубежной литературы по теме диссертации, разработан дизайн исследования и информационные карты, проведен выбор данных из первичной медицинской документации. Самостоятельно проведен также анализ материала, интерпретация полученных результатов, их изложение а также формулировка выводов и практических рекомендаций. Доля автора в накоплении информации – 100%, в статистической обработке – 87,5%, в обобщении и анализе материала – 100%
Положения, выносимые на защиту
В качестве научно-методических основ оптимизации программ профилактики, ранней диагностики и поэтапного сопроводительного лечения осложнений цитостатической терапии на защиту выносятся:
1. результаты ретроспективного анализа технологии лечения сублетальными дозами метотрексата и применения различных схем сопроводительного лечения при полихимиотерапии у детей и разработанные на его основе принципы формирования комплекса мероприятий по профилактике и лечению негематологической токсичности при программной полихимиотерапии солидных опухолей у детей, в частности: тошноты и рвоты, индуцированных высокоэметогенной химиотерапией, кардиотоксичности антрациклиновых антибиотиков, нефро-и уро- токсичности алкилирующих цитостатиков, включая цисплатин, нейротоксичности цитостатиков, реакции гиперчувствительности, легочной токсичности;
2. клинико-лабораторные описания и основанные на них способы ранней диагностики редко встречающихся в педиатрии специфических неотложных состояний, входящих в группу серьезных побочных эффектов цитостатической терапии - синдрома неадекватной секреции антидиуретического гормона, синдрома компрессии органов средостения, - а также методы терапии паралитического илеуса, индуцированного винкаалкалоидами;
3. разработанные в ходе выполнения работы организационно-методические аспекты междисциплинарного взаимодействия при обеспечении непрерывности сопроводительного лечения осложнений цитостатической терапии в условиях педиатрического стационара;
4. научно-методическое обоснование применения психологического консультирования в комплексе методов сопроводительного лечения при полихимиотерапии у детей.
Апробация диссертации
Материалы диссертационной работы опубликованы более чем в 100 печатных работах, в т.ч. монографиях и учебных пособиях, из них в рекомендованных ВАК изданиях – 32. Результаты работы доложены на 2-ом съезде детских онкологов России (Ростов-на-Дону, 2001), на 9-м Национальном Российском конгрессе «Человек и лекарство» (Москва, 2002), 9-м международном симпозиуме «Актуальные проблемы детской онкологии», Минск, 2002) на 13-м Национальном российском конгрессе «Человек и лекарство» (Москва, 2006) а также на научно-практических конференциях, организованных кафедрами госпитальной педиатрии и онкологии с курсами лучевой диагностики и лучевой терапии ГОУ ВПО СПбГПМА (май 2009, август 2009).
Структура и объем диссертации. Диссертация состоит из введения, обзора литературы, трех глав собственных исследований, обсуждения полученных результатов, выводов, практических рекомендаций и списка литературы. Работа изложена на 226 страницах машинописного текста. Текст иллюстрирован 45 таблицами, 12 рисунками, выписками из историй болезни и морфологических заключений. Библиографический указатель включает 326 литературных источников, в том числе 259 зарубежных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Дизайн исследования включал в себя 3 этапа:
- ретроспективный анализ историй болезни с целью выявления эпидемиологических особенностей и причинно-следственных связей в цепи «программа химиотерапии – осложнения – сценарий сопровождающей терапии» с учетом диагноза,
- систематизация симптомокомплексов, ассоциированных с различными вариантами сопроводительной терапии, определение целей оптимизации и предложение оптимизированных программ терапии,
- сравнение использования неоптимизированных и оптимизированных схем терапии в ходе построения моделей дожития Каплан-Мейер (Kaplan-Meier Product-Limit).
Кроме того, для редко встречающихся симптомокомплексов приведены клинико-лабораторные описания.
Анализированы истории болезни 318 пациентов (198 мальчиков и 120 девочек), находившихся на лечении в отделении онкологии с 1997 по 2005 гг. и отделении полихимиотерапии в 1997-2008 гг Российской детской клинической больницы Росздрава (главный врач – д.м.н., профессор Ваганов Н.Н.). Исследование было одобрено этической комиссией в установленном порядке. В исследование были включены лишь пациенты, получавшие программную химиотерапию, соответствующую стандартным международным лечебным протоколам. Всего проанализировано 1353 курса химиотерапии. При комплексной оценке кардиотоксичности, для определения важности места лучевой терапии в генезе кардиотоксичности на фоне химиотерапии антрациклин-содержащими схемами, наряду с пациентами гепатобластомой, саркомами мягких тканей, костными саркомами, нейробластомой в анализ дополнительно были включены 36 пациентов, страдавших гемобластозами (неходжкинской лимфомой или лимфогранулематозом) и получавших лечение в отделении химиотерапии с 1997 по 2000г. Характеристика пациентов, их возраст и нозологические формы солидных опухолей, включенных в научный анализ, представлена в таблице 1.
Протокол ВЕР был применен 28 пациентам в возрасте от 7 месяцев до 16 лет, страдающим герминогенными опухолями. Этот химиотерапевтический режим включал курсовую химиотерапию следующими препаратами: цисплатин 20 мг/м2 1-5 дни в виде часовой инфузии; этопозид 100 мг/м2 1-5 дни в виде часовой инфузии, блеомицин 15 мг/м2 в виде 10-минутной болюсной инфузии в 1 день курса химиотерапии. За 2 часа до старта химиотерапии назначалась стандартная инфузия - физиологический раствор: 5% раствор глюкозы со скоростью 125 мл/м2/час и суточной постинфузии в том же режиме с добавлением препаратов калия и магния и маннитола в объеме 3 г/м2 поверхности тела. Для детей в возрасте менее 12 месяцев дозы цитостатиков составляли: блеомицин 0,5 мг/кг в 1 день, этопозид 3 мг/кг 1-5 дни, цисплатин 0,7 мг/кг 1-5 дни. Объемы инфузионной терапии рассчитывались исходя из площади поверхности тела (по стандартной методике).
Таблица 1. Характеристика пациентов, включенных в исследование
| Нозологическая форма | Число пациентов | Возраст (медиана) | Программа лечения |
| Рабдомиосаркома | 53 | 2-16 лет (5,7) | CWS-90, CWS-96 |
| Прочие саркомы мягких тканей | 21 | 1г.4.м – 16 лет (4,9) | CWS-96 |
| Опухоли ЦНС | 63 | 6мес-16 лет (6,4 г) | HIT-91, HIT-2000 |
| Остеосаркома | 48 | 6-17 лет (12,3) | COSS-89, 2000 |
| Герминогенные опухоли | 28 | 7 мес. – 16 лет (3,5) | BEP |
| Нейробластома | 31 | 3 мес-4 г (2,2) | NB90, NB94A |
| Опухоль Вилмса | 14 | 6 мес. – 8 лет (2,8) | SIOP-90, SIOP-2000 |
| Саркома Юинга | 13 | 2г 2 м – 15 лет (6,1г) | EICESS, EURO-EWING-99 |
| Гепатобластома | 11 | 5 мес. – 13 лет (3,8г) | SIOPEL-3 |
| Прочие | 36 | 4 г-15 лет (7,2) | |
| Всего: | 318 | ||
Лечение остеосаркомы проводилось по адаптированной программе COSS (Германия), которая включала курсы химиотерапии и оперативное лечение. Лечение проведено 48 пациентам в возрасте от 6 до 17 лет. В курсах AP (Цисплатин/Доксорубицин) использовался цисплатин в дозе 120 мг/м2 в виде 5-ти часовой инфузии с гипергидратацией 3000 мл/м2 поверхности тела и стимуляцией диуреза осмотическими диуретиками и доксорубицин в дозе 30 мг/м2 1-3 дни в виде часовой инфузии с параллельной стандартной инфузией (2000 мл/м2) в течение 72 часов. Указанные курсы проводились 1 раз в 3 недели. При резистентности к химиотерапии и низком патоморфозе проводилась ротация химиотерапии с проведением курсов IP (ифосфамид/цисплатин), включающих ифосфамид в дозе 3 г/м2с уромитексаном в виде часовой инфузии в дни 1-2, и цисплатин в дозе 120 мг/м2 в 3 день с гиперинфузией и стимуляцией диуреза в 3-й день и последующей 72 часовой постинфузией; либо проводилась химиотерапия IE: ифосфамид 2 г/м2 1-5 дни, этопозид 100 мг/м2 1-5 дни внутривенно капельно на фоне инфузионной терапии, с протекцией уромитексаном и противорвотной терапией.
Для лечения сарком мягких тканей использовался модифицированный протокол CWS (Германия). Всего проанализировано 74 пациента в возрасте от 1 года 4 месяцев до 16 лет. Базовым элементом химиотерапевтического лечения были альтернирующие курсы химиотерапии VAIA/VACA. Режимы химиотерапии включали ифосфамид в дозе 3 г/м2в 1-2 дни, винкристин 1,5 мг/м2 1, 8 и 15 дни внутривенно струйно, доксорубицин 40 мг/м2 внутривенно болюсно в 1-2 дни курса, либо актиномицин Д 1,5 мг/м2 в виде болюсной инфузии, этопозид 150 мг/м2 1-3 дни. Курсы химиотерапии проводились на фоне 24-часовой инфузионной терапии в сочетании с введением уромитексана в суточной дозе 2 г/м2. Интервалы между курсами составляли 21 день.
Лечение опухолей центральной нервной системы проанализировано у 63 пациентов в возрасте от 6 месяцев до 16 лет. Детям проводилось цитостатическое лечение по протоколам HIT-91, HIT-2000 (Германия). Химиотерапевтическая часть протоколов состояла из так называемой «сэндвич»-терапии, включающей альтернирующие курсы цисплатина, ифосфамида, этопозида, высоких доз метотрексата, цисплатина и цитозина арабинозида. Ифосфамид назначался в дозе 3 г/м2поверхности тела 1-3 дни в сочетании с этопозидом 150 мг/м2 4-6 дни на фоне гипергидратации с протекцией уромитексаном. Высокие дозы метотрексата назначались в дозе 5000 мг/м2 на фоне форсированного диуреза защелаченной мочой с введением антагониста метотрексата – лейковорина в соответствии с номограммами экскреции метотрексата, начиная с 42 часа в пятую и шестую недели «сэндвич»-терапии. Следующим курсом химиотерапии – на седьмой неделе лечения - завершался курс «сэндвич»-терапии – назначался цисплатин в дозе 40 мг/м2в сочетании с цитозина арабинозидом в повышенной дозе 400 мг/м2 на фоне гипергидратации.
При лечении пациентов, страдающих саркомой Юинга (13 человек в возрасте от 2.2 до 16 лет), использовались химиотерапевтические элементы протоколов EICESS, EURO-EWING. Последние включали альтернирующие курсы химиотерапии VAIA/VACA или VIDE/VAC. Режимы химиотерапии включали ифосфамид в дозе 3 г/м2 в 1-2 дни, винкристин 1,5 мг/м2 1, 8 и 15 дни внутривенно струйно, доксорубицин 40 мг/м2 внутривенно болюсно в 1-2 дни курса, либо актиномицин Д 1,5 мг/м2 в виде болюсной инфузии. Курсы химиотерапии проводились на фоне 24-часовой инфузионной терапии в сочетании с введением уромитексана в суточной дозе 2 г/м2. Интервалы между курсами составляли 21 день.
В пред- и послеоперационной химиотерапии больных опухолью Вилмса использовался протокол SIOP (Международное общество детских онкологов). Лечение проанализировано у 14 больных в возрасте от 6 месяцев до 8 лет. Химиотерапия опухоли Вилмса имеет дробно-протяженный режим и заключается в еженедельном введении винкристина в дозе 1,5 мг/м2 поверхности тела и актиномицина Д в дозе 45 мкг/кг 1 раз в три недели, доксорубицин 1,5 мг/м2 1 раз в в3 недели.
Для лечения 31 пациента нейробластомой в возрасте от 4 месяцев до 4 лет использовался европейский протокол NB 90 (группа высокого риска), который включал цикловую химиотерапию с использованием альтернирующих режимов VP/Carbo (карбоплатин 200 мг/м2 и этопозид 150 мг/м2 1-3 дни) и CADO (циклофосфамид по 300 мг/м2 1-5 дни, доксорубицин 30 мг/м2 в/в 4-5 дни и винкристин 1,5 мг/ м2 1 и 5 дни). Лечение проводилось на фоне инфузионной терапии.
Токсичность химиотерапии злокачественных опухолей печени проанализирована у 11 пациентов в возрасте от 4 месяцев до 13 лет. Лечение больным проводилось по европейскому протоколу SIOPEL-3 с включением курсовой химиотерапии по схеме PLADO. Каждый курс лечения включал назначение доксорубицина в дозе 60 мг/м2 в виде 48-часовой инфузии и цисплатина 80 мг/м2 поверхности тела в виде 24-часовой инфузии. Химиотерапия проводилась с интервалом 2 недели на фоне гипергидратации.
Оценка критериев токсичности проведена в соответствии с методическими рекомендациями ВОЗ в модификации SIOP, опубликованные в General methodology for phase II trials in pediatric oncology, 1994.
Оперативное лечение больным с опухолями ЦНС было проведено в НИИ нейрохирургии имени Бурденко Российской АМН – 24 пациентам (директор – академик РАМН, профессор А.Н. Коновалов), отделении нейрохирургии РДКБ (зав. отделением Пальм В.В.) – 17, в территориальных нейрохирургических отделениях – 22 пациентам.
Лучевая терапия проводилась большинству пациентов в Российском научном центре Рентгенорадиологии Минздравсоцразвития России (директор – академик РАМН, профессор Харченко В.П.). Хирургические вмешательства выполнялись в отделении онкологии РДКБ (зав.отд. – Ковалев В.И.), ЛОР-отделении (зав.отд. – Водолазов С.Ю.), отд. гинекологии (зав. отд. – Дядик Т.Г.). Рентгеновская диагностика и компьютерная томография выполнены в рентгеновском отделении РДКБ (зав. отд. Нецветаева Т.Э.) и отделении компьютерной томографии (зав. отд. – д.м.н. Алеханов А.А.), ультразвуковая и электрофизиологическая диагностика выполнены в отделении функциональной диагностики РДКБ (зав. отд. – Сенякович Н.Б.). Морфологическая верификация диагноза и аутопсии выполнены в отделении патологической морфологии РДКБ (зав.отд. – к.м.н. Нажимов В.П.), клинико-лабораторные исследования проводились в клинико-биохимической и клинико-диагностической лабораториях РДКБ (зав. лаб. – Лукьянова Е.Г. и Байдун Л.В.). Статистическая обработка материала с использованием SPSS v.10.0 проведена при участии д.м.н. Попа А.В (НИИ ДОГ ГУ РОНЦ имени Н.Н. Блохина). Психологическое консультирование проводилось научным сотрудником Виноградовой Е.Ю. кафедры медицинской психологии Московского государственного Университета имени М.В. Ломоносова.
Анализ клинических и лабораторных данных проведен по критериям оценки токсичности ВОЗ с использованием компьютерной базы данных и статистической обработкой последних. Математическая обработка полученных данных проводилась в программной среде SPSS. 10,5. Была создана база данных, состоящая из нескольких групп таблиц, связанных между собой ключевыми полями в различных соотношениях. Для сравнения уровней показателей использовались стандартизованные показатели заболеваемости. Общая выживаемость на популяционном уровне рассчитывалась по методу Каплана-Майера, стандартная ошибка вычислялась по формуле Гринвуда, достоверность различий между сравниваемыми группами больных оценивалась по Log rank тесту [Parkin et al, 1991].
Научное консультирование по разделам диссертации проводилось докт. мед. наук, профессором, зав. кафедрой онкологии с курсом лучевой диагностики и лучевой терапии СПбГПМА М.Б. Белогуровой и докт. мед. наук, профессором, зав. кафедрой госпитальной педиатрии СПбГПМА В.Г. Часныком.
Полученные результаты
Тошнота и рвота во время химиотерапии у детей является наиболее стрессовым побочным эффектом. Применение антагонистов серотонина при полихимиотерапии у детей неоднозначно снижает эметогенность цитостатиков с высоким эметогенным потенциалом. В связи с этим нами была предпринята попытка определить сравнительную эффективность антагониста серотониновых рецепторов - гранисетрона, глюкокортикоида дексаметазона и их сочетания «дексаметазон+гранисетрон» у пациентов с высокоэметогенной химиотерапией. Анализированные нозологические формы и соответствующие им схемы химиотерапии представлены в таблице 2.
В исследование включены 43 больных, которым проводилась программная химиотерапия по поводу сарком мягких тканей (протокол CWS-96) и саркомой Юинга (протокол EURO-EWING-99), при этом проанализированы те курсы химиотерапии, в которых одним из компонентов являлся ифосфамид – высокоэффективный и высокоэметогенный цитостатик в курсовой дозе более 6 г/м2 поверхности тела (от 6 до 9 г/м2): схемы IVA2, VAI, IVA3, IVE (протокол CWS-96), VIDE, VAI (протокол EuroEwing-99). Другие цитостатики, применяемые в указанных выше схемах были: актиномицин-Д, доксорубицин, этопозид, винкристин. Критериями исключения из ретроспективного анализа были: наличие тошноты и рвоты любого генеза за 24-72 часа до химиотерапии; эпилептические припадки в анамнезе и связанный с ними прием противосудорожных препаратов; другие причины тошноты и рвоты (обструкция кишечника, пищевода опухолью, опухоли ЦНС); повышенные печеночные пробы (АЛТ, АСТ, ЩФ, билирубин); конкурентное лечение глюкокортикоидами или бензодиазепинами; одновременная лучевая терапия; оценка статуса пациента по шкале Карновского (в модификации Lansky) менее 40.
В курсах полихимиотерапии первой группы (109 курсов химиотерапии) в качестве противорвотного прикрытия использовался дексаметазон в дозе 8-10 мг внутривенно в виде короткой инфузии в 50-100 мл физиологического раствора хлорида натрия каждые 12 часов в дни химиотерапии и в течение 1-2 дней по ее окончании также на фоне продолжающейся инфузионной терапии. Во второй группе курсов химиотерапии (137 курсов) гранисетрон назначался из расчета 40 мкг/кг (максимально 3 мг) внутривенно струйно в виде медленной инъекции каждые 12 часов во время химиотерапии и в течение двух дней по ее окончании на фоне продолжающейся инфузионной терапии. В третью группу анализа включены те курсы химиотерапии (162), в которых в качестве профилактики тошноты и рвоты применяли дексаметазон и гранисетрон в дозировках, указанных выше.
Таблица 2. Нозологические формы и соответствующие им программы лечения
и схемы химиотерапии
| Нозологическая форма | Число больных | Программа лечения | Схемы химиотерапии |
| Эмбриональная рабдомиосаркома | 11 | CWS-96 | IVA2, VAI (CWS), IVE |
| Альвеолярная рабдомиосаркома | 16 | CWS-96 | IVA2, VAI (CWS) IVE, IVA3 |
| Синовиальная саркома | 2 | CWS-96 | VAI (CWS), IVA3, IVE |
| Лейомиосаркома | 3 | CWS-96 | VAI (CWS), IVA3, IVE |
| Злокачественная шваннома | 2 | CWS-96 | VAI, IVA3, IVE |
| Саркома Юинга/пПНЭО | 9 | EURO-EWING-99 | VIDE, VAI (EE) |
пПНЭО –периферическая примитивная нейроэктодермальная опухоль
Эпизодом рвоты считалось наличие рвоты или отрыжки содержимым желудка. Полное противорвотное «прикрытие» определялось как отсутствие эпизодов рвоты. Удовлетворительным противорвотным прикрытием считали наличие 1-2 эпизодов рвоты или отрыжки в течение любого дня химиотерапии. Недостаточным противорвотным прикрытием считали наличие 3 и более эпизодов рвоты во время любого дня химиотерапии. Полное и удовлетворительное противорвотное прикрытие рассматривалось как успешная профилактика рвоты. Тошнота классифицировалась следующим образом: 0 – отсутствие тошноты, 1 - умеренная (не влияющая на самочувствие), 2 – выраженная (влияла на самочувствие) и 3 - сильная (требовала соблюдения постельного или охранительного режима). Отсутствие тошноты определялось как полное «прикрытие» против тошноты. Статистический анализ возникновения острой и отсроченной рвоты проведен с использованием критерия Фишера. Ретроспективно оценено 408 курсов химиотерапии. Характеристика пациентов, получивших высокоэметогенные режимы химиотерапии с применением ифосфамида, представлена в таблице 3.
Полное противорвотное прикрытие наблюдалось в 77 из 109 курсов химиотерапии, в которых был применен только дексаметазон (70,6%), в 99 из 137 - только гранисетрон (72,3%) и в 150 из 162 (92,6%), при использовании комбинации препаратов. Противорвотное лечение было успешным (полный и удовлетворительный эффект) в 89 курсах химиотерапии (81,6%) первой группы, в 113 (82,5%) курсах химиотерапии группы и в 158 (97,0%) курсах третьей группы при одновременном назначении гранисетрона и дексаметазона (P<0.001). Число больных с неудовлетворительным противорвотным эффектом составило 20 (18,3%), 24 (17,5%) и 4 (2,5%) соответственно.
В 32 курсах (29,4%) лечения первой группы отмечена рвота, в 38 (27,7%) в группе гранисетрона и 12 (7,4%) – в группе сравнения при применении двух препаратов. Среднее число эпизодов рвоты в трех группах (4, 3 и 2 соответственно) было наименьшими в третьей группе сравнения при использовании комбинации «дексаметазон+гранисетрон», но эти различия статистически не достоверны. Среднее время наступления рвоты было более продолжительным в группе сравнения при назначении дексаметазона (8,75 часов), чем во второй группе при лечении гранисетроном (6,25 часов) (Р=0.03), и в группе «дексаметазон+гранисетрон» - 8 часов (Р=0,26).
Таблица 3. Клиническая характеристика пациентов, получивших высокоэметогенные курсы химиотерапии с применением ифосфамида
| Характеристика пациентов | Дексаметазон Группа 1 | Гранисетрон Группа 2 | Дексаметазон +гранисетрон Группа 3 | |||
| N = 109 | N=137 | N=162 | ||||
| n | % | n | % | n | % | |
| Пол Мужской Женский | 56 53 | 51,3 48,7 | 61 76 | 44,5 55,5 | 74 88 | 45,7 54,3 |
| Возраст (средний) | 10,8 | 9,9 | 10,2 | |||
| Возрастные группы: 5-8 лет 8-12 лет 12-16 лет | 31 25 53 | 28,4 22,9 48,7 | 46 26 65 | 33,6 18,9 47,5 | 65 37 60 | 40,1 22,8 37,1 |
| Оценка статуса по шкале Карновского: 40-80 90-100 | 15 94 | 13,8 86,2 | 17 120 | 12,4 87,6 | 18 146 | 11,1 88,9 |
| Используемые схемы цитостатиков: IVA2 VAI (CWS) IVA3 IVE VIDE VAI (EE) | 21 14 20 9 26 19 | 19.3 12.8 18.3 8.3 23.9 17.4 | 26 19 14 22 31 25 | 19.0 13.9 10.2 16.1 22.6 18.2 | 34 27 18 21 45 17 | 21.0 16.7 11.1 13.0 27.8 10.4 |
Полное «прикрытие» от тошноты достигнуто у пациентов, получивших комбинацию «дексаметазон+гранисетрон» (116 из 162 (71,6%) в сравнении с 60 из 109 (55,0%)в «дексаметазоновой» группе и 66 из 137 (48,2%) в группе, получавшей гранисетрон (P<0,001). Степень выраженности тошноты была одинаковой во всех 3 группах. Среднее время наступления тошноты было статистически достоверно меньше в группе пациентов, получивших гранисетрон ( 5, 4 часа), чем в группе, получившей дексаметазон (7,8 часов Р=0,03) или «дексаметазон+гранисетрон» (7,7 часов, Р=0.002).
Полная защита от тошноты и рвоты (табл. 4) была статистически выше у пациентов, получивших комбинацию дексаметазона и гранистерона (114 из 162 (70,4%) в сравнении с 54 из 109 (49,3%) в случаях лечения дексаметазоном и 59 из 137 (43,1%), получивших гранисетрон (Р<0,001). Указанные факты свидетельствуют о том, что разница в полном противорвотном прикрытии и полным прикрытием против тошноты статистически достоверно отсутствует между группой больных, получивших только дексаметазон и группой больных, получивших только гранисетрон.
Таблица 4. Процентное соотношение больных с полным противорвотным прикрытием, от тошноты, от тошноты и рвоты одновременно
| Полное прикрытие | Дексаметазон | Гранисетрон | Дексаметазон+гранисетрон | Р |
| n=109 | n=137 | n=162 | ||
| Противорвотное | 70,6 (62,9-78,3) | 72,3 (64,8-79,8) | 92,6 (88,2-97,0) | <0.001 |
| От тошноты | 55,1 (46,7-63,5) | 48,2 (39,8-56,6) | 71,9 (64,3-79,5) | <0.001 |
| От рвоты и тошноты | 49,3 (40,9-57,7) | 43,1 (34,8-51,4) | 70,4 (62,7-78,1) | <0.001 |
Дополнительно была проанализирована отсроченная рвота, наблюдаемая в первые 2-3 дня по окончании курса химиотерапии (+4 - +5 дни) в тех же группах. В таблице 5 суммированы результаты этого анализа. Соотношение пациентов с полным прикрытием от рвоты и тошноты на день +4 и +5 достоверно выше у пациентов, получивших два препарата. Эффективность всех трех антиэметических режимов не различалась на день +6 и +7.
Таблица 5. Процентное соотношение полного «прикрытия»
от отсроченных рвоты и тошноты
| Полное «прикрытие» | Дексаметазон (n=107) | Гранисетрон (n=134) | Декаметазон+гранисетрон (n=162) | Р |
| От рвоты | ||||
| День +4 | 89,5 | 77,6 | 89,6 | 0.008 |
| День+5 | 92,5 | 88,8 | 95,2 | 0.16 |
| День +6 | 69,3 | 91,0 | 90,4 | 0.11 |
| День +7 | 98,5 | 94,0 | 94,8 | 0.13 |
| От тошноты | ||||
| День +4 | 62,7 | 42,5 | 64,4 | <0.001 |
| День +5 | 63,4 | 47,0 | 60,7 | 0.02 |
| День +6 | 68,7 | 61,9 | 66,7 | 0.49 |
| День +7 | 82,8 | 74,6 | 79,3 | 0.26 |
| От рвоты и тошноты | ||||
| День +4 | 61,9 | 41,0 | 62,2 | <0.001 |
| День +5 | 61,9 | 44,8 | 60,0 | 0.009 |
| День +6 | 67,9 | 60,4 | 65,9 | 0.42 |
| День +7 | 82,1 | 72,4 | 77,8 | 0.17 |
При анализе всего противорвотного лечения (острые тошнота и рвота и отсроченные тошнота и рвота) получено, что эффективность комбинированной профилактики тошноты и рвоты дексаметазоном и гранисетроном была выше (79,3%), чем в группах использования только одного препарата (67,2% для дексаметазона и 61,9% для гранисетрона). Процентное соотношение тошноты и рвоты у пациентов после +6 дня лечения было незначительным и разница статистически недостоверна. Как видно из таблицы 6 наиболее частыми побочными явлениями противорвотной терапии были запор и чувство «прилива» у пациентов, получивших дексаметазон+гранисетрон: 0 – у больных, получивших дексаметазон, 1 (2,2%) – в группе, получавшей только гранисетрон и 9 (5,6%) – в группе, получившей комбинацию этих препаратов. Головная боль наблюдалась одинаково во всех 3 группах сравнения. Боли в эпигастрии отмечались редко (2,8%, 2,9% и 1,2% соответственно) и не зависели от вида противорвотного лечения.
Комбинированная профилактика тошноты и рвоты имела очевидные преимущества перед изолированным использованием каждого препарата в отдельности. Полная защита от острых тошноты, рвоты и двух этих факторов была выше на 20% при сочетании двух противорвотных препаратов. Наиболее эффективной противорвотная защита от отсроченных тошноты и рвоты проявлялась у тех пациентов, у которых эти симптомы были минимальны в период проведения курса химиотерапии. В нашем наблюдении более 80% больных, получивших лечение дексаметазоном или дексаметазоном в сочетании с гранисетроном, не проявляли побочных эффектов цитостатической терапии в виде рвоты в течение 2-5 дней после окончания курса химиотерапии (89,5% и 89,6% соответственно). В противоположность этому дети, получившие в качестве противорвотного прикрытия только гранисетрон, были в меньшей степени защищены от отсроченной рвоты.
Таблица 6. Побочные эффекты противорвотной терапии
| Побочный эффект | Дексаметазон | Гранисетрон | Дексаметазон+гранисетрон | Р |
| n=109 | N=137 | N=162 | ||
| Головная боль | 14 (12,8%) | 16 (11,7%) | 14 (8,6%) | 0,89 |
| Запор | 0 | 3 (2,2%) | 9 (5,6%) | 0,006 |
| Изжога | 4 (3,7%) | 0 | 0 | 0,06 |
| Слабость | 11 (10,1%) | 9(6,6%) | 5 (3,1%) | 0,30 |
| Боли в эпигастрии | 3 (2,8%) | 4 (2,9%) | 2 (1,2%) | 0,69 |
| Беспокойство | 1 (0,9%) | 0 | 1 (0,6%) | 0,54 |
| Чувство «прилива» | 1 (0,9%) | 0 | 6 (3,6%) | 0,03 |
| Бессонница | 0 | 1 (0,7%) | 1 (0,6%) | 0,54 |
| Другие | 19 (17,4%) | 18 (13,1%) | 10 (6,2%) | 0,16 |
| Всего | 53 (48,6%) | 52 (37,9%) | 48 (28,7%) | 0,80 |
Для исследования кардиотоксического побочного действия антрациклиновых антибиотиков проанализированы истории болезни 142 детей, клиническая характеристика которых представлена в таблице 7. Для каждого пациента учитывалась следующая информация: возраст пациента на дату начала химиотерапии; пол; нозологическая форма опухоли; химиотерапевтический протокол: кумулятивная доза антрациклиновых антибиотиков (доксорубицина, рубомицина и/или эпирубицина), сочетание антрациклинов с циклофосфамидом и ифосфамидом; дата начала химиотерапии антрациклинами; наличие конкурентной лучевой терапии с включением в поле облучения сердца, в т.ч. левой половины брюшной полости, кранио-спинального облучения, дата последнего наблюдения; дата и причина смерти; клинические симптомы сердечной недостаточности и, в случае их наличия, их причину, лечение и клинический исход. Под антрациклиновой кардиотоксичностью понимали застойную сердечную недостаточность, связанную с применением антрациклиновых антибиотиков, не обусловленную прямым воздействием на сердечную деятельность опухоли септического шока или почечной недостаточности. В зависимости от времени выявления выделяли раннюю антрациклиновую кардиомиопатию (во время или в течение одного года после окончания химиотерапии антрациклинами) и позднюю антрациклиновую кардиомиопатию (более года после антрациклин-содержащей химиотерапии). Средний возраст пациентов составлял 7,3 лет (от 5 мес. до 16 лет). Кумулятивная доза антрациклиновых антибиотиков варьировала от 28 до 880 мг/м2 поверхности тела. Только эпирубицин получили 18 детей, 89 – только доксорубицин, 14 – только рубомицин, 21 больным назначались другие препараты антрациклиновых антибиотиков. У 67 больных (47,2%) в программной полихимиотерапии антрациклиновые антибиотики сочетались с циклофосфаном, в 32 наблюдениях (22,5%) – с ифосфамидом. Лучевая терапия на область средостения, область левого гемиторакса или левую половину брюшной полости, грудного отдела спинного мозга в суммарной очаговой дозе 10,5 – 32,6 Грей проведена 24 (16,9%) пациентам. Среднее время наблюдения за больными составило 4,3 года (0,5 – 9,6 лет).
Из выделенной когорты 38 пациентов (26,7%) умерли от разных причин, из них 1 пациент (2,6%) от дилятационной кардиомиопатии, ассоциированной с антрациклиновой токсичностью. Антрациклиновая кардиотоксичность зарегистрирована у 4 больных, что составило 2,8% больных.
Характеристика больных, у которых развилась антрациклиновая кардиомиопатия, представлена в таблице 8. Средний возраст пациентов с антрациклиновой кардиомиопатией, составил 6,5 лет (1 г.11 мес. – 12 лет), средняя кумулятивная доза антрациклиновых антибиотиков при этом была 510 мг/м2 поверхности тела (320-650 мг/м2). Одному пациенту
Таблица 7. Клиническая характеристика 142 пациентов, которым проведена полихимиотерапия с антрациклиновыми антибиотиками
| Характеристика | Число пациентов | Больные с кардиотоксичностью (n=4) | |
| n | % | ||
| Пол : | |||
| Мужской | 81 | 2 | 2,5 |
| Женский | 61 | 2 | 3,3 |
| Возраст на начало химиотерапии: | |||
| Менее 2 лет | 21 | 1 | 4,8 |
| 2-4 года | 43 | 1 | 2,3 |
| 5-9 лет | 36 | 1 | 2,8 |
| 10-14 лет | 24 | 1 | 4,2 |
| Более 14 лет | 18 | 0 | 0 |
| Диагноз: | |||
| Острый лимфобластный лейкоз | 2 | 0 | 0 |
| Лимфогранулематоз | 15 | 1 | 6,7 |
| Неходжкинская лимфома | 19 | 1 | 5,2 |
| Остеосаркома | 21 | 1 | 4,8 |
| Саркома Юинга | 13 | 1 | 7,7 |
| Саркома мягких тканей | 29 | 0 | 0 |
| Опухоль Вилмса | 21 | 0 | 0 |
| Гепатобластома (гепатоцеллюлярный рак) | 11 | 0 | 0 |
| Опухоль ЦНС | 11 | 0 | 0 |
| ВСЕГО | 142 | 4 | 2,8 |
| Кумулятивная доза антрациклинов: | |||
| Менее 150 мг/м2 | 17 | 0 | 0 |
| 150-300 мг/м2 | 49 | 0 | 0 |
| 300-450 мг/м2 | 43 | 1 | 2,3 |
| 450-600 мг/м2 | 26 | 1 | 3,8 |
| Более 600 мг/м2 | 4 | 2 | 50,0 |
| Неизвестно | 3 | 0 | 0 |
| ВСЕГО | 142 | 4 | 4,2 |
| Ифосфамид: | |||
| Не назначался | 106 | 1 | 0,9 |
| Назначался | 32 | 1 | 3,1 |
| Неизвестно | 4 | 0 | 0 |
| ВСЕГО | 142 | ||
| Циклофосфан: | |||
| Не назначался | 73 | 1 | 1,4 |
| Назначался | 67 | 2 | 2,9 |
| Неизвестно | 2 | 0 | 0 |
| ВСЕГО | 142 | ||
| Лучевая терапия с включением в поле облучения сердца: | |||
| Проводилась | 24 | 1 | 4,2 |
| Не проводилась | 117 | 3 | 2,6 |
| Неизвестно | 1 | 0 | 0 |
| ВСЕГО | 142 | ||
| Период лечения: | |||
| 1995-1997гг | 42 | 3 | 7,1 |
| 1998-2000гг | 36 | 1 | 2,7 |
| 2000-2005гг | 64 | 0 | 0 |
| ВСЕГО | 142 | 4 | 2,8 |
в программе полихимиотерапии одновременно назначался ифосфамид, еще одному ребенку – циклофосфамид и проводилась лучевая терапия на область средостения в суммарной очаговой дозе 25,5 Грей. У всех больных отмечена дилятация полостей сердца и уменьшение контрактильной способности миокарда до 24%, 28%, 38% и 42% соответственно. Всем больным проведено лечение по поводу антрациклиновой кардиомиопатии дигоксином и диуретиками. В одном случае смерть больного наступила от дилятационной кардиомиопатии, в других случаях – от прогрессирования основного заболевания.
Анализ периодов лечения показал, что указанные случаи развития антрациклиновых кардиомиопатий наблюдались в эпоху становления сопроводительного лечения при химиотерапии злокачественных опухолей у детей и после 1998 года не регистрировались.
Таблица 8. Характеристика, лечение и исход у 4 пациентов с антрациклиновой кардиомиопатией
| № п/п | Пол | Диагноз | Возраст | Суммарная доза антрацик линов | Лучевая терапия | Ифос фамид | Циклоф осфан | Сроки развития АК | Исход |
| 1 | М. | Лимфогранулематоз | 8 лет | 320 мг/ м2 | + | - | + | До 1 г. | Смерть |
| 2 | Д. | НХЛ | 4 года | 460 мг/ м2 | - | - | - | До 1 г. | Смерть |
| 3 | М. | Остеосаркома | 12 лет | 610мг/ м2 | - | - | - | 2,6 лет | Смерть |
| 4 | Д. | Саркома Юинга | 1г.11м | 650 мг/ м2 | - | + | - | 4,6 лет | Смерть от АК |
АК- антрациклиновая кардиомиопатия; НХЛ – неходжкинская лимфома
Ретроспективно изучена возможность развития кардиотоксичности высоких доз эпирубицина при интенсификации химиотерапии антрациклиновыми антибиотиками в программном лечении злокачественных новообразований у детей. В связи с тем, что широко применяемый в России протокол CWS-96 для лечения сарком мягких тканей содержит высокую суммарную дозу эпирубицина гидрохлорида - 450-600 мг/м2 - была проанализирована кардиотоксичность химиотерапии именно этого протокола. В исследовании проанализировано 26 последовательных пациентов, страдающих саркомами мягких тканей, в возрасте от 2 до 16 лет с прогностически неблагоприятными формами опухоли. Все больные были в группе высокого риска, им была проведена полихимиотерапия по протоколу CWS-96. Электрофизиологические исследования сердца и ЭхоКГ проводились всем пациентам до начала лечения, при этом грубая органическая патология сердца была выявлена у 1 ребенка, и он был переведен в группу лечения без использования антрациклиновых антибиотиков. К группе высокого прогностического риска отнесены больные, имеющие следующие характеристики опухоли (табл.9).
Таблица 9. Распределение больных по нозологическим формам сарком мягких тканей
| Нозологическая форма | Число пациентов |
| Эмбриональная рабдомиосаркома различных локализаций | 6 |
| Альвеолярная рабдомиосаркома различных локализаций | 4 |
| Синовиальная саркома стопы | 1 |
| Периферическая примитивная нейроэктодермальная опухоль | 4 |
| Эмбриональная рабдомиосаркома IV стадия | 3 |
| ВСЕГО | 18 |
Режим химиотерапии CEVAIE приведен на рисунке 1.
| IVA | CEV | IVE | |||||
| IFO | | | | | Carbo | | | IFO | ||| | ||
| 3г/м2 | 500 мг/м2 | 3 г/м2 | |||||
| VCR | | (|) (|) | EPI | | | VCR | | (|) (|) | ||
| 1,5мг/м2 | 150 мг/м2 | 1,5 мг/м2 | |||||
| AMD | | | VCR | | (|)(|) | VP | ||| | ||
| 1,5мг/м2 | 1,5 мг/м2 | 150 мг/м2 | |||||
| недели | 1 2 3 | недели | 4 5 6 | недели | 7 8 9 | ||
IFO-ифосфамид, VCR- винкристин, AMD- актиномицин Д, Carbo – карбоплатин, EPI- эпирубицин, VP- этопозид
Рисунок 1. Режим химиотерапии CEVAIE
Пациенты с саркомами мягких тканей (клиническая стадия II-III) получали 3 курса CEVAIE, пациенты с IV стадией – от 3 до 4 курсов CEVAIE. Таким образом, кумулятивная доза эпирубицина у пациентов составляла от 450 до 600 мг/м2. Эпирубицин вводился внутривенно в 5% растворе глюкозы в виде 6-часовой инфузии в 1 день 4-й недели химиотерапии каждого курса CEVAIE, наряду с карбоплатином и винкристином. В процессе химиотерапии тахикарадия выявлена у 12 больных (67%), экстрасистолия – у 2 пациентов (11%). В перерыве между курсами химиотерапии CEVAIE у всех больных (100%) возникали изменения на ЭКГ – синусовая тахикардия (89,6%), экстрасистолия (33,6%), эктопия сердечного ритма (5,6%), уменьшение вольтажа QRS (44,8%), либо незначительное удлинение интервала PQ (11,2%). Однако, показатели контрактильной способности миокарда левого желудочка, размеров левого желудочка и фракции изгнания левого желудочка оставались в переделах возрастных норм. Оценить другие побочные эффекты эпирубицина (миелосупрессия, тошнота, рвота, повреждение слизистых оболочек и придатков кожи) не представлялось возможным, т.к. препарат назначался в режимах полихимиотерапии. После проведения химиотерапии миелосупрессия была выраженной и требовала заместительной трансфузионной терапии, антибактериальной терапии и назначения колониестимулирующих факторов.
Не выявлено зависимости между электрокардиографическими нарушениями ритма, проводимости и состоянием сократимости миокарда в процессе и по окончании лечения. Жизнеугрожающие нарушения ритма не регистрировались даже при преодолении кумулятивной дозы антрациклинового порога в 450 мг/м2. Не было отмечено клинических и инструментальных проявлений поздней антрациклиновой кардиотоксичности у больных, получивших в процессе полихимиотерапии кумулятивную дозу эпирубицина до 600 мг/м2. Ранние изменения на ЭКГ в дебюте химиотерапии, даже до назначения эпирубицина, были в основном представлены синусовой тахикардией и/или аномалией на ЭКГ (неспецифические изменения сегментов ST-T), тахиаритмией, включая желудочковую экстрасистолию и желудочковую тахикардию, а также брадикардией, блокадой ножек пучка Гиса. Возникновение этих явлений не являлось прогностическим фактором развития впоследствии отсроченной кардиотоксичности, они не были клинически значимыми, были обратимыми и не требовали отмены терапии эпирубицином. Выявляемая при лечении доксорубицином в эквивалентных дозах поздняя (отсроченная) кардиомиопатия, в наших наблюдениях при сроках наблюдения 12-34 мес. (в среднем 28,6 мес.) не выявлены. При динамическом проведении ЭхоКГ даже после кумуляции дозы эпирубицина от 450 до 600 мг/м2 не выявлено расширения полостей сердца, снижения сократительной способности миокарда и фракции выброса ниже нижней границы возрастной нормы. При суммарной дозе эпирубицина 450-600 мг/м2 признаков антрациклиновой кардиотоксичности не выявлено ни у одного больного, что свидетельствует о хорошей переносимости препарата и его высоком профиле безопасности в плане развития кардиотоксичности. Изменения на ЭКГ были обратимы и связывались с теми патологическими состояниями, которые сопутствовали течению заболеванию у ребенка – опухолевой интоксикацией, электролитными нарушениями, анемией, фебрильной лихорадкой в период нейтропении, сепсисом.
В исследовании проведен ретроспективный анализ токсичности высоких доз цисплатина (120 мг/м2 поверхности тела) при лечении 48 пациентов, страдающих остеосаркомой длинных трубчатых костей в возрасте от 6 до 17 лет (медиана 12,3 года), которым проводилась пред- и послеоперационная химиотерапия. Проанализировано 246 курсов химиотерапии АС. На рисунке 2 схематично представлен режим химиотерапии в блоке АС.
| DOXO- 30 мг/м2 24 часа | DOXO- 30 мг/м2 24 часа | DOXO- 30 мг/м2 24 часа | CDDP 120мг/м2 6 часов |
1 день 2 день 3 день 4 день
DOXO- доксорубицин, CDDP – цисплатин
Рисунок 2. Схема блока химиотерапии АС
Комплексная тактика сопроводительного лечения включала: профилактику тошноты и рвоты блокаторами серотониновых рецепторов в стандартных дозах, причем при проведении 83 курсов (33,8%) требовалось потенцирование противорвотного действия дексаметазоном в разовой дозе 10-20 мг внутривенно болюсно; использование режимов гипергидратации с форсированием диуреза маннитом; мониторинг баланса введенной и выделенной жидкости; коррекцию электролитов при лабораторных признаках электролитных нарушений. В 179 случаях (73%) исследования клиренса по эндогенному креатинину этот показатель составил более 100 мл/мин. Перед 67 курсами (27%) он колебался от 70 до 100 мл/мин. Это требовало проведения редукции доз цисплатина на 50% при сохранении режимов гипергидратации и форсирования диуреза маннитом. Острые токсические эффекты цисплатина проанализированы во всех 246 курсах химиотерапии АС, проведенных 48 больным. Частота острых токсических эффектов цисплатина приведена в таблице 10.
Таблица 10. Острые токсические эффекты цисплатина (n=246)
| Побочное действие | Количество курсов ХТ | % |
| Тошнота | 22 | 8,94 |
| Рвота | 239 | 97,15 |
| Нефрит | 12 | 4,8 |
| Нейтропения/агранулоцитоз | 167 | 67,89 |
| Анемия | 70 | 28,46 |
| Тромбоцитопения (менее 20х109/л) | 98 | 39,83 |
| Полиневрит | 16 | 6,5 |
| Гипокальциемия | 79 | 32,11 |
| Синдром неадекватной секреции антидиуретического гормона | 4 | 1,62 |
| Артериальная гипотензия | 14 | 5,69 |
| Нефротоксичность : Повышение креатинина в сыворотке крови | 74 | 30,08 |
| Снижение клиренса креатинина | 69 | 28,05 |
Среди побочных явлений превалировали: рвота (97,2%), гематологическая токсичность (67,9%), нефротоксичность (30,1). Также отмечались полиневрит в 6,5%, цитостатический нефрит в 4,8%, снижение артериального давления в 5,7% случаев.
Более углубленный анализ острой токсичности цисплатина был проанализирован по следующим показателям: кратность рвоты; отрицательный баланс выделенной почками жидкости; гематологическая токсичность; необходимость назначения антибиотиков; необходимость назначения гранулоцитарного колониестимулирующего фактора; факт отсрочки проведения последующего блока ПХТ; количество трансфузий эритроцитарной массы; количество трансфузий тромбоцитарной массы; снижение клиренса по эндогенному креатинину после блока AC. Зависимость острых токсических эффектов цисплатина от выраженности тошноты и рвоты представлена в таблице 11.
Таблица 11. Зависимость острых токсических эффектов
от выраженности тошноты и рвоты (n=246)
| Гематологическая токсичность | Отрицат. водный баланс | Назначение АБ | Назначение ГКСФ | Кол-во трансфузий ЭМ | Кол-во трансфузий ТК | Снижение КК | Отсрочка блока ХТ | |||
| II ст. | III ст. | IV ст. | ||||||||
| Тошнота | 2 | 4 | 0 | 0 | 3 | 0 | 3 | 0 | 0 | 3 |
| n/ % | 0.8% | 1.6% | 0% | 0% | 1.2% | 0% | 1.2% | 0% | 0% | 1.2% |
| Рвота 1-3 раза | 13 | 23 | 28 | 5 | 28 | 0 | 10 | 3 | 0 | 17 |
| n/ % | 5.3% | 9.4% | 11.4% | 2.0% | 114% | 0% | 4.1% | 1.2% | 0% | 6.9% |
| Рвота 4-6 раз | 0 | 10 | 55 | 12 | 37 | 6 | 19 | 21 | 15 | 42 |
| n/ % | 0% | 4.1% | 22.4% | 4.9% | 15.0% | 2.4% | 7.7% | 8.5% | 6.1% | 17.1% |
| Рвота >6 раз | 8 | 6 | 97 | 29 | 99 | 72 | 58 | 46 | 54 | 96 |
| n/ % | 3.3% | 2.4% | 39.4% | 11.8% | 40.2% | 29.3% | 23.6% | 18.7% | 21.9% | 39.0% |
| Итого | 23 | 43 | 180 | 46 | 167 | 78 | 90 | 70 | 69 | 158 |
| n/ % | 9.3% | 17.5% | 73.2% | 18.6% | 67.9% | 31.7% | 36.6% | 28.5% | 28.1% | 64.2% |
АБ-антибиотики, ГКСФ-гранулоцитарный колониестимулирующий фактор, ЭМ – эритроцитарная масса. ТК – тромбоконцентрат, КК – клиренс креатинина, ХТ – химиотерапия.
При анализе полученных данных (табл.11) выявлено, что задержка мочи (в 11,8% случаев), гематологическая токсичность 3-4 степени (в 29,3% случаев), частота развития фебрильных нейтропений (в 40,4%), потребность в трансфузиях компонентов крови (36,6%) после курса химиотерапии цисплатином были наивысшими в случаях недостаточности противорвотной терапии. На рисунке 3 отражено возрастание частоты гематологической токсичности, требующей назначения антибиотиков, колониестимулирующих факторов, отсрочки в проведении последующего блока химиотерапии и заместительной трансфузионной терапии от выраженности рвотного синдрома. Чем выраженнее рвота во время курса химиотерапии, тем выше частота развития нейтропении, анемии, тромбоцитопении, снижения клиренса эндогенного креатинина, тем больше объем дополнительного лечения осложнений (антибактериальная терапия, колониестимулирующие факторы, трансфузии компонентов крови).
Проблема легочной токсичности рассмотрена на примере блеомицина. Применение блеомицина в программном лечении больных герминогенными опухолями имеет принципиальное значение: режим химиотерапии ВЕР является одной из наиболее эффективной комбинацией цитостатиков, при помощи которой возможно достижение более чем 95% показателя 3-х летней бессобытийной выживаемости. Проанализирована группа, состоящая из 29 пациентов в возрасте от 7 месяцев до 16 лет, получавших химиотерапию по поводу герминогенных опухолей. В 1 случае отмечен ранний рецидив опухоли у больной крестцово-копчиковой тератобластомой в возрасте 2 г. 2 мес. и больной было проведено противорецидивное лечение в виде 8 альтернирующих курсов химиотерапии АСЕ (актиномицин Д, циклофосфамид, этопозид) и РОМВ (цисплатин, винкристин, метотрексат, блеомицин). Кумулятивная доза блеомицина составила 60-90 мг/м2 (в среднем 74,2 мг/м2
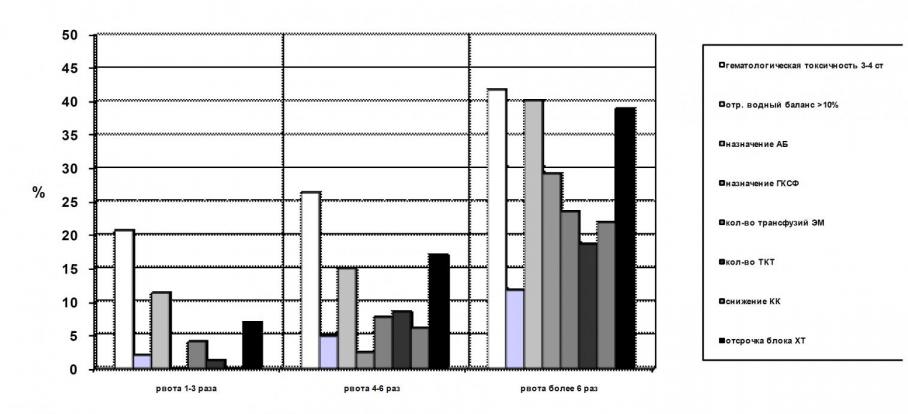
АБ-антибиотики, ЭМ – эритроцитарная масса, ТКТ-трансфузия концентрата тромбоцитов, КК – клиренс креатинина, ХТ – химиотерапия, ГКСФ - гранулоцитарный колоние-стимулирующий фактор
Рисунок 3. Ассоциация рвоты с токсическими эффектами высоких доз цисплатина
поверхности тела) у 27 больных и 210 мг/м2 поверхности тела у одной больной с рецидивом опухоли. В группу по изучению блеомициновой легочной токсичности мы также включили
одного пациента 13 лет с пресакральной тератобластомой и метастазами во внутригрудные лимфатические узлы, которому в другом учреждении была проведена непрограммная полихимиотерапия с кумулятивной дозой блеомицина 240 мг/м2 поверхности тела с консолидацией эффекта лучевой терапией на область средостения в суммарной очаговой дозе 18 Грей. Блеомициновая легочная токсичность развилась у 2 пациентов: у больной в возрасте 2 лет и 2 мес. и больного 13 лет. Кумулятивная доза блеомицина составила 210 мг/м2 и 240 мг/ м2 соответственно. Клинические симптомы, развившиеся в течение 2-4 недель после окончания полихимиотерапии блеомицином, проявлялись интерстициальным пульмонитом с исходом в легочный фиброз.
При анализе клинического материала заострена проблема ранее не описанной в отечественной литературе вегетативной нейропатии у детей раннего возраста, которая является грозным осложнением, требующим проведения дифференциальной диагностики с широким кругом заболеваний и осложнений химиотерапии.
Проведен ретроспективный анализ историй болезни 31 пациента раннего возраста (от 3 месяцев до 4 лет), которым проводилось лечение по поводу нейрогенных опухолей. Особенностью протоколов лечения нейрогенных опухолей является более частое, чем обычно, введение винкристина. Проанализировано 60 курсов химиотерапии, которые в протоколах NB94A (CAV) и VP16/Carbo-CADO практически идентичны, состоят из 5-ти дневного курса, в состав которых входит циклофосфамид 300 мг/м2 1- 5 дни внутривенно капельно, доксорубицин в курсовой дозе 60 мг/м2 внутривенно капельно и винкристин, который вводится в стандартной дозе 1,5 мг/ м2 поверхности тела внутривенно струйно в 1и 5 дни курса химиотерапии. Характеристика пациентов, включенных в анализ по развитию вегетативной нейропатии, представлена в таблице 12.
Проанализировано развитие нейротоксичности вегетативной нервной системы в 60 курсах химиотерапии CAV и CADO. Переносимость лечения у всех больных была удовлетворительной, однако во всех случаях (100%) развивалась гематологическая токсичность 3- 4 степени по шкале ВОЗ. Развитие пареза кишечника различной степени выраженности, вплоть до паралитического илеуса, выявлено после 37 курсов химиотерапии (61,7%), что соответствовало двум введениям винкристина в стандартной дозе.
Таблица 12. Характеристика пациентов, включенных в анализ по развитию вегетативной нейропатии (n=31)
| Возраст | 3 мес. – 4 года (1,9 лет) |
| Пол (М:Ж) | 2,3:1 |
| CADO (винкристин, циклофосфан, доксорубицин) | 16 курсов |
| CAV (циклофосфан, винкристин, доксорубицин) | 34 курса |
| Локализация опухоли: Забрюшинное пространство Средостение Голова/шея Малый таз | 14 (45,8%) 12 (38,7%) 4 (12,9%) 2 (6,5%) |
Адинамический илеус (паретический) развился в 8 случаях (13,3%) и характеризовался значительным ухудшением состояния больных. Клинические проявления включали полный отказ от еды, аускультативное ослабление или полное отсутствие кишечной перистальтики, увеличение в размерах живота за счет метеоризма и растяжения петель кишечника, перкуторно определяющимся тимпаническим звуком. Лабораторные исследования включали определение уровней Na+, К+, Са2+ и Mg2+, полной формулы крови, активности амилазы. При рентгенографии органов брюшной полости (в вертикальном положении) выявлялись диффузное распределение газа по кишечнику, иногда выявлялись чаши Клойбера. Характеристика клинических симптомов паралитического илеуса представлена в таблице 13. Для исключения других причин паретического илеуса проводилась дифференциальная диагностика с внутрибрюшинным воспалительным процессом, перфорацией полого органа брюшной полости, гипокалиемией, гипомагнезиемией, сепсисом, обтурационной, спастической, странгуляционной непроходимостью, плевропневмонией.
Таблица 13. Характеристика пациентов и клинические симптомы при развитии паралитического илеуса, индуцированного химиотерапией винкристином (n=8)
| Признак | Абс. числа | % |
| Возраст | 3 мес. –4 года | |
| Пол (М:Ж) | 5:3 | |
| Опухоль забрюшинного пространства | 6 | 75 |
| Другая локализация нейрогенной опухоли | 2 | 25 |
| Беспокойство (боли в животе) | 8 | 100 |
| Отказ от еды | 8 | 100 |
| Рвота | 8 | 100 |
| Вздутие живота | 8 | 100 |
| Ослабление/отсутствие перистальтики | 8 | 100 |
| Гипокалиемия | 4 | 50 |
| Повышение альфа-амилазы | 1 | 12,5 |
| Нейтропения | 7 | 87,5 |
| Лихорадка | 8 | 100 |
| Синдром дыхательных расстройств | 6 | 75 |
Консервативное лечение паралитического илеуса, индуцированного винкристином, включало: коррекцию водно-электролитных нарушений, гипокалиемии и гипомагниемии; коррекцию кислотно-щелочного равновесия; восстановление объема циркулирующей крови; декомпрессию желудка и кишечника назогастральным зондом; активацию кишечной перистальтики; детоксикационную и антибактериальную терапию; сердечно-сосудистую терапию; профилактику и устранение синдрома дыхательных нарушений. Перистальтика кишечника на фоне интенсивного лечения возобновлялась в тонкой кишке через 24-72 часов, толстой кишке — через 3-5 суток. В таблице 14 представлена рентгенологическая семиотика паралитического илеуса, индуцированного винкристином.
Клинические проявления винкристиновой вегетативной нейропатии обладали выраженным полиморфизмом, причем наибольшую опасность представляла вегетативная нейропатия, проявляющаяся паралитическим илеусом. Знание клинической симптоматики этого вида нейропатии, своевременной и правильной оценки комплекса симптомов и правильной интерпретации лабораторных данных одновременно с назначением посиндромного лечения способствовала благоприятному исходу при этом ургентном осложнении цитостатического лечения. Смертей от паралитического илеуса не было.
Таблица 14. Рентгенологические признаки паралитического илеуса, индуцированного химиотерапией винкристином у 8 больных
| Клинический признак | Скиаскопический признак | Абс.ч | % |
| Газ в кишечнике | Значительное количество газа, распределенного диффузно по кишечнику | 8 | 100 |
| Газ в толстой кишке | Увеличенное количество по всей толстой кишке | 6 | 75 |
| Уровни жидкости в кишке | Часто много и повсеместно | 6 | 75 |
| Наличие опухоли | В забрюшинном пространстве | 3 | 37,5 |
| Перитонеальный экссудат | Отмечается при перитоните, асците | 1 | 12,5 |
| Диафрагма | Приподнята, движение ограничено | 8 | 100 |
В работе освещен малоизвестный вопрос в детской онкологической практике – синдром неадекватной секреции антидиуретического гормона (НСАДГ). При ретроспективном анализе историй болезни умерших больных, получавших химиотерапию до эры внедрения полноценного сопроводительного лечения при химиотерапии, в 4 случаях установлен прижизненно невыявленный синдром неадекватной секреции антидиуретического гормона. Характеристика указанных больных и клинические симптомы синдрома НСАДГ представлены в таблице 15.
При анализе клинических данных обращало внимание то, что прогрессирующая симптоматика развивалась в течение 18-36 часов. Первыми симптомами были, как правило, анорексия, рвота, жажда, т.е. те симптомы, которые можно было принять за обычные осложнения химиотерапии. Во всех случаях одновременно отмечалась слабость, адинамия. Неврологические симптомы развивались постепенно, в течение 1-3 часов и проявлялись судорогами, спутанностью сознания, комой. Все больные были переведены в отделение реанимации, где проводилась искусственная вентиляция легких, назначались диуретики, кардиотоники. Проводилась дифференциальная диагностика с острым нарушением мозгового кровообращения по ишемическому или геморрагическому типу. Однако в связи с прогредиентным прогрессированием неврологической общемозговой и стволовой симптоматики проводимые реанимационные мероприятия успеха не имели. При аутопсиях, проведенных в трех случаях, выявлены отек и набухание головного мозга при отсутствии инфарктов или кровоизлияний в вещество головного мозга. Сопоставляя патоморфологические данные и лабораторно выявленную выраженную гипонатриемию, посмертно или ретроспективно были сделаны выводы о наличии синдрома неадекватной секреции антидиуретического гормона, приведшие к смерти больных.
Таблица 15. Характеристика больных с посмертно установленным синдромом НСАДГ
| Возраст, пол | Диагноз | Предполагаемый этиологический фактор | [C]Na мгЭкв/л | Клинические симптомы (в порядке прогрессирования) |
| Д., 9 мес. | Нефробластома | Винкристин (10 недель еженедельного введения) | 124 | Анорексия Судороги Кома Смерть |
| Д., 12 лет | В-клеточная неходжкинская лимфома | Сепсис Винкристин | 122 | Рвота Гипорефлексия Спутанное сознание судороги Смерть |
| Д., 7 лет | Рецидив неходжкинской лимфомы | Сепсис Винкристин Отмена глюкокортикоидов | 126 | Отказ от еды Кома Судороги Смерть |
| М., 4 лет | Медуллобластома червя мозжечка | Винкристин Цисплатин Несбалансированная инфузионная терапия | 126 | Жажда Головная боль Судороги Кома Смерть |
Таким образом, синдром неадекватной секреции антидиуретического гормона в данных клинических наблюдениях носил молниеносный характер, был обусловлен общей тяжестью состояния больных, недооценкой клинических данных и недостаточным лабораторным обследованием при начальных клинических признаках этого синдрома.
Таблица 16. Клиническая характеристика пациентов с развитием гипонатриемии
| Диагноз | Возможная причина гипонатриемии | Число больных | Число эпизодов гипонатриемии |
| Нефробластома | Винкристин | 4 | 9 |
| Нейрогенные опухоли | Вторичный пиелонефрит, сепсис | 3 | 3 |
| Нейрогенные опухоли | Винкристин, цисплатин, циклофосфан | 3 | 4 |
| Медуллобластома | Винкристин, цисплатин | 1 | 2 |
| Опухоли ЦНС | Винкристин, Высокие дозы метотрексата, гиперинфузия, септическое состояние, отмена глюкокортикоидов | 2 | 5 |
| Рак коры надпочечника | Сольтеряющая форма, ранний послеоперационный период | 1 | 1 |
| Саркома мягких тканей | Фебрильная нейтропения | 3 | 3 |
| Саркома Юинга | Фебрильная нейтропения | 2 | 2 |
| Остеосаркома | Цисплатин, фебрильная нейтропения | 3 | 3 |
В последнее время (1997-2008гг.) эпизоды гипонатриемии во время проведения химиотерапии, при развитии септических осложнений находятся под пристальным вниманием детского онколога и подлежат коррекции немедленно после регистрации таковых. При электролитном мониторинге, являющимся рутинным методом при проведении химиотерапии, зарегистрировано 32 эпизода гипонатриемии менее 132 мгЭкв/л ([C]Na=125-132 мгЭкв/л) у 22 пациентов (табл. 16). Причины гипонатриемии были разнообразны и связаны, в основном, с назначением цитостатичесих препаратов, диуретиков, гипотонических инфузионных растворов, септическими осложнениями. Клинические симптомы при выявленной минимальной гипонатриемии неспецифичны и проявлялись в виде вялости, адинамии, снижения аппетита.
Таблица 17. Группа риска пациентов по развитию синдрома НСАДГ
| Диагноз/осложнение/состояния | Причина включения | Контроль |
| Нефробластома | Еженедельное введение винкристина | Ежедневный контроль над состоянием больного: степенью его активности, отрицательного баланса введенной и выведенной жидкости, наличием олигурии, пастозности лица, отеков, прибавки веса. Регулярное исследование электролитов в сыворотке крови на предмет выявления гипонатриемии |
| Винкристиновая нейропатия | Токсическое действие винкристина на периферическую нервную систему | |
| Опухоли ЦНС Остеосаркома Герминогенные опухоли | Назначение цисплатина, петлевых диуретиков во время химиотерапии | |
| Нейробластома | Назначение винкристина, циклофосфана | |
| Наличие хронического пиелонефрита, цистита | Необходимость проведения химиотерапии | |
| Нарушение функции тазовых органов | Необходимость проведения химиотерапии | |
| Септические осложнения | Назначение инфузионной и антибактериальной терапии | |
| Болевой синдром Операционная травма | Назначение наркотических анальгетиков | |
| Бактериальные и грибковые инфекции | Назначение инфузионной и антибактериальной терапии, амфотерицина В | |
| Отмена глюкокортикоидов | Электролитные нарушения | |
| Все опухоли | Периоды аплазии кроветворения, фебрильной нейтропении, при завершении лечения винкаалколоидами и глюкокортикоидами |
На основании обобщения клинического опыта выделена группа пациентов высокого риска по развитию синдрома неадекватной секреции антидиуретического гормона, которая представлена в таблице 17. Лечение заключалось в ограничении поступления жидкости, назначении инфузии физиологического раствора натрия хлорида 500 мл/м2/24 часа с дополнительным возмещением текущих потерь жидкости с мочой физиологическим раствором. В случае развития неврологических симптомов (судороги или рвота) назначалась инфузия гипертонических солевых растворов (200 мл 1.5% раствора NaCl в течение 6-8 часов, затем медленнее до нормализации показателей в течение 24-72 часов). Для поддержания диуреза использовался фуросемид в дозе не более 1 мг/кг. В 1 случае спутанности сознания, судорог и развития комы больному проводилась коррекция электролитов в реанимационном отделении при искусственной вентиляции легких.
Проблема анафилактических реакций на цитостатики рассмотрена на примере наиболее анафилактогенного цитостатика – блеомицина гидрохлорида у 28 последовательных пациентов при применении схемы ВЕР. В первый день первого курса химиотерапии какой-либо премедикации перед внутривенным болюсным введением блеомицина не проводилось. Реакции гиперчувствительности на внутривенное введение блеомицина развились у 16 пациентов, что составило 57,1%. Спектр клинических проявлений реакций гиперчувствительности в первый день первого курса химиотерапии ВЕР представлены в таблице 18.
Основными клиническими проявлениями реакций гиперчувствительности немедленного типа был резкий подъем температуры до и выше фебрильных цифр (93,8%), нередко с потрясающим ознобом с появлением инспираторной одышки (75%), тахикардией (87,5%). Снижение артериального давления зарегистрировано у половины пациентов, имевших признаки анафилаксии. Эритема кожных покровов (75%) сопровождалась кожным зудом. Осиплость голоса, появление крапивницы явились минимальными проявлениями среди всех зарегистрированных реакций гиперчувствительности и составило 18,8% и 25% соответственно.
Таблица 18. Клинические проявления реакций гиперчувствительности в первое введение блеомицина (n=16)
| Клинические проявления | Число больных | % |
| Озноб | 15 | 93,8 |
| Резкий подъем температуры тела выше фебрильных цифр | 15 | 93,8 |
| Тахикардия | 14 | 87,5 |
| Инспираторная одышка | 12 | 75 |
| Эритема кожных покровов | 12 | 75 |
| Снижение артериального давления | 8 | 50 |
| Головная боль | 7 | 43,8 |
| Покраснение и отечность лица | 9 | 37,5 |
| Крапивница | 4 | 25 |
| Осиплость голоса | 3 | 18,8 |
Проявления гиперчувствительности у 16 пациентов требовали немедленного лечения: назначения антигистаминных препаратов, всем больным, по меньшей мере, однократно были назначены глюкокортикоиды внутривенно. Все клинические проявления после назначения антигистаминных препаратов претерпевали обратное развитие в течение 20-180 минут. В последующем 16 больным, имевшим анафилаксию во время проведения первого курса химиотерапии ВЕР, проведено от 3 до 5 курсов химиотерапии ВЕР, всего проведено 104 курса аналогичного режима. Перед введением блеомицина в последующие курсы химиотерапии больным обязательно проводилась премедикация, состоящая из внутривенного введения антигистаминных препаратов в возрастных дозировках и глюкокортикоидов непосредственно перед болюсной инфузией блеомицина. В таблице 19 представлены данные по уменьшению частоты анафилактических реакций после проведения премедикаций.
Таким образом, как видно из таблицы 19, использование премедикации перед повторным введением блеомицина у больных с зарегистрированной ранее анафилактической реакции на этот препарат, уменьшил частоту побочных эффектов: лихорадки на 89%, эритемы кожных покровов на 74,1%, приступов удушья на 69,3%, падения артериального давления на 46,2%.
Проведение профилактических мероприятий сделало возможным окончание программного лечения у всех 16 больных (100%), имевших реакцию гиперчувствительности немедленного типа на блеомицин.
Таблица 19. Клинические проявления анафилактических реакций после премедикации при повторных введениях блеомицина (n=104)
| Клинические проявления | Число эпизодов | % | Уменьшение частоты (%) |
| Эритема кожных покровов | 1 | 0.9 | 74,1 |
| Крапивница | 1 | 0.9 | 24,1 |
| Озноб | 13 | 12.5 | 81,3 |
| Резкий подъем температуры тела выше фебрильных цифр | 5 | 4.8 | 89,0 |
| Головная боль | 18 | 17.3 | 25,5 |
| Тахикардия | 21 | 20.2 | 57,3 |
| Снижение артериального давления | 4 | 3.8 | 46,2 |
| Покраснение и отечность лица | 6 | 5.7 | 31,8 |
| Инспираторная одышка | 6 | 5.7 | 69,3 |
| Осиплость голоса | 3 | 2.9 | 15,9 |
Фармакокинетические исследования при применении высоких (сублетальных) доз метотрексата в детской онкологической практике используются рутинно. Проведен ретроспективный анализ концентрации метотрексата в сыворотке крови у больных страдающих опухолями центральной нервной системы, получавшим лечение по протоколу HIT-91, а именно той его части, где проводится терапия высокими дозами метотрексата (5г/м2/24часа). Характеристика пациентов, получавших терапию высокими дозами метотрексата, представлена в таблице 20.
В настоящее исследование включены 63 ребенка с опухолями головного мозга, которым проводилась полихимиотерапия с включением высоких доз метотрексата (5г/м2) в соответствии с протоколом HIT-91, HIT-2000 (Рис.4.). Больным в соответствии с протоколом проведено по 4 курса высокодозного метотрексата. Таким образом, общее число проанализированных курсов химиотерапии составило 252. В связи с высокой опасностью проведения краниального облучения у детей в возрасте до 36 месяцев, последним лучевая терапия не проводилась, а в дни химиотерапии вводился метотрексат в дозе 2 мг интравентрикулярно через резервуар Омайя, либо интратекально (протокол HIT-91 в модификации SKK). Метотрексат вводился в виде внутривенной инфузии в течение 24 часов (1/10 общей дозы – в течение первых 30 минут, остальные 9/10 дозы в течение последующих 23,5 часов).
Во время химиотерапии высокими дозами метотрексата все пациенты имели нормальные гематологические показатели, печеночные пробы (трансаминазы, глютаминтрансферазу, билирубин) и нормальную функцию почек (электролиты, креатинин, мочевина, клиренс по эндогенному креатинину). Инфузии метотрексата предшествовала гиперинфузия с защелачиванием мочи в течение, как минимум, 12 часов. В качестве противорвотного «прикрытия» использовались блокаторы серотониновых рецепторов в стандартных возрастных дозировках. Инфузия метотрексата начиналась и продолжалась при рН мочи более 7,5 и при положительном диурезе. Кальциевая соль фолиевой кислоты (лейковорин) вводилась из расчетов концентраций метотрексата в сыворотке крови. Лейковорин вводился внутривенно струйно в дозе 15 мг/м2 поверхности тела и выше, начиная с 42 часа от начала введения метотрексата каждые 6 часов 6-ти кратно в соответствии с диаграммой соответствия доз лейковорина концентрации метотрексата в сыворотке крови. Клинические проявления токсичности высоких доз метотрексата представлены в таблице 21.
| Операция | |||||||||
| Элемент II | Элемент III/1 | Элемент III/2 | Элемент IV | ||||||
| IFO 3 г/м2 24 часа 1-3 дни MESNA 3 г/м2/сут 1-5 дни VP16 150 мг/м2/1 час 4-6 дни | HD MTX 5г/м2/24 часа LV 15мг/м2 x 6 введений | HD MTX 5г/м2/24 часа LV 15 мг/м2 x 6 введений | CDDP 40 мг/м2/1 час 1- 3 дни ARA-C 400 мг/м2 за 5 час 1-3 дни | ||||||
| Лучевая терапия | |||||||||
| Поддерживающая терапия | |||||||||
| CeeNU75 мг/м2 VCR 1,5 мг/м2 CDDP 70 мг/м2 | VCR 1,5 мг/м2 | VCR 1,5 мг/м2 | x8 | ||||||
Дни 1 8 15 42=1
IFO – ифосфамид, MESNA-уромитексан, VP16 – этопозид, HD MTX – высокие дозы метотрексата, LV- лейковорин, ARA-C – цитозина арабинозид, CeeNU - ломустин, VCR - винкристин, CDDP - цисплатин
Рисунок 4. Дизайн протокола HIT-91
Таблица 20. Характеристика пациентов, которым проведен анализ фармакокинетики высоких доз метотрексата
| Число пациентов | 63 |
| Пол: Муж. Жен. | 28 35 |
| Возраст | 6 мес.- 16 лет |
| Возрастные группы: До 1 года 1-3 года 3-10 лет старше 10 лет | 4 16 31 12 |
| Количество курсов высоких доз метотрексата | 252 |
| Гистологическая структура опухоли: Медуллобастома Супратенториальные примитивные нейроэктодермальные опухоли Анапластическая астроцитома Глиобластома | 29 11 14 9 |
Таблица 21. Клинические проявления токсичности высоких доз метотрексата в 252 курсах химиотерапии
| Степень 0 | Степень 1 | Степень 2 | Степень3 | Степень4 | ||||||
| Абс.ч | % | Абс.ч | % | Абс.ч | % | Абс.ч | % | Абс.ч | % | |
| Анемия | 239 | 94,8 | 4 | 1,6 | 6 | 2,38 | 1 | 0,4 | 0 | 0 |
| Тромбоцитопения | 221 | 87,7 | 12 | 4,8 | 11 | 4,4 | 8 | 3,2 | 0 | 0 |
| Нейтропения | 207 | 82,1 | 26 | 10,3 | 18 | 7,1 | 1 | 0,4 | 0 | 0 |
| Рвота | 218 | 86,5 | 16 | 6,3 | 18 | 7,1 | 0 | 0 | 0 | 0 |
| Анорексия | 206 | 81,7 | 34 | 13,4 | 12 | 4,8 | 0 | 0 | 0 | 0 |
| Гингивит | 169 | 67,0 | 39 | 15,5 | 32 | 12,7 | 12 | 4,8 | 0 | 0 |
| Глоссит | 173 | 68,6 | 36 | 14,3 | 38 | 15,1 | 4 | 1,6 | 1 | 0,4 |
| Стоматит | 175 | 69,4 | 31 | 12,3 | 34 | 13,5 | 12 | 4,8 | 0 | 0 |
| Диарея | 226 | 89,7 | 11 | 4,4 | 14 | 5,6 | 1 | 0,4 | 0 | 0 |
| Печеночная токсичность | 247 | 98,0 | 2 | 0,8 | 3 | 1,2 | 0 | 0 | 0 | 0 |
| Кожная токсичность | 190 | 75,3 | 34 | 13,5 | 26 | 10,3 | 2 | 0,8 | 0 | 0 |
Фармакокинетические исследования инфузии высокодозного метотрексата проведены как часть клинического протокола. Шестьдесят три пациента с опухолями головного мозга были разделены на 4 возрастные группы: дети до 1 года (n=4), 1-3 года (n=16), 3-10 лет (n=31) и старше 10 лет (n=12). Исследования концентрации метотрексата в сыворотке крови проводили на 24, 42, 48 и 72 часе от начала инфузии метотрексата. Всего проанализировано 252 инфузии высоких доз метотрексата. Образцы крови центрифугировали и проводили иммуноферментное исследование концентрации метотрексата (TDX, Abbot laboratories) минимальный лимит чувствительности – 0,1 ммоль/л. Клиренс метотрексата (Clp, 1/час/м2 или 1/час/кг) рассчитывался исходя из внутривенно введенного (458,9ммоль/м2/час), деленный на стационарную концентрацию метотрексата, измеренную на 24-й час от начала инфузии. В связи с тем, что разовая доза метотрексата рассчитывалась исходя из г/м2 поверхности тела и могла быть значительно выше у пациентов младшего возраста, показатели клиренса были выражены как в расчете на квадратные метры поверхности тела, так и на килограмм массы тела. Фармакокинетические параметры высоких доз метотрексата у детей разного возраста суммированы в таблице 22.
Как видно из таблицы 21, выраженность токсических проявлений высоких доз метотрексата 5г/м2/24 час была минимальной и ограничивалась, в основном 1-2 степенью. Наиболее частыми проявлениями были мукозиты полости рта (25,8%), нейтропения (17,4%) и тромбоцитопения (9,2%). Эти осложнения требовали симптоматического лечения и не приводили к исключению высокодозного метотрексата из программы лечения. Очередной курс химиотерапии был отложен на 2-5 дней только в 12 (4,8%) случаях.
Таблица 22. Фармакокинетические параметры высокодозного метотрексата (5г/м2 24- часовая инфузия) у детей различного возраста
| 0-1 год (4) | 1-3 года (16) | 3-10 лет (31) | 10-16 лет (12) | |||||
| Значения + S.D. | медиана | Значения + S.D. | медиана | Значения + S.D. | медиана | Значения + S.D. | Медиана | |
| C[MTX] 24ч | 57,8+42,1* | 39,5 | 57,9+28,2** | 51,8 | 57,7+30,4** | 50 | 102,5+68,1 | 73 |
| Cl (1/ч/м 2) | 10,7+5** | 11,6 | 9,6+4,3* | 8,8 | 9,5+3,8* | 9,1 | 6,6+3,8 | 6,3 |
| Cl (1/кг) | 0,61+0,29** | 0,71 | 0,45+0,2** | 0,43 | 0,39+0,16* | 0,4 | 0,25+0,12 | 0,19 |
*- Р<0,05; ** - P<0,01 vs. группы 10-14 лет (тест Дункана)
В каждой возрастной группе рассчитан средний и медианный показатели концентрации стационарного метотрексата в сыворотке крови, т.е. исследованный на 24-й час от начала инфузии препарата (C[MTX] 24ч), системные клиренсы метотрексата из расчета на квадратный метр поверхности тела [Cl (1/ч/ м2)] и килограмм массы тела [Cl (1/ч/кг)].
При анализе данных (таблица 22) получено, что в старшей возрастной группе в сравнении с пациентами других групп концентрация метотрексата C[MTX] 24ч достигала наивысших значений (102,5 ммоль/л). Более того, обнаружено, что клиренс метотрексата становился ниже с увеличением возраста. Системный клиренс метотрексата у детей различного возраста во время последовательных курсов химиотерапии представлен в таблице 23.
Таблица 23. Значения клиренса (1/час) высоких доз метотрексата у детей различного возраста во время четырех последовательных курсов химиотерапии
| курс | 0-1 год (4) | 1-3 года (16) | 3-10 лет (31) | 10-16 лет (12) | |||||
| Значения + S.D. | медиана | Значения + S.D. | медиана | Значения + S.D. | медиана | Значения + S.D. | Медиана | ||
| 1 | Cl /м2 | 10,7+ 5** | 11,6 | 9,6+4,3** | 8,8 | 9,5+ 3,8* | 9,1 | 6,6 +3,8 | 6,3 |
| Cl /кг | 0,61+0,29** | 0,71 | 0,45+0,2** | 0,43 | 0,39+0,16* | 0,04 | 0,25+0,12 | 0,19 | |
| 2 | Cl /м2 | 10,6+5,2* | 8,4 | 12,5+,6** | 10,4 | 10,2+5,06* | 9 | 8,8+4,2 | 6,4 |
| Cl /кг | 0,58+0,26** | 0,55 | 0,6+ 0,2** | 0,5 | 0,41+0,21** | 0,36 | 0,2+0,15 | 0,2 | |
| 3 | Cl /м2 | 10,3+3,9* | 12,4 | 13,04+7,3* | 10,8 | 12+ 6,5** | 10,5 | 7 +4 | 5,8 |
| Cl /кг | 0,57+0,23** | 0,66 | 0,59+ 0,3** | 0,5 | 0,5+0,3* | 0,45 | 0,2+0,13 | 0,2 | |
| 4 | Cl /м2 | 11,9+4,5 ** | 10,5 | 13,6+ 6,3** | 11,6 | 10,5+ 4,6** | 10,2 | 6,6+2,9 | 6,3 |
| Cl /кг | 0,6+0,3** | 0,5 | 0,62+ 0,3** | 0,5 | 0,4+0,2** | 0,4 | 0,21+0,1 | 0,2 | |
*- P<0,05; ** - P<0/01 vs.группы 10-14 лет (Тест Дункан)
Общий клиренс выражали в двух видах: из расчета на квадратный метр поверхности тела и на килограмм массы тела. При анализе полученных данных выявлено, что наименьший клиренс метотрексата был выявлен у пациентов старше 10 лет (0,2 vs. 0,61 1/ч/кг или 6,6 vs.10,7 1/ч/м2). Вариантный анализ выявил статистически достоверное снижение клиренса в старшей возрастной группе на 1/3 в сравнении с другими группами (P<0,01). Проведенный анализ фармакокинетики высоких доз метотрексата у детей различных возрастных групп показал, что клиренс метотрексата в сыворотке снижается у детей в возрасте старше 10 лет в сравнении с детьми более раннего возраста: клиренс 10,7 1/час/ м2 у грудных детей прогрессивно снижается у более старших пациентов, достигая 6,6 1/час/ м2 у подростков.
В работе проанализирована эффективность трансфузионной терапии компонентами крови. Подвергнуты анализу у 146 последовательных пациентов в возрасте от 5 месяцев до 16 лет (медиана 5,4 года), которым было проведено 224 трансфузии эритромассы с целью коррекции анемии, индуцированной цитостатической терапией. Одновременно проведен анализ 157 трансфузий отмытых эритроцитов у 32 пациентов в возрасте от 8 месяцев до 17 лет. Расчет доз количества эритроцитарной массы или отмытых эритроцитов составлял 5-10 мл/кг. При трансфузиях отмытых эритроцитов в сравнении с трансфузией эритроцитарной массы (табл. 24) отмечено значительное снижение фебрильных негемолитических трансфузионных реакций (2,5% против 14,2%), аллергических реакций (1,9% против 8,1%) и аллоиммунизации (0% против 0,45%). Это констатирует факт более высокой безопасности трансфузий отмытых эритроцитов в сравнении с эритроцитарной массой. Случаи развития температурных неспецифических реакций и иммунных реакций негемолитического типа были минимальными в группе трансфузий отмытыми эритроцитами и сократились в 4-5 раз в сравнении с первой изучаемой группой и связаны, видимо, с бактериальной контаминацией трансфузируемой среды.
Таблица 24. Трансфузионные реакции на эритроцитарную массу и отмытые эритроциты
| Трансфузионные реакции | Трансфузия эритроцитарной массы (n=224) | Трансфузия отмытых эритроцитов (n=157) | ||
| Абс.ч. | % | Абс.ч. | % | |
| Гемолитическая трансфузионная реакция | 0 | 0 | 0 | 0 |
| Фебрильная негемолитическая трансфузионная реакция | 32 | 14,2 | 4 | 2,5 |
| Аллергическая реакция | 18 | 8,1 | 3 | 1,9 |
| Аллоиммунизация | 1 | 0,45 | 0 | 0 |
Проблема трансфузий концентрата тромбоцитов (ТКТ) в период цитостатически индуцированной тромбоцитопении остается актуальной. В исследование вошли 86 пациентов в возрасте от 1 до 16 лет, страдающих солидными опухолями и получающих цикловую полихимиотерапию. Проанализировано 368 миелотоксичных блоков химиотерапии с включением стандартных доз винкристина, циклофосфамида, ифосфамида, доксорубицина, актиномицина Д, цисплатина, карбоплатина, блеомицина, высоких доз метотрексата, высоких доз цитарабина. В 314 случаях (85,3%) зарегистрирована тромбоцитопения менее 75х109/мкл, развившаяся на 7-23 дни от начала блока химиотерапии. В 37 случаях (11,8%) тромбоцитопения составила менее 10 х 109/л. Геморрагический синдром зарегистрирован в 8 (21,6%) случаях, бессимптомная тромбоцитопения – в 29 (78,4%) случаях. Профилактику кровотечений проводили в соответствии с рекомендациями Gmur et al, 1991. Трансфузии концентрата тромбоцитов проводились в 36 эпизодах тромбоцитопении, как с профилактической, так и с лечебной целью. Пациентам проведено 114 ТКТ (от 1 до 6 трансфузий, в среднем 2,7). ТКТ проводились из расчета 1 доза (0,5-0,75 х 1011 тромбоцитов) на 10 кг массы тела больного или 4 дозы на 1 м2 поверхности тела больного. Критериями эффективности трансфузионной терапии служили: клинические признаки остановки кровотечения, уменьшение геморрагических проявлений, увеличения числа тромбоцитов, исследованных через 24 часа после трансфузии.
В резистентных к трансфузиям случаях использовался показатель скорректированного прироста числа тромбоцитов (СПЧТ), рассчитываемый по формуле:
Абсолютный прирост числа тромбоцитов Х площадь поверхности тела (м2)
N доз тромбоцитов х 0,6х1011
Отрицательные значения СПЧТ в нашем наблюдении не встречалась. Таким образом, рефрактерность не была связана с аллоиммунизацией. Относительная рефрактерность к трансфузиям тромбоцитов наблюдалась в 4 случаях тромбоцитопении (3,5%) и была обусловлена наличием у пациента сепсиса (3 наблюдения) и дыхательным дистрес-синдромом, развившимся на фоне легочного пневмоцистоза (1 случай). При ТКТ в 18 случаях (15,8%) отмечены побочные реакции. В 16 случаях (14,0%) отмечалась фебрильная реакция – подъем температуры тела до фебрильных цифр во время трансфузии или непосредственно после нее, в 2 случаях (1,75%)– появление уртикарной сыпи, купируемой введением антигистаминных препаратов. Анафилактического шока не было зарегистрировано ни разу.
Лабораторные признаки эффективности заместительной терапии переливания тромбоцитарного концентрата заключались в увеличении количества циркулирующих тромбоцитов в русле крови реципиента через час после трансфузии (при эффективном переливании их число достигает 50 - 60 х 109/л).
Особенностью ведения больных с синдромом компрессии органов переднего средостения интраторакально расположенной опухолью в практике детского онколога является необходимость морфологической верификации диагноза в виду различных подходов в программном лечении больных при различных нозологических формах опухоли. В наблюдаемой нами группе больных было проанализировано 11 пациентов с изолированными опухолями переднего средостения и гемиторакса в возрасте от 9 месяцев до 16 лет (медиана 4,3 года).
Клинические симптомы включали: выраженную дыхательную недостаточность, боль в груди, стридорозный кашель, ортопноэ, развитие коллатеральных вен на грудной стенке, отечность лица, сопор, снижение насыщения кислородом капиллярной крови. Клинические симптомы синдрома компрессии верхней полой вены представлены в таблице 25. Тяжесть состояния больных определялась выраженной дыхательной и сердечной недостаточностью, требовавшая проведение вспомогательной искусственной вентиляции легких у 6 (54,5%) больных.
Таблица 25. Клинические проявления синдрома компрессии верхней полой вены
у 11 детей
| Клинические симптомы | Число пациентов | % |
| Отечность или пастозность лица | 11 | 100 |
| Покраснение или цианоз лица, шеи и верхних конечностей | 9 | 81,8 |
| Инъецированность конъюнктив | 9 | 81,8 |
| Развитие коллатеральных вен на передней грудной стенке | 8 | 72,7 |
| Сопор | 4 | 36,4 |
| Сухой, навязчивый кашель | 11 | 100 |
| Осиплость голоса | 9 | 81,8 |
| Одышка в покое и при минимальной физической нагрузке | 10 | 9,1 |
| Положение ортопноэ | 10 | 9,1 |
| Стридорозное дыхание | 9 | 81,8 |
| Снижение сатурации кислорода в капиллярной крови | 4 | 36,4 |
| Боль в груди | 7 | 63,6 |
Лечебно-диагностические мероприятия проводились в реанимационном отделении. В связи с возможностью наличия у больных герминогенной опухоли средостения исследовался уровень альфа-фетопротеина. При этом у 2 пациентов выявлено значительное повышение этого показателя (785600 МЕ/мл и 1243610 МЕ/мл), что подтверждало диагноз герминогенной опухоли средостения. Оба ребенка были в возрасте до 3 лет и морфологическая верификация диагноза в данном случае не требовалась. В обоих случаях назначалась соответствующая химиотерапия по программе ВЕР с уменьшением компрессии в первые дни химиотерапии (рис.5). В связи с высоким риском общего обезболивания у больных во время диагностической торакотомии 9 пациентам (81,8%), уровень альфа-фетопротеина которых соответствовал нормальным значениям, с целью устранения компрессии назначался преднизолон 20-40 мг/м2 и циклофосфан по 200 мг/м2 №1-3.
На 2-5 сутки у 7 больных достигнута регрессия опухоли и уменьшение признаков дыхательной недостаточности, после чего проводилось хирургическое вмешательство в виде диагностической торакотомии. В 2 случаях эффекта от циторедуктивной химиотерапии не наступило и проведение диагностической торакотомии осуществлялось на фоне продолжающейся искусственной вентиляции легких. Программная химиотерапия была назначена в первые сутки после получения предварительного морфологического заключения, послеоперационная летальность составила 0%. Результаты морфологических исследований представлены в таблице 26.
АФП- альфа-фетопротеин, ХТ ВЕР- режим химиотерапии (блеомицин, этопозид, цисплатин)
Рисунок 5. Алгоритм междисциплинарного взаимодействия, диагностических и лечебных мероприятий при синдроме компрессии органов средостения
Таблица 26. Морфологические варианты опухоли переднего средостения и гемиторакса
| Морфологический диагноз | Число больных | % |
| Болезнь Ходжкина | 2 | 18,8 |
| Крупноклеточная анапластическая лимфома | 3 | 27,2 |
| Неходжкинская лимфобластная Т-клеточная лимфома | 2 | 18,8 |
| Тератобластома | 2 | 18,8 |
| Периферическая примитивная нейроэктодермальная опухоль | 1 | 9,1 |
| Воспалительная псевдоопухоль средостения | 1 | 9,1 |
| Всего | 11 | 100 |
Общепринятая практика ведения пациентов с фебрильной нейтропенией, индуцированной цитостатическим лечением, включает проведение рентгенографии органов грудной полости в первые часы развития этого осложнения. Нами сделано предположение, о том, что патогенетически у пациентов в индуцированной нейтропении типичной рентгенологической картины пневмонии не будет, а выраженные изменения в легких будут зафиксированы только при повышении уровня лейкоцитов как в периферической крови, так и в легочном инфильтрате. В связи с этим мы проанализировали 145 эпизодов лихорадки, развившихся на фоне нейтропении у 72 пациентов, которым в ходе обследования проводилась рентгенография органов грудной полости с целью исключения пневмонии как причины повышения температуры тела и ухудшения состояния. Рентгенографию органов грудной полости проводили в первые сутки лихорадки, при показаниях – повторно. Всего было проведено 176 исследований. В соответствии с критериями ВОЗ нейтропенией считалось снижение общего числа гранулоцитов в периферической крови менее 0,5 х 109/л.
Под термином «лихорадка» подразумевалось повышение температуры тела свыше 37,5оС в течение 2 часов или выше 38оС однократно. Пациенты страдали солидными опухолями, их возраст варьировал от 6 месяцев до 17 лет, в среднем 8,2 года. Все пациенты в качестве профилактики пневмоцистной пневмонии получали перорально бисептол из расчета 5 мг/кг массы тела в сутки (по триметоприму), при снижении общего числа лейкоцитов ниже 2.0 х 109/л бисептол назначали одновременно с ципрофлоксацином в дозе 10 мг/кг/сутки в качестве деконтаминации желудочно-кишечного тракта. В качестве противогрибкового деконтаминтанта применяли флюконазол в дозе 6 мг/кг/сутки. В понятие эмпирической антибактериальной терапии входило назначение двух антибиотиков широкого спектра действия при первых признаках инфекционно-септических осложнений до получения данных более детального обследования.
В таблице 27 представлена клинико-рентгенологическая характеристика пациентов в первые часы возникновения лихорадки, из которой видно, что в 7 из 145 случаев (4,8%) лихорадки в первые 24 часа у пациентов с нейтропенией действительно были документированы рентгенологические изменения в легких, которые были расценены как нижнедолевая пневмония (2 случая) или прогрессирование основного заболевания (опухолевый плеврит, метастатическое поражение легких) в 5 случаях. При этом важно отметить, что во всех случаях отмечались те или иные признаки синдрома дыхательных расстройств (тахипноэ, акроцианоз, кашель, болевой синдром, хрипы в легких, ослабление дыхания, снижение насыщения периферической крови кислородом), либо расстройства гемодинамики.
Таблица 27. Клинико-рентгенологическая характеристика пациентов в первые часы возникновения лихорадки
| Характеристика больных | Без признаков дыхательной недостаточности (n=138) | Наличие дыхательной недостаточности (n=7) | Всего (n=145) |
| С рентгенологическими изменениями | 0 | 7 | 7 (4,8%) |
| Без рентгенологических изменений | 138 | 0 | 138 (95,2%) |
Таким образом, информативность рентгенографии, выполненной в первые часы возникновения лихорадки, составила 4,8%. В 23 случаях (15,8%) сохраняющейся на фоне антибактериальной терапии лихорадки с нейтропенией рентгенологическое исследование проводилось повторно в динамике с интервалом 3-8 дней. При этом у 5 пациентов были зафиксированы изменения в легких на «выходе» из аплазии кроветворения при числе гранулоцитов периферической крови более 1,0 х 109/л (табл. 28). На рентгенограммах были выявлены скиаскопические признаки интерстициальной пневмонии (диффузные изменения в легких по типу «снежной бури», сгущение интерстициального компонента легочного рисунка), в 2 случаях – инфильтративные изменения в нижней доле легкого в сочетании с плевритом, в одном – подозрение на аспергилему легкого. Следует отметить, что клинических признаков дыхательной недостаточности у больной с подозрением на аспрегилему не отмечалось.
Руководствуясь результатами проведенного анализа, можно заключить, что рентгенография органов грудной полости, как обязательный метод обследования у всех лихорадящих больных, находящихся в индуцированной аплазии кроветворения в первые часы возникновения лихорадки без наличия синдрома дыхательных расстройств, является, по меньшей мере, нецелесообразной. При наличии признаков дыхательной недостаточности в первые часы развития фебрильной нейтропении, наоборот, действительно требует рентгенографии органов грудной полости.
Таблица 28. Клинико-рентгенологическая характеристика пациентов при повторной рентгенографии органов грудной полости
| Характеристика больных | Без признаков дыхательной недостаточности (n=17) | Наличие синдрома дыхательных расстройств (n=6) | Всего (n=23) |
| С рентгенологическими изменениями | 1 (5,9%) | 4 (66,7%) | 5 (21,7%) |
| Без рентгенологических изменений | 16 (94,1%) | 2 (33,3%) | 18 (78,3%) |
Показанием к проведению этого исследования на фоне фебрильной нейтропении служит наличие клинических признаков дыхательного дистресс-синдрома (одышка, кашель, акроцианоз, аускультативное ослабление дыхания, гипоксемия и др.) и/или расстройства гемодинамики.
Наряду с выраженными соматическими проблемами, у заболевшего раком ребенка или подростка всегда наблюдаются психологическая дезадаптация, тревога, страх, ужас и другие негативные эмоции. Это значит, что результаты высокотехнологичного лечения определяются не только тяжестью основного заболевания, проводимой химиотерапией, но и психологическим состоянием ребенка, а также членов его семьи. Большинство пациентов детских онкологических отделений нуждаются в психологической поддержке, однако действующими штатными нормативами психологическая помощь в таких отделениях не предусмотрена. Заболевшие дети и подростки с трудом справляются с психологической нагрузкой, не всегда в состоянии выработать необходимые конструктивные средства психологической адаптации к своей болезни, ходу лечения, тяжести побочных эффектов и прогнозу заболевания. Целью психологической поддержки в детской онкологической клинике является создание условий для наилучшей адаптации пациента и его родственников в период лечения, а в идеале - и на более продолжительное время. После выздоровления у ребенка возникают серьезные трудности с интеграцией в школьный коллектив, подростковое сообщество. Это объясняется имеющимися остаточными последствиями пережитых стрессов, депрессивным состоянием, страхом перед возвращением к «нормальной» жизни. В детской онкологической клинике перед врачом, медицинским коллективом, психологом ставится цель создания условий для наилучшей психологической адаптации пациента и его родителей в период лечения. Задача состоит в возможности формирования оптимальной мотивации сопротивлению болезни и сотрудничества с врачами. Такого рода психо-эмоциональные состояния (психологическая дезадаптация, выражающаяся в наличии повышенного уровня тревожности, депрессивного синдрома, заниженной самооценки, нарушения круга межличностного общения) могут быть основой для низкой социальной адаптации детей и подростков после выздоровления и возвращения в коллектив сверстников.
Подход к решению психологических задач определяется индивидуальными личностными особенностями ребенка, а методы, применяемые в работе, могут отличаться разнообразием, что требует от психолога владением самыми разносторонними методиками. В работе использованы проективные методики (метод построения «социального атома», «рисунка семьи», «рисуночного изображения болезни»), представляющие собой неструктурированную задачу для испытуемого, не вызывая защитные реакции, и помогая налаживанию контакта с пациентом.
ЗАКЛЮЧЕНИЕ
В данной работе представлен ретроспективный анализ профилактики и лечения осложнений химиотерапии пациентов, страдающих солидными опухолями, на протяжении последних 15 лет. Исторически выделено две группы больных – до 1997 г. (86 детей) и после 1997 (232 ребенка). Начиная с 1997 г., в силу благоприятных возможностей, связанных с появившейся доступностью методологий сопроводительного лечения и лекарственных препаратов для его проведения, появился шанс обеспечить детей не только цитостатическим лечением, но и комплексом мер, направленных на профилактику и лечение осложнений. Осложнения химиотерапии были выделены в самостоятельные синдромы и продемонстрированы на наиболее токсичных режимах агрессивной полихимиотерапии, применяющейся в настоящее время при солидных опухолях.
Одной из задач в работе было изучение эффективности противорвотной терапии при высокоэметогенных режимах, применяемых при лечении сарком мягких тканей и саркомы Юинга. Исследовано три группы пациентов химиотерапии – получающие в качестве противорвотного прикрытия только дексаметазон, только гранисетрон и комбинацию «дексаметазон+гранисетрон». Противорвотное лечение было успешным (полный и удовлетворительный эффект) в 89 курсах химиотерапии (81,6%) первой группы, в 113 (82,5%) курсах химиотерапии группы и в 158 (97,0%) курсах третьей группы при одновременном назначении гранисетрона и дексаметазона (P<0.001).
Антрациклиновая кардиотоксичность в виде дилятационной кардиомиопатии развилась у 2,8% пациентов, причем лишь у тех из них, у которых был превышен порог кумулятивной дозы доксорубицина, составляющий 300 мг/м2. Полученные данные свидетельствуют о необходимости использовать другие антрациклиновые антибиотики с менее выраженным кардиотоксическим эффектом. Для выявления более поздней кардиотоксичности необходимо проведение углубленного кардиологического катамнеза за пациентами, излеченными от злокачественных новообразований. Как показано в исследовании, проведение лучевой терапии на область грудной полости, применение совместно с доксорубицином алкилирующих препаратов (циклофосфамида и ифосфамида) способствовали развитию антрациклиновой кардиомиопатии при преодолении порога кумулятивной дозы. Проведенный анализ применения эпирубицина в программной химиотерапии показал его преимущества перед доксорубицином в плане развития кардиотоксичности: кумулятивные дозы эпирубицина 450-600 мг/м2 не привели к развитию антрациклиновой кардиомиопатии.
Одним из путей профилактики развития легочной токсичности блеомицина является минимизация общей кумулятивной дозы препарата. Суммарная доза препарата не должна превышать 200 мг/м2. Проведение лучевой терапии на область легочных полей, средостения недопустимо способствовало развитию интерстициального пульмонита с исходом в легочный фиброз. Легочная токсичность после использования блеомицина развилась у 6,9% при превышении дозы препарата 200 мг/м2.
Синдром неадекватной секреции антидиуретического гормона представляет собой ургентную ситуацию в практике детского онколога, связанную с цитостатическим лечением, которая может развиться как во время полихимиотерапии с применением винкристина, цисплатина, циклофосфамида, так и в период септических осложнений и привести к смертельному исходу. Частота этого осложнения, выявляемая по мониторингу электролитов в сыворотке крови, при проведении стандартной химиотерапии достигала 6,9% случаев. Эффективным методом профилактики этого синдрома явилась ежедневная оценка клинического состояния во время проведения химиотерапии, в ранний цитостатический период, а также исследование электролитов сыворотки крови на предмет выявления гипонатриемии.
Высокие дозы метотрексата (5 г/м2) удовлетворительно переносились детьми грудного возраста (от 6 до 12 мес.), толерантность к метотрексату была выше, чем у детей более старшего возраста, без выраженной токсичности или отсроченной метотрексатовой экскреции. Эти данные позволяют обсуждать интенсификацию химиотерапии высокими дозами метотрексата у детей раннего возраста, которые из-за биологических особенностей опухолей имеют наихудший прогноз. Важно при этом, что риск увеличения токсичности лечения, по-видимому, будет минимален. Ускоренная элиминация метотрексата у детей раннего возраста явилась ключом к пониманию безопасности применения более высоких доз препарата.
Для профилактики реакций гиперчувствительности на введение блеомицина проводилась гипосибилизирующая премедикация, состоящая из антипиретиков, глюкокортикоидов и антигистаминных препаратов. В нашем исследовании проведение подобных мероприятий снизило частоту реакций гиперчувствительности на 50-85%. Что не требовало отмены блеомицина в последующие курсы химиотерапии.
В исследовании показано абсолютное преимущество трансфузий отмытых эритроцитов перед эритроцитарной массой по эффективности и числу осложнений. Глубокая тромбоцитопения (менее 10 х 109/л) требовала заместительной ТКТ. Умеренная тромбоцитопения (менее 25 х 109/л), сопровождающаяся геморрагическим синдромом, сепсисом, нарушением мозгового кровообращения также требовала немедленной заместительной ТКТ. Расчет количества доз проводили исходя из массы или площади поверхности тела пациента. Клиническими критериями эффективности переливания тромбоцитарного концентрата явились прекращение спонтанной кровоточивости и отсутствие свежих геморрагий на коже и видимых слизистых. Клинически наблюдаемый гемостаз являлся важнейшим критерием эффективности и адекватности дозы перелитых донорских тромбоцитов, хотя при этом зачастую не происходило рассчитанного и ожидаемого увеличения количества тромбоцитов в циркуляции. Среди реакций на ТКТ следует, прежде всего, отметить фебрильные реакции, в анализируемом клиническом материале они встречались в 14% трансфузий.
Описанная тактика предоперационной подготовки пациентов при синдроме компрессии верхней полой вены интраторакально расположенной опухолью позволила: обеспечить высокий показатель выживаемости у данной категории больных, ранее считавшихся инкурабельными, провести отсроченную диагностическую торакотомию с биопсией опухоли и правильно верифицировать морфологический диагноз. Данный методологический подход позволил однозначно определиться с морфологическим диагнозом и включить пациента в соответствующую лечебную программу.
В нашем исследовании установлено, что рентгенологические изменения в органах грудной полости в первые сутки развития фебрильной нейтропении выявлялись лишь у больных, имеющих синдром дыхательных расстройств. С учетом патофизиологического механизма формирования воспалительных инфильтратов и гранулем во внутренних органах сделано заключение о том, что проведение рентгенографии органов грудной полости наиболее информативно на этапе «выхода» из аплазии кроветворения. Также целесообразно проведение рентгенографических исследований пациентам с длительной лихорадкой, резистентной к эмпирической антибактериальной терапии.
Для анализа эффективности мер сопроводительного лечения во время программной полихимиотерапии у детей, страдающих солидными опухолями, были построены кривые дожития по Каплан-Мейер (см.рис.6).
Из когорты изученных пациентов (318 чел.) были выделены 2 группы. Так, общая выживаемость 232 больных, получивших адекватное и своевременное сопроводительное лечение, составила 82,9%, тогда как 86 пациентов, которым сопроводительное лечение проводилось бессистемно, имели более низкий показатель - 28,3%. (рис.5). Несмотря на то, что объем сопроводительного лечения при химиотерапии не относится к общепринятым факторам прогноза, таким как нозологическая форма, гистологический вариант, стадия заболевания, возраст пациента и пр., рассмотрение данного аспекта представляется интересным с точки зрения правильности научного поиска.
 1– адекватная сопроводительная терапия N = 232 (82,18% + 0,4)
1– адекватная сопроводительная терапия N = 232 (82,18% + 0,4)
2– неадекватная сопроводительная терапия (до 1997г) N = 86 (28,31% + 0,4) р = 0,0001
Рисунок 6. Общая выживаемость детей в зависимости от адекватности проведения сопроводительного лечения
Как и следовало ожидать, различия между двумя кривыми возникают в первые 6-12 месяцев лечения, т.е. приходятся на этап программного лечения. Показатель выживаемости продолжает снижаться и по истечении 12 месяцев – эти события можно отнести к смерти от прогрессирования заболевания, связанной с несколькими причинами. Среди них можно предположить недостаточность, и даже ущербность первичного лечения (увеличение интервалов между курсами химиотерапии, уменьшение их количества, вынужденное снижение курсовых доз цитостатиков, недостаточный патоморфоз опухоли после предоперационной химиотерапии и пр.). Все эти аспекты должны послужить поводом для научного анализа в последующем. Тем не менее, как видно из рисунка 5, несистематизированный фактор прогноза - адекватность проведения сопроводительного лечения - значительно влиял на различия в показателях общей выживаемости больных, что демонстрирует оценку важности проделанной работы.
Систематизированные данные научно-обоснованного поэтапного плана профилактики и лечения осложнений химиотерапии солидных опухолей у детей приведены в таблице 29.
Таблица 29. Этапы профилактики и лечения осложнений цитостатической терапии в педиатрической практике
| Наименование этапа | Воздействующие факторы | Потенциальный токсический (побочный) эффект | Скрининг и рекомендации |
| Профилактика тошноты и рвоты | Высоко-, средне- и низкоэметогенные цитостатические препараты, лучевая терапия | Острая и отсроченная тошнота и рвота | Назначение антиэметиков (блокаторов серотониновых рецепторов) с/без глюкокортикоидов |
| Профилактика кардиотоксичности | Лечение антрациклиновыми антибиотиками | Развитие антрациклиновой кардиомиопатии (острой и поздней) | Мониторинг ЭКГ, ЭхоКГ до начала химиотерапии и в процессе ее, применение менее кардиотоксичных препаратов |
| Профилактика и лечение нефро- и уротоксичности | Химиотерапия препаратами платины, алклирующими препаратами (ифосфамид, циклофосфамид) | Тубулярный некроз проксимальных и дистальных канальцев. Развитие острой почечной недостаточности | Назначение гиперинузии с потенцированием диуреза осмотическими диуретиками. Избегать назначения петлевых диуретиков и нефротоксичных антибиотиков |
| Профилактика нейротоксичности | Химиотерапия винкаалколоидами, препаратами платины | Развитие периферической (двигательной, чувствительной) нейропатии, паретической кишечной непроходимости, ототоксичности | Проведение инфузионной терапии. Избегать назначения петлевых диуретиков и нефротоксичных антибиотиков при лечении цисплатином |
| Развитие мукозита | Химиотерапия | Развитие стоматита, эзофагита, гастрита, энтерита, парапроктита, вплоть до язвенно-некротических поражений | Посиндромное лечение |
| Нейтропения | Любая химиотерапия | Развитие инфекционных осложнений (бактриальных, вирусных, грибковых) | Назначение гранулоциатрных колониестимулирующих факторов как с лечеб-ной, так и с профилакти-ческой целью. |
| Анемия, индуцированная химиотерапией | Химиотерапия | Развитие нормо- или ги-похромной анемии, уси-ление прочих видов ток-сичности химиотерапии | Профилактика – назна-чение эритропоэтина. Лечение–трансфузия отмытых эритроцитов |
| Нарушение гемостаза | Химиотерапия L-аспарагиназа | Развитие тромбоцитопении, индуцированной цитостатическим лечением Истощение факторов свертывания крови | Трансфузия тромбоконцентрата Использование факторов свертывания крови |
| Развитие пульмонита | Блеомицин, лучевая терапия. Препараты нитрозометилмочевины | Развитие пульмонита, отека легких, легочного фиброза | Знание особенностей назначения блеомицина. При развитии осложнений – глюкокортикоиды |
| Анафилактические реакции | Блеомицин, карбоплатин | Развитие удушья, стридора, гиперемии лица, нарушение гемодинамики | Посиндромное лечение. Последующие введения препаратов – после антигистаминной премедикации |
| Лечение высокими дозами метотрексата | Кристаллообразование меторексата в тубулярной системе почек | Эритема и некроз кожи, развитие мукозита, апла-зия кроветворения, по-чечная недостаточность | Назначение гиперинфузии. Введение лейковорина |
| Инфекционные осложнения | Любая химиотерапия | Фебрильная нейтропения. Сепсис (бактериальный, грибковый), Вирусные инфекции (в т.ч. герпетические, цито-мегаловирусная и пр.) | Антибактериальная, противовирусная, противогрибковая терапия. В периоде аплазии - назначение гранулоциатрных колониестимулирующих факторов |
| Синдром неадекватной секреции АДГ | Химиотерапия и ее септические осложнения | Развитие спутанности сознания, комы, отека мозга | Мониторинг концентрации натрия в сыворотке крови, посиндромное лечение |
| Синдром компрессии верхнего средостения | Опухоль переднего средостения | Развитие легочно-сердечной недостаточности | См. соответствующий раздел |
| Психологическая дезадаптация | Психотравмирующие факторы: Общее представление об онкологических заболеваниях, существующее в нашем социуме, неизбежно оказывающее влияние на заболевшего подростка; Необходимость длительного лечения; Продолжительный отрыв от дома и школы; Изменение привычного круга общения, внешкольных занятий; Длительные и болезненные процедуры; Осложнения химиотерапии (изнуряющая тошнота и рвота, диарея, лихорадка, септические осложнения) Калечащее лечение (химиотерапия, операции) | Психологическое консультирование пациентов, родителей, персонала | |
Заложенные в работе предпосылки в создании системы методов и средств проведения высокотехнологичной медицинской помощи – совершенствования химиотерапии злокачественных новообразований у детей – являются обобщением основных клинических синдромов, с которыми приходится сталкиваться в повседневной работе онкологам и педиатрам, когда им надлежит оказывать помощь больным злокачественными новообразованиями. Профилактика и лечение осложнений цитостатического лечения отдельных неопухолевых заболеваний у детей (ювенильный ревматоидный артрит, гломерулонефрит и пр.) должны проводиться аналогично таковым при злокачественных новообразованиях. Цитостатическое лечение пациентам с неонкологическими заболеваниями должно проводиться педиатром, имеющим опыт проведения такого лечения и знающим основы сопроводительного лечения – профилактики и лечения осложнений цитостатического лечения.
ВЫВОДЫ
- Наилучшие показатели полной защиты от острых тошноты и рвоты при высокоэметогенных режимах химиотерапии достигаются комбинацией блокаторов серотониновых рецепторов с дексаметазоном. Антиэметогенный потенциал каждого из рассмотренных препаратов в отдельности (дексаметазона и гранисетрона) на 20% ниже их сочетания. Профилактика отсроченной рвоты, индуцированной химиотерапией, обеспечиваются назначением глюкокортикоидов, либо их сочетанием с блокаторами серотониновых рецепторов.
- Не выявлено зависимости между электрокардиографическими нарушениями ритма, проводимости и контрактильной способностью миокарда, размерами полости левого желудочка в процессе и по окончании химиотерапии с использованием эпирубицина гидрохлорида в кумулятивной дозе 450-600 мг/м2, что говорит о его высоком профиле безопасности в плане развития антрациклиновой кардиомиопатии в эквивалентных доксорубицину дозах.
- Реакции анафилактического типа на введение блеомицина наблюдались в 57% случаев, что требовало проведения гипосенсибилизирующих мероприятий, снижающих частоту и выраженность этого осложнения на 50-75%. Отмены блеомицина после развитии анафилактической реакции не требовалось.
- Легочная токсичность блеомицина проявляется при превышении кумулятивной дозы 200 мг/м2 и сопровождается интерстициальным пульмонитом с исходом в легочный фиброз. Одновременное или отсроченное с химиотерапией блеомицином проведение лучевой терапии на область легочных полей, средостения недопустимо.
- Доминирующим эффектом, влияющим на фармакокинетику высоких доз метотрексата, является возраст пациента. Анализ фармакокинетики сублетальных доз метотрексата 5г/м2 у детей различных возрастных групп показал, что клиренс метотрексата в сыворотке крови снижался у детей в возрасте старше 10 лет в сравнении с детьми более раннего возраста (6,6/час/м2 против 10,1/час/м2). Этим объясняется удовлетворительная толерантность к метотрексату у детей раннего возраста.
- Во время химиотерапевтического лечения солидных опухолей развивались специфические неотложные состояния, требующие междисциплинарного взаимодействия, а именно:
- развитие вегетативной периферической нейропатии вплоть до развития паралитического илеуса наблюдалось у 61,7% пациентов с нейробластомой;
- синдром неадекватной секреции антидиуретического гормона во время полихимиотерапии и в период септических осложнений наблюдался в 6,9% случаях;
- циторедуктивная химиотерапия при синдроме компрессии верхней полой вены интраторакально расположенной опухолью у 11 больных, позволившая: прижизненно верифицировать морфологический диагноз, обеспечить отсутствие послеоперационной летальности, провести отсроченную торакотомию с биопсией опухоли.
- Недостаточный контроль над рвотой, индуцированной химиотерапией высокими дозами цисплатина (120 мг/м2), приводил к прямо-пропорциональному усилению гематологической токсичности, снижению фильтрационной способности почек и требовал значительного большего объема сопроводительного лечения (лечения фебрильной нейтропении, трансфузий компонентов крови, электролитных нарушений), способствовал отсрочке в проведении очередного этапа лечения.
- Объективная потребность в трансфузиях концентрата тромбоцитов в раннем цитостатическом периоде зарегистрирована в 11,8% курсах миелотоксичной химиотерапии. Число фебрильных негемолитических реакций при проведении заместительной трансфузионной терапии отмытыми эритроцитами снизилось с 14,2% до 2,5% в сравнении с трансфузией эритроцитарной массы, а аллергических реакций с 8,1% до 1,9%, что позволяет обеспечить более высокий уровень безопасности трансфузионной терапии в период индуцированной аплазии кроветворения.
- Рентгенологические изменения в органах грудной полости в первые часы возникновения фебрильной нейтропении, индуцированные химиотерапией, документированы лишь в 4,8% случаях и только у пациентов, имеющих клинические признаки легочного дистресс-синдрома. Проведение рентгенографии органов грудной полости в постцитостатическом периоде наиболее информативно на этапе «выхода» из аплазии кроветворения.
- С помощью проективных методик определены индивидуальные психологические факторы адаптации детей к цитостатическому лечению, которые способствуют преодолению социальной депривации и эмоциональной реабилитации пациентов.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Для наилучшей профилактики острой тошноты и рвоты у детей, которым проводится высокоэметогенная химиотерапия, целесообразно использовать сочетание блокаторов серотониновых рецепторов с дексаметазоном, за исключением тех случаев, когда назначение кортикостероидов противопоказано по сопутствующей или фоновой патологии у больного.
- Рекомендуем регистрировать ЭКГ до и после каждого курса лечения. Уплощение или инверсия зубца T, депрессия сегмента S-T или начинающаяся аритмия (обычно временная и обратимая) не обязательно являются абсолютными показаниями к прерыванию лечения эпирубицином. Преходящее снижение вольтажа QRS-комплекса может быть следствием электролитных нарушений, анемии, нарушения реологических свойств крови, септицемии, неизбежно сопровождающих химиотерапию у детей. Кардиомиопатия, вызванная антрациклинами, проявляется стойким снижением вольтажа QRS, удлинением систолического интервала. Контроль функции сердечной мышцы на предмет развития антрациклиновой кардиомиопати следует проводить неинвазивными методами (ЭхоКГ) до начала химиотерапии и перед каждым введением антрациклиновых антибиотиков с оценкой объема полостей сердца, фракции выброса левого желудочка и контрактильной способности миокарда. Превосходящий профиль безопасности эпирубицина в эквивалентных доксорубицину дозах следует использовать для интенсификации химиотерапии у пациентов высокого прогностического риска по опухолевому процессу.
- Профилактика нефротоксичности цисплатина и прочих видов токсичности, в первую очередь гематологической, напрямую зависит от контроля над тошнотой и рвотой. Эффективный контроль эметогенного действия высоких доз цисплатина и ранних проявлений нефротоксичности значительно уменьшает объем сопроводительного лечения, способствует своевременности проведения этапов лечения.
- Эффективных методов лечения блеомициновой токсичности не разработано, а эффективная профилактика повреждения блеомицином эндотелия капилляров легких у детей до настоящего времени отсутствует. Это диктует необходимость проведения химиотерапии блеомицином только в специализированных отделениях врачами, имеющим опыт проведения химиотерапии блеомицином. Для профилактики реакции гиперчувствительности на введение блеомицина необходимо проведение гипосенсибилизирующих мероприятий непосредственно перед введением цитостатиков. В состав внутривенной премедикации должны включаться антигистаминные препараты и глюкокортикоиды. Тем самым достигается удовлетворительный профилактический эффект на возможную анафилаксию на введение блеомицина.
- Знание клинической симптоматики вегетативной винкристиновой нейропатии, проявляющейся развитием паралитического илеуса, своевременной оценки комплекса симптомов и правильной интерпретации лабораторных данных одновременно с правильно проведенным посиндромным лечением способствуют благоприятному исходу при данном виде осложнений цитостатического лечения.
- Проведение химиотерапии сверхвысокими дозами метотрексата требует обязательного фармакокинетического исследования элиминации препарата. Этим обеспечивается лучшая толерантность к высоким дозам метотрексата.
- При анемии следует проводить заместительную трансфузионную терапию отмытыми эритроцитами, что обеспечивает высокий уровень безопасности трансфузионной терапии. Трансфузии концентрата тромбоцитов должны проводиться только по строгим показаниям.
- Психологическое консультирование стало неотъемлемой частью комплексной проблемы лечения солидных опухолей. Введение психотерапевтичекой работы способствует нивелированию негативного психологического фона в системе «врач-пациент-родители». С целью оптимизации переносимости химиотерапевтического лечения необходимо создать, нормативно утвердить и внедрить работу по психологическому консультированию и проведению психокоррекционной работы с этой категорией пациентов, их родителями. Тесная взаимосвязь врача, среднего медицинского персонала и психолога способствует преодолению кризисных ситуаций, связанных с лечением детей и подростков от раковых опухолей.
- Профилактика и лечение осложнений химиотерапии при лечении неопухолевых заболеваний должно предусматривать разработанный комплекс мер по профилактике и лечению осложнений химиотерапии при солидных злокачественных опухолях.
- Разработанные в ходе исследования конкретные программы профилактики, ранней диагностики и сопроводительной терапии осложнений химиотерапии отдельных видов солидных опухолей, систематизированные в работе, могут быть рекомендованы для поэтапного проведения сопроводительного лечения в зависимости от вида цитостатического воздействия, нозологической формы солидной опухоли и возраста пациента. Использование элементов химиотерапии при лечении системных заболеваний соединительной ткани у детей должно проводиться педиатрами, имеющими опыт проведения сопроводительного лечения при цитостатической терапии.
Список трудов, опубликованных по теме диссертации
- Махонова Л.А., Петерсон И.С., Копосов П.В. и др. Злокачественный гистиоцитоз у детей // Журн. Вопр. онкол. – 1990. - Т.36, №9 - С. 1063-1067.
- Махонова Л.А., Тупицын Н.Н., Копосов П.В. и др. Гистиоцитарные пролиферативные заболевания у детей // Журн. Педиатр. – 1992. - №2. - С. 20-24.
- Павловская А.И., Матвеева И.И., Копосов П.В и др. Изолированное поражение щитовидной железы при Лангергансово-клеточном гистиоцитозе. // Журн. дет. онкол.- 1995. - №1, С.32-35.
- Koposov P., Pavlovskaya A., Makhonova L. LCH of thyroid masquerating as thyroid tumor in two pts. // “Tenth annual meeting of Histiocyte Society”: abstract book. Paris, France. – 1994. - P. 8.
- Makhonova L.A., Morozova O.V.. Koposov P.V., et al. The role of interferonotherapy and immunocorrection in the programs of treatment of stage III-IV childnood non-Hodgkin’s lymphoma // Med.Ped.Oncol. – 1994. - Vol.-.23, P.229.
- Kurmashov V., Popa A., Koposov P., et al. Structure of complications and death causes in patients treated by BFM-protocols // Med. and Ped. Oncol. – 1995. – Vol. 25.- p.347
- Тюкалова Н.Р., Островская А.В., Копосов П.В. и др. Результаты терапии детей с болезнью Ходжкина в условия амбулаторного отделения // Журн. гематол. и трансфузиол. -1999. - Т.44, - №5, С.3-6.
- Простомолотов О.А, Проценко Р.М., Копосов П.В. Роль ленограстима в программном лечении беркиттоподобных злокачественных неходжкинских лимфом у детей// Журн. гематол. и трансфузиол.-1999. - Т.44,- № 6, С.40.
- Копосов П.В., Проценко Р.М., Простомолотов О.А.. Гранулоцитарно-макрофагальный колониестимулирующий фактор(GM-GSF) сокращает продолжительность нейтропении индуцированной полихимиотерапии у пациентов со злокачественными новообразованиями ЦНС//. 6-й Рос. национ. конгресса «Человек и лекарство»: сб.науч.тр. – 1998. -.С.176-177.
- Простомолотов О.А., Проценко Р.М., Копосов П.В. и др. Рентгенография, как этап диагностического поиска у онкологических больных с лихорадкой в нейтропении // 2-й междунар. симп. «Диагностическая и интервенционная радиология в педиатрии, Москва 15-16 сентября, 1999 г.»:сб.науч.тр. - С.15.
- Maschan A.A., Koposov P.V., Protzenko R.M., et al.. A pilot study of Docetaxel in Previously untreated children with solid tumors // Proceedings of ASCO. - 2000 V.19. -P.529.
- Zorina E.A., Koposov P.V., Kovalev V.I.et al. Solid alveolar rhabdomyosarcoma of the right thigh in a child with Cystic Fibrosis // XIII International Cystic Fibrosis Congress, 4-8 June 2000: abstract book. - 2000- Stockholm, Sweden. - P.46.
- Бударин М.А., Нажимов В.П., Копосов П.В. и др. Случай сложной морфологической диагностики саркомы Юинга у ребенка // Журн.. Вопр. онкол. – 2000. - №46(1). - С. 90-93.
- Копосов П.В. Неотложные состояния при злокачественных новообразованиях у детей // Журн. Дет. больница. – 2000. - №1/00. – С. 51-59.
- Копосов П.В., Карпин Л.Е., Простомолотов О.А. и др. Полустационарная форма оказания медицинской помощи пациентам, страдающим солидными опухолями // Современные проблемы стационарной медицинской помощи детям: сб. науч. тр. – М.- 2000.- С. 144-145.
- Самочатова Е.В., Островская А.В., Копосов П.В. и др. Значение верификации варианта неходжкинских лимфом у детей для эффективности лечения по современным протоколам // Журн. гематол. и трансфузиол. – 2000. - №6. – С. 9-14.
- Желудкова О.Г., Копосов П.В., Простомолотов О.А. и др. Результаты комплексного лечения медуллобластом (МБ) у детей с использованием среднедозовой и высокодозной полихимиотерапии (ПХТ)// "Современные технологии в детской краниофациальной хирургии и неврологии": сб.науч.тр. 3-го Международного симпозиума Москва, 23 - 24 ноября 2000 г. – М., 2000. - Эллит-Принт. – С..278.
- Проценко Р.М., Нецветаева Т.Э., Копосов П.В. и др. Целесообразность проведения рентгенографии органов грудной полости у больных с лихорадкой при нейтропении, индуцированной полихимиотерапией // Журн. гематол. и трансфузиол.- 2000. - №1. – С.13-16.
- Ковалев В.И., Копосов П.В., Старостина А.Ю. и др.. Комбинированное лечение саркомы Юинга у детей // “Рентгенорадиология ХХI века. Проблемы и надежды…”: сб.науч.тр. VIII Всерос. съезда рентгенологов и радиологов. – Челябинск-Москва. - 2000. - С.30.
- Желудкова О.Г., Кумирова Э.В., Копосов П.В. и др. Полихимиотерапия в комплексном лечении медуллобластом у детей // II съезд детских онкологов и гематологов России: сб. науч. тр. - Ростов-на-Дону, 2001. - С.68-69.
- Копосов П.В., Ковалев В.И., Старостина А.Ю. и др. Результаты комбинированного лечения саркомы Юинга у детей // II съезд детских онкологов и гематологов России: сб. науч. тр. - Ростов-на-Дону, 2001. - С.93-94.
- Копосов П.В., Ковалев В.И., Старостина А.Ю. и др. Влиняие гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) на продолжительность нейтропении, индуцированной полихимиотерапией у пациентов со злокачественными герминогенными опухолями // II съезд детских онкологов и гематологов России: сб. науч. тр. - Ростов-на-Дону, 2001. - С.94-95.
- Ковалев В.И., Стрыков В.А., Копосов П.В. и др. Диагностическая торакоскопия и проблема лечения генерализованных форм злокачественных опухолей у детей // Журн. Дет. хирург. – 2001. - №5. – С. 19-23.
- Ковалев В.И., Копосов П.В., Ковалев Д.В. и др. Онкологическое отделение детской многопрофильной больницы: современное состояние и перспективы // Журн. Дет. хирург. – 2001. - №5. - С.49-51.
- Проценко Р.М., Копосов П.В., Простомолотов О.А., и др. Применение доцетаксела в лечении сарком мягких тканей у детей // Журн. Совр. Онкол. – 2001. -Т.3. - №1.- С.19-21.
- Копосов П.В., Ковалев В.И., Ковалев Д.В. и др. Аддитивные аспекты нефротоксичности цисплатина при химиотерапии у детей с остеогенной саркомой. // Всерос. конф. «Проблемы раннего цитостатического периода»:сб.науч.тр., М., 2002. – С. 112-113.
- Копосов П.В., Ковалев В.И., Стрыков В.А. и др. Трансфузии концентрата тромбоцитов детям, страдающим солидными опухолями во время полихимиотерапии // Журн. Вопр. онкол.- 2002. -Т.48. - №3. - С.365-368.
- Лосева М.С., Ковалев Д.В., Копосов П.В. и др. Результаты комбинированного лечения агрессивного фиброматоза у детей // Рос. конф. “Достижения и перспективы детской хирургии”, посвященные 80-летию профессора А.Г. Баирова: сб.науч.тр. - Санкт-Петербург, 2002. - С. 149.
- Ковалев В.И., Бородачев А.В., Ковалев Д.В., Копосов П.В. Детская онкология: достижения и новые перспективы. // Рос. конф. “Достижения и перспективы детской хирургии”, посвященные 80-летию профессора А.Г. Баирова: сб.науч.тр. - Санкт-Петербург, 2002. - С. 143.
- Ковалев В.И., Копосов П.В., Бородачев А.В. и др. Комбинированное лечение агрессивного фиброматоза абдоминальной локализации у ребенка 5 лет (клиническое наблюдение) // Журн. Анн. пластич., реконстр. и эстет. хирург. – 2002. - №3. - С. 34-40.
- Ковалев В.И., Ковалев В.И., Копосов П.В. Остеогенная саркома у детей. – М.: Триада-Фарм, 2002. - 168 с.
- Копосов П.В., Ковалев В.И., Ковалев Д.В. и др. Взаимосвязь острых токсических эффектов цисплатина при химиотерапии остеогенной саркомы у детей // 1-й Всерос. конгр. “Современные технологии в педиатрии и детской хирургии”: сб.науч.тр. – М., 2002. –С.77-78.
- Ковалев В.И. Копосов П.В., Бородачев А.В. Рекомендации SIOP по организации отделения детской онкологии (по материалам комитета SIOP по стандартам в подготовке и попечения в детской онкологии) // Рабочее совещание главных детских онкологов регионов России с симпозиумом по проблеме опухолей почек у детей: сб.науч. тр. - М., 2002. – С. 8-9.
- Копосов П.В., Ковалев В.И., Ковалев Д.В. – Профилактика и лечение осложнений химиотерапии злокачественных опухолей у детей: современные подходы. Руководство для врачей. – М.: Клевер-принт, 2002. - 128 с.
- Ковалев В.И., Ковалев Д.В., Копосов П.В. и др. Органосохраняющие операции в комбинированном лечении остеогенной саркомы у детей // Журн. Дет. хирург. – 2002. - №3. – С.16-21.
- Ковалев Д.В., Копосов П.В. – Агрессивный фиброматоз у детей // Журн. Анн. Хирург. – 2002. - №4. - С. 13-16.
- Ковалев В.И., Копосов П.В., Ковалев Д.В.и др. Онкологическое отделение детской многопрофильной больницы: современное состояние и перспективы // 2-й Рос. конгр. «Современные технологии в педиатрии и детской хирургии»: сб.науч.тр. –М., 2003, С. 359.
- Копосов П.В., Ковалев В.И., Старостина А.Ю. и др. // 2-й Рос. конг. «Современные технологии в педиатрии и детской хирургии»: сб.науч.тр. –М., 2003, С. 360.
- Ковалев В.И., Копосов П.В., Ковалев Д.В. и др. Онкологическое отделение детской многопрофильной больницы: исторический очерк, современное состояние и перспективы // Журн. дет. онкол. – 2003. - №4. - С. 24-28.
- Ковалев В.И., Нажимов В.П., Копосов П.В. Предоперационная подготовка при синдроме компрессии верхней полой вены, вызванной опухолью переднего средостения у детей и подростков // Журн. Вопр. совр. педиатр.- 2004. – Т.3. - Прил.1. – С.202.
- Копосов П.В., Ковалев В.И., Старостина А.Ю. и др. Значение сопроводительной терапии в современном лечении злокачественных опухолей у детей // Журн. Вопр. совр. педиатр.- 2004. – Т.3. - Прил.1. – С.213.
- Ковалев Д.В., Ковалев В.И., Старостина А.Ю. и др. Результаты аутопластики малоберцовой костью при остеогенной саркоме у детей // Журн. Вопр. совр. педиатр.- 2004. – Т.3. - Прил.1. – С.200.
- Ковалев Д.В., Ковалев В.И., Копосов П.В. и др. Роль диагностической торакоскопии в ранней диагностике легочных метастазов // Журн. Вопр. совр. педиатр.- 2004. – Т.3. - Прил.1. – С.200
- .Ковалев В.И., Копосов П.В., Ковалев В.И. и др. Комбинированное лечение агрессивного фиброматоза у детей // Журн. Вопр. совр. педиатр.- 2004. – Т.3. - Прил.1. – С.201.
- Ковалев В.И., Копосов П.В., Ковалев Д.В. и др. Отделение онкологии в многопрофильной детской клинике: современное состояние и перспективы // Журн. Вопр. совр. педиатр.- 2004. – Т.3. - Прил.1. – С.201.
- Ковалев Д.В., Копосов П.В., Ковалев В.И. Злокачественные опухоли у детей: учебн. пособие для студ. мед. вузов – М.: Эликском, 2004 – 136 с.
- Виноградова Е.Ю., Раевский С.О., Копосов П.В. и др. Психологическая работа с детьми и подростками, страдающими злокачественными опухолями // Журн. Дет. онкол. [Электронный ресурс]. 2004. - №2. - разд. 4.8. – 1 электрон.-опт. диск (CD ROM).
- Ковалев В.И., Копосов П.В., Ковалев Д.В. и др. Результаты комбинированного лечения агрессивного фиброматоза у детей// Журн. Дет. онкол. [Электронный ресурс]. 2004. - №2. - разд. 2.2.3. – 1 электрон.-опт. диск (CD ROM).
- Ковалев Д.В., Копосов П.В., Ковалев В.И.и др. Факторы прогноза при диагностике и лечении остеогенной саркомы у детей // Журн. Дет. онкол. [Электронный ресурс]. 2004. - №2. - разд. 2.2.9. – 1 электрон.-опт. диск (CD ROM).
- Ковалев Д.В., Копосов П.В., Ковалев В.И.и др. Источники ошибок в диагностике и лечении злокачественных опухолей длинных трубчатых костей // Журн.. Дет. онкол. [Электронный ресурс]. 2004. - №2. - разд. 2.2.10. – 1 электрон.-опт. диск (CD ROM).
- Копосов П.В., Ковалев Д.В., Старостина А.Ю., Ковалев Д.В., Бородачев А.В. Сопроводительная терапия в современном лечении злокачественных опухолей у детей// Журн. Дет. онкол. [Электронный ресурс]. 2004. - №2. - разд. 3.10. – 1 электрон.-опт. диск (CD ROM).
- Ковалев В.И., Ковалев Д.В., Копосов П.В. и др. Реконструктивные операции в комбинированном лечении рабдомиосарком мочевого пузыря // Журн. Дет. онкол. [Электронный ресурс]. 2004. - №2. - разд. 2.5.2. – 1 электрон.-опт. диск (CD ROM).
- Копосов П.В., Ковалев В.И., Старостина А.Ю.и др. – Результаты лечения экстракраниальных зародышево-клеточных опухолей у детей. // III российск. Конгр. «Современные технологии в педиатрии и детской хирургии»: сб. науч. тр., М., 2004. - С.408
- Копосов П.В. – Клиническая оценка кардиотоксичности программной химиотерапии сарком мягких тканей у детей по протоколу CWS-96.- // III российск. Конгр. «Современные технологии в педиатрии и детской хирургии»: сб. науч. тр., М., 2004. - С. 407-408.
- Ковалев Д.В., Нажимов В.П., Копосов П.В. и др. Морфологические параллели лучевой и видеоторакоскопической диагностики остеогенной саркомы у детей //Журн. Анн. хирург. -2004. - №3. - С. 68-72.
- Ковалев Д.В., Ковалев В.И., Копосов П.В. и др. Костная аутопластика и эндопротезирование в комбинированном лечении остеогенной саркомы у детей // Российск. онкол. журн. – 2004. - №3. – С. 4-12.
- Копосов П.В. Клиническая оценка кардиотоксичности программной химиотерапии сарком мягких тканей у детей по протоколу CWS-96 // Журн.. Дет. онкол. – 2004. - №3-4. – С.2-8.
- Ковалев Д.В., Ковалев В.И., Копосов П.В. и др Значение диагностической торакоскопии в лечении генерализованных форм злокачественных солидных опухолей у детей // Российск. онкол. журн. – 2005. - №1. - С.29-34.
- Виноградова Е.Ю., Копосов П.В. Необходимость психологической помощи детям в онкологическом стационаре // Междунар. научно-практич. конф.. (17-19апреля 2006г.): сб.науч.тр. - Уфа, 2006. – С. 126-129
- Копосов П.В., Когония Л.М. Проявления кожной токсичности при лечении гефитинибом // XI Рос. онкол. конгр.: сб.науч.тр. -, М., 2007. – С. 126-127.
- Ковалев Д.В., Ковалев В.И., Копосов П.В. и др. – Злокачественные опухоли у детей: Учебн. Пособ. для студ., обучающихся по специальности 060103 (040200) «педиатрия». – М.: Макс-Пресс, 2008. - 112 с.
- Диагностика и лечение солидных опухолей у детей: Рук. для врачей/Сост. В.И. Ковалев и др.; под ред. проф. А.Г. Румянцева и проф. А.В. Гераськина. – М.: Медпрактика М, 2008, 171 с.

