Ревматоидный артрит с ревматоидными узелками: клинико-иммунологические особенности
На правах рукописи
УДК: 616.72-002.77
БУЛДАКОВА ЮЛИЯ РАФАЭЛЕВНА
РЕВМАТОИДНЫЙ АРТРИТ С РЕВМАТОИДНЫМИ УЗЕЛКАМИ:
КЛИНИКО-ИММУНОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
14.00.05 - Внутренние болезни
14.00.39 - Ревматология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва - 2009
Работа выполнена в ГОУ ВПО «Московский государственный медико-стоматологический университет Росздрава»
Научный руководитель:
доктор медицинских наук,
профессор Алиханов Багдади Абумуслимович
Научный консультант:
доктор медицинских наук Тимофеев Виталий Тимофеевич
Официальные оппоненты:
доктор медицинских наук, профессор Надежда Александровна Шостак
ГОУ ВПО «Российский государственный медицинский университет им. Н.И. Пирогова Росздрава»
доктор медицинских наук, профессор Александр Эдуардович Радзевич
ГОУ ВПО «Московский государственный медико-стоматологический университет Росздрава»
Ведущая организация: ГОУ ВПО «Московская медицинская академия им. И.М. Сеченова Росздрава»
Защита состоится « »______________2009 г. в _____часов на заседании диссертационного совета Д 208.041.01 при ГОУ ВПО «Московский государственный медико-стоматологический университет Росздрава» (127473, г. Москва, ул. Делегатская, д. 20/1)
С диссертацией можно ознакомиться в библиотеке Московского Государственного медико-стоматологического университета (127206, Москва, ул. Вучетича, д.10а)
Автореферат разослан « »____________2008 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Е.Н. Ющук
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования
Одной из актуальных проблем современной ревматологии является совершенствование диагностики и лечения ревматоидного артрита (РА). Несмотря на несомненные успехи последних десятилетий, все еще не удается прогнозировать тяжесть течения РА, быстро и надежно подавлять его активность.
Клиническая картина РА вариабельна: встречаются как благоприятные формы с медленной деструкцией суставов и минимальными висцеральными проявлениями, так и агрессивные формы с быстро прогрессирующим артритом и высокой активностью аутоиммунных процессов в синовии и внутренних органах. По мнению E.D. Harris (1990), «В целом, врачи недооценили смертность и тяжесть течения РА». При РА быстро развивается стойкая нетрудоспособность, смерть наступает в более ранние сроки, чем в среднем в популяции (Насонова В.А. и соавт., 1997, Ребров А.П., 2003), изменения развиваются не только в суставах, но и в других органах и системах (Нестеров А.И., Сигидин Я.А. (1966), E.D. Harris (1990), В.А. Насонова (1997), Н.В. Чичасова (2000), C. Turesson и соавт. (2003) и др.).
Одними из наиболее часто встречающихся системных проявлений РА являются ревматоидные узелки (РУ), которые, входя в число диагностических критериев РА, не имеют четкой трактовки диагностической ценности. Необходимость тщательного и всестороннего изучения РУ как «равноправных» участников ревматоидного процесса подчеркивал Заслуженный деятель науки РФ, доктор медицинских наук, профессор, Юрий Константинович Токмачев (1929-2002), явившийся инициатором написания этой работы. Генез и клинические особенности других внесуставных проявлений у больных РА с наличием РУ также изучены недостаточно.
Литературные данные о патологии иммунной системы при РА, содержат немало сведений о фенотипе и функции лимфоцитов и субпопуляциях Т-лимфоцитов в синовии и в синовиальной жидкости больных, значительно меньше данных отражают фенотип и функции лим-фоцитов периферической крови больных РА, единичны данные о фенотипе лимфоцитов периферической крови у больных РА с наличием РУ.
В настоящее время уделяется большое внимание роли адгезивных рецепторов в патогенезе аутоиммунного и гранулематозного воспаления, однако процессы адгезии лимфоцитов периферической крови больных РА с наличием РУ к клеткам микроокружения изучены недостаточно.
Цель исследования:
Определение у больных РА с ревматоидными узелками особенностей параметров клинико-лабораторной активности заболевания, показателей рецепторного фенотипа и адгезивности лимфоцитов периферической крови.
Задачи исследования:
1. Провести исследование суставного статуса и клинико-лабораторной активности у больных РА с ревматоидными узелками и без таковых.
2. Провести исследование внесуставных проявлений РА у больных с ревматоидными узелками и без таковых.
3. Изучить CD-фенотип лимфоцитов периферической крови с определением маркеров активации, дифференциации, созревания и адгезии у больных исследуемых групп и здоровых лиц.
4. Сопоставить данные клинического и иммунологического обследования больных РА с ревматоидными узелками и без таковых.
5. Изучить способность к адгезивному взаимодействию лимфоцитов периферической крови больных РА и здоровых лиц с культурами эпителиальных клеток тимуса, легких и фибробластами в эксперименте in vitro.
Научная новизна. На основании комплексного клинико-лабораторного обследования 120 больных РА выявлены особенности течения РА, заключающиеся в том, что у больных РА с ревматоидными узелками преобладают внесуставные проявления, связанные с аутоиммуноагрессией и пролиферацией лимфоцитов в тканях (лимфаденопатия, кожный васкулит, узловатая эритема, иридоциклит), тогда как у больных РА без ревматоидных узелков превалируют внесуставные проявления, связанные с неспецифическим воспалением и интоксикацией (потеря массы тела, лихорадка, анемия).
Впервые у больных РА с ревматоидными узелками установлено достоверное снижение в периферической крови абсолютного содержания лимфоцитов, несущих основной Т-клеточный маркер CD3, как по сравнению с группой контроля, так и по сравнению с больными РА без ревматоидных узелков. Методом корреляционного анализа выявлена обратная зависимость между содержанием в периферической крови лимфоцитов CD3+ и показателем множественности ревматоидных узелков, что может быть объяснено повышенной миграцией Т-лимфоцитов из периферической крови в ткани у больных РА с ревматоидными узелками.
Впервые в обеих группах больных РА выявлено многократное повышение в периферической крови уровня лимфоцитов, несущих CD10 (маркер незрелых Т- и В-лимфоцитов), что, возможно, связано с нарушением созревания лимфоцитов у больных РА.
Впервые в эксперименте in vitro при сокультивировании лимфоцитов периферической крови больных РА с эпителием тимуса и легких и фибробластами обнаружена повышенная адгезивная активность лимфоцитов больных РА независимо от наличия ревматоидных узелков по сравнению с лимфоцитами здоровых лиц.
Практическая значимость работы. Исследован рецепторный аппарат лимфоцитов периферической крови больных РА в подгруппах с наличием или отсутствием РУ и выявлен ряд отличий, имеющих диагностическую ценность.
В эксперименте in vitro изучена способность лимфоцитов больных РА с ревматоидными узелками и без таковых к адгезии с клетками эпителиальных линий: in vitro смоделированы процессы, подобные которым имеют место в условиях гранулематозного воспаления, в том числе в РУ.
Выявлены внутринозологические отличия в клиническом течении РА с
ревматоидными узелками и без таковых, что дополняет знания, применяемые
в диагностике, лечении и динамическом наблюдении за больным РА.
Основные положения, выносимые на защиту:
- При РА имеются особенности внесуставных проявлений в зависимости от наличия или отсутствия РУ: при РА с наличием РУ они преимущественно связаны с лимфопролиферацией и аутоиммуноагрессией, а при РА без РУ – преимущественно с интоксикацией и неспецифическим воспалением.
- Показатель множественности РУ обратно пропорционален степени снижения уровня СD3+-Т-лимфоцитов периферической крови больных РА.
- У больных РА в периферической крови повышен уровень лимфоцитов, несущих рецептор CD10+, свойственный «незрелым» лимфоцитам, при этом адгезивность лимфоцитов периферической крови больных РА к эпителиальным клеткам тимуса повышена.
Внедрение в практику. Результаты исследования внедрены в практику 31 отделения ГКБ №1 им. Н.И. Пирогова, а также используются в учебном процессе на кафедре внутренних болезней стоматологического факультета ГОУ ВПО МГМСУ.
Апробация диссертации состоялась на совместном заседании кафедры внутренних болезней стоматологического факультета ГОУ ВПО МГМСУ с кафедрой факультетской терапии им. акад. А.И. Нестерова ГОУ ВПО РГМУ Росздрава, кафедрой факультетской терапии и пропедевтики внутренних болезней ГКА им. Маймонида министерства образования и науки РФ и врачей терапевтических отделений ГКБ 67 Департамента здравоохранения г. Москвы (г. Москва, март 2007 г.).
Личное участие автора в разработке проблемы: соискателем лично обследованы 120 больных РА, из них 70 с привлечением иммунологических методик; проведена серия из 100 экспериментов in vitro по определению адгезивности лимфоцитов больных РА к эпителиальным клеточным линиям по разработанной при участии автора методике. Произведена статистическая обработка и обобщение результатов исследования, выработаны практические рекомендации.
Результаты работы доложены на ежегодной конференции «Проблемы современной ревматологии» в ЦКГ МВД в 2006 и 2007 годах, по материалам диссертации опубликовано 15 печатных работ, в т.ч. в одной статье в журнале, рекомендованном ВАК.
Структура и объем диссертации. Диссертация содержит введение, обзор литературы, главу о материалах и методах исследования, собственные данные, обсуждение результатов, выводы, практические рекомендации и список литературы из 150 работ отечественных и 75 работ иностранных авторов. Объем работы 125 печатных страниц, включены 21 таблица, 13 рисунков, 2 клинических примера.
СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ.
Материалы и методы. Клиническая характеристика больных.
В работе использованы данные стационарного и амбулаторного обследования 120 (37 мужчин и 83 женщины в возрасте от 24 до 73 лет) больных достоверным РА по пересмотренным критериям АРА (1987). Иммунологические методики применены у 70 из 120 больных РА.
Таблица 1.
| Нозология и количество больных | Возраст больных (г.) | Средний возраст дебюта РА (г.) | Средняя длительность заболевания (г.) |
| РА с наличием РУ n=85 | 52,4±7,2 | 45,4±12,2 | 7,3±5,9 |
| РА без РУ n=35 | 53,1±7,2 | 46,5±5,9 | 6,6±5,4 |
Возраст и длительность заболевания больных РА.
Группу контроля составили 25 здоровых лиц, сопоставимых по полу, средний возраст которых был 39,9±4,9 г.
Обследование больных проходило в ревматологическом отделении ГКБ №1 им. Н.И. Пирогова (зав. отд. к.м.н. Е.И. Шмидт) и в Московском городском ревматологическом центре (МГРЦ) (зав. МГРЦ К.М. Коган), а также в иммунологической лаборатории кафедры факультетской терапии им. акад. А.И. Нестерова РГМУ (зав. кафедрой проф. Н.А. Шостак). Здоровые лица были обследованы в ГП №79 СЗАО г. Москвы (гл. врач Г.А. Василькова).
Стадию РА определяли по Штейнброкеру (O. Steinbrocker, 1949). Изменения в суставах, соответствующие II стадии артрита, имели место у половины больных обеих групп (в процентном соотношении), отмечалось процентное преобладание I стадии артрита у больных РА без РУ и, напротив, III стадии артрита у больных РА с наличием РУ (табл. 2).
Таблица 2.
| Больные РА | I | II | III | IV |
| РА с РУ, n=85 | 10 11,7% | 43 50,6% | 23 27,1% | 7 8,2% |
| РА без РУ, n=35 | 8 22,9% | 19 54,3% | 6 17,1% | 2 5,7% |
Рентгенологическая стадия РА у исследуемых больных.
Активность РА определялась в соответствии с рекомендациями EULAR (Европейской антиревматической лиги) путем подсчета DAS28 (Disease Activity Score). Активность умеренной степени определена у 55,3% больных РА с наличием РУ и у 57,15% больных РА без РУ, высокой степени - у 44,7% больных РА с наличием РУ и 42,85% больных РА без РУ, минимальная степень активности не имела место.
Методы исследования. Лабораторное исследование включало биохимическое и иммунологическое исследование крови, взятой из кубитальной вены после 14-часового голодания. Определяли С-реактивный белок полуколичественным методом на основе латексного диагностикума; ревматоидный фактор (РФ) в сыворотке крови методом латекс-агглютинации по Л. Сперанскому (1968); концентрацию иммуноглобулинов (Ig) A, M, G в сыворотке методом радиальной иммунодиффузии по Манчини в планшетах фирмы «Реафарм». Определение популяций лимфоцитов и субпопуляций Т-лимфоцитов и экспрессии их мембранных маркеров производили методом иммунофлуоресцентной микроскопии (Г.Фримель, 1987) с использованием моноклональных антител (фирма «Сорбент») к молекулам CD2, CD3, CD19, CD4, CD8, CD38, CD45, CD25, CD10, HLA-DR человека. При анализе данных иммунологического обследования больных использовали систему поэтапного иммуномониторинга, описанную В.Т. Тимофеевым и соавт. (2000, 2002). Основой интер-претации данных о содержании субпопуляций лимфоцитов периферической крови больных РА служили методические рекомендации Порядина Г.В. и соавт. (2002) и Л.В. Ковальчука (2003). Иммунологическое исследование крови выполнялось в лаборатории кафедры факультетской терапии им. акад. А.И. Нестерова РГМУ под руководством в.н.с. ПНИЛ д.м.н. В.Т. Тимофеева, в иммунологической лаборатории МГРЦ (зав. лабораторией - С.В. Попова) и в лаборатории клеточного иммунитета ГНЦ «Институт иммунологии» ФМБА (зав. лабораторией акад. А.А. Ярилин) в рамках проекта 04-48104, «Изучение патологии тимического и внетимусного звеньев положительной селекции Т-лимфоцитов человека и поиск путей ее коррекции» и проекта 08-0401508 «Изучение роли лимфоидных клеток с атипичным соотношением антигенраспознающего рецептора/ко-рецепторов (TCR-CD3/CD4, CD8) при системной иммунопатологии человека» (руководитель проектов к.м.н. М.В. Головизнин), поддержанных грантами Российского Фонда Фундаментальных Исследований).
Эксперимент по изучению адгезивного взаимодействия лимфоцитов больных РА с эпителиальными клетками тимуса, легких и фибробластами, разработанный к.м.н. Головизниным М.В. при участии автора на основе реакции розеткообразования, выполнялся на культуральных клеточных линиях в лаборатории клеточного иммунитета ГНЦ «Института иммунологии» ФМБА.
Статистический анализ полученных данных. Статистический анализ данных выполнялся с использованием пакета программ Statistica 6.1 (StatSoft, Inc., США) в соответствии с рекомендациями (Реброва О.Ю., 2002).
Описательная статистика количественных признаков представлена средними и средне-квадратическими отклонениями (в формате M+s; в случае нормальных распределений) либо медианами и квартилями (в формате Me [Q1; Q3]). Описательная статистика качественных признаков представлена абсолютными и относительными частотами.
При анализе соответствия распределений количественных признаков нормальному закону применялся критерий Шапиро-Уилка.
Для сравнения несвязанных групп по количественным и порядковым признакам применялся непараметрический дисперсионный анализ по Краскел-Уоллису, множественные post hoc сравнения групп по Сигэл и Кастеллан, тест Манна-Уитни, для сравнения связанных групп – тест Вилкоксона. Сравнение несвязанных групп по качественным признакам проводилось с использованием теста Хи-квадрат и точного критерия Фишера. Проводился непараметрический корреляционный анализ по Спирмену.
При проверке гипотез статистически значимыми считались результаты при достигнутом уровне значимости p<0,05.
Результаты собственных исследований и обсуждение.
Данные клинико-лабораторной активности РА.
Дебют РА в обеих группах приходился в среднем на 46-ой год жизни (45,8±9,3 г.). В группе РА с наличием РУ появление РУ в среднем приходится на начало пятого года (4,14±1,9 г.) от начала заболевания. В группе РА с наличием РУ I степень активности была установлена у 5,8% больных, II степень активно-сти у 62,45% и III степень у 31,75%. В группе РА без РУ показатели активности соответственно равнялись 8,5%, 65,8% и 25,7%.
| Клиническое проявление | РА с РУ (n=85) | РА без РУ (n=35) | р |
| Утренняя скованность (ч) | 3,6±0.3 | 2,8±0,4 | р=0,161 |
| Число воспаленных суставов | 7,8±0,3 | 8,0±0,5 | р=0,285 |
| ВАШ (мм) | 70,0±0,9 | 74,3±0,9 | р=0,014 |
| СОЭ (мм/ч) | 38,5±13,3 | 37,2±13,3 | р=0,611 |
| СРБ (мг/л) | 98,87±40,7 | 136,8±58,3 | р=0,098 |
| DAS | 5,16±0,58 | 5,07±0,6 | р=0,441 |
Таблица 3.
Некоторые показатели активности РА у исследуемых больных
Группы больных РА были сопоставимы по показателям утренней скованности, количеству воспаленных суставов и СОЭ. Отмечался достоверно более высокий (р=0,014) уровень ВАШ у больных без РУ, что, возможно, обусловлено худшей переносимостью заболевания у больных РА без РУ вследствие более частого одновременного сочетания нескольких видов внесуставных проявлений (табл. 3 и 7).
Клинико-лабораторные данные у больных РА с наличием РУ
Ревматоидные узелки – непостоянные объемные образования, выявляемые у части больных РА. При единообразии микроскопических данных, характерных для гранулемы, РУ имеют большой полиморфизм макроскопического строения, разнообразную локализацию (как наружную, так и во внутренних органах) и различные сроки существования. Данные о численности РУ представлены в табл. 4.
| РУ Больные | Единичные РУ | 2-3 РУ | 4 и более РУ | |||
| n | % | n | % | n | % | |
| Мужчины (n=24) | 5 | 20,8 | 11 | 45,8 | 8 | 33,4 |
| Женщины (n=61) | 24 | 39,3 | 23 | 37,7 | 14 | 22,9 |
Таблица 4.
Численность выявленных РУ у больных РА.
Одиночные РУ чаще отмечались у женщин, тогда как множественные РУ преобладали у мужчин. Отмечалась тенденция к увеличению количества РУ по мере прогрессирования РА. У больных с I стадией РА не встречались множественные (4 и более) РУ, а у больных с IV стадией артрита не отмечались единичные РУ.
Большинство РУ локализовались на верхних конечностях (179 случаев РУ у 80 больных). Эта цифра включает и одиночные мелкие РУ, и тесно спаянные в крупные конгломераты РУ (табл. 5). У 15 больных из 85 (17,6%) РУ обнаружены только в области локтевых суставов. У 65 больных из 85 (76,5%) выявлены РУ как этой, так и другой локализации. У 5 больных из 85 (5,9%) имелись РУ только вне области локтевых суставов. У 38 больных (47,5%) РУ в области локтевых суставов были асимметричными (в 3 раза чаще слева, чем справа). В области проксимальных межфаланговых суставов (ПМФС) II и III пальцев кисти РУ имели преимущественно симметричное расположение. Количество РУ в области предплечья, запястья и ПМФС кисти было невелико и не имело закономерности распределения.
Таблица 5.
| Область верхней конечности | Количество больных | Симметричность РУ | Количество больных |
| Область локтевых суставов | 80 | С обеих сторон Только слева Только справа | 42 29 9 |
| Область предплечья | 8 | С обеих сторон Только слева Только справа | 3 2 3 |
| Область запястья | 5 | С обеих сторон Только слева Только справа | 1 0 4 |
| Область ПФС кисти | 10 | С обеих сторон Только слева Только справа | 3 3 4 |
| Область МФС кисти | 16 | С обеих сторон Только слева Только справа | 11 1 4 |
Локализация РУ в области верхних конечностей
У 13 пациентов РУ располагались вне верхних конечностей (табл. 6).
| Другая локализация РУ | Число случаев | Численность РУ |
| Область плечевого пояса | 1 | единичный |
| Область головы | 2 | единичный и множественные |
| Область коленных суставов | 1 | множественные |
| Область голеностопных суставов | 2 | множественные |
| Область стопы | 5 | единичный и множественные |
| Пульмонарная локализация | 2 | единичные |
Таблица 6.
Редкая локализация РУ (вне верхних конечностей).
У двух больных (1 женщина и 1 мужчина) были выявлены множественные мелкие РУ пальмарной локализации, располагавшиеся по ходу сухожилий-сгибателей пальцев. Эти случаи были отнесены к РУ с необычной локализацией, и, предположительно, связаны с индукцией РУ приемом метотрексата. У обоих больных еще до назначения метотрексата уже имелись типичные РУ в области локтевых суставов. Подобные наблюдения отмечали McGrath MN, Fleischer A., (1989), Miehle W., Streibl H., (1994), Jang KA et al., (1999).
Необходимо отметить, что у 71 (83,5%) из 85 исследованных больных развитие РУ связано с обострением РА: из них у 12 больных (17,0%) РУ появились или увеличились в начале обострения, у 53 больных (74,6%) – на «высоте» обострения, у 6 больных (8,4%) – при стихании обострения РА. У 11 больных (12,9%) образование РУ сопровождало дебют РА, 3 больных (3,5%) не смогли охарактеризовать обстоятельства появления РУ и их динамику.
В ходе исследования достоверно установлено (р<0,001), что РУ значительно изменялись или исчезали после внутрисуставного введения кортикостероидов у 59 больных РА (69,4%). Подобной динамики РУ не было выявлено при пероральном приеме системных кортикостероидов, не сочетающемся с внутрисуставным введением. Только у 1 больной единичный «молодой» РУ исчез в течение двух первых недель перорального приема преднизолона в дозе 10 мг/сут. Изменения РУ, как правило, отмечались уже с вторых-третьих суток после внутрисуставного введения ГКС и проявлялись уменьшением размеров и упругости РУ, появлением «флюктуации» при пальпации узелков. Через 10-14 дней после внутрисуставных инъекций ГКС часть РУ напоминала запустевшие кисты, другая – тестоватые солидные образования, легко меняющие форму при пальпации.
Описание РУ в составе конгломератов и их количественный учет вызвали определенные трудности. Конгломераты РУ в виде крупных бугристых опухолевидных образований выявлялись у больных с длительно текущим РА (3 и более лет) и включали в себя элементы различной формы, размеров, консистенции и разной степени изменчивости при обострениях и ремиссиях РА. В доступной литературе мы не нашли данных о причинах и закономерностях формирования конгломератов РУ. По нашим наблюдениям, лишь четверть РУ - 22 (25,9%) исчезали бесследно спонтанно или под влиянием базисной терапии. В остальных случаях РУ регрессировали, но сохранялись, становясь при следующем обострении «точкой роста» для новых РУ и образования конгломератов. При наблюдении за состоянием РУ в динамике отмечено, что наибольшим колебаниям формы, консистенции и размеров подвержены «молодые» элементы конгломератов РУ с выраженным экссудативным компонентом. «Старые» элементы РУ, появившиеся месяцы или годы назад, отличались плотной текстурой, напоминающей фиброзную ткань, и слабо отвечали или не отвечали на внутрисуставное введение ГКС. Гистологическое исследование конгломератов РУ мы не проводили.
Внесуставные проявления РА были выявлены у больных обеих групп. У 43 (50,5%) больных РА с наличием РУ и 25 больных (70%) больных РА без РУ было отмечено одновременное сочетание 3-х и более видов внесуставных проявлений. Более частое выявление у больных РА без РУ одновременно нескольких видов внесуставных проявлений, возможно, объясняет более высокие показатели ВАШ в этой группе (табл. 3 и 7).
Таблица 7.
| Внесуставные проявления | РА с наличием РУ n=85 | РА без РУ n=35 | ||
| Всего | % | Всего | % | |
| Анемия | 45 | 52,9% | 24 | 68,5% |
| Лихорадка | 24 | 28,2% | 11 | 31,4% |
| Потеря массы тела | 37 | 43,5% | 22 | 62,8% |
| Гипотрофия мышц плечевого и/или тазового пояса | 37 | 43,5% | 25 | 71,4% |
| Лимфаденопатия | 8 | 9,4% | - | - |
| Полинейропатия | 3 | 3,5% | - | - |
| Кожный васкулит | 7 | 8,2% | 1 | 2,8% |
| Узловатая эритема | 1 | 1,2% | - | - |
| Глазные (иридоциклит, эписклерит) | 2 | 2,4% | - | - |
| Синдром Шегрена | - | - | 2 | 5,7% |
| Синдром Рейно | 1 | 1,2% | 1 | 2,8% |
| Асептический некроз головки бедренной кости | 1 | 1,2% | 3 | 8,6% |
Внесуставные проявления у больных РА.
Как видно из таблицы, только у больных РА с наличием РУ были выявлены полинейропатия (3), лимфаденопатия (8), узловатая эритема (1), иридоциклит (1), эписклерит (1), кожный васкулит (7). Все эти проявления (суммарно 21) связаны с пролиферацией Лф, иммунокомлексными и гранулематозными реакциями. У больных РА без РУ отмечались лишь 1 случай кожного васкулита и 2 случая синдрома Шегрена, сходными по патогенезу с вышеперечисленными, а преобладали внесуставные проявления, связанные с неспецифическим воспалением и интоксикацией (лихорадка, потеря массы тела, анемия).
РФ был обнаружен у 80 из 85 больных (94,1%) группы РА с наличием РУ и у 31 из 35 (88,60%) пациентов группы РА без РУ. Преобладание высоких титров РФ (1:640 и выше) у пациентов с РУ не достигло статистической достоверности (табл. 8).
Таблица 8.
| Группа | РФ не об-наружен n/% | 1:40 n/% | 1:80 n/% | 1:160 n/% | 1:320 n/% | 1:640 n/% | 1:1280 n/% | более 1:1280 n/% |
| РА с РУ n=85 | 5 5,9% | 2 2,3% | 6 7,1% | 7 8,2% | 18 21,2% | 23 27,1% | 22 25,9% | 2 2,4% |
| РА без РУ n=35 | 4 11,4% | 2 5,7% | 5 14,3% | 6 17,1% | 7 20,0% | 6 17,1% | 5 14,3% | 0 0% |
Процентное соотношение титров РФ у больных РА
Примечание: в таблице учтены максимальные значения титров РФ за период наблюдения.
Уровень IgG, IgА, IgM был достоверно повышен в обеих группах РА по сравнению с контролем (табл. 9).
Таблица 9.
| Ig группа | IgG (г/л) | IgA (г/л) | IgM (г/л) |
| РА с наличием РУ (n=30) | 17,72* ± 1,32 | 4,14 ± 0,34 | 2,83 ± 0,17 |
| РА без РУ (n=32) | 20,98 ± 0,89 | 4,93 ± 0,32 | 3,01 ± 0,18 |
| Здоровые (n=20) | 14,67 ± 0,56 | 3,14 ± 0,18 | 1,57 ± 0,10 |
Содержание иммуноглобулинов A, M, G в крови больных РА.
Примечание: * - р<0,05 по сравнению с группой РА без РУ; - р<0,05 по сравнению со здоровыми; - р<0,005 по сравнению со здоровыми; р<0,0001 по сравнению со здоровыми
У больных РА без РУ уровень IgG достоверно превышал таковой у больных РА с наличием РУ. Более низкий уровень IgG у больных РА с наличием РУ, возможно, связан с более высокими титрами РФ (являющегося антителом к IgG) у этих больных.
Исследование рецепторного фенотипа лимфоцитов ПК больных РА проводилось по уровню экспрессии кластеров дифференциации (антигенов CD): основных маркеров Т- и В-лимфоцитов (CD3, CD19), маркеров активации (CD25, HLA-DR, CD38), дифференцировки (CD4, CD8), адгезии (CD2) и созревания (CD10). Определению фенотипа предшествовал подсчет содержания лимфоцитов в периферической крови больных в абсолютных значениях и в процентном соотношении. У больных РА с наличием РУ количество лимфоцитов было достоверно ниже (1132,0±97,1, р=0,005), чем у больных РА без РУ. В процентном соотношении обе группы достоверно (р=0,0001) отличались от контроля. Содержание субпопуляций лимфоцитов периферической крови больных РА с наличием РУ и без РУ в процентном соотношении и в абсолютных значениях представлено соответственно в табл. 10 и 11.
У больных РА без РУ отмечалось достоверное повышение процентных показателей HLA-DR (р<0,001), CD19 (р<0,0001), CD25 (р<0,01), CD2 (р<0,005) и CD10 (р<0,0001) по сравнению с контрольной группой здоровых лиц. У больных РА с наличием РУ по сравнению с контролем был повышен уровень СD4 (р<0,005), CD10 (р<0,0001), CD25 (р<0,0001), CD19 (р<0,05), HLA-DR (р<0,05) и CD2 (р<0,05).
У больных РА с наличием РУ отмечалось достоверное снижение уровня экспрессии CD3 как по сравнению со здоровыми лицами, так и по сравнению с РА без РУ (табл. 10 и 11). Методом корреляционного анализа выявлена обратная зависимость экспрессии CD3 от признака множественности РУ у больных РА: больший уровень экспрессии CD3 наблюдался при единичных РУ, меньший уровень – при множественных РУ (рис. 1).
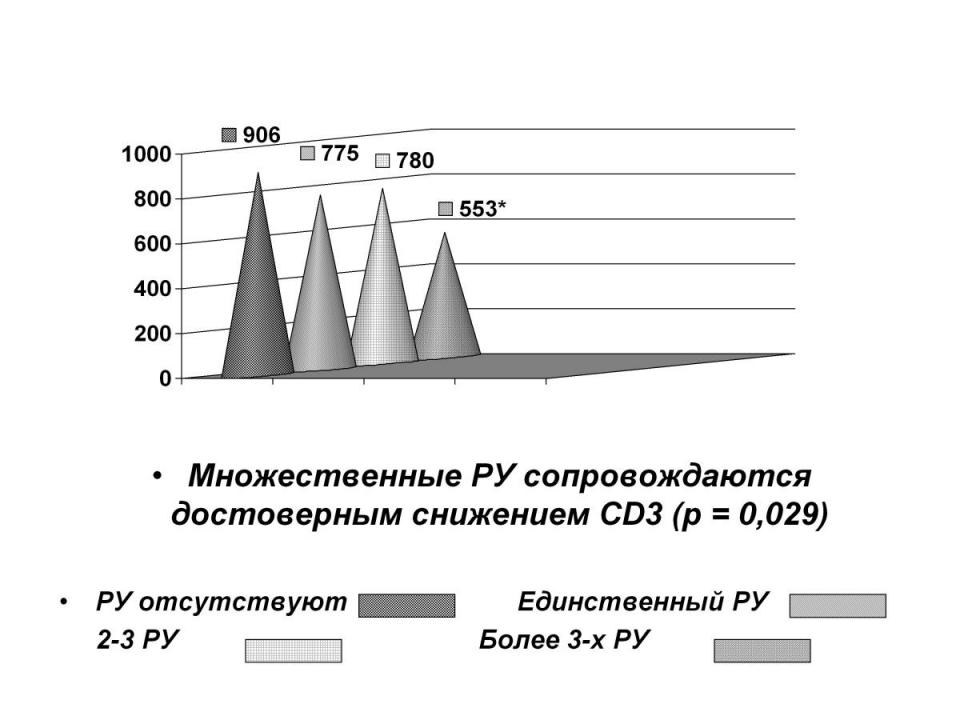
Рисунок 1. Зависимость экспрессии CD3 от признака множественности РУ у больных РА
Экспрессия дифференцировочных рецепторов. Абсолютные значения количества клеток, несущих CD4 и CD8, у больных РА с наличием РУ было меньше, чем в группе РА без РУ, тогда как процентное содержание CD4+, CD8+ клеток у первых превышало таковое у вторых и у здоровых лиц (табл. 10 и 11). Таким образом, уровень дифференцировочных маркеров CD4 и CD8 в группе РА с наличием РУ не был пониженным, в этой связи вышеописанное достоверное снижение у них уровня CD3 вряд ли обусловлено Т-клеточным иммунодефицитом и может быть объяснено: а) повышенной миграцией клеток CD3+ из ПК в ткани; б) более низкой плотностью CD3+ на клетках по сравнению с плотностью экспрессии CD4 и CD8; в) наличием в крови больных РА необычных клеток, ко-экспрессирующих рецепторы CD4 и CD8. Такое объяснение косвенно подтверждается наличием обратной кор-реляционной зависимости между уровнем CD3 и множественностью РУ.
Экспрессия адгезивного рецептора CD2. Процентное содержание клеток CD2+ у всех больных РА было достоверно снижено (р<0,005 в группе РА без РУ, р<0,05 в группе РА с наличием РУ) по сравнению со здоровыми лицами. В абсолютных значениях содержание лимфоцитов CD2+ у всех больных РА не имело достоверных различий от контроля, (табл. 10 и 11).
Таблица 10.
| Группа | CD3 | CD19 | CD4 | CD8 | CD2 | HLADR | CD25 | CD10 | Лф |
| РА с РУ n=25 | 58,1 ±13,8 | * 21,7 ±9,4 | *** 53,9 ±11,9 | 23,6 ±16,2 | * 61,0 ±13,8 | * 31,5 ±18,4 | **** 28,1 ±14,2 | **** 22,8 ±14,6 | **** 18,7 ±8,0 |
| РА без РУ n=25 | 62,0 ±11,1 | **** 24,5 ±7,5 | 50,6 ±12,5 | 20,8 ±9,9 | *** 59,3 ±13,3 | *** 33,0 ±12,9 | ** 23,8 ±12,6 | **** 21,8 ±13,5 | **** 19,9 ±7,2 |
| Здоро-вые n=25 | 4,2 ±11,2 | 17,0 ±4,8 | 45,5 ±6,9 | 22,4 ±6,6 | 69,3 ±7,9 | 21,9 ±9,1 | 15,4 ±7,1 | 3,1 ±2,7 | 29,2 ±6,1 |
CD-маркеры лимфоцитов больных РА в процентном соотношении
Примечание: * - р<0,05 по сравнению со здоровыми; ** - р<0,01 по сравнению со здоровыми; *** - р< 0,005 по сравнению со здоровыми; **** - р <0,0001 по сравнению со здоровыми
Таблица 11.
| Группа | CD3 | CD19 | CD4 | CD8 | CD2 | HLA-DR | CD25 | CD10 | Лф |
| РА с РУ n=25 | * 691,2 ±63,5 | 275 ±41,9 | 638,8 ±68,7 | 246,0 ±29,3 | 750,0 ±77,4 | 406,9 ±61,9 | * 309,8 ±32,4 | *** 270,8 ±43,0 | 1132 ±97,1 |
| РА без РУ n=25 | 961,2 ±82,5 | ** 405,0 ±44,1 | * 811,8 ±72,6 | 358,6 ±53,2 | 971,2 ±86,9 | *** 601,2 ±73,6 | * 394,4 ±50,7 | *** 389,2 ±62,0 | 1608 ±121 |
| Здоро вые n=25 | 858,5 ±50,6 | 232,2 ±16,6 | 602,5 ±36,8 | 314,8 ±29,1 | 931,2 ±60,7 | 286,5 ±24,8 | 220,2 ±23,3 | 40,8 ±9,7 | 1365 ±82,2 |
CD-маркеры лимфоцитов больных РА в абсолютных значениях.
Примечание: *- р<0,05 по сравнению со здоровыми; ** - р<0,005 по сравнению со здоровыми; ***- р<0,0001 по сравнению со здоровыми; - р<0,05 по сравнению с другой группой больных РА; - р<0,005 по сравнению с РА без РУ
Экспрессия маркеров созревания Т- и В- лимфоцитов: в обеих группах больных РА отмечалось достоверное многократное повышение содержания клеток CD10+ по сравнению со здоровыми лицами (р=0,0001) (табл. 10 и 11). Т-лимфоциты CD10+ являются незрелыми и в норме не покидают тимус.
Экспрессию маркеров активации изучали по содержанию лимфоцитов, несущих CD25+ - (цепь рецептора к интерлейкину-2). Уровень клеток CD25+ в обеих группах больных РА достоверно превышал контроль как в процентном соотношении, так и в абсолютных значениях, группы больных РА между собой отличались недостоверно (табл. 10 и 11).
В обеих группах РА, но с заметным преобладанием в группе без РУ отмечался рост клеток HLA-DR+. У больных РА без РУ значения НLА-DR+ превышали контроль как в процентном соотношении (р<0,01), так и в абсолютных значениях (р<0,0001) (табл. 10 и 11), а у больных РА без РУ статистически достоверные отличия от здоровых лиц имело только процентное содержание клеток НLА-DR+ (р<0,001).
Таким образом, в обеих группах больных РА отмечалось достоверное повышение уровня лимфоцитов, несущих рецепторы активации (CD25, HLA-DR) и многократное повышение уровня лимфоцитов, несущих рецепторы созревания (CD10+) по сравнению с контролем. Циркуляция в периферической крови клеток CD10+ ранее описана лишь при некоторых формах лейкозов. Нельзя исключить, что преждевременно вышедшие из тимуса незрелые лимфоциты, циркулирующие в крови больных РА, при взаимодействии с элементами микроокружения активируются, проявляют повышенную адгезивную способность, участвуют в развитии аутоиммуноагрессии.
Адгезия лимфоцитов больных РА к эпителиальным клеткам в культуре in vitro. У больных РА с наличием РУ и РА без РУ исследована адгезивная способность лимфоцитов периферической крови при их инкубации в культуре in vitro с клетками эпителия тимуса (ТЭК), легких и кожи. Клетки эпителия тимуса были выбраны нами в связи с выявлением в крови больных РА с наличием и без РУ лимфоцитов, несущих рецептор CD10, свойственный незрелым тимоцитам. Контролем служила реакция взаимодействия ТЭК с тимоцитами человека и с лимфоцитами крови здоровых лиц. В контрольном эксперименте при взаимодействии ТЭК с тимоцитами адгезия составляла 65-80%, при взаимодействии ТЭК с лимфоцитами здоровых лиц розетки образовывали всего в 12,7±2,9% клеток. Лимфоциты обеих групп больных РА имели значительную тропность к ТЭК (разброс результатов от 14 до 45% клеток (табл. 12)).
Таблица 12.
| Клетки Группа | ТЭК n (%) | Фибробласты n (%) | Эпителий легких n (%) |
| РА с наличием РУ | 17 (28,12%) | 12 (15,6%) | 13 (28,4%) |
| РА без РУ | 18 (27,30%) | 5 (20,0%) | 9 (22,9%) |
| Здоровые лица | 8 (10,75%) | 5 (4,6%) | 5 (5,8%) |
Результаты реакции розеткообразования.
Так как СD2 является одной из основных адгезивных молекул, то с целью оценки его участия в реакции адгезии, у ряда больных (5 больных РА с наличием РУ и 2 больных РА без РУ) мы предварительно инкубировали лимфоциты периферической крови с антителами к рецептору СD2. Степень адгезии заметно ослабевала, ее значения приближались к результатам в группе контроля. Изложенное позволяет отнести лимфоциты, участвующие в реакции с ТЭК, к Т-клеткам.
Показатели адгезии в обеих группах больных РА были значительно выше, чем у здоровых лиц (р<0,05 в обоих случаях), однако, не имели достоверных различий между группами больных РА. Адгезия лимфоцитов больных РА обеих групп к ТЭК была несколько выше, чем к эпителию легких и фибробластам. Однако и в этих случаях результаты больных РА кратно превосходят контрольные значения. Дальнейшее изучение адгезивной способности лимфоцитов периферической крови больных РА с наличием РУ при их сокультивировании с клетками макрофагально-гистиоцитаного происхождения и изучение, наряду с CD2, роли других молекул адгезии, которые опосредуют межклеточные взаимодействия (рецепторы группы интегринов), позволит расширить представления о патогенезе и роли РУ.
Выводы:
- У больных РА с ревматоидными узелками преобладают внесуставные проявления, обусловленные экспансией лимфоцитов в тканях: лимфаденопатия, иридоциклит, узловатая эритема, кожный васкулит; тогда как у больных РА без ревматоидных узелков преобладают лихорадка, потеря массы тела, анемия, развитие которых преимущественно связано с неспецифическим воспалением и общей интоксикацией.
- У больных РА с ревматоидными узелками выявлено достоверное снижение количества Т-лимфоцитов, несущих основной дифференцировочный маркер CD3, как по сравнению с больными РА без ревматоидных узелков, так и со здоровыми лицами. У больных РА с множественными ревматоидными узелками количество CD3 достоверно ниже, чем с единичными ревматоидными узелками.
- Серопозитивность по РФ установлена у 94,1% больных РА с ревматоидными узелками и у 88,6% больных РА без ревматоидных узелков. Количество больных с титрами РФ 1:640 и выше преобладало в группе РА с ревматоидными узелками. В этой же группе отмечался достоверно более низкий уровень IgG по сравнению с группой РА без ревматоидных узелков.
- На лимфоцитах периферической крови больных РА без ревматоидных узелков выявлена повышенная в 10 раз по сравнению со здоровыми лицами экспрессия рецептора незрелых лимфоцитов CD10. У больных РА с ревматоидными узелками уровень экспрессии CD10 был повышен в 7 раз по сравнению со здоровыми.
- Лимфоциты периферической крови больных РА, независимо от наличия ревматоидных узелков, имеют свойство образовывать клеточные ассоциации в виде розеток с эпителиальными клетками тимуса, легких и фибробластами, что свидетельствует о наличии на их поверхности адгезивных рецепторов, участвующих в патогенезе ревматоидного синовита и в формировании ревматоидной гранулемы.
Практические рекомендации:
1. При анализе иммунограмм больных РА целесообразно одновременно определять уровень экспрессии рецепторов дифференцировки, активации, созревания и адгезии, так как у больных РА, как правило, имеется одновременное нарушение всех этих процессов. У больных РА с наличием РУ целесообразно проводить комплексную оценку экспрессии дифференцировочных маркеров (CD3, CD4, CD8), так как изолированное снижение CD3+ у больных с ревматоидными узелками является не свидетельством иммунодефицита, а следствием миграции клеток из крови в ткани на фоне активности РА.
2. Снижение экспрессии CD3 на лимфоцитах периферической крови больных РА может служить предиктором формирования множественных ревматоидных узелков.
3. Реакция адгезии лимфоцитов периферической крови больных РА к культурам эпителиальных клеток, может быть рекомендована в качестве дополнительного метода для подтверждения диагноза у больных ранним РА.
Список научных работ по теме диссертации:
1. Булдакова Ю.Р., Алиханов Б.А., Головизнин М.В., Тимофеев В.Т. Фенотип лимфоцитов при ревматоидном артрите и саркоидозе.//Научно-практическая ревматология, приложение к №2, материалы Конгресса ревматологов Росиии, г. Саратов, 2003 г., с. 18.
2. Булдакова Ю.Р., Тимофеев В.Т., Алиханов Б.А., Головизнин М.В. Иммуномониторинг – ключ к выбору терапии ревматодного артрита с учетом клинических вариантов течения.//Материалы конгресса «Человек и лекарство», Москва, 19-23 апреля 2004 г., с. 98
3. Головизнин М. В., Тимофеев В.Т., Булдакова Ю.Р., Шарова Н.И. Оценка уровня и свойств незрелых Т-лимфоцитов крови у больных системными аутоиммунными заболеваниями как потенциальный метод контроля иммунокорригирующей терапии.//Эфферентная, иммунокорригирующая и интенсивная терапия в клинической практике. В сборнике научных трудов Всероссийской научно-практической конференции с международным участием, 2004 г., Ижевск, с. 54-55.
4. Булдакова Ю.Р., Тимофеев В.Т., Алиханов Б.А., Головизнин М.В. Иммуномониторинг как стандарт обследования и основа для выбора терапии больных ревматоидным артритом.//Материалы конгресса «Человек и лекарство», Москва, 18-22 апреля 2005 г., с. 74
5. Головизнин М. В. Шарова Н.И., Лахонина Н.С., Булдакова Ю.Р, Тимофеев В.Т., Стрюк Р.И., Ярилин А.А. Т-лимфоциты с атипичным «незрелым» фенотипом у больных системными заболеваниями соединительной ткани.//Сборник трудов Всероссийской научно-практической конференции «Контроль инфекций», Москва, 2005, с.12
6. Goloviznin M.V., Timofeev V.T., Buldakova Y.R., Sharova N.I. The level and properties of peripheral blood immature T-lymphocytes in patients with systemic autoimmune diseases (Уровень и особенности незрелых Т-лимфо-цитов периферической крови пациентов с системными аутоиммунными заболеваниями).//Ann Rheum Dis 2005; 64, Suppl III, 129.
7. Goloviznin M., Buldakova Y., Timofeev V., Shmidt E., Sharova N., Lachonina N. Common autoimmune features of peripheral blood lymphocytes in sarcoidosis and rheumatoid arthritis. (Лимфоциты периферической крови больных саркоидозом и ревматоидным артритом: общие признаки аутоиммунизации)//XIV Congreso Latinoamericano de Alergia, Asma e Inmunologa, XIX Congreso Nacional de Alergia e Inmunologa. XXX Jornadas Anuales de la AAAelC, 18/08/06 Quinquela, Volumen 37, Supl. 2, 2006, р. 67.
8. Булдакова Ю.Р., Головизнин М.В., Тимофеев В.Т. Ревматоидный артрит: клинико-иммунологические показатели больных с ревматоидными узелками.//Материалы Третьей научно-практической конференции «Про-блемы современной ревматологии». ГКГ МВД России, Москва, 2006, с. 50.
9. Булдакова Ю.Р., Тимофеев В.Т., Головизнин М.В., Алиханов Б.А. Саркоидоз и ревматоидный артрит: CD-фенотип лимфоцитов.// Матери-алы конгресса «Человек и лекарство», Москва, 3-7 апреля 2006 г., с. 79.
10. Тимофеев В.Т., Головизнин М.В., Булдакова Ю.Р., Алиханов Б.А. Ревматоидный артрит: клинико-иммунологическая характеристика больных с внесуставными проявлениями.//Вестник Российского государственного медицинского университета, 2006, №1, с. 10-14.
11. Булдакова Ю.Р., Головизнин М.В., Тимофеев В.Т., Шмидт Е.И., Лахонина Н.С. Ревматоидный артрит и саркоидоз: сходство и различие клинико-иммунологических показателей»//Материалы Четвертой научно-практической конференции «Проблемы современной ревматологии». ГКГ МВД России, Москва, 2007 г., с. 14
12. Головизнин М.В., Лахонина Н.С., Стрюк Р.И., Булдакова Ю.Р, Шарова Н.И., Ярилин А.А. Новый подход к анализу иммунного статуса больных ревматоидным артритом с учетом нарушения созревания и селекции Т-лимфоцитов.//Материалы Четвертой научно-практической конференции «Проблемы современной ревматологии». ГКГ МВД России, Москва, 2007, с. 38.
13. Головизнин М.В., Лахонина Н.С., Стрюк Р.И., Шарова Н.И., Булдакова Ю.Р., Тимофеев В.Т., Ярилин А.А. Нарушение созревания Т-лимфоцитов как один из факторов патогенеза системных аутоиммунных заболеваний// Материалы Пятой научно-практической конференции «Проблемы современной ревматологии». ГКГ МВД России, Москва, 2008 г., с. 58.
14. Goloviznin M., Buldakova Y., Timofeev V., Stryuk R., Lachonina N. //Immunological basis of compatibility of extraarticular manifestations in patients with nodular variant of rheumatoid arthritis. Иммунологическая основа развития экстраартикулярных проявлений РА у больных с ревматоидными узелками.//The 13th Congress of Asia Pacific League of Associations for Rheumatology, International Journal of Rheumatic Diseases, 2008, II (Suppl. I), р. 92.
15. M. Goloviznin N., Lachonina N., Timofeev V., Stryuk R., Buldakova Y.. The study of T-cell positive selection in systemic autoimmune diseases. Исследование положительной Т-клеточной селекции при системных аутоиммунных заболеваниях.//Тhe 13th Congress of Asia Pacific League of Associations for Rheumatology, International Journal of Rheumatic Diseases, 2008, II (Suppl. I), р. 336.

