Особенности деструкции опухоли на модели экспериментальной аденокарциномы эрлиха при фотодинамической терапии с сенсибилизатором второго поколения группы хлоринов
На правах рукописи
БИКБОВ
Эльмир Надирович
ОСОБЕННОСТИ ДЕСТРУКЦИИ ОПУХОЛИ НА МОДЕЛИ ЭКСПЕРИМЕНТАЛЬНОЙ АДЕНОКАРЦИНОМЫ ЭРЛИХА ПРИ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ С СЕНСИБИЛИЗАТОРОМ ВТОРОГО ПОКОЛЕНИЯ ГРУППЫ ХЛОРИНОВ
14.01.12 – Онкология
14.03.02 – Патологическая анатомия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Уфа – 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
Научные руководители:
доктор медицинских наук, профессор Привалов Валерий Алексеевич;
доктор медицинских наук, профессор Куренков Евгений Леонидович
Официальные оппоненты:
доктор медицинских наук, профессор Пухов Александр Григорьевич
доктор медицинских наук, профессор Михалева Людмила Михайловна
Ведущее учреждение – Государственное образовательное учреждение высшего профессионального образования «Уральская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
Защита состоится: «___» ____________2010г. в ___ часов на заседании диссертационного совета Д 208.006.04 при Государственном образовательном учреждении высшего профессионального образования «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» по адресу: 450000, г. Уфа, ул. Ленина, 3.
С диссертацией можно ознакомиться в научной библиотеке Государственного образовательного учреждения высшего профессионального образования «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию».
Автореферат разослан «___» ___________ 2010 г.
Ученый секретарь
диссертационного совета Рахматуллина И.Р.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Злокачественные новообразования являются одной из наиболее сложных медико-социальных проблем современного общества. По данным международного агентства по изучению рака (МАИР), в мире прогнозируется увеличение заболеваемости злокачественными новообразованиями с 10 млн в год, регистрируемых в настоящее время, до 15 млн к 2020-му году. Одновременно смертность может возрасти с 6 до 9 млн случаев в год.
Неблагоприятные демографические тенденции и сложная экологическая обстановка сопровождаются неуклонным ростом числа онкологических заболеваний, в тоже время раннее лечение злокачественных новообразований дает гораздо лучший прогноз.
В последние годы генеральной концепцией клинической онкологии является органосохраняющее лечение опухолей [Чиссов В.И., 2002]. Арсенал методов, позволяющих проводить органосохраняющее лечение, расширился, благодаря принципиально новому методу лечения – фотодинамической терапии. Фотодинамическая терапия [ФДТ] основана на деструкции злокачественных новообразований в результате возникновения ряда фотохимических реакций при взаимодействии различных видов светового излучения определенных длин волн и лекарственного препарата –
фотосенсибилизатора, избирательно накапливающегося в опухолевой ткани [Вакуловская Е.Г. и др., 2004; Тиглиев Г.С. и др., 2004].
В своем современном виде фотодинамическая терапия злокачественных новообразований применяется в клинической практике около 25 лет [Странадко Е.Ф. и др., 1998]. Известные ранее фотосенсибилизаторы 1-го поколения «Фотогем», «Фотофрин» – производные гематопорфирина и 2-го поколения «Фотосенс», «Фталосенс» – производные фталоцианинов имеют ряд существенных недостатков: медленное накопление в опухолевой ткани, недостаточно высокую селективность, сравнительно невысокую терапевтическую эффективность, длительный (не менее 3-х месяцев) период полувыведения из организма, что повышает риск развития тяжелых форм кожной светочувствительности и связанных с ней осложнений [Вакуловская Е.Г. и др., 2002]. Этого недостатка лишен новый фотосенсибилизатор оригинальный отечественный препарат производное тетрапиррольных макроциклов хлоринового ряда «Радахлорин», который выводится из организма на 94 % уже через сутки [Решетников А.В. и др., 2001]. Поэтому для дальнейшего развития фотодинамической терапии опухолей перспективным является изучение фотосенсибилизаторов второго поколения, производных хлоринового ряда.
Результаты доклинических пилотных исследований и первой фазы клинических испытаний «Радахлорина» свидетельствуют о хороших фотофизических свойствах, высокой фотодинамической активности и практическом отсутствии побочных эффектов данного препарата при лечении экспериментальных опухолей [Решетников А.В. и др., 2002]. Препарат изучен в эксперименте и показал высокую эффективность, хорошие спектральные, физико-химические и энергетические характеристики. Выявленные характеристики, выгодно отличают его от используемых в клинике препаратов отечественного и импортного производства. Однако до сих пор мало изученными остаются механизмы противоопухолевого действия ФДТ, имеющиеся данные позволяют рассуждать о многих аспектах ФДТ только на уровне теорий и носят поисковый характер. Отсутствие однозначного мнения по указанной проблеме делает выполнение данной работы актуальным. Исследование механизмов фотодинамического повреждения с фотосенсибилизатором второго поколения хлоринового ряда ранее проводили только лишь на культурах клеток in vitro, а на тканевом уровне – на ткани «здоровой» печени крыс [Кац В.А. и др., 1996; Каплан М.А., 2004].
Цель исследования
Определить механизмы формирования некроза опухоли, лежащие в основе фотодинамического повреждения при использовании Радахлорина в эксперименте на лабораторных животных с перевитой опухолью.
Задачи исследования
- Оценить возможность использования аденокарциномы Эрлиха перевитой мышам линии Balb/c, в качестве модели экспериментальной опухоли для изучения фотодинамических эффектов нового фотосенсибилизатора Радахлорин.
- На основе динамического клинико-морфологического исследования экспериментальной аденокарциномы Эрлиха определить особенности формирования и развития некроза опухоли в результате фотодинамической терапии с препаратом Радахлорин.
- На основании полученных данных определить некоторые механизмы некробиоза опухоли после фотодинамической терапии с фотосенсибилизатором «Радахлорин».
Научная новизна
Впервые в эксперименте на перевиваемых опухолях у мышей проведена клинико-морфологическая оценка эффективности фотодинамической терапии с фотосенсибилизатором второго поколения Радахлорин. На модели экспериментальной аденокарциномы Эрлиха подробно описаны клинические изменения в опухоли после фотодинамической терапии с момента облучения до отторжения некротизированной опухоли и формирования рубца. Впервые описаны морфологические проявления эффектов фотодинамической терапии на опухоль в динамике с момента облучения лазером опухоли до ее некроза и отторжения. Определены механизмы и стадии некробиоза опухоли в результате фотодинамической терапии. В генезе фотодинамического повреждения опухоли первостепенное значение имеют расстройства гемодинамики, протекающие стадийно и определяющие развитие некроза.
Разработана классификация этапов некробиоза опухоли после фотодинамической терапии на основе сопоставления клинических наблюдений и морфологических изменений в опухоли после фотодинамической терапии.
Данная работа на экспериментальной модели опухоли in vivo выполнена впервые.
Практическая значимость
Полученные сведения могут служить основой новых исследований по изучению фотосенсибилизаторов хлоринового ряда и фотодинамической терапии с их использованием. Выявленный сосудистый механизм повреждения опухоли обосновывает возможность проведения фотодинамической терапии в качестве предварительного этапа комбинированного лечения, когда высок риск гематогенного метастазирования, а также для повышения абластики и антибластики во время операции и после нее на «ложе» опухоли. Кроме того, фотодинамическую терапию с сенсибилизаторами хлоринового ряда можно рекомендовать для клинических испытаний в лечении сосудистых новообразований.
Представленные результаты исследования обосновывают перспективность и целесообразность клинического применения с сенсибилизаторами группы хлоринов фотодинамической терапии злокачественных опухолей.
Внедрение результатов исследования в практику
Полученные результаты изучения механизмов формирования некрозов опухоли при фотодинамической терапии с Радахлорином внедрены в учебный процесс кафедр общей хирургии и патологической анатомии Челябинской государственной медицинской академии.
Апробация работы
Основные положения диссертации доложены на заседании Челябинского областного общества хирургов (Челябинск, 2009), на научно-практической конференции молодых ученых (Челябинск, 2009).
Публикации
По результатам исследования опубликованы 4 научные работы, в том числе 1 в издании, рекомендованном ВАК Министерства образования и науки РФ.
Соответствие диссертации паспорту научной специальности
Научные положения диссертации соответствуют формуле специальности 14.01.12 – «Онкология» (медицинские науки). Результаты проведенного исследования соответствуют области исследования данной специальности, конкретно пунктам 2, 6 паспорта научной специальности.
Научные положения диссертации также соответствуют формуле специальности 14.03.02 – «Патологическая анатомия» (медицинские науки). Результаты проведенного исследования соответствуют области исследования данной специальности, конкретно пункту 1 паспорта научной специальности.
Основные положения диссертации, выносимые на защиту
- Экспериментальная аденокарцинома Эрлиха является адекватной моделью злокачественной опухоли для оценки фотодинамических эффектов с фотосенсибилизатором Радахлорин.
- В эксперименте на перевиваемых опухолях мышей установлены закономерности клинико-морфологических проявлений повреждающего некробиотического действия фотодинамической терапии на злокачественную опухоль, в основе которых лежит гипоксическое повреждение опухоли, опосредованное расстройствами микроциркуляторного русла.
- Морфологические и морфометрические исследования позволяют в динамике оценить патогенетические механизмы некробиоза опухоли при фотодинамической терапии.
Объем и структура работы
Работа представлена на 145 страницах, содержит 8 таблиц и 40 рисунков. Список литературы содержит 299 источников, в том числе 152 отечественных и 147 зарубежных. Диссертация состоит из введения, обзора литературы (одна глава), собственных исследований (четыре главы), выводов и практических рекомендаций.
Личный вклад автора
Все исследования, указанные автором в диссертации, обработка, анализ и оценка результатов выполнены лично автором.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы
Работа выполнена на базе центральной научно-исследовательской лаборатории ЧелГМА с 2006 по 2009 год. Все манипуляции на экспериментальных животных проводили в соответствии с требованиями Этического комитета ГОУ ВПО «Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова», разработанными на основе Хельсинской декларации Всемирной медицинской ассоциацией.
В рамках эксперимента проведена оценка клинических и морфологических эффектов ФДТ на экспериментальной модели злокачественной опухоли.
В работе использовались лабораторные мыши с перевитой подкожно аденокарциномой Эрлиха.
Асцитическую жидкость от мышей-доноров, содержащую большое количество опухолевых клеток вводили подкожно, для воспроизведения солидной подкожной опухоли. Всего в работе использовано 195 особей (таблица 1). Пятнадцать мышей, которым внутрибрюшинно вводили асцитическую жидкость, использовались нами в качестве доноров опухолевого материала. Эти особи становились донорами опухоли после развития у них опухолевого асцита.
Для отработки оптимального разведения асцитической жидкости при воспроизведении солидной опухоли у мышей нами использовались 30 особей. Клетки опухоли данным мышам вводились подкожно в спинку.
Оставшимся 150 мышам перевивали подкожно аденокарциному Эрлиха, 28 из них погибли в ближайшие сутки после перевивки, у 11 особей опухоль не соответствовала необходимым требованиям по размерам, и только 111 особей включены в основной эксперимент.
Таблица 1 – Мыши, использованные в эксперименте
| Мыши-доноры (n=15) | Подбор оптимального разведения (n=30) | Мыши с подкожно перевитой опухолью Эрлиха (n=150) | |||
| погибли после перевивки (n=28) | отбракованы по размеру (n=11) | включены в эксперимент (n=111) | |||
| клиническая часть эксперимента (n=24) | морфологическая часть эксперимента (n=87) | ||||
| 15 | 30 | 28 | 11 | 24 | 87 |
| итого | 195 | ||||
Итак, в эксперимент включены 111 мышей с перевитой подкожно аденокарциномой Эрлиха, 87 из них использованы в морфологической части эксперимента, 24 особи – в клинической части.
Для оценки эффектов ФДТ мыши распределены по 4 группам: основная и три контрольные группы.
В основную, «экспериментальную» группу включены мыши, которым проводили лечение перевитой опухоли Эрлиха методом ФДТ.
Вторую группу животных составили контрольные мыши, которым Радахлорин вводился в тех же дозах, что и в первой группе, но облучение лазером не проводилось (1-я контрольная группа).
Третью группу составили контрольные мыши, которым ФС не вводился, а облучение лазером проводилось, как и в первой группе (2-я контрольная группа).
Последнюю, четвертую группу исследования, или третий контроль, составили особи с перевитой аденокарциномой Эрлиха, которым не проводилось никакого лечения – интактная опухоль. У животных этой группы мы в первую очередь оценивали прогрессирование опухоли и сроки выживания «не леченных» животных.
В клинической части эксперимента 24 особи распределены по группам следующим образом. 9 мышей составили основную группу, которым проведена ФДТ, 6 мышей составили группу особей, облученных лазером без введения Радахлорина, еще 6 мышей составили группу животных, получивших Радахлорин без облучения лазером и 3 особи – контрольную группу «интактная опухоль».
Для оценки динамики морфологических изменений в опухоли после ФДТ использованы 87 мышей, которые аналогично клиническому этапу исследования также разделены на 4 группы. Для выявления механизмов формирования некроза опухоли после ФДТ мышей выводили из эксперимента в различные сроки по 3 особи через 5 и 30 минут, через 1, 3, 6, 12, 24 часа, а также через 7 и 28 суток после облучения лазером (таблица 2).
Таблица 2 – Группы исследования
| Сроки выведения животных из эксперимента (после обучения) | Группы исследования* (мыши) | ||
| основная группа – после ФДТ (n=30) | 1-я контрольная группа – после введения Радахлорина (n=30) | 2-я контрольная группа – после облучения лазером без введения Радахлорина (n=27) | |
| 5 минут | 3 | 3 | 3 |
| 30 минут | 3 | 3 | 3 |
| 1 час | 3 | 3 | 3 |
| 3 часа | 3 | 3 | 3 |
| 6 часов | 3 | 3 | 3 |
| 12 часов | 3 | 3 | 3 |
| 24 часа | 3 | 3 | 3 |
| 3 суток | 3 | 3 | 3 |
| 7 суток | 3 | 3 | 3 |
| 28 суток | 3 | 3 | |
*Четвертую группу (не включена в таблицу) – 3-й контроль (интактная опухоль) составили 3 мыши, которые в рамках эксперимента выведены из опыта для морфологической оценки солидной «нетронутой» опухоли.
В эксперименте для фотодинамической терапии в качестве сенсибилизатора второго поколения группы хлоринов нами использован препарат «Радахлорин», разработанный в лабораториях российской фармацевтической компании ООО «РАДА-ФАРМА».
Препарат «Радахлорин» содержит комплекс соединений ряда циклических тетрапирролов с гидрированным кольцом D (хлоринов). Он является фотосенсибилизирующим средством, применяется для фотодинамической терапии злокачественных новообразований и разрешен для клинических применений (рег. номер ЛС-001868 от 04.08.2006 г.).
Препарат «Радахлорин, 0,35 %-ный раствор для внутривенного введения» вводили внутрибрюшинно в дозе 40 мг/кг массы тела. Дозу препарата определяли по общепринятой формуле пересчета дозы, принятой для пересчета на мышей с дозы на человека Dм=Dч . 40, где Dм – доза для мыши (мг/кг), Dч – доза для человека (мг/кг), 40 – общепринятый в экспериментах на мышах коэффициент пересчета. По этой формуле получаем: Dм=40 . 1=40 мг/кг.
В качестве источника света для ФДТ использовался лазерный диодный модуль «ML662-SP» (синонимы: Лахта, Милон 500-СП), производимый ЗАО «Милон Лазер» (Санкт-Петербург), на основе лазерного фотокоагулятора ФЛОД-1, имеющего сертификат Минздрава РФ c излучением на длине волны 662 нм, мощность 3 Вт.
Для доставки света к опухоли использовались моноволоконные кварцевые световоды с микролинзой, которые дают круговую диаграмму рассеивания с четкой границей светового пятна.
Перед облучением всем животным проводилась депиляция кожи в зоне засветки методом выщипывания. Проведение ФДТ не требовало наркотизации животного ввиду кратковременности облучения (от 90 до 120 сек). Облучение начинали через 2 – 3 часа после введения ФС с контролем пика накопления с помощью прямой спектрометрии.
В результате ранее проведенных преклинических испытаний было доказано, что при дистанционном лазерном облучении и использовании световой дозы 150 Дж/см2 получен слабый эффект поражения опухолей, вместе с тем полный некроз опухли с последующим образованием струпа наблюдался в группе животных, получивших световую дозу 300 Дж/см2 [Решетников А.В. и др., 2002]. Кроме того, первые клинические испытания препарата при лечении базально-клеточного рака кожи показали эффективность фотодинамической терапии при световой дозе в 200 Дж/см2 [Кочнева Е.В., Привалов В.А., 2004]. Поэтому в эксперименте мы сочли целесообразным использовать световую дозу 200 Дж/см2. При поверхностной методике облучения опухолей световая доза сильно зависит от координат (расстояния от излучателя до поверхности опухоли) и оптических свойств самой ткани. Аппарат для определения дозного поля в настоящее время существует только в экспериментальных работах. Поэтому при расчете световой дозы при дистанционной методике облучения мы исходили из следующего приближенного подхода. При поверхностном облучении создается объемная доза для достаточного эффекта вплоть до глубины 5 мм. Значит при толщине опухоли в 5 мм, поверхностной дозе 200 Дж/см2 и диаметре светового пятна 1 см, средняя объемная доза в зоне облучения будет составлять 400 Дж/см3.
Длительность облучения при фотодинамической терапии рассчитывали, исходя из заданной эмпирически подобранной эффективной плотности энергии подведенного излучения Е (эффективной световой дозой мы считали плотность лазерного излучения 200 Дж/см2).
Для расчета времени экспозиции применялась следующая формула:
T = E . S/P
где T – время экспозиции света (сек.); E - эффективная плотность энергии подведенного излучения (Дж = Вт . сек.); S – площадь опухоли (см2); P – выходная мощность на торце световода (Вт).
В эксперименте использована методика поверхностного (дистанционного) лазерного облучения. Световод устанавливался на таком расстоянии от поверхности опухоли, чтобы световое пятно захватывало всю опухоль и часть окружающей кожи с отступлением от видимых границ опухоли не менее 0,5 см.
Воздействие лазерным излучением производилось методом кругового поля. Световая энергия подводилась строго перпендикулярно поверхности опухоли.
Иссеченную в различные сроки после ФДТ опухоль фиксировали в 10 % нейтральном формалине в течение 24 часов. Затем производилась макроскопическая оценка опухоли. Далее кусочки опухоли обезвоживали, обезжиривали и подвергали заливке в парафин. С парафиновых блоков готовили срезы (3 – 6) толщиной 5 мкм на предметных стеклах. После депарафинирования микропрепараты окрашивали гематоксилином и эозином по стандартной методике [Пирс Э., 1962; Лилли Р., 1969]. Для выявления мукополисахаридов в эпителиоцитах и строме опухоли применяли комбинированную окраску ШИК-альциановым синим. Нейтральные мукополисахариды окрашивались ШИК-реакцией, кислые гликозаминогликаны – альциановым синим. Коллагеновые волокна идентифицировали при обработке тканевых срезов пикрофуксином по ван Гизону. Ретикулярные волокна стромы обнаруживались при импрегнации азотнокислым серебром по методу Гомори.
Иммуногистохимические исследования проводились на серийных парафиновых срезах в 20 наблюдениях. Демаскировка антигенных детерминант на депарафинированных, обезвоженных срезах проходила в течение 10 минут в СВЧ-печи в 0,01М цитратном буфере (рН 6,0). Затем срезы охлаждались в течение 30 минут, промывались в фосфатно-солевом буфере (рН 7,4). Иммунное окрашивание проводилось стрептавидин-биотиновым пероксидазным методом. Хромогеном служил DAB+ («Novocastra», Великобритания). Срезы инкубировали 24 часа с моноклональными антителами к CD34 эндотелиальных клеток. На заключительном этапе гистологические срезы докрашивались гематоксилином.
Объемную плотность эпителия, стромы, некроза, сосудистого русла, мышечной и жировой ткани определяли с использованием окулярных сеток, методом точко-счета при увеличении 400 в 5 – 10 случайно отобранных полях зрения каждого случая [Автандилов Г.Г., 1990]. Определение диаметра сосудов осуществлялось при помощи лицензионной программы анализа изображения микрообъектов «Видеотест-Морфология 5.0» (Россия).
Статистическую обработку полученных данных проводили на персональном компьютере с помощью лицензионного пакета прикладных программ «Statistica 6.0» («StatSoft, Inc.») [Реброва О.Ю., 2003]. Применялись методы вариационной статистики: определение средней арифметической, среднего квадратического отклонения, стандартной ошибки средней арифметической. Статистическая значимость различий сравниваемых признаков в группах проводилась с помощью непараметрического U-теста Манна-Уитни. Различия считались статистически значимыми при уровне р<0,05, что соответствует 95 % вероятности безошибочного прогноза.
Результаты исследования
В эксперименте использовали методы внутрибрюшинной и подкожной перевивки опухоли из культуры клеток асцитической жидкости мышей с аденокарциномой Эрлиха.
При внутрибрюшинной перевивки опухоли Эрлиха в достаточно короткие сроки (7 – 14 суток) у мышей формировался асцит. Асцитическая жидкость содержала большое количество опухолевых клеток – в 0,2 мл асцитической жидкости до 7,5 млн клеток опухоли (рисунок 1а). Мыши с опухолевым асцитом использовались в эксперименте в качестве доноров клеток аденокарциномы Эрлиха. Забор асцитической жидкости осуществлялся после лапаротомии мышей, выведенных из эксперимента.

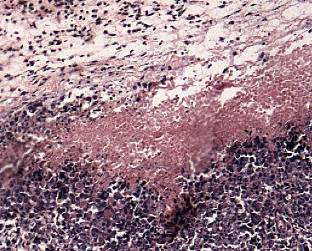
Рисунок 1 – Аденокарцинома Эрлиха при внутрибрюшинном воспроизведении
а – цитологическая картина асцитической жидкости после внутрибрюшинной перевивки аденокарциномы Эрлиха;
б – гистологическая картина канцероматозных узлов после внутрибрюшинной перевивки аденокарциномы Эрлиха. Пласты атипичных клеток на париетальной брюшине, поля опухолевых некрозов. Окраска гематоксилином и эозином (увеличение 100)
На брюшине при лапаротомии отмечены множественные, просовидные образования до 3 мм в диаметре, по типу канцероматоза. При гистологическом исследовании канцероматозных узелков, морфологическая картина полностью совпадала с картиной солидной подкожно перевитой опухолью Эрлиха (рисунок 1б).
Для подбора оптимального разведения культуры опухолевого материала нами использована асцитическая жидкость мышей – доноров в трех концентрациях: без разведения; разведение 0,9 % физиологическим раствором натрия хлорида в 3 раза и в 5 раз.
Введение культуры клеток опухоли Эрлиха во всех, указанных выше разведениях, сопровождалось развитием опухолевого асцита. Отмечена прямая зависимость сроков развития асцита от концентрации опухолевого материала: чем выше разведение, тем больше сроки формирования асцита. Таким образом, при данном методе перевивки опухоли Эрлиха, путем разведения культуры клеток мы управляли сроками подготовки мышей – доноров.
При подкожной перевивки у всех особей на разных сроках сформировалась подкожная опухоль (рисунок 2а), которая подтверждена морфологически (рисунок 2б).
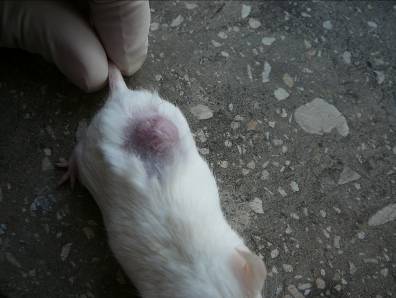
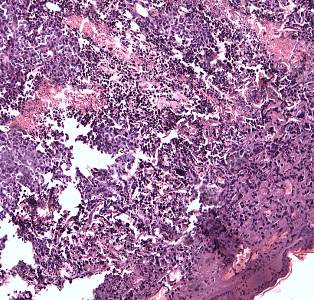
Рисунок 2 а, б – Подкожно перевитая аденокарцинома Эрлиха. 12 суток после перевивки:
а – формирование опухоли Эрлиха после подкожной перевивки, 1 см в диаметре;
б – гистологическая картина: среди пластов атипичных клеток единичные тубулярные структуры, «замурованные» пучки мышц, поля опухолевых некрозов. Окраска гематоксилином и эозином (увеличение 100)
В ходе наблюдения в течение месяца за группами мышей с подкожно перевитой культурой опухоли, наиболее подходящий для нашего эксперимента оказался метод перевивки без разведения асцитической жидкости, так как опухоль у данной группы мышей формировалась в короткие сроки с примерно одинаковым объемом и размером. Именно такая концентрация обеспечивала формирование относительно одинаковых по размерам (1 – 1,5 см в диаметре) опухолей, расположенных подкожно, у большой группы мышей в сроки 7-10 суток.
Таким образом, как при внутрибрюшной, так и при подкожной перевивки опухоли у всех животных (100 %) отмечен рост опухоли. Разведение культуры клеток опухоли влияло в первую очередь на сроки клинической манифестации опухолевого процесса: чем выше разведение, тем медленнее рост. Использование не разведенной культуры клеток опухоли Эрлиха (из асцита) оказалось наиболее адекватным для воспроизведения солидной подкожной опухоли. Кроме того, аденокарцинома Эрлиха обладает так называемым «плоским» ростом, без интенсивного распространения в глубжележащие ткани, что было важным для проведения данного эксперимента, учитывая, что эффективная глубина проникновения в биологические ткани лазерного излучения красного диапазона с длиной волны 662 нм составляет до 7 мм (рисунок 3).
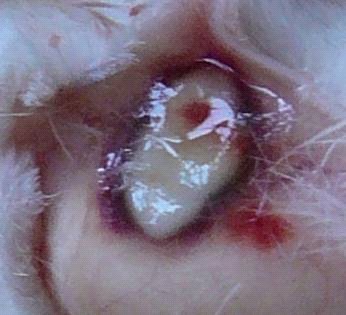

Рисунок 3 – Очаг опухоли через 14 суток после подкожной перевивки
1,5 . 1,0 см, резецирован единым блоком с кожей
Учитывая полученные данные, экспериментальная аденокарцинома Эрлиха зарекомендовала себя хорошей моделью злокачественной опухоли для оценки фотодинамических эффектов с фотосенсибилизатором Радахлорин. Опухоль хорошо воспроизводится как при внутрибрюшинной (асцитический вариант), так и при подкожной (солидный вариант) перевивки.
На клиническом этапе эксперимента нами анализированы изменения в области опухоли после ФДТ у 9 мышей основной группы животных.
В конце сеанса ФДТ поверхность опухоли, как правило, становилась бледной (ишемичной). Бледная окраска опухоли у животных основной группы сохранялась в первые часы после ФДТ, имела четкую границу и совпадала с границами опухоли, в то время как окружающая кожа имела обычную окраску. Однако уже через 1 – 2 часа после лазерного облучения бледная окраска опухоли сменялась развитием цианоза. Таким образом, бледность с последующим развитием цианоза опухоли, как реакция на облучение лазером в процессе ФДТ, выявлена у всех 9 мышей.
Как правило, спустя 3 – 6 часов после ФДТ на облученной лазером поверхности опухоли появлялись участки темного цвета, которые увеличивались в размерах, сливались между собой и участок опухоли в зоне «засветки» приобретал фиолетовый или черный цвет, что расценивалось как начало формирования геморрагического некроза (9 мышей – 100 %).
Перечисленные изменения в области опухоли после ФДТ также сопровождались развитием отека. Развитие отека начиналось постепенно, спустя несколько часов после ФДТ, по периферии опухоли, то есть на границе здоровой ткани и опухоли, а затем в самой опухоли. У 6 мышей (66,7 %), начало его отмечено через 1 – 2 часа после ФДТ с постепенным достижением максимума к концу первых, началу вторых суток. У остальных 3-х мышей (33,3 %) отек развивался спустя 3 – 4 часа. К концу 2-х суток он был наиболее выражен. Развитие отека отмечено у всех мышей основной группы.
После ФДТ наиболее выраженная фотохимическая реакция отмечалась в самой опухоли (в конечном итоге в виде развития сухого, коагуляционного некроза), интактные окружающие ткани по периферии опухоли в зоне «засветки» также реагировали появлением умеренного отека, изменением цвета кожи (по типу легкой гиперемии), но, как правило, даже при увеличении световой дозы до 400 Дж/см2, реакция окружающих тканей была менее выраженной, чем в опухоли. Это реакция была обратимой по типу ожога I степени и она купировалась самостоятельно через 3 – 4 дня. При этом не происходило формирования некрозов.
Через 7 – 14 дней у всех мышей основной группы на месте опухоли наблюдался плотный струп черного цвета с четкой демаркационной линией между окружающей кожей и некротизированной тканью новообразования (рисунок 4). Окружающие ткани полностью восстанавливали свой первоначальный вид.
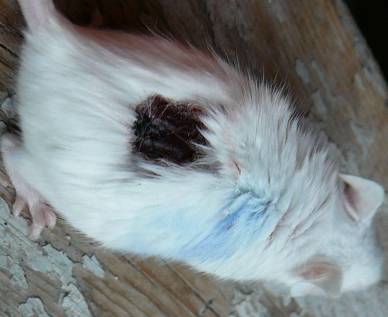
Рисунок 4 – Сухой некроз опухоли в виде черного плотного струпа, 10 суток после ФДТ
После отторжения некроза, заживление ран происходило под струпом. Сроки отторжения некроза и эпителизации зависели от первоначальных размеров опухоли.
В контрольных группах мышей изменения отмечены только у особей, облученных лазером без Радахлорина. В облученной лазером опухоли, мы наблюдали кратковременную легкую гиперемию тканей, ограниченную зоной засветки. Без фотосенсибилизатора, как неотъемлемого компонента ФДТ, в облучаемых лазером тканях воздействие последнего можно сравнить с физиотерапевтической процедурой и эффектом прогревания. Описанное явление у мышей данной контрольной группы сохранялось непродолжительное время с постепенным восстановлением обычной окраски. Признаков отека тканей в области «засветки» не отмечено. Спустя 12 часов после облучения лазером без Радахлорина у всех мышей контрольной группы, ткани в зоне «засветки» восстанавливали прежний вид и не отличались от внешнего вида опухоли других контрольных групп.
В контрольной группе мышей, которым вводили только Радахлорин без облучения, а также в контроле с интактной опухолью никаких местных изменений не наблюдалось.
У животных всех трех контрольных групп рост опухоли прогрессировал, развивался односторонний, а затем двусторонний паралич задних лап и на 14 - 15-е сутки отмечен пик гибели 2/3 животных (66,6 %) (таблица 3). Максимальная выживаемость 22 суток со дня эксперимента (32 дня с момента перевивки опухоли) в контрольных группах отмечена только у 1 мыши.
Таблица 3 – Сроки гибели животных в контрольных группах
| Сроки гибели животных от генерализации процесса, сутки | Группы исследования | ||
| 1-я контрольная группа – после введения Радахлорина (n=6) | 2-я контрольная группа – после облучения лазером (n=6) | 3-я контрольная группа – интактная опухоль (n=3) | |
| 9 | 1 | ||
| 10 | 1 | ||
| 12 | 1 | ||
| 14 | 3 | 2 | 1 |
| 15 | 2 | 1 | 1 |
| 18 | 1 | ||
| 22 | 1 | ||
При вскрытии погибших животных контрольных групп наблюдалась картина прогрессирования роста опухоли с прорастанием ее в мышцы и позвоночный канал (подтверждено морфологически), чем и объясняется наблюдаемая нами неврологическая картина и гибель животных в указанные сроки.
Выживаемость животных основной группы в сроки «свыше 28 суток» составила 100 % и она более чем в два раза (44 дня) превысила сроки выживаемости по сравнению с контрольными животными, что свидетельствует об эффективности фотодинамической терапии. Именно поэтому мы не отслеживали до конца сроки гибели каждого животного в основной группе, но практически все животные выведены из опыта не ранее чем через 50 суток после ФДТ в рамках последующих исследований.
При морфологическом исследовании в основной группе животных-опухоленосителей уже через 5 минут после проведения сеанса ФДТ преобладали функциональные расстройства кровообращения. Во всех полях зрения выявлялись спазмированные капилляры, артериолы и обширные зоны опухолевой ткани с опустошенными сосудами (рисунок 5а). Стенки артериол с палисадообразным расположением ядер эндотелия, что отражает их спастическое состояние. Средний диаметр сосудов опухоли и объемная плотность сосудистого русла уменьшались до 12,5±0,8 мкм и 7,4±0,8 % соответственно (р=0,04 при сравнении с интактной группой). Достоверных различий в объемном содержании эпителиального и стромального компонентов, некрозов в опухоли после ФДТ в эти сроки по сравнению с интактной группой не установлено (таблица 4).
Таблица 4 – Динамика морфометрических показателей структурных компонентов опухоли в интактной и основной группах исследования
| Морфометрические показатели | Средний диаметр сосудов, мкм | Объемная плотность, % | ||||
| эпителий | строма | сосудистое русло | некроз | мышечная, жировая ткань | ||
| Интактная опухоль Основная группа, после ФДТ через 5 минут 30 минут 1 час 3 часа 6 часов 12 часов 1-е сутки 3-и сутки 7-е сутки 28 сутки | 15,7±1,1 34,6±2,4 44,3±2,7 10,2±1,0 8,3±2,4 2,6±0,8 12,5±0,8* 35,4±2,3 45,8±2,6 7,4 ±0,8* 8,9±2,2 2,5±0,9 9,5±0,7* 36±2,5 46,7±2,7 5,1±0,7* 10±2,8 2,2±0,7 11,8±0,6* 30,1±1,8 47,5±2,5 6,9±0,8 13,6±3,2 1,9±0,8 22,4±2,0* 19,7±1,8 49,8±2,3 8,4±0,7 20,7±2,1* 1,4±0,7 20,5±1,3 9,2±1,4 54,3±3,0 7,7±0,8 27,1±4 1,7±0,7 18,9±1,4 9,7±1,3 55,1±3,1 5,2±0,6* 28,4±4,5 1,6±0,6 18,1±1,3 8,4±1,2 60,4±3,2 4,3±0,6 25,6±3,9 1,8±0,9 19,3±1,9 6,7±1,5 64,8±2,9 2,4±0,4* 24,6±4,8 1,5±0,7 19,5±2,9 5,2±1,6 80,8±3* 1,1±0,4* 11,8±2,6 1,1±0,3 9,2±1,3* 2,8± 0,8 95,5±1,2* 0,9±0,2 0±0* 0,8±0,4 | |||||
* - статистически значимые различия при сравнении с предыдущей группой (p<0,05).
В основной группе животных через 30 минут после ФДТ наряду с функциональными сосудистыми расстройствами развивались дистрофические и некробиотические изменения в клетках опухоли, эпидермисе. Обнаруживались отек и набухание опухолевых клеток и увеличение объемной плотности эпителия – 36,0±2,5 %; нарастание доли некрозов до 10,0±2,8 % (р>0,05). В микроциркуляторном русле наблюдалось чередование спазма и пареза на соседних участках сосуда; уменьшались средний диаметр сосуда до 9,5±0,7 % мкм (р=0,007) и объемная плотность сосудистого русла – 5,1±0,7 % (р=0,04) (рисунок 5б).
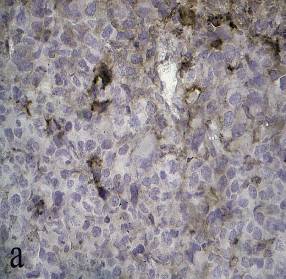
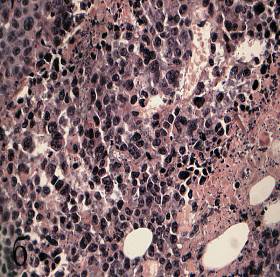
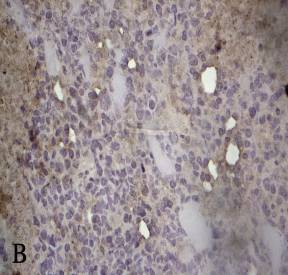
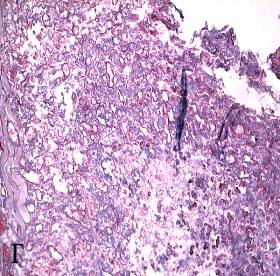
Рисунок 5 а, б, в, г – Сосудистые расстройства в опухоли Эрлиха при фотодинамической терапии
а – спазм сосудов микроциркуляторного русла, агглютинация эритроцитов в капилляре. Стрептавидин-биотиновый иммунопероксидазный метод на CD34 эндотелиальных клеток, докраска гематоксилином (увеличение 400);
б – чередование спазма и пареза на соседних участках артериолы. Окраска гематоксилином и эозином (увеличение 200);
в – паретическое расширение капилляров. Стрептавидин-биотиновый иммунопероксидазный метод на CD34 эндотелиальных клеток, докраска гематоксилином (увеличение 400);
г – полнокровие сосудов, стаз крови. Окраска ШИК-альциановый синий (увеличение 200)
Через 1 час в опухолевой ткани сосудистые расстройства прогрессировали, характеризовались преимущественно ангиопаретическими и гемореологическими расстройствами: парез артериол, капилляров, стаз крови с агглютинацией эритроцитов в просвете сосудов (рисунок 5в,г). Объемная плотность сосудистого русла и средний диаметр сосудов нарастали по сравнению с предыдущим сроком – соответственно 6,9±0,8 % (р=0,09) и 11,8±0,6 мкм (р=0,01). Зона некротического детрита опухоли увеличивалась до 13,6±3,2 %, объемная доля эпителия в опухоли уменьшалась – 30,1±1,8 % (р>0,05). Эпидермальный слой кожи, расположенный над опухолью некротизирован.
Через 3 часа после сеанса ФДТ в опухоли обнаруживались тромбозы в сосудах микроциркуляции, очаговые кровоизлияния (рисунок 6а). Наряду с этим выявлялись зоны невосстановленного кровотока со спавшимися капиллярами (рисунок 6б). В паренхиме достоверно возрастала объемная плотность некрозов – 20,7±2,1 % (р=0,000 при сравнении с интактной группой и через 5, 30 минут; р=0,01 при сравнении с 1-м часом). Статистическая значимость различий установлена в увеличении среднего диаметра сосуда и объема сосудистого русла, уменьшении объемной плотности эпителия по сравнению с таковыми через 30 минут, 1 час (таблица 4). В строме выявлялись периваскулярный отек и геморрагические инфильтраты, обусловленные сосудистыми расстройствами.

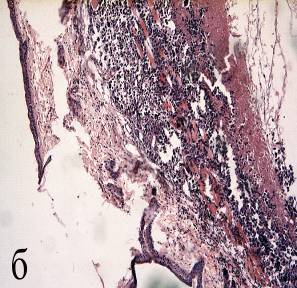
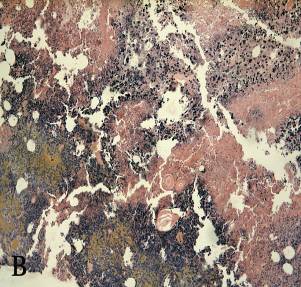
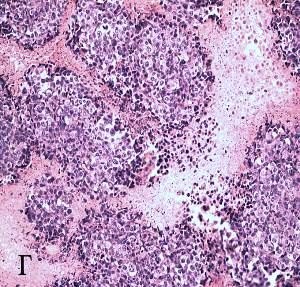
Рисунок 6 а, б, в, г – Морфологические изменения в опухоли Эрлиха через 3-24 часа после сеанса фотодинамической терапии
а – некрозы сливного характера, геморрагическая инфильтрация опухолевой ткани. Окраска гематоксилином и эозином (увеличение 100);
б – некроз эпидермиса, «запустевшие» сосуды. Окраска гематоксилином и эозином (увеличение 100);
в – плазматическое пропитывание стенок артериол. Окраска гематоксилином и эозином (увеличение 100);
г – слабая лейкоцитарная инфильтрация по периферии обширных некрозов. Окраска гематоксилином и эозином (увеличение 200)
В группе, исследованной через 6 часов, отмечалось преобладание альтеративно-экссудативных изменений в строме и сосудах опухоли. Стенки артериол с явлениями плазматического пропитывания; эндотелий сосудов набухший (рисунок 6в). В строме признаки мукоидного набухания: с бледно-розовым ШИК-позитивным окрашиванием и накоплением кислых гликозаминогликанов. Ретикулярная сеть при импрегнации солями серебра по Гомори набухшая, огрубевшая. Участки некроза опухоли нарастали и составили 27,1±4,0 % (р=0,007; при сравнении с 1-м часом), объемная плотность эпителия уменьшалась до 9,2±1,4 % (р=0,000). Объемная доля стромы составила 54,3±3,0 % (р=0,04; по сравнению со сроком 5 минут).
Через 12 часов опухоль была представлена полями некротического детрита (объемной плотностью 28,4±4,5 %), окружающего пласты канкрозных клеток 9,7±1,3 %. В отличие от предыдущих сроков эксперимента и интактной группы по периферии оксифильных масс некроза появлялась слабо выраженная круглоклеточная воспалительная инфильтрация (рисунок 6г). Это свидетельствовало о некрозе опухоли, обусловленном ее повреждением, т.е. действием ФДТ. Средний диаметр сосудов составил 18,9±1,4 мкм; их объемная плотность уменьшалась до 5,2±0,6 % (р=0,02).
Гистологическая картина через 1 сутки характеризовалась нарастанием дистрофических процессов в строме и сосудах опухоли. В утолщенных стенках артериол накопление ШИК-позитивного материала, сегментарные фибриноидные некрозы, периваскулярно располагались инфильтраты из клеток лимфогистиоцитарного происхождения, средний диаметр сосудов составил 18,1±1,3 мкм; Капиллярная сеть с явлениями дезорганизации, спавшаяся. Объемная плотность сосудистого русла в среднем была равна 4,3±0,6 %. Коллагеновые волокна в составе стромы с потерей фуксинофилии, окрашивались пикрофуксином в оранжевый цвет. Объемная плотность отечной стромы составляла 60,4±3,2 %.
Через 3 суток эпителий в составе опухоли обнаруживался в отдельных полях зрения, его объемная плотность составляла 6,7±1,5 %. Преобладала строма 64,8±2,9 % с дистрофическими изменениями в виде порционного отека и безъядерный некротический детрит 24,6±4,8 %. Снаружи от некротических масс наблюдались признаки формирования грануляционной ткани – пролиферация фибробластов, располагающихся тяжами на границе с некрозами. В стенках сосудов артериолярного типа отмечалась инфильтрация лимфоидными клетками, появление признаков васкулита (рисунок 7а).
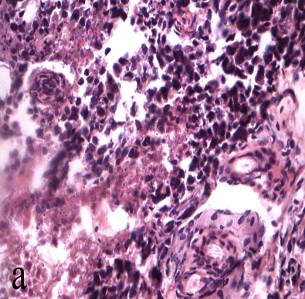
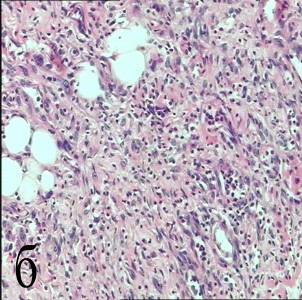
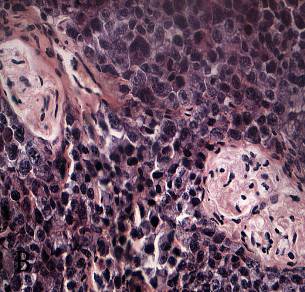
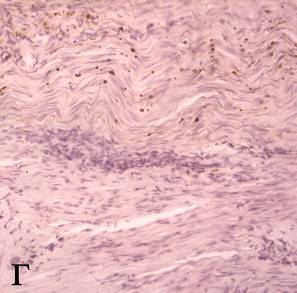
Рисунок 7 а, б, в, г – Морфологические изменения в опухоли Эрлиха через 3-28 суток после сеанса фотодинамической терапии
а – продуктивные васкулиты в опухоли. Окраска гематоксилином и эозином (увеличение 400);
б – формирование грануляционной ткани. Окраска гематоксилином и эозином (увеличение 200); в – организация тромбов в просвете сосудов. Окраска гематоксилином и эозином (увеличение 400);
г – волокнистая оформленная соединительная ткань во всех слоях дермы. Окраска гематоксилином и эозином (увеличение 200)
На 7-е сутки эксперимента при морфологическом исследовании обнаружена пролиферация и краевое подрастание базального слоя эпителия под струп, ниже располагалась сформировавшаяся грануляционная ткань (рисунок 7б). Нерезорбированные некротические массы объемом 11,8±0,6 %. Объемная плотность некрозов статистически достоверно уменьшалась по сравнению с предыдущими сроками – через 3, 6, 12, 24 часа после ФДТ. Среди грануляций у 2 мышей обнаружены группы опухолевых клеток (объемной плотностью 5,2±0,6 %). Расположенные среди клеток опухоли сосуды диаметром 19,5±2,9 мкм часть их них с явлениями продуктивного васкулита и стенозом просвета, другие с организацией тромботических масс и развитием тромбоваскулита (рисунок 7в). Капилляры в островках опухоли выявлялись при иммуногистохимическом исследовании; средний объем сосудистого русла в паренхиме равнялся 1,1±0,3 %.
К 28-м суткам восстановленный непрерывный слой эпидермиса у 1 животного; все слои дермы содержали зрелую оформленную волокнистую соединительную ткань. У 1 мыши выявлены опухолевые клетки, которые располагались среди пучков коллагеновых волокон. Их объемная плотность составила 2,8±0,8 % (рисунок 7г). В опухолевой ткани обнаружены при иммуногистохимическом исследовании новообразованные капилляры (объемной плотностью 0,9±0,2 %), их средний диаметр был равен 9,2±1,3 мкм.
На всех сроках эксперимента в первой контрольной группе (мыши после введения ФС без облучения лазером) опухоль инвазирует глубокие слои дермы, эпителиальный пласт кожи над карциномой сохранен, некрозы опухоли с отсутствием демаркационной воспалительной реакции. Статистически значимых различий в объемной плотности эпителиоцитов, стромы, сосудистого русла, некроза и среднего диаметра сосудов на сроках 5, 30 минут, 1, 3, 6, 12 часов не установлено. На 3-и и 7-и сутки эксперимента регистрировалась незначительное нарастание объемной плотности некрозов опухоли и уменьшение среднего диаметра сосудов, вероятно обусловленные опухолевой прогрессией – неоангиогенезом, темпом пролиферации и гибели опухолевых клеток. Такие же изменения были характерны и для «интактной опухоли» (третья контрольная группа).
При морфологическом исследовании карциномы второй контрольной группы (лазерное облучение без ФС) в непосредственной близости от зоны лазерного облучения были обнаружены в ранние сроки очаговые разрушения поверхностных слоев эпидермиса. В опухоли наблюдалась гиперемия сосудов, очаговые кровоизлияния, отек и набухание эндотелия микроциркуляторного русла, интерстиция. Средний диаметр сосудов был наибольшим через 5 минут после воздействия лазером – 18,6±1,2 мкм. Полнокровие сосудов опухоли было кратковременным и сохранялось в течение 30 минут. Через 3 суток наблюдалась эпителизация кожи у 2 животных, объемное содержание структурных компонентов опухоли соответствовало аналогичным показателям в этот срок у интактной и I контрольной группы, без увеличения зон некрозов. На 7-е сутки после лазерного облучения разрастания грануляционной ткани не обнаружено, сохранялась обычная структура опухоли Эрлиха, не отличимая от интактной опухоли.
Анализ полученных результатов клинического и морфологического исследований в определенные периоды времени позволил нам выстроить экспериментально обоснованную, хронологическую картину фотодинамического повреждения опухоли. В патогенезе гибели опухоли после ФДТ мы выделили условно несколько периодов: период функциональных микроциркуляторных нарушений, переходный период, период необратимых изменений и формирования некроза, период отторжения опухолевого некроза и формирования рубца.
Итак, первый период, который длится около одного часа с момента ФДТ, мы характеризуем как период функциональных микроциркуляторных нарушений. Первичный ответ на фотохимическое повреждение опухоли в результате ФДТ можно охарактеризовать как спазм сосудов микроциркуляторного русла. Так, уже в конце сеанса ФДТ в основной группе животных-опухоленосителей поверхность опухоли, как правило, становилась бледной (ишемичной), что клинически свидетельствует о нарушении кровообращения. Кожа над опухолью после облучения лазером становилась бледной с четкими контурами и еле выраженным валиком гиперемии по периферии на границе со здоровой тканью. Такой вид опухоли сохранялся в течение 1 – 2 часов с момента облучения. Морфологические изменения в этот период подтверждают клиническую картину и характеризуются в первые 30 минут – 1 час после ФДТ сосудистой реакцией в ответ на фотодинамическое воздействие, которая носит «чисто» функциональный характер, проявляясь только спазмом с последующим паретическим расширением на отдельных участках. К отметке «1 час», на отдельных участках, наряду с функциональными микроциркуляторными расстройствами (спазм и парез сосудов), наблюдаются начальные явления формирования тромбов в результате замедления кровотока и стаза крови в сосудах, что в свою очередь, явилось причиной дистрофических и некробиотических изменений, а также отека опухолевых клеток. Достоверных данных о прямом повреждении опухолевых клеток в период наблюдения до 1 часа не получено. Что касается контрольных групп, то каких-либо статистически значимых изменений исследуемых параметров в группах «интактная опухоль» и «Радахлорин без облучения лазером» не получено. Интерес представляет лишь контрольная группа животных, получивших лазерное облучение без фотосенсибилизатора. Кожа в зоне засветки у животных этой группы была слегка гиперемированна. Этот факт находил подтверждение и в результатах морфологического исследования, где в ранние сроки, начиная с 5 минут, регистрировались статистически значимые увеличения среднего диаметра и объемной плотности сосудов кожи и опухоли, их полнокровие, что соответствовало клинически проявляющейся гиперемии. Эти явления мы расценили как тепловой эффект лазерного излучения на ткани, которое с одной стороны кратковременно влияло на состояние микроциркуляторного русла опухоли, вызывая обратимую гиперемию, с другой стороны вело к очаговым разрушениям поверхностных слоев эпидермиса, проявляющимся очаговыми кровоизлияниями и отеком. Выявленные изменения носили кратковременный и обратимый характер (до 6 часов) и расценены нами как результат теплового повреждения по типу ожога I степени. О тепловом характере изменений свидетельствует и тот факт, что при уменьшении мощности излучения с 0,5 – 1,0 Вт до 200 мВт при одновременном увеличении времени лазерного облучения (что позволяло сохранить дозу света в 200 Дж/см2), сосудистые изменения не проявлялись. Таким образом, эффектом фотодинамической терапии в ранний период наблюдения до 1 часа, с учетом результатов исследования в контрольных группах, можно считать только микроциркуляторные нарушения функционального характера.
В следующий период, ограниченный 1 и 3 часами с момента ФДТ, который мы назвали переходным, характеризуется усугублением процессов, происходящих в сосудах опухоли и приобретающих необратимый характер.
В это время в микроциркуляторном русле все еще наблюдается спазм сосудов, уменьшение их среднего диаметра и снижение объемной плотности сосудистого русла, однако кое-где, наблюдались чередование спазма и пареза на соседних участках сосуда с образованием и прогрессированием тромбов.
Паретическое расширение сосудов нарастало и на отметке «1 час» в опухолевой ткани выявлялись преимущественно ангиопаретические и гемореологические расстройства: парез артериол, капилляров, стаз крови с агглютинацией эритроцитов в просвете сосудов. Данное явление мы фиксировали и клинически – через час после ФДТ бледность сменялась цианозом и синюшным оттенком опухоли, что говорило о прогрессирующей ишемии ткани. Объемная плотность сосудистого русла и средний диаметр сосудов нарастали по сравнению с предыдущим сроком. Если в первом периоде, мы наблюдали спазм артериол, что ведет к уменьшению кровенаполнения и ангиоспастической ишемии, то во втором периоде спазм сменяется паретическим расширением артериол. Парез сосудов приводит к увеличению кровенаполнения опухоли, при этом объем оттока венозной крови не меняется, т.е. возникает венозная гиперемия после ишемии. Это и объясняет наличие отека и цианоза опухоли. Переходный период ознаменовался началом необратимых процессов и лежащей в их основе несостоятельности сосудистой системы опухоли. Такие глубокие и необратимые сосудистые изменения с формированием тромбоза в них приводят к прогрессирующему ишемическому некрозу опухоли. Именно с этого периода как клинически, так и морфологически отмечаются все масштабы некротических повреждений опухоли в результате ФДТ.
Что касается контрольной группы животных, облученных лазером без Радахлорина, сосудистые изменения, а также изменения других компонентов опухоли, если и были статистически значимыми, однако не столь бурными и, как показали последующие сроки наблюдения, они были кратковременными и обратимыми. Кроме того, если в основной группе животных мы видим отрицательную динамику процессов, происходящих в опухоли, то в контроле после облучения лазером без Радахлорина, по крайней мере, к концу суток видна положительная тенденция восстановления прежней структуры тканей. Клинически признаков глубоких некрозов в данной контрольной группе мы не отмечали, а в зоне засветки кожа имела темно красный цвет с формированием к 3-м часам ограниченного перифокального отека. В других контрольных группах никаких статистически значимых изменений компонентов опухоли не обнаружено.
В третий период, который мы назвали периодом необратимых изменений в ткани опухоли и формирования некрозов, в основной группе исследования также отмечали прогрессирование изменений в сосудистой системе опухоли, однако наибольший интерес представляют процессы некробиоза опухоли. Таким образом, данный период мы рассматривали как результат двух процессов: сосудистых и некробиотических.
В сосудистой системе опухоли в этот период формируются и прогрессируют тромбозы, нарастают очаговые кровоизлияния на фоне спавшихся сосудов и определяются обширные участки невосстановленного кровотока. К 6 часам наблюдаются изменения в стенках сосудов в виде их плазматического пропитывания, сужения вплоть до полного отсутствия просвета артериол за счет набухшего эндотелия. Позднее, на отметках исследования в 12 и 24 часа, мы отмечались дистрофические изменения в сосудах, периваскулярный отек и инфильтрация и, в конечном итоге, к концу первых суток после ФДТ происходит полная дезорганизация сосудистой сети опухоли.
Некробиоз опухоли в этот период сопровождался следующими процессами. Во все периоды наблюдения, начиная еще с переходного (3 часа после ФДТ), происходит достоверное увеличение зоны некроза опухоли на фоне уменьшения объемной плотности эпителия. Через три часа присоединяется периваскулярный отек и геморрагическая инфильтрация, которая прогрессирует к 6 часам с появлением признаков мукоидного набухания. К 12 часам опухоль представляет собой поля некротического детрита со слабо выраженной воспалительной инфильтрацией по периферии. Это не что иное, как формирование демаркационной линии, отграничивающей некротизирующуюся опухоль. Перечисленные явления становятся более выраженными к концу первых суток после ФДТ.
Клинически первые признаки некроза мы фиксировали уже через 6 часов после ФДТ, когда появлялись ограниченные темные участки в области опухоли, а к 24 – 48 часам практически вся опухоль была черного цвета с ровными границами по периферии с окружающей тканью (рисунок 4).
В контрольных группах «интактная опухоль» и «после введения Радахлорина» по-прежнему статистически значимых изменений не выявлялось. В контрольной группе с облученной лазером опухолью без фотосенсибилизатора к концу суток, кожа приобретала обычную окраску, поверхность ее была сухой, шелушащейся в зоне засветки.
В четвертом периоде, в основной группе, мы фиксировали четкую демаркацию сухого опухолевого струпа от здоровой кожи с последующим его отторжением и появлением грануляционной ткани (5 – 6 сутки) на границе с некротизированной опухолью и краевой эпителизацией. Этот последний, четвертый период мы назвали периодом отторжения некроза и формирования рубца.
Клиническая картина у животных всех трех контрольных групп в этот период наблюдения была идентичной и характеризовалась признаками прогрессирования опухолевого процесса. Опухоль и кожа над ней в контрольной группе после лазерного облучения без Радахлорина полностью восстановила свой прежний вид на 2 – 3 сутки, а реакция поверхностных слоев эпидермиса на лазерное облучение проявлялась лишь некоторым шелушением кожи в области засветки. Прогрессирование опухоли не отличалось от остальных контрольных групп.
Таким образом, результаты, полученные нами в эксперименте, позволили получить подробную клинико-морфологическую характеристику процессов, происходящих в опухоли после фотодинамической терапии и предложить классификацию этапов некробиоза опухоли, разделенную нами на четыре периода. Такая классификация выбрана нами не случайно, так как именно деление на периоды позволяет нам понять причинно – следственную связь между фотодинамической терапией и гибелью опухоли (таблица 5). Если в первом периоде мы видим только обратимые микроциркуляторные нарушения, продолжающиеся около 1 часа с момента ФДТ, то в следующем периоде мы наблюдаем усугубление сосудистых нарушений, вплоть до несостоятельности всей сосудистой системы в третьем периоде, нарастании объема некрозов и гибели всей опухоли с формированием некротического струпа, его отторжением и рубцеванием в заключительном четвертом периоде.
Таблица 5 – Этапы формирования некрозов опухолевой ткани при фотодинамической терапии
| Периоды некробиоза опухоли | Сроки | Клинические проявления | Морфологические проявления |
| Период функциональных микроциркуляторных нарушений | 5 мин – 1 ч | Побледнение опухоли | Спазм сосудов, с последующим их парезом и началом формирования тромбов |
| Переходный период | 1 – 3 ч | Бледность сменяется цианозом, начинает формироваться отек тканей в области опухоли | Парез артериол, капилляров, стаз крови с агглютинацией эритроцитов в просвете сосудов и прогрессирование тромбозов |
| Период необратимых изменений и формирования некроза | 6 ч – 7 сут | Появление темных участков в опухоли, опухоль приобретает черный цвет с формированием некротического струпа и четкой демаркацией от здоровой кожи | Микроциркуляторные нарушения, тромбозы и повреждение эндотелия приводят к дезорганизации сосудистой сети и некрозу всей опухоли |
| Период отторжения опухолевого некроза и формирования рубца | 4 – 5 нед | отторжение опухолевого некроза и формирование нежного рубца | Появлением грануляционной ткани на границе с некротизированной опухолью, отторжение некроза и начало краевой эпителизации |
Проведенные исследования позволяют считать повреждение микроциркуляторного русла одной из основных причин гибели опухоли в результате ФДТ, однако это не исключает и других механизмов.
Таким образом, при ФДТ развиваются гипоксические повреждения опухоли, опосредованные микрососудистыми расстройствами и нарушениями гемоциркуляции.
Выводы
- Экспериментальная аденокарцинома Эрлиха является адекватной моделью злокачественной опухоли для оценки фотодинамических эффектов. Опухоль хорошо воспроизводится как при внутрибрюшинной (асцитический вариант), так и при подкожной перевивки (солидный вариант), имеет «плоский» характер роста.
- Первостепенное значение при фотодинамической терапии в генезе опухолевого повреждения имеют расстройства гемодинамики в опухоли, которые носят стадийный характер: период функциональных микроциркуляторных нарушений; переходный период; период необратимых изменений и формирования некроза; период отторжения опухолевого некроза и формирования рубца.
- Одним из основных механизмов некроза опухоли в результате фотодинамической терапии является развивающееся гипоксическое повреждения опухоли, опосредованное расстройствами микроциркуляторного русла.
Практические рекомендации
- Полученные результаты могут быть использованы в экспериментальной онкологии при изучении фотодинамической терапии злокачественных опухолей с использованием фотосенсибилизаторов второго поколения хлоринового ряда. Результаты эксперимента могут быть также использованы в экспериментальной морфологии при изучении при изучении опухолевого патоморфоза после фотодинамической терапии.
- Предложена классификация этапов некротического процесса опухоли при фотодинамической терапии.
- Результаты выполненной работы могут быть использованы в учебном процессе на кафедрах онкологии и патологической анатомии.
Список работ, опубликованных по теме диссертации
- Привалов В.А., Бикбов Э.Н., Селиверстов О.В., Сергийко С.В., Файзрахманов А.Б., Яровой Н.Н., Лаппа А.В. Первый опыт фотодинамической терапии при местнораспрастраненном раке щитовидной железы // Материалы межрегиональной конференции с международным участием «Рак щитовидной железы и эндемический зоб». – Екатеринбург, 2007. – С.151 – 152 (лично автора – 0.01 п.л.).
- Бикбов Э.Н. Особенности фотодинамических эффектов «Радахлорина» в эксперименте на мышах с перевитой аденокарциномой Эрлиха // Материалы Российской научно-практической конференции «Реформа онкологической службы Уральского Федерального округа и идеология развития позитронной эмиссионной томографии в регионах». – Челябинск: Изд-во «Иероглиф». – 2009. – С.35 – 37 (лично автора – 0.08 п.л.).
- Бикбов Э.Н., Привалов В.А., Куренков Е.Л. Эффекты фотодинамической терапии с препаратом Радахлорин в эксперименте на мышах с перевитой аденокарциномой Эрлиха // Вестник Южно-Уральского государственного университета (перечень ВАК Минобрнауки РФ). – Челябинск. – 2009. – Вып. 19. – №20(153). – С.83-88 (лично автора – 0.08 п.л.).
- Бикбов Э.Н., Привалов В.А., Куренков Е.Л. Динамика морфологических изменений в опухоли при ФДТ в эксперименте // Иероглиф. – 2009. – №21 – С.41 – 59 (лично автора – 0.24 п.л.).

