Медико-биологические эффекты фотодинамической терапии пациентов с возрастной макулярной дегенерацией
На правах рукописи
Балацкая Наталья Владимировна
МЕДИКО-БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ПАЦИЕНТОВ С ВОЗРАСТНОЙ МАКУЛЯРНОЙ ДЕГЕНЕРАЦИЕЙ
14.03.11. – восстановительная медицина, спортивная медицина, лечебная физкультура, курортология и физиотерапия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва, 2010
Работа выполнена в Отделе клинической химии ГУП МНКЦ «Интермедбиофизхим»
и ФГУ «РНЦ восстановительной медицины и курортологии Росздрава»
Научные руководители:
доктор биологических наук, профессор Фролков Валерий Константинович
доктор медицинских наук, профессор Киселева Татьяна Николаевна
Официальные оппоненты:
доктор медицинских наук, профессор Юрова Ольга Валентиновна
доктор биологических наук, Зак Павел Павлович
Ведущая организация:
Московский областной научно-исследовательский клинический институт им. М.Ф.Владимирского
Защита состоится « 29 » апреля 2010 г. в « 11 » часов на заседании диссертационного совета Д 208.060.01 при ФГУ «Российский научный центр восстановительной медицины и курортологии Минздравсоцразвития Российской Федерации» (121069, Москва, пер. Борисоглебский, 9).
С диссертацией можно ознакомиться в библиотеке ФГУ «Российский научный центр восстановительной медицины и курортологии Минздравсоцразвития Российской Федерации»
Автореферат разослан « ____» _______________________2010 г.
Ученый секретарь диссертационного совета
доктор биологических наук, профессор Фролков В.К.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Исследования последних лет свидетельствуют о перспективности применения различных методов терапии, основанной на активизации фотосенсибилизаторов (ФС) при немедикаментозном лечении ряда заболеваний. Однако в офтальмологии эта проблема изучена в недостаточной степени (Blumenkranz M.S. et al., 2000; Aisenbrey S., 2002; Аветисов С.Э. и соавт., 2007). Остаются не ясными механизмы реализации биологического потенциала фотодинамического воздействия при патологии глазного яблока. Все это сдерживает разработку более эффективных и безопасных методов лечения и профилактики заболеваний органов зрения.
Вместе с этим, в зрелом и, особенно, в пожилом возрасте достаточно часто встречаются зрительные расстройства, в основе которых лежат процессы активизации ангиогенеза. Возрастная макулярная дегенерация (ВМД) – одно из самых распространенных заболеваний глаз, угрожающих значительным снижением зрения и инвалидностью во второй половине жизни, и как причина слабовидения занимает 1-е место в структуре глазной патологии, значительно опережая глаукому и диабетическую ретинопатию (Bunce C.,Wormald R.,2008). Рост заболеваемости и значительный риск инвалидности трудоспособного населения делают ВМД серьезной медико-социальной проблемой (Мухина М.А., 2000; Либман Е.С. 2006).
Более 90% случаев слепоты от ВМД связано с развитием неоваскулярной формы заболевания – патологическим неоангиогенезом, характеризующимся пролиферацией клеток эндотелия хориокапилляров и ростом новообразованных неполноценных сосудов через дефекты мембраны Бруха под пигментный эпителий сетчатки и/или нейроэпителий. Механизмы снижения зрительных функций при ВМД изучены не достаточно, поэтому существующие многочисленные методы лечения данной патологии (хирургические и консервативные) имеют весьма ограниченную эффективность.
Хотя причины развития субретинальной неоваскулярной мембраны при ВМД до конца не понятны, большие надежды возлагаются на фотодинамическую терапию (ФДТ) - способ лечения, основанный на селективном накоплении в очаге поражения ФС экзо - и эндогенного происхождения, с последующей фотоактивацией их молекул светом определенной длины волны, развитием фотоцитотоксических эффектов (Schmidt-Erfurth U. et al., 1999; Blumenkranz M.S. et al., 2000). ФДТ вызывает фотодинамическую окклюзию новообразованных сосудов с сохранением окружающих тканей (фоторецепторов, пигментного эпителия, хориокапилляров). Метод выгодно отличается избирательностью поражения патологической ткани, что повышает эффективность лечения и создаёт перспективу для улучшения зрительных функций. Избирательность поражения, возможность воздействия на эндотелиальные клетки новообразованных сосудов и отсутствие теплового эффекта, губительного для фоторецепторов, позволило рекомендовать ФДТ для применения в офтальмологии, в частности, в лечении субретинальной неоваскуляризации.
Не вызывает сомнений, что разработке и внедрению эффективных методов лечения заболеваний должны предшествовать всестороннее обоснование механизмов их лечебного воздействия и диагностика, в рамках которых определяются приоритеты для полного или частичного восстановления нарушенных функций организма. Следует отметить, что патологический процесс при ВМД течет индивидуально, однако при развитии субретинальной неоваскуляризации временной фактор приобретает ключевое значение. Вероятно, что при ранней диагностике этого состояния и правильной тактике своевременно начатого лечении можно избежать потери зрительных функций, добиться длительной ремиссии или обратного развития заболевания. В этом плане особое значение приобретает исследование изменений иммуно-биохимических показателей для разработки приемов мониторинга лечения и прогнозирования течения субретинальной неоваскуляризации у пациентов с ВМД.
Цель настоящего исследования:
разработка комплекса параметров ранней диагностики и обоснование медико-биологических и лечебных эффектов фотодинамического воздействия на процессы субретинальной неоваскуляризации у пациентов с ВМД.
Задачи исследования
1. Исследовать основные функциональные системы и охарактеризовать факторы, участвующие в формировании неоваскуляризации при ВМД, на основании комплексного клинико-инструментального и лабораторного исследования.
2. Оценить возможности и обосновать информативность биохимических и иммунологических параметров в диагностике и прогнозе развития субретинальной неоваскуляризации при возрастной макулярной дегенерации.
3. Проанализировать характер реализации биологического и лечебного эффекта фотодинамического воздействия.
4. Изучить отдаленные результаты фотодинамического воздействия на процессы субретинальной неоваскуляризации у пациентов с ВМД.
Научная новизна
Впервые проведено клинико-инструментальное обследование в комплексе с иммунологическими и биохимическими исследованиями у пациентов с неоваскулярной ВМД в процессе ее развития. Выявлено, что в ходе формирования патологического очага неоваскуляризации наряду с повышением активности факторов ангиогенеза происходит усиление провоспалительных реакций при активации прооксидантных процессов на системном уровне.
Показано, что направление репаративного процесса в исходе субретинального неоангиогенеза связаны с характером изменения уровней трансформирующих факторов роста TGF 1,2в сыворотке крови и TGF 2 – в слезной жидкости.
Установлены доклинические критерии для ранней диагностики начала формирования субретинальной неоваскуляризации на основании выявленной активации ангиогенеза и воспалительной реакции: повышения содержания фактора роста эндотелия сосудов - VEGF-A в сыворотке крови (СК), слезной жидкости (СЖ), трансформирующих факторов роста TGF 1, 2 и фактора некроза опухолей – в СК.
Впервые изучено влияние фотодинамической терапии на состояние систем прооксиданты – антиоксиданты, иммунореактивности и ангиогенеза у больных с неоваскулярной формой ВМД.
Практическая значимость
Разработаны подходы к ранней диагностике и прогнозу субретинальной неоваскуляризации при ВМД на основании разработанных и представленных в работе биохимических и иммунологических параметров. Определена эффективность применения ФДТ у пациентов с СНМ на основании проведенного анализа биологического и лечебного эффекта фотодинамического воздействия. Представлен комплекс биохимических и иммунологических параметров для прогнозирования течения субретинальной неоваскуляризации и мониторинга фотодинамической терапии пациентов, страдающих неоваскулярной формой ВМД. Обоснована целесообразность использования данных критериев в качестве контроля за эффективностью лечения субретинальной неоваскуляризации.
Положения, выносимые на защиту:
1. Обоснована патогенетическая роль провоспалительных реакций, экспрессии трансформирующих факторов роста и активности факторов ангиогенеза в формировании субретинальной неоваскуляризации при ВМД.
2. Доказана информативность показателей фактора роста эндотелия сосудов - VEGF-A, в сыворотке крови и слезной жидкости, трансформирующего фактора роста TGF-1, фактора некроза опухолей TNF- и активности прооксидантных процессов в СК на раннем этапе развития субретинальной неоваскуляризации.
3. Реализация биологического и лечебного эффекта фотодинамического воздействия при субретинальной неоваскуляризации сопровождается снижением активности патологического ангиогенеза, адекватным ответом со стороны провоспалительных реакций при тенденции к восстановлению баланса в системе про- и антиоксидантных реакций.
Внедрение результатов исследования
Разработанный комплекс клинико-лабораторных исследований внедрен в клиническую практику отделения сосудистой и витреоретинальной патологии НИИ глазных болезней РАМН. Результаты диссертационной работы используются на курсах повышения квалификации НИИ глазных болезней РАМН, ФГУ «РНЦ восстановительной медицины и курортологии Росздрава».
Апробация работы
Основные положения диссертации доложены и обсуждены на VI Всероссийской научно – практической конференции «Отечественные противоопухолевые препараты» 24-26 марта 2007г. (секции ФТД), научно-практической конференции «Современные технологии лечения витреоретинальной патологии» 23 марта 2007 г. в ФГУ МНТК «Микрохирургия глаза» им. С.Н. Федорова, II-ой Всероссийской научной конференции молодых ученых с участием иностранных специалистов «Актуальные проблемы офтальмологии» 13 июня 2007 г. в ФГУ МНТК «Микрохирургия глаза» им. С.Н. Федорова, Х Международной научной конференции «Профессиональное долголетие и качество жизни» АСВОМЕД 24-26 сентября 2007 г., 10-й юбилейной научно-практической конференции офтальмологов «Актуальные проблемы офтальмологии» 5 октября 2007 г. в ФГОУ ИПК ФМБА России, Всероссийском форуме по восстановительной медицине, курортологии и физиотерапии «РеаСпоМед» 27 – 29 февраля 2008г., VII-й Всероссийской научно – практической конференции «Отечественные противоопухолевые препараты» 17 - 19 марта 2008г. (секции ФТД). Апробация диссертации проведена на заседании научно-методического совета ФГУ РНЦ ВМ и К Росздрава 22 октября 2009 года.
Публикации
По теме диссертации опубликовано 13 печатных работ, из них 1 в журнале, входящем в Перечень рецензируемых журналов и изданий, рекомендованных ВАК, и 1 - в иностранной печати, получен патент на изобретение RU 2 350 274 «Способ прогнозирования субретинальной неоваскулярной мембраны».
Структура работы
Работа изложена на 149 страницах машинописи и включает введение, обзор литературы, 2 главы собственных исследований и обсуждение результатов, заключение, выводы, указатель литературы (публикации 72 отечественных и 195 зарубежных авторов). Рукопись иллюстрирована 22 таблицами и 13 рисунками.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Проведено комплексное клинико-инструментальное обследование глаза, включающее визометрию, общую и макулярную электроретинографию (ЭРГ), морфометрию сетчатки, флюоресцентную ангиографию, а также биохимические и иммунологические исследования - у 123 пациентов с неоваскулярной формой ВМД, средний возраст которых колебался от 54 до 87 лет и в среднем составлял 69,3±12,9 года. Диагноз установлен на основании результатов флюоресцентной ангиографии глазного дна (ФАГД). Длительность заболевания не превышала 5 лет.
Пациенты были разделены на три группы. В I (основную) группу вошли 45 пациентов (68 глаз) с неоваскулярной формой ВМД, которым был проведен курс ФДТ. Во II группу (контрольную) были включены 53 пациента (73 глаза) с неоваскулярной формой ВМД, получавших курс стандартной медикаментозной терапии. Группу без медицинского вмешательства составили 25 пациентов (25глаз) с ВМД. Группы были сопоставимы по половым, возрастным характеристикам и сопутствующей патологии. 28 человек (56 глаз) составили группу здоровых добровольцев соответствующего возраста и пола без глазной патологии.
При проведении ФДТ в качестве фотосенсибилизатора (ФС) применен отечественный препарат «Фотосенс» производства ФГУП «ГНУ НИОПИК», разрешённый для медицинского применения при проведении ФДТ и ФД злокачественных онкологических заболеваний. Препарат «Фотосенс» - 0,2% - ный раствор для инъекций, вводился внутривенно в дозе 0,05 мг/кг. Для проведения ФДТ использована щелевая лампа и отечественная «Установка лазерная для фотодинамической терапии ЛФТ-630/675-01 «Биоспек» ГОСТ Р 50460-92», регистрационное удостоверение № 29/05020400/0616-00 от 27.07.2000 [Киселев Г.Л., В.Б. Лощенов., 1998.]. Сеанс проводился через трое суток после введения препарата согласно пику накопления и максимальному градиенту концентрации с использованием лазера длиной волны 675 нм, экспозиционной световой дозой 120 Дж/см2. Количество сеансов колебалось от 3 до 5 в неделю в зависимости от клинической картины СНМ. Суммарная световая доза не превышала 500 Дж/см2.
Пациенты II-й группы (контрольной) получали консервативное лечение, включавшее назначение диуретиков, стероидов, антиоксидантов, ангиопротекторов, витаминов, микроэлементов и ферментативных препаратов.
Всем больным проведена флюоресцентная ангиография глазного дна (ФАГД) с использованием фундус камеры TRC 50 EX. В качестве контрастного вещества применялся
10 % - ный раствор флуоресцеина натрия (Флуоресцид) производства фирмы «Alcon» (США), который вводился в локтевую вену в количестве 2,0 мл в течение 2 секунд. В день проведения ФАГД зрачок расширяли мидриатиками. Через 6-7 сек. от начала инъекции начинали серийную съемку глазного дна в течение 20-25 сек. с интервалом 0,8-1,0 сек. Последующие кадры выполняли с интервалом 5 - 10 сек. Поздние фазы регистрировали через 15, 30 и 60 минут.
Электроретинография (ЭРГ) проводилась для оценки функционального состояния сетчатой оболочки с помощью компьютерного электрофизиологического комплекса «Электроретинограф-02» (Россия). Регистрировали максимальную (общую) и макулярную ЭРГ (функцию колбочковой системы макулярной области), для оценки результатов которых исследованы - амплитуда (мкВ) а - волны (ответ фоторецепторов) и b-волны (электрическая активность биполяров, Мюллеровских, горизонтальных и амакриновых клеток).
Морфометрия центральной зоны сетчатки выполнена с использованием анализатора толщины сетчатки RTA (Retinal Thickness Analyzer) фирмы «TALIA» (Израиль). Определялись морфометрические показатели центральной зоны сетчатки площадью 66 мм (в 20 градусах от точки фиксации). Согласно стандартным схемам исследования толщины сетчатки Talia Technology анализировалась толщина нейроэпителия без ретинального пигментного эпителия по следующим параметрам: средняя толщина парафовеолярной области, средняя толщина в фовеальной области, средняя толщина над СНМ.
Материалом для лабораторных исследований послужили сыворотка периферической крови, гемолизат эритроцитов и слезная жидкость 123 пациентов с неоваскулярной формой ВМД и 28 здоровых лиц. Кровь забирали с 8 до 9 часов утра натощак из локтевой вены с помощью стандартных вакуумных систем «BD VACUTAINER TM» в пробирки для сбора плазмы крови с антикоагулянтом Li-гепарином и пробирки для сбора сыворотки крови без активатора свертывания. Слезную жидкость собирали автоматической пипеткой – дозатором из нижнего конъюнктивального свода обоих глаз без предварительной эпибульбарной анестезии в пробирки «EPPENDORF» в объеме 50 -100 мкл. Полученные образцы хранили при температуре -20°С до выполнения исследований.
Биохимические исследования. Уровень общего антиоксидантного статуса (Total antioxidant status (TAS)) определяли в реакции образца сыворотки крови с 2,2-азино-ди-3-этилбензтиазолин сульфонатом (ABTS® Boehringer Mannheim) и системы Н2О2-метмиоглобин по снижению интенсивности окраски образовавшегося комплекса феррилмиоглобин- ABTS® («TAS Randox» Великобритания) на автоматическом биохимическом анализаторе DAYTONA (Ирландия). Активность внутриэритроцитарных ферментов исследовали в гемолизате: селензависимой глутатионпероксидазы (ГП) - по методу Paglia D.E. и Valentine W.N. с использованием тест-системы «Ransel» Randox Laboratory, Ltd (Великобритания) и супероксиддисмутазы (СОД) - по методу Sun Y. диагностическим набором «Ransod» Randox Laboratory, Ltd (Великобритания) на автоматическом биохимическом анализаторе DAYTONA (Ирландия). Содержание общих биопероксидов (ТВНР – total biologic hydroperoxydes) определяли в сыворотке крови с помощью тест-системы OxyStat (BIOMEDICA GRUPPE, Бельгия) колориметрическим методом на спектрофотометре «StatFax -2100» (США). Концентрацию малонового диальдегида (МДА) - продукта перекисного окисления липидов (ПОЛ), активного при реакции с тиобарбитуровой кислотой (ТБК) измеряли по методу Uchiyama M., Mihara M. с использованием отечественной тест-системы фирмы «Агат-Мед» (Россия, Москва).
Иммунологические методы исследования. Провоспалительные цитокины - фактор некроза опухолей – (TNF- ), интерлейкина - 6(IL - 6), интерлейкин - 8(IL - 8) в сыворотке крови исследовали иммуноферментным методом (ИФА) с помощью диагностических наборов Bender MedSystems® (Австрия). Трансформирующие факторы роста ТGF - 1,ТGF - 2 и ангиогенеза VEGF-А определяли в сыворотке крови и слезной жидкости – диагностическими тест-системами Biosourse (Бельгия), DRG Diagnostic (США) и Bender MedSystems® (Австрия) соответственно.
Статистический анализ проведен с использованием программного комплекса Stastica for Windows Version 6.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Неоваскулярная форма ВМД характеризуется низкой остротой зрения и прогрессирующим снижением зрительных функций. Некоторые стороны механизма этого процесса известны. Во-первых, структурные изменения в сетчатой оболочке глаза (что в нашем исследовании подтверждено изменением морфометрических показателей центральной зоны сетчатки): достоверное увеличение показателей средней толщины нейроэпителия парафовеальной и фовеальной областей у пациентов с неоваскулярной ВМД по сравнению с таковыми в группе здоровых лиц (р<0,05). Во-вторых, изменение показателей биоэлектрической активности сетчатки по данным ЭРГ. Результаты общей ЭРГ - достоверное снижение амплитуды а-волны -свидетельствовали о поражении фоторецепторов центральной зоны сетчатки, а данные макулярной ЭРГ выявили изменение функциональной активности колбочек при относительной сохранности внутренних слоев сетчатки. Значительное снижение амплитуды b-волны свидетельствовало о вовлечении в патологический процесс клеток Мюллера и снижение активности нейронов (ON биполярных клеток).
В-третьих, общепризнанно, что основной причиной, ведущей к явным патологическим морфофункциональным перестройкам сетчатки и потере центрального зрения, является активация неоангиогенеза за счет сосудов хориоидеи и прорастания последних под пигментный эпителий и/или нейросенсорную сетчатку, что в нашей работе было подтверждено данными ФАГД.
Доказано, что VEGF-А - ключевой фактор ангиогенеза вырабатывается практически всеми видами клеток, испытывающих длительное кислородное голодание [Shima D.T., Adamis A.P., Ferrara N., et al., 1995]. Мы выявили VEGF- A у пациентов с неоваскулярной ВМД в сыворотке крови (СК), а также слезной жидкости (СЖ) и показали, что в среднем его уровень был достоверно выше по сравнению с группой здоровых лиц. (Табл. 1).
Полученные результаты исследования VEGF-А соответствовали данным клинико-инструментального обследования пациентов. Высокий уровень VEGF наблюдался у больных с клиническими симптомами активной СНМ. Согласно современным представлениям, процесс ангиогенеза, его начало и исход тесно сопряжены с активацией трансформирующих факторов роста, а степень рубцевания напрямую зависит от взаимодействия трансформирующих факторов TGF-1 и TGF-2 [Boulton M., Gregor Z., 1997.]. Показатель сывороточного TGF-1 повышался почти в 2 раза у пациентов с неоваскулярной ВМД по сравнению с группой здоровых лиц (табл.1).
Анализ результатов исследования провоспалительных цитокинов показал статистически значимый подъем уровней сывороточных ТNF-, IL-6 и IL-8 у этих больных, что в определенной мере подтверждает гипотезу о возможном участии провоспалительного компонента в развитии неоваскулярной или терминальной стадии ВМД [Ali M.H., Schlidt S.A. и др., 1999; Cohen T., Nahari D. et al., 1996; Maruo N., Morita I. et al., 1992.] (табл. 1).
Таблица 1
Состояние ангиогенеза, иммунореактивности, системные механизмы изменения активности про- и антиоксидантных реакций у больных с неоваскулярной формой возрастной макулярной дегенерации
| Показатель | Здоровые лица (n=28) | Больные ВМД (n=98) |
| TGF-2, пг/мл (СК) | 1218 ± 24,8 | 1493 ± 22,0** |
| TGF-1, пг/мл (СК) | 94 ± 5,2 | 179 ± 8,2*** |
| VEGF-A, пг/мл (СК) | 69 ± 5,2 | 250 ± 21,1*** |
| VEGF-A, пг/мл (СЖ) | 1005± 112,7 | 3515 ± 105,7*** |
| TNF-, пг/мл (СК) | 4,63 ± 0,16 | 13,6 ± 0,46*** |
| IL-6, пг/мл (СК) | 1,91 ± 0,06 | 2,58 ± 0,05** |
| IL-8, пг/мл(СК) | 22,3 ± 0,65 | 25,6 ± 0,43** |
| Общие гидроперекиси (ТВНР), мкмоль/ | 378 ± 18,6 | 589 ± 9,4*** |
| Малоновый диальдегид (МДА), мкмоль/л | 2,13 ± 0,18 | 2,82 ± 0,06** |
| Антиоксиданты суммарно (TAS), ммоль/л | 1,42 ± 0,05 | 1,22 ± 0,02** |
| Супероксиддисмутаза (СОД), U/mL | 174 ± 4,1 | 160 ± 2,4* |
| Селензависимая глутатионпероксидаза (Gpx/Hb), U/gHb | 68,4 ± 3,2 | 56,7 ± 1,7* |
Примечание: надстрочные индексы показывают достоверность различия параметров у больных ВМД по сравнению со здоровыми лицами (** - p<0,01; *** - p<0,001)
Считают, что инициация экспрессии генов цитокинов, факторов роста и формирование в дальнейшем патогенных реакций прямо сопряжены и в большинстве случаев вторичны по отношению к нарушениям в системе прооксиданты – антиоксиданты [Janssen - Heininger Y. M. W. et al., 2000.].
У пациентов были выявлены выраженные изменения в системе про- и антиоксидантных реакций (табл. 1). Повышенные концентрации общих гидроперекисей (ТВНР) и малонового диальдегида (МДА) в сыворотке крови указывают на высокий уровень прооксидантных реакций и активацию процессов свободнорадикального окисления.
Значения показателя общего антиоксидантного статуса TAS у всех больных были существенно снижены по сравнению с группой здоровых лиц (p<0,01), что свидетельствовало о недостаточной активности системы антиоксидантной защиты организма и целесообразности исследования ее важнейших компонентов. Анализ результатов продемонстрировал значимое снижение активности внутриэритроцитарных ферментов АОЗ селензависимой глутатионпероксидазы (ГП) и супероксиддисмутазы СОД (p<0,05).
При помощи корреляционного анализа установлена достоверная прямая взаимосвязь между показателями антиоксидантных ферментов СОД и ГП и уровнем TAS у пациентов с неоваскулярной формой ВМД (табл. 2). Статистически незначимые парные коэффициенты корреляции, полученные для этих показателей в группе здоровых, позволяют предполагать наличие иных, более тесных взаимосвязей антиоксидантных ферментов СОД и ГП с другими компонентами многозвеньевой системы АОЗ, что открывает целое направление для дальнейших исследований.
Таблица 2
Матрица корреляционных взаимосвязей в системе про - и антиоксидантных реакций у пациентов с неоваскулярной формой возрастной макулярной дегенерации и здоровых добровольцев
| Показатели | МДА | TAS | СОД | Gpx/Hb |
| ТВНР | +0,78** +0,34 | –0,17 +0,09 | –0,42* –0,16 | +0,16 +0,10 |
| МДА | –0,21 –0,13 | –0,53* –0,35* | –0,27 +0,19 | |
| TAS | +0,44* +0,15 | +0,35* +0,17 | ||
| СОД | –0,29 –0,05 |
Примечание: в каждой клетке таблицы верхние значения – коэффициенты парной корреляции для показателей у больных ВМД, нижние – у здоровых лиц. Надстрочные индексы показывают достоверность коэффициентов парной корреляции (* - p<0,05; ** - p<0,01)
Кроме того, выявлена высокая корреляционная взаимосвязь между показателями МДА и концентрацией ТВНР пациентов с неоваскулярной ВМД и, напротив, слабая статистически незначимая взаимосвязь этих параметров у здоровых лиц. Полученные результаты свидетельствуют об активации прооксидантных реакций, обусловленных увеличением интегрального показателя ТВНР, в значительной мере сопряженного с реакциями перекисного окисления липидов (ПОЛ).
Результаты анализа коэффициентов парной корреляции про– и антиоксидантных реакций выявили статистически значимые обратные корреляционные взаимосвязи между показателями СОД и ТВНР, СОД и МДА при неоваскулярной ВМД, а также между СОД и МДА у здоровых лиц, что, вероятно, свидетельствует об исключительной роли СОД в функционировании сложноорганизованной динамической системы прооксиданты – антиоксиданты. Данные состояния про - и антиоксидантных реакций у пациентов с ВМД в зависимости от исходного уровня активности СОД в группах пациентов с неоваскулярной ВМД выявили явный дисбаланс ферментов системы АОЗ, связанный с разной степенью активности СОД (табл. 3) при сниженной ГП, достоверно сопряженный с повышенной концентрацией ТВНР и МДА в сыворотке крови.
Таблица 3
Состояние про- и антиоксидантных реакций у пациентов с неоваскулярной формой возрастной макулярной дегенерации в зависимости от исходного уровня активности супероксиддисмутазы
| Показатель | Исходный уровень СОД, U/mL | Сила влияния фактора СОД (2) | ||
| низкий (n=24) 133 ± 5,6 | норма (n=59) 169 ± 3,1 | высокий (n=15) 224 ± 12,1 | ||
| ТНВР,мкмоль/л | 639 ± 18,6 | 613 ± 10,2 | 472 ± 25,4 | 0,48** |
| МДА, мкмоль/л | 2,48 ± 0,21 | 3,17 ± 0,13 | 2,88 ± 0,37 | 0,35* |
| TAS, ммоль/л | 1,12 ± 0,07 | 1,25 ± 0,04 | 1,33 ± 0,14 | 0,53** |
| Gpx/Hb,U/gHb | 59,2 ± 3,16 | 56,7 ± 2,11 | 51,1 ± 5,40 | 0,41* |
Примечание: надстрочные индексы показывает вероятность ошибки (* - p<0,05; ** - p<0,01)
Таким образом, нами была выявлена активация системы ангиогенеза и иммунореактивности на фоне интенсификации прооксидантных реакций, изначально связанных с дисбалансом в системе ферментов АОЗ при разной степени активности СОД.
Полученные данные позволили предположить определенную диагностическую ценность исследованных параметров, и поэтому на следующем этапе нами были выполнены аналогичные исследования в динамике у 25 пациентов с ВМД, отказавшихся от проведения медикаментозной терапии и других вмешательств: при первом обращении, через 3, 6 и 12 мес.
Анализ результатов визометрии показал, что если при первом обращении у пациентов отмечался существенно сниженный уровень остроты зрения (в среднем 0,22±0,03), то через 3, 6 и 12 месяцев при отсутствии какого-либо лечения этот показатель снижался соответственно до 0,20±0,02; 0,17±0,02 и 0,13±0,01, то есть наблюдалось медленно прогрессирующее снижение зрения (табл. 4А).
Особо отметим, что у обследуемых при первом обращении на основании анализа СК и СЖ выявлено усиление активности со стороны ангиогенных реакций. Через 3 и 6 мес. наблюдался прогрессивный статистически значимый рост VEGF-A, значение которого в СК через 12 мес. в 4,3 раза превосходило таковое при первом обращении. В слезной жидкости уровеньVEGF-A возрос в 1,5 раза (табл. 4А). Отмечалось значительное повышение показателей сывороточных ТGF- 1 и ТGF- 2 при первом обращении. Через 3, 6 и 12 месяцев наблюдался дальнейший рост уровня этих цитокинов в СК. В СЖ содержание ТGF- 2 было в 1,5 раза выше нормы при первом обращении, а через 12 месяцев увеличилось в 3,5 раза по сравнению с первым обращением. Таким образом, представленные данные указывают на стремительное развитие
Таблица 4
Временная архитектоника развития патологических процессов в различных функциональных системах
больных с неоваскулярной формой возрастной макулярной дегенерации
А. Факторы ангиогенеза и иммунореактивности
| Группы пациентов | Острота зрения, ед. | Сыворотка крови | Слезная жидкость | |||||||
| TGF-1, пг/мл | TGF-2, пг/мл | VEGF-A пг/мл | TNF-, пг/мл | IL-6, пг/мл | IL-8, пг/мл | TGF-2, пг/мл | VEGF-A пг/мл | |||
| Здоровые | 1,21±0,05 | 93±6,9 | 1218±25,6 | 69±5,2 | 4,63±0,16 | 1,91±0,06 | 22,3±0,31 | 3912±131,7 | 1005±112,7 | |
| Обследование больные ВМД | 1-е | 0,22±0,03 | 138±8,4* | 1263±31,9 | 123±6,3 | 6,62±0,23* | 2,12±0,07 | 22,6±0,28 | 6120±285,4* | 2318±255,9* |
| 3 мес. | 0,20±0,02 | 151±9,8* | 1399±33,7* | 246±29,4* | 7,28±0,29* | 2,09±0,07 | 22,1±0,43 | 12061±460,2* | 3515±105,7* | |
| 6 мес. | 0,15±0,03 | 193±10,2* | 1463±31,9 | 271±34,5* | 10,3±0,35* | 2,44±0,09 | 24,7±0,39* | 13108±493,7* | 3542±171,9* | |
| 12 мес | 0,13±0,01 | 225±13,8* | 1423±33,7* | 359±40,8* | 13,6±0,41* | 2,58±0,05* | 25,6±0,43* | 13770±519,7* | 3572±143,5* | |
Б. Система про- и антиоксидантных реакций
| ТНВР мкмоль/л | МДА мкмоль/л | TAS ммоль/л | СОД U/mL | Gpx/Hb U/gHb | ||
| Здоровые | 378 ± 18,6 | 2,13 ± 0,18 | 1,42 ± 0,05 | 174 ± 4,1 | 68,4 ± 3,2 | |
| Обследование больные ВМД | 1-е | 398 ± 11,2 | 2,20 ± 0,11 | 1,36 ± 0,04 | 168 ± 2,7 | 59,5 ± 2,8* |
| 3 мес. | 459 ± 17,8* | 2,53 ± 0,12 | 1,31 ± 0,04 | 166 ± 2,2 | 57,3 ± 2,6* | |
| 6 мес. | 494 ± 16,3* | 2,68 ± 0,14* | 1,29 ± 0,03* | 164 ± 2,3* | 57,1 ± 2,6* | |
| 12 мес | 589 ± 13,4* | 2,82 ± 0,15* | 1,22 ± 0,03* | 160 ± 2,1* | 56,7 ± 2,5* | |
Примечание: надстрочные индексы показывают достоверность различия параметров у больных ВМД по сравнению со здоровыми лицами (* - p<0,05; ** - p<0,01; *** - p<0,001)
пролиферации со стороны эндотелия и рост новообразованных сосудов, на активацию экссудативного процесса и при неоваскулярной форме ВМД.
В эти же сроки наблюдения при проведении ФАГД и морфометрии сетчатки у этих пациентов отмечали формирование грубого хориоретинального рубца на фоне длительно существующего отека сетчатки, а субретинальная неоваскуляризация заняла значительную площадь центральной зоны. Помимо снижения остроты зрения, прогрессивный рост СНМ сопровождался повторными рецидивами субретинальных геморрагий, нарастанием интраретинального отека, распространяющегося в парамакулярную область глазного дна.
Анализ динамики провоспалительных цитокинов показал, что при первом посещении отмечался статистически значимый повышенный уровень TNF-, в то время как IL-6 и IL-8 находились в пределах нормы. Через 3, 6 и 12 месяцев наблюдался дальнейший рост уровня TNF- в СК. Содержание провоспалительных цитокинов достоверно повысилось на завершающем сроке, при этом значение показателя IL-6 возросло практически в 1,2 раза по сравнению с начальным этапом наблюдения и в 1,3 раза по сравнению с нормой и составило 2,58±0,05 пг/мл. У этих же пациентов нами были выявлены выраженные изменения в системе про- и антиоксидантных реакций в ходе всего срока наблюдения. Данные таблицы 4Б наглядно демонстрируют достоверное прогрессивное снижение активности внутриэритроцитарных ферментов системы АОЗ СОД и ГП, в большей степени ГП и, напротив, достоверный рост уровня общих ТВНР и МДА.
Таблица 5
Корреляционные взаимосвязи остроты зрения, активности факторов неоангиогенеза, иммунореактивности и системы про- и антиоксидантных реакций в процессе развития патологических изменений у пациентов с неоваскулярной формой возрастной макулярной дегенерации
| Показатель | Коэффициент парной корреляции с остротой зрения | |
| Сыворотка крови | Трансформирующий фактор роста 1 (TGF-1) | –0,62 p<0,01 |
| Трансформирующий фактор роста 2 (TGF-2) | –0,16 p>0,05 | |
| Фактор роста эндотелия сосудов А (VEGF-A) | –0,78 p<0,001 | |
| Фактор некроза опухолей – (TNF-) | –0,71 p<0,005 | |
| Интерлейкин IL-6 | –0,36 p<0,01 | |
| Интерлейкин IL-8 | –0,09 p<0,01 | |
| СЖ | Трансформирующий фактор роста 2 (TGF-2) | –0,84 p<0,001 |
| Фактор роста эндотелия сосудов А (VEGF-A) | –0,67 p<0,001 | |
| Общие биологические гидропероксиды (ТНВР) | –0,44 p<0,05 | |
| Малоновый диальдегид (МДА) | –0,41 p<0,05 | |
| Общий антиоксидантный статус (TAS) | +0,39 p<0,05 | |
| Супероксиддисмутаза (СОД) | +0,25 p<0,05 | |
| Селензависимая глутатионпероксидаза (Gpx/Hb) | +0,32 p<0,05 | |
В рамках корреляционного анализа установлены достоверные сильные обратные взаимосвязи между показателями остроты зрения и трансформирующим фактором роста TGF-1, фактором роста эндотелия сосудов VEGF-A, фактором некроза опухолей TNF- в СК пациентов с ВМД, а также трансформирующим фактором роста TGF-2, фактором роста эндотелия сосудов VEGF-A в СЖ (табл. 5).
Выявлены умеренные статистически значимые прямые корреляционные взаимосвязи между степенью активности ферментов системы АОЗ, общего антиоксидантного статуса и остротой зрения.
Данные таблицы 6 отражают динамику развития патологических изменений в системах ангиогенеза, иммунореактивности про- и антиоксидантных реакций у пациентов с ВМД.
Таблица 6
Градиент остроты зрения, активности факторов неоангиогенеза, иммунореактивности и системы про- и антиоксидантных реакций за 12 месяцев в процессе развития патологических изменений у пациентов с неоваскулярной формой возрастной макулярной дегенерации
| Показатель | Процент изменения | Сила влияния фактора времени | |
| Острота зрения | 41 ± 5,6 | 2=0,22 (p<0,05) | |
| Сыворотка крови | Трансформирующий фактор роста 1 (TGF-1) | 63 ± 7,2 | 2=0,38 (p<0,01) |
| Трансформирующий фактор роста 2 (TGF-2) | 12 ± 1,4 | 2=0,07 (p>0,05) | |
| Фактор роста эндотелия сосудов А (VEGF-A) | 190 ± 10,1 | 2=0,81 (p<0,001) | |
| Фактор некроза опухолей – (TNF-) | 82 ± 7,0 | 2=0,46 (p>0,01) | |
| Интерлейкин IL-6 | 22 ± 1,8 | 2=0,15 (p>0,05) | |
| Интерлейкин IL-8 | 13 ± 0,5 | 2=0,07 (p>0,05) | |
| Слезная жидкость | Трансформирующий фактор роста 2 (TGF-2) | 125 ± 8,4 | 2=0,68 (p<0,01) |
| Фактор роста эндотелия сосудов А (VEGF-A) | 54 ± 3,3 | 2=0,32 (p<0,05) | |
| Общие биологические гидропероксиды (ТНВР) | 48 ± 3,9 | 2=0,26 (p<0,05) | |
| Малоновый диальдегид (МДА) | 28 ± 1,7 | 2=0,18 (p>0,05) | |
| Общий антиоксидантный статус (TAS) | 11 ± 0,4 | 2=0,08 (p>0,05) | |
| Супероксиддисмутаза (СОД) | 5 ± 0,3 | 2=0,05 (p>0,05) | |
| Селензависимая глутатионпероксидаза (Gpx/Hb) | 4 ± 0,2 | 2=0,05 (p>0,05) | |
Результаты дисперсионного анализа позволяют предположить первоочередную роль трансформирующих факторов роста TGF-1, 2, фактора роста эндотелия сосудов VEGF-A, а также TNF- в процессе развития неоваскуляризации при ВМД и значительного падения зрения. При этом активация прооксидантных процессов на фоне недостаточности системы АОЗ, по-видимому, носит неспецифический общепатологический характер (табл. 6).
Следует обратить внимание, что в срок наблюдения пациентов, находящихся без медикаментозного вмешательства в течение 12 мес. острота зрения снижается в среднем на 41%, при этом скорость развития патологических процессов и, в частности ангиогенеза, фиброгенеза на местном уровне превышает таковую и составляет 54% (2=0,32; p<0,05) и 125% соответственно (2=0,68 (p<0,01)), а на системном уровне скорость развития проангиогенных механизмов и прооксидантных реакций - 190% (2=0,81; p<0,001) и 48% (2=0,26; p<0,05).
Таким образом, полученные данные позволяют сделать вывод о том, что скорость развития патологических изменений в системе ангиогенеза выше скорости развития клинических проявлений неоваскулярной ВМД. Повышение уровня TGF-1 и TNF- в сыворотке крови, TGF-2 и VEGF-A в слезной жидкости при одновременной активизации прооксидантных реакций может быть ранним диагностическим признаком развития субретинальной неоваскуляризации у пациентов с ВМД.
В ходе исследования нами было выявлено, что фотодинамическая терапия сопровождается улучшением остроты зрения при сохраняющейся негативной тенденции при применении стандартной медикаментозной терапии (Рис. 1).
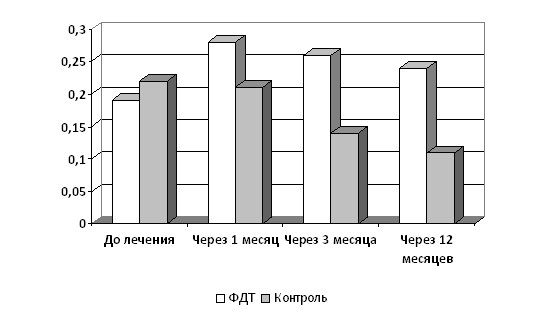
Рисунок 1. Динамика остроты зрения у пациентов с неоваскулярной ВМД в процессе лечения.
Это в первую очередь подтверждается структурными изменениями в центральной зоне сетчатки (табл. 7). Результаты морфометрии сетчатки с помощью метода RTA наглядно демонстрировали изменения как субретинального пространства, так и нейроэпителия в целом.
Таблица 7
Динамика средних значений морфометрических показателей (мкм)
в центральной зоне сетчатки у пациентов с неоваскулярной формой
возрастной макулярной дегенерации в процессе лечения
| Показатель | ФДТ (основная группа) | Стандартная терапия (контрольная группа) | ||
| До лечения | После лечения | До лечения | После лечения | |
| Толщина парафо-веолярной области | 179 ± 8,1 | 150 ± 6,2* | 187 ± 9,0 | 195 ± 9,7 |
| Толщина в фовеальной области | 261 ± 14,2 | 210 ± 12,9* | 245 ± 12,7 | 228 ± 14,3 |
| Толщина над СНМ | 374 ± 19,6 | 258 ± 17,4* | 319 ± 18,5 | 302 ± 17,7 |
Примечание: надстрочные индексы показывают достоверность различия динамики параметров у больных ВМД в процессе лечения (* - p<0,05; ** - p<0,01)
После ФДТ в основной группе отмечалась положительная динамика - снижение показателя уровня VEGF- A в СК (табл. 8). В группе больных, получавших курс традиционной терапии, наблюдалось дальнейшее повышение сывороточного VEGF- A. Через 12 мес. у всех пациентов отмечалось увеличение уровня этого показателя, наиболее выраженное в контрольной группе, что позволяет предположить нарастание гипоксии и угрозу рецидива неоваскуляризации в отдаленные сроки заболевания.
В СЖ у пациентов I группы после проведения ФДТ также имела место положительная динамика уровня VEGF-A. У пациентов II группы в этот период выявлено изменение показателя VEGF-A, в 3 раза превышающее исходный уровень и в 4 раза у здоровых лиц (табл. 8).
Через 12 мес. в СЖ определялся подъем уровня VEGF-A, наиболее выраженный у пациентов, получавших курс медикаментозной терапии, что позволяет предположить нарастание гипоксии и угрозу рецидива неоваскуляризации в отдаленные сроки заболевания.
Анализ результатов исследования TGF-1, TGF- 2 показал увеличение содержания этих цитокинов в динамике у пациентов II группы. На основании данных клинико-инструментального исследования (ФАГД, морфометрии сетчатки, ЭРГ) в динамике у пациентов, получавших медикаментозную терапию, формировался грубый хориоретинальный рубец, который привел к выраженному снижению зрительных функций.
Результаты исследования провоспалительных цитокинов в сыворотке крови показали отсутствие их изменений после проведения ФДТ в I группе и статистически недостоверное повышение этих показателей у пациентов, получающих курс традиционной медикаментозной терапии (табл. 8).
Таблица 8
Динамика факторов ангиогенеза и иммунореактивности в СК и СЖ у пациентов
с неоваскулярной формой возрастной макулярной дегенерации в процессе лечения
| Показатель | Время наблюдения | Группа I ФДТ (n=45) | Группа II контроль (n=53) |
| VEGF-A, пг/мл (СК) | До лечения | 246 ± 29,4 | 257 ± 26,6 |
| После лечения | 162 ± 26,3* | 271 ± 34,5 | |
| Через 12 мес. | 281 ± 34,5 | 359 ± 40,8* | |
| VEGF-A, пг/мл (СЖ) | До лечения | 3508 ± 183,3 | 3542 ± 171,9 |
| После лечения | 1411 ± 76,5* | 4272 ± 194,1* | |
| Через 12 мес. | 3030 ± 159,0* | 4760 ± 202,4* | |
| TGF-1, пг/мл (СК) | До лечения | 175 ± 9,1 | 183 ± 10,4 |
| После лечения | 193 ± 9,8 | 202 ± 11,6 | |
| Через 12 мес. | 165 ± 8,3 | 247 ± 13,8* | |
| TGF-2, пг/мл (СК) | До лечения | 1522 ± 27,6 | 1465 ± 31,5 |
| После лечения | 1109 ± 20,5* | 2037 ± 40,1* | |
| Через 12 мес. | 1384 ± 25,0* | 2492 ± 56,8* | |
| ТNF-, пг/мл (СК) | До лечения | 13,5 ± 0,67 | 13,7 ± 0,72 |
| После лечения | 13,2 ± 0,61 | 14,9 ± 0,74 | |
| Через 12 мес. | 15,8 ± 0,74* | 16,4 ± 0,85* | |
| IL-6, пг/мл (СК) | До лечения | 2,53 ± 0,07 | 2,61 ± 0,08 |
| После лечения | 2,40 ± 0,06 | 2,69 ± 0,09 | |
| Через 12 мес. | 2,76 ± 0,09* | 3,15 ± 0,11* | |
| IL-8, пг/мл (СК) | До лечения | 25,1 ± 0,74 | 25,9 ± 0,82 |
| После лечения | 24,7 ± 0,69 | 27,4 ± 0,86 | |
| Через 12 мес. | 24,7 ± 0,69 | 28,4 ± 0,91* |
Примечание: надстрочные индексы показывают достоверность различия динамики параметров у больных ВМД в процессе лечения и в отдаленном периоде (* - p<0,05)
В отдаленные сроки наблюдения отмечалось достоверное незначительное повышение содержания фактора некроза опухоли ТNF- и интерлейкина 6 в СК у больных сравниваемых групп. Уровень интерлейкина – 8 в дальнейшем повышался до 28,4 ± 0,91 пг/мл у пациентов группы контроля.
При проведении ФДТ не выявлено значительного повышения экспрессии провоспалительных цитокинов. Поэтому можно сделать вывод о правильно подобранном режиме фотодинамического воздействия. Однако сохраняющийся провоспалительный компонент может являться фактором риска рецидива неоваскуляризации в отдаленные сроки заболевания у пациентов основной группы.
После проведения ФДТ в I группе имело место статистически значимое повышение активности СОД (169 ± 3,6 U/mL) и ГП (59,9 ± 2,4 U/gHb) по сравнению с нормой (Табл. 9). При этом наблюдалось незначительное снижение концентрации МДА и стабилизация содержания ТВНР в сыворотке крови, что явилось основанием констатировать некоторую тенденцию к восстановлению нарушения функционирования внутриэритроцитарной ферментной системы.
Дальнейшее снижение уровня общего антиоксидантного статуса указывает на прооксидантный характер воздействия ФДТ и позволяет предположить первичный ответ СОД на фотодинамическое воздействие. Как видно из таблицы 9, в эти же сроки в группе больных, получавших курс традиционной медикаментозной терапии, наблюдалось прогрессивное снижение показателей активности СОД и ГП, создающее угрозу накопления активных интермедиатов кислорода, и свидетельствующее об истощении ферментного звена первой линии АОЗ. Незначительные колебания значений концентрации гидроперекисей ТВНР в системном кровотоке в сторону снижения, и показателя общего антиоксидантного статуса TAS в сторону повышения, отражали характер воздействия стандартной терапии, включающей как обязательный компонент препараты антиоксидантного действия.
Таблица 9
Влияние фотодинамической терапии на регресс патологических проявлений неоваскулярной формы возрастной макулярной дегенерации в системе
про - и антиоксидантных реакций
| Показатели | Время наблюдения | Группа I ФДТ (n=45) | Группа II контроль (n=53) |
| Общие гидроперекиси (ТВНР), мкмоль/л | До лечения | 579 ± 12,3 | 596 ± 14,0 |
| После лечения | 537 ± 10,1* | 590 ± 13,4 | |
| Через 12 мес. | 502 ± 9,6* | 734 ± 18,5* | |
| Малоновый диальдегид (МДА), мкмоль/л | До лечения | 2,86 ± 0,09 | 2,78 ± 0,08 |
| После лечения | 2,36 ± 0,07* | 2,70 ± 0,07 | |
| Через 12 мес. | 2,52 ± 0,08* | 3,15 ± 0,11* | |
| Антиоксиданты суммарно (TAS), ммоль/л | До лечения | 1,25 ± 0,04 | 1,19 ± 0,03 |
| После лечения | 1,12 ± 0,03 | 1,22 ± 0,04 | |
| Через 12 мес. | 1,11 ± 0,02 | 1,24 ± 0,04 | |
| Супероксиддисмутаза (СОД), U/mL | До лечения | 153 ± 3,5 | 167 ± 3,9 |
| После лечения | 169 ± 3,6* | 162 ± 3,8 | |
| Через 12 мес. | 161 ± 3,4 | 154 ± 3,5 | |
| Селензависимая глутатионпероксидаза (Gpx/Hb), U/gHb | До лечения | 55,0 ± 2,3 | 57,9 ± 2,9 |
| После лечения | 59,9 ± 2,4 | 54,6 ± 2,7 | |
| Через 12 мес. | 57,6 ± 2,2 | 54,1 ± 2,6 |
Примечание: надстрочные индексы показывают достоверность различия динамики параметров у больных ВМД в процессе лечения и в отдаленном периоде(* - p<0,05).
Через год у пациентов основной группы выявлено снижение показателя активности СОД в сыворотке крови, который, однако, оставался выше исходного уровня. Результаты исследования концентрации ТВНР у этих пациентов указывают на их дальнейшее снижение. Уровень TAS продолжал снижаться и к концу исследования составлял 1,11 ± 0,02 Ммоль/л. Кроме того, наблюдалось повышение концентрации МДА в сыворотке крови, достоверно не отличающееся от исходного уровня.
Таким образом, результаты исследования системы прооксиданты–анти-оксиданты у пациентов с неоваскулярной ВМД при проведении ФДТ, дают основание констатировать некоторую тенденцию к нормализации функции ферментного звена и сохранение сформированного дисбаланса в системе ферментов АОЗ.
Данные, полученные после лечения у пациентов основной группы, коррелировали с положительной динамикой остроты зрения, а также с результатами ФАГД, морфометрии сетчатки и показателями функциональной активности сетчатки.
У пациентов ІІ группы было выявлено дальнейшее повышение показателя TAS. При этом показатели активности СОД и ГПО оставались значительно сниженными по сравнению с таковыми до лечения и в группе здоровых лиц. Прирост TAS у пациентов этой группы, вероятно, связан с приемом антиоксидантов, являющихся неотъемлемой частью комплексной медикаментозной терапии ВМД. Значительное увеличение уровня гидроперекисей и малонового диальдегида свидетельствовало об интенсификации эндогенных прооксидантных реакций, тесно связанных с прогрессированием патогенных механизмов, сохранением дисбаланса ферментов антиоксидантной защиты, и, вероятно, недостаточно скорректированной дозой антиоксидантов. Результаты клинико-инструментального анализа у пациентов этой группы через 12 мес. наблюдения констатировали прогрессивный рост СНМ, в половине случаев на фоне длительно существующего отека сетчатки развились фиброзные изменения и рецидивы субретинальных кровоизлияний.
Длительно сохраняющееся снижение значений уровня общего антиоксидантного статуса и нарушение в работе основных ферментов системы АОС создают угрозу рецидива неоваскуляризации у пациентов с ВМД в отдаленные сроки. Следует отметить, что применение антиоксидантных препаратов в комплексной терапии ВМД должно осуществляться на основании результатов исследования системы прооксиданты – антиоксиданты по разработанному алгоритму.
Нами был проведен корреляционный анализ динамики остроты зрения у больных с неоваскулярной формой ВМД по непосредственным результатам лечения (таблица 10).
Таблица 10
Корреляционные взаимосвязи динамики остроты зрения у больных
с неоваскулярной формой возрастной макулярной дегенерации
по непосредственным результатам лечения
| Параметр | Коэффициент парной корреляции | Вероятность ошибки |
| Общие гидроперекиси | +0,11 | 0,594 |
| Малоновый диальдегид | –0,07 | 0,851 |
| Антиоксиданты суммарно | –0,37* | 0,028 |
| Супероксиддисмутаза | –0,18 | 0,489 |
| Селензависимая глутатионпероксидаза | –0,15 | 0,516 |
| Трансформирующий фактор роста TGF-1 | +0,20 | 0,420 |
| Трансформирующий фактор роста TGF- 2 | –0,43* | 0,012 |
| Фактора роста эндотелия сосудов VEGF-A (сыворотка крови) | –0,36* | 0,031 |
| Фактора роста эндотелия сосудов VEGF-A (слезная жидкость) | –0,58** | 0,008 |
| Фактор некроза опухоли ТNF- | +0,10 | 0,602 |
| Интерлейкин 6 | +0,28* | 0,043 |
| Интерлейкин 8 | –0,13 | 0,527 |
Установлены достоверные обратные корреляционные взаимосвязи между показателями остроты зрения, и трансформирующим фактором роста TGF- 2, фактором роста эндотелия сосудов VEGF-A в сыворотке крови и слезной жидкости, а также общим антиоксидантным статусом. При этом парный корреляционный анализ выявил статистически значимую взаимосвязь показателей остроты зрения и интерлейкина-6.
ВЫВОДЫ
1.Формирование субретинальной неоваскуляризации при ВМД на фоне прогрессирующего снижения остроты зрения характеризуется комплексом взаимообусловленных патологических процессов на местном уровне в тканях глаза (повышением активности факторов ангиогенеза, усилением провоспалительных реакций, индукцией экспрессии трансформирующих факторов роста) и общесистемными проявлениями заболевания (дисбалансом в системе про- и антиоксидантных реакций).
2. Динамика развития этих процессов отличается различной скоростью и выраженностью и по ряду параметров опережает скорость снижения остроты зрения, что позволяет провести раннюю диагностику начала формирования субретинальной неоваскуляризации на ранних этапах ВМД. В наибольшей степени это относится к повышению содержания фактора роста эндотелия сосудов - VEGF-A, трансформирующего фактора роста TGF-1, фактора некроза опухолей TNF- в сыворотке крови (на 190%, 63% и 82% соответственно), VEGF-A и трансформирующего фактора роста TGF-2 (на 54% и 125%) в слезной жидкости, при обязательном усилении активности прооксидантных процессов на системном уровне.
3. Фотодинамическое воздействие реализует свой биологический и лечебный эффект через активацию фотосенсибилизатора «Фотосенс», что сопровождается значительным угнетением продукции факторов ангиогенеза, адекватным ответом со стороны провоспалительных реакций и, в итоге, исчезновению очага неоваскуляризации, улучшением остроты зрения (на 41 %) в течение нескольких месяцев после воздействия.
4. Вместе с тем одновременно отмечается возрастающее увеличение дисбаланса в системе про- и антиоксидантных реакций, что с одной стороны, является одним из свидетельств угнетения неоваскуляризации на местном уровне, однако в перспективе может создать некоторые предпосылки для дальнейшего развития ВМД, о чем свидетельствует снижение общего антиоксидантного статуса, нарастание продукции фактора роста эндотелия сосудов, указывающего на усиление гипоксии и угрозу рецидива субретинальной неоваскуляризации. Для предупреждения развития этих нежелательных процессов может потребоваться применение антиоксидантных препаратов с целью повышения эффективности ФДТ и предотвращения прогрессирования заболевания в отдаленные сроки.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Photodynamic therapy for treatment subretinal neovascularization / S.Avetisov, M. Budzinskaya, T. Kiseleva, N. Balatskaya, I. Gurova, V. Loschenov, S. Shevchik, S. Kuzmin, G. Vorozhtsov // Proceedings of SPIE. – 2007. - Vol. 6632. – Therapeutic Laser Applications and Laser-Tissue Interactions III663212.
- Динамика уровня цитокинов и антиоксидантного статуса в сыворотке крови пациентов с субретинальной неоваскулярной мембраной в процессе фотодинамической терапии с препаратом «Фотосенс» / Н.В. Балацкая, Л.Б. Краснова, К.А. Парсункова, И.А. Гандурина, Н.А. Гольдина, М.В. Будзинская, С.Г. Кузьмин, Г.Н. Ворожцов // Всероссийский научный форум «Инновационные технологии медицины XXI века»: Тезисы докладов. – М., 2006. – С. 20.
- Влияние фактора роста эндотелия сосудов и трансформирующего фактора роста на развитие субретинальной неоваскулярной мембраны / М.В. Будзинская, Н.В. Балацкая, Т.Н. Киселева, Л.Б. Краснова, Н.Н. Сафарли, И.В. Гурова // Научно-практическая конференция «Вопросы офтальмологии»: Сборник статей. – Выпуск пятый. – Омск, 2007. – С.66 - 67.
- Роль основных ангиогенных факторов в развитии субретинальной неоваскуляризации / М.В. Будзинская, Н.В. Балацкая, Т.Н. Киселева, Л.Б. Краснова, Н.Н. Сафарли, И.В. Гурова // II Всероссийская научная конференция молодых учёных «Актуальные проблемы офтальмологии»: Тезисы докладов. – М., 2007. – С. 249 - 251.
- Состояние антиоксидантного статуса, спектра цитокинов и факторов роста при оценке эффективности фотодинамической терапии препаратом «Фотосенс» у больных с субретинальной неоваскулярной мембраной / Н.В. Балацкая, М.В. Будзинская, Л.Б. Краснова, И.А. Гандурина, Н.А. Гольдина, С.Г. Кузьмин, Г.Н. Ворожцов // VI Всероссийская научно-практическая конференция с международным участием «Отечественные противоопухолевые препараты»: Тезисы докладов. – Российский биотерапевтический журнал. – 2007. – № 1. – С. 9.
- Влияние фотодинамической терапии (ФДТ) препаратом фотосенс на состояние системы внутриклеточных ферментов антиоксидантной защиты у больных с неоваскулярной формой возрастной макулярной дегенерации (ВМД) / Н.В. Балацкая, Л.Б. Краснова, М.В. Будзинская, Т.Н. Киселева, И.А. Гандурина, Н.А. Гольдина, С.Г. Кузьмин, Г.Н. Ворожцов // VII Всероссийская научно-практическая конференция с международным участием «Отечественные противоопухолевые препараты»: Тезисы докладов. – Российский биотерапевтический журнал. – 2008. – №1. – С.11-12.
- Роль фактора роста эндотелия в развитии субретинальной неоваскуляризации различного генеза / М.В. Будзинская, Н.В. Балацкая, Т.Н. Киселева, Л.Б. Краснова, Н.Н. Сафарли, А.В. Халаим // Научно-практическая конференция «Офтальмоиммунология»: Тезисы докладов. – М., 2007. – С. 70-73.
- Изменение трансформирующего фактора роста у пациентов с субретинальной неоваскулярной мембраной / М.В. Будзинская, Н.В. Балацкая, Т.Н. Киселева, Л.Б. Краснова, Н.Н. Сафарли // Научно-практическая конференция «Офтальмоиммунология»: Тезисы докладов. – М., 2007. – С. 74-76.
- Окислительный гомеостаз у пациентов с субретинальной неоваскулярной мембраной на фоне фотодинамической терапии / Н.В. Балацкая, Л.Б. Краснова, М.В. Будзинская, Т.Н. Киселева, И.А. Гандурина, Н.А. Гольдина, С.Г. Кузьмин, Г.Н. Ворожцов // Международная конференция «Профессиональное долголетие и качество жизни АСВОМЕД»: Тезисы докладов. – М., 2007. – С. 30-31.
- Биохимические эффекты фотодинамической терапии субретинальной неоваскуляризации у пациентов с возрастной макулярной дегенерацией / Н.В. Балацкая, В.К. Фролков, Т.Н. Киселева, Л.Б. Краснова, М.В. Будзинская, И.А. Гандурина, Н.А. Гольдина, С.Г. Кузьмин, Г.Н. Ворожцов // Всероссийский научный форум по восстановительной медицине, лечебной физкультуре, курортологии, спортивной медицине и физиотерапии «РеаСпоМед»: Тезисы докладов. – М., 2008. – С.19-20.
- Влияние фотодинамической терапии (ФДТ) на активность антиоксидантной системы (АОС) и процессы перекисного окисления липидов (ПОЛ) больных неоваскулярной формой возрастной макулярной дегенерации (ВМД) / Н.В. Балацкая, В.К. Фролков, М.В. Будзинская, Т.Н. Киселева, Л.Б. Краснова, И.А. Гандурина, Н.А. Гольдина, С.Г. Кузьмин, Г.Н. Ворожцов // X Международная конференция АСВОМЕД«Современные технологии восстановительной медицины: Тезисы докладов. – Сочи, 2008. – С. 39-41.
- Состояние системы антиоксидантной защиты у пациентов с неоваскулярной формой возрастной макулярной дегенерации при проведении фотодинамической терапии / Н.В. Балацкая, В.К. Фролков, М.В. Будзинская, Т.Н. Киселева, Л.Б. Краснова, И.А. Гандурина, Н.А. Гольдина // Вестник восстановительной медицины. – 2008 – № 6. – С. 92 - 95.
- Патент на изобретение «Способ прогнозирования субретинальной неоваскулярной мембраны» / Л.Б. Краснова, Н.В. Балацкая, М.В. Будзинская, Т.Н. Киселёва и др. RU 2 350 274 от 11. 07.07.
СПИСОК СОКРАЩЕНИЙ
ВМД – возрастная макулярная дегенерация
ГП – селензависимая глутатионпероксидаза
ДЗН – диск зрительного нерва
МДА – малоновый диальдегид
СЖ – слезная жидкость
СК – сыворотка крови
СНМ – субретинальная неоваскулярная мембрана
СОД – супероксиддисмутаза
ФАГД – флюоресцентная ангиография глазного дна
ФДТ – фотодинамическая терапия
ФС – фотосенсибилизатор
ЭРГ – электроретинография
IL- 6 – интерлейкин 6
IL- 8 – интерлейкин 8
TAS – общий антиоксидантный статус
ТВНР – общие биологические гидропероксиды
TGF-1 – трансформирующий фактор роста 1
TGF-2 – трансформирующий фактор роста 2
ТNF- – фактор некроза опухолей
VEGF-A – фактор роста эндотелия сосудов

