Влияние длинноволнового ультрафиолетового излучения уфа-1 диапазона на клинические и иммуноморфологические показатели у больных ограниченной склеродермией
На правах рукописи
МУРАДЯН
Нана Левоновна
ВЛИЯНИЕ ДЛИННОВОЛНОВОГО УЛЬТРАФИОЛЕТОВОГО
ИЗЛУЧЕНИЯ УФА-1 ДИАПАЗОНА НА КЛИНИЧЕСКИЕ
И ИММУНОМОРФОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ
У БОЛЬНЫХ ОГРАНИЧЕННОЙ СКЛЕРОДЕРМИЕЙ
14.01.10 - кожные и венерические болезни
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
МОСКВА – 2010
Работа выполнена в отделе дерматологии Федерального государственного учреждения «Государственный научный центр дерматовенерологии Федерального агентства по высокотехнологичной медицинской помощи».
Научные руководители:
доктор медицинских наук Волнухин Владимир Анатольевич
кандидат медицинских наук,
доцент Катунина Оксана Рахимовна
Официальные оппоненты:
доктор медицинских наук,
профессор Гребенюк Владислав Николаевич
доктор медицинских наук Мордовцева Вероника Владимировна
Ведущая организация: Российский университет дружбы народов, г. Москва
Защита диссертации состоится « » ______________ 2010 г. на заседании Диссертационного совета (Д 208.115.01) при ФГУ «Государственный научный центр дерматовенерологии Федерального агентства по высокотехнологичной медицинской помощи» по адресу: 107076, г. Москва, ул. Короленко, д. 3, стр. 6
С диссертацией можно ознакомиться в библиотеке ФГУ «ГНЦД Росмедтехнологий».
Автореферат разослан «____» _____________2010г.
Ученый секретарь
диссертационного совета,
кандидат медицинских наук Наталия Константиновна Иванова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
В последние десятилетия наблюдается увеличение числа больных ограниченной склеродермией (Молочков В.А. с соавт., 2002; Суворов А.П., Черняева О.В., 2002; Peterson L.S. et al., 1997; Mayes M.D., 1998). Этиология заболевания до настоящего времени остаётся невыясненной; в патогенезе основное значение придаётся дисфункции иммунной системы, нарушениям метаболизма компонентов соединительной ткани и микроциркуляции (Никитина М.Н., 1980; Гусева Н.Г., 1993; Скрипкин Ю.К. с соавт., 1996; Lovell C.R. et al., 1979; Arnold H.L. et al., 1990; Feghali C.A. et al., 1992; Legerton C.W. et. al., 1995).
Существующие методы терапии склеродермии в ряде случаев недостаточно эффективны, проводятся длительно и нередко вызывают побочные эффекты (Гребенюк В.Н., 1998; Главинская Т.А., 2000; Hunzelmann N. et al., 1998; Connolly M.K., 2001; Sapadin A.N., Fleischmajer R., 2002).
В последние годы в зарубежной литературе появились публикации о возможности лечения склеротических заболеваний кожи длинноволновым ультрафиолетовым излучением УФА-1 диапазона с длиной волны 340-400 нм, способным более глубоко проникать в кожу, по сравнению с другими ультрафиолетовыми спектрами (Krutmann J., Schpf E., 1992; Asawonando P. et al., 1999; Morita A. et al., 2000; Stnder H. et al., 2002). В отличие от метода фотохимиотерапии, УФА-1 терапия проводится без использования фотосенсибилизаторов и обладает меньшим количеством побочных эффектов (Krutmann J. et al., 2001).
При УФА-1 терапии облучение кожи можно проводить низкими (10-20 Дж/см2), средними (30-50 Дж/см2) и высокими (130 Дж/см2) разовыми дозами (Mang R., Krutmann J., 2005; Kreuter A. et al., 2009). В большинстве работ, посвященных изучению эффективности применения данного диапазона в лечении больных ограниченной склеродермией, облучение проводилось высокими разовыми дозами. Однако, в экспериментальных исследованиях на мышах установлено, что облучение кожи высокими дозами УФА-1 света может индуцировать развитие плоскоклеточного рака кожи (Sterenborg H.J., van der Leun J.C., 1990; Runger T.M., 1999). Эффективность лечения ограниченной склеродермии низкими и средними дозами излучения изучена недостаточно. В отечественной практике данный метод лечения не разработан.
Возникновение очагов склеродермии на коже обусловлено развитием в дерме хронического воспаления (Fleischmajer R. et al., 1983; Khri V.-M., 1993; Mauch C.M. et al., 1993; Black C.M., 1999), одним из проявлений которого является периваскулярная и/или диффузная клеточная инфильтрация кожи. В доступной литературе имеются лишь единичные сведения о влиянии УФА-1 терапии на субпопуляционный состав и активацию дермальных лимфоцитов у больных ограниченной склеродермией.
Известно, что в формировании фиброза кожи принимают участие различные цитокины и ростовые факторы, влияющие на активацию и пролиферацию фибробластов (Chen K. et al., 2003; Badea I. et al., 2008; Yamamoto T., 2009). Основными из них являются трансформирующий фактор роста бета 1 (TGF-1) и тромбоцитарный фактор роста (PDGF). Показано, что эти факторы стимулируют рост и пролиферацию фибробластов, способствуют формированию их фиброгенного фенотипа, а также индуцируют синтез и отложение в коже коллагена и других компонентов экстрацеллюлярного матрикса (Liu B., Connoly M.K., 1998; Kissin E.Y. et al., 2002; Pannu J. et al., 2004; Bonner J.C., 2004; Trojanowska M., 2008; Andrae J. et al., 2008). Вопрос об участии указанных цитокинов в реализации механизмов действия УФА-1 терапии практически не изучен.
Всё вышесказанное обусловливает актуальность проведения исследований, направленных на разработку метода лечения больных ограниченной склеродермией низкими и средними дозами длинноволнового ультрафиолетового излучения УФА-1 диапазона, оценку его эффективности, а также изучение механизмов терапевтического действия.
Цель работы: разработка метода лечения больных ограниченной склеродермией низкими и средними дозами длинноволнового ультрафиолетового излучения УФА-1 диапазона на основе комплексных иммуноморфологических исследований клеточных иммунных механизмов и содержания профиброзных цитокинов в очагах поражения.
Задачи:
- Изучить эффективность лечения больных ограниченной склеродермией низкими и средними дозами длинноволнового ультрафиолетового излучения УФА-1 диапазона.
- Провести изучение морфологических изменений кожи, развивающихся в очагах склеродермии, после курса УФА-1 терапии.
- Провести исследование динамики содержания в коже больных субпопуляций Т-хелперов/индукторов (CD4+) и супрессорно-цитотоксических Т-лимфоцитов (CD8+), а также клеток, экспрессирующих активационные маркеры HLA-DR и CD25, в процессе курса УФА-1 терапии.
- Исследовать в дерме пораженной кожи больных содержание и распределение клеток, экспрессирующих трансформирующий фактор роста бета (TGF-1), рецептор I типа трансформирующего фактора роста бета (TGF-RI) и альфа-рецептор тромбоцитарного фактора роста (PDGFR-), до и после курса УФА-1 терапии.
Научная новизна
Установлена эффективность лечения больных ограниченной склеродермией низкими и средними дозами длинноволнового ультрафиолетового излучения УФА-1 диапазона.
Показано положительное влияние низких и средних доз УФА-1 излучения на морфологические изменения кожи, выявляемые в очагах ограниченной склеродермии на светооптическом уровне.
Выявлен супрессивный эффект УФА-1 терапии на процессы иммунного воспаления в очагах склеродермии, характеризующийся уменьшением в периваскулярных инфильтратах кожи количества супрессорно-цитотоксических Т-лимфоцитов, а также клеток, экспрессирующих маркеры ранней активации CD25+ и HLA-DR+.
Получены новые данные о роли трансформирующего фактора роста бета 1 в развитии ограниченной склеродермии, свидетельствующие о снижении его содержания в дерме пораженной кожи, что может быть обусловлено уменьшенной продукцией данного ростового фактора клетками, участвующими в иммунном воспалении.
Установлена важная роль в патогенезе заболевания повышенной экспрессии на клетках дермы рецепторов I типа трансформирующего фактора роста бета (TGF-RI) и альфа-рецепторов тромбоцитарного фактора роста (PDGFR-), принимающих активное участие в формировании фиброза кожи в очагах склеродермии.
Выявлен новый механизм терапевтического действия УФА-1 излучения, проявляющийся уменьшением содержания в очагах ограниченной склеродермии рецепторов I типа трансформирующего фактора роста бета (TGF-RI) и альфа-рецепторов тромбоцитарного фактора роста (PDGFR-).
Практическая значимость
Разработан новый эффективный метод лечения больных ограниченной склеродермией с использованием низких и средних доз ультрафиолетового излучения УФА-1 диапазона, определены показания и противопоказания к его применению. Внедрение метода в практику позволит повысить эффективность и сократить сроки лечения, уменьшить побочные эффекты и медикаментозную нагрузку на больных.
Основные положения, выносимые на защиту
1. Терапия низкими и средними дозами длинноволнового ультрафиолетового излучения УФА-1 диапазона является эффективным методом лечения больных ограниченной склеродермией.
2. В развитии склеродермии патогенетически значимую роль играют нарушения содержания в коже больных трансформирующего фактора роста бета (TGF-I), а также экспрессии на клетках рецепторов I типа трансформирующего фактора роста бета (TGF-RI) и альфа-рецепторов тромбоцитарного фактора роста (PDGFR-).
3. Под действием УФА-1 терапии в очагах склеродермии наблюдается уменьшение морфологических нарушений в коже, выявляемых гистологическими и гистохимическими исследованиями.
4. Лечение низкими и средними дозами длинноволнового ультрафиолетового излучения УФА-1 диапазона приводит к нормализации клеточных иммунных процессов в очагах склеродермии, о чем свидетельствует уменьшение в коже количества супрессорно-цитотоксических Т-лимфоцитов и клеток, экспрессирующих активационные маркеры CD25 и HLA-DR.
5. УФА-1 терапия способствует восстановлению в очагах поражения процессов нормального метаболизма компонентов соединительной ткани, о чем свидетельствует уменьшение после лечения исходно повышенного количества клеток, экспрессирующих рецепторы I типа трансформирующего фактора роста бета (TGF-RI) и альфа-рецепторы тромбоцитарного фактора роста (PDGFR-).
Апробация работы. Основные положения доложены и обсуждены на II Всероссийском конгрессе дерматовенерологов (Санкт-Петербург, 2007), XXV научно-практической конференции ММА им. И.М. Сеченова «Рахмановские чтения. Современная дерматовенерология: от истории к инновациям», пленарном заседании Московского общества дерматовенерологов им. А.И. Поспелова (Москва, 2008), III Всероссийского конгрессе дерматовенерологов (Казань, 2009).
Внедрение результатов исследования. Основные результаты исследований внедрены в работу отделения физиотерапии ФГУ «Государственный научный центр дерматовенерологии Росмедтехнологий» и дерматологического отделения ФГУ «Медицинская санитарная часть №7» Федерального медико-биологического агентства России. Полученные данные используются в учебном процессе на сертификационном цикле, а также в лекционных курсах и практических занятиях для ординаторов, аспирантов и врачей ФГУ «Государственный научный центр дерматовенерологиии Росмедтехнологий», кафедры дерматовенерологии и клинической микологии ФУВ ГОУ ВПО Российского государственного медицинского университета Росздрава, в лекционном курсе и на практических занятиях врачей, проходящих обучение на циклах общего и тематического усовершенствования кафедры дерматовенерологии ФГУ «Институт повышения квалификации Федерального медико-биологического агентства России». На основе материалов диссертации разработана новая медицинская технология «Лечение больных ограниченной склеродермией длинноволновым ультрафиолетовым излучением УФА-1 диапазона» (рег. удостоверение №ФС-2007/052-У от 20.04.07 г.).
Публикации. По материалам диссертации опубликовано 8 научных работ, из них 3 в журналах, рекомендованных ВАК Минобрнауки РФ.
Объем и структура диссертации
Диссертационная работа изложена на 120 страницах компьютерного текста, иллюстрирована 10 таблицами и 26 рисунками и состоит из введения, 3 глав с описанием данных литературы и результатов собственных исследований, заключения, выводов, практических рекомендаций и указателя литературы, содержащего 40 отечественных и 103 зарубежных источника.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Под клинико-лабораторным наблюдением находились 75 больных ограниченной склеродермией (60 - женского пола, 15 - мужского пола) в возрасте от 7 до 76 лет. Клиническое обследование больных включало изучение анамнеза жизни и заболевания, оценку общего и локального статуса. При анализе клинических проявлений в очагах склеродермии до и после лечения определяли площадь индурации кожи (в см2), а также интенсивность эритемы и индурации кожи, которую выражали в баллах от 0 до 3 (0 баллов соответствовал отсутствию клинического признака, 1, 2 и 3 балла – минимальной, средней и максимальной выраженности признака). До и после курса лечения всем больным проводили лабораторное обследование, включавшее клинический анализ крови и мочи, биохимическое исследование крови. С целью исключения противопоказаний к ультрафиолетовой терапии больные были консультированы терапевтом, офтальмологом, эндокринологом, гинекологом, по показаниям - другими специалистами.
Пятидесяти одному больному проведена УФА-1 терапия с использованием ультрафиолетового излучения дальнего длинноволнового диапазона (УФА-1 диапазон, длина волны 340-400 нм). Облучение осуществляли в ультрафиолетовой кабине «Waldmann UV-7001К» (рег. номер 98/647), производства фирмы Herbert Waldmann GmbH & Co (Германия), укомплектованной лампами F85/100W-TL10R, генерирующими излучение в диапазоне волн 350-400 нм с максимумом эмиссии на длине волны 370 нм. При назначении начальной дозы облучения учитывали тип кожи, степень загара и индивидуальную чувствительность больного к ультрафиолетовому свету. Процедуры проводили с режимом 3-5 раз в неделю. Облучение начинали с дозы 5-10 Дж/см2, последующие разовые дозы повышали на 5-10 Дж/см2 до максимальной разовой дозы 20-40 Дж/см2.
Группу сравнения составили 24 больных, которым проводили медикаментозное лечение, включавшее пенициллин, лидазу, вазоактивные и наружные средства. Пенициллин назначали по 1-2 миллиона ЕД в сутки, на курс 20-34 миллиона ЕД, лидазу вводили по 64 УЕ ежедневно или через день, на курс 10-15 инъекций. Витамин Е больные принимали внутрь по 0,2 г 2 раза в сутки, трентал - по 400 мг 2 раза в сутки, ксантинола никотинат - по 0,15 г 3 раза в сутки в течение 1-1,5 месяцев. Для наружного лечения применяли гепариновую мазь, 25-50% водный раствор диметилсульфоксида (ДМСО). Все пациенты получали по 2-3 курса указанной терапии с интервалом в 2-3 месяца.
Для определения терапевтической эффективности у каждого больного рассчитывали процент уменьшения клинических симптомов: интенсивности эритемы, интенсивности индурации, а также площади индурации, после чего рассчитывали процент уменьшения поражения кожи. За клиническое выздоровление принимали уменьшение поражения кожи на 95% и более, значительное улучшение - 51-94%, улучшение – 25-50%, отсутствие эффекта – менее, чем на 25%. С целью статистической обработки результаты терапии выражали в виде балла эффективности лечения: 3 балла соответствовало клиническому выздоровлению, 2 - значительному улучшению, 1 - улучшению, 0 - отсутствию эффекта.
У 10 больных до и после курса УФА-1 терапии проведены гистологические, гистохимические и иммуноморфологические исследования кожи. Биоптаты кожи до лечения брали из очагов уплотнения, после лечения – из участков ранее поражённой кожи, расположенных рядом с местом предыдущей биопсии. Иммуноморфологические исследования проводили также у 10 здоровых добровольцев (группа контроля), у которых биоптаты кожи брали при проведении косметических операций.
Биоптаты кожи подвергали стандартной гистологической обработке: фиксировали в 10% растворе забуференного формалина, осуществляли гистологическую проводку путем обезвоживания в этиловом спирте и заливки в парафин. Для проведения гистологического и гистохимического исследования срезы окрашивали гематоксилин-эозином, по методу Вейгерта и толуидиновым синим.
Для проведения иммуноморфологических исследований использовали мышиные моноклональные антитела производства фирмы «Novocastra Laboratories Ltd» (Великобритания), специфичные к CD4 - маркеру субпопуляции Т-хелперов/индукторов, CD8 - маркеру субпопуляции супрессорно-цитотоксических Т клеток, CD25 - маркеру a-цепи рецептора ИЛ-2, HLA-DR - молекуле главного комплекса гистосовместимости II класса. Исследование содержания профиброзных цитокинов проводили с использованием антител, специфичных к TGF-1 - маркеру трансформирующего фактора роста бета 1 производства фирмы «Visionbiosystems novocastra» (Великобритания), TGF-RI – маркеру рецептора I типа трансформирующего фактора роста бета 1 производства «Visionbiosystems novocastra» (Великобритания), PDGFR- – маркеру альфа-рецептора тромбоцитарного фактора роста производства «NeoMarkers Thermo Fisher Scientific» (США).
Для визуализации иммуноморфологической реакции использовали стрептавидин-биотинилированные вторичные антитела Novocastra Peroxidase Detection System производства «Leica Microsystems» (Великобритания). Срезы расправляли на предметных стеклах с полилизиновым покрытием. Постановку реакции осуществляли согласно протоколам, прилагаемым к используемым моноклональным антителам. Высокотемпературную антигенную демаскировку проводили путем кипячения в цитратном буфере (рН – 6,0) в СВЧ-печи при максимальной мощности 900 Вт тремя циклами по 5 минут с 1-минутными перерывами. Остывшие препараты промывали в растворе ТРИС-буфера (рН –7,54-7,58), обрабатывали 0,3% раствором перекиси водорода на метаноле (1:1) для предотвращения эндогенной пероксидазной активности. Инкубацию с первичными антителами проводили в течение 60 минут при температуре 23°C, со вторичными антителами - в течение 30 минут при температуре 37°С. Для завершения окрашивания осуществляли фоновое контрастирование биоптатов гематоксилином Майера.
Полученные гистологические, гистохимические и иммуногистохимические препараты заключали под покровное стекло и изучали с помощью светового микроскопа Leica DM4000В (Германия), изображение документировали цифровой камерой Leica DFC320 (Германия).
Содержание CD4+, CD8+ и CD25+ клеток в эпидермисе определяли из расчета на 100 эпителиоцитов базального слоя. При оценке содержания CD4+, CD8+, CD25+ клеток в дерме в 5 периваскулярных инфильтратах произвольно выбирали по 20 клеток, среди которых проводили подсчет количества клеток, меченных указанными антителами, после чего для каждого биоптата рассчитывали средние значения их относительного содержания. Определение содержания HLA-DR+ клеток осуществляли с использованием программы «Adobe Photoshop’CS» (версия 8). Для этого в пикселях измеряли площадь поля зрения и площадь окрашенных клеток, затем высчитывали процентное отношение площади окрашенных клеток к площади поля зрения. Экспрессию TGF-1+, TGF-RI+ и PDGFR-+ клеток в дерме оценивали путем определения количества окрашенных клеток в 1 поле зрения. Подсчет количества клеток осуществляли в 5 произвольно выбранных полях зрения, после чего для каждого биоптата рассчитывали средние значения.
Статистический анализ проводили с применением пакета прикладных программ Statistica’99 (StatSoft, США) и SPSS 16 (SPSS, Inc., США). Проверка на нормальность распределения осуществлялась с помощью критерия Шапиро-Уилкса. Описание распределений количественных и порядковых признаков в выборках представляли в виде медиан и границ интерквартильных отрезков, качественных признаков – в виде абсолютных и относительных частот. При сравнении показателей до и после лечения внутри групп использовали тест Вилкоксона, при сравнении групп друг с другом – U-критерий Манна-Уитни. Сравнение групп по качественным признакам проводили с использованием теста Хи-квадрат и точного критерия Фишера. Оценка корреляционных связей осуществлялась с помощью коэффициентов ранговой корреляции Спирмена. Критическим уровнем значимости было выбрано значение P<0,05.
Результаты исследования
Изучение эффективности терапии больных ограниченной склеродермией низкими и средними дозами УФА-1 излучения. Клиническая характеристика наблюдавшихся пациентов представлена в таблице 1. УФА-1 терапия проведена 51 больному в возрасте от 11 до 65 лет. Продолжительность заболевания у них варьировала от 3 месяцев до 10 лет. Бляшечной формой страдали 46 (90,2%) больных, линейной – 2 (3,9%), экстрагенитальным склероатрофическим лихеном – 3 (5,9%). Начальные дозы УФА-1 облучения варьировали от 5 до 20 Дж/см2 (медиана 5), максимальные дозы - от 20 до 40 Дж/см2 (медиана 30), курсовые дозы - от 321 до 1939 Дж/см2 (медиана 525). На курс пациенты получали от 15 до 60 процедур (медиана 27).
Группу сравнения составили 24 больных (20 женщин, 4 мужчин) в возрасте от 9 до 73 лет, с длительностью заболевания от 3 месяцев до 42 лет, которым проводилось лечение медикаментозными средствами. Бляшечной формой склеродермии страдали 20 больных (83,3%), линейной – 2 (8,3%), склероатрофическим лихеном – 2 (8,3%). При сравнении исходных значений клинических показателей в группах больных статистических различий по полу, возрасту, длительности и формам заболевания, а также интенсивности эритемы, интенсивности индурации и площади индурации не выявлено (P>0,05).
Таблица 1. Клиническая характеристика больных.
__________________________________________________________
Группа Группа
Клинические УФА-1 терапии медикаментозного
показатели (n=51) лечения
(n=24)
______________________________________________________________
Возраст (лет) 30 [23; 50] 31 [18,5; 58,7]
Пол (муж/жен) 38/13 4/20
Формы (Б/Л/САЛ) 46/2/3 20/2/2
Длительность
болезни (мес.) 48 [12; 120] 25 [12,5; 48]
Интенсивность
эритемы (баллы) 0,5 [0,3; 1,0] 0,5 [0,2; 1,0]
Интенсивность
индурации (баллы) 0,5 [0; 1] 0,5 [0,1; 1,0]
Площадь
индурации (см2) 29 [6,2; 60,7] 25,5 [8,5; 49,2]
__________________________________________________________
Примечание. Пол и формы заболевания указаны в абсолютных частотах, остальные
показатели в виде медиан и интерквартильных отрезков. Б – бляшечная склеродер-
мия, Л – линейная склеродермия, САЛ – экстрагенитальный склероатрофический
лихен. Уровень статистической значимости при сравнении групп по клиническим
показателям P>0,05 (U-критерий Манна-Уитни).
Анализ полученных результатов показал высокую эффективность УФА-1 терапии (рис. 1). Применение низких и средних доз УФА-1 излучения оказалось эффективным при всех наблюдавшихся формах заболевания. Клиническое выздоровление достигнуто у 4 (7,8%) пациентов, значительное улучшение - у 24 (47,1%), улучшение – у 18 (35,3%); эффект отсутствовал у 5 (9,8%) больных (табл. 2).
В процессе лечения статистически значимой динамике подвергались все изучавшиеся клинические симптомы склеродермии (рис. 2, 3). Медианы интенсивности эритемы, интенсивности индурации и площади индурации пораженной кожи после лечения уменьшились соответственно на 78% (P<0,001), 57,2% (P<0,001) и 10,4% (P<0,001).
В группе медикаментозного лечения клиническое выздоровление достигнуто у 1 (4,2%) больного. Значительное улучшение констатировано у 5 пациентов (20,8%), улучшение - у 4 (16,7 %), эффект отсутствовал у 14 (58,3%). После проведенной терапии медианы интенсивности эритемы и индурации пораженной кожи уменьшились соответственно на 24% (P=0,014) и 40,6% (P=0,157), а площадь индурации увеличилась на 9,4% (P=0,073).
При сравнении результатов в группах больных с использованием критерия Манна-Уитни балл эффективности лечения в группе УФА-1 терапии (3,0 [2,0; 3,0]) оказался статистически значимо выше, чем в группе медикаментозного лечения (1,0 [1,0; 3,0]; P=0,001). Продолжительность лечения в группе УФА-1 терапии, наоборот, оказалась меньше (2,0 [1,0; 3,5] месяцев), чем в группе сравнения (9,0 [6,3; 14,0] месяцев; P<0,001).
Интересно отметить, что при корреляционном анализе в группе УФА-1 терапии выявлена статистически значимая корреляционная связь процентов уменьшения интенсивности эритемы и индурации кожи (r=0,41, P=0,02), тогда как в группе сравнения такой зависимости не обнаружено.
УФА-1 терапия в целом хорошо переносилась больными. Побочные эффекты отмечены у 8 (15,7%) больных: 4 (7,8%) пациента отмечали сухость кожи, 2 (3,9%) - чувство жара, 1 (2%) – повышение артериального давления. У 1 больной (2%) к концу курса фототерапии появились пузыри в отдельных очагах поражения, которые разрешились после временной отмены процедур. Ни у одного больного в процессе лечения не наблюдалось развития эритемы. У большинства пациентов к концу курса облучений формировалась фотоиндуцированная пигментация кожи, исчезавшая спустя несколько месяцев после окончания лечения.
В процессе медикаментозного лечения побочные эффекты наблюдали у 9 (37,5%) пациентов: у 8 (33,3%) больных отмечены токсико-аллергические
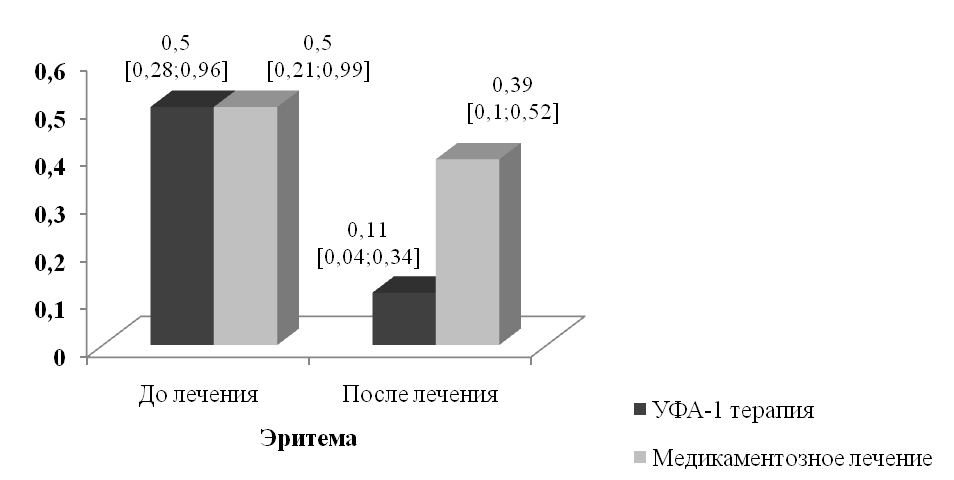
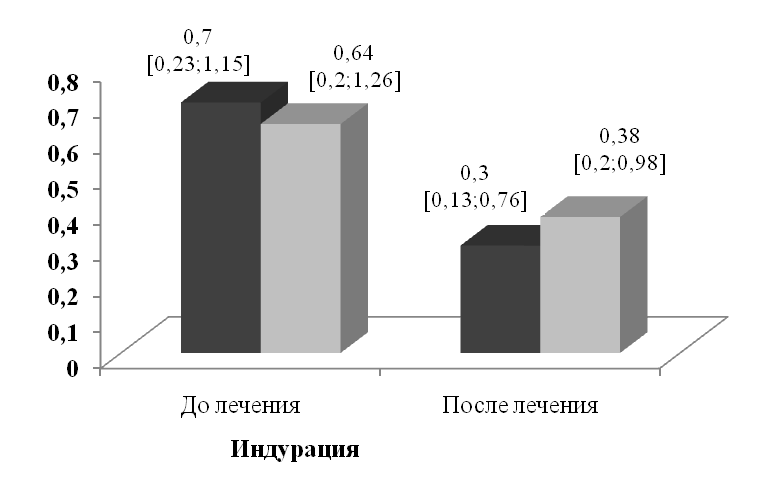
Рисунок 2. Динамика интенсивности эритемы и индурации в очагах ограниченной склеродермии в процессе лечения (баллы, медианы и квартили)
реакции, у 6 (25%) – контактный дерматит, у 4 (16,7%) – диспепсические явления.
Отдаленные результаты в группе УФА-1 терапии прослежены у 30 пациентов, в группе медикаментозного лечения - у 18. Установлено, что достигнутое в процессе лечения улучшение сохранялось в течение 1 года соответственно у 27 (90%) и 12 (66,7%) больных, в течение 2 лет – соответственно у 13 (43,3%) и 6 (33,3%).
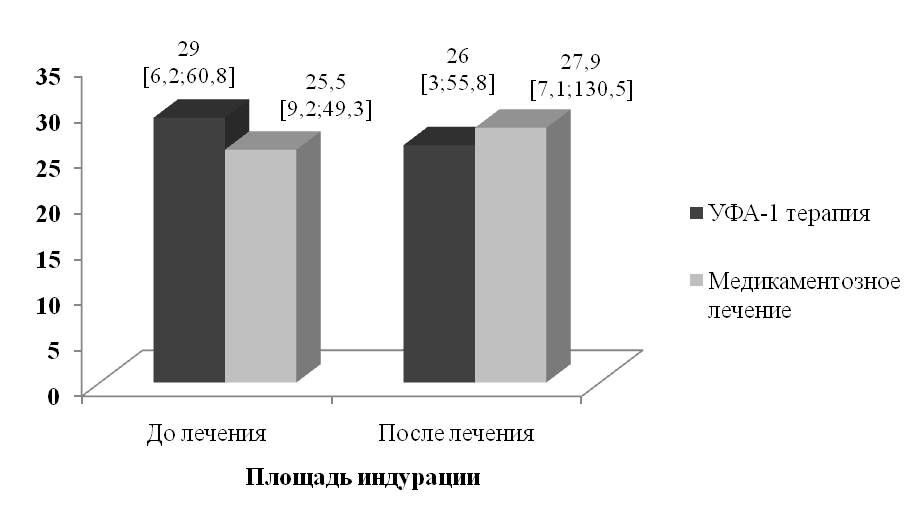
Рисунок 3. Изменение площади индурации в очагах ограниченной склеродермии в процессе лечения (см2, медианы и квартили)
Таким образом, разработанный метод УФА-1 терапия является эффективным и хорошо переносимым методом лечения больных бляшечной и линейной склеродермией, а также экстрагенитальным склероатрофическим лихеном. Применение данного метода приводит к регрессу основных клинических симптомов заболевания – эритемы и индурации кожи, что свидетельствует о его противовоспалительном и антифиброзном действии.
Изучение динамики морфологических изменений кожи в очагах склеродермии после курса УФА-1 терапии (по данным световой микроскопии).
Гистологические, гистохимические и иммуноморфологические исследования кожи проведены у 10 больных ограниченной склеродермией (4 мужчин и 6 женщин) в возрасте от 23 до 57 лет (медиана 27,5 лет) и длительностью болезни от 5 месяцев до 17 лет (медиана 1,5 года) и 10 здоровых добровольцев (5 мужчин и 5 женщин) в возрасте от 29 до 64 лет (медиана 45,5 лет). У всех больных диагностирована бляшечная форма заболевания в стадии эритемы и индурации. Группа больных не отличалась по возрасту и полу от группы здоровых добровольцев (P>0,05).
Все исследования у больных были проведены до и после курса УФА-1 терапии. На курс больные получали от 20 до 40 процедур (медиана 30 процедур). Максимальные дозы облучения варьировали от 20 до 40 Дж/см2 (медиана 30 Дж/см2), курсовые дозы - от 510 до 1939 Дж/см2 (медиана 648 Дж/см2). В результате проведенной терапии положительный эффект констатирован у 9 из 10 больных: клиническое выздоровление достигнуто у 1 пациента, значительное улучшение - у 4, улучшение - у 4. В процессе лечения в очагах склеродермии наблюдали уменьшение интенсивности как эритемы (P=0,005), так и индурации кожи (P=0,011); площадь индурации сократилась на 22% (P=0,011).
При гистологическом исследовании биоптатов кожи больных до лечения эпидермис имел неравномерную толщину с участками атрофии, в нем выявляли небольшой гиперкератоз, вакуольную дистрофию и гиперпигментацию базальных кератиноцитов, экзоцитоз единичных лимфоцитов в эпидермис. В дерме обнаруживали сглаженность дермальных сосочков, уплотнение коллагеновых волокон с признаками гомогенизации и гиалинизации, интерстициальный отек и периваскулярные инфильтраты преимущественно лимфо-гистиоцитарного характера, уменьшение общего количества капилляров и атрофию придатков кожи. При дополнительной окраске по Вейгерту отмечали выраженное нарушение структуры эластических волокон в виде их истончения, фрагментации и комкования. Изменения структуры эластических волокон были особенно заметны в местах выраженного уплотнения коллагеновых волокон; в отдельных участках они полностью отсутствовали. При окраске толуидиновым синим в инфильтратах обнаруживали умеренное количество тканевых базофилов в фазе дегрануляции.
После курса УФА-1 терапии наблюдали уменьшение атрофических изменений в эпидермисе с формированием межсосочковых выростов, отсутствие вакуольной дистрофии в базальных кератиноцитах и эпидермального экзоцитоза лимфоцитов, частичное восстановление нормальной структуры коллагеновых волокон, особенно выраженное в нижележащих отделах дермы, уменьшение периваскулярных инфильтратов, увеличение количества сосудов и придатков кожи. При окраске по Вейгерту обнаруживали частичное восстановление нормальной структуры эластических волокон. При окраске толуидиновым синим в инфильтратах находили лишь единичные тканевые базофилы.
Таким образом, у больных ограниченной склеродермией после курса УФА-1 терапии наряду с улучшением клинической картины заболевания наблюдалось уменьшение морфологических нарушений в коже.
Изучение влияния УФА-1 терапии на клеточные иммунные механизмы в коже больных ограниченной склеродермией. Иммуномофрологические исследования препаратов кожи с антителами CD4 и CD8 показали, что в группе здоровых добровольцев CD4+ и CD8+ лимфоциты в эпидермисе отсутствовали, а в дерме встречались лишь единичные клетки. В эпидермисе больных CD4+ лимфоциты также не обнаруживали, тогда как отдельные CD8+ лимфоциты находили в большинстве исследованных препаратов, нередко они располагались вблизи базального слоя эпидермиса в тесном контакте с эпителиоцитами. В дерме СD4+ клетки находили лишь в периваскулярных инфильтратах, СD8+ лимфоциты встречались как в составе периваскулярных инфильтратов, так и в виде отдельных клеток, располагавшихся в сосочковом слое дермы.
При статистическом анализе как в эпидермисе, так и в периваскулярных инфильтратах пораженной кожи больных выявлено более высокое содержание CD8+ лимфоцитов, по сравнению с таковым в группе здоровых добровольцев (табл. 2; P<0,001). Количество СD8+ лимфоцитов в очагах склеродермии ока-
залось в 2,3 раза выше количества СD4+ клеток.
Реакция к антигену CD25 (рецептору ИЛ-2) в коже здоровых лиц была отрицательной как в эпидермисе, так и в дерме. В эпидермисе больных СD25+ клетки также отсутствовали, однако в дерме они в значительном количестве
Таблица 2. Содержание популяций клеток в эпидермисе и периваскулярных инфильтратах кожи здоровых добровольцев и больных ограниченной склеродермией до и после курса УФА-1 терапии (медианы и квартили)
Популяции Здоровые Больные P P1 P2
клеток добровольцы ограниченной
(n=10) склеродермией
(n=10)
Эпидермис
CD8+ 0 0,8 [0,6; 1,2] <0,001 0,064 0,002
0,4 [0; 0,8]
Периваскулярные инфильтраты (%)
CD4+ 5,5 [5,0; 6,5] 11,5 [5,0; 18,3] 0,077 0,173 <0,001
17,0 [14,5; 19,0]
CD8+ 8,0 [7,1; 10,8] 26,5 [21,0; 31,8] <0,001 0,022 <0,001
18,5 [16,8; 21,5]
CD25+ 0 31,5 [26,3; 51,5] <0,001 0,005 <0,001
17,0 [16,0; 20,5]
HLA-DR+ 1,8 [1,4; 2,8] 7,1 [4,8; 10,9] 0,002 0,009 0,005
4,9 [3,7; 6,4]
____________________________________________________________________
Примечание. У больных в числителе представлены значения показателей до лечения, в знаменателе - после лечения. В эпидермисе приведено количество окрашенных клеток на 100 эпителиоцитов базального слоя. P и P2 - уровни статистической значимости различий при сравнении показателей у здоровых добровольцев и больных соответственно до и после лечения (U-критерий Манна-Уитни). P1 - уровень статистической значимости различий при сравнении показателей у больных до и после лечения (тест Вилкоксона).
выявлялись в клетках периваскулярных инфильтратов поверхностного сосудистого сплетения; единичные окрашенные клетки встречались среди коллагеновых волокон. При статистическом анализе содержание СD25+ клеток в периваскулярных инфильтратах оказалось значительно повышенным, по сравнению с показателем в группе здоровых добровольцев (табл. 2; Р<0,001).
HLA-DR+ клетки и в группе здоровых добровольцев, и в группе больных выявляли как в эпидермисе, так и в дерме в виде конгломератов клеток с пере
плетающимися отростками. Различий в содержании этих клеток в эпидермисе здоровых лиц и больных не обнаружено, однако в периваскулярных инфильтратах у больных их количество почти в 4 раза превышало таковое в контрольной группе (P=0,002). При корреляционном анализе каких-либо статистически значимых связей содержания указанных клеток с клиническими показателями не выявлено.
После курса УФА-1 терапии в эпидермисе больных выявлено двукратное снижение содержания СD8+ лимфоцитов, однако полной нормализации данного показателя не наблюдалось (табл. 2). Экспрессия молекул HLA-DR в эпидермисе значительной динамике под действием лечения не подвергалась. В периваскулярных инфильтратах количество СD4+ лимфоцитов статистически значимо не изменялось, тогда как содержание СD8+ лимфоцитов достоверно уменьшалось (P=0,022). Тем не менее, после лечения уровень СD8+ лимфоцитов оставался более высоким, чем в группе здоровых лиц. Количество СD25+ и HLA-DR+ клеток в периваскулярных инфильтратах кожи после лечения статистически значимо снижалось, но также оставалось повышенным.
Следует подчеркнуть, что указанные изменения иммунологических показателей у 9 из 10 больных наблюдались на фоне улучшения клинических симптомов заболевания.
Известно, что формирование фиброза в очагах склеродермии сопровождается хроническим воспалением (Fleishmajer R., Lebwohl M., 1986; Mauch C. et al., 1993; Black C.M. et al., 1999), одним из проявлений которого является периваскулярная и/или диффузная клеточная инфильтрация кожи. Однако роль Т-клеточного звена иммунной системы в патогенезе ограниченной склеродермии окончательно не установлена. Полученные нами данные свидетельствуют об увеличении в коже больных количества супрессорно-цитотоксических лимфоцитов, а также повышенном содержании CD25+ и HLA-DR+ клеток, что свидетельствуют об активации в коже Т-клеточного звена иммунной системы.
В доступной литературе имеются лишь единичные сведения о влиянии УФА-1 терапии на субпопуляционный состав и активацию дермальных лимфоцитов у больных ограниченной склеродермией. В наших исследованиях установлено нормализующее влияние УФА-1 терапии как на субпопуляционный состав лимфоцитов, так и на активность клеточных иммунных процессов в очагах склеродермии.
Динамика содержания профиброзных цитокинов в коже больных ограниченной склеродермией в процессе УФА-1 терапии. Согласно имеющимся литературным данным, трансформирующий фактор роста бета и тромбоцитарный фактор роста являются ключевыми медиаторами процессов фиброза. TGF- способствует дифференцировке миофибробластов и формированию фиброгенного фенотипа фибробластов (Varga J. et al., 2004), регулирует образование PDGF, стимулирует синтез компонентов межклеточного матрикса, в том числе коллагена и фибронектина (Ignotz R.A. et al., 1987; Gay S. et al., 1992, Massague J., 1990, Wrana J.L. et al., 1994.), уменьшает продукцию ферментов, способствующих деградации компонентов межклеточного матрикса (коллагеназы, гепариназы и стромелизина), повышает синтез белков (ингибитора активатора плазменогена I типа и тканевого ингибитора металлопротеиназ), ингибирующих эти ферменты (Klareskog L. et al., 1990). Тромбоцитарный фактор роста является сильным митогеном гиперпластического роста фибробластов и участвует в стимуляции их пролиферации и миграции (Bonner J.C., 2004; Trojanowska M., 2008; Andrae J. et al., 2008).
В наших исследованиях при иммуноморфологическом анализе препаратов кожи с моноклональными антителами TGF-1, TGF-RI и PDGFR- в дерме здоровых добровольцев в большинстве случаев выявляли отдельные TGF-1+ и TGF-RI+ клетки, которые локализовались в периваскулярных инфильтратах и вокруг волосяных фолликулов. Умеренно выраженная экспрессия PDGFR- наблюдалась на клетках эндотелия, эпителия потовых и сальных желез, а также на фибробластах.
В коже больных отмечалась экспрессия TGF-1 на отдельных клетках периваскулярных инфильтратов, а также в цитоплазме эпителиоцитов потовых желез, TGF-RI в значительном количестве выявляли на клетках периваскулярных инфильтратов кожи, клетках мышц, поднимающих волос, и сальных желез. PDGFR- обнаруживали в эпителии волосяных фолликулов, потовых и сальных желез, а также мышц, поднимающих волос. Экспрессия этого рецептора наблюдалась также на клетках периваскулярных инфильтратов и фибробластах.
При статистическом анализе полученных данных в группе больных установлено пониженное, по сравнению с группой здоровых добровольцев, содержание в дерме пораженной кожи TGF-1+ клеток (P=0,007) и повышенное количество TGF-RI+ (P=0,001) и PDGFR-+ клеток (P<0,001; табл. 3).
Вопрос о роли трансформирующего фактора роста бета в патогенезе ограниченной склеродермии до настоящего времени остаётся нерешенным. В литературе имеются отдельные публикации, посвященные изучению содержания TGF-1 в очагах ограниченной склеродермии, результаты которых противоречивы. В одних исследованиях обнаружена значительная (Higley H. et al., 1994; Querfeld C. et al., 1999; Gilmour T.K. et al., 2000) или слабая (Vuorio T. et al., 1991; Farell A.M. et al., 2001) экспрессия цитокина в коже, в других она не отличалась от таковой в здоровой коже (Restrepo J.F. et al., 2003) или отсутствовала (Oikarinen A. et al., 1991). Необходимо подчеркнуть, что большинство указанных исследований были выполнены на небольшом числе больных без статистического анализа полученных данных.
Поскольку в нашем исследовании проводился подсчет всех иммунореактивных клеток в дерме, выявленное снижение содержания TGF-1 в коже больных может быть, по всей видимости, обусловлено уменьшением его продукции
клетками, участвующими в иммунном воспалении – макрофагами, эндотелиоцитами, Т-лимфоцитами, в том числе Th3 регуляторными клетками, являющимися одним из основных пулов, синтезирующих данный ростовой фактор (Насонова В.А., Бунчук Н.В., 2001; Apostolou I. et al., 2008).
Известно, что трансформирующий фактор роста бета относится к мультифункциональным цитокинам, обладающим широким спектром действия. Он участвует не только в процессах фиброза, но и в реакциях воспаления, ангиогенезе, восстановлении поврежденных тканей (Blobe M. et al., 2000). При воздействии на иммунные реакции TGF- выступает преимущественно в качестве супрессорного фактора, сдерживающего, в том числе, аутоиммунные процессы (Kawakami T. et al., 1998; Ярилин А.А., 1999). Показано, что он принимает участие в ингибировании гемопоэза, синтеза воспалительных цитокинов, ответа лимфоцитов на интерлейкины 2, 4, 7, подавлении образования цитотоксических NK и Т-клеток (Кетлинский С.А., Калинина Н.М., 1995; Yin L., 2003; Svegliati S.B. et al., 2005, 2006).
Таблица 3. Количество TGF-1+, TGF-RI+ и PDGFR-+ клеток в коже здоровых добровольцев и больных ограниченной склеродермией (в 1 поле зрения) до и после курса УФА-1 терапии (n=10, медианы и квартили)
___________________________________________________________________
Популяции Здоровые Больные P P1 P2
клеток добровольцы ограниченной
склеродермией
____________________________________________________________________
TGF-1+ 2,9 [2,6; 3,8] 1,3 [1,0; 2,1] 0,007 0,138 0,129
2,0 [1,4; 3,4]
TGF-RI+ 7,7 [6,8; 9,2] 21,8 [14,5; 27,3] 0,001 0,005 0,791
7,4 [2,6; 13,3]
PDGFR- 33,4 [30,6; 34,8 ] 60,6 [52,9; 71,4] <0,001 0,005 0,001
42,8 [36,2; 46,6]
____________________________________________________________________
Примечание. У больных в числителе представлены значения показателей до лечения, в знаменателе - после лечения. P и P2 - уровни статистической значимости различий при сравнении показателей у здоровых добровольцев и больных соответственно до и после лечения (U-критерий Манна-Уитни). P1 - уровень статистической значимости различий при сравнении показателей у больных до и после лечения (тест Вилкоксона).
Выключение гена TGF-1 у экспериментальных животных приводит к развитию фатальной генерализованной воспалительной патологии, в основе которой лежит аутоиммунный процесс (Jelaska A., Korn J.H., 2000).
Установлено, что данный ростовой фактор участвует в иммуносупрессивных реакциях, опосредованных регуляторными лимфоцитами (Wahl S.M. et al., 1988; Pyzik M., Piccirillo C.A., 2001; Marie J.C. et al., 2005; Taylor A.W., 2009). В ряде исследований у больных системной склеродермией выявлено уменьшение содержания TGF-1 в сыворотке крови (Dziadzio M. et al., 2005), а также продукции его циркулирующими моноцитами и Т-клетками (Giacomelli R. et al., 1996; Scala E. et al., 2004). Кроме того у больных системной склеродермией обнаружено снижение супрессорной функции T-регуляторных клеток (Tregs), связанной с недостаточной продукцией этого цитокина (Radstake T.R. et al., 2009).
Исходя из приведенных данных, можно предположить, что обнаруженное в нашем исследовании пониженное количество TGF-1 в очагах ограниченной склеродермии обусловлено уменьшением его продукции Т-клетками. Полученные нами результаты нашли подтверждение в недавно проведенных исследованиях зарубежных коллег, в которых как в крови, так и в коже больных ограниченной склеродермии выявлено пониженное содержание TGF- и регуляторных Т-лимфоцитов (Antiga E. et al., 2010).
Известно, что биологические эффекты TGF- и PDGF опосредуются активацией клеточных рецепторов, высоко аффинных к этим цитокинам. При анализе экспрессии рецепторов ростовых факторов в коже в группе больных нами выявлено повышенное, по сравнению с группой здоровых добровольцев, количество TGF-RI+ (в 2, 8 раза; P=0,001) и PDGFR-+ клеток (в 1,8 раза P<0,001). Каких-либо корреляционных связей содержания TGF-1, TGF-RI и PDGFR- с клиническими показателями не выявлено.
В литературе имеется лишь одно сообщение о нарушении содержания рецепторов TGF- в коже больных ограниченной склеродермией (Kubo M. et al., 2001), в котором методом in situ гибридизации выявлена повышенная экспрессия mRNA TGF-RI и TGF-RII. Установленное нами повышенное содержание TGF-RI+ клеток в коже больных согласуется с результатами этих исследований и свидетельствует о вовлечении данного рецептора в патогенез заболевания. Работ, посвященных изучению содержания рецепторов тромбоцитарного фактора роста в коже больных ограниченной склеродермией, в доступной литературе нам не встретилось. Проведенные нами исследования свидетельствуют об участии альфа-рецепторов тромбоцитарного фактора роста в механизмах развития заболевания.
С учётом имеющихся литературных данных о вовлечении указанных ростовых факторов в фиброгенез, можно утверждать, что обнаруженное нами повышенное содержание в коже больных ограниченной склеродермией рецепторов I типа трансформирующего фактора роста бета и альфа-рецепторов тромбоцитарного фактора роста свидетельствует об активации процессов формирования фиброза в очагах поражения, а также их важной роли в патогенезе заболевания.
При анализе биоптатов, взятых у больных ограниченной склеродермией после курса УФА-1 терапии, нами не выявлено существенных изменений экспрессии и распределения TGF-1+ клеток в коже. Экспрессия TGF-RI значительно уменьшалась в периваскулярных инфильтратах, но сохранялась выраженной на клетках придатков кожи. Экспрессия PDGFR- уменьшалась в периваскулярных инфильтратах и между пучками коллагеновых волокон.
При статистическом анализе установлено, что количество TGF-1+ клеток после лечения незначительно возрастало (P=0,138), тогда как количество TGF-RI+ и PDGFR-+ клеток достоверно уменьшалось (табл. 3, рис. 4).

TGF-1+ TGF-RI+ PDGFR-+
(P=0,138) (P=0,005) (P=0,005)
Рисунок 4. Динамика содержания TGF-1+, TGF-RI+ и PDGFR-+ клеток в очагах ограниченной склеродермии в процессе лечения (количество клеток в 1 поле зрения, медианы, n=10)
При сравнении после лечения содержания TGF-1+ и TGF-RI+ клеток в коже больных с аналогичными показателями в коже здоровых добровольцев статистически значимых различий не установлено (соответственно P=0,129 и P=0,791), однако содержание PDGFR-+ клеток оставалось повышенным (P=0,001).
В литературе имеется лишь одна работа, в которой был проведен анализ содержания TGF-1 в коже больных ограниченной склеродермией до и после курса УФА-1 терапии, однако статистически значимых изменений не обнаружено (Kreuter A. и соавт., 2006). Исследований, посвященных изучению изменений содержания рецепторов TGF-1 и PDGF под действием ультрафиолетового излучения УФА-1 диапазона, в доступной литературе нам не встретилось. Согласно полученным нами данным, УФА-1 терапия приводила к уменьшению исходно повышенного количества рецепторов I типа трансформирующего фактора роста бета и альфа-рецепторов тромбоцитарного фактора роста в очагах поражения. Учитывая важную роль указанных рецепторов в формировании фиброза кожи, можно заключить, что снижение их уровня в процессе фототерапии свидетельствует о патогенетическом характере действия данного вида лечения.
ВЫВОДЫ
- Терапия низкими и средними дозами длинноволнового ультрафиолетового излучения УФА-1 диапазона является эффективным методом лечения больных ограниченной склеродермией: положительный эффект наблюдается у 90,2% больных, клиническое выздоровление и значительное улучшение – соответственно у 7,8% и 47,1% пациентов. Под действием УФА-1 излучения значительно уменьшаются основные клинические симптомы заболевания - эритема и индурация кожи.
- После курса УФА-1-терапии в очагах склеродермии наблюдаются уменьшение атрофии эпидермиса с формированием межсосочковых выростов, регрессия вакуольной дистрофии в базальных кератиноцитах и эпидермального экзоцитоза лимфоцитов, уменьшение периваскулярных инфильтратов, частичное восстановление нормальной структуры коллагеновых волокон, особенно выраженное в нижних отделах дермы, увеличение количества сосудов и придатков кожи.
- Улучшение клинических симптомов заболевания в процессе УФА-1 терапии сопровождается снижением в пораженной коже количества супрессорно-цитотоксических Т-лимфоцитов (CD8+), а также клеток, экспрессирующих активационные маркеры HLA-DR и CD25, что свидетельствует об уменьшении активности иммунного воспаления в очагах склеродермии, обусловленного иммуносупрессивным действием данного вида лечения.
- В пораженной коже больных ограниченной склеродермией обнаружена повышенная экспрессия на клетках дермы рецепторов I типа трансформирующего фактора роста бета (TGF-RI) и альфа-рецепторов тромбоцитарного фактора роста (PDGFR-), являющихся ключевыми медиаторами формирования фиброза. Выявленное после курса фототерапии уменьшение содержания в коже клеток, экспрессирующих данные рецепторы, указывает на патогенетический характер действия длинноволнового ультрафиолетового излучения УФА-1 диапазона.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Терапия ультрафиолетовым излучением УФА-1 диапазона с длиной волны 340-400 нм может применяться в качестве метода выбора у больных бляшечной и линейной формой ограниченной склеродермии, а также экстрагенитальным склероатрофическим лихеном.
- Перед назначением лечения для выявления противопоказаний к применению фототерапии необходимо проводить клинико-лабораторное обследование больного: общий анализ крови, общий анализ мочи, биохимический анализ крови, консультацию терапевта, офтальмолога, эндокринолога, гинеколога; по показаниям - обследование у других специалистов.
- Облучения начинают с дозы 5-10 Дж/см2, последующие разовые дозы повышают на 5-10 Дж/см2 до максимальной разовой дозы 20-40 Дж/см2. Процедуры проводят с режимом 3-5 раз в неделю.
- Для достижения выраженного клинического эффекта необходимо проведение курса, составляющего 25-60 процедур.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ
- Мурадян Н.Л. Частота побочных реакций при лечении больных ограниченной склеродермией / Н.Л. Мурадян // Сб. тез. науч. раб. Всерос. конф. дерматовенерологов «Новые технологии в организации дерматологической помощи населению Российской Федерации». – М., 2004. - С. 24.
- Мурадян Н.Л. Ближайшие и отдаленные результаты УФА-1 терапии больных ограниченной склеродермией / Н.Л. Мурадян // Сб. тез. науч. раб. II Всерос. Конгр. дерматовенерологов. - С-Пб., 2007. - С.77-78.
- Волнухин В.А. Эффективность ультрафиолетовой терапии больных экстрагенитальным склероатрофическим лихеном / В.А. Волнухин, О.В. Выборнова, Н.Л. Мурадян // Сб. тез. науч. раб. II Всерос. Конгр. дерматовенерологов. - С-Пб., 2007. - С.42-43.
- Волнухин В.А. УФА-1 терапия больных ограниченной склеродермии / В.А. Волнухин, Н.Л. Мурадян, О.В. Выборнова и др. // Вестн. дерматол. венерол. – 2007 - №6. - С. 4-8.
- Мурадян Н.Л. Характеристика фенотипа лимфоцитов в очагах ограниченной склеродермии / Н.Л. Мурадян, В.А. Волнухин, О.Р. Катунина // Сб. тез. науч. раб. Х Всерос. съезда дерматовенерологов. – М., 2008. – С.31.
- Кубанова А.А. Лечение больных ограниченной склеродермией длинноволновым ультрафиолетовым излучением УФА-1 диапазона. Медицинская технология № ФС-2007/052-У от 20 апреля 2007 года. /А.А. Кубанова, В.А.Самсонов, Н.Л. Мурадян и др. // Вестн. дерматол. венерол. – 2008. - №4. – С.34-38.
- Мурадян Н.Л. Экспрессия рецептора трансформирующего фактора роста бета I типа в коже больных ограниченной склеродермией. / Н.Л. Мурадян // Сб. тез. науч. раб. Всеросс. научн.- практ. конф. «Актуальные вопросы дерматологии и урогенитальной патологии» - М., 2009. - С. 33-34.
8. Волнухин В.А. Особенности нарушений Т-клеточных иммунных процессов в коже больных ограниченной склеродермией и их динамика в процессе УФА-1-терапии / В.А. Волнухин, Н.Л.Мурадян, О.Р. Катунина // Вестн. дерматол. венерол. – 2009. - №6. – С. 74-80.
Автор выражает искреннюю благодарность своему первому научному руководителю профессору, доктору медицинских наук Александру Михайловичу Вавилову за неоценимую помощь в выборе темы исследования и выполнения диссертационной работы.
СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ
ОС - ограниченная склеродермия
САЛ - склероатрофический лихен
УФА-1 - ультрафиолетовое излучение дальнего длинноволнового диапазона (УФА-1 диапазон, длина волны 340-400 нм)
CD4, СD8, CD25 - маркеры мембранных антигенов клеток
HLA-DR – молекула главного комплекса гистосовместимости
ИЛ-2 – интерлейкин 2
TGF-1- трансформирующий фактор роста бета 1
TGF-RI - рецептор I типа трансформирующего фактора роста бета
PDGF- – альфа-рецептор тромбоцитарного фактора роста

