Критерии ранней диагностики и прогрессирования рефлюкс-нефропатии у детей и оптимизация лечения
На правах рукописи
ЛЕПАЕВА
ТАТЬЯНА ВИКТОРОВНА
КРИТЕРИИ РАННЕЙ ДИАГНОСТИКИ И ПРОГРЕССИРОВАНИЯ РЕФЛЮКС-НЕФРОПАТИИ У ДЕТЕЙ И ОПТИМИЗАЦИЯ ЛЕЧЕНИЯ
14.01.08 - педиатрия
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
кандидата медицинских наук
Москва – 2013
Работа выполнена в ФГБУ «Московский научно-исследовательский институт педиатрии и детской хирургии» Министерства здравоохранения Российской Федерации
Научные руководители:
Заслуженный врач Российской Федерации,
доктор медицинских наук, профессор Длин Владимир Викторович
Доктор медицинских наук, профессор Казанская Ирина Валерьевна
Официальные оппоненты:
Кириллов Владимир Иванович, доктор медицинских наук, профессор, ГБОУ ВПО «Московский государственный медико-стоматологический университет имени А.И.Евдокимова» Минздрава России, кафедра педиатрии, профессор
Гусева Наталья Борисовна, доктор медицинских наук, ГБУЗ «Детская городская клиническая больница № 9 имени Г.Н.Сперанского» Департамента здравоохранения г.Москвы, Центр урологии, андрологии и патологии тазовых органов, руководитель
Ведущая организация:
ГБОУ ВПО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России
Защита состоится «____» _________________ 2013 г. в …… часов на заседании диссертационного Совета Д-208.043.01 в ФГБУ «МНИИ педиатрии и детской хирургии» Минздрава России (125412, город Москва, улица Талдомская, дом 2)
С диссертацией можно ознакомиться в библиотеке ФГБУ «МНИИ педиатрии и детской хирургии» Минздрава России
Автореферат разослан «____» _________________ 2013 г.
Ученый секретарь диссертационного совета,
кандидат медицинских наук
Землянская Зинаида Константиновна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы пузырно-мочеточникового рефлюкса обусловлена высокой распространенностью данной патологии (среди детей с инфекцией мочевой системы встречается в 35-66,4% случаев) c развитием фокального нефросклероза (рефлюкс-нефропатии) с одной стороны, а с другой отсутствием единой точки зрения на ведение этих больных.
У 3-4% детей с рефлюкс-нефропатией наблюдается прогрессирующее течение заболевания с развитием хронической почечной недостаточности. В то же время у взрослых хроническая почечная недостаточность, обусловленная рефлюкс-нефропатией, составляет 10-11% (Молчанова Е.А. и соавт., 2004, 2011; Hattori Sh. et al., 2002). Впервые прогрессирующее течение фокального нефросклероза было отмечено Hodson C.J. (1975, 1979), который выделил факторы, отражающие тяжесть заболевания и способствующие развитию и прогрессированию рефлюкс-нефропатии (высокие степени пузырно-мочеточникового рефлюкса, двусторонний процесс, появление персистирующей протеинурии более 1 г/24ч, развитие ренальной гипертензии). В дальнейших исследованиях были выделены факторы риска развития рефлюкс-нефропатии, такие как: мужской пол, ранний возраст ребенка, сочетание пузырно-мочеточникового рефлюкса с нейрогенной дисфункцией мочевого пузыря, рецидивы инфекции мочевых путей. В исследованиях последних лет большое значение в формировании рефлюкс-нефропатии придается биологически активным соединениям (медиаторам воспаления, факторам роста, маркерам апоптоза и т.д.) (Паунова С.С., 2004, 2011; Fogo A., 2007; Lee HS., 2011), а также находит все большее подтверждение теория генетической предрасположенности к рефлюкс-нефропатии (Mezzano S. et al., 2000; Vats Ketal, 2006; Lundsedt A. et al., 2007). Однако поиски маркеров развития и прогрессирования рефлюкс-нефропатии продолжаются, учитывая высокий риск развития гипертонии и ухудшения почечных функций.
Одним из ведущих неиммунных факторов прогрессирования поражения почек является артериальная гипертензия (Тареева И.Е., 1996, 2000), которая, по данным разных исследований, развивается от 5 до 27% детей с рефлюкс-нефропатией. У взрослых, имеющих рефлюкс-нефропатию, распространенность артериальной гипертонии намного выше и в среднем составляет 50%, что отражает высокий риск развития гипертонии в любом возрасте. Но в ряде случаев артериальная гипертензия может длительно протекать субклинически. С другой стороны, по данным литературы, на ранних этапах развития артериальной гипертензии, прежде всего, нарушается суточный ритм артериального давления. В этих случаях оптимальным методом диагностики является суточное мониторирование артериального давления (Леонтьева И.В. и соавт., 2000; Бургал А., 2002; Цыгин А.Н. и соавт. 2011; Jimenez-Hereza J.M., 1998; Lama G., 2003; Carcia-Donaire JA. et al. 2011). Работы по изучению изменений циркадного ритма артериального давления у детей с рефлюкс-нефропатией единичны.
В 1982 г. B. Brenner et al. выдвинули новую гипотезу прогрессирования нефропатий с акцентом на гемодинамические процессы, происходящие в почке при потере клубочков при прогрессировании нефропатии с развитием состояния гиперфильтрации, повышением внутриклубочкового давления и, соответственно, усиленному проникновению белка в канальцы и повышению реабсорбции, что вызывает увеличение продукции медиаторов воспаления. Таким образом, предиктором прогрессирования оказывается нарастающая протеинурия (Кириллов В.И., 2012; Brenner B., 2003; Ardissini G. et al. 2004). Однако почечные заболевания нередко имеют латентное течение, и уровень протеинурии не всегда отражает глубину поражения почечной ткани. Проведенные многочисленные исследования показали, что микроальбуминурия является более чувствительным маркером начинающихся изменений в почках, чем традиционная протеинурия, и нередко используется в качестве диагностического маркера на доклинической стадии нефропатий различного генеза (Аксенова М.Е., 1998; Приходина Л.С., 2001; Guder W.G. et al., 1997; Crowley S.D. et al., 2005).
В последние годы в медицине интенсивно развивается так называемое «метаболическое» направление, формируются представления о нарушении клеточного энергообмена в генезе самых разнообразных патологических процессов (Клембовский А.И. и соавт., 1997, 2000; Белоусова И.С., 2005; Shapinra A.H.V., 1999; Ruggenetti P. et al., 2006). Перспективы дальнейшей разработки патогенеза рефлюкс-нефропатии, обусловленной расстройствами мочеиспускания, во многом связаны с исследованиями энергетического метаболизма гладкомышечных структур нижнего отдела мочевого тракта. Работ по изучению уровня активности клеточной биоэнергетики у детей с пузырно-мочеточниковым рефлюксом в доступной литературе нами не найдено.
В настоящее время существуют противоречивые данные о тактике ведения детей с пузырно-мочеточниковым рефлюксом. Есть сторонники консервативной терапии, другие же авторы придерживаются тактики обязательного хирургического лечения всех пациентов (Mac Gregar M.E. et al., 1975; Hodson C.I. et al., 1975; Puri O. et al., 1986; Le Due A. et al., 1987; Matsuo et al., 1994; Cooper C.S. et al. 2004; Hodson E.M. et al., 2007). В последние десятилетия применяется эндоскопический метод коррекции пузырно-мочеточникового рефлюкса, позволяющий достичь хороших результатов в короткие сроки без оперативного вмешательства (Неменова А.А., 1991; Вишневский Е.Л. и соавт., 1993; Frey P. et al., 1992; Ander A.H., 2006; Lakgren G., 2009, Hsieh M., 2010). Однако окончательно не решены вопросы о длительности проведения консервативной терапии, о показаниях и сроках проведения эндоскопической коррекции пузырно-мочеточникового рефлюкса. В литературе отсутствуют данные о частоте развития и прогрессирования рефлюкс–нефропатии у детей после эндоскопической коррекции.
Вышеизложенное послужило основой для проведения настоящего исследования и сформулировало его цель.
Цель исследования.
На основании клинико-лабораторных данных разработать критерии ранней диагностики и прогрессирования рефлюкс-нефропатии у детей с пузырно-мочеточниковым рефлюксом для обоснования дифференцированной терапии.
Задачи исследования.
- Определить клинико-функциональные особенности рефлюкс-нефропатии и состояние клеточного энергообмена в зависимости от тяжести повреждения почечной ткани и степени пузырно-мочеточникового рефлюкса.
- Выявить ранние маркеры почечного повреждения у детей с пузырно-мочеточниковым рефлюксом.
- Разработать критерии прогрессирования рефлюкс-нефропатии и разработать алгоритм ведения больных с пузырно-мочеточниковым рефлюксом.
- Определить характер течения рефлюкс-нефропатии в зависимости от метода коррекции пузырно-мочеточникового рефлюкса.
- Оценить терапевтическую эффективность ингибиторов ангиотензин-превращающего фермента в профилактике прогрессирования рефлюкс-нефропатии.
Научная новизна.
Установлено, что ведущими факторами риска прогрессирования рефлюкс-нефропатии являются нарастающая протеинурия, часто рецидивирующая инфекция мочевой системы, высокий уровень микроальбуминурии и стойкие и рецидивирующие формы пузырно-мочеточникового рефлюкса.
Микроальбуминурия у детей с пузырно-мочеточниковым рефлюксом имеет диагностическое значение для раннего выявления рефлюкс-нефропатии и ее прогрессирования.
Повышенное артериальное давление определяется преимущественно у детей с выраженными степенями рефлюкс-нефропатии, чаще в ночное время, с преобладанием повышения систолического артериального давления, как днем, так и ночью. Более чем у половины детей, независимо от степени рефлюкс-нефропатии, выявлены патологические варианты циркадного ритма артериального давления, что отражает высокий риск последующего развития артериальной гипертензии.
У детей с прогрессирующим течением рефлюкс-нефропатии чаще и в более ранние сроки развивается артериальная гипертензия.
Установлена связь нарушений клеточной биоэнергетики в виде снижения активности -глицерофосфатдегидрогеназы, глутаматдегидрогеназы и, особенно, нарушения уровня сукцинатдегидрогеназы в митохондриях лимфоцитов периферической крови со степенью выраженности пузырно-мочеточникового рефлюкса и степенью тяжести рефлюкс-нефропатии.
Доказано, что после эндоскопического и оперативного лечения пузырно-мочеточникового рефлюкса прогрессирование рефлюкс-нефропатии наблюдается реже по сравнению с детьми, получавшими только консервативную терапию, независимо от тяжести пузырно-мочеточникового рефлюкса. Прогрессирование рефлюкс-нефропатии у детей на консервативной терапии обусловлено длительным сохранением стойкого или интермиттирующего пузырно-мочеточникового рефлюкса, рецидивами инфекции мочевой системы.
Научно обоснована и определена эффективность ингибиторов ангиотензин-превращающего фермента для предупреждения прогрессирования рефлюкс-нефропатии. Установлено, что, наряду с коррекцией артериального давления, наблюдается антипротеинурический эффект, снижается уровень микроальбуминурии, и улучшаются показатели функционального состояния почек.
Практическая значимость.
Предложено в качестве раннего маркера повреждения почечной паренхимы у детей с пузырно-мочеточниковым рефлюксом определять экскрецию микроальбумина с мочой.
В качестве маркеров прогрессирования рефлюкс-нефропатии предложены высокий уровень микроальбуминурии, нарастающая в динамике протеинурия, стойкие и рецидивирующие формы пузырно-мочеточникового рефлюкса независимо от степени, частые рецидивы инфекции мочевой системы.
Показано, что у детей на консервативной терапии чаще, чем после эндоскопической или оперативной коррекции пузырно-мочеточникового рефлюкса, наблюдается прогрессирующее течение рефлюкс-нефропатии, что обосновывает изменение лечебной тактики.
Для предупреждения прогрессирования рефлюкс-нефропатии предложена длительная терапия ингибиторами ангиотензин-превращающего фермента с использованием доз препарата выше среднетерапевтической, которую целесообразно назначать на стадии микроальбуминурии, независимо от степени повреждения почечной паренхимы.
Внедрение в практику.
Научные положения и практические рекомендации исследования внедрены в клиническую практику отделения наследственных и приобретенных болезней почек (заведующий - заслуженный врач Российской Федерации, д.м.н., профессор Длин В.В.) ФГБУ «Московский НИИ педиатрии и детской хирургии» Минздрава России.
Апробация работы.
Основные положения диссертационного исследования доложены и обсуждены на II Российском конгрессе «Современные методы диагностики и лечения в детской нефрологии и урологии» (Москва, 2002); Международной нефрологической конференции (Берлин, 2003); Научно-практической конференции педиатров России «Фармакотерапия в педиатрии» (Москва, 2003); Ш Конгрессе педиатров-нефрологов России (С-Петербург, 2003); XI Российском национальном конгрессе «Человек и лекарство» (Москва, 2004); Конференции по детской нефрологии, посвященной 35-летию отделения наследственных и приобретенных болезней почек МНИИ П и ДХ Росздрава (Москва, 2005); VI съезде научного общества нефрологов России (Москва, 2005); VII Конгрессе по детской нефрологии (в рамках VII Российского Конгресса «Современные технологии в педиатрии и детской хирургии») (Москва, 2008); VШ Конгрессе «Новые технологии в педиатрии и детской хирургии» (Москва, 2009); X Российском Конгрессе «Инновационные технологии в педиатрии и детской хирургии» (Москва, 2011).
Работа выполнена в отделении наследственных и приобретенных болезней почек (заведующий – заслуженный врач Российской Федерации, д.м.н., профессор Длин В.В.) ФГБУ «МНИИ педиатрии и детской хирургии» Минздрава России (директор – д.м.н., профессор Царегородцев А.Д.).
Публикации по теме диссертации.
По материалам диссертации опубликовано 30 печатных работ, в том числе 3 статьи в журналах, рекомендованных ВАК.
Объем и структура диссертации.
Диссертация состоит из введения, обзора литературы, описания материалов и методов исследования, 3 глав собственных результатов исследования, заключения с обсуждением результатов, выводов и практических рекомендаций. Работа изложена на 261 страницах машинописного текста, содержит 122 таблицы, иллюстрирована 91 рисунками. Библиографический указатель включает 293 источника, из них 79 отечественных и 214 зарубежных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Клиническая характеристика обследованных больных, объем и методы исследования.
Для решения поставленных задач обследовано 74 ребенка с пузырно-мочеточниковым рефлюксом (ПМР) различной степени выраженности. Возраст детей на момент обследования составлял от 1 года 10 месяцев до 16 лет (в среднем 8,5±0,49 мес), в том числе 17 мальчиков (23%) и 57 девочек (77%). Клинико-лабораторное обследование детей проводилось на базе отделения нефрологии (заведующая – к.м.н. Турпитко О.Ю.) ФГБУ «Московский НИИ педиатрии и детской хирургии» Минздрава России.
Средний возраст детей на момент первого обследования составил 8,5±0,5 года, преобладали дети школьного возраста – 63%. Несколько другая картина при первичном выявлении инфекции мочевой системы (ИМС) или ПМР – когда до 55% составили дети раннего возраста (до 3-х лет), и 38% из них до года. С возрастом частота выявления ИМС или ПМР снижается, в старшей возрастной группе (более 12 лет) составляет всего 4%, при этом у 2 из 3-х детей признаков ИМС не отмечалось.
Средний срок наблюдения больных составил 3,0±0,2 года (от 1 месяца до 7 лет), 68 человек (88%) из них наблюдались в динамике. Длительность временного промежутка от момента выявления ПМР до включения в исследование составляла от 0 до 173 месяцев (в среднем 31,9±4,9 мес). Длительность временного промежутка от момента диагностики ИМС до включения в исследование составляла от 2 до 180 месяцев (в среднем 63,6±6,9 мес). У детей без ИМС длительность заболевания от момента первичного выявления была значительно ниже, чем у пациентов с ИМС, и составила в среднем 25±15 месяцев (p<0,001).
У всех детей выявлялся ПМР различной степени выраженности: ПМР I степени имели 15% детей, ПМР II степени – 30%, ПМР III степени – 43%, ПМР IV степени – 8%, ПМР V степени – 4%. У трети – 24 ребенка (32%) – диагностирован двухсторонний ПМР, а у 50 детей (68%) – односторонний, в том числе левосторонний в 39% случаев (29 детей), а правосторонний – у 29% (n=21) детей.
В 44-х случаях (59%) ПМР выявлялся в сочетании с другими аномалиями органов мочевой системы (ОМС): удвоение почки отмечалось у 8-ми человек (18%), нарушения уродинамики нижних мочевых путей (стеноз уретры и меатостеноз) у 15 человек (34%, все девочки), мегауретер – у 2-х пациентов (5%, все девочки), гипоплазия почки у 8 детей (18%), агенезия и дистопия почки – по 1-му ребенку (по 2%), повышенная подвижность почек – у 10 человек (23%).
ИМС послужила в большинстве случаев поводом к обследованию – у 85,1% детей, в том числе у 52 девочек (82,5%) и у 11 мальчиков (17,5%) (p<0,02). В остальных случаях (14,9%) ПМР был диагностирован в связи с энурезом, пиелоэктазией и/или уменьшением размеров почки, по данным ультразвукового исследования (УЗИ), а также при обследовании по поводу артериальной гипертензии. Инфекция ОМС с часто рецидивирующим течением наблюдалась у 29% больных (3 и более рецидивов в год). У остальных пациентов были редкие рецидивы мочевой инфекции. У 21 ребенка (33%) при поступлении в клинику наблюдались признаки активной ИМС (в основном у девочек – 95%), мочевой синдром был в виде лейкоцитурии, причем в 2/3 случаев абактериального характера. Бактериурия выявлялась у трети пациентов, в основном высевалась E.coli (86%), у 14% – условно-патогенная флора (Klebsiella pneumonia, Enterocoocus). Остальные дети (42 больных – 56,8%) находились в ремиссии пиелонефрита. У 11 детей (14,9%) данных за ИМС в анамнезе и при обследовании в отделении не было выявлено.
У большинства детей наблюдались парциальные нарушения функции почек, преимущественно по тубулярному (45%) или смешанному типу (53%). Изолированное нарушение клубочковой фильтрации, так же как и отсутствие признаков нарушений функций почек, было лишь у единичных больных (q=0,03 и q= 0,013, соответственно). У 73% детей определялась хроническая болезнь почек (ХБП) I стадии (скорость клубочковой фильтрации (СКФ) более 90 мл/мин), в 27% случаев – 2 стадия ХБП (СКФ 60-90 мл/мин). ХБП 3 стадии (СКФ менее 60 мл/мин) не определялась ни у одного пациента.
Артериальная гипертензия при разовых измерениях была выявлена у 2-х девочек (3%) в возрастной группе более 14 лет с ИМС.
Всем детям в комплексе обследования использовались визуализирующие методы исследования: УЗИ (100%), внутривенная урография (90,5%) и нефросцинтиграфия (НСГ) с димеркаптосукциновой кислотой (ДМСА) (100%).
Признаки поражения паренхимы почек выявлялись: по данным УЗИ у 29,7%, по данным внутривенной урографии у 46,3% детей. В то же время, по данным нефросцинтиграфии с ДМСА, те или иные изменения паренхимы почек диагностированы у 97,3% детей (p<0,01). Одностороннее поражение отмечалось у 13 детей (18%), чаще в левой почке (q=0,62), и у 59 (82%) – в обеих почках. У 43 детей выявлялась рефлюкс-нефропатия (РН) 1-2 степени (60%), у 29 детей отмечались признаки РН 3-4 степени (40%).
Из всей группы (n=74) обследуемых детей 24 пациентам оперативное лечение ПМР было проведено непосредственно после установления диагноза (32,4%). Остальные 50 детей получали консервативную терапию в течение 6-65 месяцев. 7 детей (9,5%) были направлены на эндопластику уретеровезикального соустья после 6-12-месячного курса консервативной терапии, оказавшейся неэффективной, пятеро из которых выбыли из под наблюдения и из дальнейшего анализа были исключены. Таким образом, 43 детям (58%) было проведено только консервативное лечение, которое включало: длительную антибактериальную терапию, коррекцию нейрогенной дисфункции мочевого пузыря (при наличии её признаков) с применением физиотерапевтических процедур и терапии фармпрепаратами (ноотропные препараты, средства, воздействующие на тонус гладкой мускулатуры мочевыводящих путей), а также мебрано- и энерготропные средства. Оперативное и эндоскопическое лечение было проведено 26 детям (35,1%), из них оперативное лечение получили 9 детей (11,5%), а эндоскопическую коррекцию устьев мочеточника – 17 пациентов (88,5%).
Общеклиническое нефроурологическое обследование
Проводилось клинико-генеалогическое исследование с составлением родословной и указанием наследственной отягощенности по заболеваниям ОМС (прежде всего ПМР, инфекции ОМС и гипертонической болезни). Уточнялись особенности течения беременности и родов у матери, а также данные о перенесенных заболеваниях, их связи с дебютом и обострениями инфекции ОМС, эффективности предшествующего лечения.
При клиническом обследовании внимание уделялось оценке наличия и выраженности симптомов интоксикации, болевого и дизурического синдромов, артериальной гипертензии, физического развития ребенка, определению числа малых аномалий развития.
В число обязательных лабораторных исследований входили повторные клинические анализы крови и мочи, анализ суточной мочи с определением протеинурии и количества цилиндров и форменных элементов. Исследовалась моча на степень бактериурии с определением чувствительности выявленной микрофлоры к антибактериальным препаратам, а также на наличие возбудителей урогенитальной инфекции (хламидии, уреаплазмы, микоплазмы).
Также проводился биохимический анализ крови, который включал в себя определение мочевины, креатинина, мочевой кислоты, электролитов. Биохимические параметры крови исследовались на автоматическом анализаторе «Финпипет» (Финляндия).
Функциональное состояние проксимального отдела канальцев почек определялось по экскреции с мочой калия, натрия, кальция, фосфора и глюкозы. Функциональное состояние дистального отдела нефрона изучалось на основании концентрационной способности (по пробе Зимницкого, при необходимости – пробе на концентрацию мочи), а также показателей ацидоаммониогенеза (экскреции аммиака, титруемых кислот, рН мочи) методом ацидометрического титрования. Гломерулярная фильтрация оценивалась по клиренсу эндогенного креатинина с пересчетом на стандартную величину поверхности тела ребенка, а также по скорости клубочковой фильтрации, рассчитанной по формуле Шварца. Исследования проводились в клинико-диагностической лаборатории ФГБУ МНИИП и ДХ (зав.лаб. - Акопова Т.В.). Исследования иммунного статуса осуществлялись в НИЛ общей патологии МНИИП и ДХ (зав. лаб. – проф. Сухоруков В.С.). В качестве нормальных иммунологических показателей крови использовались данные, представленные в руководстве для врачей Ю.Е. Вельтищева, Д.В. Стефании (1997), полученные в отделе иммунологии и иммунохимии МНИИП и ДХ.
Всем детям проводилось ультразвуковое исследование органов брюшной полости и почек на аппарате «Acusson-128/10XP» (США), экскреторная урография, микционная цистография. Оценка полученных урограмм проводилась с использованием методов рентгенометрии и рентгенопланиметрии почек. Исследования проводились в отделениях ультразвуковых и эндоскопических методов исследования (зав. отд. – к.м.н. Осипова Э.К.), рентгенологических методов исследования МНИИ педиатрии и детской хирургии (зав. отд. – Назарова Н.Ф.).
Состояние нижних мочевых путей оценивалось при помощи суточного ритма спонтанных мочеиспусканий, УЗИ мочевого пузыря (до и после мочеиспускания), уродинамического исследования по показаниям (урофлоуметрия, цистотонометрия) с использованием аппарата «Рельеф-1» (Россия).
По показаниям в план исследования включалась цистоскопия с оценкой состояния слизистой оболочки мочевого пузыря, местоположения, формы и величины устьев, их перистальтики, с калибровкой уретры у девочек (использовался цистоскоп фирмы «Storz», Германия).
Специальные методы исследования:
1) изучение анатомо-топографических особенностей и функционального состояния паренхимы почек на основании нефросцинтиграфии с Технеций-99м-технемек (димеркаптосукциновой кислотой) (ДМСА). Исследование проводилось на базе отдела радиационной медицины ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России совместно с руководителем отдела, д.м.н. Фоминым Д.К.
2) определение уровня и циркадного ритма АД на основании суточного мониторирования на приборе АВPM-02/М (фирма «Медитех» Венгрия).
3) определение экскреции микроальбуминов с мочой, методом конкурентного иммуноферментного анализа на анализаторе «Униплан» (США) с наборами фирмы «Randox».
4) цитохимическое определение активности митохондриальных ферментов в лимфоцитах периферической крови по методу Пирса (1957) в модификации Нарцисова Р.П. (1987).
Статистическая обработка результатов проведена по общепринятым методикам вариационной статистики: рассчитывалась средняя арифметическая, ошибка средней, достоверность по критерию t Стьюдента и Спирмана, производился расчет относительного риска (RR). Различия считались существенными при р<0,05. Многофакторный корреляционный анализ проводился с использованием пакета статистических программ «Statistica».
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
По данным НСГ с ДМСА все больные были распределены на 2 группы:
- группа 1 – дети с рефлюкс-нефропатией 1-2 степени (n=43);
- группа 2 – дети с рефлюкс-нефропатией 3-4 степени (n=29).
В 1-й группе преобладали девочки (q=0,91), средний возраст 7,5±0,6 лет, в то время как во 2-й группе количество мальчиков и девочек было практически равным (q=0,45 и q=0,55, соответственно), а средний возраст составлял 10,3±0,8 лет (p<0,02).
Выявлена связь высоких степеней ПМР с развитием тяжелых поражений почечной паренхимы (рис.1). При РН 1-2 степени достоверно выше частота ПМР 1-2 степени (0,51 против 0,14, р<0,01), в то время как при РН 3-4 степени – выше частота ПМР 4-5 степени (0,28 против 0,04, р<0,01).
 Рисунок 1. Частота степеней ПМР в зависимости от тяжести РН
Рисунок 1. Частота степеней ПМР в зависимости от тяжести РН
(по анамнестическим данным)
Аномалии ОМС с одинаковой частотой выявлялись у детей с РН 1-2 степени и 3-4 степени (q=0,63 и q=0,62 соответственно). Однако в группе детей с РН 3-4 степени чаще выявлялся так называемый синдром маленькой почки, а у детей с РН 1-2 степенью чаще определялись нарушения уродинамики нижних мочевых путей (p <0,05).
Установлено, что часто рецидивирующая ИМС (3 и более эпизодов в год) выявлялась чаще в группах больных с высокими (3-5) степенями ПМР (p <0,05) и с более тяжелым поражением почечной паренхимы (табл. 1). При этом у детей без признаков ИМС в 1-й группе преобладали девочки, а во 2-й группе – были пациенты только мужского пола (p <0,05).
Таблица 1
Частота ИМС у детей с разными степенями РН
(на момент включения в исследование с учетом данных анамнеза)
| Показатели | РН 1-2 степени (n=43) 1 | РН 3-4 степени (n=29) 2 | P1-2 | ||
| абс | % | абс | % | ||
| ИМС всего | 37 | 86 | 24 | 83 | >0,05 |
| ИМС с частыми рецидивами | 2 | 5 | 8 | 33 | <0,02 |
| Без признаков ИМС, в том числе: - мальчики - девочки | 6 1 5 | 13,9 16,7 83,3 | 5 5 0 | 17,2 100 0 | >0,05 <0,05 <0,05 |
Корреляционный анализ выявил положительную средней силы связь между степенью РН и возрастом детей (длительностью заболевания) на момент обследования (r= +0,38), а также с мужским полом (r= +0,42), степенью ПМР (r= +0,48) и слабую связь с наличием аномалий ОМС (r= +0,18).
Таким образом, наибольший риск развития тяжелых степеней рефлюкс-нефропатии наблюдался у лиц мужского пола, с ПМР высоких степеней и с большей длительностью заболевания.
На основании комплексной оценки функционального состояния почек были выделены больные с парциальными нарушениями почечной функции 1 степени, 2а степени, парциальными нарушениями почечной функции 2б степени – преобладали функциональные нарушения почек по тубулярному типу вне зависимости от степени поражения паренхимы почек.
Установлено, что у детей с выраженными (3-5) степенями ПМР достоверно (р<0,05) выше частота снижения СКФ менее 90 мл/мин (на момент включения в исследование). Выявлено, что в группе детей с рефлюкс-нефропатией 3-4 степени частота снижения СКФ менее 90 мл/мин в 2 раза выше, чем при более низких степенях РН, а гипоизостенурия в 1,5 раза чаще наблюдалась при РН 1-2 степени.
С возрастом средний уровень суточной протеинурии возрастал, достигая наибольших значений в подростковом возрасте независимо от тяжести РН (р<0,05). Однако при РН 3-4 степени средний уровень протеинурии был достоверно выше (р<0,05), чем при у детей с РН 1-2 степени (рис. 2).
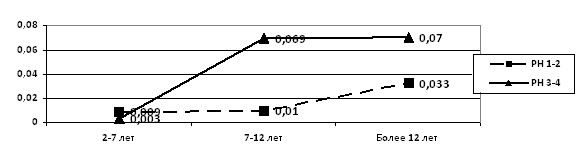
Рисунок 2. Средний уровень суточной протеинурии (г/24ч) в зависимости от выраженности РН и возраста детей
Частота протеинурии более 0,05 г/24ч в группе детей с РН 3-4 степени была в 4,5 раза выше, а частота протеинурии более 0,1 г/24ч в 5 раз выше, чем у пациентов 1-й группы. Установлено, что повышенный уровень протеинурии более 0,05 г/24ч выявлялся только у детей старше 7 лет, причем более чем в 5 раз чаще при РН 3-4 степени по сравнению с РН 1-2 степени (р<0,05).
У детей с РН 1-2 степени достоверно чаще (р<0,05) определялась микроальбуминурия, стандартизированная на креатинин мочи (МАУ/Cr) более 1,17 мг/ммоль Cr (рис. 3) и достоверно выше (р<0,05) средний уровень МАУ/Cr (2,22±0,46 мг/ммоль Cr), чем у детей с РН 3-4 степеней (0,87±0,23 мг/ммоль Cr).
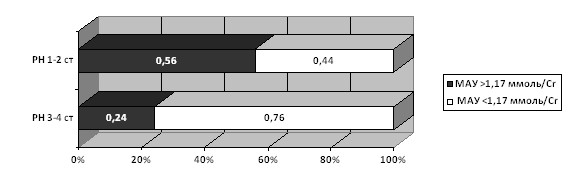
Рисунок 3. Частота МАУ/Cr более 1,17 мг/ммоль Cr (M±) у детей с РН
Установлена обратная корреляционная связь МАУ/Cr со степенью РН (r= -0,42) и несущественные корреляционные связи с мужским полом (r= 0,11), возрастом (r= -0,11) и уровнем протеинурии более 0,1 г/24ч (r= -0,16).
Выявлено, что уровень экскреции МАУ/Cr различался только в зависимости от степени РН, причем, чем тяжелее было повреждение почечной паренхимы, тем ниже был уровень микроальбуминурии. Относительный риск (RR) выявления ранних стадий РН составил 2,33.
Артериальное давление при разовых (трехкратных) измерениях по методу Короткова у 97% детей было в пределах возрастной нормы. Иные данные получены при проведении суточного мониторирования артериального давления (СМАД) – гипертензия диагностирована почти в трети (31,3%) случаев (р< 0,05).
При сопоставлении уровня АД и степени рефлюкс-нефропатии выявлена достоверная разница, в основном за счет большей частоты стабильной АГ, у детей с тяжелыми поражениями паренхимы (табл. 2).
Таблица 2
Частота артериальной гипертензии у детей в зависимости
от тяжести рефлюкс-нефропатии
| группы | СМАД | |||
| АГ | АГ стабильная | АГ латентная | Нормальное АД | |
| 1. РН 1-2 степени (n=39) | 0,21 | 0 | 0,21 | 0,79 |
| 2. РН 3-4 степени (n=25) | 0,48 | 0,2 | 0,28 | 0,52 |
| P1-2 | <0,05 | <0,05 | >0,05 | <0,05 |
У детей, независимо от тяжести РН, преобладали больные с патологическими циркадными ритмами (в 68,8% случаях), что значительно выше, чем в популяции здоровых детей (15%). Среди вариантов патологического циркадного ритма АД практически с равной частотой определялись «over-dippers» и «non-dippers». Для детей с РН 1-2 степени наиболее частым вариантом был «non-dippers». Нарушений циркадного ритма по типу «night-peakers» не было выявлено.
Цитохимические методы исследования выявили наличие недостаточности клеточной биоэнергетики у всех обследуемых детей, особенно выраженные при тяжелых степенях РН, которая проявлялась в снижении активности таких ферментов, как -глицерофосфатдегидрогеназы и глутаматдегидрогеназы у более чем 80% пациентов и в 4 раза более частом нарушении активности сукцинатдегидрогеназы (p>0,05). Таким образом, для тяжелых степеней РН характерна более выраженная степень митохондриальной дисфункции, что, возможно, отражает процессы гипоксии в почечной ткани и структурно-функциональную дезорганизацию митохондрий и носят вторичный характер, сопровождая основной патологический процесс.
Установлено, что прогрессирующее течение рефлюкс-нефропатии характерно в случае сохранения на протяжении 12 и более месяцев стойкого или интермиттирующего ПМР (табл. 3).
Таблица 3.
Прогрессирование РН от состояния ПМР в динамике наблюдения
| Динамика ПМР | Прогрессирующая РН 1 | Стабильная РН 2 | Р1-2 |
| 1. Регресс ПМР А) через 12 месяцев Б) через 36 месяцев В) через 60 месяцев | 0,31 0,72 0,96 | 0,77 0,84 1,0 | <0,05 >0,05 >0,05 |
| 2. Стойкий ПМР А) через 12 месяцев Б) через 36 месяцев В) через 60 месяцев | 0,69 0,28 0,04 | 0,23 0,16 0 | <0,05 >0,05 >0,05 |
| P1А-2А | <0,05 | <0,05 | |
| P1Б-2Б | <0,05 | <0,05 | |
| P1В-2В | <0,05 | <0,05 |
Также выявлено, что в группе детей с прогрессирующим течением РН частота рецидивирования ИМС была более чем в 1,5 раза выше, по сравнению с детьми со стабильным течением рефлюкс-нефропатии (p<0,05), и в этой же группе была достоверно выше и частота случаев ИМС в год.
При анализе функциональных показателей выявлено, что частота снижения СКФ достоверно не отличались у детей в зависимости от течения РН. В то же время частота нарушений концентрационной функции в группе больных с прогрессирующим течением РН была в 3,5 раза выше, чем у пациентов со стабильным течением РН (p<0,05) (рис. 4).
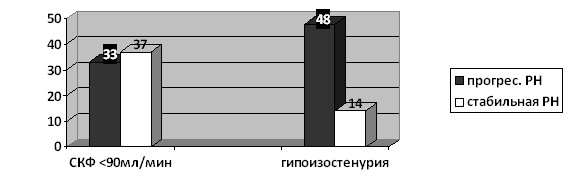
Рисунок 4. Частота нарушения функции почек в зависимости от течения РН
Установлено, что у детей с прогрессирующей РН в динамике наблюдения отмечалось нарастание экскреции белка с мочой (более чем на 30% в год) после 36 месяцев наблюдения (рис. 5) и в 8 раз выше частота суточной протеинурии более 0,05 г/24ч (p<0,05).
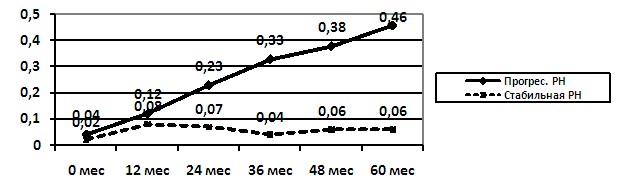 Рисунок 5. Частота протеинурии более 0,05 г/24ч у детей в зависимости от течения РН в динамике наблюдения
Рисунок 5. Частота протеинурии более 0,05 г/24ч у детей в зависимости от течения РН в динамике наблюдения
За время наблюдения в группе пациентов со стабильным течением РН средний уровень МАУ/Cr не превышал нормальных значений. В то же время у детей с прогрессирующим течением РН длительно сохранялся высокий уровень экскреции МАУ/Cr (p<0,05), и только в отдаленный период наблюдения его уровень значительно снижался (рис. 6).
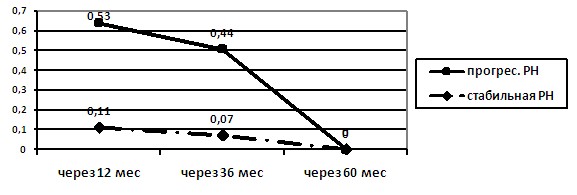
Рисунок 6. Частота МАУ/Cr более 2,34 мг/ммольCr у детей в зависимости от течения РН в динамике наблюдения
Для проведения анализа эффективности различных тактик ведения детей с ПМР были выделены 2 группы: 1 группа – 26 детей после оперативной и эндоскопической коррекции ПМР и 2 группа – 45 пациентов, получавших консервативную терапию. Группы отличались по возрасту – у оперированных детей средний возраст был достоверно выше (10,1±0,81 и 7,56±0,57 лет, соответственно), отмечалось преобладание 4-5 степени ПМР (p<0,05) и более тяжелых поражений почечной паренхимы (p<0,05).
Так как известно, что наличие ПМР является одним из ведущих факторов развития РН, было проведено сравнение двух видов лечения по динамике ПМР. Установлено, что в 2/3 случаев, независимо от тактики коррекции ПМР, прогрессирование РН выявлялось у детей со стойкими формами ПМР, в то время как при регрессии ПМР в 67% случаев (p<0,05) не отмечалось прогрессирующего течения рефлюкс-нефропатии в динамике наблюдения (табл. 4).
Таблица 4
Частота прогрессирования РН у детей со стойкими формами и рецидивами ПМР (отдаленный период)
| ПАРАМЕТРЫ | прогрессирующая РН (n=24) | стабильная РН (n=45) | p | ||
| абс | % | абс | % | ||
| 1. Неблагоприятная форма ПМР, в том числе: | 16 | 66,7 | 15 | 33,3 | <0,05 |
| 10 | 41,7 | 13 | 28,9 | >0,05 |
| 6 | 25 | 2 | 4,4 | >0,05 |
| 2. Регрессия ПМР | 8 | 33,3 | 30 | 66,7 | <0,05 |
| P1-2 | <0,05 | <0,05 | |||
Установлено, что у детей на консервативной терапии чаще наблюдались стойкие и интермиттирующие формы ПМР (p<0,05) на протяжении всего периода наблюдения.
Выявлено, что в группе детей, получавших консервативную терапию, сохранялась в 2-2,5 раза более высокая частота пациентов с рецидивами ИМС, чем в группе оперированных детей (>0,05) (рис. 7), что связано с характером ПМР. Установлено, что в 1,5 раза чаще рецидивы ИМС отмечались у детей со стойкими формами ПМР, чем у пациентов с регрессом ПМР.
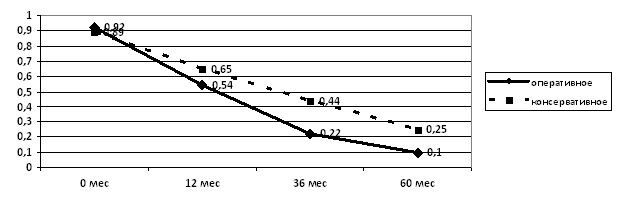 Рисунок 7. Частота детей с рецидивами ИМС в динамике наблюдения в зависимости от тактики лечения
Рисунок 7. Частота детей с рецидивами ИМС в динамике наблюдения в зависимости от тактики лечения
У детей, получавших консервативную терапию ПМР, частота комбинированных нарушений функций почек в динамике наблюдения увеличилась в 2,5 раза, в отличие от группы после оперативной коррекции ПМР, где частота комбинированного нарушения функций почек оставалась стабильной (рис. 8).

Рисунок 8. Динамика комбинированных нарушений функционального состояния почек у пациентов в зависимости от тактики терапии ПМР
В динамике наблюдения имело место нарастание частоты артериальной гипертензии (по данным СМАД) почти в 3 раза в группе детей, получавших консервативную терапию. В группе детей с оперативной коррекцией ПМР частота артериальной гипертензии оставалась на стабильном уровне (рис. 9).
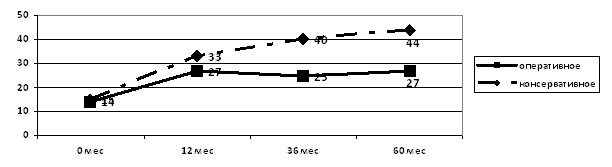
Рисунок 9. Частота артериальной гипертензии по данным СМАД у детей в динамике наблюдения в зависимости от тактики терапии ПМР
В динамике наблюдения в группе детей после оперативной коррекции ПМР отмечалось снижение как частоты повышенного уровня микроальбуминурии (МАУ/Cr более 2,34 мг/ммоль Cr), так и среднего уровня МАУ/Cr вплоть до полной нормализации ее уровня в моче в отдаленный период (p<0,05). В отличие от этого у четверти детей в группе консервативной терапии ПМР сохранялся высокий уровень микроальбуминурии на всем протяжении наблюдения (рис. 10).
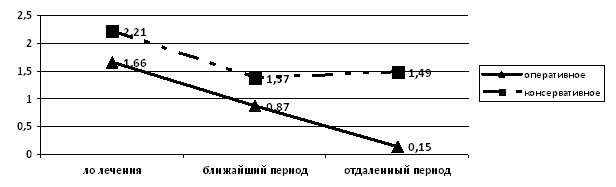
Рисунок 10. Динамика среднего уровня МАУ/Cr в моче (мг/ммоль креатинина) у детей в зависимости от тактики терапии ПМР
Частота прогрессирования РН в отдаленный период наблюдения (через 36 месяцев) более чем в 1,5 раза выше в группе детей на консервативной терапии, и более чем в 3,5 раза - при наблюдении через 60 месяцев (p<0,05) (рис. 11).
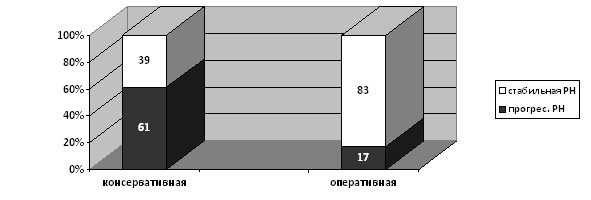
Рисунок 11. Частота прогрессирования рефлюкс-нефропатии у обследуемых детей в отдаленные сроки наблюдения
Таким образом, наибольший риск прогрессирования рефлюкс-нефропатии наблюдался у детей с нарастающей протеинурией в динамике (на 30% и более в год), с рецидивирующим течением ИМС, с высоким уровнем микроальбуминурии и протеинурии (0,05 г/24ч и более), с нарушением концентрационной функции почек, а также со стойкими и рецидивирующими формами ПМР. Артериальная гипертензия оказывала менее существенное влияние на прогрессирование рефлюкс-нефропатии (табл. 5).
Таблица 5
Критерии прогрессирования рефлюкс-нефропатии
| №п/п | Показатели | RR |
| 1 | Нарастание протеинурии в динамике более 30% в год | 5,0 |
| 2 | ИМС > 1 случая в год | 4,7 |
| 3 | Микроальбуминурия > 2,34 мг/ммоль Cr (МАУ/Cr) | 3,73 |
| 4 | Гипоизостенурия | 3,42 |
| 5 | Протеинурия > 0,05 г/24ч | 3,32 |
| 6 | Стойкие и рецидивирующие формы ПМР | 3,13 |
| 7 | Артериальная гипертензия | 1,66 |
Учитывая прогрессирующее течение рефлюкс-нефропатии, важное значение имеет использование препаратов, препятствующих нарастанию нефросклероза. В связи с этим детям с РН с ренопротективной целью назначались иАПФ. Показаниями к проведению терапии иАПФ было не только появление артериальной гипертензии, но и нарастание протеинурии, прогрессирование повреждения почечной ткани. Длительность терапии иАПФ составляла 12-24 месяцев.
Для анализа были выделены 2 группы детей: получавшие иАПФ (n=22) и не получавшие иАПФ (n=43).
Группы отличались по возрасту – у детей на терапии иАПФ средний возраст был достоверно выше (10,6±0,7 и 8,0±0,5 лет, соответственно), отмечалось преобладание более тяжелых поражений почечной паренхимы, более высокой частоты артериальной гипертензии, по данным СМАД (p<0,05), по остальным показателям различий не было.
При анализе результатов ренопротективной терапии как через 12, так и через 24 месяца наблюдения установлена тенденция к уменьшению очагов в почечной паренхиме у четверти детей 1-й группы, в то время как у пациентов, не получавших иАПФ, выявлялось увеличение количества очагов в 30% (через 12 месяцев) и в 38% (через 24 месяца) случаев.
В динамике наблюдения выявлено достоверное снижение частоты АГ на фоне ренопротективной терапии, и, напротив, нарастание у детей, не получавших препараты иАПФ (p<0,05).
Установлено достоверное снижение среднего уровня протеинурии только к 24 месяцам терапии иАПФ (p<0,05), и, наоборот, нарастание протеинурии в группе детей, не получавших данную терапию (рис. 12).
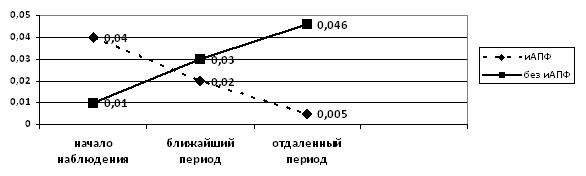 Рисунок 12. Динамика среднего уровня (г/24ч) протеинурии у детей на терапии иАПФ
Рисунок 12. Динамика среднего уровня (г/24ч) протеинурии у детей на терапии иАПФ
В динамике наблюдения выявлена тенденция к снижению микроальбуминурии в обеих группах. Однако при этом средний уровень микроальбуминурии в отдаленный период наблюдения был почти в 20 раз выше в группе сравнения (>0,05).
Получена отрицательная средней силы корреляционная связь между прогрессированием РН и терапией иАПФ (r= -0,33). Проведенный корреляционный анализ между прогрессированием РН и терапией иАПФ в зависимости от дозы (менее 0,1 мг/кг/24ч и более 0,1 мг/кг/24ч) выявил средней силы отрицательную связь (r= -0,69), что указывает на наличие дозозависимого ренопротективного эффекта, то есть: чем выше доза иАПФ, тем ниже частота прогрессирования РН.
На основании полученных данных предложен алгоритм ведения больных с ПМР:
* ренопротективная терапия
ВЫВОДЫ
- Повышенный уровень микроальбуминурии (более 1,17 мг/ммоль Cr), стандартизированной на креатинин мочи, выявляет ранние стадии повреждения почечной ткани у детей с пузырно-мочеточниковым рефлюксом.
- Для прогрессирующего течения рефлюкс-нефропатии характерен высокий уровень экскреции микроальбумина с мочой (более 2,34 мг/ммоль Cr), тогда как при стабильном течении рефлюкс-нефропатии уровень микроальбуминурии был в пределах нормальных значений (менее 1,17 мг/ммоль Cr).
- Сохранение стойкого или интермиттирующего пузырно-мочеточникового рефлюкса, рецидивирующее течение (более 3-х эпизодов в год) инфекции мочевой системы, уровень протеинурии, превышающий 0,05 г/24ч, и нарастание его более 30% в год характерно для детей с прогрессирующим течением рефлюкс-нефропатии.
- Артериальная гипертензия вдвое чаще развивается у детей с тяжелыми поражениями паренхимы почек, причем стабильная артериальная гипертензия выявляется только у детей с рефлюкс-нефропатией 3-4 степени. Для детей с рефлюкс-нефропатией 1-2 степени типичным вариантом патологического циркадного ритма артериального давления является «non-dippers», диагностированный у 41% больных, в то время как у детей с рефлюкс-нефропатией 3-4 степени в трети случаев определяется нарушение циркадного ритма по типу «over-dippers».
- У всех детей с пузырно-мочеточниковым рефлюксом определяется нарушение процессов клеточной биоэнергетики в виде снижения активности -глицерофосфатдегидрогеназы и глутаматдегидрогеназы. Особенно низкие уровни активности сукцинатдегидрогеназы в митохондриях лимфоцитов периферической крови выявляются при высоких степенях пузырно-мочеточникового рефлюкса и тяжелых повреждениях почечной ткани.
- В течение первого года наблюдения регресс пузырно-мочеточникового рефлюкса наблюдается вдвое чаще у детей после оперативного и эндоскопического лечения по сравнению с пациентами на консервативной терапии. Через 5 лет наблюдения у каждого пятого ребенка на консервативной терапии сохраняется стойкий пузырно-мочеточниковый рефлюкс, тогда как после оперативного и эндоскопического лечения во всех случаях наблюдается регресс пузырно-мочеточникового рефлюкса.
- У больных, получавших консервативную терапию, независимо от степени пузырно-мочеточникового рефлюкса, в 3 раза чаще наблюдалось прогрессирование очагового нефросклероза, чем у детей после оперативной коррекции, что обусловлено длительным сохранением стойких форм пузырно-мочеточникового рефлюкса.
- Ингибиторы АПФ эффективны в профилактике прогрессирования РН: у 80% больных отмечается отсутствие прогрессирования нефросклероза по данным РСГ с ДМСА, купирование артериальной гипертензии и снижение уровня или исчезновение протеинурии и микроальбуминурии.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Для определения тактики лечения пациентов с пузырно-мочеточниковым рефлюксом рекомендуется использовать разработанный алгоритм.
- Для прогнозирования прогрессирования рефлюкс-нефропатий у детей с пузырно-мочеточниковым рефлюксом рекомендуется учитывать частоту рецидивов инфекции мочевой системы, уровень протеинурии и микроальбуминурии, нарастающий (более 30% в год) уровень протеинурии и наличие стойких или рецидивирующих форм пузырно-мочеточникового рефлюкса, особенно у детей на консервативной терапии.
- У детей на консервативной терапии при выявлении критериев прогрессирования рефлюкс-нефропатии даже при низких степенях пузырно-мочеточникового рефлюкса рекомендуется проводить эндоскопическую коррекцию.
- Независимо от метода коррекции пузырно-мочеточникового рефлюкса для профилактики прогрессирования рефлюкс-нефропатии необходимо регулярно (каждые 6-9 месяцев) выявлять стойкие и рецидивирующие формы пузырно-мочеточникового рефлюкса.
- Для предупреждения прогрессирования рефлюкс-нефропатии рекомендуется проводить терапию ингибиторами ангиотензин-превращающего фермента с использованием доз препарата выше среднетерапевтических (энап более 0,1 мг/кг/24ч) и сроком 2 и более лет с контролем ее эффективности с помощью суточного мониторирования артериального давления.
ПУБЛИКАЦИИ
- Аксенова М.Е., Лепаева Т.В., Длин В.В. Артериальная гипертензия у детей с пузырно-мочеточниковым рефлюксом.// Материалы конгресса «Современные методы диагностики и лечения в детской нефрологии и урологии». - Москва, 2002. С.93.
- Фомин Д.К., Каралкин А.В., Аксенова М.Е., Лепаева Т.В., Игнатова М.С. Радионуклидная диагностика пузырно-мочеточникового рефлюкса и рефлюкс-нефропатии у детей // Материалы конгресса «Современные методы диагностики и лечения в детской нефрологии и урологии». Москва, 2002. С. 101-102.
- Аксенова М.Е., Лепаева Т.В., Длин В.В., Турпитко О.Ю., Гусарова Т.Н., Фомин Д.К.. Осложнения пузырно-мочеточникового рефлюкса у детей // Материалы Всероссийской конференции «Современные технологии в педиатрии». Москва, 2002. С.211.
- Аксенова М.Е., Лепаева Т.В., Длин В.В., Фомин Д.К. Факторы риска развития артериальной гипертензии у детей с пузырно-мочеточниковым рефлюксом // Материалы Международной нефрологической конференции «Белые ночи» XI ежегодного Санкт-Петербургского нефрологического семинара и V Балтийской конференции. С-Петербург, 2003. С.22.
- Аксенова М.Е., Лепаева Т.В., Фомин Д.К., Длин В.В. Параметры артериального давления у детей с разной степенью рефлюкс-нефропатии // Материалы II Российского конгресса «Современные технологии в педиатрии и детской хирургии». Москва, 2003. С.218-219.
- Аксенова М.Е., Лепаева Т.В., Фомин Д.К., Длин В.В. Показатели артериального давления у детей с разной степенью рефлюкс-нефропатии // Материалы III Конгресса педиатров-нефрологов России. С-ПбГПМА, 2003. С.92.
- Лепаева Т.В., Длин В.В., Казанская И.В. Протеинурия у детей с рефлюкс-нефропатией. // Материалы III Конгресса педиатров-нефрологов России. Санкт-Петербург, 2003. С.126.
- Aksenova M., Lepaeva T., Dlin V., Fomin D., Nazarova N., Ignatova M. Arterial hypertension in children with reflux nephropathy: frequency and factors predisposing to its development.- Nephrol Dial Transplant(2003)vol.18, suppl.4, p.820.
- Аксенова М.Е., Лепаева Т.В., Фомин Д.К., Длин В.В. Уровень артериального давления у детей с разной степенью рефлюкс-нефропатии // Материалы III Российского Конгресса "Современные технологии в педиатрии и детской хирургии". Москва, 2004. С.262.
- Aksenova M., Lepaeva T., Fomin D., Dlin V. Blood pressure in children with vesicoureteral reflux: its relation with degree of reflux-nephropathy). Abstract book from the XLI Congress of ERA-EDTA: Lisbon (Portugal), 2004. p.126.
- Aksenova M., Lepaeva T., Fomin D. Аrterial hypertension development risk factors in children with reflux-nephropathy. Abstracts of 13th Congress of IPNA: Adelaide (Australia), 2004 // Pediatr.Nephrol., 2004. N19. C162.
- Лепаева Т.В., Длин В.В., Казанская И.В. Артериальная гипертензия у детей с рефлюкс-нефропатией.// Материалы IV конференции РДО. - Санкт-Петербург, 2005.– Нефрология и диализ. – 2005. – т.7, № 3, с.367.
- Лепаева Т.В., Длин В.В., Казанская И.В. Микроальбуминурия при рефлюкс-нефропатии у детей.// Материалы IV конференции РДО. - Санкт-Петербург, 2005.– Нефрология и диализ. – 2005. – т.7, № 3, с.367-368.
- Лепаева Т.В., Конькова Н.Е., Длин В.В. Эффективность ингибиторов ангиотензинпревращающего фермента у детей с рефлюкс-нефропатией. // Материалы IV Российского Конгресса «Современные технологии в педиатрии и детской хирургии». Москва, 2005. с.192.
- Смирнов Ю.Н., Фомин Д.К., Яцык С.П., Длин В.В., Лепаева Т.В., Агапов Е.Г., Назаров А.А. Радионуклидные методы исследований в детской уронефрологии.// Материалы II Евразийского конгресса по медицинской физике и инженерии «Медицинская физика – 2005», Москва, 2005, с. 166.
- Лепаева Т.В., Длин В.В., Казанская И.В. Диагностика рефлюкс-нефропатии у детей.// Материалы VI съезда научного общества нефрологов России. – Москва, 2005. – с. 29-30.
- Фомин Д.К., Яцык С.П., Иванова В.В., Лепаева Т.В., Борисова О.А., Назаров А.А Количественное определение интенсивности пузырно-мочеточникового рефлюкса по данным непрямой радионуклидной цистографии.// Материалы V Российского конгресса по детской нефрологии. – Воронеж, 2006. – С.241 – 242.
- Лепаева Т.В., Длин В.В., Казанская И.В. и др. Диагностическое значение микроальбуминурии у детей с рефлюкс-нефропатией. // Материалы VI Всероссийского конгресса «Современные технологии в педиатрии и детской хирургии» – Москва, 2008. – С. 236.
- Фомин Д.К., Яцык С.П., Лепаева Т.В., Агапов Е.Г., Борисова О.А., Назаров А.А. Клиническая значимость определения количественных показателей непрямой радионуклидной цистографии // Медицинская визуализация. 2008.- №4. С 108-113.
- Фомин Д.К., Лепаева Т.В., Агапов Е.Г., Яцык С.П., Рябцева А.В., Назаров А.А. К вопросу о выборе радиофармпрепарата для динамической сцинтиграфии почек с функциональными пробами // Педиатрическая фармакология. 2008. –т.5. –№ 5. –С 57-59.
- Каприн А.Д., Фомин Д.К., Яцык С.П., Лепаева Т.В., Агапов Е.Г., Башмаков В.А. Особенности радионуклидного исследования у детей с аномалиями развития мочевыводящих путей // Вестник РНЦРР. –2008. – вып. 7 (электронная версия).
- Каприн А.Д., Фомин Д.К., Яцык С.П., Лепаева Т.В., Агапов Е.Г., Башмаков В.А. Оценка отдаленных результатов хирургического лечения уретерогидронефроза и гидронефроза методами комплексной динамической сцинтиграфии // Вестник РНЦРР. – 2008. – вып. 7 (электронная версия).
- Фомин Д.К., Яцык С.П., Лепаева Т.В., Агапов Е.Г., Борисова О.А., Назаров А.А. Радионуклидная методика оценки количественных характеристик пузырно-мочеточникового рефлюкса у детей. // Вестник РНЦРР. – 2008. – вып. 7 (электронная версия).
- Фомин Д.К., Яцык С.П., Лепаева Т.В., Агапов Е.Г., Борисова О.А., Назаров А.А. Функциональное состояние почечной паренхимы у больных с пузырно-мочеточниковым рефлюксом. //Вестник РНЦРР. – 2008. – вып. 7 (электронная версия).
- Фомин Д.К., Яцык С.П., Лепаева Т.В., Агапов Е.Г., Борисова О.А., Назаров А.А. Особенности развития нефросклероза у детей при обструктивных уропатиях по данным статической нефросцинтиграфии //Вестник РНЦРР. –2008. – вып. 8 (электронная версия).
- Фомин Д.К., Яцык С.П., Лепаева Т.В., Агапов Е.Г., Борисова О.А., Назаров А.А. Значение определения количественных показателей динамической сцинтиграфии почек с микционной пробой. Вестник РНЦРР. – 2008. – вып. 8 (электронная версия).
- Лепаева Т.В., Длин В.В., Казанская И.В., Фомин Д.К. Характер поражения почек у детей с ПМР в зависимости от тактики ведения. // Материалы VIII конгресса «Современные технологии в педиатрии и детской хирургии». – Москва, 2009 – с.191.
- Лепаева Т.В., Длин В.В., Казанская И.В., Погомий Н.Н., Окунева Т.С., Фомин Д.К., Зайкова Н.М. Микроальбуминурия при рефлюкс-нефропатии у детей //Нефрология и диализ – Москва, 2009 – т.11, №1, с. 31-34.
- Агапов Е.Г, Длин В.В, Лепаева Т.В. Прогнозирование прогрессирующего течения рефлюкс-нефропатии у детей (медицинская технология). 2009 г.
- Длин В.В., Махачев Б.М., Лепаева Т.В., Османов И.М. Пузырно-мочеточниковый рефлюкс и рефлюкс-нефропатия у детей// Практическое руководство по детским болезням под ред. Коколиной В.Ф., Румянцева А.Г. – Медпрактика-М, Москва, 2010 – с. 241-265.
СПИСОК ПРИНЯТЫХ СОКРАЩЕНИЙ
АГ - артериальная гипертензия;
АД - артериальное давление;
ДМСА - димеркапто-сукциновая кислота;
иАПФ - ингибиторы ангиотензин- превращающего фермента;
ИМС - инфекция мочевой системы;
МАУ/Cr - микроальбуминурия к креатинину мочи;
НСГ - нефросцинтиграфия;
ОМС - органы мочевой системы;
ПМР - пузырно-мочеточниковый рефлюкс;
РН - рефлюкс-нефропатия;
СКФ - скорость клубочковой фильтрации;
СМАД - суточное мониторирование артериального давления;
СПБ - суточная потеря белка;
УЗИ - ультразвуковое исследование;
ХБП - хроническая болезнь почек

