Особенности клинического течения гипертонической болезни при развитии дисциркуляторной энцефалопатии второй стадии
На правах рукописи
ЦУРЦУМИЯ
Дареджан Бичикоевна
ОСОБЕННОСТИ КЛИНИЧЕСКОГО ТЕЧЕНИЯ
ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНИ ПРИ
РАЗВИТИИ ДИСЦИРКУЛЯТОРНОЙ
ЭНЦЕФАЛОПАТИИ ВТОРОЙ СТАДИИ
14.01.04 – внутренние болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Санкт-Петербургская государственная медицинская академия им. И. И. Мечникова Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель:
доктор медицинских наук,
профессор Радченко Валерий Григорьевич
Официальные оппоненты:
доктор медицинских наук,
профессор Болдуева Светлана Афанасьевна
доктор медицинских наук,
профессор Шуленин Сергей Николаевич
Ведущее учреждение:
“ГОУВПО Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова” Росздрава
Защита состоится «09» декабря 2010 года в ___ часов на заседании диссертационного совета Д 208.086.01 в ГОУВПО «Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова Федерального агентства по здравоохранению и социальному развитию» (195067, Санкт-Петербург, Пискаревский пр., д. 47).
С диссертацией можно ознакомиться в библиотеке ГОУВПО «Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова Федерального агентства по здравоохранению и социальному развитию»
Автореферат разослан « ___ » ___________ 2010 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук,
профессор Соколова Л.А.
Введение
Актуальность проблемы. В настоящее время более 30% населения России страдает гипертонической болезнью (ГБ), прогрессирование которой приводит к тяжелым патоморфологическим изменениям "органов-мишеней", что является одним из основных факторов, определяющих смертность (Чазова И.Е., 2003). При этом церебро-васкулярная патология, развивающаяся при ГБ, является еще и важнейшей медико-социальной проблемой. Это обусловлено тяжестью ее течения, проявляющейся выраженным нарушением качества жизни, а также неуклонным ростом встречаемости данной патологии, преимущественно за счет лиц трудоспособного возраста (Бурцев Е.М., 1995, Кипарисова Е.С., 2001).
При ГБ преимущественно поражаются интрацеребральные артерии и микроциркуляторное русло, с развитием в них функциональной, а затем структурной перестройки, следствием чего является возникновение гипертонической или дисциркуляторной ангиоэнцефалопатии (ДЭ). Тем не менее, не ясным остается влияние последующих изменений, возникающих в сосудистой системе головного мозга, на течение самой ГБ. Особенную актуальность в прогностическом плане имеет решение вопроса: на какой стадии ДЭ отмечается наиболее существенное ее воздействие на клиническое течение заболевания и качество жизни больных.
В последнее время активно изучается диагностическое и прогностическое значение начальной стадии ДЭ в отношении развития стенотического и тромботического процесса. Установлено, что изменения церебральной гемодинамики в большинстве случаев компенсируются резервными возможностями организма (Кипарисова Е.С., 2001). Разработанные специалистами принципы диагностики и лечения поздних стадий ДЭ, в основном направлены на профилактику ее тяжелых патологических форм, таких как транзиторные ишемические атаки (ТИА) и острое нарушение мозгового кровообращения (ОНМК). Клинические проявления и роль ДЭ второй стадии у больных ГБ, при этом, остаются исследованными недостаточно. В литературе не описано ее влияние на формирование кардиологических синдромов и показатели качества жизни. Не изучены сопутствующие этой стадии ДЭ изменения суточного профиля артериального давления (АД) и состояние мозгового кровотока, а также подходы к их коррекции.
Опубликованные в настоящее время данные о влиянии различных групп гипотензивных и вазоактивных препаратов на церебральную гемодинамику противоречивы. В ряде работ имеются сведения о способности некоторых средств, снижающих системное АД, усугублять ишемические изменения головного мозга, что является небезопасным у лиц с ДЭ. При этом не определена роль и эффективность препаратов, улучшающих мозговой кровоток на разных стадиях ДЭ, в особенности при второй стадии. До настоящего времени не полностью изучены эффекты их влияния на клиническое течение ГБ, изменения ее кардиологических и неврологических симптомов, в том числе на особенности колебаний суточного АД и мозговой кровоток.
Учитывая вышеизложенное, актуальным является изучений клинического течения ГБ, динамики ее инструментальных характеристик и оценка эффективности терапии, влияющей на проявления заболевания, у больных с ДЭ второй стадии.
Цель исследования. Оптимизация диагностики и терапии у больных гипертонической болезнью с дисциркуляторной энцефалопатией второй стадии с учетом особенностей клинического течения заболевания.
Задачи исследования
1. Изучить особенности кардиальных проявлений у больных гипертонической болезнью с дисциркуляторной энцефалопатией второй стадии, в сравнении с пациентами ГБ с дисциркуляторной энцефалопатией первой стадии.
2. Оценить некоторые характеристики качества жизни и психологического статуса у больных гипертонической болезнью с дисциркуляторной энцефалопатией второй стадии, в сравнении с пациентами гипертонической болезнью с первой стадией дисциркуляторной энцефалопатии.
3. Оценить влияние дисциркуляторной энцефалопатии второй стадии на выраженность изменений, регистрируемых при суточном мониторировании артериального давления у больных гипертонической болезнью.
4. Дать характеристику особенностей мозгового кровотока у больных гипертонической болезнью с дисциркуляторной энцефалопатией второй стадии.
5. Оценить краткосрочное и долгосрочное (через 12 месяцев) влияние терапии, включающей лизиноприл и винпоцетин, на клинические проявления, инструментальные характеристики сердечно-сосудистой системы и состояние мозгового кровотока у больных гипертонической болезнью с дисциркуляторной энцефалопатией второй стадии.
Научная новизна исследования. Впервые оценена роль дисциркуляторной энцефалопатии второй стадии, как независимого фактора прогрессирования гипертонической болезни, реализующегося развитием у больных нестабильной гемодинамики, увеличением пульсового артериального давления и ночного повышения артериального давления.
Выявлено значимое снижение показателей качества жизни при развитии ДЭ второй стадии у больных ГБ.
Определено диагностическое значение суточного мониторирования артериального давления и транскраниальной ультразвуковой допплерографии в верификации второй стадии дисциркуляторной энцефалопатии у больных гипертонической болезнью.
Впервые оценено влияние комплексной терапии, включающей лизиноприл и винпоцетин, на вариабельность, пульсовое артериальное давление, нагрузку давлением и степень ночного повышения артериального давления, вазоспазм и общее периферическое сопротивление мозговых артерий у больных гипертонической болезнью с дисциркуляторной энцефалопатией второй стадии.
На основании комплексного обследования больных гипертонической болезнью с дисциркуляторной энцефалопатией второй стадии определены показания для комбинированной долгосрочной терапии лизиноприлом и винпоцетином.
Теоретическая и практическая значимость работы. Определено значение кардиальных проявлений, качества жизни и психологического функционирования у больных гипертонической болезнью в диагностике дисциркуляторной энцефалопатии второй стадии.
Выявлены показатели суточного мониторирования артериального давления и транскраниальной ультразвуковой допплерографии у больных гипертонической болезнью, позволяющие диагностировать вторую стадию дисциркуляторной энцефалопатии.
Оптимизирована комплексная терапия гипертонической болезни у больных с дисциркуляторной энцефалопатией второй стадии, в зависимости от показателей пульсового артериального давления, вариабельности АД, нагрузки давлением и степени ночного повышения артериального давления, вазоспазма и общего периферического сопротивления мозговых артерий.
Выявлена высокая эффективность и определены показания для комбинированной долгосрочной терапии лизиноприлом и винпоцетином у больных гипертонической болезнью с дисциркуляторной энцефалопатией второй стадии.
Подготовлена усовершенствованная медицинская технология «Диагностика и лечение гипертонической болезни при развитии дисциркуляторной энцефалопатии», утвержденная Комитетом по здравоохранению Правительства Санкт-Петербурга (2010 г.).
Основные положения, выносимые на защиту
1. Развитие дисциркуляторной энцефалопатии второй стадии у больных гипертонической болезнью способствует прогрессированию заболевания, путем развития нестабильной гемодинамики, снижения показателей качества жизни, психологического функционирования и нарушения мозгового кровотока.
2. Диагностирование второй стадии дисциркуляторной энцефалопатии у больных гипертонической болезнью возможно на основании анализа показателей суточного мониторирования артериального давления и транскраниальной ультразвуковой допплерографии.
3. Оптимальным вариантом долгосрочной (12 месяцев) комплексной терапии гипертонической болезни у больных с дисциркуляторной энцефалопатией второй стадии является комбинация ингибитора АПФ лизиноприла и вазоактивного препарата группы винпоцетина.
Личный вклад автора. Автор лично участвовал в обследовании, динамическом наблюдении и лечении 150 больных гипертонической болезнью с дисциркуляторной энцефалопатией. Непосредственно автором проводилось клиническое обследование пациентов, оценка параметров качества жизни, данных ЭКГ, Эхо-КГ, суточного мониторирования АД (СМАД), транскраниальной ультразвуковой допплерографии (УЗДГ), а также статистическая обработка полученных результатов.
Апробация и реализация работы. Основные материалы исследований были доложены на итоговой конференции кафедры внутренних болезней с курсом терапии и нефрологии ФПК «Актуальные вопросы внутренних болезней» Санкт-Петербург, Россия, 2007, 2008, 2009, 2010 гг.
Результаты исследования были внедрены в практическую работу кафедры внутренних болезней с курсом терапии и нефрологии ФПК СПбГМА им И.И. Мечникова, ГУЗ клинической инфекционной больницы им. С.П. Боткина, сети медицинских центров ООО «Ришар» г. Санкт-Петербурга, городской поликлиники №87 (Санкт-Петербург).
Результаты работы включены в план тематических занятий со студентами, слушателями факультета повышения квалификации врачей и преподавателей СПбГМА им. И.И. Мечникова.
По теме диссертации опубликовано 7 научных работ, в том числе 1 статья в ведущем журнале, входящем в перечень ВАК.
Структура и объем диссертации. Диссертация изложена на 156 страницах машинописного текста, состоит из введения, 5 глав, включающих обзор литературы, материалы и методы исследования, собственные данные, обсуждение результатов, выводы и практические рекомендации. Библиографический указатель содержит 211 наименований, из них 108 иностранных источника. Работа иллюстрирована 17 рисунками и 28 таблицами.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования. В основу работы положены результаты обследования 150 больных ГБ, сочетающейся с ДЭ, находящихся на лечении в клинике внутренних болезней с курсом терапии и нефрологии ФПК ГОУВПО «Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова Федерального агентства по здравоохранению и социальному развитию».
Соотношение мужчин и женщин составило 53 (35 %): 97 (65 %) человек. Средний возраст пациентов был 58,3±4,7 лет.
Встречаемость ГБ с ДЭ у мужчин была несколько ниже, чем у женщин – 38,7 % и 61,3 % соответственно. При этом в обеих группах отмечался рост заболеваемости с возрастом. Так, среди пациентов с ГБ и ДЭ преобладал возраст старше 60 лет – у 48,7 % человек, что свидетельствовало о более высоком риске у них церебро-васкулярных осложнений (Гусев Е.И., 1997; Чазова И.Е., 2003).
Критериями включения пациентов в исследование явилось повышение АД в пределах 140/90–200/110 мм. рт. ст.
Все исследуемые больные ГБ в зависимости от наличия и выраженности ДЭ были распределены на группы:
1 группа: больные ГБ II стадии с начальными клиническими проявлениями ДЭ 1 стадии – 45 человек (группа сравнения).
2 группа: пациенты c ГБ II стадии и клинически выраженными проявлениями ДЭ 2 стадии – 67 человек.
3 группа: больные с ГБ III стадии и ДЭ 3 стадии, перенесшие ОНМК или ТИА, давностью не менее 9 месяцев – 38 человек (группа сравнения).
Контрольная группа включала 30 практически здоровых лиц, соответствующих исследуемым группам по полу и возрасту.
Диагноз ГБ устанавливался на основании жалоб, анамнеза, объективного осмотра, а также данных лабораторно-инструментальных исследований, осмотра невропатолога и окулиста.
Стратификация тяжести артериальной гипертензии проводилась в соответствии с Национальными рекомендациями (2007), а также руководством Европейского общества кардиологов (Guidelines Committee, 2003). При этом, пациенты с ГБ I стадии в выборке отсутствовали, тогда как встречаемость ГБ II стадии составила 75 %, а ГБ III стадии – 25 %.
Диагноз ДЭ у больных ГБ верифицировался на основании жалоб и подробного неврологического осмотра, а также данных магнитно-резонансной томографии головного мозга в соответствии с критериями, предложенными Кипарисовой Е.С. (2001 г.). Градация стадии ДЭ основывалась на классификации, предложенной Е.В. Шмидтом и соавт. (1971), в последствии дополненной Н.В. Верещагиным и соавт. (1977), Е.И. Гусевым (1985); Е.И. Бурцевым и соавт. (1993).
Для оценки влияния медикаментозной терапии на клиническое течение ГБ, при развитии ДЭ второй стадии, в зависимости от вида проводимого лечения, путем случайной выборки, больные исследовательской группы дополнительно были рандомизированы на две сравнимые подгруппы 33 и 34 человека. Все пациенты в сравниваемых подгруппах были сопоставимы по возрасту и полу.
В I подгруппу (подгруппу сравнения) вошло 33 (49,3 %) больных ГБ, которым проводилась гипотензивная терапия ингибитором АПФ группы лизиноприла (препарат Диротон) в дозе 5–10 мг/сут.
II подгруппу (опытную подгруппу) составили 34 (50,7 %) пациентов, которые дополнительно к лизиноприлу получали лечение вазоактивным препаратом, воздействующим на мозговой кровоток, группы винпоцетина (препарат Кавинтон). Винпоцетин назначался ежедневно по 5 мг в/в капельно, на 200 мл физиологического раствора в течение 10 дней, с последующим переходом на пероральный прием по 5 мг/сут. в течение 3 месяцев (краткосрочная терапия), с повторным курсом данной терапии через 6 месяцев (долгосрочная терапия).
Оценка эффективности терапии больных проводилась спустя 3 и 12 месяцев после окончания терапии на основании анализа динамики клинических и биохимических параметров, показателей качества жизни, СМАД, данных ЭКГ, Эхо-КГ, транкраниальной УЗДГ, до и после проведенного лечения. Кроме того, осуществлялось клиническое наблюдение за данными подгруппами пациентов в течение 12 месяцев с анализом количества экстренных госпитализаций по поводу дестабилизации АД.
При клиническом обследовании больных ГБ с ДЭ оценивались характеристики болевого кардиального синдрома, сердцебиения и одышка при физической нагрузке, выраженность астеновегетативного синдрома, цефалгий, головокружений и нарушений памяти. В исследование не включались лица с выявленными стенокардией, декомпенсированной сердечной недостаточностью и гемодинамически значимыми нарушениями сердечного ритма.
Физикальное обследование больных проводилось по общепринятым методикам. Учитывая существенное значение присоединения атеросклеротического процесса у больных ГБ, из исследования были исключены лица с гемодинамически значимыми стенотическими поражениями магистральных артерий (аорты, сонных, почечных), при которых обнаруживался грубый систолический шум.
Для оценки степени психо-эмоциональных нарушений и дезадаптационного синдрома у больных ГБ с ДЭ, проводилось психометрическое определение качества жизни с помощью наиболее распространенного в клинических исследованиях и при индивидуальном мониторинге опросника SF-36 (Russian Standard Version 1.0) (Ware J.E., 1993).
Всех пациентов осматривали невропатолог.
Общеклинические лабораторные исследования крови, мочи и кала осуществлялись на основе стандартных методик. В комплекс биохимического исследования сыворотки крови входили анализ липидограммы, активности аланинаминотрансферазы и аспартатаминотрансферазы, уровней креатинина, калия, сахара и скорости клубочковой фильтрации (СКФ) по MDRD. В исследование не включались пациенты с гипергликемией, микроальбуминурией, протеинурией, снижением СКФ, гиперхолестеринемией (более 6 ммоль/л).
СМАД осуществлялось с использованием аппарата «Shiller» с дневным интервалом 15–20 минут и ночным – 30 минут. Дневные и ночные периоды определялись в соответствии с дневниками пациентов. По данным мониторирования анализировались:
а) средние значения систолического АД (САД) и диастолического АД (ДАД) за 24 ч, за день и ночь;
б) вариабельность АД, представляющая собой оценку отклонений АД от кривой суточного ритма, которая рассчитывалась как стандартное отклонение от среднего АД;
в) суточный индекс (СИ) или степень снижения ночного АД. Определялся как процентное отношение ночного уровня АД к его дневным показателям, рассчитывался по формуле СИ=(среднее АД дневное – среднее АД ночное)100/среднее АД дневное. В зависимости от степени снижения ночного АД (НСАД) выделялось несколько типов суточных профилей АД;
г) индекс времени АД (ИВ) - показатель нагрузки давлением на органы-мишени, представляемый как процент повышенных измерений АД, превышающих принятый за верхнюю границу нормы (для дня – 140/90, для ночи – 120/80 мм.рт.ст.) к общему количеству регистраций;
д) пульсовое АД (ПАД) среднесуточное, среднедневное и средненочное – параметр гемодинамики, представляющий разницу между САД и ДАД.
ЭКГ осуществлялась в утренние часы, в положении лежа, после 30-ти минутного отдыха, производилась в 12-ти стандартных отведениях на аппарате CardioMAX – 3010 «FukudaDENSHI»- Япония. Полученные результаты оценивались по стандартной методике (Орлов В.Н., 2006). В исследование не включались пациенты с выявленными очаговыми изменениями, признаками коронарной недостаточности, мерцательной аритмией.
Суточное мониторирование ЭКГ проводилось на аппарате Кардиолайн АД-35, при этом учитывались частота и характер различных нарушений ритма, наличие депрессии сегмента ST при физической нагрузке. В исследование не включались пациенты с выявленными ишемическими эпизодами, пароксизмальной мерцательной аритмией.
Эхо-КГ выполнялось на аппарате «Sonas-2000», по общепринятой методике, в М- и В- режимах. Измерения проводились согласно рекомендациям американского эхокардиографического общества (Schiller N.B., 1989).
УЗДГ позволяла оценить состояние гемодинамики экстра- и интракраниальных артерий. Она выполнялась на аппаратах "Спектра", производство Россия. Наибольшее значение придавалось изучению кровотока в позвоночной артерии (ПА) и левой среднемозговой артерии (СМА), который нарушается в большей степени у правшей. Оценивали максимальную систолическую (S), конечную диастолическую (D) и среднюю (V) линейную скорость кровотока (ЛСК). Рассчитывали показатель периферического сопротивления - пульсационный индекс Гослинга (PI) по формуле S-D/V, индекс сопротивления Пурсело (RI) по формуле S-D/S. Кроме того, оценивались признаки вазоспазма в СМА в зависимости от соотношения ЛСК в СМА и ПА. Пациенты, у которых были выявлены гемодинамически значимые окклюзивные нарушения церебральных сосудов в исследование не включались.
Магнитно-резонансная томография головного мозга была выполнена на аппарате Somaton AR-C фирмы Siemens по стандартной методике у 47 (31,3 %) пациентов с ГБ и ДЭ: у 10 (22,2%) больных 1 группы, 25 (37,3 %) пациентов 2 группы и у 12 (31,6%) больных 3 группы.
Полученные в процессе исследования данные обрабатывались на ЭВМ типа IBM-PC c помощью программы STATISTICA for Windows (версия 7.0).
Результаты исследования и их обсуждение. Оценка клинических особенностей у больных ГБ выявила, что развитие у них ДЭ характеризовалось наличием сопутствующих кардиальных жалоб. Так, у четверти пациентов с ГБ и начальными проявлениями ДЭ встречался дискомфорт в прекардиальной области, связанный как правило с повышением АД. Это были болевые ощущения давящего характера в области верхушки сердца, не связанные с физической нагрузкой и длящиеся до 40-50 минут. Частота этого симптома значительно увеличивалась до 40% и 55% у больных с ДЭ 2 и 3 стадии, соответственно. Эпизоды сердцебиений без четкой связи с физической нагрузкой, в свою очередь, встречались у каждого третьего больного ГБ с начальной ДЭ, с максимальным преобладанием до 50,7 % в группе с ДЭ 2 стадии, что вероятно было связано со симпатикотонией. Одышка при физической нагрузке для пациентов 2 группы регистрировалась почти в 42 % случаев, тогда как в 1 группе она наблюдалась у 9% пациентов. У больных, перенесших ТИА или ОНМК, встречаемость указанной жалобы составила 60,5 %.
Одним из нерешенных вопросов клинического течения ГБ является определение момента присоединения ДЭ. В результате проведенного исследования было выявлено, что начальные проявления ДЭ возникали в первые 5 лет, ДЭ 2 стадии – 5–10 лет, ДЭ 3 стадии – более 10 лет течения ГБ.
При объективном обследовании больных ГБ с ДЭ обращало на себя внимание изменение основных параметров центральной гемодинамики в зависимости от выраженности нарушений церебрального кровотока. Так, увеличение стадии ДЭ у больных ГБ сопровождалось появлением наклонности к тахикардии у пациентов 2 и 3 групп, что свидетельствовало об усилении тонуса симпатической нервной системы.
При оценке показателей САД и ДАД у всех обследованных больных определялось его повышение, а колебания и средние величины были максимальными во 2 группе, где их перепады составили от 146/88 до 190/108 мм.рт.ст. Более низкие, по сравнению со 2 группой, средние показатели АД в 3 группе были связаны с наличием в анамнезе перенесенного ОНМК, следствием которого являлся эффект "обезглавленной" гипертензии. Показатели ПАД оказались более высокими у больных 2 и 3 групп, 70 мм.рт.ст. и 67 мм.рт.ст. соответственно.
Изучение показателей качества жизни у больных ГБ свидетельствовало о том, что у пациентов с 1 стадией ДЭ имели место незначительные различия с контролем. При этом, отмечалось снижение характеристик ролевого эмоционального и психологического функционирования. Сравнительная оценка характеристик качества жизни во 2 и 3 группах пациентов выявила их общее значимое снижение, по сравнению с 1 группой (p<0,05). Наибольшие различия были отмечены по шкалам ролевого, ролевого эмоционального и психологического функционирования, а так же шкалам боли, общего здоровья, жизнеспособности (p<0,01). Достоверные различия с 3 группой были зарегистрированы только для шкалы ролевого эмоционального функционирования (p<0,05).
При оценке психологического статуса у больных ГБ с ДЭ 1 стадии отмечалось достоверное, в сравнении с контролем, возрастание личностной и реактивной тревожности, общей тревоги, а так же проявления физической астении и пониженной активности (p<0,05). Для больных ГБ с ДЭ 2 стадии было характерно еще большее, в сравнении с 1 группой, возрастание личностной и реактивной тревожности, появление общей тревоги и депрессии, с ростом ее коэффициента (p<0,05). Кроме того, регистрировались проявления общей, физической и психической астении, со значимым понижением активности и мотивации (p<0,05). Сравнительная, со 2 группой, оценка пациентов с ДЭ 3 стадии выявила преобладание тревоги в последней, а так же прогрессирующие симптомы психической, физической и общей астении (p<0,05).
При анализе параметров СМАД во всех группах отмечалось повышение среднесуточных, дневных и ночных величин САД и ДАД (рис. 1).


Рис. 1. Показатели суточного мониторирования АД (мм.рт.ст.) у больных ГБ с ДЭ (M±m)
*различия с группой больных ГБ и ДЭ 1 стадии статистически достоверны (р<0,05)
** различия с группой больных ГБ и ДЭ 3 стадии статистически достоверны (р<0,05)
По данным рисунка 1, у больных ГБ с ДЭ 1 стадии, в сравнении с контролем, отмечалась тенденция к повышению показателей с достоверным возрастанием дневного и ночного САД (p<0,05) и ДАД (p<0,05), а так же суточного ДАД (p<0,05). У пациентов с ГБ и ДЭ 2 стадии, по сравнению с 1 группой, было выявлено достоверное повышение среднесуточного САД, до 162,4±12,5 мм.рт.ст., дневного САД до 172,5±2,7 мм рт.ст. (p<0,05), ночного САД до 162,3±2,3 мм рт.ст. (p<0,05). Кроме того, у больных ГБ с ДЭ 2 стадии выявлялись наиболее высокие цифры ПАД в дневное и ночное время – 76, 8 мм рт.ст. и 76,2 мм.рт.ст. соответственно. У больных 3 группы средние цифры суточного АД были сопоставимы с показателями во 2 группе, с преобладанием дневного и ночного ДАД более 100 мм.рт.ст. (p<0,05).
Особое значение при проведении СМАД придавалось оценке вариабельности АД (рис. 2).


Рис. 2. Показатели вариабельности АД (мм.рт.ст.) у больных ГБ с ДЭ (M±m)
*различия с группой больных ГБ и ДЭ 1 стадии статистически достоверны (р<0,05)
** различия с группой больных ГБ и ДЭ 3 стадии статистически достоверны (р<0,05)
Как следует из данных, представленных на рисунке 2, у пациентов с 1 стадией ДЭ отмечалось повышение вариабельности АД, имеющее достоверные различия с контролем только для дневного и ночного ДАД. Важным, с прогностической точки зрения, во 2 группе явился факт наличия высоких величин вариабельности АД, которые значительно превышали аналогичные показатели в 1 и 3 группах. Так, вариабельность дневного САД во 2 группе составляла 17,4±2,3 мм рт.ст., а в 1 и 3 группах 15,3 и 14,7 мм рт.ст. соответственно, а ДАД 14,1±2,3 мм против 10,5 мм рт.ст. в 3 группе. Аналогичное преобладание отмечалось и для ночных характеристик. Самые высокие показатели вариабельности АД у пациентов с ДЭ 2 стадии свидетельствовали о существовании независимого дополнительного фактора риска в поражении микроциркуляторного русла головного мозга, связанного с нестабильностью гемодинамики и выраженной неустойчивостью сосудистого тонуса в церебральных артериях. У пациентов 3 группы отмечалось значимое снижение величины вариабельности, по сравнению со 2 группой, как свидетельства формирования тенденции к стойкому повышению АД (p<0,05).
При исследовании СИ и ИВ были выявлены особенности в зависимости от стадии ДЭ (рис. 3).
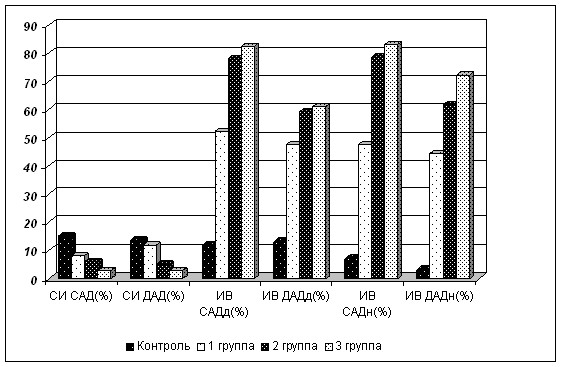

Рис. 3. Степень снижения ночного АД и показатели ИВ (%) у больных ГБ с ДЭ (M±m)
*различия с группой больных ГБ и ДЭ 1 стадии статистически достоверны (р<0,05)
** различия с группой больных ГБ и ДЭ 3 стадии статистически достоверны (р<0,05)
Как следует из рисунка 3, у всех пациентов с ГБ отмечалось выраженное снижение СИ и значительное увеличение ИВ. У пациентов с ДЭ 1 стадии выявлялось двухкратное уменьшение СИ САД и снижение СИ ДАД (p<0,05). Так же у них регистрировалось преобладание ИВ САД над ДАД (52 % и 47 %) соответственно, с достоверным возрастанием величины ИВ ДАД в ночные часы (p<0,05). При оценке СИ у больных 2 группы, по сравнению с контролем и 1 группой, было выявлено прогрессирующее снижение СИ САД, менее чем до 6 % и ДАД, до 5 %, что отражало преимущественное наличие суточного профиля АД типа nоn-dipper (p<0,05). Измерение нагрузки АД во 2 и 3 группах выявило высокие величины всех показателей, превышающие характерные для стабильной АГ – 50 %. Дополнительно в 3 группе отмечался высокий ИВ САД особенно в ночное время (более 80 %) и значимое увеличение ИВ ДАД в ночное время в сравнении со 2 группой, на фоне минимальных, не превышающих 3 % величин СИ, что отражало преобладание суточного профиля АД non-dipper.
С помощью УЗДГ у больных ГБ с ДЭ были выявлены изменения ЛСК в ПА и левой СМА (рис. 4).


Рис. 4. Показатели УЗДГ у больных ГБ в зависимости от стадии ДЭ (M±m)
*различия с группой больных ГБ и ДЭ 1 стадии
Как следует из данных рисунка 4, у больных ГБ с ДЭ 1 стадии выявлялось уменьшение ЛСК в ПА в среднем до 19,9 см/с. Подобная тенденция наблюдалась во 2 и 3 группах, составив 19,2 и 18,7 см/с соответственно, что косвенно свидетельствовало о нарушении венозного оттока.
Для ЛСК (S) в СМА было характерно прогрессивное снижение, в зависимости у выраженности ДЭ, составив 63,2 см/с в 1 группе, 59,3 см/с – во 2 группе и 52,4 см/с – в 3 группе, что в целом отражало снижение степени перфузии мозговой ткани. Также происходило снижение конечно-диастолической скорости кровотока в СМА (D). Так, в 1 группе этот показатель составил 40,2 см/с, тогда как во 2 и 3 группах – 28,0 см/с и 31,3 см/с соответственно. Указанный характер ее снижения, с наименьшими значениями у больных с ДЭ 2 стадии отражал наиболее выраженное повышение периферического сопротивления в сосудистом русле у пациентов этой группы.
Кроме изменений в ЛСК у больных ГБ с ДЭ при УЗДГ оценивались признаки вазоспазма, упруго-эластические свойства артерии (PI) и периферическое сопротивление (RI) (табл. 1).
Таблица 1
Показатели УЗДГ у больных ГБ в зависимости от стадии ДЭ (М±m)
| Показатели | Контроль (n=30) | 1 группа (n=45) | 2 группа (n=67) | 3 группа (n=38) |
| СМА/ПА | 1,98±0,12 | 2,62 ±0,11 | 3,50±0,09* ** | 2,43±0,10 |
| PI | 1,2±0,09 | 0,73±0,18 | 0,67±0,12 | 0,55±0,14 |
| RI | 0,54±0,02 | 0,52±0,09 | 0,37±0,11 | 0,40±0,10 |
* различия с группой контроля статистически достоверны (p<0,05)
** различия с группой больных с 1 стадией ДЭ статистически достоверны (p<0,05)
Как следует из данных, представленных в таблице 1, индекс соотношения СМА/ПА превышал контрольные показатели во всех группах, с максимальными значениями у пациентов с ДЭ 2 стадии, отражая склонность к вазоспазму у данной группы пациентов. Данный параметр во 2 группе составил 3,5, что свидетельствовало о второй степени вазоспастической реакции, тогда как в 1 и 3 группах – соотношение СМА/ПА было 2,6 и 2,4 соответственно, что характерно для первой степени вазоспазма. Некоторое снижение выраженности ангиоспазма у пациентов 3 группы, по сравнению со 2 группой, было связано с высокой встречаемостью стойких органических изменений сосудистой стенки и характеризовало уменьшение ее адаптивных возможностей после перенесенных ТИА и ОНМК.
При анализе количественных параметров кровотока, не зависящих от угла сканирования, а именно PI и RI, было выявлено снижение PI от 1 к 3 группе, составив 0,73; 0,67; 0,55 соответственно, что отражало прогрессирующее нарушение упруго-эластических свойств артерии по мере усугубления выраженности ДЭ у больных ГБ. RI также прогрессивно снижался, составив 0,52; 0,37 и 0,40 – в 1, 2 и 3 группах соответственно, что свидетельствовало о повышении периферического сопротивления церебральных артерий.
В целом, для больных ГБ с ДЭ было характерно снижение перфузии ткани мозга и упруго-эластических свойств артерий, максимально выраженное при ДЭ 3 стадии, нарастание сосудистого сопротивления и наклонности к вазоспазму, преобладающее у лиц с ДЭ 2 стадии. У лиц с ГБ и ДЭ 1 стадии вышеуказанные изменения регистрировались в начальных своих проявлениях.
Влияние терапии лизиноприлом и винпоцетином на течение ГБ с
ДЭ 2 стадии
При оценке кардиальных жалоб на фоне проводимой терапии через 3 и 12 месяцев у всех больных ГБ с ДЭ 2 стадии встречаемость дискомфорта в прекардиальной области, эпизодов сердцебиений и одышки достоверно снижалась. При этом, значимых различий у больных I подгруппы, принимавших лизиноприл и пациентов II подгруппы, получавших комбинированную терапию лизиноприлом и винпоцетином выявлено не было. Необходимо подчеркнуть, что дополнение комплекса терапии вазоактивным препаратом винпоцетином не сопровождалось возрастанием частоты кардиальных жалоб у пациентов ГБ, что свидетельствовало о безопасности данного вида лечения.
Проявления цефалгического синдрома достоверно снижались на фоне проводимой терапии через 3 месяца в обеих подгруппах, что в целом было связано с общей нормализацией АД. При этом, только в опытной подгруппе регистрировались значимые различия после проведенного лечения через 12 месяцев в виде уменьшения его частоты до 10,4 %, тогда как в подгруппе сравнения она составила почти 18 %. В отношении астено-вегетативного синдрома отмечалась аналогичная динамика достоверного снижения его встречаемости на фоне проводимой терапии в обеих подгруппах, что однако носило более выраженный характер в опытной подгруппе, где снижение происходило более чем в 3 раза, тогда как в подгруппе сравнения только в полтора раза. Наиболее показательной явилась динамика когнитивных нарушений на фоне проводимого лечения, которая характеризовалась только тенденцией к снижению их частоты в I подгруппе, при отсутствии однако достоверных различий. Тогда как во II подгруппе отмечалось не только значимое снижение указанных проявлений на фоне терапии, но и достоверно меньшая встречаемость по сравнению с подгруппой сравнения через 12 месяцев (р<0,05). При этом, частота когнитивных нарушений уменьшилась более чем в 2 раза, что свидетельствовало о выраженном влиянии винпоцетина на данные клинические характеристики заболевания. Вестибуло-мозжечковые расстройства имели достоверную динамику снижения, более чем в 2 раза, только в опытной подгруппе как через 3 месяца, так и через 12 месяцев лечения, что так же подтверждало этот клинический аспект терапевтического действия винпоцетина.
При оценке показателей АД у всех обследованных пациентов определялось его достоверное снижение вследствие назначенной терапии через 3 месяца. При этом средние показатели САД и ПАД имели достоверные различия на фоне комбинированного лечения. Так, разница в исходной до лечения и в конечной контрольной точке значений САД превышала 50 мм рт.ст., тогда как в подгруппе сравнения она составила только 32 мм рт.ст. Полученные данные свидетельствовали о потенцировании винпоцетином гипотензивного эффекта лизиноприла. При этом, в опытной подгруппе не было зарегистрировано ни одного случая выраженной тахикардии и резких падений АД, что свидетельствовало о достаточной безопасности используемой комбинации. Достоверное снижение показателей ПАД, так же более выраженное во II подгруппе, отражало снижение риска развития цереброваскулярных осложнений у данной категории пациентов. Через 12 месяцев наблюдения позитивный эффект гемодинамических сдвигов сохранялся только у лиц опытной подгруппы.
Динамика параметров качества жизни на фоне проводимой терапии свидетельствовала о том, что у пациентов обеих подгрупп происходил достоверный прирост показателей по шкалам боли и общего восприятия здоровья. При этом, по остальным параметрам, достоверность различий была зафиксирована только во II подгруппе. Так, по всем базовым значениям опросника SF-36 был превышен 60-балльный порог, что свидетельствовало о достижении пациентами удовлетворительного качества жизни. Тогда как в I подгруппе показатели ролевого и психологического функционирования оставались ниже 50-балльного рубежа. Кроме этого, по показателям восприятия общего здоровья, жизнеспособности, ролевого эмоционального, социального и психологического функционирования были зарегистрированы значимые различия с пациентами подгруппы сравнения на фоне комплексной терапии в контрольной точке. При оценке параметров качества жизни через 12 месяцев только у больных опытной подгруппы наблюдалось сохранение позитивных сдвигов по основным шкалам, что свидетельствовало о стойком протективном эффекте комбинированной терапии лизиноприлом и винпоцетином.
У всех больных на фоне проводимой терапии отмечалась общая тенденция улучшения показателей психологического статуса. При этом, достоверные различия, по сравнению с исходным уровнем, в плане уменьшения реактивной тревожности, тревоги, депрессии, сниженной мотивации и психической астении были зарегистрированы только у пациентов опытной подгруппы (р<0,05). Кроме этого, при использовании комбинированного лечения отмечалось значимое уменьшение показателей, характеризующих личностную тревожность, уровень депрессии, пониженную активность, общую и физическую астению, по сравнению не только с исходным уровнем, но и с I подгруппой (р<0,05).
При анализе параметров СМАД в обеих подгруппах отмечалось достоверное понижение средних показателей ПАД днем и САД, как в дневные, так и в ночные часы через 3 месяца терапии.
Уменьшение САД в подгруппе сравнения происходило до показателей мягкой гипертензии 145,1±2,7 мм.рт.ст. днем и 140,3±2,3 мм.рт.ст. ночью, а в опытной – до высокого нормального давления 132,6±3,3 мм.рт.ст. и 131,5±2,5 мм.рт.ст., соответственно. Средние суточные показатели САД и ДАД, а так же дневные и ночные показатели ДАД имели значимые различия с исходными только на фоне комбинированной терапии, при наличии достоверных различий с опытной группой для колебаний дневного ДАД (p<0,05). Спустя 12 месяцев наблюдения только у пациентов II подгруппы сохранилось достоверное стойкое снижение среднесуточных, дневных показателей САД и ДАД. Аналогичные динамике САД и ДАД у больных ГБ с ДЭ 2 стадии, регистрировались изменения вариабельности АД
Динамика повышенной вариабельности САД и ДАД характеризовалась ее снижением в обеих исследуемых подгруппах, при наличии достоверных различий с исходными спустя 3 и 12 месяцев, только на фоне терапии, дополненной винпоцетином (p<0,05). При этом, дневная вариабельность САД достигала целевого, менее 15 мм.рт.ст., значения только у пациентов опытной подгруппы.
Не менее важными на фоне лечения пациентов исследуемых подгрупп были изменения степени снижения ночного АД и ИВ.
Изменения СИ на фоне проводимого лечения имели достоверные различия с исходными показателями в обеих подгруппах через 3 месяца (p<0,05). Несмотря на увеличение средних величин СИ САД до 8,9±1,7 % и СИ ДАД до 9,2±1,6 %, регистрируемого у пациентов I подгруппы, оно оценивалось, как недостаточное, что свидетельствовало о сохранении у них суточного профиля – nоn-dipper. Повышение исследуемых показателей до 12,6±1,4 % и 11,7±1,2 %, соответственно, у больных II группы отражало формирование у них нормального суточного профиля – dipper.
ИВ АД так же имел достоверную динамику уменьшения для дневных цифр ДАД и ночных показателей САД и ДАД в обеих группах через 3 месяца. При этом, у пациентов I подгруппы регистрировалось только незначимое уменьшение среднего дневного показателя ИВ САД – от 76,7 % до 47,3 %, и достоверное снижение ночных показателей ИВ САД и ДАД, что однако только незначительно было меньше целевого, менее 50 %, значения (p<0,05). В опытной подгруппе на фоне проводимого лечения, была отмечена достоверная разница для дневных и ночных показателей ИВ САД и ДАД, которые снижались до целевых, менее 50 % и даже меньших величин (p<0,05).
Через 12 месяцев лечения только у пациентов, получающих комбинированную терапию лизиноприлом и винпоцетином, отмечалось стойкое сохранение суточного профиля АД типа dipper, АД дневных и ночных показателей также сохранялся на достигнутом уровне менее 50 %.
При УЗДГ у всех больных выявлялась тенденция к увеличению ЛСК в ПА на фоне проводимой терапии, что, однако не носило достоверного характера.
При этом, отмечалось улучшение перфузии мозговой ткани, в виде повышения ЛСК (S) в СМА, составив 63,2 см/с в I подгруппе и 73,1 – во II, что имело достоверную разницу как с исходными значениями, так и с данными в подгруппе сравнения (p<0,05).
Отмечалось повышение конечно-диастолической скорости кровотока в СМА (D) и (V) в подгруппе сравнения до 34,7±1,3 см/с и 43,4±1,4 см/с, соответственно и в опытной подгруппе до 39,7±1,8 см/с и 47,2±1,2 см/с, соответственно, что имело значимые различия с исходным уровнем (p<0,05) и отражало понижение в них периферического сопротивления. При долгосрочной терапии только у больных опытной подгруппы сохранялась положительная динамика показателей мозговой перфузии.
При анализе динамики индекса соотношения СМА/ПА отмечалось его снижение в обеих подгруппах, причем во II подгруппе отмечалось наличие достоверной разницы не только с исходным до терапии уровнем, но и в сравнении с 1 подгруппой (p<0,05). При этом конечные цифры исследуемого показателя 2,03±0,07, свидетельствовали о регрессии второй степени вазоспастической реакции у больных опытной подгруппы до первой, что в целом характеризовало восстановление адаптивных возможностей стенки этого сосуда.
При анализе количественных параметров кровотока PI и RI в опытной подгруппе, было выявлено, что на фоне проводимого лечения происходило их повышение, с наличием значимых различий, как с исходными показателями, так и с показателями в подгруппе сравнения (p<0,05). Присутствие указанной динамики спустя 3 и 12 месяцев наблюдения в целом отражало восстановление упруго-эластических свойств артерии и снижение периферического сопротивления в церебральных артериях (Таб. 2).
При клиническом наблюдении в течение 12 месяцев за пациентами с ГБ и ДЭ 2 стадии, которым проводилась комбинированная долгосрочная терапия лизиноприлом и винпоцетином, не было зарегистрировано случаев экстренной госпитализации по поводу дестабилизации АД и прогрессирования ДЭ. Тогда как среди лиц, получавших монотерапию лизиноприлом, в 27 % случаев потребовалась госпитализация в связи с гипертоническим кризом и у 38 % больных возникла необходимость добавления к лечению гипотензивных препаратов других групп, в связи со стойким повышением АД. При комбинированной терапии не было зарегистрировано побочных эффектов лизиноприла и винпоцетина и не потребовалось замены или отмены препаратов.
Таблица 2
Показатели УЗДГ у больных ГБ с ДЭ 2 стадии в зависимости от вида
проводимой терапии (M±m)
| Показатели | I подгруппа | II подгруппа | ||||
| до лечения | после лечения (3 мес.) | после лечения (12 мес.) | до лечения | после лечения (3 мес.) | после лечения (12 мес.) | |
| PI | 0,71± 0,10 | 0,79± 0,12 | 0,76± 0,12 | 0,63± 0,11 | 0,94± 0,10* | 0,98 ±0,10* ** |
| RI | 0,38± 0,10 | 0,47± 0,07 | 0,44± 0,07 | 0,36± 0,11 | 0,51± 0,08* | 0,56 ±0,08* ** |
| СМА/ПА | 3,27± 0,12 | 2,73 ±0,09 | 2,89 ± 0,09 | 3,73± 0,07 | 2,03± 0,07* | 2,00± 0,07* ** |
* различия с группой больных до лечения статистически достоверны (p<0,05)
** различия с I группой больных после лечения статистически достоверны (p<0,05)
Таким образом, результаты работы подтверждали наличие причинно-следственных связей между сердечно-сосудистым континуумом и состоянием церебрального кровотока. Полученные данные позволили объективизировать влияние ДЭ на течение ГБ. При этом, формирование 2 стадии ДЭ оказывало наиболее выраженное влияние на состояние центральной гемодинамики в отношении ее частой дестабилизации и прогрессирования ремоделирования сердечно-сосудистой системы. Тем самым, выявленные кардиологические клинико-инструментальные особенности, характерные для ДЭ 2 стадии, явились предикторами утяжеления течения и неблагоприятного прогноза ГБ. Применение комбинированной долгосрочной терапии лизиноприлом и винпоцетином оказывало потенцирующее действие в отношении улучшения клинического течения как самой ГБ, так и ДЭ. При этом у лизиноприла не наблюдалось отрицательного влияния на состояние перфузии головного мозга, а у винпоцетина не регистрировалось негативного воздействия на функции миокарда.
Выводы
1. У пациентов с гипертонической болезнью при развитии дисциркуляторной энцефалопатии 2 стадии, по сравнению с больными дисциркуляторной энцефалопатией 1 стадии, особенностями кардиологических проявлений явились значимо большая частота и выраженность тахикардии, одышки при физической нагрузке, высокого пульсового артериального давления.
2. При развитии дисциркуляторной энцефалопатии 2 стадии у больных гипертонической болезнью выявлялось снижение показателей общего здоровья, жизнеспособности, ролевого эмоционального и психологического функционирования с возрастанием личностной и реактивной тревожности, проявлений общей тревоги, физической и психической астении, депрессии, со значимым понижением активности и мотивации.
3. Формирование 2 стадии дисциркуляторной энцефалопатии у больных гипертонической болезнью было связано с выраженным повышением дневного и ночного пульсового артериального давления, дневной вариабельности артериального давления, показателей среднесуточного, среднедневного и средненочного систолического артериального давления, превышением более 70 % в сутки общей нагрузки давлением, преобладанием суточного профиля давления – Non-dippers, по результатам суточного мониторирования артериального давления.
4. Развитие дисциркуляторной энцефалопатии 2 стадии у больных гипертонической болезнью проявлялось снижением линейной скорости кровотока, повышением периферического сопротивления и наклонностью к вазоспазму в левой средне-мозговой артерии.
5. Терапия гипертонической болезни у пациентов с проявлениями дисциркуляторной энцефалопатии 2 стадии, включающая лизиноприл и винпоцетин в течение 12 месяцев, способствовала уменьшению пульсового артериального давления, головных болей, астено-невротических и вестибуло-мозжечковых нарушений, нормализации некоторых показателей качества жизни, снижению среднесуточного, среднедневного, средненочного показателей артериального давления, повышенной вариабельности артериального давления, индекса времени на 40%, частоты суточного профиля Non-dippers на 30 %, улучшению мозгового кровотока за счет повышения линейной скорости кровотока, нормализации периферического сопротивления.
Практические рекомендации
1. У больных гипертонической болезнью ранними диагностическими критериями дисциркуляторной энцефалопатии 2 стадии являются снижение показателей качества жизни, жизнеспособности, ролевого эмоционального и психологического функционирования с возрастанием личностной и реактивной тревожности, проявлений общей тревоги, физической и психической астении, депрессии, с понижением активности.
2. У больных гипертонической болезнью прогрессирование дисциркуляторной энцефалопатии до 2 стадии может быть диагностировано на основании появления склонности к тахикардии, одышки при физической нагрузке, высокого пульсового артериального давления, повышенной вариабельности артериального давления, суточного профиля Non-dippers, увеличения периферического сопротивления и наклонности к вазоспазму в левой средне-мозговой артерии.
3. Комплекс обследования больных гипертонической болезнью с анамнезом заболевания более 5 лет должен включать суточное мониторирование артериального давления и транскраниальную ультразвуковую допплерографию.
4. Показаниями для комбинированного долгосрочного использования ингибиторов АПФ группы лизиноприла и вазоактивных препаратов группы винпоцетина у больных гипертонической болезнью является наличие клинических и инструментальных признаков дисциркуляторной энцефалопатии 2 стадии.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО
ТЕМЕ ДИССЕРТАЦИИ:
1. Цурцумия Д.Б. Эффективность комбинированной терапии диротоном и кавинтоном у пациентов с артериальной гипертонией / Д.Б. Цурцумия // Актуальные вопросы внутренних болезней: Сборник научных трудов Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова – СПб., 2005. – С. 75–77.
2. Цурцумия Д.Б. Оценка комбинированной терапии кавинтоном и диротоном больных с артериальной гипертензией и вертебробазилярной недостаточностью / Д.Б. Цурцумия // Актуальные вопросы внутренних болезней: Сборник научных трудов Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова – СПб., 2006. – С. 40–42.
3. Цурцумия Д.Б. Особенности суточной динамики артериального давления у больных гипертонической болезнью в зависимости от степени дисциркуляторной энцефалопатии / Д.Б. Цурцумия, О.А. Мехтиева // Исследования по приоритетным направлениям в медицине и биологии: Материалы научно-практической конференции – СПб., 2009. – С. 256.
4. Цурцумия Д.Б. Особенности мозгового кровотока у больных гипертонической болезнью в зависимости от степени дисциркуляторной энцефалопатии / Д.Б. Цурцумия, О.А. Мехтиева // Актуальные вопросы внутренних болезней: Сборник научных трудов Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова – СПб., 2009. – С. 104–106.
5. Цурцумия Д.Б. Взаимосвязь показателей суточного профиля артериального давления и лабораторно-инструментальных показателей у больных стеатогепатитом / Д.Б. Цурцумия, Е.Е. Хилько, В.Н. Шестаков, В.Г. Радченко // “Реабилитация больных, перенесших кардиохирургические операции”. “Кедровские чтения”: Материалы научно-практической конференции – СПб., 2005. – С. 69-70.
6. Цурцумия Д.Б. Особенности течения гипертонической болезни в зависимости от стадии дисциркуляторной энцефалопатии и методы их коррекции / Д.Б. Цурцумия //Вестник Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова – СПб., 2009. – № 2. –С. 161–164.
7. Цурцумия Д.Б. Диагностика и лечение гипертонической болезни при развитии с дисциркуляторной энцефалопатии: усовершенствованная медицинская технология / Д.Б. Цурцумия., В.Г. Радченко. – СПб, 2010. – 22 с.
СПИСОК СОКРАЩЕНИЙ
АПФ –ангиотензинпревращающий фермент
ГБ – гипертоническая болезнь
ГЛЖ – гипертрофия левого желудочка
ДАД – диастолическое артериальное давление
ДЭ – дисциркуляторная энцефалопатия
ИВ – индекс времени
ИММЛЖ – индекс массы миокарда левого желудочка
ЛСК – линейная скорость кровотока
МЖП – межжелудочковая перегородка
ММЛЖ – масса миокарда левого желудочка
МОК – минутный объем кровотока
ОНМК – острое нарушение мозгового кровообращения
ОПС – общее периферическое сопротивление
ПА – позвоночная артерия
ПАД – пульсовое артериальное давление
СИ – суточный индекс
СМАД – суточное мониторирование артериального давления
СМА – средняя мозговая артерия
ТИА – транзиторная ишемическая атака
УЗДГ – ультразвуковая допплерография
УО – ударный объем
ЧСС – частота сердечных сокращений
ЭКГ - электрокардиография
Эхо-КГ – эхокардиография
PI – пульсационный индекс Гослинга
RI – индекс сопротивления Пурсело
ЛР № 020496
Подписано в печать 14.10.2010 г. Заказ № 2378
Формат бумаги 60 х 84/16. Тираж 100 экз. Усл.п.л. 1,0
Санкт-Петербургская государственная медицинская
академия им. И.И. Мечникова
195067 Санкт-Петербург, Пискаревский пр., 47
Типография ООО «ЛАДОГА» Санкт-Петербург,
Выборгская наб., д. 29

