Состояние фибринолитической активности крови и мочи у новорожденных и детей раннего возраста с врожденными пороками развития органов мочевой системы
На правах рукописи
Зенченко Олеся Алексеевна
СОСТОЯНИЕ ФИБРИНОЛИТИЧЕСКОЙ АКТИВНОСТИ КРОВИ И МОЧИ У НОВОРОЖДЕННЫХ И ДЕТЕЙ РАННЕГО ВОЗРАСТА С
ВРОЖДЕННЫМИ ПОРОКАМИ РАЗВИТИЯ ОРГАНОВ МОЧЕВОЙ СИСТЕМЫ
14.00.09 – педиатрия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт - Петербург
2009
Работа выполнена на кафедре педиатрии факультета повышения квалификации и первичной переподготовки специалистов ГОУ ВПО «Алтайский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель:
доктор медицинских наук профессор Суворова Александра Владимировна
Официальные оппоненты:
Доктор медицинских наук профессор Романюк Федор Петрович
Доктор медицинских наук профессор Пшеничная Ксения Ивановна
Ведущая организация:
ГОУ ВПО «Новосибирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Защита состоится “ ” ______________2009г. в ______часов на заседании диссертационного совета Д 208.089.05 при ГОУ ДПО «Санкт- Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию» (191015, г. Санкт-Петербург, ул. Кирочная, д. 41)
С диссертацией можно ознакомиться в фундаментальной библиотеке ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию» (191015, г. Санкт-Петербург, Заневский пр., д. 1/82)
Автореферат разослан “____”______________2009 г.
Ученый секретарь диссертационного совета
доктор медицинских наук профессор В.В. Кирьянова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Врожденные пороки развития органов мочевой системы занимают значительное место среди всех форм патологии органов мочевой системы у детей и характеризуются высокими темпами роста заболеваемости в последние годы (Вельтищев Ю.Е., Игнатова М.С., 1989, 2005; Акопян А.С., 1999; Баранов А.А., 2003; Маковецкая Г.А, 2008).
Морфофункциональное развитие почек к рождению ребенка еще не завершено, что и обуславливает высокую вероятность их поражения с повреждением почечной ткани (Игнатова М.С., 1989; Гельдт В.Г., 1996; Папаян А.В., 2002; Чугунова О.Л, 2001; Баум М., 2006).
У новорожденных и детей раннего возраста ранняя диагностика заболеваний почек затруднена в связи с отсутствием специфичной клинической симптоматики, и, нередко, латентным течением нефропатий, что способствует их прогрессированию (Игнатова М.С., 1989; Чугунова О.Л., 2006; Ярошевская О.И., 2006). Поздняя диагностика нефропатий у детей раннего возраста также обусловлена недостаточной информативностью традиционных методов обследования.
Именно в раннем детском возрасте закладываются предпосылки для развития патологии ОМС у детей старшего возраста, что требует длительной диспансеризации больных с проведением реабилитационных мероприятий.
Существенным фактором прогрессирования нефропатий являются повреждение и изменение тубулоинтерстициальной ткани почек (Коровина Н.А., 1991; Muller G.A., 2000; Becker G., 2000; Eddy A., 2005).
Согласно современным представлениям, в основе интерстициального фиброза лежит накопление в мезангии и интерстиции почечной ткани компонентов экстрацеллюлярного матрикса, ведущее к уменьшению массы функционирующей почечной ткани и к развитию хронической почечной недостаточности (Игнатова М.С., 1986; Картамышева Н.Н, 2005; Fine L., 1993; Becker G., 2000; Eddy A., 2000, 2005).
В развитии интерстициального фиброза важная роль принадлежит фибринолитической системе почек, участвующей в регуляции процессов накопления экстрацеллюлярного матрикса. Урокиназа, являющаяся активатором плазминогена, контролирует матриксную деградацию путем конверсии плазминогена в плазмин, осуществляя протеолиз матриксных белков. Недостаточная активность урокиназы может способствовать развитию фиброза почечной ткани (Щербак А.В., 2001; Brown N., 2002; Rerolle J., 2000; Zhang G.,2003; Yamaguchi I., 2007; Hildenbrand R., 2008).
Несомненно, адекватная оценка функционального состояния почек у детей раннего возраста с ВПР ОМС имеет важное прогностическое значение. Применение дифференцированных, патогенетически обоснованных методов определения активности и степени выраженности патологического процесса в почечной паренхиме на ранних стадиях развития поражения почек является актуальным и имеет решающее значение в осуществлении своевременных лечебных и реабилитационных мероприятий у новорожденных и детей раннего возраста с ВПР ОМС.
Цель исследования
Определить значение урокиназной активности мочи для ранней диагностики функциональных нарушений и тубулоинтерстициального повреждения почек у новорожденных и детей раннего возраста с врожденной патологией ОМС.
Задачи исследования
- Уточнить наиболее значимые пренатальные факторы риска развития врожденных пороков развития органов мочевой системы.
- Изучить состояние фибринолитической активности крови и урокиназной активности мочи у новорожденных и детей раннего возраста с врожденной патологией органов мочевой системы.
- Сопоставить изменения урокиназной активности мочи с показателями почечных функциональных проб и лабораторными критериями тубулоинтерстициального повреждения почек у новорожденных и детей раннего возраста.
- Определить диагностическую значимость исследования урокиназной активности мочи на разных стадиях развития нефропатий у детей с врожденными пороками развития органов мочевой системы и выявить критерии риска неблагоприятного исхода.
- Оценить возможности неинвазивных методов обследования для определения функционального состояния почек и характера патологических изменений в почечной ткани у новорожденных и детей раннего возраста с врожденными пороками развития органов мочевой системы, определить значение системной организации мочи для оценки состояния ткани почек и характера патологических изменений.
Научная новизна проведенного исследования
Впервые у новорожденных и детей раннего возраста с врожденной патологией ОМС в качестве раннего маркера поражения почек и оценки степени прогрессирования нефропатий изучено состояние урокиназной активности мочи.
Установлено, что снижение урокиназной активности мочи предшествует клиническим и другим лабораторным признакам поражения почек у новорожденных и детей раннего возраста.
Выявлено, что при различных видах врожденной патологии ОМС у детей снижение урокиназной активности мочи коррелирует со степенью активности патологического процесса в почках. Наиболее выраженные изменения отмечаются у детей с клиническими проявлениями вторичного воспалительного процесса и признаками нарушения функций почек, что указывает на возможность использования данного показателя в качестве критерия прогноза прогрессирования нефропатий.
Установлена диагностическая ценность УАМ при нарушениях функционального состояния почек и повреждениях тубулоинтерстициальной ткани у новорожденных и детей раннего возраста с ВПР ОМС.
У новорожденных и детей раннего возраста с ВПР ОМС для диагностики поражения почек внедрен неинвазивный метод исследования мочи (метод клиновидной дегидратации), приближающийся по диагностической ценности к морфологическому исследованию, позволяющий осуществлять мониторирование прогрессирования нефропатий.
Практическая значимость работы
Детям с ВПР ОМС, имеющих неблагоприятный акушерский анамнез, рекомендовано проводить углубленное клинико-лабораторное обследование анатомо-функционального состояния органов мочевой системы для своевременной коррекции выявленных нарушений.
Установлена низкая диагностическая информативность показателей общего анализа мочи у новорожденных с ВПР ОМС.
Обоснована необходимость комплексного обследования новорожденных и детей раннего возраста с поражением почек на фоне ВПР ОМС, включающего исследование функционального состояния почек, УАМ и фибринолитической активности крови.
На основании полученных результатов разработан комплекс методов ранней и дифференциальной диагностики поражений почек у детей с ВПР ОМС, позволяющий с высокой степенью информативности диагностировать патологический процесс в почках на доклинической стадии, контролировать его течение, в том числе, при проведении лечебных мероприятий, и определять прогноз заболевания.
Разработаны критерии прогнозирования течения врожденных нефро- и уропатий.
Выделены группы больных высокого риска по прогрессированию врожденных нефро- и уропатий, к которым относятся дети с неблагоприятным акушерским анамнезом, дети с ВПР ОМС, осложненными воспалительным процессом и микропротеинурией, больные с ВПР ОМС с признаками нарушения функций почек и со снижением урокиназной активности мочи.
Предложенный метод исследования УАМ может быть использован в работе специалистов, занимающихся вопросами диагностики и мониторинга в детской нефрологии.
Основные положения, выносимые на защиту
- Среди материнских факторов риска рождения детей с ВПР ОМС превалируют состояния, вызывающие гипоксию плода (ХФПН у 80,9% матерей); из экстрагенитальной патологии преобладают заболевания почек и мочевой системы – 32%.
- В структуре ВПР ОМС у обследованных нами новорожденных и детей раннего возраста преобладают обструктивные уропатии: гидронефроз (25,7%), уретерогидронефроз (20,9%), пузырно-мочеточниковый рефлюкс (13,3%), на фоне которых в 87% случаев протекает пиелонефрит.
- Наличие пиелонефрита и (или) стойкая протеинурия, в том числе, канальцевая усугубляют прогноз и способствуют прогрессированию нефропатий у детей с ВПР ОМС.
- Ключевая роль в патогенезе повреждения почек принадлежит канальцевым дисфункциям, что подтверждается у обследованных нами больных с помощью таких маркеров, как ферментурия и нарушение канальцевой реабсорбции фосфатов и микропротеина. Тубулоинтерстициальные повреждения ухудшают прогноз больных с ВПР ОМС.
- Так как у 55 % больных с ВПР ОМС не отмечалось патологических изменений в общем анализе мочи даже при наличии функциональных нарушений, высокую диагностическую информативность у новорожденных и детей раннего возраста приобретают такие неинвазивные методы исследования, как УАМ, микропротеинурия и ферментурия, исследование мочи методом клиновидной дегидратации.
- Функциональные нарушения почек у детей с ВПР ОМС по мере их развития имеют определенную последовательность:
— снижение урокиназной активности мочи;
— формирование тубулярных дисфункций;
— нарушение гломерулярных функций почек с исходом в ПН.
Личный вклад автора
Автором лично выполнен анализ медицинской документации, исследование УАМ, осмотр и динамическое наблюдение больных. Организовано проведение лабораторных и инструментальных исследований. Сформирована база данных, произведена их статистическая обработка и анализ полученных результатов исследования.
Внедрение результатов исследований в практику
В практику отделения патологии новорожденных, консультативно-диагностической поликлиники Алтайской краевой клинической детской больницы внедрен метод определения урокиназной активности мочи и исследования мочи методом клиновидной дегидратации. Получено удостоверение на рационализаторское предложение № 862 от 20 мая 2008 ГОУ ВПО «АГМУ».
Комплекс неинвазивных методов обследования используется в консультативно-диагностической поликлинике АККДБ при диспансерном наблюдении детей с ВПР ОМС.
Основные положения диссертации используются в учебном процессе на кафедре педиатрии ФПК и ППС АГМУ.
Апробация материалов диссертации
Основные положения работы доложены и обсуждены на ХI международной медико-экологической выставке «Человек. Экология. Здоровье», на тематической секции «Наука и практика в медицине» (Барнаул 2006); на итоговых научных конференциях АГМУ (Барнаул, 2007); городских научно-практических конференциях молодых ученых «Молодежь – Барнаулу» (Барна ул, 2005, 2006).
Публикации
По теме диссертации опубликовано 9 работ, в том числе 1 в журнале, рецензируемом ВАК.
Структура и объем диссертации
Диссертация изложена на 151 страницах машинописного текста, иллюстрирована 26 таблицами и 30 рисунками. Состоит из введения, обзора литературы, главы с описанием обследованных больных и методов исследования, изложением результатов собственных наблюдений и исследований, заключения, выводов, практических рекомендаций и списка литературы из 293 источников (165 отечественных и 128 зарубежных).
МАТЕРИАЛ И ОБЪЕКТ ИССЛЕДОВАНИЯ
Дети, включенные в исследование, родились в 2005–2008 г. в г. Барнауле и районах края, находились на стационарном лечении в отделении патологии новорожденных, в гастронефрологическом отделении, а также наблюдались в поликлинике Алтайской краевой клинической детской больницы. Исследование проведено нами у 105 детей с ВПР ОМС. Эти дети составили основную группу наблюдения.
Контрольную группу составили 20 практически здоровых доношенных новорожденных и детей раннего возраста.
Возраст обследуемых больных составил от 14 дней до 3 мес. Срок наблюдения до 18 мес.
Из 105 новорожденных с ВПР ОМС, находящихся под нашим наблюдением, гидронефроз установлен у 27 больных (25,7%), уретерогидронефроз — у 22 (20,9%), ПМР — у 14 (13,3%), пиелоэктазии — у 19 (18 %), удвоение ЧЛС и мочеточников — у 5 (4,8%), поликистоз почек — у 3 (2,8%), мультикистоз почки — у 6 (5,7%), подковообразная почка — у 6 (5,7%), агенезия почки — у 10 (9,5%), гипопластическая дисплазия почек — у 9 (8,6%), эктопическая почка — у 6 (5,7%), врожденный нефротический синдром — у 2 (1,9%).
Дизайн исследования
Для выполнения поставленных задач и с учетом цели исследования нами были выделены следующие группы больных:
- группы сравнения: дети с ВПР ОМС (группы 1–3, n=105)
- контрольная группа: дети без патологии ОМС (группа 4, n=20).
Для отбора детей в группы сравнения использовались следующие критерии:
1. Возраст детей от 14 дней до 3 месяцев.
2. Наличие ВПР ОМС, выявленного антенатально и в первые месяцы жизни.
Критерии исключения из основной группы и групп сравнения:
- дети с неполными данными обследования;
- дети с тяжелой сопутствующей патологией;
- глубоко недоношенные дети с низкой и экстремально низкой массой тела.
В зависимости от характера патологического процесса в почечной ткани и их функционального состояния (степени выраженности снижения урокиназной активности мочи и нарушения канальцевой реабсорбции фосфатов), пациенты основной группы были распределены на группы сравнения (табл. 1,2).
Таблица 1
Характеристика обследованных пациентов
| № | Группы обследованных | Количество |
| 1 | Группа больных с ВПР ОМС с сохраненной урокиназной активностью мочи и нормальными показателями реабсорбции. | 17 |
| 2 | Группа детей с ВПР ОМС со снижением урокиназной активности мочи и нормальными показателями реабсорбции. | 40 |
| 3 | Группа больных с ВПР ОМС со снижением урокиназной активности мочи и нарушением канальцевой реабсорбции. | 48 |
| 4 | Контрольная группа | 20 |
Таблица 2
Показатели УАМ и канальцевой реабсорбции фосфатов у обследованных больных в группах сравнения, (M±m)
| № | Группы обследованных | Кол-во больных | УАМ, % | Канальцевая реабсорбция,% |
| 1 | Группа больных с ВПР ОМС с сохраненной урокиназной активностью мочи и нормальными показателями реабсорбции. | 17 | 80,06±1,09*# | 96,7±0,7# |
| 2 | Группа детей с ВПР ОМС со снижением урокиназной активности мочи и нормальными показателями реабсорбции. | 40 | 66,09±1,49*^ | 95,5±0,45^ |
| 3 | Группа больных с ВПР ОМС со снижением урокиназной активности мочи и нарушением канальцевой реабсорбции. | 48 | 53,4±1,5#^ | 80,25±1,99#^ |
| 4 | Контрольная группа | 20 | 84,1±8,8 | 98,01±0,37 |
Примечание: подчеркнуты показатели, достоверно (р<0,001) отличающиеся от показателей контрольной группы. Отмечены достоверные межгрупповые различия: * 1-2 группы, # 1-3 группы, ^ 2-3 группы (р<0,001).
Нами был проведен анализ акушерско-гинекологического анамнеза матерей детей с ВПР ОМС, их экстрагенитальной патологии, а также осложнений течения беременности. Результаты проведенного анализа представлены на рис. 1.

Рис. 1. Частота встречаемости патологических проявлений течения беременности у матерей детей с ВПР ОМС
В результате проведенного анамнеза было выявлено, что отягощенный акушерско-гинекологический анамнез наблюдался у 87% матерей детей с ВПР ОМС. При формировании ВПР ОМС у детей наиболее значимыми явились такие пренатальные факторы риска как: наличие у матери заболеваний органов мочевой системы, инфекций мочевой системы, хронических специфических инфекций, ХФПН, угрозы прерывания беременности, ранних и поздних гестозов. Таким образом, в перинатальном периоде имело место сочетание нескольких повреждающих факторов, неблагоприятно влияющих на развитие плода и новорожденного, а наиболее значимым по частоте является гипоксия плода. Неблагоприятный акушерский анамнез матери является дополнительным фактором риска развития ВПР ОМС и прогрессирования нефропатий у детей. Данная категория детей нуждается в динамическом мониторинге лабораторных показателей, начиная с периода новорожденности.
Методы исследования
При обследовании всех детей нами применялись общепринятые клинико-лабораторные методы исследования, включающие сбор анамнеза, анализ медицинской документации, клинический осмотр и наблюдение.
1. Клинические и клинико-биохимические методы исследования
- клинический анализ крови с подсчетом количества эритроцитов, лейкоцитов, тромбоцитов и определением концентрации гемоглобина;
- общий анализ мочи; проба мочи по Нечипоренко;
- исследование биохимического состава мочи (кальций, фосфор, мочевина, креатинин, щелочная фосфатаза, микропротеин, глюкоза, мочевая кислота);
- биохимическое исследование крови (мочевина, креатинин, общий белок, белковые фракции, кальций, фосфор, щелочная фосфатаза, трансаминазы, калий, натрий);
- бактериологическое исследование мочи с определением наличия и степени бактериурии и вида возбудителя.
2. Инструментальные методы исследования
Все врожденные пороки развития органов мочевой системы были выявлены инструментальными методами исследования — при помощи ультразвукового исследования ОМС, экскреторной урографии и микционной цистоуретерографии.
3.Методы исследования почек и их функционального состояния
- Определение канальцевой реабсорбции фосфатов (Nordin B., Hodkinson A., 1967; Малкоч А.В., 2005; Форман Дж., 2006).
- Определение экскреции микропротеина (protein USP) при помощи сверхчувствительного теста определения белка в моче —Fluitest USP Biocon Diagnostic Vohl/Marienhagen, Germany
- Определение активности щелочной фосфатазы мочи.
- Определение уровня клубочковой фильтрации (по формуле Шварца)
4. Исследование урокиназной активности мочи проводилось с помощью хромогенного субстрата Хромотех-плазминоген фирмы «Технология-стандарт», адаптированного для исследования мочи.
5.Методы исследования системы гемостаза
- Определение плазминогена с применением хромогенного субстрата по А.М. Момоту и соавт. (1999).
- Определение XII а-зависимого фибринолиза (ХЗФ) по Г.Ф. Еремину, А.Г. Архипову (1979).
- Определение уровня Д-димера в крови методом латексной агглютигнации с помощью полуколичественного экспресс-теста фирмы Biomeriux; (порог чувствительности теста — 500 нг/мл).
6.Исследование мочи методом клиновидной дегидратации по методу В.Н. Шабалина, С.Н. Шатохиной (1995).
Для анализа полученных результатов исследования были использованы стандартные статистические функции Microsoft Excel 2000. При статистической обработке использовали параметрические и непараметрические критерии (ранговая корреляция по Spearman) по методическим рекомендациям С. Гланца (1999), В. И. Юнкерова, С. Г. Григорьева (2002) и Е. В. Сидоренко (2001).
Статистический анализ проводился при помощи пакета программ Statistica 5.0. Для каждого показателя в группах наблюдения вычисляли среднее арифметическое значение Х и среднюю ошибку средней величины m. Использовались методы непараметрической статистики - рассчитывалось угловое преобразование Фишера.
Также применялись методы доказательной медицины. Исследовались следующие показатели: чувствительность, специфичность, прогностическая ценность (Кельмансон И.А., 2004).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Всего было проведено комплексное обследование 105 детей с врожденными пороками развития органов мочевой системы (мальчиков — 64, девочек — 41).
Структура ВПР ОМС у обследованных больных была определена нами в соответствии с классификацией врожденных и наследственных нефро- и уропатий (Папаян А.В., 1997). Характер ВПР ОМС представлен в таблице 3.
Таблица 3
Характер врожденной патологии органов мочевой системы и реализованной патологии почек у обследованных больных
| Нозологические формы | 1 группа | 2 группа | 3 группа | Всего | ||||
| абс. | % | абс. | % | абс. | % | Абс. | % | |
| Гидронефроз (стеноз ЛМС) | 2 | 1,9 | 14 | 13,3 | 11 | 10,5 | 27 | 25,7 |
| Уретерогидронефроз | 4 | 3,8 | 18 | 17,1 | 22 | 20,9 | ||
| ПМР | 2 | 1,9 | 12 | 11,4 | 14 | 13,3 | ||
| Пиелоэктазии | 13 | 12,4 | 2 | 1,9 | 4 | 3,8 | 19 | 18,1 |
| Аномалии формы: — подковообразная почка | 5 | 4,8 | 1 | 0,9 | 6 | 5,7 | ||
| Аномалии положения: — эктопическая почка | 1 | 0,9 | 4 | 3,8 | 1 | 0,9 | 6 | 5,7 |
| Количественные аномалии: — гипоплазия почки — агенезия почки — удвоение почек | 2 | 1,9 | 5 7 2 | 4,8 6,6 1,9 | 4 3 1 | 3,8 2,8 0,9 | 9 10 5 | 8,6 9,5 4,8 |
| Кистозные дисплазии: — мультикистоз — поликистоз | 3 | 2,8 | 3 3 | 2,8 2,8 | 6 3 | 5,7 2,8 | ||
| Пиелонефрит | 2 | 1,9 | 11 | 10,4 | 28 | 26,6 | 41 | 39 |
| ХПН | 7 | 6,6 | 7 | 6,6 | ||||
Как видно из таблицы 3, среди врожденных пороков развития у обследованных нами больных преобладают обструктивные уропатии (гидронефроз, уретерогидронефроз, ПМР), которые составляют около 60% среди всех аномалий развития.
Клинико-лабораторная характеристика больных с ВПР ОМС
В клинико-лабораторном плане ВПР ОМС характеризовались: мочевым синдромом в виде лейкоцитурии – у 41 (39 % детей), протеинурии персистирующего характера — у 48 (45,7%), микрогематурии — у 10 (9,5%), бактериурии — у 29 (27,6%), кристаллурии — у 34 (32,4%).
Патологические изменения в анализах мочи у детей групп сравнения представлены в таблице 4.
Таблица 4
Патологические изменения в анализах мочи у детей с ВПР ОМС
и их частота в группах сравнения
| Характер мочевого синдрома | 1 группа (n = 17) | 2 группа (n =40) | 3 группа (n =48) | Всего | |
| Абс. | % | ||||
| Протеинурия (0,03 – 0,815 г/л) | - | 15 | 33 | 48 | 45,7 |
| Лейкоцитурия (10–сплошь в поле зрен.) | 2 | 11 | 28 | 41 | 39 |
| Эритроцитурия (3 – 20 в поле зрения) | — | 2 | 8 | 10 | 9,5 |
| Кристаллурия | 7 | 12 | 15 | 34 | 32,4 |
| Бактериурия | — | 10 | 19 | 29 | 27,6 |
Протеинурия персистирующего характера отмечена у 15 (37,5%) больных 2 группы, 33 (68,7%)-3 группы. Частота лейкоцитурии в группах сравнения составила 9(11,7%), 11(27,5%), 28(58,3%) соответственно (рис.2).
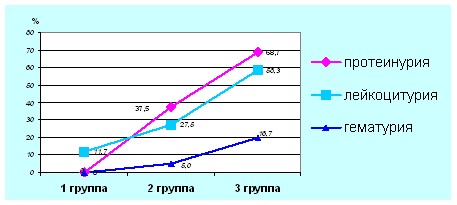
Рис. 2. Частота лейкоцитурии, протеинурии и гематурии у пациентов с ВПР ОМС
Характеристика функционального состояния почек у обследованных больных
- Оценка азотовыделительной функции почек
При анализе азотовыделительной функции почек у больных 1 и 2 групп не отмечено изменений по сравнению с нормой уровня креатинина, мочевины крови и СКФ тогда как у больных 3 группы отмечались признаки нарушения фильтрационной функции почек по показателю СКФ (табл. 5).
Таблица 5
Показатели мочевины, креатинина и СКФ
у обследованных больных, (M±m)
| Показатель | 1 группа | 2 группа | 3 группа | Контроль |
| Мочевина, ммоль/л | 2,49±0,26 | 2,84±0,23 | 4,78±0,47 | 2,37±0,2 |
| Креатинин, мкмоль/л | 0,027±0,003 | 0,025±0,02 | 0,047±0,004 | 0,017±0,002 |
| СКФ,мл/мин | 117,62±9,5 | 105,1±6,72 | 51,4±2,64 | 98,4±11,2 |
Характер канальцевых дисфункций у детей с ВПР ОМС
В связи с тем, что степень тубулоинтерстициальных изменений почек является фактором, способствующим прогрессированию нефропатий, а выраженные изменения тубулоинтерстициальной ткани приводят к нарушению почечных функций и, прежде всего, канальцевых функций, для выявления структурных и функциональных повреждений канальцев почек у больных с ВПР ОМС нами был определен уровень микропротеинурии, ферментурии и канальцевой реабсорбции фосфатов.
При исследовании ферментурии у больных с ВПР ОМС установлено повышение активности щелочной фосфатазы у больных 2 и 3 групп (6,38±0,23 и 7,24±0,26 Ukat/l соответственно, р<0,05), что может свидетельствовать о наличии структурных изменений канальцевого отдела нефрона у этих больных, и, в частности – повреждении проксимальных канальцев почек.
Исследование уровня микропротеинурии показало достоверное повышение экскреции микропротеина у больных 3 группы (207,82±15,5мг/л, р<0,001) и тенденцию к повышению экскреции микропротеина у больных 2 группы. Во 2 группе повышенная экскреция микропротеина (более 120 мг/л) определялась у 12 из 40 больных, а средний его уровень составил 215,51±18,5 мг/л. В 3 группе микропротеинурия более 120 мг/л выявлена у 44 из 48 больных, причем у 18 из 48 из них вдвое превышала верхнюю границу нормы и в среднем составила 311,01±15,9 мг/л, что указывает на дисфункцию проксимальных канальцев у этих больных
Наиболее высокий уровень низкомолекулярного белка выявлен у больных с ПН (362,3±40,2мг/л), что свидетельствует о выраженном нарушении у них реабсорбционной функции почек.
Изменения уровня микропротеинурии коррелируют с выраженностью лейкоцитурии и протеинурии у обследованных больных (r=0,42; 0,52 соответственно, р<0,05). А при отдельном рассмотрении показателей микропротеинурии у больных 3 группы, выявлена более выраженная микропротеинурия у больных в присутствии лейкоцитурии — 222,1±21,7 мг/л и у детей с ПН — 362,3±40,2 мг/л, что также подтверждает роль вторичного воспалительного процесса в процессах повреждения тубулоинтерстициальной ткани почек, приводящего к нарушению их функционального состояния.
Вместе с тем, следует отметить, что уровень низкомолекулярного белка у детей 3 группы без пиелонефрита составил 190,11±2,51 мг/л.
Выявленная достоверная корреляционная зависимость между уровнем микропротеинурии и показателями, характеризующими азотовыделительную функцию почек - СКФ (r = - 0,47, р<0,05), мочевиной и креатинином крови (r =0,49; 0,37, р<0,05 соответственно), а также наличие более выраженной микропротеинурии у больных с ПН свидетельствует о роли протеинурии, в том числе низкомолекулярной в процессах прогрессирования заболевания почек и отражает их функциональное состояние.
Анализ канальцевой реабсорбции фосфатов у пациентов с ВПР ОМС показал отсутствие изменений показателей канальцевой реабсорбции у больных 1 и 2 группы, которые оставались в пределах нормы и достоверно не отличались от показателей контрольной группы (табл.2).
У больных 3 группы отмечалось достоверное, статистически значимое, снижение уровня канальцевой реабсорбции фосфатов (80,25± 1,99%, р<0,001), которое было более выражено у больных с ПН (61,26± 6,8%).
Снижение канальцевой реабсорбции фосфатов у больных с ВПР ОМС ассоциируется с вторичным воспалительным процессом, что подтверждается наличием достоверной и значимой отрицательной корреляции между выраженностью лейкоцитурии и уровнем канальцевой реабсорбцией фосфатов (r = -0,56, р<0,05), а также более низкими показатели канальцевой реабсорбции у больных 3 группы в присутствии лейкоцитурии - 76,8 ± 2,9%.
Уровень канальцевой реабсорбции фосфатов коррелирует с величиной экскреции микропротеина (r = -0,43, р<0,05), характеризуя в общем наличие канальцевого повреждения почек и нарушение реабсорбционной способности канальцев.
Таким образом, у больных 2 и 3 группы с ВПР ОМС уже на ранних сроках заболевания выявлены маркеры тубулоинтерстициального поражения почек — наличие ферментурии и повышение экскреции микропротеина, а у больных 3 группы – более выраженные признаки канальцевого поражения почек, проявляющиеся функциональными нарушениями органа — нарушением канальцевой реабсорбции фосфатов и уровня СКФ.
Урокиназная активность мочи у детей с ВПР ОМС
Фибринолитической системе почек отводится важная роль в процессах регуляции клеточной пролиферации и накопления экстрацеллюлярного матрикса в интерстициальной ткани почек и прогрессировании нефропатий у больных с ВПР ОМС, в связи с чем нами была исследована урокиназная активность мочи с целью выявления признаков раннего поражения почек, нарушения их функционального состояния и для оценки прогноза заболевания.
Уровень УАМ у больных 1группы достоверно не отличался от показателей контрольной группы. При анализе УАМ у больных 2 и 3 группы отмечено достоверное снижение показателя по сравнению с контролем (табл. 6).
Таблица 6
Показатели урокиназной активности мочи и достоверность различий между группами больных с ВПР ОМС и детей контрольной группы
| Показатель | Группа 1 n=17 | Группа 2 n=40 | Группа 3 n=48 | Контр. группа 4 n=20 |
| Урокиназная активность мочи, (%) | 80,06±1,09*# | 66,09±1,5*^ | 53,4±1,5#^ | 84,1±8,8 |
Примечание: подчеркнуты показатели, достоверно (р<0,05) отличающиеся от показателей контрольной группы. Отмечены достоверные межгрупповые различия: * 1-2 группы, # 1-3 группы, ^ 2-3 группы (р<0,001).
Снижение УАМ ассоциировалось с наличием воспалительного процесса в почечной ткани, о чем свидетельствуют более низкие показатели УАМ у больных в присутствии лейкоцитурии и наличие отрицательной корреляционной связи между лейкоцитурией и УАМ (r = -0,40, р<0,05).
Нами установлено, что по мере развития тубулоинтерстициального повреждения уровень УАМ снижается, независимо от характера ВПР ОМС.
При проведении корреляционного анализа нами выявлена тесная взаимосвязь между УАМ и показателями, характеризующими тубулоинтерстициальное повреждение: с ферментурией (r = -0,30, р <0,05); с микропротеинурией (r = -0,54, p<0,05), канальцевой реабсорбцией фосфатов (r = 0,47, p<0,05), что указывает на вероятную роль УАМ в патогенезе ренальных заболеваний как регулятора процесса тубулоинтерстициальных изменений в почечной ткани.
Среди пациентов с резко сниженной УАМ, отмечены низкие показатели канальцевой реабсорбции фосфатов и СКФ (рис. 3). Коэффициент корреляции УАМ с этими показателями составил 0,47; 0,46, соответственно (p<0,05), что с достаточной достоверностью свидетельствует о существовании зависимости активности урокиназы мочи от степени функциональных нарушений почек и выраженности изменений почечной ткани с вовлечением в патологический процесс всех отделов нефрона.
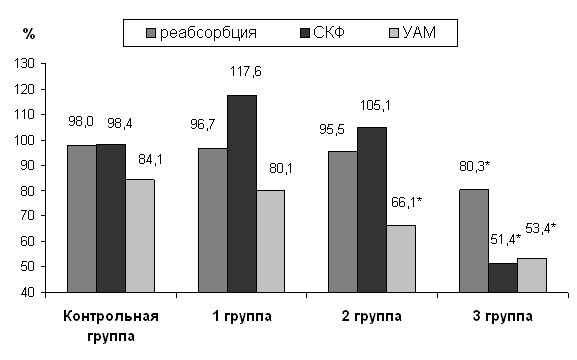
Рис. 3. Показатели канальцевой реабсорбции фосфатов, СКФ и урокиназной активности мочи у обследованных больных и детей контрольной группы.
Примечание: * отмечены показатели, достоверно (р<0,001) отличающиеся от показателей контрольной группы.
Можно сделать вывод, что нарушение синтеза урокиназы предшествует тубулоинтерстициальным изменениям и функциональным нарушениям почек, о чем свидетельствуют нормальные показатели реабсорбции и СКФ у больных 1 и 2 группы, что позволяет рассматривать снижение УАМ как предиктора поражения почек у детей с ВПР ОМС.
Установленные изменения УАМ являются свидетельством ранних клеточных изменений в почечной паренхиме, приводящих к нарушению эндогенной продукции проэнзима урокиназы у детей с ВПР ОМС и отражают степень выраженности структурно-функциональных изменений почек. Данная категория больных представляет группу высокого риска по развитию фиброза почечной ткани и требует тщательного наблюдения в динамике.
Чтобы уточнить точки приложения (функции почек), наиболее уязвимые для низкой активности урокиназы в моче, мы определили чувствительность, специфичность и прогностическую ценность снижения УАМ в развитии функциональных нарушений почек. Данные приведены в таблице 7.
Таблица 7
Показатели чувствительности, специфичности и прогностической ценности УАМ в группах сравнения у детей раннего возраста с ВПР ОМС
| Группы | Чувствительность, % | Специфичность, % | Прогностическая ценность, % |
| Нарушение СКФ | 86 | 66 | 69 |
| Канальцевая протеинурия | 80 | 80 | 80 |
| Нарушение реабсорбции | 93 | 80 | 93 |
В качестве негативного исхода была избрана стойко нарушенная функция почек.
Наибольшая чувствительность теста «урокиназная активность мочи» выявлена в отношении такой почечной функции, как канальцевая реабсорбция (93%); чувствительность теста в отношении клубочковой фильтрации также высока (86%). Тест более специфичен в отношении выявления канальцевых дисфункций; его прогностическая ценность в отношении нарушений реабсорбции также наиболее высока.
Таким образом, высокие показатели чувствительности, специфичности и прогностической ценности позволяют использовать показатель УАМ для диагностики поражения всех отделов нефрона и, особенно, канальцевого аппарата почек.
Состояние фибринолитической активности крови у детей с ВПР ОМС
При анализе фибринолитической активности крови у детей с ВПР ОМС нами были выявлены следующие нарушения: угнетение фибринолиза по тесту ХЗФ, снижение активности плазминогена по его концентрации в плазме крови (табл.8).
Таблица 8
Показатели фибринолиза крови у детей с ВПР ОМС в группах сравнения
| Показатели | Группа 1, n=17 | Группа 2, n=40 | Группа 3, n=48 | Контр. гр.,n=20 |
| ХЗФ, мин. | 12,13±1,5*# | 16,59±1,58*^ | 29,1±1,84#^ | 6,1± 0,2 |
| Плазминоген, % | 65,01±6,1*# | 50,3±6,2*^ | 28,5±3,4#^ | 79,5±4,5 |
| Д-димер | 0/17 | 0/40 | 2/48 | 0/20 |
Примечание: уровень Д-димера измерялся полуколичественно; в числителе – количество положительных тестов, в знаменателе – общее количество тестов. Подчеркнуты показатели, достоверно (р<0,001) отличающиеся от показателей контрольной группы. Отмечены достоверные межгрупповые различия: * 1-2 группы (р<0,05), # 1-3 группы, ^ 2-3 группы (р<0,001).
Было выявлено более выраженное угнетение фибринолитической активности крови по тесту ХЗФ у детей с нарушениями функций почек, то есть у детей 3 группы. Чем более выражено нарушение функций почек, тем более глубоким оказалось замедление фибринолиза. Об этом также свидетельствует более выраженное угнетение ХЗФ у детей с ПН (56,4±12,2 мин.).
Угнетение ХЗФ сочеталось со снижением активности плазминогена.
Нами было выявлено снижение активности плазминогена по уровню его концентрации в плазме крови, причем наиболее низкие показатели плазминогена отмечались у детей 3 группы, у которых были выявлены признаки нарушения функционального состояния почек и тубулоинтерстициального повреждения.
Наличие более низких показателей активности плазминогена у больных с ПН (21,6±2,4%, p<0,05), а также наличие корреляций с СКФ и креатинином (r = 0,54; r = -0,50, p<0,05) и корреляция с УАМ свидетельствуют об участии фибринолитической системы почек в регуляции фибринолитической системы крови у обследованных нами детей с ВПР ОМС.
Таким образом, при исследовании фибринолитической системы крови выявлено, что у больных с ВПР ОМС имеются признаки нарушения активности факторов фибринолитической системы.
Прежде всего, следует отметить снижение активности плазминогена и активности ХЗФ, что характеризуется депрессией фибринолиза. Тяжесть поражения почек коррелировала со степенью угнетения фибринолиза крови. Наиболее выраженное нарушение фибринолиза нами выявлено у больных с наличием признаков тубулоинтерстициального повреждения и ПН.
Результаты исследования мочи методом клиновидной дегидратации у детей с ВПР ОМС
Исследование мочи методом клиновидной дегидратации показало, что фации мочи пациентов 1 группы не имеют отклонений, либо имеют незначительные отличительные особенности от фаций мочи здоровых детей. Они характеризовались наличием единичных трещин в краевой зоне и отсутствием патологических структур.
Наиболее выраженные изменения структуропостроения мочи отмечались у больных 2 и 3 группы.
В фациях мочи этих больных отмечалось наличие трещин в краевой белковой зоне, а также наличие патологических структур типа «листа», «жгута», характеризующие наличие склеротических процессов почечной ткани, а наличие анизотропных трещин в центральной зоне свидетельствует о нарушении микроциркуляции в почечной ткани (Шатохина С.Н., Чугунова О.Л, 2002).
Более сложное структуропостроение мочи свидетельствует о более глубокой степени повреждения почечной ткани, это подтверждается в нашем исследовании наличием коррелятивных связей с показателями, характеризующими канальцевое повреждение почек: с микропротеинурией (r = 0,55, p<0,05) и канальцевой реабсорбции фосфатов (r = -0,51, p<0,05).
Выявленные патологические маркеры мочи характерны для морфофункциональных повреждений почек, что подтверждается согласно нашим исследованиям наличием коррелятивных связей с уровнем УАМ (r =-0,6, p<0,05), канальцевой реабсорбцией фосфатов (r = -0,51, p<0,05) и СКФ (r = -0,6, p<0,05).
ВЫВОДЫ
- Среди врожденных пороков развития органов мочевой системы у обследованных нами детей преобладают обструктивные уропатии. В формировании врожденных пороков развития органов мочевой системы имеют значение следующие неблагоприятные факторы антенатального периода: хронические заболевания почек, инфекции мочевой системы во время беременности, хронические специфические инфекции, анемия у матери во время беременности, а также осложнения течения беременности — ХФПН, угроза прерывания беременности, ранние и поздние гестозы, маловодие и многоводие.
- Установлена зависимость между показателями урокиназной активности мочи с показателями, характеризующими тубулоинтерстициальное повреждение почечной ткани (микропротеинурией, ферментурией) и показателями, характеризующими почечные функции (канальцевой реабсорбцией фосфатов и СКФ). Снижение фибринолитической активности крови и мочи прогрессирует параллельно появлению признаков тубулоинтерстициального повреждения и ухудшения почечных функций. Максимальная депрессия фибринолиза отмечается у детей с почечной недостаточностью.
- Наличие пиелонефрита и протеинурии, в том числе, канальцевой ухудшают прогноз течения врожденных уро- и нефропатий, что подтверждается наличием коррелятивных связей с показателями, характеризующими наличие тубулоинтерстициального повреждения почечной ткани и функциональные нарушения почек.
- Выявление нарушений урокиназной активности мочи у детей с врожденными пороками развития органов мочевой системы позволяет диагностировать поражение почек на ранних стадиях развития нефропатий. Значительное снижение урокиназной активности мочи указывает на выраженность структурно-функциональных изменений почек.
- Такие неинвазивные методы обследования, как исследование мочи методом клиновидной дегидратации, определение активности урокиназы, щелочной фосфатазы и выраженности микропротеинурии у детей с врожденными пороками развития органов мочевой системы позволяют определять характер и степень выраженности патологического процесса в почечной ткани.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Выявление у новорожденных детей и детей раннего возраста врожденных пороков развития органов мочевой системы (ВПР ОМС) является показанием для проведения полного нефроурологического обследования, в том числе, для определения состояния канальцевого аппарата почек.
2. У больных с ВПР ОМС для выявления структурно-функциональных изменений почек целесообразно выполнение следующего комплекса лабораторных тестов: определение уровня микропротеинурии и ферментурии, уровня канальцевой реабсорбции фосфатов, УАМ, исследование мочи методом клиновидной дегидратации.
3. Установленное снижение УАМ может быть использовано в качестве дополнительного диагностического критерия формирования и прогрессирования врожденных нефропатий и предрасположенности к фиброгенезу.
4. Результаты исследования свидетельствуют о необходимости обязательного диспансерного наблюдения детей с ВПР ОМС с использованием, помимо общепринятых диагностических методов, исследование в динамике УАМ, являющейся наиболее чувствительным диагностическим тестом для определения функционального состояния почек и степени повреждения почечной паренхимы.
5. Выявление у больных детей с ВПР ОМС признаков тубулоинтерстициального повреждения почек (с резким снижением УАМ) позволяет рекомендовать проведение адекватной медикаментозной (ренопротективной) терапии и ранней хирургической коррекции врожденных уропатий с целью предупреждения прогрессирования или, по крайней мере, замедления развития ХПН.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Зенченко О. А. Структура патологии органов мочевой системы у новорожденных детей / О. А. Зенченко // Молодежь – Барнаулу: материалы науч.-практ. конф. – Барнаул, 2005. – С. 246-247.
- Зенченко О. А. Исследование фибринолитической активности мочи у новорожденных и детей раннего возраста с патологией органов мочевой системы / О. А. Зенченко // Молодежь – Барнаулу: материалы науч.-практ. конф. – Барнаул, 2006. – С. 233-234.
- Зенченко О. А. Новые диагностические и прогностические возможности исследования мочи у новорожденных и детей раннего возраста с врожденной патологией органов мочевой системы / О. А. Зенченко, А.В.Суворова, Т.Ю. Кубышкина, С.Н. Боронина // Материалы XII конгресса педиатров России «Актуальные проблемы педиатрии». – М., 2008. - С. 128.
- Зенченко О. А. Значение определения урокиназной активности мочи у новорожденных и детей раннего возраста с патологией органов мочевой системы. / О. А. Зенченко, А.В Суворова, И.С. Купряшина // Материалы XII конгресса педиатров России «Актуальные проблемы педиатрии». – М., 2008. – С. 129.
- Зенченко О. А. Диагностическая ценность определения урокиназной активности мочи у новорожденных и детей раннего возраста с врожденной патологией органов мочевой системы / О. А. Зенченко, А.В.Суворова // Материалы VI Российского конгресса по детской нефрологии. – М., 2007. – С. 58-59.
- Суворова А.В. Возможности лабораторной диагностики и мониторинга в неонатальной нефрологии / А.В.Суворова, О. А. Зенченко // Бюллетень сибирской медицины. — 2008. — Т.7, приложение 2. — С. 179–182.
- Зенченко О. А. Клинико-лабораторные параллели в оценке функций почек у новорожденных и детей раннего возраста с врожденной патологией органов мочевой системы / А.В.Суворова, О. А. Зенченко // Сборник трудов XVI Санкт-Петербургского нефрологического семинара. – СПб., 2008. – С. 54-56.
- Зенченко О.А. Состояние тубулярных функций почек и урокиназной активности мочи у детей раннего возраста с врожденными пороками развития органов мочевой системы / О. А. Зенченко, А.В.Суворова // Материалы Всероссийского конгресса нефрологов // Нефрология. — 2009. — Т.13, №3. — С. 101.
- Зенченко О.А.Состояние парциальных функций почек и урокиназной активности мочи у новорожденных и детей раннего возраста с врожденными пороками развития органов мочевой системы / О. А. Зенченко, А.В.Суворова // Бюллетень сибирской медицины. — 2009. — Т.8, №3. — С. 37–42.
СПИСОК СОКРАЩЕНИЙ
ВПР — врожденные пороки развития
ОМС — органы мочевой системы
ПН — почечная недостаточность
СКФ — скорость клубочковой фильтрации
УАМ — урокиназная активность мочи
ХЗФ — Хагеман - зависимый фибринолиз
ХПН — хроническая почечная недостаточность
ХФПН — хроническая фето-плацентарная недостаточность

