Молекулярно-генетические и метаболические нарушения при заболеваниях, ассоциированных с постменопаузой. стратегия и тактика лечения.
На правах рукописи
АБУСУЕВА
ЗУХРА АБУСУЕВНА
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ И МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ ПРИ ЗАБОЛЕВАНИЯХ, АССОЦИИРОВАННЫХ С ПОСТМЕНОПАУЗОЙ. СТРАТЕГИЯ И ТАКТИКА ЛЕЧЕНИЯ.
14.00.01 – акушерство и гинекология
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Москва – 2006
Работа выполнена на кафедре акушерства и гинекологии ГОУ ВПО «Российский государственный медицинский университет».
Научные консультанты:
доктор медицинских наук, профессор Стрижова Нина Владимировна академик РАМН, доктор медицинских наук, профессор Сухих Геннадий Тихонович.
Официальные оппоненты:
академик РАМН, доктор медицинских наук, профессор Савельева Галина Михайловна
доктор медицинских наук, профессор Подзолкова Наталья Михайловна
доктор медицинских наук, профессор Дурнев Андрей Дмитриевич
Ведущее учреждение: Московский государственный медико-стоматологический университет
Защита диссертации состоится « » 2006 года в часов на заседании диссертационного совета Д 208.048.01 при Московском областном научно-исследовательском институте акушерства и гинекологии (101000, Москва, ул.Покровка, д.22-а).
С диссертацией можно ознакомиться в библиотеке МОНИИАГ.
Автореферат разослан « » 2006 года.
Ученый секретарь диссертационного совета
доктор мед. наук, профессор Серова О.Ф.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
С переходом каждого поколения в более старшую возрастную группу происходит рост частоты различных заболеваний, патогенетически связанных со старением, что в определенной мере является вполне закономерным и нормальным явлением (Дильман В.М., 1987).
На сегодняшний день большинство женщин доживает до возраста, в котором наступает менопауза. В развитых странах доля женщин старше 50 лет за последние 100 лет увеличилась втрое. По данным ВОЗ, число женщин старше 45 лет к 2015 году составит 46%, а средняя продолжительность жизни 70 лет. Увеличение числа женщин в постменопаузе и большая продолжительность жизни подчеркивает важность создания условий для сохранения их здоровья и качества жизни (Сметник В.П., 2001).
В результате прекращения репродуктивной, а затем и менструальной функции, в условиях дефицита эстрогенов, влияющих на функционирование всех органов и систем, устанавливается совершенно иной гомеостаз. Организм женщины начинает существовать в иных условиях, в ином режиме и на эти изменения реакция женщины может быть различна. Некоторые женщины рассматривают менопаузу, как положительное и раскрепощающее явление, другие, наоборот, как отрицательное. До этого периода жизни женщина уже выполнила важную биологическую функцию – продолжение рода, но этот период нередко осложняется развитием климактерического синдрома (КС), резко меняя качество жизни. На фоне дефицита эстрогенов в перименопаузе развиваются вазомоторные, психоэмоциональные, обменные нарушения, остеопороз, заболевания сердечно-сосудистой системы (Балан В.Е., 1995; Беневоленская Л.И., 2003; Сметник В.П., 1995).
С развитием молекулярной биологии, изучения генетических факторов, участвующих в процессах старения, полученные знания позволили рассматривать старение как гетерогенный продукт генетических факторов, проявляющихся под влиянием различных причин окружающей среды, поведенческих, психосоциальных и экономических условий, многие из которых подвержены значительному влиянию как имеющихся, так и вновь появляющихся лечебных стратегий.
Здоровье женщины в период менопаузы и постменопаузы является предметом особого внимания. Медицинская наука и практика в области изучения патогенеза менопаузы развивается интенсивно, поскольку эта область знаний имеет огромную не только медицинскую, но и социальную значимость.
Помимо медицинской и социальной значимости проблема менопаузы несет и сугубо личностный характер, поскольку касается каждой женщины. Эта значимость проявляется особенно в последнее время, когда участие женщины в обществе становится все более активным.
Главной причиной заболеваний, ассоциированных с постменопаузой, считается дефицит эстрогенов, поэтому для лечения последствий выключения гормональной функции яичников логичным было использование заместительной гормональной терапии (ЗГТ). Несмотря на логичность ее использования, менопауза является единственным гормональнозависимым состоянием, при котором использование гормонов продолжает быть предметом острой дискуссии (Макацария А.Д. и соавт.,2006; Коллинз П., Наннет К., Паолетти Р., 2004; Daly и соавт., 1996).
Основой дискуссии является сложность соотнесения риска и пользы при выборе лечебных средств, метода терапии осложненного течения менопаузы.
Продолжающаяся дискуссия о пользе и риске ЗГТ объясняется также и тем, что менопауза является физиологическим, запрограммированным самой природой женщины, процессом старения и как следствие этого процесса, увеличение вероятности целого ряда патологических изменений в организме, которые могут быть реализованы, возникать и усугубляться, в том числе при использовании лекарственных средств.
Нарастающий дефицит эстрогенов является фактором стресса, поскольку организм, переходя на другой режим существования, в связи с гормональной перестройкой, не может сразу адаптироваться к меняющемуся гомеостазу. Возможность организма адаптироваться и противостоять развитию заболеваний, связанных с угасанием функции яичников, зависит от адаптационных возможностей организма и состояния гомеостатических систем.
Представляется, что продолжающаяся дискуссия по стратегическим вопросам лечения климактерических расстройств может быть объяснена еще не полными знаниями всех причин, которые вызывают эти расстройства. Приближение к выяснению причин развития климактерического синдрома может стать основой для выработки лечебной стратегии и составления оптимальных рекомендаций, основанных на принципах доказательной медицины, которые предполагают, что главной задачей любой программы диагностики, наблюдения и лечения, является улучшение прогноза, отсрочка инвалидизирующих осложнений и летального исхода.
Несмотря на интенсивное развитие науки, в исследовании проблемы постменопаузы, остается еще много нерешенных вопросов, которые касаются как патогенеза постменопаузальных расстройств, так и стратегии и тактики лечения. Все сказанное обусловило проведение исследования, цель которого заключалась в оптимизации стратегии и тактики лечения заболеваний, ассоциированных с постменопаузой, на основании изучения молекулярно-генетических и метаболических нарушений.
Для выполнения этой цели были поставлены следующие задачи:
- Оценить интерфероновый статус у женщин в постменопаузе, играющий контрольно-регуляторную роль в сохранении гомеостаза.
- Изучить интенсивность перекисного окисления липидов по его конечному продукту – малоновому диальдегиду (интегральному показателю состояния системы гомеостаза) в сопоставлении с возрастом и степенью тяжести климактерического синдрома.
- Оценить состояние системы гемостаза, метаболизма липидов и углеводного обмена в сопоставлении с возрастом и степенью тяжести климактерического синдрома.
- Определить частоту полиморфных генов ингибитора активатора плазминогена 1 типа и метилентетрагидрофолатредуктазы у женщин постменопаузального возраста с сердечно-сосудистыми заболеваниями.
- Определить частоту полиморфных генов COLIA1 и VDR у женщин с постменопаузальным остеопорозом.
- Изучить топографические особенности остеопороза в зависимости от возраста и длительности постменопаузы и влияние на минеральную плотность костной ткани фосамакса в сравнении с гормональной терапией.
- На основе результатов исследования определить стратегию и тактику лечения и профилактики постменопаузальных расстройств.
Научная новизна
Ряд положений диссертации являются принципиально новыми и представляют научный и практический интерес, как для гинекологов, так и для врачей различных специальностей (терапевтов, невропатологов, травматологов).
Впервые проведен комплекс обследования женщин в постменопаузе с климактерическим синдромом, включающий определение состояния контрольно-регулирующих систем организма – интерферонового статуса и перекисного окисления липидов, универсального маркера постоянства метаболического режима организма.
Изучено участие метаболических и молекулярно-генетических факторов в патогенезе заболеваний, ассоциированных с постменопаузой. Выявлены метаболические нарушения в системе гемостаза, липидном, углеводном обменах, степень которых зависит от степени тяжести климактерического синдрома и возраста пациентки.
Изучена частота клинически значимых аллелей генов COLIA1, VDR, PAI-1, МТГФР у женщин с сердечно-сосудистыми заболеваниями и постменопаузальным остеопорозом.
Выявлены топографические особенности постменопаузального остеопороза, в зависимости от возраста пациентки.
Показаны внутрисистемные и межсистемные связи метаболических нарушений у женщин в постменопаузе с климактерическим синдромом.
Практическая значимость работы
Анализ анкетирования женщин в пери- и постменопаузе показал недостаточную осведомленность женщин о возможности осложненного течения постменопаузального периода и необходимость активного выявления женщин с начальными признаками климактерического синдрома и заболеваниями, ассоциированными с постменопаузой.
По результатам анализа ряда клинических, биохимических и молекулярно-генетических параметров у женщин в пери- и постменопаузе разработан и предложен для внедрения в практику алгоритм обследования женщин в пери- и постменопаузальном периоде.
Проведенное исследование состояния гомеостатических систем организма - интерферонового статуса, перекисного окисления липидов, состояние системы гемостаза, липидного спектра и углеводного обмена, позволили говорить о системных и межсистемных нарушениях гомеостаза у женщин в пери- и постменопаузе с проявлениями климактерического синдрома и заболеваниями, ассоциированными с постменопаузой. Эти данные, а также исследование частоты, генетически обусловленных, заболеваний сердечно-сосудистой системы, тромбофилических состояний и остеопороза, послужили основой для предложенной стратегии и тактики профилактики и лечения климактерических расстройств, главной задачей которой является не только и не столько коррекция дефицита эстрогенов, сколько коррекция нарушений гомеостатических систем.
Положения, выносимые на защиту:
1.Женщины в постменопаузе составляют группу риска по развитию сердечно-сосудистых заболеваний, тромбофилических состояний, остеопороза и метаболического синдрома.
2. Причинами развития климактерических расстройств и заболеваний, ассоциированных с постменопаузой, наряду с дефицитом эстрогенов являются молекулярно-генетические факторы и метаболические нарушения, развивающиеся на фоне дисбаланса интерферонового статуса и усиления перекисного окисления липидов. Метаболические нарушения носят характер, как внутрисистемных, так и межсистемных нарушений.
3. Генетически обусловленное повышение активности ингибитора активатора плазминогена 1 типа (PAI-1) увеличивает риск развития метаболического синдрома и сердечно-сосудистых заболеваний женщин в постменопаузе.
4.Для достижения эффективности терапии климактерических расстройств и прогнозирования их развития, необходим интегральный подход к оценке состояния систем гомеостаза. Лечение постменопаузальных расстройств должно быть направлено не столько на коррекцию дефицита эстрогенов, сколько на поддержание адаптационных систем организма и коррекцию нарушений в системах гомеостаза.
Апробация материалов диссертации
Материалы диссертации доложены на 2-ом Российском конгрессе по остеопорозу (г.Ярославль, 30 сентября 2005 года), Международном конгрессе «Практическая гинекология: от новых возможностей к новым стратегиям» (Москва, 30 марта 2006 года), Первом Международном конгрессе по репродуктивной медицине (Москва, 11июня 2006 года).
Работа обсуждена на межклинической конференции кафедры акушерства и гинекологии лечебного факультета с курсом вечернего отделения ГОУ ВПО РГМУ.
Внедрение результатов исследования в практику здравоохранения
На основании результатов проведенных исследований даны рекомендации и внедрены в практическую работу клинических баз кафедры акушерства и гинекологии лечебного факультета с курсом вечернего отделения РГМУ – гинекологическое отделение и поликлиника 4 ГКБ (г.Москва), гинекологическое отделение 3-го родильного дома (г.Москва), гинекологическое отделение 55 ГКБ, филиал поликлиники Газпрома (г.Москва). Результаты работы внедрены в учебный процесс кафедры акушерства и гинекологии лечебного факультета ГОУ ВПО Российский Государственный медицинский университет. Основные рекомендации включены в семинары и лекции для аспирантов и ординаторов.
Структура и объем диссертации
Диссертация состоит из введения, обзора литературы, описания материала и методов исследования, четырех глав, посвященных анализу данных, полученных в ходе работы, обсуждения результатов исследования, выводов, практических рекомендаций, приложения и списка использованной литературы. Работа изложена на 276 машинописных страницах, содержит 35 таблиц и 13 рисунков. Библиография включает 565 литературных источников, в том числе 140 отечественных и 425 зарубежных авторов.
Содержание работы
Материалы и методы исследования
Проведено анкетирование 609 женщин постменопаузального возраста, находившихся в травматологическом, 19 терапевтическом и 6 хирургическом отделениях 4-й городской клинической больницы г.Москвы, а также в травматологическом отделении 64-й городской клинической больницы г.Москвы и поликлиники Газпрома. Анкетирование проведено по составленной нами анкете.
Из числа 609 анкетированных, в возрасте 48-70 лет и более было отобрано 289 женщин с симптомами климактерического синдрома, принявших участие в исследовании.
Методы исследования
Уровень липидов определялся в сыворотке крови натощак, после 14-ти часового голодания. Триглицериды, общий холестерин, ЛПВП определяли стандартными ферментными методами на аппаратах «Hitachi 917» и « Adiva 1650». ЛПВП определяли методом Бурштейна. Исследования проходили на базе клинико-диагностической лаборатории консультативно-диагностического центра № 1 г.Москвы.
Атерогенность липидного профиля определялась как абсолютными значениями концентрации отдельных липидов в крови, так и характером сочетаний состава липидов и липопротеинов конкретного человека – фенотипом дислипидемии.
Костный метаболизм оценивался по исследованию кальция сыворотки крови, ионизированного кальция, суточной экскреции кальция с мочой, щелочной фосфатазы.
Для выявления ожирения проводилось взвешивание на стандартных весах. Расчет ИМТ (индекс Кетле) определялся по формуле: ИМТ=масса тела (кг) / рост (м2).
Измерение ОТ и ОБ проводилось для выявления типа ожирения с последующим определением их соотношения. Абдоминальный тип ожирения – ОТ/ОБ<0,8.
Для изучения углеводного статуса определяли уровень глюкозы в капиллярной крови натощак после 12-ти часового голодания на аппарате Jonson &Jonson (в ммоль/л).
Уровень иммунореактивного инсулина определяли в сыворотке крови натощак после 12-ти часового голодания на автоматическом анализаторе «Len Tech» в биохимической лаборатории «НЦ АГиП РАМН». В клинических условиях для исследования инсулинорезистентности используется расчет индекса Caro, то есть отношение концентрации глюкозы в крови (в ммоль/л) к уровню иммунореактивного инсулина (в мкЕД/мл).
Для анализа степени тяжести КС использовался метод расчета менопаузального индекса, предложенный Купперманом и известный в нашей стране в модификации Е.В. Уваровой
Определение уровня гомоцистеина в плазме венозной крови было проведено с использованием наборов фирмы Abbot и поляризационного флуоресцентного иммуноанализатора IMxr фирмы BioRad Laboratories. Оценка состояния перекисного окисления липидов проводилась по методу Ishihara в модификации И.С. Гончарова и А.М. Латинова (1985). В качестве объекта исследования использовали кровь. Метод дает возможность судить об интенсивности перекисных процессов по концентрации в крови малонового диальдегида (МДА) – одного из конечных продуктов перекисного окисления липидов (ПОЛ).
Исследование ИФН-статуса включало количественное измерение следующих параметров:
- Количество циркулирующего в крови (сывороточного) ИФН;
- Уровень спонтанной продукции ИФН лейкоцитами;
- Уровень продукции лейкоцитами -ИФН при его индукции in vitro вирусом болезни Ньюкасла (конц. 100 ЦПД 50/0,1);
- Уровень продукции лейкоцитами -ИФН при его индукции in vitro стафилококковым энтеротоксином (СЭТ) 2,5 мкг/мл, фитогемаглютинином (ФГА) в дозе мкг/мл «Difco» США и КонА 2,5 мкг/мл.
С целью диагностики остеопороза проводили исследование минеральной плотности костной ткани (МПКТ) методом двухэнергетической рентгеновской абсорбции (ДРА) с помощью аппарата QDR-4500 A «Hologic». Исследования выполнены в отделении КТ и МРТ (ЦКБ УДП РФ).
Исследование генетического полиморфизма проводилось с использованием метода аллель - специфической полимеразной цепной реакции (ПЦР) с последующим гидролизом ампликонов соответствующей рестриктирующей эндонуклеазой (рестриктаза) в лаборатории клинической иммунологии ГУ НЦ АГиП РАМН.
Статистический анализ данных проводился с помощью программы для персонального компьютера, позволяющей проводить сравнение организованных пользователем групп данных с использованием статистических непараметрических критериев, не зависящих от характера распределения – точного метода Фишера и критерия «хи-квадрат», а также традиционно используемого в биомедицинских исследованиях t-критерия Стьюдента для нормально распределенных данных.
Результаты исследования и их обсуждение
Среди 609 женщин при анкетировании оказались курящими 30,03%, употребляли алкоголь 6,8% пациенток. Следует отметить, что 11,3% женщин злоупотребляли кофе – 4 и более чашек в день. Исследование наследственной семейной отягощенности выявило, что преобладали сердечно-сосудистые заболевания, тромбофилические и переломы. О наличии климактерического синдрома у матери сообщили 54% женщин.
Почти все женщины с КС отмечали наличие «приливов», нарушение сна, депрессивные состояния, боли в сердце, обильное потоотделение. Можно сказать, что все предъявленные жалобы отражали симптомокомплексы климактерического синдрома.
По степени тяжести климактерического синдрома в зависимости от ММИ пациентки распределялись, как указано на рисунке 1.
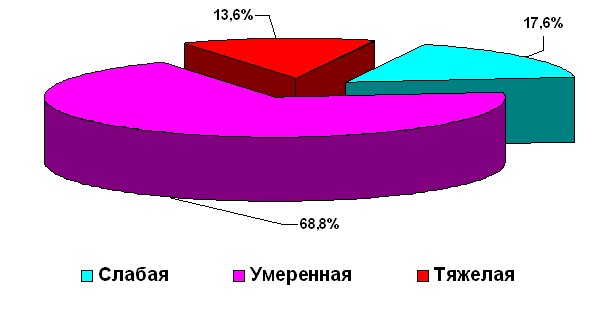
Рисунок 1. Частота КС по степеням тяжести.
Наибольшее число пациентов (68,8%) были с умеренной степенью тяжести климактерического синдрома и 13,6% - с тяжелой степенью КС. Наиболее частыми проявлениями климактерического синдрома были симптомы нейровегетативного и психоэмоционального симптомокомплексов.
Что касается частоты встречаемости симптомокомплексов, то с нейровегетативными расстройствами было 80,2% женщин и психо-эмоциональными – 48,1%.
Состояние контрольно-регуляторных систем у женщин с климактерическим синдромом.
Состояние системы интерферона. Учитывая, что в сохранении гомеостаза большая роль принадлежит контрольно - регулирующей роли системы интерферона (Ершов Ф.И., 1996; Сорокин А.И., Моисеева Н.В. и др., 1988) в своем исследовании мы сочли необходимым исследовать систему интерферона (ИФН), которая рассматривается как часть иммунной системы. Имеется много исследований, основанных на изучении возрастных изменений иммунной системы, при этом - лишь единичные исследования о связи изменений в иммунной системе с наступлением менопаузы (Крыжановская И.О., 2000).
Показатели интерферонового статуса мы исследовали у 76 женщин с проявлениями климактерического синдрома. Группу сравнения составили 20 женщин репродуктивного возраста.
Показатели интерферонового статуса представлены в следующей таблице 1.
Таблица 1
Показатели ИФН - статуса у женщин с климактерическим синдромом.
| Показатели МЕ/мл | Норма | Основная группа n=76 | Группа сравнения n=20 |
| Сывор. ИФН | <4 | 17,6±1,39*** | 4,3±0,23 |
| СПИЛ | <4 | 4 | 4 |
| - ИФН | 64-256 | 13,7±1,24*** | 85±3,9 |
| - ИФН | 16-64 | 10,6±2,4** | 26,7±4,6 |
Примечание: различие статистических значений по критерию tst с * - p<0,05; **-p<0,01; ***-p<0,001 между основной и контрольной группой.
Из представленных данных можно заключить, что у всех 76 женщин с КС (100%) имеются нарушения в ИФН статусе. Разница в показателях основной группы и группы сравнения статистически достоверна. Продукция -ИФН оказалась сниженной у 90,7% женщин и средние значения составили 13,7±1,24 МЕ/мл.
Значительно был повышен уровень сывороточного ИФН у 63 (82,9%) женщин. Обращает внимание значительное снижение продукции -ИФН – 10,6±2,4 против 26,7±4,6 МЕ/мл у женщин группы сравнения.
Их данных литературы (Ершов Ф.И., Жданов В.М., 1996) известно взаимодействие ФНО и ИФН-, являющихся факторами активации противоопухолевых и антимикробных механизмов, которые снижаются с возрастом. Кроме того, предполагается, что ИФН ответственен за зависящие от возраста и генотипа вариации активности ЕК и уровня Т-лимфоцитов, чувствительных к ЕК. Предполагается также, что ранним и независимым от вилочковой железы, следствием распознавания опухолевых клеток является синтез ИФН естественными киллерами, которые, в свою очередь, активизируют их способность лизировать опухолевые клетки. Из этого можно заключить, что выявленный нами сниженный уровень -интерферона является неблагополучным признаком и должен вызывать настороженность в плане развития возможных пролиферативных процессов, которые более часто развиваются у женщин пожилого возраста.
ИФН - статус значимо не отличался у женщин с климактерическим синдромом от ИФН - статуса у женщин без КС, что видно из таблицы 2.
Таблица 2
Показатели ИФН - статуса у женщин с климактерическим синдромом и без КС
| Показатели МЕ/мл | Женщины с КС n=76 | Женщины без КС n=20 |
| Сывороточный ИФН | 17,6±1,39 | 18,9±1,34 |
| СПИЛ | 4 | 4 |
| - ИФН | 13,7±1,24 | 12,9±1,19 |
| - ИФН | 10,6±2,4 | 11,3±2,1 |
Представленные в таблице данные позволяют заключить, что дисбаланс ИФН-статуса зависит не от наличия климактерического синдрома, а характерен для женщин постменопаузального возраста и является объективным доказательством сниженной сопротивляемости организма при его старении.
Интенсивность перекисного окисления липидов у женщин с КС. Важной проблемой является также изучение биохимических аспектов климактерического синдрома, отражающих состояние адаптационных возможностей организма, в частности, изучение перекисного окисления липидов (ПОЛ). У пожилых людей необходимость знания процессов ПОЛ объясняется снижением компенсаторных возможностей и анатомо-физиологическими особенностями старения организма, а также увеличением с возрастом соматических заболеваний, патогенез которых предусматривает нарушение липопероксидации свободных радикалов. Перекисное окисление липидов рассматривается как универсальный механизм повреждения биологических мембран при различных патологических состояниях.
В исследовании мы определяли интенсивность перекисного окисления липидов у 68 женщин с КС по его конечному продукту – малоновому диальдегиду (MДA). Группу сравнения составили 40 женщин в постменопаузе без проявлений климактерического синдрома и 20 здоровых женщин репродуктивного возраста. При определении MДA в этих группах мы получили данные, представленные в таблице 3.
Таблица 3
Интенсивность ПОЛ у женщин с климактерическим синдромом и без проявлений КС
| Показатель ПОЛ | Женщины в репродуктивном возрасте n=20 | Женщины без проявлений КС n=40 | Женщины с проявлениями КС n=68 | Р |
| МДА ммоль/л | 1,9±50,16 | 3,87±0,48 | 5,07±0,48 | 1-2** 1-3** 2-3** |
Примечание: различие статистических значений по критерию tst с * - p<0,05; **-p<0,01; ***-p<0,001.
Как видно из таблицы, интенсивность перекисного окисления липидов достоверно выше у женщин в постменопаузе и степень интенсивности ПОЛ повышается еще более с развитием КС. У женщин без проявления климактерического синдрома усиление ПОЛ менее выражено, но оно есть и объяснением этому является снижение физиологических и биохимических процессов, происходящих в стареющем организме в результате имеющихся соматических заболеваний. Присоединение же климактерического синдрома на таком фоне вызывает более выраженное усиление перекисного окисления липидов. Интенсивность перекисного окисления статистически достоверно (р<0,05) возрастала в зависимости от тяжести КС (таблица 4). Этот факт свидетельствует о напряжении регуляторных механизмов, срыве компенсаторных возможностей и определяет развитие многих заболеваний, возникающих у женщин пожилого возраста - сердечно-сосудистых, развитие метаболического синдрома и т.д.
Таблица 4
Показатели МДА в зависимости от степени тяжести климактерического синдрома.
| Показатель ПОЛ | Легкая степень КС n=28 | Средняя степень КС n=24 | Тяжелая степень КС n=12 | Р |
| МДА в плазме крови (ммоль/л) | 3,45±0,6 | 4,60±0,34 | 5,61±0,09 | 1-2*** 1-3*** 2-3 ** |
Примечание: различие статистических значений по критерию tst с *- p<0,05; **-p<0,01; ***-p<0,001.
Кроме того, мы проанализировали, с чем связано усиление перекисного окисления липидов индивидуально у 15-ти женщин. Это были пациентки, у которых КС сочетался с заболеваниями молочных желез (диффузная мастопатия), получавших заместительную гормональную терапию фемостоном 1/5 или клиогестом.
В этой группе, с КС в сочетании с диффузной мастопатией и высоким МДА, ультрасонографическое исследование проводилось через 6 месяцев с момента начала проведения ЗГТ. Положительная динамика в виде уменьшения диаметра протоков, уменьшения диаметра кист отмечалась у каждой пятой пациентки. Прогрессирование заболевания в виде дальнейшего расширения протоков и кистозных полостей определялось в 40% наблюдений. Через 12 месяцев лечения ЗГТ отрицательная динамика на рентгенограммах была установлена уже в 60% наблюдений. При анализе рентгенологической плотности молочных желез по Wolfe в 60% наблюдений установлено увеличение оптической плотности молочных желез за счет увеличения железистого и кистозного компонентов.
Эти данные позволяют полагать, что высокие концентрации МДА, у женщин с климактерическим синдромом в сочетании с диффузной мастопатией и исходно повышенной оптической плотностью молочных желез, являются основанием для включения этих пациентов в группу высокого онкологического риска по заболеванию молочных желез.
Состояние гомеостатических систем у женщин с климактерическим синдромом.
Состояние углеводного обмена.
При распределении женщин в зависимости от массы тела оказалось, что избыточную массу тела имели 52,7% из общего числа обследованных, у 13,2% из числа женщин с избыточной массой тела было ожирение III степени, у 35,8% - II- я степень ожирения, и у 50,9% - I -я степень ожирения.
Состояние иммунореактивного инсулина (ИРИ) и углеводного обмена исследовано у 168 женщин с климактерическим синдромом в зависимости от возраста и длительности постменопаузы (таблица 5).
I группу составили 59 женщин с длительностью постменопаузы 1-3 года в возрасте до 50 лет, вторую группу – 54 пациентки с длительностью постменопаузы 4-8 лет и в возрасте 51-60 лет, третья группа представлена 37 женщинами с длительностью постменопаузы 9-16 лет в возрасте 61-70 лет и IV группа – 18 женщин 71 года и старше в постменопаузе 17 и более лет.
Как видно из таблицы 15, имеет место повышение концентрации глюкозы, показателей ИРИ и снижение индекса Каро, которые коррелируют с возрастом и длительностью постменопаузы. Повышение этих показателей в совокупности с андроидным ожирением определяется как метаболический синдром. Эти изменения являются факторами риска развития сердечно-сосудистых заболеваний, увеличения частоты диабета II типа.
Таблица 5
Показатели ИРИ и углеводного обмена в зависимости от длительности постменопаузы
| Показатели | Группа сравнения n=20 | I группа n=59 | II группа n=54 | III группа n=37 | IV группа n=18 |
| Индекс Кетле кг/м2 | 26±0,21 | 27,56±0,19 | 29,49±0,14 | 30,36±0,12 | 35,41±0,23 |
| Р | 0-1**; 0-2***; 0-3***; 0-4***; 1-2***; 1-3**; 1-4*; 2-4***; 2-3***; 3-4 - | ||||
| Глюкоза ммоль/л | 3,90±0,10 | 4,27±0,07 | 4,57±0,1 | 4,76±0,2 | 5,68±0,18 |
| Р | 0-1***; 0-2**; 0-3**; 0-4***; 1-4**; 2-4- ; 3-4-; 1-2*; 1-3**; 2-3- | ||||
| ИРИ мкЕД/мл | 8,9±0,5 | 11,78±0,31 | 14,52±0,63 | 15,68±0,73 | 16,58±0,64 |
| Р | 0-1***; 0-2***; 0-3***; 0-4***; 1-4***; 2-4-; 1-2***; 1-3***; 2-3- | ||||
| Индекс Каро | 0,43±0,6 | 0,35±0,5 | 0,30±0,34 | 0,29±0,6 | 0,28±0,45 |
Примечание: *- различие статистических значений по критерию tst с p<0,05; **-p<0,01; ***-p<0,001; - p>0,05
Индекс Каро во всех группах ниже 0,33, что является критерием достоверности инсулинорезистентности.
Представлялось интересным проанализировать показатели ИРИ и углеводного обмена, в зависимости от тяжести климактерического синдрома Оказалось, при тяжелой степени климактерического синдрома выявлены самые низкие показатели индекса Каро (0,29±0,04), высокие показатели ИРИ (15,61±0,76) и глюкозы.
Липидный профиль у женщин с климактерическим синдромом
Рост сердечно-сосудистых заболеваний у женщин постменопаузального возраста часто связан с патологическими изменениями липидного гомеостаза.
Показатели липидного спектра у 168 женщин с климактерическим синдромом представлены в таблице 6.
Таблица 6
Показатели липидного спектра крови у женщин с КС в зависимости от возраста
| Показатели | I группа (до 50 лет) n=59 | II группа (51-60 лет) n=54 | III группа (61-70 лет) n=37 | IV группа (более 70 лет) n=18 |
| Холестерин общий ммоль/л | 4,1±0,24 | 5,9±0,11 | 5,8±0,23 | 6,51±1,9 |
| 1-2**; 1-4*; 2-4-; 3-4- | ||||
| ТГ ммоль/л | 0,81±0,02 | 1,86±0,14 | 2,1±0,03 | 2,6±0,08 |
| Р | 1-4***; 2-4**;3-4***;1-3***; 2-3-;1-2*** | |||
| ХС-ЛПВП ммоль/л | 1,1±0,03 | 1,1±0,04 | 0,75±0,01 | 0,78±0,2 |
| Р | 1-2-; 1-3-; 2-3*; 1-4- | |||
| ХС-ЛПНП ммоль/л | 4,1±0,15 | 4,4±0,16 | 5,2±0,18 | 5,4±0,16 |
| Р | 1-4***; 2-4**; 3-4-; 2-3**; 1-2- | |||
| КА | 3,72±0,12 | 4,0±0,18 | 6,5±0,43 | 6,75±0,31 |
| Р | 1-4***;2-4***;3-4-;1-3***;2-3***;1-2- | |||
Примечание: различие статистических значений по критерию tst с *- p<0,05; **-p<0,01; ***-p<0,001, - p>0,05
Анализ полученных данных показал, что у всех женщин, независимо от возраста, оказался повышенным общий холестерин. Наиболее высокие цифры были у женщин самого пожилого возраста (III и IV группы). Важный показатель - коэффициент атерогенности также наиболее высоким оказался у женщин двух старших по возрасту группах. Имеющееся снижение показателей липопротеидов высокой плотности свидетельствуют о риске развития атеросклероза.
Описанные сдвиги обмена липидов по степени выраженности возрастают не только с возрастом, но и с длительностью постменопаузы и степенью тяжести климактерического синдрома (таблица 7).
Таблица 7
Показатели липидного профиля сыворотки крови в зависимости от степени тяжести климактерического синдрома
| Показатели | Слабая n=83 | Умеренная n=64 | Тяжелая n=21 |
| Холестерин общий ммоль/л | 4,8±0,01 | 5,9±0,02 | 5,96±0,08 |
| Р | 1-2***; 1-3**; 2-3- | ||
| ТГ ммоль/л | 0,83±0,01 | 2,2±0,03 | 2,5±0,07 |
| Р | 1-2**; 1-3***; 2-3*** | ||
| ХС-ЛПВП ммоль/л | 1,2±0,03 | 0,9±0,01 | 0,8±0,03 |
| Р | 1-2**;1-3***; 2-3- | ||
| ХС-ЛПНП ммоль/л | 4,2±0,03 | 5,4±0,04 | 5,4±0,17 |
| Р | 1-2***;1-3***; 2-3- | ||
| КА | 3,5±0,21 | 6,14±0,41 | 6,75±0,45 |
| Р | 1-2***;1-3***; 2-3- | ||
Примечание: *- различие статистических значений по критерию tst с p<0,05; **-p<0,01; ***-p<0,001; - p>0,05
Из приведенных данных, можно проследить тенденцию к повышению уровня общего холестерина, липопротеидов низкой плотности, триглицеридов, снижению липопротеидов высокой плотности, что отразилось и на увеличении величины коэффициента атерогенности. Эти изменения оказались тем более выражены, чем тяжелее степень климактерических расстройств. Корреляцию наиболее выраженных изменений в липидном гомеостазе с тяжестью течения климактерического синдрома, можно объяснить нередким сочетанием КС с соматическими заболеваниями - сердечно-сосудистыми, метаболическим синдромом.
Состояние системы гемостаза и частота генетических нарушений у женщин постменопаузального возраста. Среди генетических причин снижения фибринолитической активности и повышенной наклонности к тромбообразованию является увеличение концентрации ингибитора активатора плазминогена 1 типа (РАI-1). Повышение уровня РАI-1 ассоциируется с высоким риском инфаркта миокарда, сахарного диабета I типа (Sneider, Sobel, 1990).
Процессы регуляции фибринолиза тесно связаны с концентрацией в крови гомоцистеина (Ambrosi P., Garson D., Riberi A. и др., 1998). Многочисленными исследованиями была показана связь гипергомоцистеинемии с прогрессирующими заболеваниями сердечно-сосудистой системы и высокой частотой тромбоэмболий (Макацария А.Д., Бицадзе В.О., 2003; Шевченко О.М., Олефриенко Г.А., 2002; Kuch B., Bobak M., 2002).
Одним из факторов, способствующих росту гомоцистеина в крови, являются генетические дефекты в метаболизме гомоцистеина. Наиболее частой генетической причиной умеренной гипергомоцистеинемии является мутация в гене фермента метилентерагидрофолатредуктазы (Макацария А.Д. и соавт., 2006; Rosen R., 1997.; Rosenblatt David S., 2001).
Исследование частоты полиморфизма генов ингибитора активатора плазминогена 1 типа (PAI-1) и метилентетрагидрофолатредуктазы (МТГФР) проведено у 116 женщин. Из них 32 страдали ишемической болезнью сердца, у 37 гипертоническая болезнь и 47 были с варикозной болезнью. Следует отметить, что 10 их этого числа (8,6%) перенесли инфаркт миокарда, у 8 венозный тромбоз в анамнезе (6,8%). Контрольную группу составили 56 условно здоровых женщин сопоставимых по возрасту, не страдавших ИБС, ГБ и варикозной болезнью.
Из приведенной таблицы 8 видно, что у женщин как с сердечно-сосудистыми заболеваниями, так и с варикозной болезнью, значительно чаще, чем в контрольной группе встречались генотипы, содержащие 4G аллель гена РАI-1 в гомозиготной или гетерозиготной форме. Так, у женщин с ИБС частота 4G аллеля составила 57,8%, у женщин с гипертонической болезнью - 63,5%, у женщин с варикозной болезнью – 59,6%.
Таблица 8
Частота полиморфизма генов РАI-1, МТГФР
у женщин с сердечно-сосудистыми заболеваниями.
| Генотип | Группы наблюдения | |||||||
| контрольная группа (n=56) | с ИБС (n=32) | с гипертонией (n=37) | c варикозной болезнью (n=47) | |||||
| абс. | % | абс | % | абс. | % | абс. | % | |
| полиморфизм РАI-1 | ||||||||
| 4G/4G | 11 | 19,6 | 6 | 25,5 | 12 | 32,4 | 12 | 25,5 |
| 4G/5G | 24 | 42,8 | 25 | 68,1** | 23 | 62,2 | 32 | 68,1* |
| 5G/5G | 21 | 37,5 | 1 | 6,4*** | 2* | 5,4*** | 3 | 6,4*** |
| Аллель | ||||||||
| 4G | 46 | 41 | 37 | 57,8* | 47 | 63,5** | 56 | 59,6* |
| 5G | 66 | 59 | 27 | 42,2* | 27 | 36,5** | 38 | 40,4* |
| С 677Т полиморфизм МТГФР | ||||||||
| СС | 41 | 73,2 | 13 | 40,6** | 14 | 37,8** | 16 | 34,0*** |
| СТ | 15 | 28,6 | 14 | 43,8 | 18 | 48,6* | 24 | 51,06* |
| ТТ | 0 | 0 | 5 | 15,6** | 5 | 13,5** | 7 | 15,04** |
| Аллель | ||||||||
| С | 97 | 86,6 | 40 | 62,5*** | 46 | 62,2*** | 56 | 59,6*** |
| Т | 15 | 13,4 | 24 | 37,5*** | 28 | 37,8*** | 38 | 40,04*** |
Примечание: *- различие статистических значений по критерию tst с p<0,05; **-p<0,01; ***-p<0,001 по сравнению с контрольной группой.
Статистически достоверны были различия и по частоте гомозиготного носительства аллеля Т гена метилентетрагидрофолатредуктазы; так в группе женщин с ИБС и варикозной болезнью – 15%, тогда как в группе контроля ни одной женщины. Частота Т-аллеля гена МТГФР в группе женщин с ИБС составила 37,5%, с гипертонической болезнью-37,8% и у женщин с варикозной болезнью- 40%.
Наши данные позволяют считать, что у женщин постменопаузального возраста имеет место выраженная связь риска развития сердечно-сосудистых заболеваний и варикозной болезни и повышением уровня ингибитора активатора плазминогена в крови, обусловленным присутствием в их генотипе 4G аллеля гена PAI-1 и T аллеля гена МТГФР.
Эпидемиологические исследования свидетельствуют о связи уровня РАI-1 плазмы крови с метаболическими нарушениями. Обнаружена ассоциация между метаболическим синдромом (синдром Х), который сопровождается инсулинорезистентностью, висцеральным ожирением, гипертензией, дислипидемией и повышенным уровнем РАI-1 (Макацария А.Д., Пшеничникова Е.Б. и др., 2006). Наши данные подтвердили это положение.
Таблица 9
Частота полиморфизма гена ингибитора активатора плазминогена 1 типа (РАI-1) у женщин с метаболическим синдромом (n=55)
| Показатели | Аллель | ||
| 4G/4G | 4G/5G | 5G/5G | |
| N=16 (29%) | N=27 (43,6%) | N=12 (21,8%) | |
| Индекс Кетле кг/м2 | 32,31±0,56 | 30,36±0,36 | 26,4±0,27 |
| P | 1-2*; 1-3***; 2-3*** | ||
| ИРИ мкЕд/мл | 15,61±0,63 | 10,78±0,36 | 8,9±0,01 |
| P | 1-2***; 1-3***; 2-3*** | ||
| ХС общий ммоль/л | 5,8±0,4 | 4,5±0,12 | 3,86±0,1 |
| P | 1-2***; 1-3***; 2-3** | ||
| ТГ ммоль/л | 2,43±0,07 | 3,81±0,02 | 0,86±0,18 |
| P | 1-2***; 1-3***; 2-3*** | ||
| ЛПВП ммоль/л | 0,6±0,12 | 0,9±0,04 | 0,9±0,03 |
| P | 1-2**; 1-3*; 2-3- | ||
| ЛПНП ммоль/л | 5,4±0,4 | 4,3±0,23 | 1,53±0,9 |
| P | 1-2*; 1-3***; 2-3*** | ||
Приложение: аллель: 4G – 59 – 53,6%
5G – 51 – 46,4%
Примечание: *- различие статистических значений по критерию tst с p<0,05; **-p<0,01; ***-p<0,001; - p>0,05
Исследование показало, что частота аллеля 4G гена РАI-1 у женщин с метаболическим синдромом была высокой и составила 53,6%. При этом 29% женщин были гомозиготными носителями аллели 4G.
У женщин-носительниц аллеля 4G гена PAI-1 достоверно отличались показатели углеводного и липидного обменов от женщин, не имеющих эту полиморфную аллель. Особенно выраженные нарушения показателей липидного спектра крови, индекса Кетле, ИРИ отмечалось у женщин-носительниц 4G аллеля в гомозиготной форме.
Показатели гомоцистеина исследованы у 52-х женщин в постменопаузе и у 15-ти здоровых женщин репродуктивного возраста (таблица 10).
Таблица 10
Уровень гомоцистеина в зависимости от возраста
| Показатель | Возраст | ||||
| Группа сравнения (n=15) | 45-52 г. (n=15) | 53-57 лет (n=14) | 58-62 г. (n=8) | 63 и более (n=15) | |
| Гомоцистеин мкмоль/л | 7,5±0,3 | 7,61±0,5 | 8,01±0,47 | 8,94±0,91 | 9,93±0,24* |
Примечание: различие статистических значений по критерию tst с *- p<0,05; **-p<0,01; ***-p<0,001.
Показатели гомоцистеина в нашем исследовании оказались выше у женщин в постменопаузе и увеличение общего гомоцистеина повышалось с возрастом.
По поводу нормативных значений гомоцистеина, циркулирующего в крови, в различных публикациях указываются различные его уровни со значительным разбросом. Данные В.С. Ефимова (1999), А.З. Кашежевой и соавт. (2003), Sarah M.D. (2002) считают, что если уровень циркулирующего гомоцистеина превышает 10 ммоль/л, то это повышает риск тромбообразования. Walker M.C. и соавт. (1999) считает нормативным уровень общего гомоцистеина 7,9±1,7 мкмоль/л. Наши данные совпадают с данными Walker M.C.
В проведенном исследовании показано повышение уровня гомоцистеина у женщин в постменопаузе с возрастом и достоверная разница между уровнем гомоцистеина была в группе сравнения и старшей возрастной группе.
Значимые различия уровня гомоцистеина оказались у женщин постменопаузального возраста с варикозной болезнью и без нее (рисунок 2). Средние показатели гомоцистеина у 26 женщин с варикозной болезнью составили 10,48 мкмоль/л, против 8,71 мкмоль/л – без варикозной болезни.
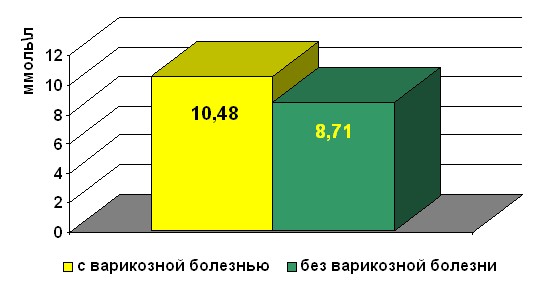
Рисунок 2. Уровень общего гомоцистеина у женщин постменопаузального возраста с варикозной болезнью и без нее.
При изучении зависимости состояния липидного спектра крови от уровня гомоцистеина и мы получили данные, указанные в таблице 11.
Как показано в таблице, имеется достоверная корреляционная связь (p<0,05) между уровнем гомоцистеина и общего холестерина, триглицеридов, что является значимым фактором и свидетельствует о межсистемных связях важнейших гомеостатических систем.
Таблица 11
Показатели липидного спектра крови и уровень гомоцистеина у женщин в постменопаузе
| Липидный спектр крови | Уровень гомоцистеина до 8 мкмоль/л (n=29) | Уровень гомоцистеина более 8 мкмоль/л (n=23) |
| Общий холестерин ммоль/л | 5,4±0,08*** | 6,08±0,36 |
| ЛПВП ммоль/л | 1,1±0,03 | 1,06±0,06 |
| ТГ ммоль/л | 2,08±0,05*** | 3,08±0,10 |
| ЛПНП ммоль/л | 3,4±0,07 | 3,87±0,36 |
Примечание: различие статистических значений по критерию tst с *- p<0,05; **-p<0,01; ***-p<0,001.
В основе повышения уровня гомоцистеина лежат либо наследственный дефицит ферментов, участвующих в метаболизме метионина, либо приобретенные факторы (Perry D.Y., 1999). Проведенные исследования полиморфизма генов PAI-1 и МТГФР, уровня гомоцистеина подтверждают ранее проведенные исследования о значимости роли генетических нарушений в развитии тромбофилических нарушений и сердечно-сосудистых заболеваний.
Важную роль в состоянии гемостаза играет сосудисто-тромбоцитарного звено.
Из таблицы 12 видно, что у женщин в постменопаузе были выявлены значительные нарушения адгезивно-агрегационных свойств тромбоцитов, играющие большую роль в развитии сосудистой патологии.
При исследовании коагуляционного гемостаза выявлено увеличение индекса тромботического потенциала (9,2±0,7), индекса гиперкоагуляции (0,23±0,81), фибриногена (3,1±0,2), что свидетельствуют об опасности тромбообразования.
Таблица12
Показатели сосудисто-тромбоцитарного звена гемостаза в постменопаузе.
| Показатели | Женщины в постменопаузе (n=68) | Женщины репродукт-го возраста (n=20) |
| Количество тромбоцитов, 10/9/л | 384,6±12,3*** | 290,4±12,6 |
| Адгезивная активность тромбоцитов (%) | 38,2±5,9 | 27,4±1,2 |
| Агрегация тромбоцитов с коллагеном (%) | 139,4±5,7* | 116,3±2,3 |
| Ретракция сгустка (%) | 47,8±3,6 | 33,4±1,2 |
Примечание: *- различие статистических значений по критерию tst с p<0,05; **-p<0,01; ***-p<0,001.
Индивидуальный анализ показал прямую зависимость коагуляционных свойств крови от степени тяжести КС. Наиболее высокий уровень тромботического потенциала - 9,4±0,6 был выявлен у женщин с тяжелой степенью климактерического синдрома, так же, как и ТЭГ (индекс гиперкоагуляции), значения которого были выше у женщин со средней и тяжелой степенью КС и составляли 1,1±0,1 – 1,09±0,3. Усиление агрегации тромбоцитов, по мере нарастания тяжести климактерического синдрома, способствуют процессу коагуляции, т.е. развитию ДВС синдрома. Описанные нарушения в системе гемостаза являются серьезным основанием для внесения женщин постменопаузального возраста в группу высокого риска по таким серьезным заболеваниям, как сердечно-сосудистые и тромбофилические.
Состояние костного метаболизма. При анализе клинического материала выявлена группа пациенток, у которых вне зависимости от длительности постменопаузы, доминантным осложнением постменопаузального периода был остеопороз. Из 177 женщин с КС у 168 (95,2%) при денситометрии было выявлено снижение минеральной плотности костной ткани (МПКТ). Кроме того, было проанализировано влияние фосамакса на течение остеопороза у 258 женщин, лечившихся в ЦКБ и филиале поликлиники Газпрома.
Таблица 13
Показатели минеральной плотности костной ткани (г/см2) зависимости от возраста и длительности постменопаузального периода
| Показатели | I группа n=48 | II группа n=54 | III группа n=39 | IV группа n=27 | Группа сравнения n=20 |
| Длит-сть пост- менопаузы | 3,0±0,89 | 7,3±0,94 | 15,4±1,2 | 19,1±2,4 | - |
| МПКТ L2-L4 | 0,794±0,02*** | 0,606±0,04*** | 0,821±0,03*** | 0,789±0,04 *** | 1,086±0,03 |
| T | -2,26±0,17 *** | 1,19±0,25* | 2,02±0,35 *** | 2,31±0,33 *** | -0,26±0,15 |
| Z | -1,73±0,17 | -0,02±0,27 | - 0,16±0,36 | - 0,14±0,31 | |
| МПКТ L2-L4 в бок. проекции | 0,622±0,03*** | 0,678±0,02*** | 0,611±0,04 *** | 0,636±0,01 *** | 0,826±0,02 |
| Т | 2,37±0,21 *** | 1,49±0,33 * | 2,46±0,33 *** | 2,32±0,124 *** | 0,22±0,05 |
| Z | -1,44±0,23 | 0,17±0,128 | 0,31±0,16 | 0,43±0,35 | |
| МПКТ области Варда | 0,565±0,03*** | 0,554±0,29*** | 0,505±0,03 *** | 0,394±0,03 *** | 0,802±0,04 |
| Т | 1,81±0,46* | 2,17±0,33 *** | -2,64±0,3 *** | 3,59±0,25 *** | 0,27±0,04 |
| Z | 0,75±0,03 | -0,27±0,42 | 0,14±0,04 | -0,12±0,28 | |
| МПКТ шейки бедра | 0,665±0,023*** | 0,749±0,02 | 0,703±0,02 | 0,582±0,02 *** | 0,883±0,03 |
| Т | 2,40±0,2 *** | 1,43±0,32 * | 1,90±0,33 *** | 2,69±0,14 *** | 0,23±0,07 |
| Z | -1,51±0,22 | -0,21±0,30 | 0,42±0,13 | -0,66±0,2 | |
| МПКТ прокс-ных от. бедра | 0,805±0,02*** | 0,89±0,02 ** | 0,862±0,03 ** | 0,692±0,02 *** | 1,012±0,02 |
| Т | 1,39±0,21 ** | 0,49±0,31* | -0,94±0,3 | 2,34±0,26 *** | 0,37±0,24 |
| Z | 1,02±0,23* | 0,2±0,16 | 0,40±0,24 | -0,46±0,21 | 0,25±0,05 |
Примечание: различие статистических значений по критерию tst с *- p<0,05; **-p<0,01; ***-p<0,001; - p>0,05. Средний возраст пациенток в группе сравнения - 28±5 лет.
В таблице 13 показано, что во всех возрастных группах средние показатели МПКТ были ниже нормативных, и степень снижения коррелировала с длительностью постменопаузы.
Остеопения отмечалась в 45-ти наблюдениях (26,7%) и в 123 (73,3%) остеопороз – значения МПКТ (по Т-критерию) были ниже -2,5 СД, что является показателем выраженного нарушения минерализации костной ткани и первичного остеопороза. Во всех группах отмечалось снижение МПКТ в зоне Варда. Наиболее значительное снижение МПКТ было у женщин старшей возрастной группы – 70 и более лет, в 4 наблюдениях у женщин этой группы отмечалось выраженное снижение МПКТ в области шейки бедра и области Варда.
При анализе показателей МПКТ выявлялись некоторые особенности МПТК по зонам исследования в зависимости от возраста женщины. Так у женщин II группы (51-60 лет) в 32 (59,2%) наблюдений наибольшее снижение показателей МПКТ обнаруживалось в области позвонков L2-L4, а в области Варда (наименьшая плотность в области шейки бедра, наиболее подверженная переломам, тонко реагирующая на изменение минерального метаболизма) снижение МПКТ (Т-критерий – 2,18±0,31) имело место в 12 (22,2%) наблюдениях, тогда как в 29% наблюдений в проксимальных отделах бедра показатели МПКТ были в пределах нормы. Снижение МПКТ в области Варда – у женщин 61-70 лет обнаружилось в 76% наблюдений, которые сочетались со снижением МПКТ в области позвоночника и проксимальных участках бедренной кости. В группе женщин старше 70 лет имелось снижение МПКТ во всех отделах, особенно выраженное в области шейки бедра. В анамнезе женщин этой группы наблюдались один или несколько переломов.
Изучение анамнеза женщин позволяет сделать вывод, что степень нарушения костного метаболизма зависит от длительности постменопаузального периода и возраста женщины. Изменения показателей МПКТ в первую очередь проявляются в области поясничного отдела позвоночника, а в более старшем возрасте - в проксимальных отделах бедра и области Варда.
При индивидуальном анализе была выявлена зависимость потери костной массы от степени тяжести КС. Из общего числа женщин с тяжелым течением КС, которых было 39, у 9-ти из них показатели МПКТ по Т-критерию составили в среднем 3,09±0,2. Остеопороз у них сочетался с выраженными симптомами нейровегетативных расстройств.
С целью выявления частоты генетически детерминированного остеопороза, была исследована связь генетического полиморфизма в локусах коллагена I типа и рецептора витамина Д у 103 женщин с постменопаузальным остеопорозом. Контрольную группу составили 71 женщина в постменопаузе без остеопороза.
Таблица 14
Частота полиморфизма генов COLIA1 и VDR
у женщин с постменопаузальным остеопорозом
| генотип | С остеопорозом (n=103) | Контрольная группа (n=71) | ||
| абс. | % | абс. | % | |
| Sp1-полиморфизм гена COLIA1 | ||||
| SS | 58 | 56,3* | 51 | 71,8 |
| Ss | 36 | 35 | 18 | 25,4 |
| ss | 9 | 8,7 | 2 | 2,8 |
| Bsml-полиморфизм гена рецептора витамина D (VDR) | ||||
| bb | 26 | 25,2 | 28 | 39,4 |
| Bb | 47 | 45,6 | 30 | 45,2 |
| BB | 30 | 29,1 | 13 | 18,3 |
Примечание: *- различие статистических значений по критерию tst с p<0,05; **-p<0,01; ***-p<0,001.
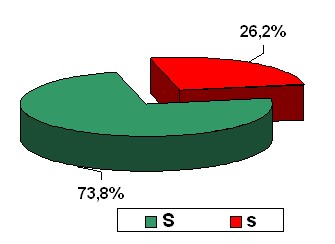
| Рисунок 3. Частота полиморфизма гена COLIA1 у женщин остеопорозом |
Рисунок 4. Частота полиморфизма гена VDR у женщин с остеопорозом
Как видно из рисунка 3 у женщин с остеопорозом частота «дефектного» аллеля s гена COLIA1 (26,2%) была достоверно выше, чем у женщин в контрольной группе (15,5%). В основной группе почти в 3 раза больше было носительниц полиморфного аллеля в гомозиготной форме (ss), по сравнению с женщинами контрольной группы (таблица 14). Характерен анамнез женщин с гомозиготным полиморфизмом COLIA1. В анамнезе у 9 женщин с ss генотипом, у 6-ти был перелом лучевой кости, причем у 3-х сочетался с переломами ребер и у 2-х – с переломами ключицы.
При исследовании полиморфизма гена рецептора витамина Д была выявлена достоверно более высокая частота аллеля В у женщин с остеопорозом - 52%, по сравнению с контрольной группой (39,5%), что видно из рисунка 4.
Достоверно ниже оказались и показатели МПКТ у женщин с генотипом ВВ, по сравнению с женщинами с генотипом bb (рисунок 5).

Рисунок 5. Показатели МПКТ по зонам исследования и полиморфизм гена VDR.
В таблице 15 представлены данные показателей VDR, COLIA1 у женщин, имевших и не имевших переломы в анамнезе. В исследование вошли 76 женщин, из них 35 женщин с остеопорозом без переломов в анамнезе и 41 – с переломами.
Частота генотипа ВВ гена VDR была значительно выше у женщин с переломами и составила 35%.
Таблица 15
Ассоциация полиморфизма генов рецептора витамина Д (VDR) и COLIA1 с наличием переломов
| Генотип | Без переломов (n=43) | С переломами (n=60) |
| VDR (Bsml) | ||
| bb | 23 (53,4%) | 15 (25%)** |
| Bb | 15 (34,8%) | 24 (40%) |
| BB | 5 (11,6%) | 21 (35%)* |
| COLIA1 (Spl) | ||
| SS | 26 (60,4%) | 20 (33,6%)** |
| Ss | 12 (27,9%) | 24 (40%) |
| ss | 5 (11,6%) | 16 (26,6%) |
Примечание: *- различие статистических значений по критерию tst с p<0,05; **-p<0,01; ***-p<0,001.
В то же время частота полиморфных аллелей гена COLIA1 у женщин с переломами была более чем в 2 раза выше, по сравнению с группой без переломов, но не была статистически достоверна.
При исследовании костного метаболизма у 116 женщин с постменопаузальным остеопорозом, мы получили данные представленные в таблице 16. Таблица демонстрирует достоверное снижение ионизированного кальция в сыворотке крови и некоторое повышение уровня щелочной фосфатазы у женщин в постменопаузе с остеопорозом. Лабильность показателей щелочной фосфатазы может зависеть от принимаемых лекарственных средств, что было у наших пациентов пожилого и старческого возраста, отягощенных тяжелыми соматическими заболеваниями. Уровень ионизированного кальция был нормальным или приближенным к нормальному уровню лишь у 8 из 116 женщин и составил 6,9%.
Таблица 16
Состояние кальциевого гомеостаза при постменопаузальном остеопорозе
| Показатель | Женщины с остеопорозом (n=116) | Контрольная группа (n=20) |
| Щелочная фосфатаза (МЕ/л) | 209,5±71,5 | 208,6±56,4 |
| Кальций сыворотки крови ммоль/л | 2,44±0,18 | 2,05±0,11 |
| Кальций ионизированный ммоль/л | 1,017±0,19 | 1,10±0,57 |
| Суточная экскреция кальция с мочой ммоль/л | 3,4±0,8 | 2,5±0,6 |
Уровень экскреции кальция с мочой показан на рисунке 6.
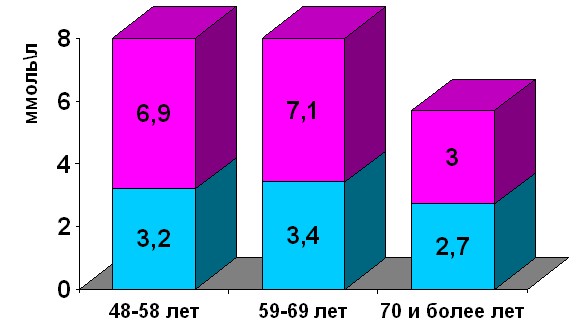
Рисунок 6. Уровень экскреции кальция в различных возрастных группах.
Уровень экскреции кальция с мочой у женщин в возрастном диапазоне 59-69-ти лет был выше нормативных значений и составил 3,4-7,1 ммоль/л, но после 70 лет у женщин суточная потеря кальция с мочой, не достигая нормальных значений, несколько снижается.
Проведенное исследование состояния костного метаболизма у женщин постменопаузального возраста позволяет сделать вывод, что его нарушение может быть следствием не только гипоэстрогенемии, но и генетических нарушений.
Влияние фосамакса на минеральную плотность костной ткани, состояние сосудисто-тромбоцитарного звена гемостаза и выраженность болевого синдрома. Важной проблемой является лечение и профилактика развития остеопороза при выработке стратегии лечения с условием соотношения факторов пользы и риска от назначенной терапии.
Нами проведен анализ показателей МПКТ при лечении фосамаксом 258 пациентов различных возрастных групп в течение года.
Среди обследованных женщин 189 были с постменопаузальным остеопорозом и 69 - с сенильным. Возраст женщин был в пределах 50 - 85 лет. МПКТ L1-L4 по Т-критерию была от -2,5 СД до -4,5 СД. Женщины получали пролонгированный препарат фосамакса 70 мг 1 раз в неделю, натощак, запивая стаканом воды. Дополнительно назначался 600-1000 мг кальция и 400 МЕ витамина Д3.
Анализ данных остеоденситометрии показал повышение значений МПКТ у женщин получавших фосамакс во всех областях (рисунок 7).
Наиболее выраженный эффект от приема фосамакса отмечался в первые 6 месяцев практически у всех пациенток (94,6%). В дальнейшем повышение МПКТ отмечалось более медленными темпами. Лишь у 12 пациенток, отмеченное повышение МПКТ в первые 6 месяцев (до 6% и 4,5% в поясничных позвонках и шейках бедер соответственно), оставалось стабильно на этом уровне до конца года.
Во всех возрастных группах наибольшей нестабильностью отличалась область Варда.
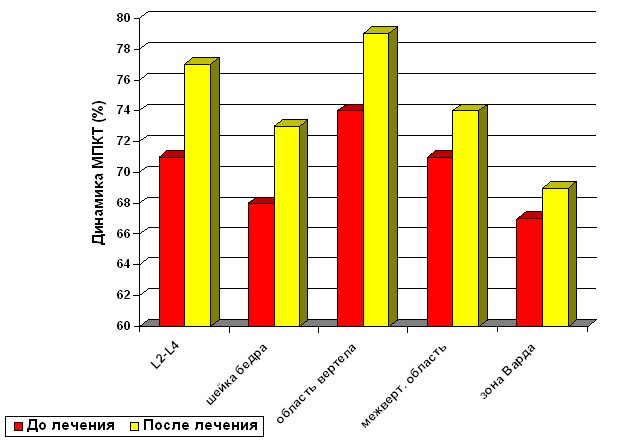
Рисунок 7. Динамика суммарных показателей МПКТ через год после лечения фосамаксом.
Анализ динамики показателей МПКТ в наблюдениях с ОП, при проведении терапии фосамаксом, показал неоднозначность результатов у пациенток в разных возрастных группах. При индивидуальном анализе была отмечена интересная закономерность – нередко у женщин старше 70 лет оказывался более высокий темп прироста костной массы – до 8,5% в поясничных позвонках. Это, по-видимому, обусловлено: приемом более высоких доз активных метаболитов и солей кальция; назначением фосамакса женщинам старше 70 лет после проведения симптоматического лечения, направленного на снижение активности воспалительного процесса, сопровождающегося сильными болями (ДОА и др.), и повышения физической активности; более низкие исходные значения МПКТ у пациенток старше 70 лет способствовали более интенсивному усвоению препаратов кальция и давали выраженный прирост МПКТ, чем в наблюдениях до 65 лет. Только в области шеек бедренных костей темпы роста МПКТ не доминируют над остальными возрастными группами.
За 12 месяцев наблюдения у всех наших пациенток, принимавших фосамакс, отмечена нормализация уровня кальция в сыворотке крови, и ионизированного кальция, который контролируется и рассматривается, как физиологическая константа кальциевого гомеостаза.
При исследовании состояния сосудисто-тромбоцитарного звена гемостаза у 96 пациенток, до начала терапии фосамаксом и через 6 месяцев на фоне лечения, мы получили данные позволяющие утверждать, что фосамакс не сказывается отрицательно на состоянии тромбоцитарного звена гемостаза.
Важным является вопрос, как долго сохраняется эффективность лечения тем или иным препаратом после отмены лечения. В научной литературе имеются данные, что прекращение лечения эстрогенами на любом сроке длительной терапии вновь увеличивает темп костного обмена, и потеря костной массы возобновляется с той же скоростью, что и в ранней менопаузе (Сметник В.П., 2001). Мы проанализировали показатели МПКТ через 1 год после прекращения лечения фосамаксом (рисунок 8).
Из данного рисунка можно видеть, что полученные результаты лечения фосамаксом сохраняются на достигнутом уровне спустя год после отмены терапии.
Таким образом, проведенное исследование позволяет сделать заключение с учетом ретроспективного анализа данных анкетирования, клинических наблюдений и полученных результатов исследования, что развитие постменопаузальных заболеваний носит характер общесистемных расстройств, метаболических и генетических нарушений.
 Рисунок 8. Динамика суммарных показателей МПКТ через год после прекращения лечения фосамаксом.
Рисунок 8. Динамика суммарных показателей МПКТ через год после прекращения лечения фосамаксом.
ВЫВОДЫ
- Данные анкетирования 609 женщин в постменопаузе показали: частота климактерического синдрома составила 47,4%. У 37,3% женщин с климактерическим синдромом родители страдали сердечно-сосудистыми заболеваниями, у - 45,4% ожирением, у 70,4% - варикозной болезнью, климактерический синдром был у 54% матерей, переломы в анамнезе у родителей - у 63,9%. Более 90% анкетированных не знали, как может отразиться на состоянии их здоровья наступление менопаузы.
2. Климактерические расстройства и ассоциированные с постменопаузой заболевания – сердечно-сосудистые, тромбофилические, остеопороз, развиваются на фоне дисбаланса иммунной системы, усиления интенсивности перекисного окисления липидов и метаболических нарушений, которые носят как внутрисистемный, так и межсистемный характер.
3. Выявленные системные метаболические нарушения у женщин в постменопаузе и усиливающиеся при климактерическом синдроме явились одной из причин формирования тромбофилических состояний, сердечно-сосудистых заболеваний и метаболического синдрома.
4. У женщин в постменопаузальном периоде повышен уровень гомоцистеина до 9,36 мкмоль/л, по сравнению с уровнем в репродуктивном возрасте, который составил 7,5мкмоль/л. Повышение уровня гомоцистеина наиболее выражено у женщин с варикозной болезнью (10,48 мкмоль/л). Обнаружена достоверная зависимость между уровнем гомоцистеина и показателями общего холестерина и триглицеридами, что является показателем межсистемных связей, определяющих состояние гомеостаза.
5. Причинами сердечно-сосудистых заболеваний, тромбофилических состояний и постменопаузального остеопороза, наряду с дефицитом эстрогенов, являются генетические нарушения. Выявлена связь риска сердечно-сосудистых заболеваний и тромбофилических состояний с повышенным уровнем ингибитора активатора плазминогена 1 типа (PAI-1), обусловленного присутствием в их генотипе 4G аллеля гена PAI-1 и аллеля 677Т гена метилентетрагидрофолатредуктазы (МТГФР). Частота полиморфного аллеля (4G) гена PAI-1 составила 57,8% у женщин с ИБС, 63,5% - с гипертонической болезнью и 59,6% - у женщин с варикозной болезнью. Частота полиморфного аллеля (Т) гена МТГФР у женщин с ИБС составила 37,5%, с гипертонической болезнью - 37,8% и у женщин с варикозной болезнью - 40%.
6.Установлены возрастные особенности показателей минеральной плотности костной ткани по зонам исследования – у 59,2% женщин 50-60 лет наибольшее снижение МПКТ обнаруживается в области позвонков L2-L4. У женщин 61-70 лет в 76% наблюдений - в области Варда, сочетаясь со снижением МПКТ в позвоночнике и проксимальных отделах бедренной кости. У женщин старше 70 лет снижение МПКТ обнаруживается во всех зонах исследования и особенно выражено в шейке бедра.
7. Риск развития постменопаузального остеопороза увеличивается у пациенток носительниц полиморфного аллеля s гена COLIA1 и аллеля В (Bsml) гена рецептора витамина D (VDR). У женщин с постменопаузальным остеопорозом частота s-аллеля гена COLIA1 составила 26,2%, а аллеля В гена VDR – 52%. При этом у женщин с гомозиготным носительством полиморфного аллеля гена рецептора витамина D минеральная плотность костной ткани достоверно ниже, чем у женщин с генотипом bb.
8. Женщинам с климактерическим синдромом и диффузной мастопатией в анамнезе, с исходно повышенной интенсивностью перекисного окисления липидов, следует рекомендовать отказаться от лечения гормональными препаратами и использовать альтернативные методы лечения.
9. Использование фосамакса эффективно решает проблему лечения остеопороза, не влияя отрицательно на состояние системы гемостаза и сохраняя достигнутый уровень минеральной плотности костной ткани (увеличение МПКТ на 4-8%) через год после прекращения лечения.
10. Стратегия и тактика лечения и профилактики постменопаузальных расстройств должна учитывать риск развития генетически детерминированных заболеваний (сердечно-сосудистых заболеваний, тромбофилических состояний, остеопороза), снижение адаптационных возможностей и оксидантной активности у женщин пожилого возраста и быть направлена не столько на коррекцию дефицита эстрогенов, сколько на коррекцию нарушений систем гомеостаза. В основе тактики лечения осложненного течения постменопаузы должна лежать оценка соотношения польза/риск и оцениваться индивидуально, с учетом значимости пользы и наличия факторов риска у конкретной пациентки.
11. Лекарственные препараты, используемые пациентами с климактерическими расстройствами, должны учитывать их влияние на систему гемостаза, липидный спектр крови, углеводный обмен и наличие сопутствующих соматических заболеваний. Использование ЗГТ целесообразно у женщин с ранними и средневременными проявлениями климактерического синдрома.
12. С целью предупреждения тяжелых последствий постменопаузы следует рекомендовать генетическое обследование женщин с отягощенным семейным анамнезом по сердечно-сосудистым и метаболическим заболеваниям, тромбофилическим состояниям, остеопорозу в пременопаузальном периоде.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Изучение параметров систем гомеостаза у женщин с климактерическим синдромом позволяет предложить, с целью прогнозирования климактерических расстройств, следующий алгоритм обследования женщин пременопаузального возраста:
- Оценка данных семейного анамнеза с целью выяснения наследственной предрасположенности к сердечно-сосудистым заболеваниям, тромбофилическим состояниям, метаболическому синдрому, развитию постменопаузального остеопороза и климактерического синдрома. При выяснении указанных признаков – скрининговое исследование системы гемостаза и липидного профиля, а также рекомендовать генетическое обследование на выявление полиморфизма генов PAI-1, МТГФР, COLIA1;
- Скрининговое исследование содержания ионизированного кальция в сыворотке крови, и при снижении его уровня проведение денситометрии.
- Стратегия лечения и профилактики менопаузальных расстройств должна учитывать риск развития генетически детерминированных заболеваний (сердечно-сосудистых заболеваний, тромбофилических состояний, остеопороза), снижение адаптационных возможностей и оксидантной активности у женщин пожилого возраста и быть направлено не столько на коррекцию дефицита эстрогенов, сколько на коррекцию нарушений основных гомеостатических систем.
- Лекарственные препараты, используемые у женщин с климактерическим синдромом, должны назначаться с учетом их влияния на систему гемостаза, липидный спектр крови, углеводный обмен, состояние костного метаболизма и сопутствующих соматических заболеваний, а также имеющегося снижения адаптационных реакций и нарушение перекисного окисления липидов.
- У женщин с КС, имеющих в анамнезе заболевания молочных желез, при назначении лечения предпочтительно назначение негормональных препаратов.
- Современные подходы к терапии остеопороза должны придерживаться принципа:
- лечение должно быть патогенетически направлено на стимуляцию костеобразования, подавление костной резорбции;
- симптоматическое - в первую очередь это коррекция болевого синдрома;
- кроме того, в комплексе антиостеопоротических мероприятий необходима диета с повышенным содержанием кальция - молочные продукты, орехи, морепродукты, активные метаболиты витамина Д.
Наши исследования позволяют считать средством выбора лечения остеопороза фосамакс.
- Учитывая широкую распространенность и малую осведомленность женщин о климактерических расстройствах, необходимо активно выявлять начальные признаки проявлений климактерического синдрома при обращении женщин пре- и менопаузального возраста к гинекологу с помощью дополнительных вопросов, которые бы помогли выявить семейную отягощенность и наследственную предрасположенность к развитию тяжелых поздних осложнений- остеопороза, сердечно-сосудистых заболеваний и тромбофилических состояний.
- При обращении женщины к врачу с симптомами, связанными с прекращением менструальной функции тактика обследования и лечения должна решаться гинекологом совместно с врачами смежных специальностей (терапевт, невролог).
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Абусуева З.А., Коробейников А.П., Стрижова Н.В. Возможности использования системной энзимотерапии в лечении пациентов с климактерическим синдромом. // Материалы XI Российского национального конгресса «Человек и лекарство». – Москва, 19-23 апреля 2004. С. 55-56.
- Абусуева З.А., Стрижова Н.В. Оценка использования вобензима в комплексном лечении климактерического синдрома. // Материалы XI Российского национального конгресса «Человек и лекарство».- Москва, 19-23 апреля 2004. – С.56.
- Коробейников А.П., Абусуева З.А., Стрижова Н.В. Оценка влияния экзогенных гормонов на уровне инсулиноподобного фактора роста 1 и связывающего белка – 3 в плазме от метода введения у женщин с климактерическим синдромом. // Материалы XI Российского национального конгресса «Человек и лекарство».- Москва, 19-23 апреля 2004. – С.201.
- Абусуева З.А., Коробейников А.П., Стрижова Н.В. Оценка влияния экзогенных гормональных факторов и риска заболеваний раком молочной железы у женщин постменопаузального периода. // Вестник Российского Государственного медицинского университета. – Москва, 2004. - № 4(35). – С. 18-26.
- Абусуева З.А., Стрижова Н.В., Коробейников А.П. Перекисное окисление липидов у пациенток с заболеваниями молочных желез и оценка их состояния на фоне заместительной гормональной терапии. // Материалы Российского конгресса по гинекологической эндокринологии и менопаузе. – Москва, 2004. – С.83.
- Абусуева З.А., Стрижова Н.В., Берестовая Н.А. Постменопауза и возрастные особенности локализации остеопороза. // Акушерство и гинекология. – Москва, 2005. - № 2. – С.50-52.
- Абусуева З.А., Стрижова Н.В., Коробейников А.П. Особенности метаболических нарушений у женщин в менопаузе. // Материалы XII Российского национального конгресса «Человек и лекарство». – Москва, 18-22 апреля 2005. – С.45.
- Абусуева З.А., Стрижова Н.В., Коробейников А.П. Интенсивность перекисного окисления липидов при заболеваниях молочной железы и их состояние при проведении заместительной гормональной терапии. // Материалы XII Российского национального конгресса «Человек и лекарство». – Москва, 18-22 апреля 2005. – С.44.
- Абусуева З.А., Стрижова Н.В., Берестовая Н.А. Состояние костного метаболизма у женщин с остеопорозом в менопаузе. // Материалы XII Российского национального конгресса «Человек и лекарство». – Москва, 18-22 апреля 2005. – С.253.
- Стрижова Н.В., Коробейников А.П., Берестовая Н.А. Особенности топографии остеопороза в зависимости от длительности менопаузы и возраста. // Материалы конгресса «Современные технологии в диагностике и лечении гинекологических заболеваний». – Москва, 2005. – С.52.
- Стрижова Н.В., Коробейников А.П., Абусуева З.А. Метаболические нарушения у женщин в постменопаузе. // Журнал Российского общества акушеров-гинекологов. – Москва, 2005. – №2. – С.35-36.
- Абусуева З.А., Стрижова Н.В., Берестовая Н.А., Коробейников А.П. Менопауза и возрастные особенности топографии остеопороза. // Вестник Российского Государственного медицинского университета. – Москва, 2005. - № 2(41). – С.12-15.
- Абусуева З.А., Банин В.С., Воронцов В.Л., Берестовая Н.А. Двухэнергетическая рентгеновская абсорбциометрия в диагностике остеопороза у женщин в постменопаузальном периоде. // Материалы II Российского конгресса по остеопорозу. – Ярославль, 28 сентября – 1 октября 2005. – С. 115-116.
- Берестовая Н.А., Байдина О.И., Абусуева З.А., Волков Е.Е., Гордеев А.В. Применение альфадол-Са для лечения остеопороза у женщин. // Материалы II Российского конгресса по остеопорозу. – Ярославль, 28 сентября – 1 октября 2005. – С.115-116.
- Берестовая Н.А., Воронцов В.Л., Юшков И.В., Абусуева З.А., Волков Е.Е. Современные подходы к диагностике, лечению и профилактике остеопороза.// Материалы научно-практической конференции, посвященной 70-летию клинического санатория «Барвиха» управления делами президента Российской Федерации. – Москва, 29 сентября 2005. – С.65-67.
- Стрижова Н.В., Кольцова Л.В., Абусуева З.А. Метаболические нарушения у женщин в постменопаузе. // Материалы научно-практической конференции, посвященной 70-летию клинического санатория «Барвиха» управления делами президента Российской Федерации. – Москва, 29 сентября 2005. – С.208-210.
- Сухих Г.Т., Стрижова Н.В., Абусуева З.А., Файзуллин Л.З. Молекулярно-генетические факторы развития постменопаузального остеопороза. // Журнал Российского общества акушеров-гинекологов. – Москва, 2005. - № 4. –С.34-36.
- Абусуева З.А., Коробейников А.П., Стрижова Н.В., Чернова Е.Г. Перекисное окисление липидов у пациенток с заболеваниями молочных желез и оценка их состояния на фоне заместительной гормональной терапии. // Вестник Российского Государственного медицинского университета. – Москва, 2006. - № 1(48). – С.22-27.
- Стрижова Н.В., Абусуева З.А., Коробейников А.П. Интенсивность перекисного окисления липидов у женщин с доброкачественными заболеваниями молочных желез на фоне заместительной гормональной терапии. // Акушерство и гинекология. – Москва, 2006. - № 1. – С.48-50.
- Стрижова Н.В., Сухих Г.Т., Абусуева З.А. Генетические факторы сердечно-сосудистых заболеваний у женщин в постменопаузе. // Материалы Международного конгресса «Практическая гинекология». – Москва, 27-31 марта 2006. – С.174-175.
- Абусуева З.А., Сухих Г.Т., Стрижова Н.В., Файзуллин Л.З. Кальциевый гомеостаз и роль генетических факторов в развитии постменопаузального остеопороза. // Материалы XII Российского национального конгресса «Человек и лекарство». – Москва, 3-7 апреля 2006. – С.45.
- Абусуева З.А., Файзуллин Л.З., Стрижова Н.В., Сухих Г.Т. Роль генетических факторов в развитии сердечно-сосудистых заболеваний у постменопаузальных женщин. // Материалы XII Российского национального конгресса «Человек и лекарство». – Москва, 3-7 апреля 2006. – С.45-46.
- Берестовая Н.А., Стрижова Н.В., Скороглядов А.В., Банин В.С., Абусуева З.А., Воронцов В.Л., Коробейников А.П. Клиническая оценка эффективности пролонгированного фосамакса в терапии постменопаузального остеопороза. // Акушерство и гинекология. – Москва, 2006. - № 3. – С.33-35.
- Абусуева З.А., Файзуллин Л.З., Стрижова Н.В., Сухих Г.Т. Генетические факторы риска сердечно-сосудистых заболеваний у женщин постменопаузального возраста. // Акушерство и гинекология. – Москва, 2006. - № 5. – С.32-34.

