Кызы роль экзогенного лютеинизирующего гормона в фолликуло- и оогенезе при проведении программ вспомогательной репродукции
На правах рукописи
МАМЕДОВА
НАРМИНА РАМИЗ КЫЗЫ
РОЛЬ ЭКЗОГЕННОГО ЛЮТЕИНИЗИРУЮЩЕГО ГОРМОНА В ФОЛЛИКУЛО- И ООГЕНЕЗЕ ПРИ ПРОВЕДЕНИИ ПРОГРАММ ВСПОМОГАТЕЛЬНОЙ РЕПРОДУКЦИИ
14.01.01 – Акушерство и гинекология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2012
Работа выполнена на кафедре акушерства, гинекологии, перинатологии и репродуктологии ФППО врачей ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздравсоцразвития РФ.
Научные руководители:
доктор медицинских наук, профессор НАЗАРЕНКО Татьяна Алексеевна
доктор биологических наук, профессор ФАНЧЕНКО Николай Дмитриевич
Официальные оппоненты:
КАЛИНИНА Елена Анатольевна — доктор медицинских наук, руководитель отделения вспомогательных технологий в лечении бесплодия ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздравсоцразвития России;
САМОЙЛОВА Татьяна Евгеньевна — доктор медицинских наук, профессор кафедры женских болезней и репродуктивного здоровья Института усовершенствования врачей ФГУ «Национальный медико-хирургический центр им. Н.И. Пирогова» Минздравсоцразвития России.
Ведущая организация: ГБОУ ВПО «Московский государственный медико-стоматологический университет» Минздравсоцразвития России.
Защита состоится «_____» ________2012 г., в ________ ч. на заседании диссертационного совета Д 208.048.01 при ГУЗ «Московский областной научно-исследовательский институт акушерства и гинекологии» (101000, Москва, ул. Покровка, д. 22а).
С диссертацией можно ознакомиться в библиотеке ГУЗ «Московский областной научно-исследовательский институт акушерства и гинекологии».
Автореферат разослан «____» __________2012 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор ЗАЙДИЕВА Я.З.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Достижения фармакологии, эмбриологии, эндокринологии и ультразвуковой диагностики сделали возможным реализацию генеративной функции у женщин методом экстракорпорального оплодотворения (ЭКО), который является универсальным, наиболее эффективным способом лечения всех видов бесплодия, включая мужское, идиопатическое и ассоциированное с эндометриозом.
Стимуляция функции яичников является основой программ вспомогательной репродукции и используется в циклах естественной фертильности при лечении ановуляторного бесплодия, при проведении внутриматочной инсеминации, а также в программах ЭКО. Эффективность этих методов во многом определяется характером ответа яичников на введение индукторов овуляции: числом растущих фолликулов, количеством и качеством получаемых ооцитов и культивируемых эмбрионов (Назаренко Т.А., 2009).
Впервые индукторы овуляции стали применяться в 60-е годы прошлого века. С этого периода времени используемые препараты и методики стимуляции, при сохранении общих принципов, претерпели значительные изменения в деталях.
Внимание клиницистов привлечено к решению вопроса об индивидуальном подборе оптимальных схем индукции овуляции, которые позволили бы, с одной стороны, обеспечить адекватный фолликулогенез и получение зрелых ооцитов, а с другой избежать осложнений (Caglar G.S., 2005). Не менее значимой проблемой является «бедный» ответ, который имеет место практически у трети пациентов, преимущественно старшего репродуктивного возраста, которые все чаще в последнее время обращаются по поводу лечения бесплодия (Краснопольская К.В., 2004; Ferraretti A.P. et al., 2004; Kailasam C. et al., 2004).
Расширение спектра препаратов, используемых для стимуляции яичников, а это как мочевые гонадотропины, содержащие ЛГ и ФСГ, так и рекомбинантные, содержащие только ФСГ или только ЛГ, аналоги гонадолиберинов-агонисты и антагонисты, диктует необходимость индивидуального подбора наиболее оптимальных протоколов лечения.
До сих пор обсуждаются вопросы преимуществ и недостатков рФСГ и ЧМГ. Принципиальная суть этих разногласий сводится к мнению ряда ученых о необходимости добавления экзогенного ЛГ на уровне финального созревания ооцитов для завершения оогенеза и адекватной подготовки эндометрия к имплантации (Filicori M. et al., 2001; Lisi F. et al., 2002; De Placido G. et al., 2004; Andersen A.N., 2006), тем более что протоколы, использующие десенситизацию гипоталамо-гипофизарной системы предполагают подавление обоих гонадотропинов, а экзогенно вводится лишь один из них – рФСГ.
Проведенные до сегодняшнего дня исследования не позволяют ответить на основные вопросы клинической практики: какова роль ЛГ в фолликулогенезе индуцированного цикла и у каких групп больных добавление ЛГ повысит эффективность лечения бесплодия. Также неизвестно, какие дозы экзогенного ЛГ необходимы для осуществления адекватного фолликулогенеза, может ли введение ЛГ в схему стимуляции преодолеть проблемы «бедного ответа» и синдрома гиперстимуляции яичников (СГЯ).
Вышеизложенное определило цель настоящего исследования: оптимизировать протоколы стимуляции яичников в программах ЭКО на основании уточнения механизмов эндокринной регуляции процессов фолликуло- и оогенеза.
Задачи исследования
1. Изучить исходные клинико-лабораторные характеристики и результаты предшествующего лечения пациенток программ ЭКО.
2. Провести сравнительный анализ результатов программ ЭКО при использовании 3-х вариантов стимуляции яичников: рФСГ, ЧМГ и рФСГ в сочетании с ЧМГ.
3. Оценить эффективность 3-х вариантов стимуляции яичников у исследуемой группы больных в зависимости от показателей овариального резерва.
4. Исследовать динамику концентраций ЛГ в периферической крови в процессе индуцированного цикла при различных протоколах стимуляции яичников и с учетом овариального резерва.
5. Оценить характер изменения уровней антимюллерова гормона (АМГ) в периферической крови при различных протоколах стимуляции яичников.
6. Сопоставить концентрации ЛГ, АМГ и эстрадиола (Е2) в фолликулярной жидкости и периферической крови и определить диагностическое значение фолликулярной жидкости как биологического субстрата.
7. Разработать индивидуальные протоколы стимуляции яичников в программах ЭКО, способствующие повышению эффективности лечения.
Научная новизна
В работе впервые установлена общая закономерность динамики ЛГ в течение индуцированного цикла, заключающаяся в снижении его уровня на 6–7 день стимуляции, независимо от состояния овариального резерва пациенток и использованного протокола стимуляции. Выявлено, что снижение уровня ЛГ ниже значений 1,5 МЕ/л сопряжено с худшими показателями оогенеза. Показано, что наиболее благоприятным для исхода лечения является уровень ЛГ на 6–7 день стимуляции от 1,5 до 2,5 МЕ/л. Определены группы пациенток, которым необходимо добавление ЛГ-содержащих препаратов на этапе финального созревания фолликулов для оптимизации результатов лечения бесплодия.
Доказано, что выбор схемы стимуляции должен определяться на основании исходных характеристик овариального резерва пациенток: при нормальных показателях овариального резерва можно использовать только препараты рФСГ, тогда как при сниженном резерве необходимо добавление ЛГ-содержащих препаратов; при высоких показателях овариального резерва и выраженной тенденции к развитию СГЯ замена рФСГ на ЧМГ в период завершения фолликулогенеза может способствовать снижению этого риска. Выявлено снижение концентрации АМГ в периферической крови в преовуляторном периоде по сравнению с исходными значениями. Показано, что концентрации гормонов в фолликулярной жидкости не отражают качества получаемых ооцитов.
Практическая значимость
Характер динамики уровня ЛГ в периферической крови в течение индуцированного цикла позволил рекомендовать его определение на 6–7 день стимуляции, что наряду с УЗИ, может служить критерием для модификации схемы стимуляции и добавления ЛГ-содержащих препаратов на стадии финального созревания фолликулов. Проведенное исследование позволило оптимизировать методы лечения бесплодия у пациенток с бедным ответом и риском СГЯ путем добавления ЛГ, или замены рФСГ на ЧМГ. Разработан и рекомендован для применения в клинической практике алгоритм, позволяющий выбрать протокол стимуляции яичников в программах ЭКО и тем самым улучшить результаты лечения и снизить риск осложнений.
Положения, выносимые на защиту
1. Параметры фолликулогенеза в индуцированном цикле определяются видом гонадотропной стимуляции. Введение рекомбинантного ФСГ предопределяет активный фолликулогенез с формированием в преовуляторном периоде большого числа фолликулов разного размера, однако доля ооцитов хорошего качества от общего числа полученных оказалась меньше, чем при использовании ЧМГ или при сочетании рФСГ с ЧМГ.
2. В индуцированном цикле происходит падение уровня ЛГ на 6–7 день стимуляции независимо от состава используемого индуктора, применяемого аналога Гн-РГ и состояния овариального резерва; уровень ЛГ ниже 1,5 МЕ/л и выше 2,5 МЕ/л ассоциирован с худшим качеством ооцитов.
3. При сниженных показателях овариального резерва добавление ЛГ-содержащих препаратов на финальных этапах фолликулогенеза способствует оптимизации процессов оогенеза, получению качественных ооцитов и повышению эффективности лечения до 34,5%. У пациенток с нормальными и повышенными показателями овариального резерва добавление ЛГ снижает риск развития СГЯ, но не влияет на частоту наступления беременности.
4. В течение индуцированного цикла происходит снижение уровня АМГ в преовуляторном периоде, причем это снижение не зависит от применяемого протокола стимуляции. Концентрация АМГ в фолликулярной жидкости коррелирует с таковой в периферической крови и с числом полученных ооцитов. Уровни ЛГ в фолликулярной жидкости не отражают количества и качества полученных ооцитов.
Личный вклад автора в проведенное исследование
Лично автором проведено клинико-анамнестическое, лабораторное инструментальное обследование, забор и анализ биологического материала, статистическая обработка полученных данных у 225 инфертильных женщин, проходивших лечение бесплодия в программе ЭКО. Исследована диагностическая значимость уровней гормонов в периферической крови и фолликулярной жидкости при стимуляции яичников в программах ЭКО. На основании проведенного многогранного исследования автор предлагает алгоритм выбора схемы стимуляции для пациенток с бесплодием в зависимости от состояния овариального резерва и уровня ЛГ, определяемого на 6–7 день стимуляции в периферической крови.
Апробация работы
Апробация диссертации была проведена на заседании кафедры акушерства, гинекологии, перинатологии и репродуктологии ФППО врачей ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздравсоцразвития России от 29 ноября 2011 г.
Внедрение результатов работы в практику
Результаты исследования внедрены в клиническую практику отделения сохранения и восстановления репродуктивной функции ФГБУ «НЦ АГ и П им. академика В.И. Кулакова» Минздравсоцразвития России. Материалы работы используются для практических занятий и лекций со слушателями семинаров ФГБУ «НЦ АГ и П им. академика В.И. Кулакова» Минздравсоцразвития России, аспирантами и клиническими ординаторами. По теме диссертации опубликовано 7 научных работ, из них 3 — по перечню ВАК РФ.
Структура и объем диссертации
Диссертация состоит из введения, 4 глав, выводов, практических рекомендаций и списка литературы. Работа изложена на 145 страницах машинописного текста, содержит 19 таблиц и 14 рисунков. Библиографический указатель содержит 170 источников, из них 28 отечественных и 142 иностранных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Для достижения цели исследования и поставленных задач проведено комплексное клинико-лабораторное обследование 225 женщин с различными формами бесплодия, поступивших в отделение сохранения и восстановления репродуктивной функции ФГБУ «НЦ АГиП им. В.И. Кулакова» Минздравсоцразвития России в период с 2006 по 2010 гг.
1-ю группу исследования составили 103 пациентки в возрасте от 21 до 37 лет (средний возраст 32,0±4,1 лет), которым проводили стимуляцию овуляции препаратом рФСГ; 2-ю группу исследования составили 60 женщин в возрасте от 24 до 40 лет (средний возраст 34,2±4,0 лет), у которых в качестве индуктора использовали препарат ЧМГ; 3-ю группу исследования составили 62 женщины в возрасте от 25 до 45 лет (средний возраст 34,0±4,6 лет), которым стимуляцию суперовуляции проводили с помощью сочетанного введения рФСГ и ЧМГ.
Индуктор вводили со 2–4 дня менструального цикла внутримышечно или подкожно один раз в день в одно и то же время суток в индивидуально подбираемых дозах. Начальную дозу индуктора назначали исходя из состояния овариального резерва пациенток. Затем с 5 дня стимуляции производили коррекцию дозы в зависимости от ответа яичников, который определялся по уровню Е2 и результатам УЗИ. Введение ЧМГ в 3-й группе начинали на этапе финального созревания фолликулов на 6–8 день стимуляции на фоне продолжающегося введения рФСГ вплоть до введения ХГЧ. При этом снижали ежедневную дозу вводимого рФСГ на 75–150 МЕ и добавляли 1–2 ампулы (75–150 МЕ) ЧМГ. Аналоги ГнРГ применяли в рамках «длинного» протокола с аГн-РГ и протокола с антГн-РГ.
Всем женщинам, вошедшим в исследование, проведены следующие методы обследования:
I. Общеклинические: сбор анамнеза, общий и гинекологический осмотры.
II. Оценивали состояние овариального резерва общепринятыми методами исследования: гормональное обследование включало определение в сыворотке крови уровней лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), антимюллерового гормона (АМГ), эстрадиола (Е2); ультразвуковое исследование объема яичников и количества антральных фолликулов в них.
IІІ. Стимуляция функции яичников в программе ЭКО.
ІV. Оценка качества ооцитов и эмбрионов по существующим международным критериям.
V. Исследование гормонов АМГ, ЛГ и Е2 в фолликулярной жидкости.
VІ. В работе были применены следующие статистические методы обработки данных: критерий Шапиро–Уилка для проверки на нормальность распределений; критерий 2 для таблиц сопряженности признаков 2х2 и 2х3 в том числе с использованием поправки; однофакторный дисперсионный анализ; сравнительный анализ переменных с помощью непараметрического критерия Вилкоксона, Круаскала-УоллисаМанна–Уитни; сравнительный анализ средних тенденций с помощью t-критерия Стьюдента для несвязанных совокупностей; ранговый корреляционный анализ Спирмена и Пирсона. Для автоматизации статистической обработки использовали статистический пакет «Statistica for Windows v.7.0».
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
И ИХ ОБСУЖДЕНИЕ
Анализ данных клинико-анамнестического, гормонального и ультразвукового обследований выявил, что в исследуемую группу больных вошли соматически здоровые женщины репродуктивного возраста от 21 до 45 лет (средний возраст 33,1±4,3 лет) преимущественно с трубно-перитонеальным фактором бесплодия (43,1%), отягощенным гинекологическим анамнезом и не имеющие противопоказаний к проведению программы ЭКО.
Исследование уровней АМГ в плазме крови позволил заключить, что у обследованных пациенток его средние значения были в пределах нормы, тем не менее, показатели АМГ колебались от 0,1 нг/мл до 9,8 нмоль/л, что отражало возраст и различное состояние овариального резерва пациенток, включенных в исследование. Тоже самое было продемонстрировано в уровне ФСГ, который был в пределах от 2,5 МЕ/л до 12 МЕ/л. Таким образом, несмотря на то, что средние значения укладывались в параметры нормы для фертильных женщин, ключевые показатели АМГ, ФСГ и количество антральных фолликулов колебались от значений низкого овариального резерва до избыточного.
Средняя длительность бесплодия у пациенток, вошедших в исследование, была равна 7,1±4,2 лет. В течение этого времени женщины в зависимости от генеза бесплодия получали консервативную терапию и хирургическое лечение, однако беременность наступила лишь у 17 женщин, а родили только две из них.
На следующем этапе исследования пациентки в зависимости от применяемого индуктора были разделены на 3 группы, которые подверглись сравнительному анализу клинико-анамнестических характеристик, не выявившему различий в возрасте, длительности и характере менструального цикла, гормональных показателях. Тем не менее, доля пациенток более молодого возраста (< 35 лет) с лучшими показателями овариального резерва оказалась несколько большей в группе с применением рФСГ. Так, меньше 5 антральных фолликулов в яичниках было обнаружено у 7 (6,8%) женщин 1-й группы, у 12 (20%) пациенток 2-й группы и у 11 (17,7%) пациенток 3-й группы соответственно. Тогда как 10 и более антральных фолликулов визуализировались у 70 (68%) пациенток 1-й группы, лишь у 20 (35%) пациенток 2-й группы и у 23 (37%) пациенток 3-й группы. Те же особенности выявлены при индивидуальном исследовании уровней ФСГ и АМГ, средние значения которых достоверно не отличались по группам. Однако пациенток, имеющих уровень ФСГ в пределах 9–12 МЕ/л, АМГ – 1,0 нг/мл и меньше, в 1-й группе оказалось лишь 12, тогда как во 2-й – 23, а в 3-й – 25 женщин. Высокие концентрации АМГ были зарегистрированы у 21 (20,4%) пациенток 1-й группы, 15 (25%) женщин 2-й группы, и у 4 (6,5%) 3-й группы.
Это свидетельствует о том, что хотя выбор схемы стимуляции суперовуляции производился произвольно, тем не менее, врачи предпочитают использовать рФСГ в качестве индуктора овуляции у молодых женщин с нормальными параметрами овариального резерва, что является общепринятой тенденцией.
Согласно поставленным задачам работы были изучены особенности ответной реакции яичников на стимуляцию суперовуляции в программе ЭКО и ПЭ, количество и качество ооцитов и эмбрионов при использовании трех схем лечения. В группе с монотерапией рФСГ начальная доза вводимого гонадотропина составила в среднем 224,8±55,6 МЕ, длительность стимуляции 10,6±1,7 дней, и доза гонадотропина на курс лечения – 2186,2±572,4 МЕ. Все эти показатели были сопоставимы с аналогичными параметрами во 2-й группе (230,0±47,6 МЕ, 10,7±2,1 дней и 2283,1±570,5 МЕ). Количество дней стимуляции (11,4±2,1 дней) и среднее количество индукторов, затраченных на стимуляцию (2264±785,8 МЕ рФСГ + 637,5±520,4 МЕ ЧМГ) в 3-й группе превышало таковые при стимуляции в 1-й и 2-й группах, что, скорее всего, связано с дополнительным назначением ЧМГ без отмены введения рФСГ. Таким образом, пациентки, получающие комбинацию рФСГ и ЧМГ для стимуляции суперовуляции, несут относительно большую лекарственную нагрузку.
В литературе описаны схемы с назначением ЛГ-содержащих препаратов на рзличных этапах стимуляции, а также после отмены и на фоне рФСГ. Мы посчитали возможным начать введение ЧМГ на фоне продолжающегося введения рФСГ. Тем не менее, доза рФСГ нами была уменьшена. Средняя продолжительность применения препарата, содержащего ЛГ, составила 3,9±0,6 дня.
Несмотря на то, что в группе рФСГ нами было зарегистрировано большее количество растущих фолликулов, они были представлены фолликулами разного размера, тогда как на момент введения триггера овуляции во 2-й и 3-й группах преовуляторные фолликулы оказались более однородными. Толщина эндометрия в день введения триггера не различалась в исследуемых группах (табл. 1).
Таблица 1.
Сравнительная оценка фолликулогенеза-и уровня гормонов при стимуляции суперовуляции пациенток трех групп
| Показатель Число циклов | 1-я группа (n=103) | 2-я группа (n=60) | 3-я группа (n=62) |
| Число фолликулов, на 5-й день стимуляции 10 мм 11–14мм | 6,5±4,1 4,2±3,9 | 3,5±1,2* 2,4±1,3* | 5,3±1,2 2,4±1,5* |
| Толщина эндометрия на 5-й день стимуляции, мм | 7,0±1,0 | 6,3±1,3 | 6,4±0,9 |
| Уровень ЛГ на 5–7-й день стимуляции, МЕ/л | 2,0±2,5 | 3,1±2,8* | 1,9±1,3** |
| Уровень Е2 на 5–7-й день стимуляции, пкмоль/л | 2440,8±4251 | 1278,7±1247,7 | 1568,4±2074,6 |
| Число фолликулов в день введения чХГ 18 мм 14–17 мм | 9,8±5,9 4,9±4,1 | 5,4±4,3* 1,8±1,0* | 6,8±3,9* 3,0±2,2* |
| Толщина эндометрия в день введения ХГ, мм | 10,5±1,1 | 10,4±0,8 | 10,7±1,0 |
| Преовуляторный уровень ЛГ, МЕ/л | 1,6±0,8 | 4,3±6,2* | 4,6±5,4* |
| Преовуляторный уровень Е2, пкмоль/л | 9237,8±12347,6 | 7506,6±7863,8 | 6174,7±4342,3 |
*р<0,05 статистически значимые различия по сравнению с 1-й группой;
**р<0,05 статистически значимые различия по сравнению со 2-й группой.
Сравнительный анализ аспектов эмбриологического этапа, проведенного у пациенток трех групп (225 цикла), выявил достоверно большее число аспирированных фолликулов в группе с применением рФСГ. Тем не менее, частота получения ооцита из фолликула была выше в группе с сочетанным применением рФСГ и ЧМГ и составила 80,5%, тогда как 1-й группе 71,7%, а во 2-й группе 75,5%. Этот факт может являться свидетельством того, что пул преовуляторных фолликулов во 2-й и в 3-й группе был более однородным, чем у женщин 1-й группы, у которых при большом числе преовуляторных фолликулов, значительная часть из них были незрелыми. Несмотря на большее количество полученных ооцитов в группе с применением рФСГ, доля зрелых ооцитов из общего числа полученных была выше в группе ЧМГ и сочетанием рФСГ и ЧМГ и составила 77%, 80,3% и 85% для трех групп соответственно. Более того, доля эмбрионов хорошего качества из общего числа полученных эмбрионов оказалась меньше в 1-й группе (87%), чем во 2-й – 90,5% и 3-й – 93,8%. (рис. 1).

* достоверно значимые различия с 1-й группой (р<0,05);
** достоверно значимые различия с 2-й группой (р<0,05).
Рис. 1. Сравнительная характеристика фолликуло-, оо- и эмбриогенеза в различных группах исследования.
Перенос на 3-й день культивирования был произведен у 72 пациенток в 1-й группе, 45 во 2-й группе и у 48 пациенток 3-й группы. Число перенесенных эмбрионов не различалось в трех группах и составило 2,1±0,5, 2,2±0,7 и 2,2±0,6 эмбрионов соответственно. Максимальная стадия развития перенесенных эмбрионов в трех группах составила 6,6±1,6, 6,3±1,4 и 6,8±1,6 бластомеров соответственно. Перенос на 5-е сутки культивирования осуществляли в 63 случаях в 1-й группе, в 22 во 2-й и в 33 случаях в 3-й группе.
Применение комбинации рФСГ+ЧМГ сопровождалось развитием бедного ответа яичников на гонадотропины в 37%, т.е. реже, чем при использовании только ЧМГ (45%), но чаще, чем при назначении рФСГ (22,3%) p<0,05. В то же время частота развития СГЯ также была достоверно выше (14,5%) в 1-й группе, чем у пациенток 2-й и 3-й групп (5 и 3,2% соответственно), p<0,05. Частота наступления беременности в 1-й и 3-й группах не различалась и составила 30 и 30,6% соответственно, что достоверно превысило процент наступления беременности в 2-й группе (16,6%), p<0,05.
Распределение пациенток исследуемых групп по состоянию овариального резерва представлено на рисунке 2.
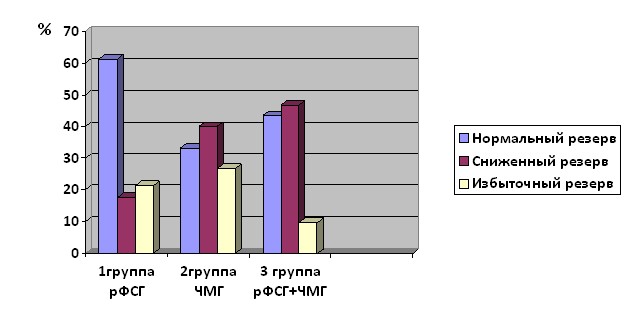 Рис. 2. Распределение пациенток в группах исследования в зависимости от состояния овариального резерва.
Рис. 2. Распределение пациенток в группах исследования в зависимости от состояния овариального резерва.
Так как состояние овариального резерва является основополагающим в прогнозировании ответа яичников на стимуляцию суперовуляции, на следующем этапе исследования мы выделили группы женщин с нормальными показателями овариального резерва (n=110), со сниженным резервом (n=71), и с высокими показателями резерва яичников (n=44). При анализе параметров индуцированного цикла у пациенток с нормальным овариальным резервом достоверных отличий при использовании 3-х протоколов лечения не выявлено, хотя количество фолликулов в группах с рФСГ (11,1±4,8) и сочетанием ГТ (10,7±4,8) не различалось, но было выше, чем в группе ЧМГ (8,8±3,5). Число полученных ооцитов также преобладало в группах рФСГ (8,5±4,2) и рФСГ+ЧМГ (8,5±3,9). При сравнении числа полученных эмбрионов выявлено их большее число в группе с применением комбинации рФСГ и ЧМГ, однако эти различия с группой рФСГ не достигли достоверного уровня.
При анализе параметров индуцированного цикла у пациенток со сниженным овариальным резервом было аспирировано больше фолликулов (6,4±3,8) в группе с применением рФСГ по сравнению с другими группами (3,9±1 и 4,9±2,8), в то время как количество полученных ооцитов при стимуляции одним рФСГ (3,7±2,0) и комбинацией рФСГ и ЧМГ (3,7±2,4) было одинаковым и достоверно превышало аналогичный показатель при стимуляции ЧМГ (2,2±1,4). Из чего можно сделать вывод, что процент получения ооцита из фолликула был наиболее высоким в группе с добавлением ЧМГ. Сравнительный анализ качества полученных ооцитов также показал наличие большего числа зрелых ооцитов в группе с добавлением ЧМГ (3,4±2,3), по сравнению с группой рФСГ (3,2±1,5) и группой ЧМГ (2,0±1,0).
Группа пациенток с избыточным резервом была также подвергнута сравнительному анализу. Несмотря на то, что число полученных фолликулов было достоверно больше в группе с монотерапией рФСГ 21,8±11,2, а во 2-й и 3-й не отличалось (13,6±7,0 и 14,2±3,1), процент получения ооцита из фолликула был ниже в 1-й группе (74,4%) по сравнению со 2-й и 3-й группами ( 80,1 и 84,5%).
Следует отметить, что гораздо меньшее число полученных ооцитов по сравнению с количеством аспирированных фолликулов говорит о том, что при стимуляции рФСГ в рост, вероятно, вступают и малые антральные фолликулы, которые не способны дать полноценный по своему качеству ооцит.
Оценка эффективности проведенных циклов индукции овуляции с применением трех схем у пациенток с различным состоянием овариального резерва, проведенная на основании числа наступивших беременностей представлена на рисунке 3.
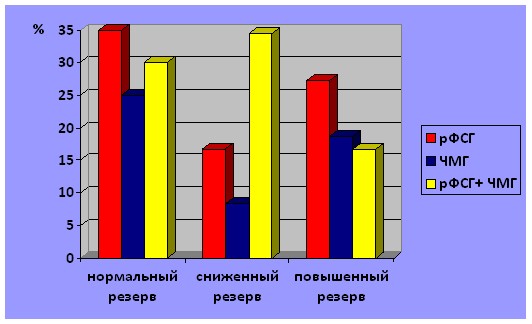
Рис. 3. Сравнительная оценка частоты наступления беременности при применении трех протоколов в зависимости от состояния овариального резерва.
Из 60 беременностей, наступивших в трех группах исследования, 35 (58,3%) наступили у пациенток с нормальным овариальным резервом, 15 (25%) — с повышенными показателями овариального резерва и 10 (16,7%) — со сниженным резервом.
Следует отметить, что в нашем исследовании не было достоверных различий по частоте наступления беременности в группе с нормальным овариальным резервом при использовании трех схем стимуляции (35%, 25% и 30%), что, возможно, свидетельствует о нецелесообразности применения дополнительной ЛГ-терапии у данного контингента пациенток. Частота наступления беременности была достоверно выше в группе с применением комбинации рФСГ и ЧМГ (34,5%) у пациенток со сниженными параметрами овариального резерва. Несмотря на более высокий процент наступления беременности при стимуляции рФСГ (27,3%) у пациенток с повышенными показателями овариального резерва, частота развития СГЯ в этой группе была выше (45,5%), чем во 2-й (18,8%) и 3-й (16,6%) группах.
Результаты данного этапа исследования позволяют считать, что у пациенток старшего репродуктивного возраста, которые составляют основную часть женщин с низкими показателями овариального резерва, и как следствие, с риском бедного ответа, более оправдано добавление препаратов с ЛГ активностью на финальных этапах фолликулогенеза.
Во всех группах исследования в программе ЭКО производили оценку гормонального статуса периферической крови и фолликулярной жидкости, полученной при трансвагинальной пункции яичников.
Уровни ЛГ на 6–7 день стимуляции составили в 1-й группе – 2,0±2,5 МЕ/л, во 2-й группе 3,1±2,8 МЕ/л, в 3-й группе – 1,9±1,3 МЕ/л. Нами отмечено явное снижение уровня ЛГ на 6—7 день введения индуктора по сравнению с его исходными значениями во всех группах исследования. Ко дню введения триггера уровень ЛГ оказался низким только в 1-й группе, в двух остальных, где имело место введение препаратов с ЛГ активностью, преовуляторный ЛГ не только не остался на том же уровне, но даже повысился (рис. 4). Таким образом, фолликулогенез в поздней фолликулярной фазе при использовании рФСГ проходил в условиях низких уровней ЛГ, что, по мнению большинства авторов, неблагоприятно сказывается на созревании фолликулов и, как следствие, яйцеклеток.
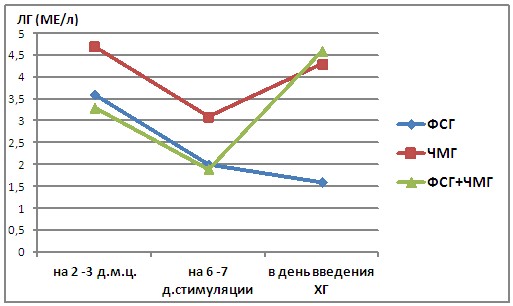
Рис. 4. Динамика ЛГ в течение индуцированного цикла при проведении 3-х схем стимуляции.
На фоне десенситизации гипоталамо-гипофизарно-яичниковой системы при использовании длинного протокола с агонистами Гн-РГ, базальные значения ФСГ и ЛГ снизились до 4,8±1,7 МЕ/л и 2,5±1,4 МЕ/л, соответственно. При сравнении уровней ЛГ на 2–3-й день менструального цикла у пациенток в протоколах с ант-ГнРГ базальные уровни ЛГ были значительно выше (5,5±2,6 МЕ/л), чем при применении а-Гн-РГ (2,5±1,4 МЕ/л). Тем не менее, во всех случаях имело место снижение ЛГ на 6–7 день стимуляции приблизительно в 1,5 раза. Следовательно, независимо от использования того или другого аналога Гн-РГ, динамика концентраций ЛГ в процессе индуцированного цикла имеет четко обозначенные закономерности: снижение концентрации на 6–7 день стимуляции по сравнению с исходными значениями. Причем такая же динамика уровня ЛГ имела место и при всех типах овариального резерва.
По мнению ряда авторов, падение уровня ЛГ ниже определенного значения неблагоприятно отражается на фолликуло- и оогенезе. С целью проверки этой гипотезы мы оценили некоторые параметры фолликуло- и оогенеза в зависимости от уровня ЛГ, сравнив уровень гормона на 6–7 день стимуляции с числом и качеством полученных ооцитов (рис. 5).
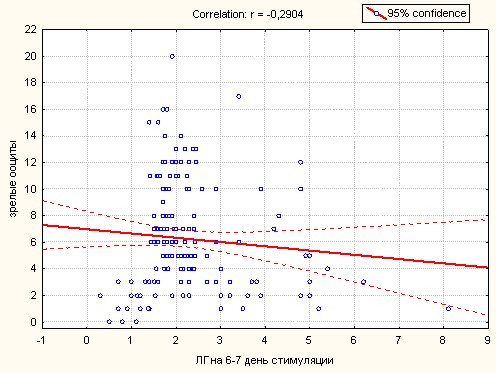
Рис. 5. Корреляционная зависимость уровня ЛГ на 6–7 день стимуляции и качества полученных ооцитов.
При индивидуальном исследовании уровня ЛГ на 6–7 день стимуляции, используя метод ранговой корреляции Спирмена (R=0,42) было показано, что оптимальными для оогенеза являются значения гормона от 1,5 до 2,5 МЕ/л при любом типе резерва. Более того, уровни гормона ниже 1,5 МЕ/л ассоциированы с малым числом и плохим качеством полученных ооцитов, тогда как при значениях ЛГ выше 2,5 МЕ/л страдает качество ооцитов, но не их число. Так, при снижении ЛГ ниже 1,5 МЕ/л, что наблюдалось в группе с монотерапией рФСГ, процент потери ооцитов при пункции у пациенток был высок, а доля полученных ооцитов хорошего качества была ниже.
Таким образом, уровень ЛГ на 6–7 день стимуляции может служить критерием отбора женщин для выделения группы, которой целесообразно назначение ЛГ-содержащих препаратов на стадии финального созревания ооцитов.
Базальный уровень АМГ также оказался выше у пациенток с большим количеством аспирированных фолликулов. В день введения триггера овуляции уровень АМГ снижался по сравнению с исходным у больных всех групп исследования. Причем относительно исходных уровней АМГ это снижение оказалось одинаковым (в 1,9 раза). Такая тенденция была выявлена во всех группах и не зависела ни от протокола стимуляции, ни от применяемого гонадотропина, ни от состояния овариального резерва. Вероятно, снижение концентрации АМГ в преовуляторный период связано с включением в рост малых антральных фолликулов, которые продуцируют АМГ.
Динамика уровней Е2 отражала число растущих, преовуляторных фолликулов и полученных ооцитов.
В работе проведено исследование гормонов в смешанной фолликулярной жидкости, полученной при трансвагинальной пункции всех аспирированных фолликулов (ФЖ). Определяли уровни ЛГ, эстрадиола и АМГ. Значения сравнивали с таковыми в периферической крови и сопоставляли с числом и качеством полученных ооцитов и эмбрионов (табл. 2)
Следует отметить, что уровни Е2 в фолликулярной жидкости были на порядок выше, чем в периферической крови, но не отражали ни число пунктированных фолликулов и полученных ооцитов, ни их качество. Соответственно этому уровни Е2 не коррелировали с таковыми в периферической крови в цикле стимуляции.
Таблица 2.
Сравнительный анализ уровней гормонов в периферической крови и
фолликулярной жидкости в цикле стимуляции
| Параметры | 1-я группа рФСГ | 2-я группа ЧМГ | 3-я группа рФСГ+ЧМГ | |
| Аспирировано фолликулов | 12,7±8,3 | 8,1±5,8* | 8,3±5,1* | |
| Получено ооцитов | 9,1±5,7 | 6,1±4,7* | 6,7±4,3* | |
| Количество зрелых ооцитов | 7,0±4,0 | 4,9±3,4* | 5,7±3,5* | |
| Количество эмбрионов хорошего качества | 6,0±3,5 | 4,3±2,8* | 5,2±3,2 | |
| Периферическая кровь | ||||
| Уровень Е2 пмоль/л на 6–7 день стимуляции | 2440,8±4251 | 1278,7±1247,7* | 1568,4±2074,6 | |
| Уровень Е2 пмоль/л в день введения ХГ | 9237,8±12347,6 | 7506,6±7863,8 | 6174,7±4342,3 | |
| Уровень ЛГ нмоль/л на 6–7 день стимуляции | 2,0±2,5 | 3,1±2,8* | 1,9±1,3** | |
| Уровень ЛГ нмоль/л в день введения ХГ | 1,6±0,8 | 4,3±6,2* | 4,6±5,4* | |
| Базальный уровень АМГ нг/мл | 2,9±2,3 | 2,3±1,8 | 1,8±1,8* | |
| Уровень АМГ в день введения ХГ | 1,5±1,5 | 1,3±2,0 | 1,0±0,6 | |
| Фолликулярная жидкость | ||||
| Эстрадиол пмоль/л | 1113732,5± 959823,74 | 902040,75± 990651,36 | 1004595,38± 829249,81 | |
| ЛГ | 1,3±0,8 | 2,0±0,8* | 2,1±3,3* | |
| АМГ нг/мл | 3,9±3,0 | 3,6 ±2,6 | 3,5±2,2 | |
*р<0,05 достоверные различия с 1-й группой;
**р<0,05 достоверные различия со 2-й группой.
Таким образом, можно предположить, что секреция этих гормонов в фолликуле происходит автономно и регулируется внутрифолликулярными факторами, которые, по всей вероятности, вырабатываются клетками гранулезы, секреторная активность которых обеспечивает гормональный уровень внутрифолликулярного окружения.
Уровень АМГ в фолликулярной жидкости положительно коррелировал с базальным и преовуляторным уровнем этого гормона в периферической крови.
Выявлена корреляционная зависимость между концентрациями ЛГ в периферической крови с таковыми в ФЖ (R=0,38). Тем не менее полученные данные не продемонстрировали зависимость между уровнем ЛГ в фолликулярной жидкости и числом антральных, аспирированных фолликулов, полученных ооцитов и ооцитов хорошего качества (R=0,22).
Корреляционная зависимость между уровнями гормонов в периферической крови в цикле стимуляции и ФЖ представлены в таблице 3.
Таблица 3.
Корреляционная зависимость между уровням гормонов в ФЖ и
периферической крови и показателями фолликуло- и оогенеза
| Показатели | ЛГ, коэффиициент ранговой корреляции Спирмена (R) | АМГ, коэффиициент ранговой корреляции Спирмена (R) | Эстрадиол, коэффиициент ранговой корреляции Спирмена (R) | P |
| Уровень гормона в периферической крови | 0,38 | 0,66 | 0,19 | p<0,05 |
| Количество аспирированных фолликулов | 0,24 | 0,35 | 0,14 | p<0,05 |
| Количество полученных ооцитов | 0,21 | 0,36 | 0,23 | p<0,05 |
| Количество зрелых ооцитов | 0,22 | 0,36 | 0,26 | p<0,05 |
Таким образом, в отличие от эстрадиола и ЛГ, уровень АМГ коррелировал с исходным состоянием овариального резерва, уровнем АМГ в периферической крови, числом пунктированных фолликулов и полученных ооцитов.
Несмотря на достаточно широкий спектр гормонов, исследуемых в фолликулярной жидкости и попытки сравнить их уровни с множеством факторов (концентрация в периферической крови, количество пунктированных фолликулов, число и качество полученных ооцитов), нам не удалось выяснить значимость этих исследований в прогнозе результатов программы ЭКО. Представляет интерес факт обнаружения корреляции между уровнями АМГ в периферической крови и фолликулярной жидкости с числом и качеством полученных ооцитов. Представленные данные могут явиться поводом для дальнейших исследований роли АМГ в прогнозе исхода программ ВРТ.
Таким образом, проведенное исследование продемонстрировало различия в динамике фолликулогенеза индуцированного цикла как в зависимости от используемого индуктора, так и от состояния овариального резерва пациентки. При использовании ФСГ-содержащих препаратов число растущих, преовуляторных и пунктированных фолликулов оказалось большим, чем в протоколах с ЧМГ и с добавлением к рФСГ ЧМГ на финальных этапах фолликулогенеза. Однако соотношение числа пунктированных фолликулов к числу полученных ооцитов хорошего качества было лучшим в группах с ЧМГ и его добавлении к рФСГ.
Была установлена общая закономерность динамики уровня ЛГ в течение индуцированного цикла, заключающаяся в снижении его концентраций на 6–7 день стимуляции, причем этот факт не зависел от характера вводимого индуктора, типа овариального резерва пациентки и применения того или иного аналога Гн-РГ. Снижение уровня ЛГ в этой точке ниже значений 1,5 МЕ/л без дополнительного экзогенного введения ЛГ ассоциировано с худшими результатами лечения.
Было показано, что при нормальных показателях овариального резерва результаты лечения по частоте наступления беременности принципиально не различаются в зависимости от применяемого индуктора, тогда как при сниженном резерве добавление ЛГ на финальных этапах фолликулогенеза улучшает результаты лечения, за счет увеличения числа и улучшения качества ооцитов. При высоких показателях овариального резерва за счет атрезии мелких фолликулов улучшается качество полученных ооцитов и снижается риск развития СГЯ.
Исследование динамики АМГ в течение индуцированного цикла продемонстрировало снижение его концентраций в преовуляторный период по сравнению с исходными значениями. Причем это не зависило от используемого протокола лечения, а определилось степенью гиперстимуляции яичников.
Полученные данные позволили разработать алгоритм ведения пациенток с функциональным бесплодием.

ВЫВОДЫ
1. Динамика фолликулогенеза при применении 3-х протоколов стимуляции яичников имеет различия, заключающиеся в том, что при использовании рФСГ отмечается рост большего числа фолликулов, чем при назначении ЧМГ и рФСГ в сочетании с ЧМГ, но доля ооцитов хорошего качества от общего числа полученных оказалась выше в группах с ЧМГ и рФСГ с ЧМГ (80,3 и 85% соответственно).
2. Динамика уровней ЛГ в течение индуцированного цикла имеет определенную закономерность, заключающуюся в падении его концентрации на 6–7 день лечения в 1,5 раза по сравнению с исходными значениями. При этом снижение концентрации ЛГ происходит независимо от используемого индуктора, аналога Гн-РГ и состояния овариального резерва.
3. При стимуляции яичников препаратами ЧМГ или добавлении ЛГ-содержащих препаратов к рФСГ уровни ЛГ в преовуляторном периоде повышаются, что может способствовать оптимизации оогенеза и получению более качественных ооцитов.
4. Снижение уровня ЛГ в сыворотке крови пациенток на 6–7 день стимуляции ниже 1,5 МЕ/л предрасполагает к бедному ответу и плохому качеству ооцитов, что делает необходимым включение в схему лечения ЛГ-содержащих препаратов.
5. У пациенток с нормальными показателями овариального резерва исход лечения не зависит от выбранного индуктора, стимуляция только рФСГ достаточна для обеспечения адекватных параметров фолликулогенеза; при низких показателях овариального резерва добавление ЛГ-содержащих препаратов приводит к повышению частоты наступления беременности от 16,7% при использовании рФСГ до 34,5% при применении рФСГ с добавлением ЧМГ.
6. При высоких показателях овариального резерва и риске развития СГЯ добавление ЛГ на 6–7 день стимуляции приводит к атрезии мелких фолликулов, что снижает степень выраженности гиперстимуляции яичников от 45,5% (рФСГ), 18,8% (ЧМГ) до 16,6% (рФСГ+ЧМГ) соответственно.
7. В течение индуцированного цикла при любом протоколе лечения происходит снижение уровня АМГ по сравнению с исходными значениями в 1,9 раза. При этом концентрация АМГ в фолликулярной жидкости коррелирует с таковой в периферической крови.
8. Уровни Е2 и ЛГ в фолликулярной жидкости не ассоциированы с числом и качеством получаемых ооцитов.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Перед проведением программ ЭКО необходимо оценить состояние овариального резерва у всех пациенток, с целью предварительного выбора протокола лечения и дозы вводимого индуктора.
2. У женщин с нормальными показателями овариального резерва стимуляцию яичников как в длинном протоколе с аГн-РГ, так и в протоколе с антГн-РГ целесообразно проводить рФСГ в дозах от 150 МЕ до 225 МЕ в сутки.
3. При обнаружении при УЗИ на 6–7 день стимуляции у женщин с нормальным состоянием овариального резерва тенденции к развитию СГЯ, характеризующуюся наличием >15 разнокалиберных фолликулов в каждом яичнике, целесообразно включить в протокол стимуляции ЧМГ с целью атрезии мелких фолликулов и обеспечения адекватного роста доминантных, при этом доза рФСГ может быть уменьшена.
4. Пациенткам с низкими показателями овариального резерва или же при слабом ответе яичников на 6–7 день стимуляции целесообразно исследовать уровень ЛГ в плазме крови; при значениях ЛГ ниже 1,5 МЕ/л рекомендуется добавить в схему стимуляции ЛГ содержащие препараты в дозе 150 МЕ, при этом дозу вводимого ранее рФСГ оставить на прежнем уровне.
5. У пациенток с высокими показателями овариального резерва и риском гиперстимуляции яичников целесообразно использовать препараты с ЛГ-активностью для атрезии мелких фолликулов и предотвращения развития СГЯ. При этом ЛГ-содержащий препарат можно добавить на 6–7 день стимуляции в дозе 75 МЕ на фоне продолжающегося введения рФСГ в дозе 150 МЕ, либо отменить рФСГ и назначить ЧМГ в дозе 150 МЕ.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Назаренко Т.А., Мишиева Н.Г., Абубакиров А.Н., Мамедова Н.Р. Оценка лютеинизирующего гормона в течение индуцированного цикла //Материалы 2-го международного конгресса по репродуктивной медицине «Репродуктивное здоровье семьи». – М., 2008. – С. 342.
2. Ускова М.А., Кузьмичев Л.Н., Абубакиров А.Н., Мамедова Н.Р. Особенности программы ЭКО и ПЭ у женщин с оперативными вмешательствами на маточных трубах // Материалы XVII Российского национального конгресса «Человек и лекарство». – М., 2010. – С. 280.
3. Ускова М.А., Кузьмичев Л.Н., Абубакиров А.Н., Мамедова Н.Р. Роль антимюллерова гормона в оценке овариального резерва у женщин с повторными опетивными вмешательствами на маточных трубах // Материалы IV Международного конгресса по репродуктивной медицине. – М., 2010. – С. 48–49.
4. Назаренко Т.А., Мамедова Н.Р. Повышение эффективности лечения путем назначения ЛГ-содержащих гонадотропинов на стадии финального созревания фолликулов в циклах стимуляции овуляции //Антибиотики и химиотерапия. – 2009. – Т.54. – 3–4 Спецвыпуск – С. 59–60.
5. Назаренко Т.А., Дмитриев Д.В., Мамедова Н.Р., Дуринян. Э.Р. Опыт использования модифицированных схем стимуляции яичников для предотвращения синдрома гиперстимуляции яичников в программах вспомогательных репродуктивных технологий // Акушерство и гинекология. – 2010. – №5. – С. 63–67 (перечень ВАК).
6 Мамедова Н.Р., Назаренко Т.А., Монахова И.В. Препараты, содержащие тютеинизирующий гормон, в программах ВРТ (обзор литературы) // Проблемы репродукции. – 2011. – Т.17. – №3. – С. 50–55 (перечень ВАК).
7. Назаренко Т.А., Мамедова Н.Р., Дмитриев Д.В. Использование «малых» доз хорионического гонадотропина человека и препаратов лютеинизирующего гормона на этапе финального созревания овоцитов в программах вспомогательных репродуктивных технологий // Российский вестник акушера-гинеколога. – 2011. – Т.11. – №5. – С. 8–11 (перечень ВАК).

