Заместительная гормонотерапия в климактерии: различные пути введения гормонов
На правах рукописи
ХОЕЦЯН СЮЗИ РАФИКИ
ЗАМЕСТИТЕЛЬНАЯ ГОРМОНОТЕРАПИЯ В КЛИМАКТЕРИИ: РАЗЛИЧНЫЕ ПУТИ ВВЕДЕНИЯ ГОРМОНОВ
14.00.01 – Акушерство и гинекология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2008
Работа выполнена в отделении гинекологической эндокринологии
ФГУ «Научный центр акушерства, гинекологии и перинатологии
имени академика В.И. Кулакова Росмедтехнологий»
Научный руководитель:
доктор медицинских наук ЗАЙДИЕВА
Янсият Зайдилаевна
Официальные оппоненты:
доктор медицинских наук, СЕРЕБРЕННИКОВА
профессор Клара Георгиевна
доктор медицинских наук ГАСПАРЯН
Надежда Дмитриевна
Ведущее учреждение:
ГОУ ВПО «Российский государственный медицинский университет»
Защита диссертации состоится «__»_______2008г. в ___ ч.
на заседании диссертационного совета Д 208.048.01 при ГУЗ «Московский областной научно-исследовательский институт акушерства и гинекологии» (101000, Москва, ул. Покровка, д.22а).
С диссертацией можно ознакомиться в библиотеке ГУЗ «Московский областной научно-исследовательский институт акушерства и гинекологии».
Автореферат разослан «__»_________2008г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор О.Ф. Серова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Около 10% населения планеты в настоящее время составляют женщины в климактерии, средняя продолжительность жизни которых в Европе превышает 80 лет. В связи с этим в современном обществе растет интерес к проблемам здоровья женщин старшей возрастной группы. Проблема сохранения здоровья женщин в климактерии является предметом всестороннего обсуждения в течение последних лет и в настоящее время вызывает большой интерес врачей различных специальностей – гинекологов, эндокринологов, кардиологов, урологов и др. Это обусловлено многогранным влиянием половых гормонов на организм женщины.
Заместительная гормонотерапия (ГТ) различными аналогами половых стероидных гормонов, при отсутствии к ней противопоказаний, относится к первой линии терапии и профилактики климактерических расстройств, возникающих на фоне биологического старения женского организма. Назначение ГТ определяется целью лечения, его преимуществами и возможными рисками с учетом причины и времени наступления менопаузы, характеристики симптомов, которые могут иметь воздействие на качество жизни и величиной исходного риска сердечно-сосудистых заболеваний, инсульта, СД, ВТЭ и других состояний у каждой конкретной женщины. В каждом конкретном случае подбор терапии осуществляется индивидуально, а основные акценты делаются не только на снижение дозы гормонов, но и пути их введения (Cметник В.П., 2006; Зайдиева Я.З., 2003; L. Patrise, 2000).
Это обусловлено тем, что у большинства женщин в постменопаузе имеются соматические заболевания, в частности, желудочно-кишечного тракта, печени, поджелудочной железы, гиперинсулинемия, артериальная гипертензия, нарушение системы гемостаза и высокий риск развития венозного тромбоза. Наличие этих заболеваний ограничивает возможности использования традиционных пероральных форм гормонотерапии у данной когорты женщин (Сметник В.П., 2006; IMS, 2007).
Различия эффектов оральных и парентеральных лекарственных средств на органном и системном уровне связаны с такими факторами, как «первичный пассаж через печень», уровень гормонов в крови, который достигается при определенном пути введения, и биологической активностью эстрогенных и прогестагенных компонентов, содержащихся в препаратах. Вопрос о преимуществах трансдермального пути введения по сравнению с оральным назначением гормонов у женщин в постменопаузе продолжает дискутироваться, поскольку все эстрогены, вне зависимости от пути введения, все же проходят через печень, вторично попадая в кровоток тонкого кишечника и печени. Однако некоторые клинические состояния диктуют необходимость использования трансдермального пути введения гормональных препаратов (Зайдиева Я.З., 2003; Uhler M.L. et al 1998; Bergeron C., Ferenczy A. 2001).
Однако на сегодняшний день накоплено недостаточно научных данных о долгосрочном влиянии, а также преимуществах и рисках при использовании парентерального пути введения гормонов для лечении эстрогендефицитных состояний у женщин в постменопаузе. Вместе с тем, несмотря на многолетний опыт использования ГТ в различных областях медицины, не изучены и не обоснованы клинические аспекты выборочного применения ГТ у больных с сопутствующими заболеваниями в постменопаузе. В связи с этим, представляется актуальной проведение сравнительной оценки эффективности и безопасности непрерывного комбинированного трансдермального режима гормонотерапии с препаратами для пероральной непрерывной гормонотерапии, содержащие аналогичные типы эстрогена и прогестагена, на климактерические расстройства у женщин в постменопаузе.
Цель исследования:
Сравнительная оценка влияния различных режимов гормонотерапии на системном (биохимические показатели печени, липидный спектр, система гемостаза) и органном (матка, эндометрий, молочные железы) уровнях у женщин с климактерическими расстройствами в постменопаузе.
Задачи исследования:
1. Провести сравнительную оценку клинической эффективности и переносимости препаратов ГТ, с учетом различных путей их метаболизма у женщин с КС в постменопаузе.
2. Оценить влияние различных доз ГТ при трансдермальном и пероральном путях введения на основные биохимические маркеры функции печени, липидный спектр крови и систему гемостаза.
3. Проанализировать частоту «кровотечений прорыва» на фоне различных типов гормонотерапии.
4. Изучить особенности морфофункционального состояния эндометрия и молочных желез на фоне лечения препаратами, используемыми перорально и трансдермально.
5. Обосновать индивидуализацию ГТ с учетом влияния различных режимов у женщин в постменопаузе.
Научная новизна
На основании комплексного системного подхода с использованием современных диагностических методов проведен сравнительный анализ эффективности и переносимости различных режимов (пероральный и трансдермальный) ГТ, содержащих стандартные и низкие дозы эстрогенов и прогестагенов, при лечении климактерических расстройств у женщин в постменопаузе.
Изучены и научно обоснованы различия воздействия препаратов ГТ при трансдермальном и пероральном пути введения на основные показатели функции печени, липидного профиля крови и систему гемостаза у женщин в постменопаузе. Дана сравнительная оценка возникновения «кровотечений прорыва» при лечении климактерических расстройств препаратами с содержанием различных доз эстрогенов и прогестагенов и разных путях их введения.
На основании объективных методов исследования проведено сопоставление динамики влияния гормонотерапии, содержащей одинаковые компоненты, но различные дозы эстрогенов и прогестагенов с учетом различных путей метаболизма гормонов на морфофункциональное состояние эндоцервикса и слизистой оболочки матки, и доказано отсутствие риска развития гипер – и неопластических процессов в эндометрии у женщин в постменопаузе.
По данным рентгенологического исследования изучена динамика состояния молочных желез на фоне различных режимов ГТ у женщин в постменопаузе, свидетельствующая об отсутствии негативного влияния ГТ, независимо от пути введения гормонов.
На основании комплексной оценки полученных результатов расширены показания для назначения трансдермальных форм гормональных препаратов женщинам, страдающим хроническими заболеваниями желудочно-печеночного комплекса, риском тромбоза.
Практическая значимость работы
В ходе проведения сравнительного анализа различных режимов ГТ доказано, что, несмотря на различия метаболизма гормонов в организме, как пероральные, так и трансдермальные препараты высокоэффективны при лечении климактерического синдрома, не повышают массу тела, обладают антипролиферативным эффектом в эндометрии, а также не оказывают отрицательного влияния на молочные железы при краткосрочном применении.
Установлено, что низкодозированная трансдермальная ГТ также эффективно, как и пероральные формы ГТ купирует симптомы КС, вызывает атрофию эндометрия, но оказывает меньшее влияние на биохимические показатели, липидный спектр крови и систему гемостаза, что делает возможным назначение данного режима ГТ пациенткам с сопутствующей соматической патологией и риском развития тромботических осложнений.
Анализ собственных данных о влиянии различных режимов гормонотерапии позволил определить оптимальный выбор современных, безопасных и эффективных препаратов, расширить использование гормональной терапии женщинам в постменопаузе с наличием соматической патологии.
Положения, выносимые на защиту:
1. Для лечения тяжелых проявлений КС у женщин в постменопаузе целесообразно назначение непрерывного режима гормонотерапии, содержащей стандартные дозы эстрогенов в комбинации с прогестагеном, которая независимо от пути введения (перорально или трансдермально), через 3 месяца эффективно купирует вазомоторные и психосоматические симптомы. Трансдермальный пластырь, содержащий низкие дозы гормонов, оказывает лечебный эффект через 6 месяцев применения.
2. В отличие от перорального режима, трансдермальный путь введения гормонов, стандартными или низкими дозами эстрогенов в комбинации с прогестагеном, не оказывает отрицательного эффекта на функцию печени и систему гемостаза, снижает атерогенный профиль липидов и уровень ТГ, не вызывая при этом негативного влияния на молочные железы.
3. У женщин в постменопаузе на фоне различных режимов ГТ в первые месяцы лечения наблюдаются маточные «кровотечения прорыва», которые достоверно чаще возникают при использовании трансдермального пластыря, содержащего стандартную дозу эстрогена. Частота «кровотечений прорыва» коррелирует с толщиной «маточного эха», в то время как взаимосвязи между указанными параметрами и морфофункциональным состоянием эндометрия не выявлено. К концу года ГТ у подавляющего большинства больных (92%, 95%, 80%) независимо от используемого режима выявлена атрофия эндометрия.
Апробация работы
Основные положения диссертации и результаты работы доложены на VI Российском Форуме «Мать и дитя» (Москва, 2004 г.), VII Российском Форуме «Мать и дитя» (Москва, 2005 г.), XII Российском Национальном Конгрессе «Человек и лекарство» (Москва, 2005 г.), международных конгрессах «Практическая гинекология: от новых возможностей к новой стратегии» (Москва, 2006 г.). Работа обсуждена на межклинической конференции сотрудников отделения гинекологической эндокринологии ФГУ «НЦ АГиП им. академика В.И. Кулакова Росмедтехнологий» 24.04.08г. и заседании апробационной комиссии ФГУ «НЦ АГиП им. академика В.И. Кулакова Росмедтехнологий» 02.06.08г.
Внедрение результатов исследования в практику
По теме диссертации опубликовано 8 печатных работ. Полученные результаты внедрены в практику работы отделения гинекологической эндокринологии и Федерального Центра «Здоровье женщин после 40 лет», функционирующего на базе ФГУ «Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Росмедтехнологий», использованы при чтении лекций акушерам-гинекологам и подготовки образовательных программ для врачей, проходящих обучение на базе Центра, а также семинарах по вопросам климактерия.
Структура и объем диссертации
Диссертация изложена на 166 страницах компьютерного текста. Диссертация состоит из введения и 4 глав: обзора литературы, описания материала и методов исследования, клинической характеристики больных и результатов собственных исследований и обсуждение полученных данных, а также выводов, рекомендаций для внедрения в практику здравоохранения и списка литературы. В работе 28 таблиц и 26 рисунков. Библиография включает 240 источников, из них 17 источников на русском и 223 на английском языках.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Проведено проспективное обследование 92 пациенток в постменопаузе с климактерическими расстройствами на базе отделения гинекологической эндокринологии ФГУ «НЦ АГиП им. академика В.И. Кулакова Росмедтехнологий». 47 пациенток включены в основные группы и 45 – в группу сравнения. Тщательно изучен анамнез и проведено общеклиническое, гинекологическое, лабораторное и инструментальное обследование наблюдаемых больных.
Критерии включения: возраст 45-60 лет, менопауза не менее 2 лет, сопровождающаяся климактерическими расстройствами; повышение уровня ФСГ в крови более 20 – 30 МЕ/л, наличие матки.
Критерии исключения: абсолютные противопоказания к ГТ, РАР – мазок ІІІ-ІV класса, непереносимость компонентов ГТ, женщины, принимавшие в ближайшие 6 месяцев ГТ в непрерывном режиме.
Для лечения климактерического синдрома 92 пациенткам назначена ГТ: перорально (клиогест) и парентерально (пластырь). Выбор указанных препаратов обусловлен тем, что в каждом из них содержатся структурно одинаковые эстрогены (эстрадиол) и прогестагены (НЭТА), но используются они в разных дозах и путях введения (перорально и парентерально). 45 пациенток I группы в течение года получали в непрерывном режиме перорально 2мг 17Е2+1мг НЭТА (группа сравнения). 22 пациентки II группы использовали трансдермальный пластырь Эстрадиол/НЭТА ТТС 1 (пластырь размером 20 см), выделяющий 25 мкг 17Е2+140мкг НЭТА, и 25 пациенток III группы использовали трансдермальный пластырь Эстрадиол/НЭТА ТТС 2 (пластырь размером 27 см), выделяющий 50мкг 17Е2+140мкг НЭТА. Все пациентки были сопоставимы по основным клиническим параметрам.
Программа обследования пациенток включала:
1. Общеклиническое и гинекологическое обследование (в т.ч. изучение акушерско-гинекологического анамнеза).
2. Подсчет индекса Куппермана. Оценку гормонального статуса: определение гонадотропных и стероидных гормонов крови в периферической крови (ФСГ и Е2) радиоиммунологическим методом.
3. Исследование биохимических показателей крови, липидного спектра крови и свертывающей системы крови.
4. Ультрасонографию органов малого таза на аппарате “ASPEN” (“Acuson”, США) с использованием мультичастотного трансвагинального датчика.
5. Рентгеномаммографию.
6. Цитологическое исследование клеточного состава шеечного эпителия.
7.Вакуум-кюретаж эндометрия проводился с использованием атравматичных аспирационных кюреток “Pipelle de Corner” (фирмы “Pharma Med Inc”, производство Франции). По показаниям - раздельное диагностическое выскабливание под контролем гистероскопии с дальнейшим патоморфологическим исследованием эндометрия.
Согласно дизайну исследования, контроль эффективности и безопасности лечения больных всех трех групп осуществляли при динамическом обследовании пациенток через 3, 6 и 12 месяцев.
Статистическая обработка полученных данных выполнена на компьютере с помощью электронных таблиц «Microsoft Excel» и пакета прикладных программ «Statistics for Windows», версия 7, StatSoft Inc. (США). Все полученные количественные анамнестические, клинические, лабораторные и инструментальные данные обработаны методом вариационной статистики; для качественных данных определены частоты (%). Статистически значимыми считались отличия при р<0,05 (95%-й уровень значимости) и при р<0,01 (99%-й уровень значимости).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Согласно полученным данным, средний возраст пациенток составил 52,69±4,1 года. Все пациентки находились в периоде постменопаузы, средняя длительность постменопаузы составила 4,3±0,32 г (2-9 лет), естественная менопауза у 87 (94,56%) женщин, хирургическая – у 5 (5,43%). При анализе структуры экстрагенитальной патологии обращает на себя внимание наличие заболеваний желудочно-кишечно-печеночного комплекса (33,7%), варикозного расширения вен нижних конечностей (34,78%), а также заболеваний опорно-двигательного аппарата (15,2%) у наблюдаемых пациенток.
Характерные для периоды постменопаузы инволютивные изменения молочных желез выявлены у большинства женщин (65,22%). К доброкачественным заболеваниям молочных желез, частота которых в целом составила 34,78%, отнесены остаточные явления диффузной и очаговой фиброзно-кистозной мастопатии, не требующие хирургического вмешательства.
В настоящем исследовании основным критерием для назначения ГТ являлось наличие климактерического синдрома различной степени выраженности. Учитывая целую гамму разнообразных симптомов при климактерическом синдроме, известную долю субъективизма в их оценке каждой отдельно взятой женщиной, оценка симптомов производилась по бальной системе. Сумма баллов указывала на степень выраженности симптомокомплекса и позволяла принять рациональное решение о необходимости проведения ГТ. Использование ИК для оценки степени тяжести КС у обследованных нами пациенток выявило наличие слабых проявлений у 16 (17,39%) женщин, умеренную степень выраженности симптомов у 39 (42,4%) женщин и тяжелое течение в 40,2% случаев. Наиболее частыми проявлениями нейро-вегетативного синдрома у наблюдаемых нами женщин были: приливы (98,9%), потливость (100%), чувство ползания мурашек (19,6%), сердцебиение (53,3%), головокружения (45,8%), головные боли (13,1%), боли в суставах (51,1%), сухость во влагалище (72,8%). Эмоциональные нарушения характеризовались, в основном, повышенной утомляемостью (95,7%), изменением настроения (97,8%), бессонницей (81,5%), снижением работоспособности (72,8%), ухудшением памяти (41,3%).
У больных I и III групп под влиянием гормонотерапии, как спустя 3 месяца, так и к концу года терапии, отмечалось достоверное снижение ИК (на 95,5%, 90% соответственно), тогда как во II группе положительный эффект отмечен через 6 месяцев в 81,8% случаев. Полученные результаты свидетельствуют об адекватном восполнении дефицита половых гормонов на фоне ГТ, что подтверждено гормональными исследованиями: уровни гонадотропинов снизились в 3,8; 2 и 2,9 раза, соответственно по группам. Исходно низкий уровень Е2 в крови (89,81±4,23пмоль/л) у всех пациенток повысился в среднем в 2 раза.
Критерии безопасности функции печени оценивались с учетом измененных и неизмененных показателей (норма/отклонение от нормы). К концу лечения во II гр. достоверно снизились показатели прямого билирубина, АЛТ и АСТ. Также отмечено достоверное снижение показателей АЛТ и прямого билирубина в III гр. пациенток (р<0,05). В I группе показатели АСТ, креатинина и щелочной фосфатазы незначительно увеличились, что свидетельствует о наличии негативного влияния гормонального препарата на функцию печени (табл. 1.).
С целью уточнения исходного состояния и реакцию на проводимую ГТ, помимо изучения биохимических печеночных ферментов, у всех обследованных пациенток проведено исследование липидного спектра в плазме крови. Полученные нами результаты свидетельствуют о наличии гиперхолестеринемии у 95,65 % (88 пациенток), снижении ХС-ЛПВП у 91,4 %, повышении ХС-ЛПНП у 93,47 % и ТГ у 94,56 % обследованных женщин.
У 86 (93,47%) пациенток выявлен IIb тип гиперхолестеринемии, IIa и V типы в 1,08% случаев соответственно. Определение указанных параметров и соотношений атерогенных и антиатерогенных фракций в комплексе с показателями холестерина и триглицеридов позволило изучить влияние ГТ при различных путях введения гормонов.
Таблица 1.
Динамика показателей функции печени (исходно и через год терапии)
| Показатели | I гр. | II гр. | III гр. | |||
| до | после | до | после | до | После | |
| Креатинин ммоль/л | 78,9±14,8 | 98±19,3* | 79,9±24,8 | 77,3±19 | 78,4±19,3 | 76,3±20,3 |
| Билирубин пр. ммоль/л | 1,88±0,43 | 1,76±0,87 | 1,82±0,61 | 1,64±0,43 | 1,91±0,87 | 1,44±0,65* |
| АСТ МЕ/л | 25,7±5,4 | 30,2±3,8* | 26,7±8,4 | 24,3±6,6 | 25,2±3,8 | 24,1±3,2 |
| АЛТ МЕ/л | 29,7±6,2 | 27,5±3,2 | 28,7±4,5 | 21,4±3,7* | 25,5±7,2 | 20,9±5,1* |
| ЩФ МЕ/л | 127,4±57 | 164,3±49* | 124,4±57 | 104,9±3* | 128,3±49 | 112,3±29* |
*р<0,05 разница между исходными данными и на фоне лечения
После года терапии пероральным препаратом в I гр. у 18 (40%) пациенток выявлен IIa тип гиперхолестеринемии, а у остальных пациенток (60%) нормальные показатели липидного спектра крови. Во II гр. через год терапии у 4 (18%) пациенток определяется IIa тип гиперхолестеринемии и у остальных пациенток (82%) нормальные показатели липидного спектра крови, и в III гр. в 16% случаев выявлен IIa тип гиперхолестеринемии, а в 84% нормальные показатели липидов крови. Высокий процент дислипидемии в I гр. на фоне гормонотерапии обусловлен увеличением уровней на 9,85% триглицеридов при пероральном приеме.
На этапе скрининга у исследуемых женщин признаков скрытой тромбофилии, свидетельствующей о хронической активации системы гемостаза, не выявлено. Отсутствовали также патологические изменения в свертывающей системе крови, которые можно было бы рассматривать как противопоказания для ГТ.
За время наблюдения в I гр. достоверно повысился (в среднем на 12,7%) показатель активации свертывания крови: ПИ до лечения - 110,41±1,60%, после лечения - 126,29±0,79% (p<0,05). Через год терапии отмечено (в среднем на 10,4%) укорочение АЧТВ от 33,94±1,38сек. до 30,41±0,65сек. (p<0,05). Концентрация фибриногена недостоверно (6,1%) снизилась от 2,71±0,07г/л до 2,54±0,08г/л. Все остальные показатели системы гемостаза оставались стабильными. Анализируя динамику показателей гемостаза у женщин обеих групп (II и III) можно сделать вывод о том, что терапия трансдермальным пластырем, независимо от дозы эстрогена, в течение года не оказывала отрицательного воздействия на коагуляционный потенциал крови (фибриноген, АЧТВ, ПИ) и антикоагулянтную активность (АТ-III). Нами не установлено изменений внутрисосудистой свертываемости (Д-димер, РКМФ) и агрегационной активности тромбоцитов. Показатель фибринолитической активности крови также оставался стабильным. Средние изменения в параметрах ПИ, АЧТВ, фибриногена, АТ-III происходили в пределах нормативных показателей.
Так как маммография является «золотым стандартом» определения состояния молочных желез на фоне различных типов ГТ, для сравнения влияния пероральных и трансдермальных форм введения гормонов мы оценивали рентгенологическую картину молочных желез в динамике. Рентгенологическая картина состояния молочных желез в основном соответствовала возрастным изменениям. На фоне комбинированных режимов ГТ во всех группах нами выявлена благоприятная картина, характеризующаяся инволютивными изменениями молочных желез (97,9% - ФЖИ).
Согласно поставленным задачам, с целью оценки частоты «кровотечений прорыва» на фоне гормональной терапии все пациентки в течение 12 месяцев вели индивидуальные дневники кровотечений. В I гр. установлено наличие кровотечений «прорыва» у 5 (11,11%) пациенток. Только у одной (2,22%) пациентки «кровотечения прорыва» максимально продолжались в течение четырех циклов терапии (с 1-го по 4-ые циклы терапии). У 2-х (4,44%) пациенток зарегистрировано умеренной интенсивности кровянистые выделения из половых путей в течение 2-х циклов терапии, одна (2,22%) из которых прекратила прием препарата на 3-м месяце лечения. Также в 2-х (4,44%) случаях наблюдались обильные кровяные выделения в течение 2-х месяцев лечения. В 88,8% (40 пациенток) случаев «кровотечений прорыва» не отмечалось.
Таблица. 2.
Частота кровотечений «прорыва» через 12 месяцев терапии
| I гр. | II гр. | III гр. | ||||
| абс. | % | абс. | % | абс. | % | |
| Отсутствие кровяных выделений | 40 | 88,8% | 20 | 90,91% | 21 | 84,0% |
| Скудные выделения | 1 | 2,22% | 2 | 9,09% | 4 | 16% |
| Умеренные выделения | 2 | 4,44% | - | - | - | - |
| Избыточные выделения | 2 | 4,44% | - | - | - | - |
Таким образом, полученные результаты показали, что прием перорального препарата в подавляющем большинстве случаев не вызывает ациклических кровотечений (табл. 2.).
В течение 3-х циклов терапии кровотечения «прорыва» достоверно чаще отмечены в группе пациенток использовавших пластырь размером 27 см (III гр.), по сравнению с группой пациенток использовавших пластырь размером 20 см (II гр.) (р=0,0083). У 16 (64%) пациенток III гр. наблюдались скудные кровянистые выделения в течение 3-х циклов терапии, и только в 36% случаев кровотечения отсутствовали. В противоположность этому, во II гр. в течение трех месяцев лечения скудные кровотечения «прорыва» выявлены у 9 (40,9%) пациенток. Следует особо обратить внимание на то, что в III гр. у 21 (84%) пациентки в течение 8-ми циклов сохранялись скудные кровяные выделения, которые к концу года терапии наблюдались только у 4-х пациенток (16%). В то время как, у пациенток II гр. только в 9,09% случаев (2 пациентки) отмечены скудные кровяные выделения, продолжительность которых не превышала 5 циклов. К этому сроку наблюдения кровянистые выделения продолжались в среднем 2,12 дня. Таким образом, полученные нами результаты показали, что использование трансдермального пластыря с содержанием стандартных (50мкг) доз 17-Е2 в большем числе случаев вызывает умеренной интенсивности кровотечения «прорыва», чем содержащие низкие дозы гормонов.
С целью уточнения реакции эндометрия на различные режимы гормонотерапии и пути метаболизма гормонов всем пациенткам проведено динамическое УЗИ внутренних половых органов. Согласно результатам проведенного исследования при сопоставлении средних значений исходных данных и результатов, полученных через год гормонотерапии в І гр. больных средний объём правого яичника увеличился на 10% (2,26±0,74см), объём левого яичника – на 12% (2,11±0,61см). Однако, различия между исходными результатами и данными через год лечения по всем параметрам были статистически не достоверны (р>0,05). Средний объём матки составил 34,4±3,36 см, что на 16% больше, чем до гормонотерапии.
Исходно по данным УЗИ во II и III группах размеры матки были уменьшены, средние размеры длины, ширины и толщины матки составили 3,42,93,9 см. По истечении года лечения размеры матки оставались стабильными. Незначимое увеличение размеров длины матки установлено в обеих группах, но все значения находились в пределах нормы. Яичники характеризовались уменьшением в размерах, изменением их эхогенности и отсутствием фолликулярного аппарата, средние размеры правого яичника исходно составили 1,11,61,5 см, и левого 1,61,31,5 см. Значимых отклонений в размерах яичников на фоне лечения не выявлено. Таким образом, при эхографическом исследовании и анализе динамики объемов матки и яичников достоверных различий между исходными данными и результатами спустя год ГТ не выявлено.
При детальном анализе, толщина эндометрия («М-эхо») на этапе скрининга варьировала между группами от «линейного» до 5,1 мм. «Тонкий» по эхо-структуре эндометрий диагностирован в подавляющем большинстве случаев (82,3%). У 21 (46,6%) – эндометрий однородной гомогенной эхо-структуры. В I гр. по данным УЗИ исходно толщина эндометрия в среднем составила 0,36±0,11 см. При УЗИ в динамике через 6 и 12 месяцев средние показатели «М-эхо» составили в среднем 0,26±0,07 см. Во II и III группах толщина эндометрия колебалась от линейного до 0,5 см, и в среднем составила по группам 0,26±0,24 см. и 0,25±0,17 см, соответственно, при однородной эхоструктуре, без патологических включений. Средние значения «М-эха» во II гр. составили 0,31±0,14 см (от 0,2 до 0,5см). В III гр. пациенток «М-эхо» составило 0,43±0,17см, что свидетельствует о достоверном увеличении толщины эндометрия на фоне лечения пластырем, содержащим более высокие дозы эстрогенов, по сравнению с низкой дозой эстрогена (пластырь размером 20 см) (р<0,05).
Таким образом, полученные нами результаты свидетельствуют о том, что пластырь, содержащий более высокую дозу эстрадиола, способствует достоверному утолщению «маточного эха» с 3-го лечебного цикла, в сравнении с пластырем с низкой дозой эстрогена, и сохраняется на протяжении всего года лечения. Так, средние значения «М-эха» пациенток, использующих, пластырь меньшего диаметра (20см) составили 0,32±0,16, а в группе пациенток использовавших пластырь большего размера (27см) толщина «М-эхо» составила в среднем 0,49±0,21см (р<0,05).
Анализ морфофункционального состояния эндометрия обследованных групп пациенток показал, что гистологическая картина слизистой оболочки матки в исходном состоянии характеризовалась типичным для постменопаузы строением: слизистая в стадии атрофии или неактивная слизистая.
При гистологическом исследовании эндометрия и анализе динамики в течение года установлено, что в I гр. в 88% (22 пациенток) случаев исходно выявлены атрофические изменения эндометрия. У 3-х (12%) пациенток с длительностью постменопаузы 2 года эндометрий соответствовал пролиферативным изменениям. После 12 месяцев терапии по результатам гистологического исследования у подавляющего большинства пациенток (92%) сохранялись атрофические изменения эндометрия, в то время как пролиферативная слизистая встречалась в 8% случаев.
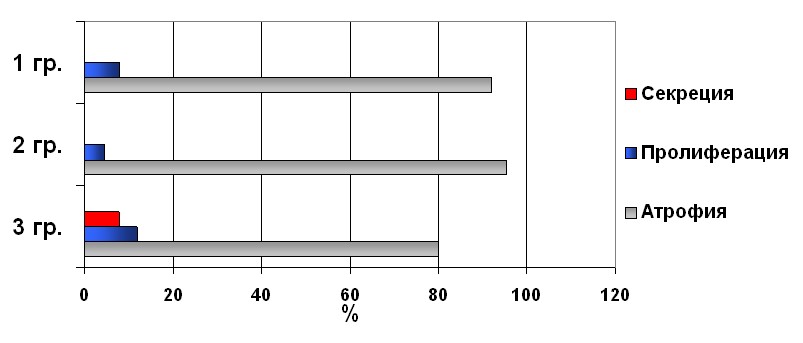
Рисунок. Реакция эндометрия на различные режимы ГТ
Во II гр. пациенток исходно в 90,88% случаев (20 пациенток) выявлена атрофия эндометрия и у 2-х пациенток (9,12%) - ранняя стадия пролиферации. Через 12 циклов терапии у 21 пациентки (95,46%) установлена атрофия, и только у одной женщины (4,54%) эндометрий соответствовал ранней фазе пролиферации (рис. 1). В III гр. пациенток, лечение которых проводилось пластырем большего размера (27 см) исходно у 24 (96%) пациенток выявлена атрофия эндометрия, и у 1-ой пациентки (4%) – пролиферация. Через 1 год терапии в данной группе атрофические изменения эндометрия отмечались у 20 (80%) пациенток, у 3-х (12%) пациенток выявлены пролиферативные изменения, и у 2-х пациенток (8%) – ранняя стадия секреции.
Нами проведен сравнительный анализ взаимосвязи частоты «кровотечений прорыва» и морфологической картины эндометрия. Установлено, что в обеих группах возникновение кровянистых выделений не зависело от результата гистологического исследования. Следует отметить, что, несмотря на высокий процент «кровотечений прорыва» на фоне 2-х различных доз ГТ при трансдермальном их применении, интенсивность кровотечений и их продолжительность была в среднем достоверно меньше, по сравнению с теми же показателями при использовании пероральных режимов ГТ.
В гр. пациенток установлена прямая корреляция (r=0,56) между частотой кровотечения, гистологической картиной эндометрия и толщиной «М-эха» после года терапии. У 6 (24%) пациенток с пролиферативным и секреторным эндометрием по данным гистологического исследования достоверно чаще отмечены кровотечения «прорыва». При этом данными УЗИ установлены максимальные значения толщины «М-эхо» (0,62 см). Следует особо подчеркнуть, что ни в одном случае на весь период наблюдения гиперплазии или рака эндометрия выявлено не было, что подтверждено данными гистологического исследования.
Таким образом, в практической деятельности при выборе препарата того или иного вида терапии крайне важно учитывать особенности лечебного воздействия при пероральном или трансдермальном пути введения гормонов. Так для достижения терапевтического эффекта оральный путь введения половых стероидов требует более высоких доз, что сопровождается пиками концентраций эстрадиола в крови. При «первичном прохождении» через печень происходит активный метаболизм, что сопровождается стимуляцией синтеза различных веществ – факторов свертывания, ангиотензина, половых стероид-связывающих глобулинов, тироксин-связывающего глобулина, из-за снижения синтеза желчных кислот появляется предрасположенность к образованию камней в желчном пузыре, а также происходит увеличение синтеза триглицеридов. К тому же, трансдермально вводимые гормоны эффективны в случаях нечувствительности к орально принимаемым гормонам. Из-за отсутствия эффекта «первичного прохождения» через печень трансдермальное введение гормонов следует рекомендовать больным с соматическими заболеваниями в стадии ремиссии в постменопаузе. К ним относятся: заболевания печени, поджелудочной железы, мальабсорбции, нарушения коагуляции, высокий риск венозных тромбозов, гипертриглицеридемия, некоторые формы гипертензии, гиперинсулинемия, повышенный риск холелитиаза, курение, мигрени, инсулинорезистентность и нарушение толерантности к глюкозе. В настоящее время трансдермальные формы гормонотерапии по этим показаниям все чаще применяются пациенткам в постменопаузе с целью лечения климактерических расстройств.
ВЫВОДЫ
- Непрерывная комбинированная гормонотерапия стандартными дозами гормонов, независимо от пути введения (перорально и трансдермально), эффективно купирует симптомы КС у женщин в постменопаузе, что подтверждается снижением индекса Куппермана (на 95,5%, 90% соответственно) к 3-му циклу лечения. Низкодозиранный трансдермальный режим оказывает положительный эффект через 6 месяцев в 81,8% случаев.
- Через год терапии пероральным препаратом (Е2+НЭТА) установлено незначительное увеличение биохимических показателей функции печени - АСТ, креатинина и ЩФ (на 12%, 11,5% и 13,38% соответственно). Напротив, трансдермальные формы ГТ не оказывают негативного влияния на функцию печени, что позволяет рекомендовать данный тип ГТ пациенткам с хроническими заболеваниями желудочно-кишечного тракта, печени и поджелудочной железы.
- Пероральный прием препарата способствует умеренному повышению уровня ТГ (на 13,85%) и концентрации ХС-ЛПВП (на 19,19%), в то время как трансдермальные формы ГТ вызывают достоверное снижение уровней ТГ (на 8,4 и 7,79% соответственно, р<0,05). Уровни общего ХС, ХС-ЛПНП и КА снижались до нормативных показателей во всех исследуемых группах.
- Пероральный препарат, содержащий комбинацию Е2+НЭТА, оказывают влияние на некоторые параметры гемостаза: увеличивает уровень ПИ на 12,7% (р<0,05) и укорачивает АЧТВ на 10,4% (р<0,05). Трансдермальные пластыри, содержащие как стандартные, так и низкие дозы эстрогенов, не оказывают отрицательного воздействия на коагуляционный потенциал крови и антикоагуляционную активность. Показатели Д-димера, протеина С и ВА во всех группах оставались стабильными в течение года терапии.
- У подавляющего большинства женщин в постменопаузе на фоне гормонотерапии, независимо от пути введения препарата, сохраняется аменорея (пероральные формы – 88,8%, трансдермальные системы – 90,9% и 84%). На фоне года лечения трансдермальным пластырем, содержащим низкую дозу эстрогена и пероральным препаратом (Е2+НЭТА) по данным УЗИ изменений средних значений показателей толщины эндометрия (0,32±0,16см и 0,26±0,07см соответственно) по сравнению с исходными данными не установлено. Тогда как, при использовании пластыря большего диаметра (27 см), отмечено достоверное увеличение толщины «М-эха» (0,49±0,21см) (р<0,05).
- Независимо от пути введения ГТ (перорально или трансдермально) в подавляющем большинстве случаев морфологическая картина эндометрия соответствовала атрофии (92%, 95,46% и 80%) и в меньшей степени - ранней пролиферации (8%, 4,54% и 12%). В то же время, в ІІI гр. пациенток в 2-х случаях на фоне ГТ выявлена стадия ранней секреции. За год наблюдения ни одного случая гиперплазии или рака эндометрия не установлено.
- Гормонотерапия КС в течение года, независимо от дозы и пути введения половых гормонов, не оказывает отрицательного влияния на ткань молочной железы.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- При тяжелых проявлениях КС и отсутствии сопутствующих заболеваний терапию следует начинать с пероральных или трансдермальных режимов ГТ, содержащих стандартные дозы гормонов.
- На фоне непрерывного комбинированного режима ГТ, как трансдермальных, так и пероральных форм, могут возникать маточные «кровотечения прорыва» (11,2%, 9,09% и 16%), продолжающиеся от 3-х до 6-ти месяцев. Частота, интенсивность и количество дней кровотечения достоверно ниже на фоне применения низкодозированной парентеральной терапии и клиогеста в сравнении с использованием пластыря с большей дозой эстрогена.
- «Кровотечения прорыва» на фоне ГТ являются показанием для проведения УЗИ органов малого таза, а при наличии патологических состояний – пайпелль-биопсии или раздельного диагностического выскабливания под контролем гистероскопии.
- Женщинам с гипертриглицеридемией и нормальным уровнем ХС-ЛПВП предпочтительнее назначение низкодозированной трансдермальной терапии, а при нормальных уровнях ТГ – пероральные препараты.
- При выборе препаратов ГТ женщинам с повышенным риском тромботических осложнений рекомендуется низкодозированный комбинированный пластырь. При назначении клиогеста в течение года, возможно, некоторое повышение тромбоцитов, в связи с чем, при необходимости рекомендуется назначение антиагрегантной терапии (под контролем системы гемостаза), или смена препарата на трансдермальный режим.
- Трансдермальный путь введения гормонов, особенно пластырь с низким содержанием эстрадиола в комбинации в прогестагеном, имеет преимущества в сравнении с пероральным и с комбинированным пластырем, содержащим стандартную дозу эстрогена, и может рассматриваться, как метод лечения женщин с сопутствующими соматическими заболеваниями и риском развития тромбоэмболических осложнений в климактерии.
Список работ, опубликованных по теме диссертации
- Зайдиева Я.З., Хоецян С.Р., Гасанова С.Х., Минасян Л.С. Влияние циклического режима гормонотерапии на ткань молочной железы у женщин в перименопаузе // Материалы 6-го Российского форума «Мать и Дитя». - М., 2004. – С. 352-353.
- Зайдиева Я.З., Хоецян С.Р., Минасян Л.С., Гасанова С.Х. Сравнительная оценка инвазивных и неинвазивных методов исследования молочных желез на фоне гормонотерапии у женщин в перименопаузе // Материалы 12-го Российского национального конгресса «Человек и лекарство». – М., 2005. – С. 384.
- Сметник В.П., Зайдиева Я.З., Балан В.Е., Хоецян С.Р. Влияние комбинированного матричного пластыря на симптомы климактерического синдрома у женщин в постменопаузе // Материалы Всероссийского форума «Мать и Дитя». – М., 2005. – С. 505.
- Зайдиева Я.З., Балан В.Е., Хоецян С.Р., Гус А.И. Эффективность и безопасность комбинированного матричного пластыря при лечении климактерических расстройств у женщин в постменопаузе // Материалы Международного конгресса «Практическая гинекология: от новых возможностей к новой стратегии». – М., 2006. – С. 65.
- Зайдиева Я.З., Гус А.И., Минасян Л.С., Гасанова С.Х., Хоецян С.Р. Влияние низкодозированной гормонотерапии на эндометрий и частоту кровотечений “прорыва” у женщин в постменопаузе // Материалы Международного конгресса «Практическая гинекология: от новых возможностей к новой стратегии». – М., 2006. – С. 66.
- Хоецян С.Р., Зайдиева Я.З. Клиническая эффективность и состояние эндометрия при лечении климактерического синдрома у женщин в постменопаузе комбинированным пластырем // АГ-Инфо. – 2007.- №1.- С. 37-39.
- Зайдиева Я.З., Минасян Л.С., Хоецян С.Р., Курбанбекова Г.Э., Липатенкова Ю.И. Влияние низкодозированной гормонотерапии на лейомиому матки малых размеров при лечении климактерических расстройств у больных в постменопаузе // Вопросы гинекологии, акушерства и перинатологии. - 2008. - Т. 7. - № 2. - С. 57-62.
- Мирзоева П.Н., Матушевская Е.В., Зайдиева Я.З., Хоецян С.Р. Перспективы использования ЗГТ для коррекции инволютивных изменений кожи // Вопросы гинекологии, акушерства и перинатологии. – 2008. - Т. 7. - № 3. - С. 56-62.
СПИСОК СОКРАЩЕНИЙ
АЧТВ – активированное частичное тромбопластиновое время
ВТЭ – венозная тромбоэмболия
ВА – волчаночный антикоагулянт
ГТ – комбинированная гормональная терапия
Е2 – эстрадиол
Е2V – эстрадиола валерат
ИК – индекс Куппермана
КС – климактерический синдром
IMS – Международная Ассоциация по Менопаузе
ЛП(а) – липопротеид (а)
НЭТА – норэтистерона ацетат
ПИ – протромбиновый индекс
СД – сахарный диабет
ТТС – трансдермальная терапевтическая система (пластырь)
ТГ - триглицериды
ХС-ЛПВП – липопротеиды высокой плотности
ХС-ЛПНП – липопротеиды низкой плотности
ЩФ – щелочная фосфатаза
УЗИ – ультразвуковое исследование
ФЖИ – фиброзно-жировая инволюция

