Сорбционные свойства и фармакологическая активность некрахмальных полисахаридов
На правах рукописи
ХОТИМЧЕНКО Максим Юрьевич
СОРБЦИОННЫЕ СВОЙСТВА И ФАРМАКОЛОГИЧЕСКАЯ
АКТИВНОСТЬ НЕКРАХМАЛЬНЫХ ПОЛИСАХАРИДОВ
14.03.06 – фармакология, клиническая фармакология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Владивосток – 2011
Работа выполнена в ГОУ ВПО «Владивостокский государственный
медицинский университет Росздрава» и Институте биологии моря им. А.В.Жирмунского Дальневосточного отделения Российской академии наук
Научный консультант: доктор биологических наук, профессор
Зуева Елена Петровна
Официальные оппоненты:
доктор медицинский наук, профессор Сулейманов Салават Шейхович
ГОУДПО «Институт повышения квалификации специалистов здравоохранения»
доктор медицинских наук, профессор Суслов Николай Иннокентьевич
НИИ фармакологии СО РАМН
доктор медицинских наук, профессор, академик РАМН
Беседнова Наталья Николаевна
НИИ микробиологии и эпидемиологии СО РАМН
Ведущая организация: ГОУ ВПО «Сибирский государственный медицинский университет Росздрава»
Защита диссертации состоится «29» апреля 2011 года в ___ часов на заседании диссертационного совета Д208.007.03 при Владивостокском государственном медицинском университете (690002, г. Владивосток, пр. Острякова, 2).
С диссертацией можно ознакомиться в библиотеке Владивостокского государственного медицинского университета по адресу: 690002, г. Владивосток, пр. Острякова, 2.
Автореферат разослан «___» ________________ 2011 года.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Е.В.Просекова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Поиск соединений с высокой фармакологической активностью и разработка на их основе новых лекарственных препаратов являются важными задачами современной экспериментальной фармакологии и фармации. Актуальность поисковых исследований обусловлена необходимостью пополнения арсенала лекарственных средств более эффективными и менее токсичными препаратами, предназначенными для лечения и профилактики социально-значимых заболеваний. Наряду с медицинскими задачами, необходимость в создании новых фармацевтических субстанций и лекарственных средств диктуется социальными и экономическими причинами. По данным агентства «DSM Group», в 2008 г. на Российском фармацевтическом рынке 75,8% лекарственных препаратов в стоимостном объеме были представлены средствами импортного производства [Кузин А.В., 2008]. Большинство лекарственных средств отечественного производства является препаратами-дженериками, эффективность которых по сравнению с оригинальными препаратами, как правило, значительно ниже. В настоящее время примерно 80% отечественных лекарственных препаратов производится из фармацевтических субстанций импортного производства. В период с 1991 г. до 2005 г. объем производства фармацевтических субстанций в Российской Федерации сократился с 17,5 тыс. усл. тонн до 0,98 тыс. усл. тонн. Все это негативно отражается на состоянии здоровья населения и требует более интенсивного развития биомедицинских исследований, направленных на создание новых эффективных лекарственных средств.
По разным оценкам от 40 до 70% новых лекарственных препаратов создается на основе природных молекул или их синтетических аналогов и производных. На основе природных соединений могут быть разработаны фармацевтические средства, обладающие качественно новыми фармакологическими эффектами по сравнению с химически синтезированными лекарственными препаратами. Существенными преимуществами лекарственных веществ из природных источников являются доступность сырья, меньшая сложность технологических процессов выделения и очистки, выраженная фармакологическая активность и, как правило, низкая токсичность [Хотимченко Ю.С., 2010]. В этом отношении большой интерес вызывают представители морской флоры и фауны, которые можно рассматривать как источник новых лекарств и фармакологически активных субстанций [Bowling J.J. et al., 2007; Martinez A., 2007; Kinghorn A. et al., 2009]. Известно, что филогенетическое (макротаксономическое) разнообразие в море существенно выше, чем на суше. Так, из 33 типов многоклеточных животных 31 тип встречается в морских водах, 17 типов – в пресных водах и только 11 типов – на суше [Адрианов А.В., 2004]. Благодаря многочисленным адаптациям к разнообразным факторам внешней среды, многие морские животные и растения вырабатывают уникальные вторичные метаболиты, отсутствующие у наземных организмов. Зачастую эти соединения характеризуются чрезвычайно высокой фармакологической активностью [Haefner B., 2003; Muller W. et al., 2003; Alonso D. et al., 2005; Newman D., Cragg G., 2006; Стоник В.А., Толстиков Г.А., 2008].
Перспективную группу веществ, преимущественно морского происхождения, составляют некрахмальные полисахариды [Хотимченко Ю.С. и др., 2005], к которым относятся альгинаты и фукоиданы морских бурых водорослей, каррагинаны красных водорослей, хитин и его производное хитозан морских ракообразных, а также пектины морских трав и наземных растений. Они широко применяются в пищевой промышленности в качестве стабилизаторов, загустителей и гелеобразователей и в меньших масштабах – в фармацевтической промышленности как формообразующие вещества [Redgwell R., Fischer M., 2005]. В последние годы эти полисахариды стали объектом нанотехнологических исследований в качестве структурных компонентов систем адресной доставки лекарственных молекул и микрокапсулирования [Liu Z. et al., 2008].
Все некрахмальные полисахариды объединены общим свойством: в желудочно-кишечном тракте они не гидролизуются амилазами слюнных и панкреатических желез и не абсорбируются из кишечника в кровь, однако, в толстой кишке подвергаются деградации под действием ферментов бактериальной микрофлоры [Wong J.M. et al., 2006]. Уникальным свойством этих полисахаридов является способность поглощать большое количество воды и в присутствии, как правило, двухвалентных ионов образовывать гели. Механизм гелеобразования лежит в основе способности некрахмальных полисахаридов связывать и прочно удерживать ионы металлов и другие ионизированные молекулы [Kohn R., 1987].
У большинства исследованных полисахаридов обнаружены те или иные фармакологические эффекты, заслуживающие внимания в плане создания новых фармацевтических субстанций. Так, пектины, альгинаты и хитозаны обладают достоверным гипохолестеринемическим и гипотриглицеридемическим эффектами [Panlasigui L.N. et al., 2003; Shields K.M. et al., 2003]. Гепатопротекторное и нефропротекотрное действие обнаружено у фукоиданов [Kawano N. et al., 2007; Veena C.K. et al., 2007]. В экспериментальных исследованиях и клинических наблюдениях была доказана терапевтическая эффективность пектинов при инфекционной патологии, проявляющаяся в снижении явлений интоксикации [Ященя О.В. и др., 2001], а также при отравлении ртутью [Соболев М.Б. и др., 1999]. У пектинов и хитозанов выявлены бактерицидные и фунгицидные эффекты, а у фукоиданов и каррагинанов – противовирусная активность [Neurath A.R. et al., 2002; Carlucci M.J. et al., 2004; Adhikari U. et al., 2006; Buck C.B. et al., 2006], которая сочетается с иммуностимулирующим эффектом [Yoshikawa Y. et al., 2008] и способностью к индукции синтеза интерферонов [Tsuji R.F. et al., 2003]. Помимо этого, у фукоиданов и каррагинанов установлена антикоагулянтная активность [Liang A. et al., 2006; Cicala C. et al., 2007], которая у высокосульфатированных фукоиданов сопоставима с таковой препаратов гепарина [Qui X.D. et al., 2006]. Фукоидан проявляет также антиагрегантные свойства [Mourao P.A.S., 2004], а альгиновая кислота, наоборот, обладает протромботической активностью, что на практике реализовалось в создании перевязочных материалов с гемостатическими свойствами [Pielesz A. et al., 2008].
Результаты многих исследований указывают на наличие противоопухолевой активности у некрахмальных полисахаридов. Пектины в эксперименте снижают частоту рака толстого кишечника, что было подтверждено результатами клинических наблюдений. На моделях перевиваемых опухолей у мышей показана противоопухолевая активность альгинатов. В ряде работ продемонстрирована способность фукоиданов ингибировать рост опухолей и уменьшать интенсивность процессов метастазирования [Алексеенко Т.В. и др., 2007; Cumashi A. et al., 2007; Li D.Y. et al., 2008]. Получены данные о противоопухолевой активности и каррагинанов [Zhou G. et al., 2006], хотя в литературе имеются факты, указывающие на их онкогенное действие [Tobacman J.K. et al., 2001; Hata K. et al., 2006]. Весьма перспективными препаратами для лечения и профилактики язвенной болезни представляются фукоиданы, которые, с одной стороны, обладают антипептическими и противовоспалительными свойствами [Shibata H. et al., 2000; Yamamoto Y. et al., 2000], а с другой, препятствуют адгезии Helycobacter pylori на мембраны эпителиальных клеток слизистой желудка [Shibata H.et al., 1999].
Следует подчеркнуть, что представители каждой группы некрахмальных полисахаридов представляют собой гетерогенные соединения, различающиеся не только источниками происхождения, но и параметрами физико-химических свойств, таких как молекулярная масса, вязкость, растворимость в воде, степень этерификации и сульфатирования, что, к сожалению, не учитывается в большинстве работ по оценке биологической активности углеводных биополимеров и, на наш взгляд, является причиной многочисленных противоречивых фактов, имеющихся в литературе, посвященной фармакологии этих полисахаридов. Отсутствие общепринятых количественных показателей для стандартизации препаратов некрахмальных полисахаридов затрудняет проведение сравнительной оценки фармакологической эффективности полисахаридов друг с другом, а также с лекарственными препаратами аналогичного действия. Сформулированные проблемы определили цели и задачи настоящей работы.
Цель работы: изучить сорбционные свойства, фармакологические эффекты и механизмы действия некрахмальных полисахаридов и обосновать возможности использования данных веществ для разработки новых фармацевтических субстанций и лекарственных средств.
Задачи работы:
- Изучить металлсвязывающие свойства природных пектинов, альгинатов, хитозанов, каррагинанов и фукоидана при взаимодействии с ионами меди, ртути, кадмия, свинца, цинка и стронция и определить с помощью математических моделей сорбции основные константы связывания.
- Провести сравнительный анализ количественных параметров связывания тяжелых металлов некрахмальными полисахаридами и лекарственными препаратами из группы энтеросорбентов и определить наиболее перспективные образцы для дальнейшей разработки на их основе новых лекарственных средств.
- Исследовать металлсвязывающую активность образцов пектинов с различной степенью этерификации при взаимодействии с ионами меди, ртути, кадмия, свинца, цинка и стронция и установить зависимость сорбционной емкости полисахаридов от степени этерификации.
- На модели свинцовой нагрузки у лабораторных животных оценить влияние пектинов, альгинатов, хитозана, каррагинанов и фукоидана на депонирование и экскрецию тяжелых металлов.
- Оценить гипохолестеринемическую, гипотриглицеридемическую и антиоксидантную активность пектинов, альгинатов, каррагинанов и фукоидана на различных моделях экспериментальной гиперлипидемии.
- Исследовать гепатопротекторное действие пектинов и альгинатов на животных с экспериментальным тетрахлорметановым поражением печени, а также оценить антиоксидантные свойства полисахаридов на данной модели.
- На экспериментальных моделях повреждения слизистой желудка оценить гастропротективные эффекты пектинов, альгинатов, хитозана и каррагинанов.
- Определить сорбционную емкость пектинов и альгинатов в отношении мочевины и креатинина и изучить лечебные и профилактические эффекты этих полисахаридов при экспериментальной почечной недостаточности.
- Провести анализ зависимости сорбционных свойств и фармакологических эффектов некрахмальных полисахаридов от их физико-химических свойств на примере высокоэтерифицированных и низкоэтерифицированных пектинов с целью стандартизации полисахаридных препаратов.
Научная новизна и теоретическое значение работы. Работа является комплексным научным исследованием, посвященным фармакологии некрахмальных полисахаридов. Дана сравнительная оценка сорбционных свойств, антитоксической, липиднормализующей, гепатопротективной, гастропротективной и нефропротектиновной активности пектинов, альгинатов, хитозана, каррагинанов и фукоидана.
На основе математического аппарата моделей сорбции Лэнгмюра, Фрейндлиха и Брюне-Эммета-Таллера определены параметры максимальной сорбционной емкости, аффинитета и прочности связывания металлов природными и модифицированными некрахмальными полисахаридами. Установлена зависимость количественных значений констант связывания от степени этерификации пектинов, содержания кальция в молекуле альгинатов и пектинов, от степени сульфатирования каррагинанов. Определены наиболее эффективные образцы некрахмальных полисахаридов, препятствующих накоплению металлов в организме и ускоряющих их выведение.
Установлены константы связывания желчных кислот, билирубина, мочевины и креатинина пектинами и альгинатами. Показана зависимость гипохолестеринемического и гипотриглицеридемического действия пектинов и альгинатов от молекулярной массы и характеристической вязкости полисахаридов. Определены образцы пектинов, альгинатов, хитозана и каррагинанов, обладающие лечебным и профилактическим действием при экспериментальном токсическом поражении печени и почек.
На различных моделях повреждения слизистой желудка крыс показано антиульцерогенное действие альгината натрия, пектата кальция и хитозана.
Проведен анализ зависимости фармакологических эффектов некрахмальных полисахаридов от их химической структуры, молекулярной массы, вязкости и других физико-химических параметров. Количественные характеристики физико-химических свойств предложены в качестве показателей стандартизации препаратов некрахмальных полисахаридов.
Теоретическое значение работы заключается в установлении новых, не известных ранее закономерных связей структуры и физико-химических свойств некрахмальных полисахаридов с их биологической активностью. Установлены новые механизмы фармакологического действия углеводных биополимеров.
Практическая значимость работы и реализация результатов исследования. Практическим итогом проведенного исследования стало базирующееся на полученных результатах обоснование дальнейшей разработки лекарственных средств на основе низкоэтерифицированных пектинов, солей пектовой и альгиновой кислот, предназначенных для применения в качестве энтеросорбентов. Высокая сорбционная емкость пектинов и альгинатов по тяжелым металлам, значительно превышающая таковую препаратов активированного угля и лигнина, сочетающаяся с возможностью их длительного безопасного приема, позволяют рассматривать эти вещества как перспективные препараты для профилактики и лечения хронических отравлений тяжелыми металлами. Пектат кальция может быть рекомендован для дальнейшей разработки в качестве гастропротективного средства.
Препараты некрахмальных полисахаридов с энтеросорбционными свойствами могут рассматриваться в качестве дополнительных средств в комплексном лечении заболеваний, сопровождающихся явлениями интоксикации.
На основании проведенных экспериментальных исследований, анализа физико-химических характеристик и технологических процессов выделения, очистки и химической модификации полисахаридов разработана и зарегистрирована в установленном порядке нормативная документация на производство и реализацию биологически активных добавок к пище, действующим компонентом которых является пектин со степенью этерификации менее 5%, комбинация пектинов с суммарной степенью этерификации 50% и альгинат кальция. Действующие компоненты рассматриваются в качестве основы для разработки лекарственных средств с энтеросорбционными свойствами.
Разработанные технологии получения модифицированных некрахмальных полисахаридов и способы их применения защищены четырьмя патентами Российской Федерации.
Основные положения, выносимые на защиту:
- Некрахмальные полисахариды обладают выраженной металлсвязывающей способностью в отношении токсичных металлов, таких как свинец, кадмий, ртуть, стронций и могут стать основой для разработки новых лекарственных средств, предназначенных для лечения и профилактики заболеваний, обусловленных действием тяжелых металлов. Наиболее перспективными для дальнейшего изучения в качестве средств профилактики и лечения хронических поражений тяжелыми металлами являются деэтерифицированный пектин, альгинат натрия, пектат кальция, альгинат кальция.
- Механизмы связывания ионов меди, свинца, кадмия и цинка пектинами и альгинатами отличаются от процессов связывания ионов ртути и стронция. Сорбция ионов меди, свинца, кадмия и цинка происходит за счет образования координационных связей между карбоксильными и гидроксильными группами галактуроновых кислот в пектине и гулуроновых кислот в альгинате и ионом метала с формированием упорядоченной структуры гомогенных активных связывающих центров. Связывание ртути и стронция происходит за счет образования координационных связей между карбоксильными и гидроксильными группами галактуроновых кислот в пектине и гулуроновых кислот в альгинате, приводящего к хаотичному формированию гетерогенных активных связывающих центров. Дополнительное введение ионов кальция в сорбционную систему связывания ртути и стронция приводит к упорядочиванию структуры активных связывающих центров.
- Пектины, альгинаты, хитозан и фукоидан при энтеральном введении оказывают липиднормализующее действие, позволяющее рассматривать их в качестве основы для разработки средств профилактики атеросклероза.
- Пектины, альгинаты и хитозан оказывают гастропротективное действие на различных моделях поражения слизистой желудка и являются перспективной основой для создания новых противоязвенных средств.
- Препараты пектинов, альгинатов и хитозана способствуют нормализации биохимических параметров печеночной интоксикации при экспериментальной поражении печени, что позволяет рассматривать их в качестве потенциальных гепатопротекторов. Одним из механизмов антитоксического действия некрахмальных полисахаридов является их антиоксидантная активность.
- Препараты альгинатов и пектинов при энтеральном введении уменьшают явления уремической интоксикации и могут найти применение в комплексном лечении почечной недостаточности.
Апробация работы:
Основные результаты работы были доложены и обсуждены на IV Международном симпозиуме «Биологически активные добавки к пище: XXI век» (С.-Петербург, 2000), Русско-японском международном медицинском симпозиуме (Благовещенск, 2000), X-XVI Российских национальных конгрессах «Человек и лекарство» (Москва, 2003, 2004, 2005, 2006, 2007, 2008, 2009), 2-ом Съезде российского научного общества фармакологов «Фундаментальные проблемы фармакологии» (Москва, 2003), Международном симпозиуме «International Conference on Development Pharmacology» (Harbin, China, 2004), Международном симпозиуме «China-Russia International Conference on Pharmacology» (Harbin, China, 2005), XV мировом фармакологическом конгрессе «Pharmacology in the 21st Century: A Bridge between the Past and the New Molecular Frontiers» (Beijing, China, 2006), V Дальневосточном региональном конгрессе с международным участием «Человек и лекарство» (Владивосток, 2008), XVI мировом конгрессе базисной и клинической фармакологии «WorldPharma 2010» (Copenhagen, Denmark, 2010).
Материалы диссертации были доложены и обсуждены на заседании Проблемной комиссии по фармакологии, клинической фармакологии и фармации Владивостокского государственного медицинского университета. По результатам обсуждения диссертация была рекомендована к защите.
Публикации:
По материалам диссертации опубликована 41 печатная работа, в том числе 1 монография, 36 статей, в том числе 16 в журналах, рекомендованных ВАК, 4 патента Российской Федерации.
Финансовая поддержка:
Работа выполнялась при финансовой поддержке грантов РФФИ № 01-04-49413 «Сравнительная эффективность и механизмы сорбционной активности высокоэтерифицированных и низкоэтерифицированных пектинов», ДВО РАН – СО РАМН № 06-III-А-05-468 «Первичные фармакологические исследования, токсикологические испытания, стандартизация и разработка лекарственных препаратов на основе некрахмальных полисахаридов», РФФИ-ДВО № 09-03-98512 «Условия и механизмы образования комплексов наночастиц некрахмальных полисахаридов с ионами поливалентных металлов», Государственных контрактов в рамках Федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007-2012 годы»: Государственный контракт № 02.512.11.2090 «Разработка фармакологических средств защиты человека от действия радионуклидов, токсических металлов и эндогенных метаболитов на основе биопрепаратов из морских животных и растений», Государственный контракт № 02.512.12.2043 «Разработка фармакологических средств на основе модифицированных некрахмальных полисахаридов для использования в терапии злокачественных новообразований».
Объем и структура диссертации
Диссертация изложена на 327 страницах машинописного текста и состоит из введения, обзора литературы, описания материалов и метолов исследования, 8 глав собственных исследований, обсуждения результатов, выводов и списка литературы.
Работа содержит 53 рисунка и 41 таблицу. Библиография состоит из 468 отечественных и зарубежных источников.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Общая характеристика экспериментальных животных
В экспериментах использованы 900 половозрелых белых беспородных крыс-самцов массой 110-195 г. и 58 половозрелых белых нелинейных мышей-самцов массой 20-26 г. Животных содержали в виварии Владивостокского государственного медицинского университета; часть животных была получена из вивария ТИБОХ ДВО РАН. Во время экспериментальных исследований животных содержали в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей [Страсбург, 1986]. Все животные помимо сбалансированного стандартного рациона (гранулированный корм ПК120-3, согласно приказу №1179 МЗ СССР от 10.10.1983) получали овес, хлеб, свежие овощи и фрукты, мел, также в зимнее время были добавлены комплексные поливитаминные препараты. При разделении животных на группы проводили их ранжирование по массе тела с целью обеспечения идентичности указанных групп по данному показателю. Наркоз и декапитацию животных проводили в соответствии с рекомендациями Рабочей группы Федерации Европейского Сообщества по науке лабораторных животных [Копаладзе Р.Е., 1998].
Характеристика изучаемых веществ
В работы были исследованы следующие вещества и препараты:
1. Альгинат натрия – полимер гулуроновой и маннуроновой кислот; содержание уроновых кислот - 77,3%, характеристическая вязкость - 1270 мл/г; молекулярная масса, вычисленная с помощью уравнения Марка-Куна-Хауинка, в среднем 403000 Да.
2. Альгинат кальция – полимер гулуроновой и маннуроновой кислот; содержание уроновых кислот - 77,3%, содержание кальция - 72,5%, 82,5% карбоксильных групп представлены в виде кальциевой соли, характеристическая вязкость - 1270 мл/г, молекулярная масса 403000 Да.
3. Пектин, степень этерификации 60% – полимер галактуроновой кислоты; содержание чистого галактуронана в молекуле пектина - 78,0%, степень этерификации – около 61%, свободные и метилированные карбоксильные группы расположены в случайном порядке; характеристическая вязкость – 915 мл/г галактуронана, молекулярная масса, вычисленная с помощью уравнения Марка-Куна-Хауинка, в среднем 224000 Да.
4. Пектин, степень этерификации 40% – полимер галактуроновой кислоты; концентрация чистого галактуронана – 70,4%, степень этерификации – около 40,1%. Свободные и метилированные карбоксильные группы расположены в случайном порядке, характеристическая вязкость – 533 мл/г галактуронана, молекулярная масса в среднем 70000 Да.
5. Пектин, степень этерификации 20% – полимер галактуроновой кислоты; концентрация чистого галактуронана – 66,6%, степень этерификации – около 18,8%. Свободные и метилированные карбоксильные группы расположены в случайном порядке, характеристическая вязкость – 433 мл/г галактуронана, молекулярная масса в среднем 45000 Да.
6. Деэтерифицированный пектин – полимер галактуроновой кислоты; концентрация чистого галактуронана – 67,1%, степень этерификации – около 1,2%. Свободные и метилированные карбоксильные группы расположены в случайном порядке, характеристическая вязкость 408 мл/г галактуронана, молекулярная масса в среднем 20500 Да.
7. Пектат кальция – кальциевая соль пектовой кислоты; содержание чистого галактуронана – 60,5%, степень этерификации – около 1,2%, характеристическая вязкость – 160 мл/г галактуронана, 86% карбоксильных групп находятся в виде кальциевой соли, молекулярная масса в среднем 20500 Да.
8. Зостерин – полимер галактуроновой кислоты, пектин из морской травы Zostera marina. Содержание чистого галактуронана в молекуле пектина – 74,8%, степень этерификации – около 5,7%, свободные и метилированные карбоксильные группы расположены в случайном порядке, характеристическая вязкость – 340 мл/г галактуронана, молекулярная масса в среднем 62000 Да.
9. Хитозан – полисахарид (полимер -(14)-2-ацетамидо-2-дезокси-D-глюкопиранозы), выделенный из панциря камчатского краба Paralithodes camtschatica.
10. Фукоидан – сложный сульфатированный полисахарид (полимер L-фукозы), выделенный из бурой водоросли Laminaria japonica.
11. Каррагинан – сульфатированный полисахарид (полимер D-галактозы и ее производных), выделенный из морской красной водоросли Chondrus сrispatus. Суммарный препарат - и -каррагинанов предоставлен лабораторией неинфекционного иммунитета ТИБОХ ДВО РАН.
12. -каррагинан – сульфатированный полисахарид (полимер D-галактозы и ее производных), выделенный из морской красной водоросли Chondrus сrispatus, предоставлен лабораторией неинфекционного иммунитета ТИБОХ ДВО РАН.
13. -каррагинан – сульфатированный полисахарид (полимер D-галактозы и ее производных), выделенный из морской красной водоросли Chondrus сrispatus, предоставлен лабораторией неинфекционного иммунитета ТИБОХ ДВО РАН.
14. Активированный уголь. В экспериментах был использован активированный уголь в таблетках, произведенный ОАО «Ирбитский химфармзавод» (Ирбит) и ЗАО «Медисорб» (Пермь).
15. Полифепан. В экспериментах был использован препарат в гранулах производства АОЗТ «Сайнтек» (Санкт-Петербург).
16. Микрокристаллическая целлюлоза. В экспериментах был использован препарат в таблетках «Анкир Б».
Экспериментальные модели
Свинцовую интоксикацию у лабораторных крыс вызывали внутрижелудочным введением ацетата свинца в дозе 50 мг/кг массы тела в течение 18 дней и в течение 21 дня, после чего исследуемые полисахариды вводили в дозах 0,1 г/кг и 0,5 г/кг, соответственно. Для оценки динамики выведения ионов металла из организма лабораторных животных под действием некрахмальных полисахаридов свинцовую интоксикацию вызывали введением свинца в дозе 100 мг/кг в течение 21 дня. Экспериментальное поражение щитовидной железы и печени вызывали введением свинца в дозе 100 мг/кг в течение 21 дня. После этого вводили исследуемые препараты в дозах от 0,1 до 0,5 г/кг в течение 21 дня.
Экспериментальную почечную недостаточность у лабораторных животных моделировали при помощи двухнедельного введения нитрата ртути в дозе 10 мг/кг через желудочный зонд в течение 2 недель. Начиная с 15 дня эксперимента, введение ртути прекращали и животным вводили исследуемые полисахариды и препараты сравнения в дозе 0,1 и 0,5 г/кг в течение трех недель.
Повреждение печеночной паренхимы у лабораторных крыс моделировали внутрижелудочным введением четыреххлористого углерода в дозе 300 мг/кг массы тела животного в течение семи дней. При оценке лечебных эффектов исследуемых полисахаридов препараты вводили после окончания введения четыреххлористого углерода в дозах 0,01, 0,05 и 0,25 г/кг в течение трех недель. Для изучения профилактических эффектов препараты вводили в течение трех недель в тех же дозах до начала введения четыреххлористого углерода. Контрольная группа на протяжении всего эксперимента получала стандартную диету вивария.
Усиление перекисного окисления липидов вызывали либо внутрижелудочным введением ацетата свинца 100 мг/кг массы тела в сутки в виде водного раствора в течение 14 дней, либо внутрижелудочным введением четыреххлористого углерода в дозе 300 мг/кг массы тела животного в течение 7 дней. Препараты некрахмальных полисахаридов вводили после окончания введения свинца или четыреххлористого углерода в дозе от 0,05 до 0,5 г/кг/сут. Контрольная группа животных получала стандартную диету.
Гиперлипидемию вызывали либо внутрижелудочным введением четыреххлористого углерода в дозе 300 мг/кг массы тела животного в течение 7 дней, либо внутрижелудочным введением 100 мг ацетата свинца на кг массы тела в сутки в виде водного раствора в течение 14 дней, либо введением 1 мл 25% водного раствора этанола в течение 30 дней. В экспериментах с тетрахлорметановой интоксикацией изучаемые полисахариды вводили после окончания введения токсиканта в дозе 0,15 г/кг массы тела. При использовании свинцовой и этаноловой моделей интоксикации исследуемые препараты вводили в дозе 0,05 г/кг массы тела животного.
Повреждение слизистой оболочки желудка у лабораторных животных вызывали введением водной суспензии индометацина в дозе 40 мг/кг, либо ежедневным внутрижелудочным введением 2,4-дихлорфеноксиуксусной кислоты в дозе 90 мг/кг в течение семи дней. Стресс-индуцированную язву желудка вызывали путем погружения крыс, находящихся в перфорированных плексигласовых клетках, ограничивающих движения, в воду с температурой 23°С на 2 часа. После действия ульцерогенного фактора исследуемые препараты вводили в дозах 0,1-0,5 г/кг в течение 2 недель.
Определение сорбционной емкости
Металлсвязывающую активность полисахаридов и препаратов сравнения изучали, используя оригинальное устройство, состоящее из стеклянной инкубационной емкости с фильтрующим элементом из капроновой сетки и стеклянной сборной емкости, снабженной поршнем. Сетка фильтра имела размер ячеи около 100 мкм, что обеспечивало быстрое прохождение рабочего раствора из одной емкости в другую. При этом частицы порошка или геля полисахаридов полностью удерживались в инкубационной емкости. В инкубационную емкость вносили 50 мг полисахарида с размерами частиц порошка 125-177 мкм. В сборную емкость добавляли от 0,5 до 3,0 мл 0,1 М раствора Hg(NO3)2, 1 мл 1,0 М буфера с необходимым значением рН и дистиллированную воду до 5 мл. Для запуска процесса взаимодействия полисахарида с ионами металла инкубационную и сборную емкости соединяли друг с другом, и жидкую фазу перемещали поршнем в инкубационную емкость. Инкубационную емкость закрывали крышкой, и ее содержимое перемешивали в течение заданного промежутка времени. После этого жидкость оттягивали в сборную емкость обратным перемещением поршня и отбирали 2,5 мл супернатанта. Эксперименты проводили при температуре 23-25°C с постоянным перемешиванием инкубационной емкости (скорость встряхивания 50 rpm). Количество связавшегося металла вычисляли по формуле:
q=V(Ci – Cf)/M,
где q – количество связавшихся с полисахаридом ионов металла (ммоль/г сухой массы полисахарида), V – объем раствора в инкубационной емкости (л), Ci – начальная концентрация металла в растворе (ммоль/л), Cf – конечная (равновесная) концентрация металла в растворе, M – масса полисахарида (г).
В ходе изучения сорбционных характеристик некрахмальных полисахаридов в отношении металлов для определения концентрации их ионов в растворе применяли титриметрический (комплексонометрический) метод и метод ион-селективных электродов. Титриметрический метод использовался для определения меди, свинца, кадмия, ртути, цинка и стронция с применением в качестве металлоиндикаторов мурексида, ксиленолового оранжевого и эриохрома черного Т [Пилипенко А.Т., Пятницкий И.В., 1990]. Количественный анализ содержания металлов в растворе с использованием иономера NICO Elit (модель 3320 рН Meter) и ион-селективных электродов проводили для соответствующих ионов металлов: свинец-селективный электрод XC-Pb-001, медь-селективный электрод «Вольта-3000», кадмий-селективный электрод XC-Cd-01 и ртуть-селективный электрод «Вольта». В ходе эксперимента в пробу, содержащую 100 мг исследуемого сорбента, титрованием добавляли раствор исследуемого металла с концентрацией 0,2 мг/мл. С помощью ион-селективного электрода осуществляли постоянный контроль концентрации свободных ионов в исследуемом растворе. Титрование прекращали при достижении в растворе концентрации исследуемого металла 0,05 мг/мл. После этого, исходя из полученного объема раствора, вычисляли общее количество металла, находящегося в растворе в свободном состоянии. Количество металла, связавшегося с 100 мг сорбента, вычисляли как разность между количеством металла, которое пошло на титрование и количеством металла, находящегося в растворе в виде свободных ионов.
Для оценки сорбционной емкости исследуемых полисахаридов в отношении эндогенных метаболитов применяли биохимические методы. При помощи стандартных коммерческих наборов реактивов определяли мочевину, креатинин, билирубин и холевую кислоту.
Для определения сорбционной активности некрахмальных полисахаридов при взаимодействии с билирубином, мочевиной, креатинином и холевой кислотой в пробирку помещали раствор соединения с точной известной концентрацией, после чего вносили навеску исследуемого препарата. По окончании инкубационного периода раствор, содержащий оба компонента сорбционной системы, отфильтровывали и в надосадочной жидкости определяли остаточное количество вещества при помощи спектрофотометрического метода. Связывание вычисляли как разницу между начальной и конечной концентрацией сорбата в растворе [Портяная Н.И. и др., 1990].
В ходе работ по оценке сорбционной активности изучаемых некрахмальных полисахаридов и препаратов сравнения были проведены эксперименты по оценке скорости течения связывающих процессов, зависимости связывания от рН среды сорбционной системы и величины сорбционной емкости при различных концентрациях сорбата.
В ходе работ по исследованию скорости протекания сорбционных процессов навеску 80 мг исследуемого полисахарида помещали в стеклянную емкость с раствором сорбата (соль металла или биогенное соединение), содержащего 10 мг в пересчете на ионы связываемого вещества. Растворы инкубировали при контролируемых температуре 24°С и рН 5,0 с постоянным перемешиванием в течение периодов от 15 с до 120 мин, после чего определяли количество связанного сорбата. В ходе оценки сорбционной емкости полисахаридов при различных параметрах кислотности сорбционной системы 10 мг порошка сорбата (соль металла или биогенное соединение) растворяли в 10 мл буферного раствора с рН от 2,0 до 10,0. После этого в систему вносили 20 мг исследуемого полисахарида в виде раствора или суспензии и инкубировали в течение 24 ч при температуре 24°С. Сорбент отделяли при помощи фильтрации и по остаточному количеству сорбата судили о связывающей способности исследуемых препаратов.
Изучение зависимости величины сорбционной емкости от равновесной концентрации сорбата проводили при рН 6,0, инкубационном периоде 120 мин и температуре 24°С. В пробирку, содержащую 10 мг раствора или суспензии изучаемого препарата, добавляли сорбат при постоянном перемешивании. Концентрации сорбата варьировали в пределах от 0,05 до 0,7 г/л. Результаты отображали в виде графика зависимости сорбционной емкости от равновесной концентрации сорбата, который носит название «изотерма сорбции». Полученные в ходе экспериментов изотермы сорбции различных соединений некрахмальными полисахаридами и препаратами сравнения использовали для последующей математической обработки результатов посредством математических моделей связывания.
В работе использованы следующие математические модели:
- Модель сорбции Лэнгмюра, которая позволяет описать процессы сорбции веществ на одинарном гомогенном слое сорбента с конечным количеством активных центров связывания. Уравнение Лэнгмюра выглядит следующим образом:
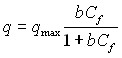 , где
, где
q – сорбционная емкость;
qmax – максимальная сорбционная емкость;
b – коэффициент аффинитета между сорбентом и сорбатом;
![]() - остаточная концентрация металла в растворе.
- остаточная концентрация металла в растворе.
При помощи данной модели определяется коэффициент qmax, отражающий количество сорбционных центров в молекуле сорбента, активно взаимодействующих с сорбатом, и коэффициент b, указывающий на степень аффинитета между конкретным сорбентом и сорбатом. Для расчета параметров изотермы Лэнгмюра был использован следующий метод линеаризации:
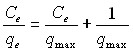
- Модель сорбции Фрейндлиха, которая применима для описания процессов сорбции веществ на одинарном гетерогенном слое сорбента с неопределенным количеством активных центров связывания. Особенностью этой модели является невозможность расчета количества активных центров на единице связывающего агента. Уравнение расчета модели Фрейндлиха выглядит следующим образом:
![]() , где
, где
qe – сорбционная емкость при данной равновесной концентрации;
Се – равновесная концентрация;
КF – коэффициент Фрейндлиха, отражающий количество и прочность образующихся связей между сорбатом и сорбентом;
n – коэффициент, отражающий интенсивность течения сорбционных процессов.
Данная модель позволяет оценить прочность и скорость образования химических связей между сорбентом и сорбатом.
- Модель сорбции Брюне-Еммет-Теллера (Brunauer-Emmet-Teller, BET) применяется для описания сорбционных процессов на гомогенной поверхности сорбента с ограниченным количеством активных центров при условии формирования многослойного связывания. Уравнение BET выглядит следующим образом:
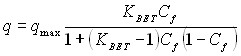 , где
, где
q – сорбционная емкость;
qmax – максимальная сорбционная емкость;
КBET – коэффициент отражающий энергию взаимодействия сорбата с поверхностью сорбента;
![]() – остаточная концентрация металла в растворе.
– остаточная концентрация металла в растворе.
Для качественной оценки сорбционной активности изучаемых препаратов производили расчет констант Лэнгмюра (максимальной сорбционной емкости [qmax] и коэффициента аффинитета [b]), Фрейндлиха (коэффициента связывающей емкости [KF] и коэффициента интенсивности сорбции [n]) и БЭТ (коэффициент максимальной сорбционной емкости [Q]).
Физико-химические и биохимические методы
Количественный анализ тяжелых металлов в биологическом материале проводили атомно-адсорбционным методом [Julshamn K., Andersen K.-J., 1983; Никаноров А.М., Жулидов А.В., 1991]. Материал предварительно высушивали в термостате до постоянной массы при 85°С и тщательно измельченные навески (100,0 – 150,0 мг) переводили в раствор с помощью мокрого озоления в смеси концентрированных кислот (HNO3 : HClO4, 2:1 об/об). Процесс минерализации осуществляли в стеклянных колбах при 180°С в течение 10 ч и прекращали после обесцвечивания образцов. Высушенный остаток перерастворяли в 0,1 н. HCl и использовали для анализа металлов. В качестве контроля использовали соответствующие объемы смесей кислот, которые подвергали аналогичной обработке. Содержание металлов определяли спектрофотометрически. Расчеты проводили относительно стандартных растворов соответствующих металлов, прошедших государственную калибрацию.
Для определения общего холестерина в сыворотке крови к 12 мл смеси спирт-ацетон добавляли 0,3 мл сыворотки, смешивали, тщательно встряхивали и добавляли 6 мл эфира. Раствор фильтровали, фильтрат выпаривали, осадок после охлаждения растворяли в 0,5 мл хлороформа и добавляли 1,9 мл ледяной уксусной кислоты. К 0,4 мл полученного раствора прибавляли 2,4 ледяной уксусной кислоты, 0,2 мл 1% раствора хлорного железа и медленно добавляли 2,0 мл концентрированной серной кислоты. Через 1 ч проводили спектрофотометрию при длине волны 580 нм [Портяная Н.И. и др., 1990].
Содержание общих липидов в сыворотке крови и в печени оценивали, добавляя к 0,2 мл сыворотки или 0,2 мл центрифугата печени порциями, периодически встряхивая, 3,8 мл смеси Блюра (3 части 96° этилового спирта и 1 часть сернокислого эфира). Затем содержимое пробирки встряхивали 2-3 мин и погружали на 20 с в кипящую баню. После охлаждения первоначальный объем восстанавливали смесью Блюра и профильтровывали смесь через бумажный фильтр. К 2,0 мл фильтрата прибавляли 10,0 мл 1% раствора серной кислоты. Через 1 ч измеряли оптическую плотность раствора при длине волны 434 нм [Портяная Н.И. и др., 1990].
Определение активности аланинаминотрансферазы и аспартатаминотрансферазы в сыворотке крови производили с помощью наборов реактивов «Биолахема-тест». 0,25 мл субстрата аланинаминотрансферазы или аспартатаминотрансферазы инкубировали 3 мин при 37°С, добавляли 0,05 мл сыворотки крови и инкубировали 60 мин при 37°С. К смеси добавляли 0,25 мл раствора 2,4-динитрофенилгидразина. Раствор перемешивали, оставляли на 20 мин, добавляли 2,5 мл раствора NaOH, перемешивали и спустя 10 мин измеряли оптическую плотность раствора при длине волны 520 нм.
Количество -липопротеидов устанавливали, измеряя оптическую плотность раствора, полученного при добавлении к 0,2 мл сыворотки крови 2 мл 0,27% раствора CaCl2 и 0,04 1% раствора гепарина [Бородин Е.А., 1989].
Гликоген в печени лабораторных животных измеряли с антроновым реактивом по Ван Ханделу [Van Handel E., 1967], используя глюкозу в качестве стандарта.
Оценку состояния антиоксидантной системы и продуктов перекисного окисления в печени экспериментальных животных проводили в лаборатории фармакологии Института биологии моря ДВО РАН. Печень гомогенизировали в 50 мМ трис-хлоридном буфере (рН=7,8) в стеклянном гомогенизаторе при 0°С. В супернатанте определяли продукты перекисного окисления. Содержание первичных продуктов перекисного окисления – диеновых конъюгатов ненасыщенных жирных кислот оценивали по характерному спектру поглощения раствора липидов в смеси изопропан – гексан. К 2 мл гомогената приливали 4 мл смеси изопропанол-гексан (1:1), встряхивали 10-15 мин на шейкере и прибавляли 1 мл раствора HCl (рН=2,0) и 2 мл гексана. Смесь интенсивно встряхивали. Через 20-30 мин отбирали гексановый слой, в котором измеряли оптическую плотность при длине волны 232 нм [Владимиров Ю.А., Арчаков А.И., 1972].
Для определения малонового диальдегида к 1,0 мл гомогената добавляли 1,0 мл 30% раствора трихлоруксусной кислоты и 1,0 мл 0,75% раствора тиобарбитуровой кислоты. Полученную смесь перемешивали и ставили на водяную баню на 15 мин, а затем центрифугировали. Оптическую плотность надосадочной жидкости, содержащей водорастворимые продукты перекисного окисления липидов, определяли при длине волны 532 нм, молярный коэффициент экстинции =1,6510 см М [Yagy K., 1984].
Для измерения восстановленного глутатиона в печени кусочки органа гомогенизировали, к 1 мл супернатанта приливали 120 мкл 50% раствора трихлоруксусной кислоты, пробу ставили на 30 мин на холод и центрифугировали. К 0,2 мл супернатанта приливали 1,8 мл 0,2 М трис-HCl (рН=8,5), 20 мкл раствора Эллмана и определяли оптическую плотность раствора при длине волны 412 нм [Anderson M.E., 1985].
Оценку интегрального показателя антиоксидантной активности крови проводили методом с применением желточных липопротеидов [Клебанов Г.И. и др., 1988].
Математическая обработка результатов
Расчет коэффициентов математических моделей сорбции Лэнгмюра, Фрейндлиха и Брюне-Эмметта-Таллера проводили с использованием программного обеспечения Microsoft Office for Windows, Excel, 2007.
Для статистического анализа и обработки результатов исследования рассчитывали средние арифметические величины и ошибки средних арифметических. Оценку достоверности различия результатов экспериментальных наблюдений проводили в сравнении с контролем с применением t-критерия Стьюдента для малых величин (n < 30). Для оценки результатов исследований с несколькими выборками использовали метод однофакторного дисперсионного анализа (ANOVA) с последующими проведением post hoc теста Tkuey’s. Уровень значимости считали достоверным при p < 0,05. Статистическая обработка полученных в ходе исследований результатов была проведена с использованием программного обеспечения SPSS for Windows, версия 11.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
В ходе собственных исследований была проведена комплексная оценка фармакологических эффектов природных и химически модифицированных некрахмальных полисахаридов и возможных механизмов реализации этих эффектов. Было обнаружено, что в большинстве случаев фармакологическая активность полисахаридных соединений обусловлена их способностью связывать и удерживать неорганические и органические соединения (сорбционная активность). В связи с этим все эксперименты были выполнены по сходной методике. В первую очередь определяли потенциальные вещества-мишени, с которыми потенциально могут взаимодействовать полисахаридные молекулы. Затем в условиях in vitro проводили комплексную оценку связывающей активности некрахмальных полисахаридов в отношении веществ-мишеней с определением параметров динамики процессов, условий формирования комплексов и вычисления констант связывающей активности. После этого на моделях патологических процессов в условиях in vivo оценивали фармакологическая эффективность некрахмальных полисахаридов.
Металлсвязывающая активность некрахмальных полисахаридов
Связывающую активность некрахмальных полисахаридов изучали в отношении ионов двухвалентных металлов, таких как медь, кадмий, свинец, цинк, ртуть и стронций, и сравнивали с параметрами сорбции лекарственных препаратов энтеросорбентов (активированный уголь, полифепан, микрокристаллическая целлюлоза).
Изучение скорости связывающих процессов показало, что связывание ионов металлов полисахаридами, растворимыми в воде, происходит достоверно быстрее, чем нерастворимыми. Так, через 1 мин инкубации растворимые полисахариды связывали от 50% до 77,1% максимального количества поглощенных ионов металла, через 5 мин – от 78,7% до 95%, через 20 мин – от 87,5% до 98%, а через 45 мин все исследуемые препараты связывали практически 100% от максимально возможного количества поглощенных ионов металла (рис. 1). Скорость связывания металлов нерастворимыми полисахаридами была ниже. Через 5 мин связывалось от 43,9% до 72,2% максимально возможного количества поглощенных ионов металла. Максимальное связывание достигалось за 120 мин инкубации (рис. 2). Анализ результатов показал, что насыщение полисахаридов, характеризующихся небольшой абсолютной сорбционной емкостью (хитозан, каррагинан), происходит быстрее, чем у соединений с выраженной сорбционной емкостью (деэтерифицированный пектин, производные альгиновой кислоты). Также скорость связывания замедляется у соединений, обладающих высокой гелеобразующей способностью (альгинат натрия). Наименьшая скорость связывающих процессов была отмечена у активированного угля и полифепана. Так как скорости связывания различных металлов изучаемыми соединениями достоверно не различались, то на рисунках 1 и 2 в качестве иллюстрации динамики взаимодействия между молекулами некрахмальных полисахаридов и ионами двухвалентных металлов приведены данные о скорости связывания ионов меди.
Формирование связей между молекулами некрахмальных полисахаридов и ионами металлов в значительной мере зависит от значений рН среды, в которой протекает реакция связывания. Согласно литературным данным, в зависимости от рН изменяется поверхностный заряд сорбента, степень ионизации, а также активность лигандных центров [Shmuhl R. et al., 2001], в которых происходит связывание ионов металла.
Большинство исследованных некрахмальных полисахаридов проявляет сорбционную активность в пределах рН от 4,0 до 8,0 (рис. 3), при этом сорбционная емкость достоверно уменьшалась при выраженном сдвиге рН в щелочную сторону.
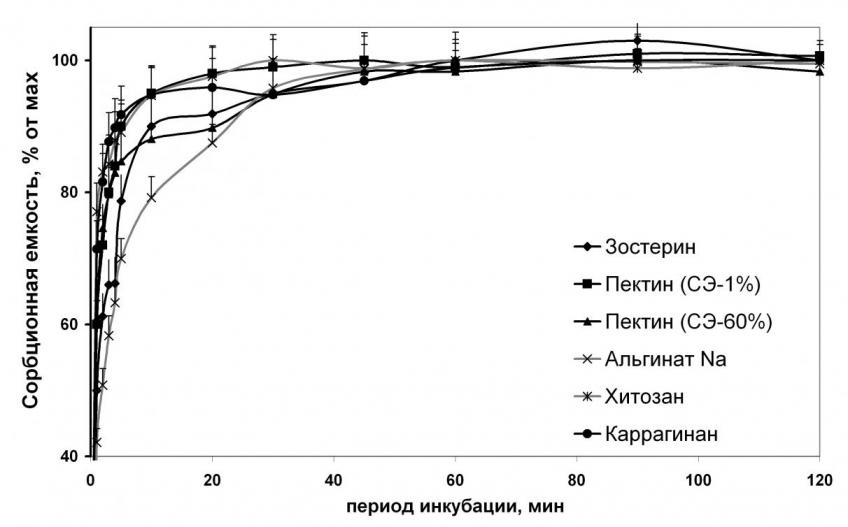
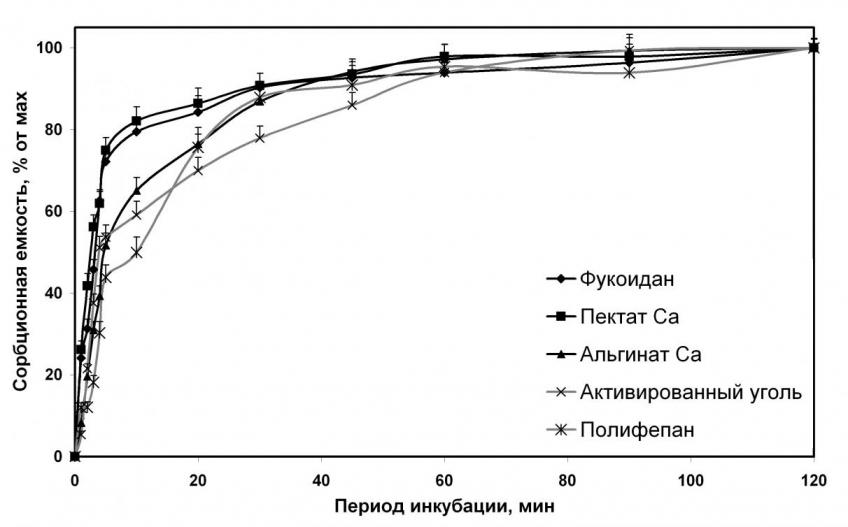
| Рисунок 1. Кинетика связывания меди растворимыми в воде полисахаридами. | Рисунок 2. Кинетика связывания меди нерастворимыми в воде сорбентами. |
по оси абсцисс – время взаимодействия, по оси ординат – количество связанного металла в % от максимальной сорбционной емкости каждого сорбента.
Изменения показателей сорбционной емкости хитозана и каррагинана при различных значениях рН отличались от таковых остальных полисахаридов. Так, при кислых значениях рН (до 5,0) связывающая способность этих двух полисахаридов близка к нулю. При значениях рН выше 5,0 она резко возрастает и достигает своего максимума при рН 7,5-8,0, после чего резко уменьшается при рН 10,0. Подобное изменение рН, по-видимому, обусловлено тем, что константа диссоциации этих соединений равна 5,0 (рК=5,0). Связывающая активность активированного угля и полифепана мало зависит от значений рН среды.
В ходе исследования были использованы буферные растворы, не вступающие в реакцию с лигандными центрами некрахмальных полисахаридов. Тем не менее, при оценке результатов следует принять во внимание то факт, что буферные системы могли оказывать влияние на процесс связывания, оценить степень которого не представляется возможным.
Изучение условий течения сорбционных реакций показало, что влияние кислотности среды на связывающую активность некрахмальных полисахаридов в отношении различных двухвалентных металлов достоверно не различается. Поэтому в качестве иллюстрации на рисунке 3 приведены графики сорбционной емкости изучаемых соединений при взаимодействии с ионами меди.
На рисунке 4 приведены изотермы сорбции связывания ионов меди некрахмальными полисахаридами и лекарственными препаратами энтеросорбентами. Анализ изотерм сорбции показал, что при различных концентрациях меди в растворе сорбционной системы эффективность связывания металла указанными препаратами различается. В частности, в области концентраций меди менее 200 мг/л наибольшей сорбционной емкостью характеризовался альгинат натрия, а при концентрации меди в растворе больше 200 мг/л сорбционная емкость фукодиана и хитозана превосходила таковую альгината натрия.
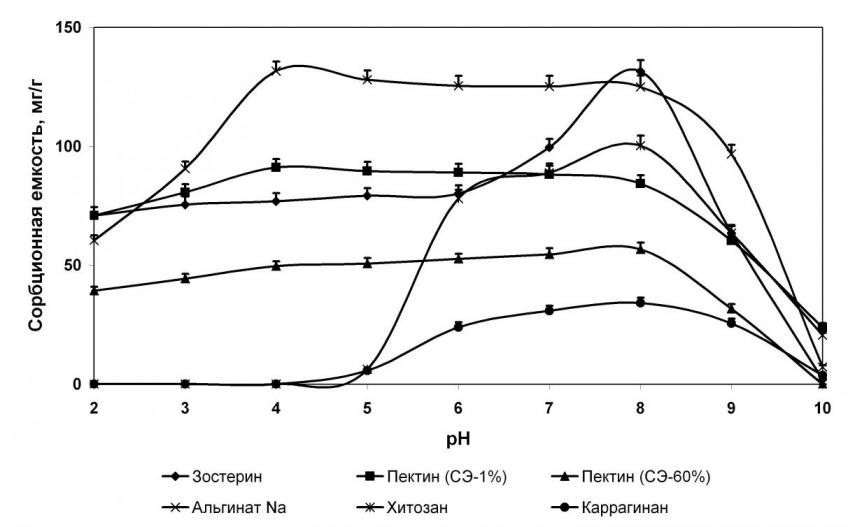
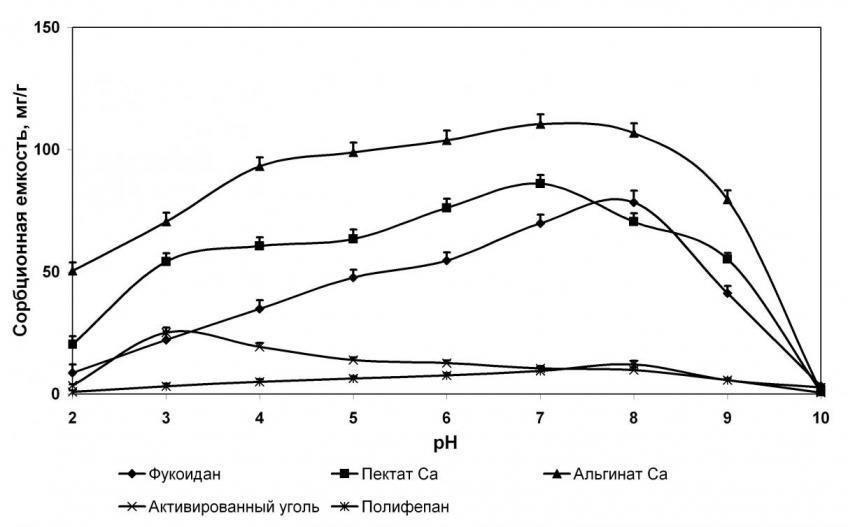
Рисунок 3. Зависимость медьсвязывающей способности некрахмальных полисахаридов и препаратов сравнения от значении рН среды.
Для оценки сорбционной активности использовали три математические модели: Лэнгмюра, Фрейндлиха и Брюне-Эмметт-Таллера. Для оценки релевантности использования моделей был рассчитан коэффициент аппроксимации (R2), в соответствии с которым для описания данных процессов наиболее подходящими являются модели Лэнгмюра и Фрейндлиха. Математическая модель БЭТ, описывающая многослойное связывание сорбатов однородными активными центрами, не подходит для описания связывания меди полисахаридными препаратами и энтеросорбентами (R2<0,95) (табл. 1). Для визуализации достоверности использования моделей Лэнгмюра и Фрейндлиха на рисунках 5 и 6 приведены графики линеаризации полученных данных с указанием уравнений и значений R2. Для оценки медьсвязывающей активности изучаемых соединений оценивали коэффициент максимальной сорбционной емкости (qmax), отражающий количество связывающих центров в молекуле сорбента, коэффициент аффинитета (b), рассчитанные при помощи уравнения Лэнгмюра, и коэффициенты Фрейндлиха, указывающие на прочность связывания и интенсивность реакций.
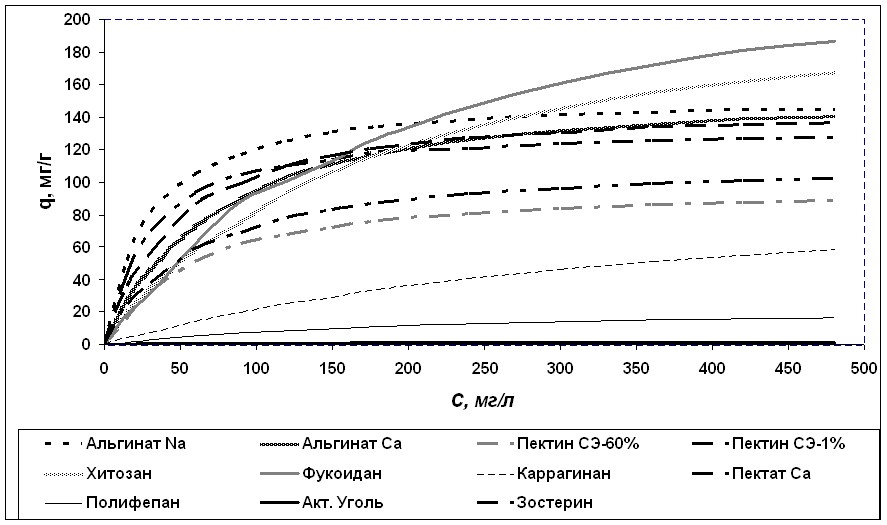
Рисунок 4. Изотермы сорбции меди некрахмальными полисахаридами и препаратами сравнения.
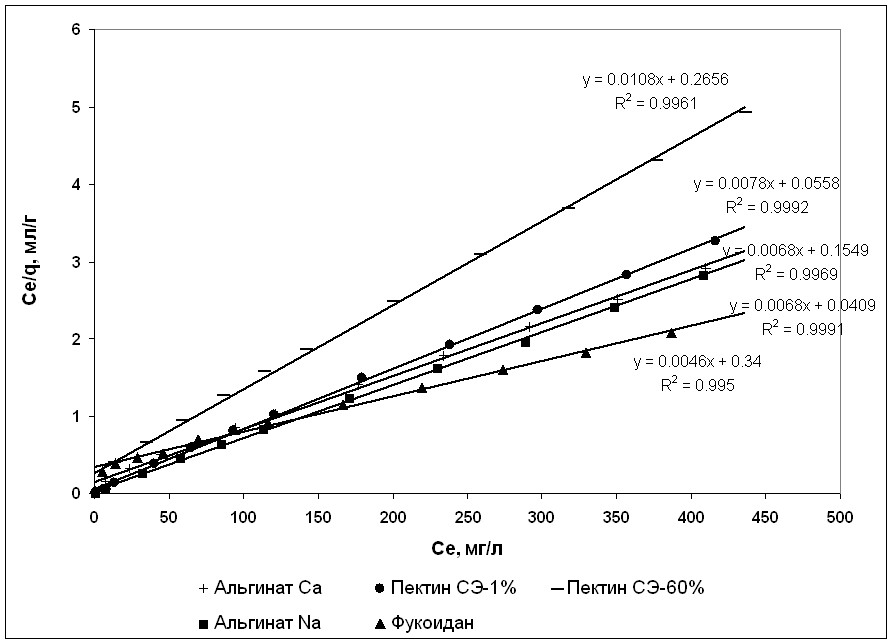

Рисунок 5. Линеаризация изотерм сорбции меди некрахмальными полисахаридами при помощи модели Лэнгмюра.
В таблицах 1-6 приведены результаты расчета констант Лэнгмюра и Фрейндлиха, характеризующие взаимодействие изучаемых некрахмальных полисахаридов с двухвалентными металлами.
Анализ связывающей активности некрахмальных полисахаридов в отношении меди показал, что процессы сорбции протекают в соответствии с моделью Лэнгмюра. Наибольший коэффициент qmax в отношении ионов меди характерен для фукоидана, однако, коэффициенты аффинитета (b) и прочности образовавшихся связей (KF), а также показатель интенсивности сорбционных процессов (n) у фукоидана достоверно ниже аналогичных показателей полисахаридов. Вследствие этого фукоидан, не смотря на большое количество связывающих центров, проявляет слабую медьсвязывающую активность.

Рисунок 6. Линеаризация изотерм сорбции меди некрахмальными полисахаридами при помощи модели Фрейндлиха.
Сходные параметры сорбционной активности были обнаружены у хитозана. Альгинаты натрия и кальция обладают примерно одинаковым количеством связывающих центров в молекуле, что подтверждается близкими значениями qmax, но при этом альгинат натрия обладает более выраженным аффинитетом к ионам меди (b) и быстрее образует связи достаточной прочности (коэффициенты n и KF). Наличие ионов кальция в молекуле альгината приводит к явлению конкурирования ионов металлов за активные центры и резкому уменьшению степени аффинитета и снижению прочности образующихся связей.
Оценка сорбционных свойств пектинов показала, что наибольшей медьсвязывающей активностью обладает деэтерифицированный пектин. Природный низкоэтерифицированный пектин из морской травы Z.marina, хотя и характеризуется большим количеством активных центров, способен связать меньшее количество ионов меди вследствие снижения аффинитета и прочности связей.
Таблица 1. Коэффициенты связывания меди некрахмальными полисахаридами
| Сорбент | Модель Лэнгмюра | Модель Фрейндлиха | ||||
| b | q max, мг/г | R2 | KF | n | R2 | |
| Фукоидан | 0,013 | 222,2 | 0,9950 | 2,610 | 1,87 | 0,9656 |
| Хитозан | 0,014 | 192,3 | 0,9932 | 2,745 | 2,04 | 0,9828 |
| Альгинат Na | 0,171 | 144,9 | 0,9991 | 6,378 | 7,76 | 0,9009 |
| Альгинат Са | 0,044 | 147,0 | 0,9969 | 4,352 | 3,63 | 0,9827 |
| Зостерин | 0,091 | 138,9 | 0,9986 | 5,282 | 5,13 | 0,9497 |
| Пектин СЭ-1% | 0,141 | 128,2 | 0,9991 | 5,836 | 7,08 | 0,9248 |
| Пектин СЭ-60% | 0,031 | 94,3 | 0,9961 | 2,947 | 2,81 | 0,8921 |
| Пектат Са | 0,042 | 106,4 | 0,9978 | 3,792 | 3,66 | 0,9746 |
| Каррагинан | 0,003 | 99,0 | 0,9981 | 0,842 | 1,33 | 0,9893 |
| Активированный уголь | 0,015 | 78,7 | 0,9976 | 2,039 | 2,29 | 0,8187 |
| Полифепан | 0,005 | 23,1 | 0,9992 | 0,631 | 1,53 | 0,9697 |
Таблица 2. Коэффициенты связывания свинца некрахмальными полисахаридами
| Сорбент | Модель Лэнгмюра | Модель Фрейндлиха | ||||
| b | q max, мг/г | R2 | KF | n | R2 | |
| Фукоидан | 0,042 | 500,0 | 0,9952 | 8,321 | 4,90 | 0,9460 |
| Хитозан | 0,001 | 133,3 | 0,9267 | 0,288 | 1,07 | 0,9971 |
| Альгинат Na | 0,423 | 454,5 | 0,9999 | 12,277 | 17,6 | 0,7669 |
| Альгинат Са | 0,190 | 434,8 | 0,9995 | 10,886 | 10,3 | 0,7568 |
| Зостерин | 0,213 | 384,6 | 0,9997 | 10,544 | 11,8 | 0,7953 |
| Пектин СЭ-1% | 0,084 | 555,6 | 0,9977 | 9,895 | 5,99 | 0,9001 |
| Пектин СЭ-60% | 0,010 | 357,1 | 0,9976 | 3,800 | 2,35 | 0,9631 |
| Пектат Са | 0,023 | 416,7 | 0,9945 | 5,921 | 3,35 | 0,9721 |
| Каррагинан | 0,009 | 53,8 | 0,9998 | 1,786 | 2,53 | 0,9141 |
| Активированный уголь | 0,003 | 270,3 | 0,9867 | 1,781 | 1,6 | 0,9827 |
| Полифепан | 0,001 | 312,5 | 0,9959 | 0,830 | 1,23 | 0,9944 |
Таблица 3. Коэффициенты связывания кадмия некрахмальными полисахаридами
| Сорбент | Модель Лэнгмюра | Модель Фрейндлиха | ||||
| b | q max, мг/г | R2 | KF | n | R2 | |
| Фукоидан | - | - | - | - | - | - |
| Хитозан | 0,008 | 175,4 | 0,9997 | 2,520 | 2,21 | 0,9451 |
| Альгинат Na | 0,511 | 222,2 | 0,9999 | 9,560 | 27,85 | 0,7775 |
| Альгинат Са | 0,023 | 48,8 | 1,0000 | 2,722 | 4,14 | 0,8711 |
| Зостерин | 0,043 | 105,3 | 0,9999 | 4,537 | 5,45 | 0,8555 |
| Пектин СЭ-1% | 0,131 | 185,2 | 0,9998 | 7,524 | 10,77 | 0,8748 |
| Пектат Са | 0,009 | 59,5 | 0,9997 | 1,831 | 2,49 | 0,9006 |
| Каррагинан | 0,0002 | 54,3 | 0,7869 | 0,152 | 1,05 | 0,9981 |
| Пектин СЭ-60% | 0,002 | 64,9 | 0,9971 | 0,597 | 1,37 | 0,9878 |
| Активированный уголь | 0,004 | 14,6 | 0,9984 | 0,555 | 1,69 | 0,9600 |
| Полифепан | 0,007 | 8,6 | 0,9999 | 0,688 | 2,27 | 0,9342 |
Сорбционная активность высокоэтерифицированного пектина значительно меньше вследствие того, что активные центры свободных карбоксильных групп в его молекуле этерифицированы метильными радикалами, наличие которых уменьшает общее количество активных центров, а также снижает их связывающую способность. Поскольку для формирования полноценного связывающего центра в молекуле пектина необходимо близкое расположение четырех неэтерифицированных карбоксильных групп, в присутствии метильных радикалов возможно формирование большого количества центров, состоящих из трех или двух карбоксильных остатков, что и проявляется снижением показателя аффинитета и прочности связей. Пектат кальция, сходный по своим параметрам с деэтерифицированным пектином, обладает меньшей медьсвязывающей активностью, что объясняется конкурентным взаимодействием меди с кальцием. Наиболее пологая изотерма сорбции меди характерна для каррагинана. При относительно высокой qmax и низких параметрах аффинитета и прочности связей этого полисахарида, его связывающая способность остается низкой. Активированный уголь и полифепан характеризуются низкой металлсвязывающей способностью.
Сходные результаты были получены при оценке связывающей способности полисахаридов в отношении свинца и кадмия, указывающие, что наиболее активными являются производные пектинов и альгинатов, поэтому следующие исследования были сфокусированы на этих полисахаридах.
Таблица 4. Коэффициенты связывания цинка некрахмальными полисахаридами
| Сорбент | Модель Лэнгмюра | Модель Фрейндлиха | ||||
| b | q max, мг/г | R2 | KF | n | R2 | |
| Пектин СЭ-1% | 0,130 | 131,6 | 0,9943 | 4,500 | 2,91 | 0,9032 |
| Пектин СЭ-20% | 0,105 | 105,3 | 0,9981 | 4,804 | 4,62 | 0,9926 |
| Пектин СЭ-40% | 0,088 | 79,4 | 0,9927 | 4,383 | 5,34 | 0,9519 |
| Пектин СЭ-60% | 0,013 | 75,7 | 0,9683 | 1,736 | 1,87 | 0,9990 |
| Пектат Са | 0,118 | 96,1 | 0,9999 | 3,561 | 2,67 | 0,9639 |
| Альгинат Са | 0,024 | 62,9 | 0,9773 | 1,719 | 1,83 | 0,8853 |
| Акт уголь | 0,020 | 5,5 | 0,9601 | 0,760 | 2,50 | 0,8369 |
| МКЦ | 0,043 | 5,1 | 0,9847 | 1,282 | 5,81 | 0,8713 |
| Полифепан | 0,027 | 7,4 | 0,9758 | 1,068 | 3,18 | 0,9530 |
Изучение связывания ионов цинка показало, что наибольшей активностью обладают деэтерифицированный пектин и производные альгиновой
кислоты, что соответствовало результатам, полученным в предыдущих экспериментах. Процессы связывания цинка соответствовали модели Лэнгмюра.
Изучение процессов взаимодействия некрахмальных полисахаридов с ионами ртути и стронция показало, что в этих случаях сорбционные реакций протекают по механизмам, описываемым уравнением Фрейндлиха, за исключением деэтерифицированного пектина, пектата кальция и альгината кальция (табл. 5 и 6). В связи с этим сравнение ртуть- и стронцийсвязывающей активности изучаемых образцов проводили, исходя из значений коэффициентов прочности связей между сорбентом и сорбатом (KF) и интенсивности течения сорбционных процессов (n). Результат расчета параметров математической модели сорбции Лэнгмюра показал, что наибольшим значением qmax характеризуется пектат кальция. Деэтерифицированный пектин незначительно уступает пектату кальция по этому показателю. Альгинат кальция характеризуется значительно меньшим значением qmax, при этом, коэффициент аффинитета у пектата кальция и альгината кальция примерно одинаков. Коэффициент сродства деэтерифицированного пектина значительно превосходит значения этого параметра у кальций содержащих полисахаридов. Вероятно, ртутьсвязывающая активность пектиновых препаратов превосходит аналогичную активность производных альгиновой кислоты.
Поскольку механизмы реакций ртутьсвязывающей и стронцийсвязывающей активности достоверно описывались при помощи модели сорбции Фрейндлиха, можно сделать заключение о том, что связывание этих металлов растворимыми в воде полисахаридами протекает путем образования разнородных свя
Таблица 5. Коэффициенты связывания ртути некрахмальными полисахаридами
| Сорбент | Модель Лэнгмюра | Модель Фрейндлиха | ||||
| b | q max, мг/г | R2 | KF | n | R2 | |
| Пектин СЭ-1% | 0,056 | 114,9 | 0,9858 | 2,607 | 1,861 | 0,9658 |
| Пектин СЭ-20% | 0,003 | 113,6 | 0,0266 | 0,694 | 0,893 | 0,9887 |
| Пектин СЭ-40% | 0,002 | 200,0 | 0,7973 | 0,825 | 1,181 | 0,9466 |
| Пектин СЭ-60% | - | - | - | - | - | - |
| Пектат Са | 0,024 | 131,6 | 0,9541 | 2,067 | 1,572 | 0,8700 |
| Альгинат Na | 0,002 | 555,5 | 0,0391 | 1,037 | 1,007 | 0,9635 |
| Альгинат Са | 0,029 | 78,1 | 0,9980 | 2,148 | 2,094 | 0,9648 |
| Акт уголь | 0,001 | 46,95 | 0,1957 | 0,199 | 0,880 | 0,9500 |
| МКЦ | 0,014 | 11,7 | 0,1325 | 1,003 | 2,532 | 0,9614 |
| Полифепан | 0,008 | 14,1 | 0,7006 | 0,891 | 2,197 | 0,9733 |
Таблица 6. Коэффициенты связывания стронция некрахмальными полисахаридами
| Сорбент | Модель Лэнгмюра | Модель Фрейндлиха | ||||
| b | q max, мг/г | R2 | KF | n | R2 | |
| Пектин СЭ-1% | 0,002 | 200,0 | 0,6798 | 0,825 | 1,18 | 0,9879 |
| Пектин СЭ-20% | 0,003 | 113,6 | 0,0266 | 0,694 | 0,89 | 0,9562 |
| Пектин СЭ-40% | 0,008 | 46,3 | 0,8678 | 0,271 | 0,57 | 0,9986 |
| Пектин СЭ-60% | - | - | - | - | - | - |
| Пектат Са | 0,024 | 131,5 | 0,9710 | 2,067 | 1,57 | 0,8957 |
| Альгинат Na | 0,002 | 555,5 | 0,1314 | 1,037 | 1,00 | 0,9277 |
| Альгинат Са | 0,029 | 78,1 | 0,9980 | 2,148 | 2,09 | 0,9648 |
| Акт уголь | 0,001 | 46,9 | 0,1372 | 0,199 | 0,88 | 0,9514 |
| МКЦ | 0,014 | 11,8 | 0,9944 | 1,003 | 2,53 | 0,8751 |
| Полифепан | 0,008 | 14,1 | 0,8650 | 0,891 | 2,20 | 0,9347 |
зей с различными участками полисахаридных молекул, что ведет к образованию связывающих центров, различающихся по своему строению и способности образовывать химические связи. Вероятно, в ходе взаимодействия карбоксильных групп уроновых кислот с ионами металлов происходит процесс быстрого формирования зон связывания, которые содержат одну или две карбоксильные группы, на что указывает малая связывающая способность в условиях низких концентраций металла. При связывании ртути и стронция нерастворимыми кальциевыми солями альгинатов и пектинов происходит образование однородных центров связывания с высоким аффинитетом к ионам металла, которые по своей структуре соответствуют модели “egg-box”, предложенной для описания сорбции металлов некрахмальными полисахаридами [Grant G.T. et al., 1973]. Наличие ионов кальция является фактором, определяющим изначальное структурирование цепей полимера, в которых в дальнейшем происходит замещение ионов кальция на другой ион металла без нарушения “egg-box” структуры молекулы.
В результате проведенных исследований был сделан вывод о том, что наиболее активными в отношении ионов двухвалентных металлов являются альгинат натрия и деэтерифицированный пектин (степень этерификации 1%).
Взаимодействие некрахмальных полисахаридов
с металлами в условиях in vivo
Основываясь на результатах in vitro экспериментов, указывающих на эффективное взаимодействие некрахмальных полисахаридов и ионов двухвалентных металлов, были проведены исследования по оценке фармакологической эффективности полисахаридных веществ в условиях моделированной свинцовой интоксикации у лабораторных животных. Было проведено три серии экспериментов по изучению влияния некрахмальных полисахаридов на кишечную абсорбцию и накопление ионов металла в тканях, на выведение металла из органов депо и на кишечную экскрецию ионов свинца.
Результаты показали, что пероральное введение свинца в течение трех недель способствует быстрому накоплению ионов металла в печени, почках, печени и бедренной кости лабораторных животных. В случае, если одновременно с раствором свинца в организм лабораторных животных вводится альгинат кальция, пектат кальция или деэтерифицированный пектин, количество свинца, накапливаемого в указанных органах и бедренной кости достоверно уменьшается. Следует отметить, что введение коммерческого высокоэтерифицированного пектина, также как и лекарственных препаратов энтеросорбентов (полифепан, активированный уголь) не изменяет уровень абсорбции свинца и его накопление во внутренних органах (табл. 7).
Выведение тяжелых металлов, депонированных в организме, представляет собой сложную задачу с точки зрения фармакотерапии, поскольку ионы металла обычно находятся в тканях-депо в связанном состоянии. В проведенных экспериментах некрахмальные полисахариды вводили перорально ежедневно в течение трех недель в дозах 0,1 и 0,5 мг/кг на фоне свинцовой интоксикации, вызванной трехнедельным введением свинца.
Таблица 7. Содержание свинца в органах крыс, получавших одновременно ацетат свинца и полисахариды (0,5 г/кг/сут) в течение 21 дня
| Группа животных | Концентрация свинца (мкг/г сухой массы) | |||
| Печень | Сердце | Почки | Бедренная кость | |
| Контроль | 3,6 ±0,6 | 10,0 ± 1,6 | 12,2 ± 2,4 | 34,8 ± 4,6 |
| Ацетат свинца | 12,4 ±1,8 | 28,2 ±2,9 | 64,3 ± 7,2 | 377,2 ± 46,3 |
| Ацетат свинца + альгинат кальция | 8,0 ± 1,3* | 12,4 ±1,5* | 29,7 ± 4,4* | 131,2 ± 22,8* |
| Ацетат свинца + д/э пектин | 7,3 ± 1,1* | 14,6 ± 1,8* | 21,6 ±3,2* | 157,1 ± 24,7* |
| Ацетат свинца + пектат кальция | 7,5 ± 1,0* | 14,6 ± 1,7* | 26,9 ± 3,4* | 129,2 ± 20,6* |
| Ацетат свинца + в/э пектин | 16,9 ±1,8 | 23,5 ± 2,2 | 49,8 ± 5,2 | 286,1 ±30,8 |
| Ацетат свинца + полифепан | 14,2 ±1,6 | 31,4 ±2,6 | 58,1 ±6,2 | 300,4 ±41,2 |
| Ацетат свинца + активированный уголь | 14,3 ±1,5 | 26,3 ±2,1 | 66,4 ±7,1 | 349,0 ± 34,8 |
Примечание: данные представлены в виде M ± SEM.
* - Р < 0,05 в сравнении с группой «Ацетат свинца».
Результаты показали, что применение всех исследуемых некрахмальных полисахаридов, включая коммерческий высокоэтерифицированный пектин, способствует достоверному уменьшению содержания ионов свинца в почках и бедренной кости лабораторных животных. Полученные данные соответствовали результатам, полученным в ходе in vitro экспериментов, следуя которым высокоэтерифицированный пектин менее эффективен, чем деэтерифицированный пектин и альгинаты натрия и кальция. Лекарственные препараты энтеросорбенты достоверно не влияли на содержание свинца во внутренних органах и бедренной кости (табл. 8).
Следует отметить, что трехнедельное введение пектинов привело к достоверному увеличению содержания свинца в печени и сердце экспериментальных животных. При этом содержание ионов свинца достоверно превышало значения этого параметра и у здоровых животных, и у животных, получавших только свинец на протяжении трех недель. Этот факт можно объяснить тем, что применение полисахаридов привело к быстрому и выраженному перераспределению ионов свинца из тканей-депо в кровь, в результате чего ионы металла накапливались в органах с хорошим кровоснабжением, каковыми являются печень и сердце. Таким образом, некрахмальные полисахариды воздействуют не только на ионы свинца, находящиеся в просвете кишечника, но и путем опосредованных механизмов оказывают влияние на депонированный металл, способствуя его мобилизации из депо и дальнейшему выведению из организма. Следует принять во внимание, что в эксперименте полисахариды вводились в большой дозе, что привело к неблагоприятному перераспределению металла в организме.
Описанные эксперименты были выполнены с использованием доз некрахмальных полисахаридов 0,1 и 0,5 мг/кг в сутки. Результаты показали наличие дозо-зависимой эффективности исследованных образцов.
Выведение тяжелых металлов из организма осуществляется двумя путями – через мочевыделительную систему и через желудочно-кишечный тракт. В следующей серии экспериментов была дана оценка металлсвязывающей способности полисахаридов и их влиянию на выведение свинца из организма крыс через желудочно-кишечный тракт.
Таблица 8. Содержание свинца в органах крыс с повышенным уровнем свинца в организме, получавших полисахариды (0,5/кг/сут) в течение 21 дня
| Группа животных | Концентрация свинца (мкг/г сухой массы) | |||
| Печень | Сердце | Почки | Бедренная кость | |
| Контроль | 15,1±2,7 | 11,3±1,2 | 29,3±3,8 | 36,1±4,8 |
| Ацетат свинца | 13,3±1,4 | 14,7±0,9 | 1034,5±133,7* | 296,8±46,5* |
| Ацетат свинца + альгинат кальция | 18,5±1,7* | 29,7±3,3* | 390,2±38,2* | 252,7±23,9 |
| Ацетат свинца + д/э пектин | 46,0±14,4* | 44,9±9,9* | 645,8±122,9* | 153,1±13,2* |
| Ацетат свинца + пектат кальция | 32,8±6,8* | 30,6±4,2* | 690,3±87,3* | 190,5±17,4* |
| Ацетат свинца + в/э пектин | 23,5±3,2* | 25,2±0,6* | 681,1±116,2* | 308,3±32,4 |
| Ацетат свинца + полифепан | 11,6±0,6 | 15,0±0,9 | 702,7±138,8 | 329,5±34,9 |
| Ацетат свинца + активированный уголь | 16,2±1,7 | 14,7±1,3 | 820,5±123,8 | 332,7±31,4 |
Примечание: данные представлены в виде M ± SEM, * - Р < 0,05 в сравнении с группой «Ацетат свинца».
На фоне дополнительного введения свинца кишечная экскреция металла
достоверно не увеличивалась, что указывает на то, что свинец либо аккумулируется в органах-депо, либо выводится через почки. В то же время, введение деэтерицифированного пектина, пектата кальция или альгината кальция достоверно увеличивало выведение свинца через кишечник (табл. 9).
Увеличение кишечной экскреции свинца не может не отражаться на функциональной активности внутренних органов лабораторных животных. В ходе экспериментальных работ была проведена оценка функциональной активности печени и щитовидной железы в условиях свинцовой интоксикации, а также эффективность применения деэтерифицированного пектина. Результаты показали, что избыточное поступление свинца инициирует процессы перекисного окисления липидов в печени и ведет к нарушению обмена липидов, сопровождаемому гиперлипидемией и гипертриглицеридемией. Применение на этом фоне деэтерифицированного пектина приводило к достоверному уменьшению содержания продуктов перекисного окисления липидов и снижению уровня холестерина и триглицеридов крови, что может рассматриваться как гепатопротекторное действие при интоксикации свинцом.
Функциональная активность щитовидной железы также изменялась вследствие воздействия ионов свинца, что проявлялось увеличением объема фолликулов и массы железы в целом, а также снижением продукции трийодтиронина и тироксина. Применение деэтерифицированного пектина приводило к нормализации морфологической структуры железы и уменьшению ее массы, а также достоверному увеличению секреции трийодтиронина.
Полученные данные указывают на то, что деэтерифицированный пектин (степень этерификации 1%), пектат кальция и альгинат кальция могут рассматриваться в качестве перспективных источников для выведения тяжелых металлов из организма и коррекции патологических состояний, вызванных избыточным воздействием тяжелых металлов.
Таблица 9. Эффект введения некрахмальных полисахаридов в течение 6 дней на количество свинца в фекалиях крыс, с повышенным уровнем свинца
| Группа животных | Количество свинца, мкг |
| Контроль | 321,85 ± 7,41 |
| Свинец | 353, 64 ± 20,34 |
| Свинец + д/э пектин | 428,66 ± 39,67* |
| Свинец + в/э пектин | 340,28 ± 13,71 |
| Свинец + пектат кальция | 515,25 ± 41,70* |
| Свинец + альгинат кальция | 406,00 ± 16,23* |
| Свинец + альгинат натрия | 377,29 ± 9,55 |
| Свинец + каррагинан | 302,33 ± 18,63 |
| Свинец + хитозан | 309,2 ±19,66 |
Примечание: данные представлены в виде M ± SEM,
* - Р < 0,05 в сравнении с группой «свинец».
Эффективность некрахмальных полисахаридов при экспериментальной почечной недостаточности
Патогенез развития симптомов хронической почечной недостаточности (ХПН) во многом обусловлен явлениями уремической интоксикации, которые связаны с накоплением в организме мочевины, креатинина и других продуктов белкового обмена. В связи с этим в лечении больных с ХПН широкое распространение получили методы детоксикации организма. В последние 15-20 лет для этих целей стали использовать пероральные сорбенты. В основе этого метода лежит выведение из организма токсических веществ экзогенной или эндогенной природы без оперативного вмешательства за счет их поглощения или нейтрализации в пищеварительном канале. Принимая во внимание выраженную связывающую активность некрахмальных полисахаридов, нами была проведена серия экспериментов по оценке эффективности связывания и выведения уремических токсинов некрахмальными полисахаридами.
Изначально были изучены особенности взаимодействия полисахаридов с уремическими токсинами в условиях in vitro. В рамках данной работы были использованы модели взаимодействия с мочевиной и креатинином. Установлено, что быстрее всего связывание креатинина происходит при взаимодействии с деэтерифицированным пектином. Максимальное насыщение достигалось в течение 10 мин инкубации. Связывание креатинина альгинатом кальция, активированным углем и полифепаном происходило достоверно медленнее. Связывание мочевины пектинами и альгинатами происходило с одинаковой скоростью и достигало максимума в течение 15-20 мин.
Расчет констант связывания креатинина и мочевины некрахмальными полисахаридами, активированным углем и полифепаном проводили при помощи математических моделей сорбции Лэнгмюра и Фрейндлиха. Наибольший коэффициент максимальной сорбционной емкости (qmax) характерен для пектина со степенью этерификации 1% и для альгината кальция. При этом альгинат кальция проявлял больший аффинитет и образовывал более прочные связи, на что указывают значения b и KF, превосходящие таковые деэтерифицированного пектина. Значения qmax активированного угля и полифепана были одинаковыми. Активированный уголь, в свою очередь, характеризовался самым высоким коэффициентом аффинитета, но в силу малого значения qmax и KF, его сорбционная активность значительно уступала таковой некрахмальных полисахаридов. Связывающая активность полифепана в отношении креатинина была самой низкой (табл. 10 и 11).
В следующих сериях экспериментов было показано, что применение некрахмальных полисахаридов на модели почечной недостаточности способствует снижению уровня уремических токсинов. Поражение почек моделировали введением нитрата ртути. Деэтерифицированный пектин и альгинаты натрия и кальция вводили ежедневно в дозе 0,5 г/кг, что по окончании эксперимента привело к достоверному увеличению суточного диуреза и уменьшению уровня креатинина и мочевины в крови (табл. 12).
Таблица 10. Коэффициенты связывания креатинина некрахмальными полисахаридами
| Сорбент | Модель Лэнгмюра | Модель Фрейндлиха | ||||
| b | q max, ммоль/г | R2 | KF | n | R2 | |
| Пектин СЭ-1% | 7,328 | 0,0046 | 0,9871 | 0,1066 | 2,050 | 0,9914 |
| Альгинат Са | 9,683 | 0,0046 | 0,9777 | 0,1137 | 2,069 | 0,9950 |
| Акт уголь | 15,996 | 0,0017 | 0,9603 | 0,0731 | 2,612 | 0,8573 |
| Полифепан | 3,714 | 0,0017 | 0,9701 | 0,0673 | 1,560 | 0,9932 |
Таблица 11. Коэффициенты связывания мочевины некрахмальными полисахаридами
| Сорбент | Модель Лэнгмюра | Модель Фрейндлиха | ||||
| b | q max, ммоль/г | R2 | KF | n | R2 | |
| Пектин СЭ-1% | 2,420 | 0,2751 | 0,9852 | 0,5334 | 1,649 | 0,9870 |
| Альгинат Са | 0,545 | 0,1697 | 0,9817 | 0,3073 | 2,579 | 0,9787 |
| Акт уголь | 0,191 | 0,3501 | 0,9807 | 0,3393 | 2,327 | 0,9555 |
| Полифепан | 0,204 | 0,0147 | 0,9600 | 0,0789 | 1,770 | 0,9366 |
Таблица 12. Влияние некрахмальных полисахаридов на показатели уремической интоксикации у крыс с экспериментальной почечной недостаточностью
| Группа | Суточный диурез, мл | Мочевина, ммоль/л | Креатинин, ммоль/л |
| Контроль | 6,30 ± 0,47 | 1,46 ± 0,12 | 2,95 ± 0,21 |
| Hg(NO3)2 | 2,15 ± 0,13* | 4,75 ± 0,45* | 13,50 ± 1,31* |
| Hg(NO3)2 + Активированный уголь | 3,20 ± 0,22*a | 5,75 ± 1,24* | 8,55 ± 0,86*a |
| Hg(NO3)2 + Полифепан | 2,75 ± 0,25* | 4,75 ± 0,43* | 10,85 ± 1,24* |
| Hg(NO3)2 + Пектин СЭ-1% | 5,16 ± 0,74a | 3,55 ± 0,32*a | 8,85 ± 0,95*a |
| Hg(NO3)2 + Альгинат Са | 5,08 ± 1,23a | 3,60 ± 0,34*a | 6,95 ± 1,41*a |
| Hg(NO3)2 + Альгинат Nа | 5,00 ± 1,05a | 3,63 ± 0,31*a | 7,12 ± 1,28*a |
Примечание: * – p < 0,05 по сравнению с группой «Контроль», a – p < 0,05 по сравнению с группой Hg(NO3)2.
Наряду с лечебными эффектами, некрахмальные полисахариды при нарушении функции почек, оказывают профилактическое действие. Полисахариды вводили в течение 2 недель до применения нефротоксиканта. Установлено, что предварительное введение деэтерифицированного пектина и альгината
кальция способствует сохранению объема диуреза, который значительно снижается вследствие действия нитрата ртути, и меньшему накоплению мочевины и креатинина в крови. Уровень уремических токсинов в опытных группах достоверно не отличался от показателей здоровых животных. Вероятно, механизм реализации нефропротекторного действия в условиях данного эксперимента обусловлен не только ускоренным выведением уремических токсинов, но и снижением абсорбции нитрата ртути, что, в свою очередь, снижает повреждающее действие на почки.
Гепатопротекторное действие
некрахмальных полисахаридов
Применение энтеросорбентов является одним из эффективных методов лечения заболеваний печени. В ходе настоящих исследований была изучена связывающая способность производных пектинов и альгинатов в отношении билирубина и желчных кислот, и были проведены исследования эффективности некрахмальных полисахаридов при экспериментальном токсическом поражении печени.
В условиях in vitro изучаемые полисахариды химически взаимодействовали с креатинином и холевой кислотой. Процессы связывания протекали быстро, достигая максимального насыщения сорбента в течение 10 мин. Наибольшую активность полисахариды проявляли в диапазоне значений рН от 4,0 до 8,0. Результаты математической обработки показали, что связывание билирубина протекает по типу реакций, описываемых уравнением Фрейндлиха, а взаимодействие с холевой кислотой – в соответствии с моделью Лэнгмюра. Из-за сложности отделения билирубина от растворимых полисахаридов эксперименты по определению параметров связывания проводил с нерастворимыми в воде полисахаридами. Опыты указали на активное взаимодействие углеводных полимеров с билирубином. Константы связывания холевой кислоты полисахаридами приведены в таблице 13, из которой следует, что наиболее активными являются альгинаты и деэтерифицированный пектин.
На модели экспериментального поражения печени, вызванного введением четыреххлористого углерода, была проведена оценка гепатопротекторного действия некрахмальных полисахаридов. Деэтерифицированный пектин и альгинат кальция вводили в дозах от 10 до 250 мг/кг с целью обнаружения дозо-зависимого эффекта. Введение максимальной дозы альгината кальция на фоне поражения печени привело к уменьшению активности АЛТ и АСТ на 62,1% и 59,2%, соответственно. Концентрация общего и прямого билирубина была на 31,5% и 32,2%, соответственно, ниже, чем у нелеченных животных. Сходные результаты были получены в группе животных, получавших 250 мг\кг деэтерифицированного пектина. Применение полисахаридов способствовало снижению интенсивности процессов перекисного окисления липидов в печени экспериментальных животных. Так, введение альгината кальция в наибольшей дозе привело к снижению уровня малонового диальдегида в сыворотке крови и печени на 50,0% и 53,9%, соответственно. Содержание восстановленного глутатиона увеличилось на 87,1%, а тиоловых групп – на 45,6%. Концентрация диеновых конъюгатов в сыворотке крови уменьшилась и достоверно не отличалась от таковой у здоровых животных. Общий показатель антиоксидантной активности крови также достоверно не отличался от контрольных значений. Сходные результаты были отмечены в группе животных, получавших пектин.
Таблица 13. Коэффициенты связывания холевой кислоты некрахмальными полисахаридами
| Сорбент | Модель Лэнгмюра | Модель Фрейндлиха | ||||
| b | q max, ммоль/г | R2 | KF | n | R2 | |
| Пектин СЭ-70% | 0,3949 | 21,008 | 0,9988 | 1,9025 | 2,627 | 0,9328 |
| Пектин СЭ-50% | 0,1199 | 8,038 | 0,9998 | 1,2758 | 2,725 | 0,9680 |
| Пектин СЭ-1% | 0,1621 | 7,112 | 0,9978 | 1,3822 | 3,394 | 0,9620 |
| Альгинат Са | 0,3858 | 9,302 | 0,9984 | 1,9031 | 5,171 | 0,7612 |
| Альгинат Na | 0,3587 | 7,231 | 0,9988 | 1,6622 | 4,796 | 0,8771 |
| Акт. уголь | 0,0923 | 20,533 | 0,9988 | 1,7329 | 2,403 | 0,9773 |
| Полифепан | 0,4465 | 7,704 | 0,9997 | 1,8935 | 6,983 | 0,9235 |
| МКЦ | 0,1534 | 8,163 | 0,9952 | 1,4806 | 3,515 | 0,9727 |
С целью оценки профилактической эффективности некрахмальных полисахаридов деэтерифицированный пектин и альгинат кальция вводили в течение 3 недель до введения гепатотоксиканта. По окончании эксперимента было отмечено, что предварительное введение полисахаридов привело к меньшему повреждению печеночной ткани, на что указывала менее выраженная активность АЛТ и АСТ и низкой уровень билирубина. Помимо этого, наблюдалась меньшая интенсивность процессов перекисного окисления липидов. В частности, уровень малонового диальдегида в сыворотке крови у животных, получавших 250 мг/кг альгината кальция, был на 52,9%, а в ткани печени на 42,5% ниже, чем у животных, не получавших альгинат кальция. Концентрация диеновых конъюгатов была на 41,4% меньше и достоверно не отличалась от показателей здоровых животных. Уровень восстановленного глутатиона и тиоловых групп был выше на 76,6% и 57,2%, соответственно. Интегральный показатель антиоксидантной активности крове был также достоверно выше. Профилактическое введение деэтерифицированного пектина вызывало похожие результаты.
Описанные гепатопротекторные эффекты некрахмальных полисахаридов зависели от дозы, в которой они применялись. Введение минимального количества полисахаридов (10 мг/кг) не привело к достоверному изменению практически всех исследуемых показателей.
Гиполипидемическая активность
некрахмальных полисахаридов
Состояния, сопровождающиеся повышенной концентрацией липидов и холестерина крови, рассматриваются в качестве факторов риска развития атеросклероза. Одним из эффективных методов, рекомендуемых диетологами для снижения уровня холестерина крови, считается обогащение рациона пищевыми волокнами, к которым относятся и некрахмальные полисахариды.
В проведенных исследованиях изучали способность таких некрахмальных полисахаридов, как цитрусовые пектины со степенью этерификации 1% и 60%, пектин из морской травы Zostera marina, альгинат кальция, хитозан и фукоидан снижать уровень липидов в печени и крови в условиях экспериментальной гиперлипидемии.
На модели тетрахлометановой гиперлипидемии введение животным альгината кальция приводило к достоверному уменьшению содержания общих липидов в сыворотке крови и в печени в среднем на 29,8% и 29,0%, соответственно. Использование хитозана способствовало снижению количества общих липидов в печени на 38,6% и в крови на 28,2%. Введение фукоидана приводило к уменьшению содержания общих липидов в сыворотке крови на 16,4%, а в печени на 22,1%. Введение пектинов также вызывало достоверное снижение этих показателей. Так, у группы мышей, получавших высокоэтерифицированный пектин на фоне отравления четыреххлористым углеродом, содержание общих липидов в печени было на 38,3%, а в сыворотке крови – на 16,1% меньше, чем у нелеченных животных. Введение деэтерифицированного пектина также привело к снижению уровня липидов крови на 16,9% и содержания общих липидов в ткани печени на 41,5%. Применение пектина, выделенного из морской травы Z. marina, также способствовало нормализации содержания общего холестерина. Наиболее выраженным гиполипидемическим действием обладали образцы хитозана и соли альгиновой кислоты.
Гастропротекторное действие некрахмальных полисахаридов
Из всех энтеросорбентов для лечения и профилактики язвенной болезни целесообразно применять пищевые волокна, в частности препараты пектинов и альгинатов. Лечебное действие как пектиновых, так и альгинатных сорбентов обусловлено прямыми и опосредованными эффектами. К первым относится способность полисахаридов санировать язвенные дефекты путем удаления с их поверхности некротических масс и части клеточного детрита с микроорганизмами, а также связывать химические медиаторы воспаления локального происхождения. Прямой контакт полисахаридного геля с грануляционной тканью оказывает на нее стимулирующее действие, что ускоряет эпителизацию. К опосредованным эффектам можно отнести уменьшение концентрации токсических соединений в крови за счет сорбции метаболитов в кишечнике. Это также ведет к уменьшению нагрузки на системы детоксикации и ускоряет процессы репарации. Большинство высокомолекулярных полисахаридов способно образовывать гель на поверхности слизистой желудка и кишечника и благодаря этому оказывать обволакивающее и защитное действие, предохраняя тем самым слизистые оболочки от раздражающего влияния агрессивных факторов.
Таблица 14. Гастропротективное действие некрахмальных полисахаридов
| Параметры | Группы | ||||
| Контроль | Индометацин | ||||
| + хитозан | + альгиновая кислота | + пектин | |||
| Число животных с язвами слизистой, % | - | 90 | 80 | 75a | 57,1 a |
| Количество язвенных дефектов | - | 14,2 ± 1,1* | 5,8 ± 0,47a | 8,1 ± 0,8a | 9,4 ± 0,5 a |
| Общая протяженность поражений, мм | - | 28,6 ± 1,8* | 5,3 ± 0,41a | 15,0 ± 1,2a | 18,4 ± 0,9 a |
| Индекс Паулса | - | 9,2 | 4,6 | 6,1 | 5,4 |
| АТФ, мкмоль/г | 1,65 ± 0,12 | 0,65 ± 0,09* | 1,21 ± 0,10a | 1,07 ± 0,06 *a | 0,88 ± 0,04* |
| Креатинфосфат, мкмоль/г | 0,95 ± 0,05 | 0,72 ± 0,07* | 0,90 ± 0,04a | 0,87 ± 0,05a | 0,90 ± 0,06* |
| Гликоген, мкмоль/г | 20,5 ± 1,10 | 14,6 ± 0,91* | 17,9 ± 0,81a | 16,6 ± 1,1* | 19,1 ± 1,0a |
| Лактат, мкмоль/г | 1,02 ± 0,05 | 1,32 ± 0,09* | 1,10 ± 0,06a | 1,02 ± 0,05 a | 1,00± 0,07a |
Примечание: * – p < 0,05 по сравнению с группой «Контроль», a – p < 0,05 по сравнению с группой индометацин.
На фоне индометационого поражения желудка введение хитозана, альгиновой кислоты и высокоэтерифицированного пектина способствовало достоверному уменьшению площади язвенных дефектов, а также нормализации биохимических показателей функциональной активности слизистой оболочки желудка. При этом наибольшая эффективность была обнаружена у хитозана (табл. 14). Схожие результаты были получены на модели стресс-индуцированной язвы желудка и поражения слизистой, вызванного введение 2,4-дихлорфеноксиуксусной кислоты.
ЗАКЛЮЧЕНИЕ
Результаты проведенных работ показали, что основные представители некрахмальных полисахаридов проявляют фармакологическую активность при различных патологических состояниях. Основным механизмом реализации фармакологических эффектов этих веществ являются сорбционные взаимодействия с экзогенными токсическими веществами и метаболитами. Выраженность фармакологических свойств некрахмальных полисахаридов находится в прямой зависимости от их сорбционной активности в отношении определенных токсических соединений. Исходя из этого было сделано заключение, что наиболее перспективными соединениями для создания на их основе новых лекарственных препаратов являются производные альгиновой, пектовой и пектиновой кислот, поскольку эти соединения обладают наиболее выраженными связывающими способностями в отношении широкого спектра токсических соединений органической и неорганической природы.
ВЫВОДЫ
1. Связывание ионов меди, свинца, кадмия и цинка некрахмальными полисахаридами происходит в соответствии с математической моделью сорбции Лэнгмюра. Связывание ионов ртути и стронция некрахмальными полисахаридами происходит в соответствии с моделью Фрейндлиха. Наибольшей металлсвязывающей активностью характеризуются образцы деэтерифицированного пектина, альгината кальция и альгината натрия.
2. При связывании тяжелых металлов значения максимальной сорбционной емкости пектина со степенью этерификации 1%, альгината натрия и альгината кальция достоверно превышает таковую активированного угля, полифепанаи и микрокристаллической целлюлозы. Величина аффинитета в отношении ионов тяжелых металлов у пектина со степенью этерификации 1%, альгината натрия и альгината кальция на 1-2 порядка больше, чем у активированного угля, полифепана и микрокристаллической целлюлозы.
3. Методом щелочной деэтерификации из высокоэтерифицированного пектина получены образцы пектинов с заданными степенями этерификации. С уменьшением степени этерификации сорбционная емкость пектинов по металлам возрастает нелинейно. Уменьшение степени этерификации пектина с 60% до 40% приводит к увеличению аффинитета на 577%, максимальной сорбционной емкости на 5%; уменьшение степени этерификации пектина до 20% приводит к увеличению аффинитета на 24%, максимальной сорбционной емкости на 33%; уменьшение степени этерификации пектина до 1% приводит к увеличению аффинитета на 19%, максимальной сорбционной емкости на 25%.
4. Деэтерифицированный пектин, пектат кальция, альгинат натрия и альгинат кальция уменьшают накопление свинца в почках, печени, сердце и бедренной кости при энтеральной свинцовой интоксикации лабораторных животных. Альгинат натрия, альгинат кальция и деэтерифицированный пектин ускоряют выведение свинца из почек и бедренной кости лабораторных животных при одновременном повышении кишечной экскреции металла.
5. На различных моделях гиперлипидемии пектины с различной степенью этерификации, альгинат кальция, хитозан и фукоидан снижают уровень холестерина и триглицеридов в печени и крови. При увеличении степени этерификации пектинов их максимальная сорбционная емкость и коэффициент аффинитета в отношении холевых кислот увеличивается. Сорбционные характеристики связывания холевых кислот альгинатом кальция, хитозаном и фукоиданом сопоставимы с таковыми высокоэтерифицированного пектина.
6. При экспериментальном поражении печени деэтерифицированный пектин и альгинат кальция снижают активность аланинаминотрансферазы и аспартатаминотрансферазы крови, уменьшают содержание свободного и связанного билирубина, малонового диальдегида и диеновых конъюгатов в крови и печени, а также повышают уровень восстановленного глутатиона и тиоловых групп в печени. Хитозан и фукоидан достоверно уменьшают содержание малонового диальдегида и диеновых конъюгатов, увеличивают содержание токоферола и повышают активность каталазы в печени.
7. При экспериментальном поражении слизистой желудка пектин из морской травы Zostera marina, альгиновая кислота и хитозан уменьшают количество и площадь язвенных дефектов, повышают уровень гликогена и уменьшают количество лактата в стенке желудка. Введение пектина снижает индекс Паулса с 15,6 до 5,4, альгиновой кислоты – до 6,1, хитозана – до 4,6.
8. При экспериментальном поражении почек, вызванном ведением нитрата ртути, деэтерифицированный пектин, альгинат натрия и альгинат кальция способствуют увеличению диуреза и снижению уровня креатинина и мочевины в крови. Константы связывания деэтерифицированного пектина и альгината кальция в отношении мочевины и креатинина превышают таковые активированного угля и полифепана.
9. Физико-химические свойства пектинов определяют выраженность их фармакологической активности. Для стандартизации препаратов пектиновых веществ целесообразно использовать такие структурные параметры как: степень этерификации (метоксилирования), содержание ангидрогалактуроновой кислоты, характеристическая вязкость и молекулярная масса, содержание катионов.
Список работ, опубликованных по теме диссертации
Монографии:
- Хотимченко М.Ю. Фармаконутрициология альгинатов. Владивосток: Дальнаука, 2009. 180 с.
Статьи:
- Хотимченко Ю.С., Хасина Э.И., Шевцова О.И., Савченко О.В., Тюпелеев П.А., Охотина С.В., Хотимченко М.Ю., Кропотов А.В. Лечебное действие полисахаридов из морских гидробионтов при экспериментальном токсическом гепатите // Дальневосточный медицинский журнал. 1997. № 4. С. 58-59.
- Хотимченко Ю.С., Кропотов А.В., Хотимченко М.Ю. Фармакологические свойства пектинов // Эфферентная терапия. 2001. Т. 7, № 4. С. 22-36.
- Khotimchenko M., Sergushchenko I., Khotimchenko Y. The effects of low-esterified pectin on lead-induced thyroid injury in rats // Environmental Toxicology and Pharmacology. 2004. Vol. 17. P. 67-71.
- Khotimchenko Y.S., Khotimchenko M.Y. Healing and preventive effects of calcium alginate on liver injury induced by carbon tetrachloride in rats // Marine Drugs. 2004. Vol. 2. P. 108-122.
- Khotimchenko Y.S., Kolenchenko E.A., Khotimchenko M.Y., Kovalev V.V. Healing and preventive effects of low-esterified pectin on liver injury induced by carbon tetrachloride in rats // Oriental Pharmacy and Experimental Medicine. 2004. Vol. 4. P. 28-36.
- Khotimchenko M., Sergushchenko I., Khotimchenko Y. Lead absorption and excretion in rats given insoluble salts of pectin and alginate // International Journal of Toxicology. 2006. Vol. 25. P. 195-203.
- Хотимченко Ю.С., Ермак И.М., Бедняк А.Е., Хасина Э.И., Кропотов А.В., Коленченко Е.А., Сергущенко И.С., Хотимченко М.Ю., Ковалев В.В.. Фармакология некрахмальных полисахаридов // Вестник ДВО РАН. 2005. № 1. C. 72-82.
- Хотимченко М.Ю., Ленская К.В., Петракова М.Ю., Хотимченко Ю.С., Ковалев В.В.. Рутьсвязывающая активность пектина, выделенного из морской травы Zostera marina // Биология моря. 2006. Т. 32, № 5. С. 367-370.
- Хотимченко М.Ю., Сонина Л.Н. Эффективность альгината кальция при токсическом поражении печени у крыс // Тихоокеанский медицинский журнал. 2006. № 4. С. 27-31.
- Разина Т.Г., Хотимченко Ю.С., Зуева Е.П., Шилова Н.В., Амосова Е.Н., Крылова С.Г., Лопатина К.А., Хотимченко М.Ю., Ковалев В.В. Некрахмальные полисахариды как корректоры цитостатической терапии экспериментальных опухолей // Бюллетень экспериментальной биологии и медицины. 2006. Т. 142, № 9. С. 323-327.
- Крылова С.Г., Хотимченко Ю.С., Зуева Е.П., Амосова Е.Н., Разина Т.Г., Ефимова Л.А., Хотимченко М.Ю., Ковалев В.В. Гастрозащитное действие некрахмальных полисахаридов природного происхождения // Бюллетень экспериментальной биологии и медицины. 2006. Т. 142, № 10. С.437-441.
- Khotimchenko M.Y., Zueva E.P., Lopatina K.A., Khotimchenko Y.S., Shilova N.V.. Gastroprotective effect of pectin preparations against indometacin-induced lesions in rats // International Journal of Pharmacology. 2006. Vol. 2, N 4. P. 471-476.
- Serguschenko I., Kolenchenko E., Khotimchenko M. Low esterified pectin accelerates removal of lead ions in rats // Nutrition Research. 2007. Vol. 27, N 10. P. 633-639.
- Khotimchenko M.Y., Kovalev V.V., Khotimchenko Y.S. Equilibrium studies of sorption of lead (II) ions by different pectin compounds // Journal of Hazardous Materials. 2007. Vol. 149, N 3. P. 693-699.
- Крылова С.Г., Ефимова Л.А., Зуева Е.П., Хотимченко М.Ю., Разина Т.Г., Амосова Е.Н., Лопатина К.А., Хотимченко Ю.С. Исследование противоязвенного действия пектата кальция в эксперименте // Экспериментальная и клиническая фармакология. 2007. Т. 70, № 5. С.19-23.
- Khotimchenko M., Shilova N., Lopatina K., Khotimchenko Y., Zueva E.. Modified pectin compounds exert different effects on Ehrlich ascites tumor cells and Lewis lung carcinoma and on efficiency of cyclophosphamide in mice // Journal of Medical Sciences. 2007. Vol. 3. P. 383-389.
- Khotimchenko Y.S., Kovalev V.V., Khotimchenko M.Y. Copper binding capacity and physicochemical properties of pectins with different degrees of esterification. Approach to standardization of pectin preparations // Oriental Pharmacy and Experimental Medicine. 2007. Vol. 7, N 2. P. 171-181.
- Хотимченко М.Ю., Коленченко Е.А.. Эффективность низкоэтерифицированного пектина при токсическом поражении печени, вызванном введением свинца // Бюллетень экспериментальной биологии и медицины. 2007. Т. 144, № 7. С. 65-67.
- Сонина Л.Н., Хотимченко М.Ю. Эффективность пектина, выделенного из морской травы Zostera marina, при поражении печени свинцом в эксперименте // Биология моря. 2007, Т. 33, № 3. С. 240-241.
- Ефимова Л.А., Хотимченко М.Ю. Изучение влияния пектата кальция на моторно-эвакуаторную деятельность кишечника, оценка его спазмолитического и анальгетического действия // Вестник Российского государственного медицинского университета. 2007. Т. 2, № 55. С. 269-270.
- Хотимченко М.Ю., Разина Т.Г., Шилова Н.В., Амосова Е.Н., Крылова С.Г., Лопатина К.А., Хотимченко Ю.С., Зуева Е.П.. Профилактический эффект альгината кальция при повреждении слизистой оболочки желудка, вызванном индометацином у крыс // Тихоокеанский медицинский журнал. 2007. № 4. С. 42-44.
- Ефимова Л.А., Хотимченко М.Ю. Возможность использования некрахмальных полисахаридов в онкологической практике // Сибирский онкологический журнал. 2008. Прил. 1. С. 48-49.
- Хотимченко М.Ю., Пятчина О.В., Коленченко Е.А. Лечебные и профилактические эффекты альгината кальция при экспериментальной почечной недостаточности // Дальневосточный медицинский журнал. 2008. № 2. С.107-109.
- Хотимченко М.Ю., Хожаенко Е.В., Коленченко Е.А. Ртуть-связывающая активность альгината кальция // Дальневосточный медицинский журнал. 2008. № 3. С.89-91.
- Крылова С.Г., Ефимова Л.А., Зуева Е.П., Хотимченко М.Ю., Амосова Е.Н., Разина Т.Г., Лопатина К.А., Хотимченко Ю.С.. Гастропротекторное действие некрахмального полисахарида пектата кальция в эксперименте // Бюллетень экспериментальной биологии и медицины. 2008. Т. 145, № 6. С. 678-681.
- Khotimchenko M.Y., Kovalev V.V., Khotimchenko Y.S. Comparative equilibrium studies of sorption of Pb(II) ions by sodium and calcium alginate // Journal of Environmental Sciences. 2008. Vol. 20. P. 827-831.
- Khotimchenko M.Y., Kolenchenko E.A., Khotimchenko Y.S.. Zinc-binding activity of different pectin compounds in aqueous solutions // Journal of Colloid and Interface Science. 2008. Vol. 323. P. 216–222.
- Крылова С.Г., Фомина Т.И., Ефимова Л.А., Зуева Е.П., Хотимченко М.Ю., Разина Т.Г., Амосова Е.Н., Лопатина К.А., Хотимченко Ю.С. Противоязвенное действие пектата кальция на модели хронического язвенного процесса слизистой желудка у крыс // Экспериментальная и клиническая фармакология. 2009. Т. 72, № 2. С. 35-38.
- Хотимченко М.Ю. Гиполипидемическая активность низкоэтерифицированных пектинов при этаноловом поражении печени в эксперименте // Биология моря. 2009. Т. 35, № 4. С. 302-305.
- Хотимченко М.Ю., Пятчина О.В., Коленченко Е.А. Лечебные и профилактические эффекты пектина при экспериментальной почечной недостаточности // Патологическая физиология и экспериментальная терапия. 2009. № 4. С. 31-33.
- Ефимова Л.А., Крылова С.Г., Зуева Е.П., Хотимченко Ю.С., Хотимченко М.Ю. Экспериментальное исследование противовоспалительного и анальгезирующего действия некрахмального полисахарида пектата кальция // Экспериментальная и клиническая фармакология. 2010. Т. 73, № 4. С. 23-26.
- Разина Т.Г., Зуева Е.П., Амосова Е.Н., Крылова С.Г., Хотимченко М.Ю., Лопатина К.А., Ефимова Л.А., Сафонова Е.А., Рыбалкина О.Ю. Влияние пектинов с различной молекулярной массой на развитие аденокарциномы Эрлиха и карциномы легких Льюис и эффективность циклофосфана у мышей // Тихоокеанский медицинский журнал. 2010. № 2. С. 32-36.
- Разина Т.Г., Зуева Е.П., Амосова Е.Н., Крылова С.Г., Хотимченко М.Ю., Лопатина К.А., Ефимова Л.А., Сафонова Е.А., Рыбалкина О.Ю. Влияние фукоидана из морской бурой водоросли Laminaria japonica на развитие аденокарциномы Эрлиха и карциномы легких Льюис и эффективность циклофосфана у мышей // Тихоокеанский медицинский журнал. 2010. № 2. С. 36-39.
- Khotimchenko Y.S., Khozhaenko E.V., Khotimchenko M.Y., Kolenchenko E.A., Kovalev V.V. Carrageenans as a new source of drugs with metal binding properties // Marine Drugs. 2010. Vol. 8, N 4. P. 1106-1121.
- Хотимченко М.Ю., Хожаенко Е.В., Ламаш Н.Е. Оценка возможности применения каррагинана для адресной доставки противоопухолевых лекарственных средств // Тихоокеанский медицинский журнал. 2010. № 2. С. 59-62.
- Khotimchenko M.Y., Kolenchenko E.A., Khotimchenko Y.S., Khozhaenko E.V., Kovalev V.V. Cerium binding activity of different pectin compounds in aqueous solutions // Colloids and Surfaces B: Biointerfaces. 2010. Vol. 77. P. 104-110.
Патенты:
- Патент на изобретение № 2330671 РФ. Способ профилактики язвенных поражений желудка, вызванных приемом нестероидных противовоспалительных средств / Зуева Е.П., Хотимченко М.Ю., Крылова С.Г., Ефимова Л.А., Разина Т.Г., Амосова Е.Н., Хотимченко Ю.С. Опубликовано: 10.08.2008, Бюл. № 22.
- Патент на изобретение № 2366429 РФ. Средство, обладающее пребиотической активностью / Крылова С.Г., Ефимова Л.А., Красноженов Е.П., Зуева Е.П., Хотимченко Ю.С., Хотимченко М.Ю., Ковалев В.В. Опубликовано: 10.09.2009, Бюл. № 25.
- Патент на изобретение № 2375377 РФ. Способ получения пектата кальция / Ковалев В.В., Хотимченко М.Ю., Хотимченко Ю.С. Опубликовано: 10.12.2009, Бюл. № 34.
- Патент на изобретение № 2395525 РФ. Способ получения альгината кальция / Ковалев В.В., Хотимченко М.Ю., Хотимченко Ю.С. Опубликовано: 27.07.2010, Бюл. № 21.
ХОТИМЧЕНКО Максим Юрьевич
СОРБЦИОННЫЕ СВОЙСТВА И ФАРМАКОЛОГИЧЕСКАЯ
АКТИВНОСТЬ НЕКРАХМАЛЬНЫХ ПОЛИСАХАРИДОВ
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук

