Значениеметилирования генов-супрессоровопухолевого роста при патологическихпроцессах эндометрия у женщинрепродуктивного возраста
На правах рукописи
ВЛАСОВ РОМАНСЕРГЕЕВИЧ
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕМЕТИЛИРОВАНИЯ
ГЕНОВ-СУПРЕССОРОВОПУХОЛЕВОГО РОСТА
ПРИ ПАТОЛОГИЧЕСКИХПРОЦЕССАХ ЭНДОМЕТРИЯ
У ЖЕНЩИНРЕПРОДУКТИВНОГО ВОЗРАСТА
14.01.01 – Акушерство игинекология
АВТОРЕФЕРАТ
диссертации насоискание ученой степени
кандидата медицинскихнаук
Москва
2011
Работа выполнена вПервом Московском государственном
медицинскомуниверситете имени И.М. Сеченова.
Научныйруководитель:
доктор медицинскихнаук
Унанян Ара Леонидович
Официальныеоппоненты:
доктор медицинскихнаук, профессор
Давыдов Александр Ильгизирович
доктор медицинскихнаук, профессор
Торчинов Амирхан Михайлович
Ведущаяорганизация: Московскийобластной научно-исследовательскийинститут акушерства и гинекологии
Защита состоится«____» _______________ 2011 года в «____» часов назаседании диссертационного совета Д 208.040.03 Первого МГМУ им. И.М.Сеченова по адресу: 119991, г. Москва, ул. Трубецкая, дом 8,строение 2.
С диссертацией можноознакомиться в ГЦНМБ ПервогоМГМУ им. И.М. Сеченова поадресу: 117998, г. Москва,Нахимовский проспект, д.49.
Авторефератразослан «_____» ____________________ 2011года.
Ученый секретарь
Диссертационногосовета
доктор медицинскихнаук,профессор
Шулутко АлександрМихайлович
АКТУАЛЬНОСТЬ
Патологические процессыэндометрия являются одной из наиболееактуальных проблем современной гинекологииввиду высокойчастоты встречаемости (в структуре гинекологическойзаболеваемостисоставляют от30 до 55%), возможности рецидивированияи малигнизации(СтрижаковА.Н., 2010;Сидорова И.С.,2009; Радзинский В.Е., 2009; Давыдов А.И., 2008; Серов В.Н., 2008).
Особуюзначимостьприобретают вопросы онкологическойтрансформацииэндометрия убольныхрепродуктивноговозраста сучетом предстоящей реализациидетородной функции (Стрижаков А.Н., 2010;ДавыдовА.И., 2009; Макаров И.О., 2008; Манухин И.Б., 2009;Подзолкова Н.М., 2009;).
Значительное место вструктуре патологии эндометриязанимаютгиперпластическиепроцессы иполипы эндометрия, которымнередко предшествуют хроническиевоспалительныепроцессы эндометрия (Сидорова И.С., Унанян А.Л., 2011; Торчинов А.М., 2011; ЧернухаГ.Е., 2010; Bilgin I.T., 2004; Savelli I.L., 2003).
Поданным Я.В.Бохмана (2002), в70% случаев раку тела матки предшествуютпатологические(фоновые ипредраковые) процессы эндометрия, а приотсутствии лечения в 40% случаев в течение 1–3лет атипическая гиперплазияэндометрия переходит в рак.
ВРоссии запоследние 10летотмечаетсянеуклонный рост заболеваемостираком эндометрия с 88,4 до 128,5 случаев на 100 тыс. населения (Чиссов В.И., 2009, Новикова Е.Г., 2009;), занимая второе место средизлокачественныхопухолейрепродуктивнойсистемы послерака молочнойжелезы.
Ксожалению, насегодняшний день данные лишь толькоанамнеза,клинико-лабораторных,инструментальныхметодов исследования не позволяют эффективнопрогнозировать риск развития онкопатологииэндометрия.
Необходимо отметить, что гиперпластическиепроцессы эндометрия могутразвиваться на фонеотсутствиягормональныхнарушений, всвязи счем объяснитьих возникновение лишь с позиций избыточноговлияния эстрогенов далеко не всегда представляетсявозможным.
Одним из основныхгенетических событий, необходимых дляразвития опухоли, является инактивациягенов-супрессоров опухолевого роста, аодним из самых распространенных и раннихмеханизмов инактивации генов-супрессоров–метилирование CpG-островков в промоторных ирегуляторных областях этих генов, чтопредставляет собой наиболее раннеесобытие в процессе возникновения опухоли(Сухих Г.Т., 2010; Залетаев Д.В.,2009; КиселевВ.И., 2009;Queeny K.Y., 2005).
Следуетотметить, чтоименно сочетанное использованиеданных клиники, морфологическихисследований и результатовмолекулярнойгенетики позволяет максимальнообоснованно выявлять наиболееранниепрогностическиемаркерызлокачественнойпатологии.
Успехимолекулярной медицины последних лет диктуют необходимостьв уточнениии впересмотре ряда аспектов,касающихся тактики веденияпациенток спатологическимипроцессамиэндометрия ираннего выявления больныхповышенногоонкологическогориска.
Цельисследования
Разработка патогенетическиобоснованногоподхода кформированию групп повышенногоонкологическогориска убольных спатологическимипроцессамиэндометрия врепродуктивномвозрасте длявыработки тактики веденияпациенток сучетом показателей метилированиягенов-супрессоров опухолевогороста.
Задачиисследования
- Изучить клинико-анамнестические особенностипатологическихпроцессов эндометрия у женщин репродуктивноговозраста свыявлениемклинически значимых факторовриска развития злокачественногопроцесса эндометрия на основе математическогоанализа.
- Оценить частоту и закономерностиметилированиягенов-супрессоровопухолевого роста (MLH1,RASSF1, p16, GSTP1, RAR-b, CDX1) при патологическихпроцессах эндометрия и корреляции показателейметилирования генов склинико-анамнестическимифакторами риска развития рака эндометрия.
- Определить степень риска развития рака эндометрияпутем разработки математическоймоделипрогнозирования на основаниианализаклинико-анамнестическихособенностей и данныхчастотыметилированиягенов-супрессоров опухолевогороста.
- Разработать дифференцированныеи патогенетически обоснованныепринципы ведения пациентокрепродуктивноговозраста сдоброкачественнымипатологическимипроцессамиэндометрия наоснове формирования групп риска повозникновению рака эндометрия.
Научнаяновизна
Полученные результатыисследованияпозволяют расширить теоретическиепредставления о ролиметилированиягенов-супрессоровопухолевого роста пригиперпластическихпроцессах ираке эндометрия.
Выявленычастота изакономерность аномальногометилированиягенов-супрессоровопухолевого роста у пациенток репродуктивноговозраста спатологическимипроцессамиэндометрия:хроническийэндометрит, полип эндометрия,простая гиперплазия эндометриябез атипии,комплекснаягиперплазия без атипии,комплекснаягиперплазия сатипией, ракэндометрия.
Выделеныфакторы риска, определеныих значимостьи относительный риск в развитиионкотрансформацииэндометрия наоснованииматематическогоанализаклинико-анамнестическихданных ипоказателейметилирования генов-супрессоровопухолевого роста.
Разработана достовернаяматематическаякомпьютерная модель прогнозированиястепенионкологическогориска (низкий,умеренный, высокий) на основании выявленныхклинико-генетическихфакторов риска развитияонкопатологии эндометрия,что позволяетосуществлятьдифференцированный и научнообоснованный подход к тактике веденияпациенток спатологическимипроцессамиэндометрия врепродуктивномвозрасте.
Практическая значимостьработы
Врезультатепроведенной работы установлена прогностическаязначимостьаномальногометилированиягенов-супрессоровопухолевого роста припатологическихпроцессах эндометрия.
Выявленные клинико-генетические факторы риска развитияонкопатологииэндометрия упациенток спатологическимипроцессами эндометриярепродуктивноговозраста явились основой для созданиядостовернойматематическойкомпьютерной модели прогнозированиястепени рискаразвития ракаэндометрия.
Разработанная математическаямодельпрогнозированияпозволяетформировать группы повышенного онкологическогориска средибольных спатологическимипроцессамиэндометрия.
Разработана компьютернаяпрограмма наоснове Exel, вкоторую вводятся данные в соответствиис обнаруженными факторамириска (0 приотсутствии фактора, 1 –при егоналичии), морфотипводится вдиапазоне от 1(хроническийэндометрит) до 5 (атипическаягиперплазияэндометрия), индекс резистентности– по данным УЗИ, ожирение – постепеням, чтопозволяет рассчитать риск развития ракаэндометрия для конкретнойпациентки. Чувствительность данной модели – 98%,специфичность – 92%.
Разработанная математическаямодельпрогнозированияриска развития онкопатологииэндометрия сприменением бинарной логистическойрегрессии позволяет осуществлятьдифференцированный и научнообоснованный подход ктактике ведения пациенток с патологическимипроцессамиэндометрия врепродуктивномвозрасте.
Выявленные закономерностианомальногометилированиягенов-супрессоровопухолевого роста припатологическихпроцессах эндометрия, а также фактобратимости метилирования (в отличие от мутации гена) открываютперспективы для разработкиновых подходов кпатогенетическойпрофилактике рака эндометрия,заключающихся в разработке и применениипрепаратов,способствующихдеметилированиюгенов-супрессоровопухолевого роста.
Основныеположениядиссертации,выносимые назащиту
- Математическийанализклинико-анамнестическихданных позволяет выявлятьклинически значимые факторы риска развитиязлокачественнойтрансформациипатологическихпроцессов эндометрия врепродуктивном возрасте.
- Частота метилированиягенов-супрессоровопухолевого роста характеризуетсяопределеннойзакономерностью в зависимостиот морфологического типапатологическогопроцесса эндометрия.
- Анализ клинико-генетических особенностейпатологическихпроцессов эндометрия у пациентокрепродуктивноговозраста позволяет создатьмодельпрогнозированияриска развития ракаэндометрия иразработатьдифференцированный,патогенетическиобоснованный подход к терапии ипрофилактике.
Апробация работы
Материалы и основные положения диссертациидоложены иобсуждены наследующихконференциях,конгрессах ифорумах: ХХII Международномконгрессе «Новые технологии в диагностике и лечениигинекологическихзаболеваний» (Москва, 2009); IIIМеждународномконгрессе порепродуктивной медицине (Москва, 2009); IVМеждународномконгрессе порепродуктивноймедицине (Москва, 2010); XVII Российскомнациональномконгрессе «Человек и лекарство» (Москва, 2010); XIВсероссийскомнаучном форуме «Мать и дитя» (Москва, 2010); Всероссийскомконгрессе «Амбулаторно-поликлиническая практика – новые горизонты»(Москва, 2010, 2011).
Апробация материаловдиссертациисостоялась 10.02.2011 г. насовместной научной конференциисотрудников кафедр акушерства и гинекологии ФППОВ,акушерства игинекологии № 1 лечебного факультетаГОУ ВПОПервый МГМУим. И.М.СеченоваМинздравсоцразвитияРоссии.
Внедрение результатовисследования в практику.
Полученные результатыиспользуются в лечебнойработе 3онкологическогоотделения ГКБ № 57 г. Москвы и Центрапланирования семьи ирепродукции № 2; в учебном процессе на кафедрахакушерства игинекологии № 1 лечебногофакультета иакушерства игинекологии ФППОВ ГОУ ВПО Первый МГМУ имени И.М. Сеченова.
Публикации.
Потеме диссертации опубликовано13 научныхработ, изних 3 работыв центральной печати.
Структура и объем диссертации
Работаизложена на 137 страницах,иллюстрирована 29таблицами, 3рисунками, 2диаграммами.
Диссертация включаетвведение, обзор литературы,описание методов исследования иклиническуюхарактеристикубольных, результаты собственныхисследований и ихобсуждение, выводы, практическиерекомендации и списоклитературы,содержащий 217источников (109 отечественных и 108 зарубежных авторов).
СОДЕРЖАНИЕ РАБОТЫ
Общаяхарактеристика больных,объем иметоды исследования
Висследование были включены 216больных, которые обратились в гинекологическийстационар вплановом иэкстренном порядке.
Критериями включения в исследованиеявлялись:репродуктивныйвозраст,морфологически верифицированныеслучаипатологическихпроцессов эндометрия.
Критерий исключения – отсутствие тяжелойэкстрагенитальнойпатологии:декомпенсированныхсердечно-сосудистыхзаболеваний,тяжелого сахарного диабета,почечной ипеченочнойнедостаточности,остроготромбофлебита и другойзлокачественнойпатологии.
Возрастобследованных женщин колебался в пределах 20–44 лет (среднийвозраст – 36,5±1,0 год).
Ретроспективно всепациентки были разделены на 6 групп в зависимостиот морфологического типапатологическогопроцесса эндометрия. В работе былаиспользованаклассификация ВОЗ 1994 года.
1-югруппу составили пациентки с хроническимэндометритом (n=32), во 2-ю группу быливключены женщины с полипом эндометрия (n=31), в 3-ю группу –с простойгиперплазиейэндометриябез атипии(n=43), в 4-ю группу –с комплексной гиперплазиейэндометрия без атипии (n=46), в 5-ю группу –с комплексной гиперплазиейэндометрия сатипией (n=42), 6-ю группусоставили пациентки свысокодифференцированнойаденокарциномойэндометрия (I стадия; n=22).Пациентки спростой гиперплазией с атипией в нашем исследованиине встречались.
Впроцессекомплексногообследования кроме клинико-анамнестических методов были использованыспециальныеинструментальные,морфологические и генетическиеметоды исследования.
Обследование больных (n=216)проводилось по разработанной«Карте комплексного обследования»,включающей: сбор анамнестическихданных, данные гинекологическогоосмотра, расширенную кольпоскопию,данныеклинико-лабораторногообследования,ультразвуковое исследованиеорганов малого таза,гистероскопию («Karl Storz», Германия),раздельноевыскабливание(полипэктомия – попоказаниям),оперативное лечение –по показаниям, гистологическоеисследованиеполученногоматериала, забор биологическогоматериала,определениеметилирования генов MLH1,RASSF1, GSTP1, p16, RAR-b, CDX1 вэндометрии.
Ультразвуковое исследование(УЗИ) сиспользованиемцветовогодопплеровскогокартирования (ЦДК) иимпульснойдопплерометрии (ИД) былопроизведено в процессеобследования и лечения всем пациенткам.Исследованиявыполняли наУЗ-аппаратах Acuson 128 ХР 10 (США) и Dornier АI 5200(Германия).
Морфологическоеисследованиемакропрепаратоввыполняли впатологоанатомическомотделении ГКБ № 40 (зав. отделением М.А. Карлова) и патологоанатомическом отделенииГКБ № 57(зав. отделением В.В. Осадчая).
Определение профиляметилированиягенов-супрессоровопухолевого роста в биопсийном материалепроводили влабораториимолекулярнойгенетики человека НИИмолекулярноймедицины Первого МГМУ им. И.М. Сеченова(зав. лабораторией –докт. биол.наук, профессор Д.В. Залетаев).
Дляопределенияметилирования CpG-островков промоторныхобластей исследуемых геновприменяли метод метилчувствительной полимеразнойцепной реакции (МЧ-ПЦР).Поиск полноразмернойнуклеотиднойпоследовательностигенов производили по базам данных Blast и Fasta, анализДНК наналичие сайтов ферментоврестрикции – спомощью программ Genebank Pustell, Genepro, WIN-SUN,для компьютерного конструированияолигонуклеотидныхпраймерови подбораусловий проведения ПЦРиспользовалипрограмму Oligo 4.0,анализ хроматограмм секвенированныхпоследовательностейи распечаткурезультатовпроводили спомощью программ Executor и Chromas.
Статистическая обработкаданных выполнена наперсональном компьютере с помощьюэлектронных таблиц Microsoft Excel,и пакетаприкладных программ Statistica forWindows v. 7.0, StatSoft Inc. (США).
Всеполученныеколичественныеанамнестические,клинические,лабораторные и инструментальныеданные обработаны методом вариационнойстатистики. Для каждогоколичественногопараметра были определены:среднее значение, среднеквадратическое отклонение,ошибка среднего, медиана, 95%доверительныйинтервал, для качественныхданных – частоты (%).
Индексмассы телапациенток рассчитывалипо формуле A.Quetelet. При оценке степениожиренияиспользовалирекомендации ВОЗ.
Длясравнения числовых данныхиспользовали метод дисперсионногоанализа ANOVA иt-критерий Стьюдента. Длясравнениянепараметрическихданных применяли метод Крускала–Уоллиса.Попарное сравнение осуществлялис помощьюкритерия Манна–Уитни. Длянахождения различий междукачественнымипоказателямииспользовали метод 2споправкой Йейтса нанепрерывность, а также точный критерийФишера длянебольших выборок. Статистическизначимыми считались отличия при р<0,05 (95%уровень значимости). Связь между изучаемымипоказателямиоценивалась по результатамкорреляционногоанализа свычислениемкоэффициентакорреляции Пирсона (R)или Спирмена(p) и последующимустановлением его значимостипо критериюt.
Относительный риск (ОР) заболеваниявычисляли пометоду Katz. Втом случаекогда одиниз показателей был равен 0, ОРвычисляли поформуле,модифицированной Haldane.Статистическуюдостоверностьотличия ОРот 1 (р)определяли по точному двустороннемукритерию Фишера длячетырехполосныхтаблиц.
Дляисследования влияния несколькихнезависимыхпеременных на однузависимую переменную использовалсяодномерныйдискриминантныйанализ – метод бинарнойлогистическойрегрессии.
Расчет степенейвероятности развития события иформирование групп риска производился по 90и 10 перцентилям. Чувствительность испецифичность математических моделейопределялась по стандартнымформулам.
РЕЗУЛЬТАТЫ РАБОТЫ И ИХОБСУЖДЕНИЕ
Клинико-анамнестические и диагностическиеособенностипатологическихпроцессов эндометрия
Намипроведен детальный сравнительныйанализклинико-анамнестическихи диагностических показателейв сформированных группахбольных.
Отмечено некотороеувеличение частоты гиперпластическихпроцессовэндометрия (ГПЭ) в старших возрастныхгруппах (35–45 лет), ностатистическизначимых различий у больных среднеговозраста невыявлено.
Исследование наследственнойотягощенностипациенток выявил значительное(более чемв 3 раза)повышениепредрасположенности к опухолевым процессам у больных с атипическойгиперплазиейэндометрия (АГЭ) (40,5%) ивысокодифференцированнойаденокарциномойэндометрия (РЭ) (59,1%) посравнению сгруппамихроническогоэндометрита (ХЭ) (15%) игиперплазии без атипии (19,5%) (p<0,05). Рядисследователейотмечали высокую степеньнаследственнойотягощенностибольных поразвитию опухолевых заболеванийполовых органов, чтоявляется важным фактором,предрасполагающим к развитиюпатологии эндометрия (MutterG.L., 2002; Joensuu E.I., 2010; Чулкова О.В., 2003).
Частота перенесенныхв детскоми юношескомвозрастеинфекционныхзаболеванийстатистическизначимых отличий не имела.
Анализрепродуктивнойфункции показал достоверновысокую частоту бесплодия у пациенток с АГЭ (33,3%) и раком тела матки (68%) (p<0,05). Нанарушениерепродуктивнойфункции утаких пациенток указывают и другиеисследователи (Ferquhar C.M., 1999;Берштейн Л.М., 2002; ВишневскаяЕ.Е., 2004;МаксимовС.Я., 2003).
Мыне выявилипатогномоничныхклиническихпроявлений патологическихпроцессов эндометрия и необнаружили связи междуморфотипомзаболевания и выраженностьюего клинических проявлений,что такжеподтверждается в работахдругихисследователей(Кулаков В.И.,2009; Бохман Я.В., 2002; ВихляеваЕ.М., 2000, Давыдов A.M. 2000; ЧулковаО.В., 2003).
Наиболее частовоспалительныезаболевания органов малого таза (ВЗОМТ)встречались в 1-й группе (87,5%), достоверновыше оказалась частотаВЗОМТ (61,3%) вгруппе сполипами эндометрия (p<0,05). Инфекции,передаваемые половым путем (ИППП),встречалисьпрактически у всехпациенток сХЭ (у 31из 32). Такжевысокая частота (54,8%) ИПППвстречалась во 2-й группе (p<0,05), чтосогласуется с данными А.В. Шуршалиной(2007). Пригиперпластическихпроцессах иРЭ достоверных различиймежду вышеописаннымипоказателями не наблюдалось,но вцелом частота ВЗОМТ и ИППП была выше, чем в популяции (Кулаков В.И., СавельеваГ.М., МанухинИ.Б., 2009).
Различные нарушенияменструальнойфункции,проявляющиеся в видеменометроррагий,полименореи,олигоменореи, примерноодинаково часто имели место в анамнезе у пациенток исследованныхгрупп больных, что явилось следствиемотсутствияпатогномоничнойклиническойсимптоматки,характерной для патологическихпроцессовэндометрия.
Синдром поликистозныхяичников (СПКЯ) ванамнезе чаще встречался в группах с гиперплазиейи РЭ (7,0%; 8,7%;16,1% и 22,7%соответственно; p<0,05).]. По данным отечественнойлитературы (Бохман Я.В., 2000;Адамян Л.Г.,2011), ГПЭвстречаются при СПКЯ у 75–91% больных.
Внашем исследовании частота ГПЭ в анамнезебыла достоверно выше в 5-й – 14,2% (p<0,05) и 6-й группах –31,8% (p<0,05),а частотарецидивированияполипов эндометрия –во 2-йгруппе (22,5%; p<0,05), что говорит о резистентностиэтих процессов к ранее проводимойтерапии уданной категориибольных (Hileeto D., 2005;Вишневская Е.Е., 2004; Станоевич И.В., 2007;Венедиктова М.Г., 2008). Следовательно,возможным резервом для снижения рецидивовГПЭ иполипов уженщинрепродуктивноговозраста является индивидуальныйподбор адекватной противорецидивнойтерапии.
Определенную роль в генезе ГПЭ играетсопутствующаясоматическаяпатология. Однако различия в частотезаболевания органов дыхания,мочевыделительной,нервной системы, ЖКТ в нашемисследовании были статистическинедостоверны (p>0,05).
Отмечено увеличениечастоты заболеваний щитовиднойжелезы, чтосогласовывается с исследованиемдругих авторов (КулавскийВ.А., 2004; Уварова Е.В., 1993). Но послепроведениякорреляционногоанализа значимой корреляцииэтого показателя с риском развития рака тела матки у нашихпациенток неполучено (p>0,05).
Уобследованных нами пациентокнаиболее часто встречающаясясопутствующаяпатология –артериальнаягипертензия,проявляющаяся в видегипертоническойболезни иливегетососудистой дистонии (ВСД) по гипертоническомутипу. Причемчастота этойпатологии возрастает от 1-й (3,1%) к 6-й (18,2%) группе (p<0,05), и достоверновыше в5-й (16,7%) и6-й (18,2%) группах (p<0,05). Вработе I. L. Savelli (2003) артериальнаягипертония выделена как один и ведущих факторов риска.
Частота сахарногодиабета типа 2 такжезакономерновозрастала от 1-й (0%) к 6-й (13,6%)группе (p<0,05).Сахарный диабет как фактор рискавозникновениягиперпластических и злокачественныхпроцессов эндометрия отмеченмногимиисследователями (RicciI.E., 2002; Л.М. Берштейн, 2002;Максимов С.Я., 2003).
Приобследованиипациенток встационаре была обнаруженасопутствующаягинекологическаяпатология. Простая миома матки чащенаблюдалась в группахпростой иатипическойгиперплазии (16–20%), в то время как пролиферирующаямиома былахарактерна идля РЭ (31,8%)(p<0,05).Неактивный аденомиоз встречалсяпримерно вравных случаях припролиферативныхпроцессах эндометрия (15–18%) и полипах (19%) и в единичномнаблюдении при эндометрите(p<0,05).Доля активногоаденомиоза была выше при полипахэндометрия иатипическойгиперплазии (25,8 и 26,2% соответственно)и достоверновыше прираке теламатки (36,4%) (p<0,05). Эти данныесогласуются с результатамидругих исследований (Унанян А.Л., 2007; ДамировМ.М., 2010;Станоевич И.В., 2007; Задонская Ю. Н., 2009; Сидорова И.С., 2008).
Сочетание миомы матки и аденомиоза былодостоверно выше в группе пациенток с комплекснойгиперплазией без атипии (8,7%),атипическойгиперплазией (14,3%) и раком тела матки (18,2%) (p<0,05), что,возможно,обусловленовзаимостимулирующимвлияниемпатологическихпроцессов эндо- и миометрия. Многиеисследователиобращают внимание на частое сочетаниеГПЭ иполипов смиомой матки(29–96%)и эндометриозом (25–69%) (Гуриев Т.Д., 2009; Кулавский В.А., 2004; СидороваИ.С., УнанянА.Л., 2008; Солдатенко И.Ю., 2008;Горенкова О.С., 2005).
СПКЯнаблюдались чаще у пациенток с ГПЭ (3-я группа –7,0%, 4-я группа– 8,7%)и былидостоверно выше в группах сатипическойгиперплазией и РЭ (11,9 и 18,2% соответственно; p<0,05), что в очередной разподчеркиваетнеобходимостьотнесения СПКЯ к значимым факторамриска развития злокачественнойпатологии эндометрия (Станоевич И.В., 2007; Задонская Ю. Н., Бохман Я.В.,2002; Mutter G.L., 2002).
Доброкачественнаяпатологияшейки маткивстречаласьодинаково часто у пациенток всех групп (p<0,05).
Фиброзно-кистознаяболезнь молочных железвстречаласьнесколько чаще при раке тела матки (27,2%), норазличия были статистическинезначимы (p > 0,05).
Приисследовании индекса массы тела в нашемисследованииотмечена стойкая тенденция к ееувеличению от 1-й (ИМТ –22,5±1,3) к6-й группе(ИМТ – 31±2,4; p<0,05).Ожирение иприсущие емуметаболическиеизмененияпотенцируетнарушениярепродуктивнойфункции женщин и отягощают уже имеющуюсяпатологию (Пашков В.М., 2004; HaleG.E., 2002).
Внаших исследованиях применениеУЗИ сЦДК явилосьосновным методом неинвазивнойдиагностики.Скорость кровотока придопплерометрии при доброкачественныхзаболеванияхстатистически не различаласьмежду собой. Только призлокачественномпроцессе отмечено резкоеповышение скорости кровотока в аркуатныхартериях (Vmax = 0,34±0,08 м/с, Vmin = 0,18±0,1 м/с; p<0,05).Наиболееинформативно было изучение ИР. ИР также статистическиотличался только призлокачественных процессах(0,3±0,03; p<0,05). В нашемисследованиистатистическизначимый показатель выраженногокровотока имел место при злокачественныхпоражениях матки, чтосогласуется с даннымидругих авторов, указывающихна низкийИР ивыраженный кровоток в эндометрии как маркерзлокачественногопроцесса (Зыкин Б.И., 2001;Медведев М.В., 2000; СтрижаковА.Н., 1994; Stachowicz N., 2000).
Используя метод Katz, был оцененотносительный риск развитияонкопатологии для каждогоклинико-анамнестическогои диагностического фактора.После определения основныхфакторов риска былаопределена их корреляция с рискомразвития рака тела матки. Установлено,что рискразвитияонкопатологиивозрастает взависимости от факторов:наследственнаяотягощенность по опухолевымзаболеваниям (=0,453) артериальнаягипертония (=0,455) бесплодие (=0,585) ожирение (=0,628) сочетанная патологияматки (миомаи/илиаденомиоз) (=0,738) СПКЯ (=0,792) рецидивирование ГПЭ (=0,797) нарушениеуглеводного обмена сахарныйдиабет (=0,818) УЗИ с ЦДК (ИР) (= -0,874).
Используя критерийПирсона, была оцененакорреляционнаязависимость основных клинико-анамнестических фактороврискамежду собой.Отсутствие сильной корреляциимежду признаками и наличие разныхкомбинацийклинических данных позволилоиспользоватьвышеперечисленныеклинико-анамнестическиепоказатели как факторыриска развития онкопатологииэндометрия.
Используя методбинарной логистической регрессии,определена вероятность развитияонкопатологии пациенток на основанииклинико-анамнестических данных.Составлена формула прогнозированияразвития рака тела матки припатологических процессах эндометрия:![]()
![]() ,
,
где е – основаниенатурального логарифма и равно 2,718; z = –5,15621 + 1,58*Х1 + 1,972*Х2 +2,1986*Х3 + 1,763*Х4 + 1,917Х5 + 1,162*Х6 + 1,5935*Х7 + 0,8123*Х8– 3,5214*Х9; Х1– нарушениеуглеводного обмена или сахарный диабет; Х2–гипертоническая болезнь; Х3 – рецидивированиеГПЭ; Х4 –сочетанная патология матки (миома и/илиаденомиоз); Х5 – наследственная отягощенность поопухолевым заболеваниям; Х6 – СПКЯ; Х7 – бесплодие; Х8– ожирение;Х9 – данныеУЗИ с ЦДК.
Используя 90 и 10%перцентилиопределены границы степеней вероятностиразвития рака тела матки (низкаястепень, умеренная степень и высокаястепень).
Такимобразом, нами сформированы 3группы пациенток: с низкой вероятностьюразвития рака –p = 0–0,29; с умереннойвероятностьюразвития рака – p =0,3–0,59;свысокой вероятностью развитиярака – p = 0,6–1,0. Модель была проверена на пациентках 1-й и6-й групп(n=54). Установленычувствительность (69%)и специфичность (78%), чтонедостаточно для использованияв клинической практике.Данный фактобусловил необходимостьпроведенияследующего этапа исследования.
Особенности метилированиягенов-супрессоровопухолевого роста и его значение в прогнозированиии выработкетактики терапии припатологическихпроцессах эндометрия
Основным методомдиагностикигиперпластических процессовэндометрия является патоморфологическое исследование,которое былопроведено увсех пациенток исследуемыхгрупп.
Дляизучениямолекулярно-биологическихособенностейпатогенезапатологическихпроцессов эндометрия былавыявлена частота аномального метилированиягенов-супрессоровопухолевого роста MLH1,RASSF1, GSTP1, p16, RAR-b, CDX1 вбиопсийных образцах эндометрия у 216 пациенток.При анализеметилирования генов контролемслужил секционный материалнормальногоэндометрия (n=7), вкотором нив одномиз наблюдений метилированияизученных генов ненаблюдалось.
Ген-супрессор опухолевогороста RASSF1 кодирует апоптотическиебелки, егоинактивациязапускает каскад реакций,направленных на подавлениеапоптоза. В1-й группеметилирования RASSF1 не обнаружено. Во 2-й группевыявленометилирование этого гена у 2 (6,45%) пациенток,в 3-й– у 1 (2,33%), в 4-й – у 3(6,52%), в 5-й– у 11 (26,19%), в 6-й –у 19 (86,36%). Pijnenborg J.M. (2007)обнаружилметилирование RASSF1при ракеэндометрия в85% случаев.
Ген MLH1отвечает засинтез белков, необходимыхдля репарации ДНК. В группепациенток сХЭ в 1 (3,13%)случае обнаружено метилированиеэтого гена.Во 2-йгруппе онобнаружен у 2(6,45%) пациенток, в 3-й группе –у 1 (2,33%), в4-й – у 4 (8,7%), в 5-й – у 9(21,43%) в 6-й– у 17 (77,27%). Вработе Salvesen H.B. (2004) отмеченавысокая специфичность (98%), но относительнонизкаячувствительность (56%)изолированногоопределения этого гена при злокачественныхпораженияхэндометрия.
Продукт гена p16(ингибиторациклинзависимойкиназы 2A) играет ключевуюроль вконтроле клеточного цикла,блокируя сигнальныйпуть циклин-D-Rb. Поврежденияили делецииp16часто регистрируются в опухолях самогоразногопроисхождения, что вызвалопредставление о нем как о наиболее частопоражаемом при канцерогенезегене-супрессоре. В нашем исследованииметилирование p16у пациентокс ХЭне встретилось. В группах с полипом эндометрия и комплекснойгиперплазииэндометрияметилирование р16 отмечено у 1 пациенткииз группы (3,23и 2,17% соответственно). В группе простойгиперплазииэндометрияметилирование р16 обнаруженоу 2 (4,65%) пациенток,при атипической гиперплазии – у 7(16,67%) и приРЭ – у 19 (86,36%).Наши данныев 6-йгруппе сопоставимы срезультатами Milde-langosch K. исоавт. (1999).
ГенRAR-b кодирует рецепторретиноевой кислоты бета,который является ядерным рецепторомгормона NRB 1-го класса,угнетающегоиндуцированноеонкогеномобразование фокусов трансформации.В 1-йгруппе метилирование этого гена необнаружено. Во 2-й и3-й группахобнаружено по 2 пациентки (4,45и 4,65% соответственно) саномальным метилированием этого гена. В 4-й группе он былобнаружен у 3(6,52%) пациенток, в 5-й – у 8(19,05%) и в6-й – у 16 (72,73%).
Продукт экспрессиигена GSTP1 выступает в качестве ингибитора JNKs (c-Jun N-terminal kinases) – группы протеинкиназ,участвующих в процессах клеточнойпролиферации и апоптоза. В нашемисследовании частота аномальногометилирования этого гена в 1-й группе составила 1 (3,13%),во 2-й – 6 (19,35%), в 3-й – 1 (2,33%), в 4-й – 7 (15,22%), в 5-й – 11 (26,19%) и в 6-й– 15 (68,18%)случаев. Вработе Queeny K.Y. Chan(2005) частотаобнаруженияметилирования GSTP1 при РЭ достигала 68%, чтосоответствует нашим данным.
ГенCDX1кодирует кластерин (аполипопротеин J),его функциисвязаны срасщеплениемклеточного «мусора» и регуляцией апоптоза.При анализеметилирования этот ген в 1-й группе не обнаружен. Во 2-й группе от выявлен у 5 (16,13%) пациенток,в 3-йгруппе – у 1(2,33), в 4-й– у 5 (10,87%), в 5-й –у 13 (30,95%), в6-й – у 14 (63,64%). В работе Yoji Wani (2008)обнаруженометилирование CDX1 при раке тела матки в 73% случаев.
Анализметилированиягенов-супрессоровопухолевого роста показал, что призлокачественныхпроцессах эндометрия во всех случаяхимело местометилирование хотя бы 3генов-супрессоров.
Послеопределения среднего показателяаномальногометилирования генов по группам намиустановлено, что частотаэпигеномныхнарушений возрастает в ряду: хроническийэндометрит (0,32%) простая гиперплазияэндометрия без атипии (3,1%) комплекснаягиперплазияэндометрия без атипии (8,33%) полип эндометрия (9,67%) комплекснаягиперплазияэндометрия сатипией (23,41%) рак эндометрия (75,7%).
Диаграмма 1
Средний показательметилирования одного гена-супрессораопухолевого роста висследованныхгруппах больных
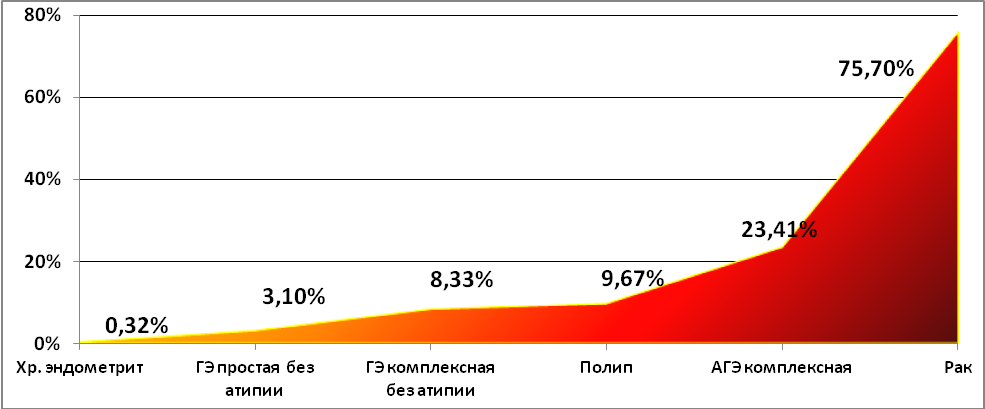
Вгруппе полиповэндометрия отмечена болеевысокая частота метилированиягенов-супрессоров по сравнению с группойгиперплазииэндометрия без атипии.Отмечено увеличение аномальногометилирования в зависимостиот наличияжелезистогокомпонента вполипе, нодостоверных различий не выявлено. Наосновании этого можнопредполагать, что полипыэндометрия по показателямметилирования и, соответственно,по рискумалигнизацииприближаются к атипическойгиперплазииэндометрия, что подтверждаетсятакже вработах Hileeto (2005).
Внашей работепосле детальной математическойоценки факторов риска и их вклада в развитие рака тела матки определенакорреляционнаязависимости между этимифакторами. Учитывая различнуювстречаемостькомбинации факторов риска и отсутствиепрямой корреляции между ними, в качествепрогностическихкритериев были выделены 16показателей:клиническо-анамнестические, морфологическиеи генетические.
Модельпрогнозирования онкопатологиисоставлялась на основании бинарнойлогистической регрессии по формуле:
гдее – основаниенатуральногологарифма, равное 2,71828182845904; z = –11,2754 + 2,32327*Х1 +2,713726*Х2 + 2,631425*Х3 + 2,412264*Х4 +2,571489*Х5 + 2,411352*Х6 + 2,521*Х7 – 3,521352*Х8 + 1,132435*Х9 +0,85648*Х10 + 1,32356*Х11 + 0,765356*Х12 + 1,211383*Х13 +1,234*Х14 + 0,921237*Х15 + 0,516623*Х16; Х1 –морфотип (1 – эндометрит, 2 –простая гиперплазия без атипии, 3 –комплекснаягиперплазия без атипии, 4 – полип эндометрия, 5–комплекснаягиперплазия с атипией); Х2 –RASSF1; Х3 –MLH1; Х4 –p16; X5 – RAR-b; X6 – GSTP1; Х7 –Cdx1; X8 – данные допплерометрии(+ИР аркуатных артерий); X9 – нарушение углеводногообмена илисахарный диабет; X10–гипертоническаяболезнь; X11 –рецидивирующая ГПЭ; Х12 – сочетанная патологияматки (миомаи/илиаденомиоз);Х13 – наследственнаяотягощенность по опухолевымзаболеваниям; Х14 –СПКЯ; Х15–бесплодие; Х16 –ожирение (постепеням).
Быласоставленакомпьютернаяпрограмма наоснове Microsoft Office Excel,при введенииданных вкоторую вычисляется рискзлокачественной трансформацииэндометрия для конкретнойпациентки; используя 90 и 10%перцентилиопределены границы степенейвероятности развития рака тела матки(низкая степень, умереннаястепень ивысокая степень).
Такимобразом, нами сформированы 3группы пациенток: с низкойвероятностьюразвития рака –p = 0–0,29; с умереннойвероятностьюразвития рака – p =0,3–0,59;с высокойвероятностьюразвития рака –p = 0,6–1,0. Модель была проверена на пациентках 1-й и6-й групп(n=54). Чувствительностьпредложенной моделисоставила 98%,специфичность – 92%.
Послеморфологическойверификации и генетическогоанализа наоснованиипредложенной формулы у всех обследованныхбольных былаопределена степень рискаразвития рака тела матки, что явилось основаниемдля выработки дифференцированногоподхода ктактике ведения.
Всвязи сизвестнойзависимостьюфизиологическойтрансформацииэндометрия от состояниягормональнойрегуляции назначение гормональныхпрепаратов для профилактикии леченияпатологическихпроцессов врепродуктивном возрастесчитаетсяпатогенетическиобоснованным (Steinauer J., 2007; Horn L.C., 2004; Чулкова О.В., 2003;Турлак Е.В.,2006).
Принизкой иумереннойвероятностизлокачественнойтрансформацииэндометрияпациенткампроводилось лечение всоответствии с рекомендациями«Национальногоруководства» под ред. В.И.Кулакова, Г.М. Савельевой,И.Б. Манухина(2009). После 6 мес. проведенноголечения нив одномслучае ненаблюдался рецидив илипрогрессированиеимеющегосяпатологическогопроцесса эндометрия.
В 1-й группе низкаявероятность развития рака определена у 26(81,25%) пациентки, умеренная – у 4 (12,5%), высокая– у 2 (6,25%).Пациенткам с ХЭ из группы высокого рискакроме базовой антибактериальной терапии сучетом возбудителя, иммуномодулирующей,метаболической и энзимотерапиипроводилась терапия прогестагенами во 2-юфазу цикла в течение 6 мес. При контрольномобследовании (УЗИ, пайпель-биопсия)патологии не выявлено. При контрольномобследовании признаков пролиферации ивоспаления в эндометрии выявлено не было. Вработах А.В. Шуршалиной, (2007), В.И.Краснопольского, О.Ф. Серова (2007)рекомендуется терапия гестагенами и КОКдля лечения и реабилитации пациенток сХЭ.
Во2-й группенизкая вероятность развитиярака определена у 19 (61,29%)пациенток, умеренная –у 5 (16,13%), высокая– у 7 (22,58%). Однойпациентке 2-йгруппы свысоким риском развитиярака теламатки проведено лечениеагонистами ГнРГ. Даннаясхема рекомендуется многимиавторами прирецидивирующихполипах эндометрия (Новикова Е.Г., 2000; Айламазян Э.К., 2004; СаидоваР.А., 2004; Дедов И.И., 2001; Luo X., 2003). При контрольномисследовании (УЗИ с ЦДК, допплерометрией)патологии невыявлено. Трое пациенток из группывысокого риска получалитерапиюпрогестагенами во 2-ю фазу цикла. При контрольном обследовании(УЗИ, РДВ)у всехобнаружен рецидив полипа,причем в 1случае вполипе обнаружен аденоматозныйкомпонент.
В3-й группенизкая вероятность развитиярака определена у 28 (65,12%)пациенток, умеренная – у 8 (18,6%),высокая – у 7(16,28%). В 3-й группе с высоким рискомразвития рака тела матки пациенткиполучали терапию гестагенами(n=2)или агонистами ГнРГ (n=3). При контрольномобследовании (РДВ) патологииэндометрия не выявлено.Четырем пациенткам проведенолечение постандартной схеме (гестагены во 2-ю фазу цикла). Приконтрольномобследованииобнаружен рецидив простойгиперплазииэндометрия у2 пациенток, переход вкомплекснуюгиперплазию – у 1пациентки иу 1 пациенткипри морфологическом исследованииобнаруженаатипическаягиперплазия эндометрия.
В4-й группенизкая вероятность развитиярака определена у 22 (47,83%)пациенток, умеренная – у 9(19,57%), высокая – у15 (32,61%). В группе высокогориска терапия гестагенамипроведена 1 пациентке, лечениеагонистами ГнРГ проведено 4пациенткам. При контрольномисследованиипатологии эндометрия необнаружено. Шесть пациентокполучали лечение по обычной схеме(Медроксипрогестерон 200мг в14-й и21-й дницикла). Приконтрольномисследовании у 3 пациентокобнаружен рецидив комплекснойгиперплазии и у 3–развитие атипической гиперплазии.Эти данныеподтверждают другие авторы,проводившие оценку эффективностигормонотерапии при гиперпластическихпроцессах эндометрия (Hileeto D.,2005; Кузнецова И.В., 2010; АкулининаИ.Н., 2002; Быковская О.С., 2005; Горенкова О.С., 2005; ПацюкО.В., 2004).
В5-й группенизкая вероятность развитиярака определена у 10 (23,81%)пациенток, умеренная –у 9 (21,43%), высокая– у 23 (57,76%). Пятипациенткам из группывысокого риска среализованнойрепродуктивнойфункцией произведенаэкстирпация матки. Приморфологическомисследовании у 3 пациентокподтвержден диагноз АГЭ, у 2 пациентокобнаружены фокусы высокодифференцированной аденокарциномыэндометрия. Трем пациенткам с атипическойгиперплазиейэндометрия высокого риска,отказавшимся от оперативноголечения, всилу экономических причинпроведено лечение гестагенами.При контрольном выскабливанииу 2 пациентокобнаружен рецидив атипическойгиперплазии, у 1 –развитиеаденокарциномыэндометрия; 1пациенткепроведено лечениеагонистами ГнРГ. Приконтрольномвыскабливанииобнаружен рецидив атипическойгиперплазии.Учитывая высокий рискмалигнизацииатипическойгиперплазииэндометрия ипринимая вовнимание настойчивое желаниепациенток сохранить матку, у 7 пациентокбыла произведена абляцияэндометрия споследующейгормонотерапией.Эффективностьабляции эндометрия, по данным разныхавторов, составляет 40–90% (НовиковаЕ.Г., 2007; БреусенкоВ.Г., 2008).В нашемисследовании 3пациентки после абляцииполучали гестагены, 4 пациентки –агонисты ГнРГ. Приконтрольномобследовании (УЗИ с ЦДК идопплерометрией)патологии эндометрия необнаружено.
Итак,полученныерезультатыисследованиясвидетельствуют, что аномальноеметилированиегенов-супрессоровопухолевого роста происходитна ранних стадиях опухолеобразования и часто обнаруживаетсяв предраковых состоянияхэндометрия.Обнаруженная высокая частотаметилированиягенов-супрессоровпри гиперплазии эндометрия с атипией и при раке эндометрия,может служить маркеромранних стадий неопластическогопроцесса вэндометрии, еще до его фенотипическогопроявления.Гиперметилированиегенов-супрессоровопухолевого роста являетсямолекулярныммаркером ранней диагностикии мониторинга теченияпатологическогопроцесса эндометрия.
Именно сочетанное использование данных клиники, морфологических исследований и результатов молекулярной генетики позволяет максимально обоснованно выявлять наиболее ранние прогностические маркеры онкопатологии эндометрия.
Современная стратегияпрофилактики и терапиигиперпластических процессовэндометрия – это патогенетическиобоснованнаякоррекция начальных нарушениймолекулярно-биологическихпроцессов. Суказанных позиций важнымподходом крешению проблемы профилактикии терапиизаболеванийэндометрия является деметилированиегенов-супрессоровопухолевого роста, что служит мишенью для направленной(таргетной) терапии, тем более что в отличие от мутаций,которыепринципиальнонеобратимы,модификации ДНК путемметилирования, хотя и весьма стабильны,но обратимы.
Перспективность данного направления настолько очевидна, что ужесейчасвомногихлабораторияхмираведетсяинтенсивныйпоискиапробацияпрепаратов,оказывающихдеметилирующее воздействие навышеуказанныегены.Несомненно,чтоданнаягруппапрепаратовзайметодноизглавныхместварсеналесредствдляпроведенияконсервативной терапии ипрофилактикипатологических процессов эндометрия и,преждевсеговпрофилактикеракаэндометрия.
ВЫВОДЫ
- Клинико-анамнестическими факторамириска развития онкотрансформацииэндометрия врепродуктивном возрастеявляются: нарушение углеводногообмена илисахарный диабет(относительный риск –0,8); артериальнаягипертония (ОР –0,5); рецидивирующие гиперпластическиепроцессы эндометрия (ОР – 0,8); сочетаннаяпатология матки (миома и/или аденомиоз) (ОР – 0,7); наследственнаяотягощенность по опухолевым заболеваниям(ОР – 0,4); синдром поликистозныхяичников (ОР– 0,8); бесплодие(ОР – 0,6); ожирение (ОР – 0,6); УЗИ с ЦДК (ИР) (ОР –-0,9;).
- Частота аномальногометилированиягенов-супрессоровопухолевогороста (RASSF1, MLH1,p16, RAR-b, GSTP1, CDX1) у пациентокрепродуктивноговозраста возрастает всоответствии с усилениемпатологическихпролиферативныхпроцессов вряду: хронический эндометрит простая гиперплазияэндометрия без атипии комплекснаягиперплазияэндометрия без атипии полип эндометрия комплекснаягиперплазияэндометрии сатипией рак эндометрия,что позволяет считатьметилирование генов маркеромранних стадий неопластическогопроцесса вэндометрии, еще до его фенотипическогопроявления.
- Корреляционныйанализклинико-анамнестическихпоказателей и частотыметилирования генов всовокупности с показателямиотносительного риска при патологическихпроцессах эндометрия обосновываетих сочетанное использованиев качестверанних прогностическихмаркеровонкопатологииэндометрия.
- Выявленные клинико-генетические факторыриска развития рака эндометрия у пациенток с патологическимипроцессамиэндометриярепродуктивноговозраста явились основой для созданиядостовернойматематическойкомпьютерной моделипрогнозированиястепени риска развитиярака эндометрия (низкий,умеренный, высокий).
- Разработаннаяматематическаямодельпрогнозированияриска развития онкопатологииэндометрия сприменением бинарной логистическойрегрессии позволяет осуществлятьдифференцированный и научнообоснованный подход к тактике веденияпациенток спатологическимипроцессамиэндометрия врепродуктивномвозрасте.
Практические рекомендации
- Дляповышения точности диагностикии эффективности обследованияпациенток спатологическими процессамиэндометриянеобходимоопределениеметилированиягенов-супрессоровопухолевого роста MLH1,RASSF1, p16,GSTP1, RAR-b, CDX1.
- Дляопределения риска развитияонкопатологииэндометрияцелесообразноиспользованиеразработаннойматематической компьютерноймоделипрогнозированиястепенионкологическогориска (низкий, умеренный,высокий).
- Пациенткам с хроническимэндометритом при высокомриске рекомендовать (кромеобщепринятогостандартного подхода) применениегестагенов во 2-ю фазу цикла или прием КОК по контрацептивнойсхеме, контроль засостояниемэндометрия – 2 раза в год (УЗИ с ЦДК,аспирационнаяпайпель-биопсия).
- При полипах эндометрия(высокий риск) –терапия агонистами ГнРГ или гестагенами(17-ОПК, Провера) – 6мес, контроль состоянияэндометрия– УЗИ с ЦДК – 3мес, контроль состоянияпутем гистероскопии и РДВ эндометрия – через 6 мес.
- При простой ГПЭ без атипии(высокий риск) –терапия агонистами ГнРГ или гестагенами(17-ОПК, Провера) – 6мес, контроль состоянияэндометрия – УЗИ с ЦДК, аспирационнаяпайпель-биопсия – через 3, 6 мес.
- Прикомплексной ГПЭ без атипии (высокийриск) – терапия агонистамиГнРГ илигестагенами (17-ОПК, Провера) – 6 мес, контрольсостояния путем гистероскопиии РДВэндометрия через 3, 6 мес.
- Прикомплексной гиперплазииэндометрия сатипией (высокий риск) при настоятельномжелании пациентки сохранитьматку – аблация эндометрия и гормонотерапия,как приначальных формах ракаэндометрия.
- Пациенткам,не заинтересованным вбеременности (или среализованнойрепродуктивной функцией), с высоким рискомразвитияонкопатологии при комплекснойи атипической гиперплазииэндометрияпоказанагистерэктомия.
СПИСОКОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ
- Сидорова И.С., Унанян А.Л., Коган Е.А., Демура Т.А., Гуриев Т.Д.,Ермоленко Г.Л., Карлова М.А., Власов Р.С., ИгнатьеваН.Н. Аденомиоз в сочетании с патологическимипроцессамиэндометрия:клинико-патогенетическиеособенности // IIIмеждународныйконгресс порепродуктивноймедицине. – 2009. – «Проблемы репродукции»(Специальный выпуск). – С.213.
- Сидорова И.С., Унанян А.Л., Коган Е.А., Демура Т.А., Гуриев Т.Д.,Ермоленко Г.Л., Карлова М.А., Власов Р.С., ИгнатьеваН.Н. Антиоксидантнаязащита убольных ссочетанием миомы матки с аденомиозом// III международныйконгресс порепродуктивной медицине. – 2009. – «Проблемы репродукции»(Специальный выпуск). – С.214.
- Сидорова И.С., Унанян А.Л., Власов Р.С. Роль антиагрегантнойтерапии влечении хронического эндометрита //Гинекология. – 2009. – Т.11, № 4. – С.33–36.
- Идрисова Э.А.,Бадгоева О.Х., Власов Р.С., МакароваИ.И., ГуриевТ.Д. Сочетание гиперпролиферативных заболеванийматки имолочных желез: возможноститаргетной терапии// IVмеждународныйконгресс порепродуктивноймедицине. – 2010. – «Проблемы репродукции»(Специальный выпуск). –С. 186-187.
- Власов Р.С., Карпов Д.В., Коган Е.А, Демура Т.А.,Макарова И.И., Карлова М.А., Гуриев Т.Д., ИдрисоваЭ.А., БогушО.С., Бадгоева О.Х.,Сидорова И.С., Унанян А.Л. Клинико-морфологические особенностипатологическихпроцессов эндометрия // IVмеждународный конгресс по репродуктивноймедицине. – 2010. –«Проблемырепродукции» (Специальныйвыпуск).– С.35-36.
- Власов Р.С., Карпов Д.В.,Залетаев Д.В., Коган Е.А, Демура Т.А., МакароваИ.И., ГуриевТ.Д., Идрисова Э.А., Богуш О.С.,Бадгоева О.Х., СидороваИ.С., УнанянА.Л. Метилированиегенов-супрессоровопухолевого роста припатологическихпроцессах эндометрия// IVмеждународныйконгресс порепродуктивноймедицине. – 2010. – «Проблемы репродукции»(Специальный выпуск). –С. 285–286.
- Игнатьева Н.Н., Власов Р.С., Карпов Д.В., Гуриев Т.Д.,Макарова И.И., ИдрисоваЭ.А., БогушО.С., Бадгоева О.Х., Коган Е.А, Сидорова И.С., Унанян А.Л. Особенностиклиники идиагностикигиперпластическихпроцессов эндометрия в сочетании саденомиозом матки // IVмеждународныйконгресс порепродуктивноймедицине. – 2010. – «Проблемы репродукции»(Специальный выпуск). – С.187-188.
- Игнатьева Н.Н., Власов Р.С., Карпов Д.В., Гуриев Т.Д.,Макарова И.И., ИдрисоваЭ.А., БогушО.С., Бадгоева О.Х., Коган Е.А, Сидорова И.С., Унанян А.Л. Молекулярные звеньяпатогенезагиперпластическихпроцессов эндометрия в сочетании саденомиозом матки // IVмеждународныйконгресс порепродуктивноймедицине. – 2010. – «Проблемы репродукции»(Специальный выпуск). –С.188–189.
- Бадгоева О.Х., Гуриев Т.Д.,Идрисова Э.А., Макарова И.И., Власов Р.С.Клиническиеособенностипараллельногоразвития простой ипролиферирующеймиомы маткис аденомиозом на фоне гиперплазииэндометрия// IVмеждународныйконгресс порепродуктивноймедицине. – 2010. – «Проблемы репродукции»(Специальныйвыпуск). – С.169–170.
- Унанян А.Л., Власов Р.С. Современныйвзгляд напроблемухроническогоэндометрита //Женская консультация. – 2010. – № 3. – С.13.
- Сидорова И.С., Унанян А.Л., Власов Р.С.,Залетаев Д.В., Киселев В.Н., Евтина И.П., Карпов Д.В., Кадырова А.Э. Клиническое значениеаномальногометилированиягенов-супрессоровопухолевого роста припатологическихпроцессах эндометрия и шейки матки // Врач. – 2011. – №1. – С. 21–23.
- Власов Р.С.,Сидорова И.С., Унанян А.Л., Евтина И.П., Карпов Д.В., Кадырова А.Э.Современный взгляд на патогенез гиперпластическихпроцессов матки // Врач. –2011. –№ 2. – С. 26–27.
- Сидорова И.С., Унанян А.Л., Власов Р.С., Евтина И.П., Карпов, Д.В.,Кадырова А.Э.Прегравидарная подготовка,беременность и лактация:особенностипримененияантиоксидантов,витаминов иминералов // Вопросыгинекологии,акушерства иперинатологии. – 2011. – Т.10, № 1. – С.91–94.
- Подана заявка в РОСПАТЕНТ № 2011105301 овыдаче патента РФ наизобретение «Способпрогнозированияразвития рака тела матки припатологическихпроцессах эндометрия у женщин репродуктивноговозраста»,авторы изобретения: Сидорова И.С., Унанян А.Л., Власов Р.С.,Залетаев Д.В., ВознесенскийВ.И.

